条文本
摘要
COVID-19大流行引发了相当大的担忧,即炎症性肠病(IBD)患者,特别是接受免疫抑制疗法的患者,感染SARS-CoV-2的风险可能增加,在COVID-19后出现更糟糕的预后,且与一般人群相比,疫苗应答效果欠佳。在这篇综述中,我们总结了关于COVID-19风险和相关结果的数据,以及关于IBD患者使用SARS-CoV-2疫苗的最新指南。新出现的证据表明,常用的IBD药物,如皮质类固醇,但不是生物制剂,与COVID-19的不良结果有关。IBD从头诊断或延迟诊断的风险没有增加,然而,内镜检查程序的总体减少导致了在大流行期间内镜检查发现的遗漏癌症的数量上升。IBD药物对疫苗应答的影响是最近的一个研究重点。数据表明,与未接受抗肿瘤坏死因子(TNF)治疗的患者相比,接受抗肿瘤坏死因子(TNF)治疗的IBD患者对SARS-CoV-2疫苗的体液应答减弱,抗体衰减更快。令人欣慰的是,在所有接种疫苗的患者中,无论是否接受IBD治疗,突破性感染和住院率仍然很低。国际指南建议,所有接受免疫抑制疗法治疗的IBD患者应在其治疗周期的任何时间点接受三剂新冠病毒疫苗,并尽快接受进一步的强化剂量。未来的研究应该集中在了解生物治疗患者的抗体衰减率,这些患者需要额外剂量的SARS-CoV-2疫苗,COVID-19对IBD病程和活动性的长期风险,以及长期COVID-19在IBD患者中的潜在风险。
- 新型冠状病毒肺炎
- 溃疡性结肠炎
- 克罗恩氏病
- 免疫反应
- 炎症性肠病
- SARS-CoV-2
- 疫苗
- 抗体
这是一篇开放获取的文章,按照创作共用署名非商业性(CC BY-NC 4.0)许可发布,该许可允许其他人以非商业性的方式发布、混编、改编、构建本作品,并以不同的条款授权他们的衍生作品,前提是原创作品被正确引用,给予适当的荣誉,任何更改都被注明,且使用是非商业性的。看到的:http://creativecommons.org/licenses/by-nc/4.0/.
来自Altmetric.com的统计
关键信息
炎症性肠病(IBD)患者感染COVID-19的风险没有增加,与普通人群相比,他们的预后基本相似,包括住院、重症监护住院和死亡率。
IBD患者COVID-19不良结局的危险因素包括高龄、共病数量增加、皮质类固醇使用和IBD活性增加。
未感染COVID-19的经生物治疗的IBD患者应继续接受大流行前的IBD治疗,不要选择性切换。
没有证据表明重新诊断或延迟诊断IBD的风险增加,然而,大流行期间内镜检查程序的总体减少导致了内镜检查发现的遗漏癌症的数量上升。
应鼓励IBD患者在其治疗周期的任何时间点接受完整疗程的SARS-CoV-2疫苗,并告知在接受全身皮质类固醇、抗肿瘤坏死因子单一疗法或联合疗法和Janus激酶抑制剂时,疫苗反应可能减弱。
对于接受多种免疫抑制药物的患者,可能需要更密集的免疫策略,然而,还需要等待报告多剂SARS-CoV-2疫苗后疫苗应答的数据,这将为未来的政策建议提供信息。
简介
截至2022年2月,全球有超过4.2亿例COVID-19病例和580万例死亡。COVID-19是由SARS-CoV-2引起的。1 2由于新变种如Delta (B.1.617.2)和Omicron (B.1.1.529)的出现,大流行仍然是对全球健康的持续威胁,它们在很大程度上被抗体中和。3 4COVID-19严重感染的风险因素包括高龄和潜在的医疗共病,如心血管或代谢性疾病。5
炎症性肠病(IBD)包括克罗恩病和溃疡性结肠炎(UC)是免疫介导的炎症性疾病(IMIDs),在全球发病率迅速上升。6在分子水平上,COVID-19的发病机制与IBD之间可能存在交叉。ACE2和跨膜丝氨酸蛋白酶2 (TMPRSS2)的上皮表达似乎是SARS-CoV-2病毒进入宿主肠细胞的必要条件,导致无拮抗的肾素-血管紧张素通路导致急性肺损伤。7IBD患者有肠道炎症,经常使用免疫抑制药物治疗,ACE2的上皮表达保持不变,甚至下调,8 - 10这可能会影响COVID-19的病谱和临床管理。
患有IBD的患者发生严重感染和肺炎的风险更大,11 - 13特别是那些使用生物药物治疗的人,已知与机会性感染的风险增加有关。14在大流行之初,人们对IBD患者是否可能发展成更糟糕的健康结果提出了担忧。目前还不确定使用免疫抑制药物治疗的患者是否如先前在其他疫苗可预防感染中所证实的那样,降低了疫苗应答。15—直到最近,包括IBD在内的IMIDs患者都被排除在SARS-CoV-2疫苗临床开发规划之外。自从新型疫苗平台在国际上推出以来(其中许多疫苗之前没有在IBD患者中进行过研究),在这些患者中接种SARS-CoV-2疫苗的安全性和有效性出现了许多问题。在本综述中,我们旨在全面综述COVID-19和IBD管理方面的最新证据,特别是IBD患者中COVID-19的风险和预后、IBD药物对COVID-19预后风险的影响、COVID-19是否影响IBD疾病活动以及在IBD患者中使用SARS-CoV-2疫苗的新数据和指南,为当前的临床实践和未来的研究方向提供参考。
IBD对COVID-19的影响
IBD患者感染COVID-19的风险
自COVID-19大流行开始以来,人们担心IBD和其他与免疫失调相关的疾病患者可能会增加SARS-CoV-2感染的风险。在意大利两项关于早期大流行的小型研究中,IBD患者的COVID-19血清流行率很高,19与一般人群相比,可能有更高的风险发展为SARS-CoV-2感染。20 21然而,随后意大利的一项单中心研究报告了相互矛盾的结果,20.以及来自西班牙的区域病例系列显示,与普通人群相比,IBD患者中COVID-19的调整发病率(0.74)较低。22全美两项大型登记研究证实,患有IBD的患者中COVID-19的总体发病率很低(0.23%),与无IBD的患者相似。23来自美国的一些数据甚至表明,与非IBD患者相比,IBD患者感染COVID-19的风险更低(风险比(RR) 0.79, 95% CI 0.72至0.86),然而,这可能是由被称为“屏蔽”的现象解释的,因为一些政府建议IBD患者呆在家里,尽量减少面对面接触,他们被认为是严重COVID-19的更高风险。24在整个欧洲都观察到了类似的趋势,在丹麦的一项队列研究中,IBD患者的患病率低于普通人群(2.5% vs 3.7%, p<0.01)。25在全球范围内,截至2022年初,IBD患者中报告的COVID-19患病率为0%至5.95%。24-29
在一项包括17项研究的荟萃分析中,每1000人IBD患者的合并发病率为4.02,普通人群为6.59。IBD患者的合并相对风险(RR 0.47, 95% CI 0.18 ~ 1.26)无显著增加,IBD亚型间无显著差异。30.尽管最初存在担忧,但IBD患者的SARS-CoV-2感染率似乎与普通人群相当。
高龄已被证明是与IBD患者COVID-19发展相关的独立风险因素,但尚未确定增加风险的年龄分界点。30 31尽管最初人们担心免疫抑制对获得SARS-CoV-2的影响,但生物药物的使用并未与COVID-19发展风险的增加有关。28 30 32
IBD患者的COVID-19结局
在大流行过程中,研究排除下冠状病毒监测流行病学(SECURE-IBD)国际登记处帮助临床医生和患者更好地了解COVID-19在IBD患者中的预后。在2022年1月登记关闭之前,已报告了来自74个国家的7038例COVID-19病例,以确定IBD治疗方案对COVID-19结局的影响,包括住院和严重COVID-19(定义为重症监护室(ICU)住院、机械通气和死亡的综合情况)的影响。33-38在整个大流行期间,SECURE-IBD一直是IBD社区的一个信息丰富的资源,然而,队列的代表性有很大的局限性,这在一定程度上次要于医生主导的登记选择的性质。尽管是一个全球登记处,来自美国的病例占数据库的三分之一以上,限制了数据集发现对其他人群的普遍性。此外,接受非生物治疗的患者比例不足,因为近三分之二提交的病例接受抗肿瘤坏死因子(anti-TNF)、抗整合素或IL12/23抑制剂治疗。尽管存在这些局限性,SECURE-IBD是迄今为止评估IBD治疗对COVID-19预后影响的最大队列研究。
IBD患者COVID-19的常见症状与普通人群相似。大多数表现为发烧(67.5%)和咳嗽(59.6%),约四分之一表现为腹泻、嗅觉丧失或呼吸困难,约10%表现为胃肠症状,包括腹痛、恶心或呕吐。39IBD患者胃肠道表现所占比例较高,但可能与COVID-19时活动性疾病相混淆。40
住院治疗
尽管与普通人群相比,IBD患者与covid -19相关的住院率最低,但住院患者的临床病程与非住院患者相似。在大流行早期进行的一项回顾性队列研究报告称,IBD患者的住院风险没有增加(RR 1.10, 95% CI 0.74至1.40)。40相反,来自荷兰和美国的两项大规模研究报告,IBD患者的发病率更高,为17%-68%。24小时41然而,在这些研究中,住院患者的临床病程与未住院患者相似,反映出国家间住院门槛的差异。在大流行后期获得的IBD患者数据估计在欧洲的21%到拉丁美洲地区的66%之间。22日使在对世界各地11项研究的一项荟萃分析中,COVID-19导致的总住院率为28%。30.最近,在英国范围内的一项基于人群的研究中,超过1700万人,包括超过2万接受免疫抑制药物(opensafety)的患者,即使在控制了年龄、性别和共病后,IBD患者住院的风险仍然增加。46然而,尽管这些数据是从英国40%的全科实践中个体水平提取的,但没有捕获到某些混杂因素,包括可能降低了感染风险的屏蔽状态和偏向于零的结果。此外,由于难以从该数据集中确定活动性肠炎和SARS-CoV-2感染之间的因果和时间关系,因此可能存在对暴露状态进行错误分类的风险。
与covid -19相关住院相关的风险因素包括高龄、活动性IBD和存在≥1种非IBD共病,如心血管疾病。42 43 47这些危险因素的影响在SECURE-IBD中得到了很好的证明,在SECURE-IBD中,IBD患者的住院率从儿童和年轻人(10-19岁)的5%到老年人(80岁)的47%。有三种以上共病的患者的发病率(60%)高于无共病的患者(9%),33UC患者与克罗恩病(RR 1.55)相比,30.西班牙裔和黑人患者与白人患者比较(RR 2.5-3.6)。48
重症监护,机械通气和肾脏替代治疗
尽管初步数据表明,在大流行期间,IBD患者可能有更多的重症监护入院,需要更多的机械通气,但令人欣慰的是,感染率与普通人群相似。在一项国际meta分析中,SECURE-IBD患者的ICU住院率为3%,5.3%。30.与一般人群相比,IBD患者入住ICU的风险相似(RR 0.85, 95% CI 0.69 ~ 1.06)。24在另一项来自荷兰的基于人群的研究中,IBD患者的ICU入院率与普通人群相似(12.5% vs 15.7%)。41OpenSAFELY显示IBD患者入院ICU和/或死亡的风险略有增加(HR 1.08, 95% CI 1.01 - 1.16)。46在SECURE-IBD注册中,整体机械通气率为2%,在老年患者中增加到9%。33IBD患者机械通气的相对风险与非IBD患者相似(6.3% vs 11.2%, p=1.00),41发生急性肾功能衰竭的风险(RR 1.00, 95% CI 0.84 ~ 1.19)和需要肾脏替代治疗的风险(RR 1.00, 95% CI 0.60 ~ 1.66)也一样。24
死亡率
初步数据表明,IBD患者的病死率可能很高,从0%到33.3%不等。41 - 45 20日22随着更细致的数据的出现,这个比率下降了很多;在一项荟萃分析中,合并COVID-19的IBD患者的总死亡率为4.3%,与一般人群的死亡率相似。30.在SECURE-IBD中,总死亡率为2%,老年患者(20%)明显高于年轻患者(0%)。33进一步的研究证实,IBD患者和非IBD患者的COVID-19死亡率相似(RR 0.95, 95% CI 0.71 - 1.26),然而,按疾病亚型分层的研究报告,UC患者的死亡率可能高于克罗恩病(RR 1.94, 95% CI 1.22 - 3.10)。24 30SECURE-IBD的多变量分析表明,这种关联可能被年龄、性别、吸烟状况和共病所混淆。34 49 50
与不良临床结果(包括ICU住院、机械通气和/或死亡)相关的危险因素是高龄、表现为呼吸困难、活动性IBD、存在≥1例共病和使用全身类固醇。24 25 34 42-45 47 51一种经过验证的预后模型用于预测合并COVID-19的IBD患者的不良结局,在调整了包括年龄、男性性别、共病、皮质类固醇和生物使用在内的已知风险因素后,证明了良好的识别率,住院的曲线下面积为0.79,ICU住院的曲线下面积为0.88,死亡的曲线下面积为0.94。50
IBD药物对COVID-19预后的影响
全身性类固醇
在整个大流行期间,有大量证据表明全身类固醇对发展为COVID-19的IBD患者的临床结果有不利影响。然而,大多数已发表的数据受到IBD活性、COVID-19严重程度和伴随的类固醇使用之间未测量的混杂因素的影响。尽管如此,数据仍然具有说服力和可复制性,并有助于告知皮质类固醇在IBD急性管理中的定位。在决定停止全身皮质类固醇的情况下,谨慎的减量仍然很重要,以避免addison危机的风险,特别是在并发疾病的情况下。52
在SECURE-IBD注册表中,33使用皮质类固醇与发生严重COVID-19的6.9倍风险和因COVID-19死亡的11.6倍风险独立相关。33 34这一发现在一个涵盖北加州440万健康计划成员的大型回顾性队列中得到了重复,其中一些人患有炎症性肠炎,因此在SARS-CoV-2感染之前使用口服强的松是随后住院、入住ICU和死亡的一致风险因素。53进一步的研究还证实,皮质类固醇的使用与SARS-CoV-2感染、住院和重症监护需求的风险增加有关。24 54 55在最近的一项荟萃分析中,接受类固醇治疗的患者住院(RR 1.99, 95% CI 1.64 - 2.40)、ICU住院(RR 3.41, 95% CI 2.28 - 5.11)和死亡率(RR 2.70, 95% CI 1.61 - 4.55)的综合相对风险均显著高于未接受类固醇治疗的患者。30.
5-aminosalicylic酸
关于5-氨基水杨酸(5-ASA)对IBD患者COVID-19病程的影响,已有相互矛盾的结果报道。在大流行早期进行的几项研究(包括两项meta分析)表明,与未接受5-ASA治疗的患者相比,接受5-ASA治疗的患者发生重症监护、使用呼吸机和死亡率的风险更高。34 35 56例如,在接受5-ASA治疗的患者中,住院的综合相对风险为1.59 (95% CI 1.39 ~ 1.82), ICU住院的综合相对风险为2.38 (95% CI 1.26 ~ 4.48),死亡的综合相对风险为2.62 (95% CI 1.67 ~ 4.11)。30.然而,在最近的一项大倾向评分匹配队列研究中,未发现5-ASA与不良结局或死亡风险增加相关。24随着更多来自SECURE-IBD的数据的出现,与该组织最初的报告相反,34在后来的出版物中,5-ASA不再与任何不良临床结果、住院或死亡相关(RR 1.02, 95% CI 0.83至1.26),这可能反映了最初的相关性是由于报告偏差,包括5-ASA和磺胺柳氮嘧啶治疗患者中未报告的轻症COVID-19病例,以及生物治疗患者中过度代表的轻症COVID-19病例,或未完全控制的协变量。36
免疫调制剂
根据在美国和法国进行的两项基于人群的研究,与treatment-naïve名IBD患者相比,使用传统免疫调节剂,即硫嘌呤和甲氨蝶呤,与COVID-19的风险增加(RR 0.89, 95% CI 0.33至2.44)、住院(RR 0.94, 95% CI 0.66至1.35)、机械通气或死亡(RR 0.35, 95% CI 0.09至1.43)无关。57 58在接受免疫调节剂治疗的患者和未接受免疫调节剂治疗的患者之间,ICU住院和死亡率的综合相对风险相似。30.据报道,在SECURE-IBD中,甲氨蝶呤(而不是硫嘌呤)与住院和死亡风险的轻微增加相关(RR为1.26,95% CI为1.00至1.57),但与严重的COVID-19或死亡无关。36值得注意的是,与单独使用生物制剂相比,硫嘌呤单一疗法或与生物制剂联合使用也与发生严重COVID-19的更高风险相关。35
生物药物
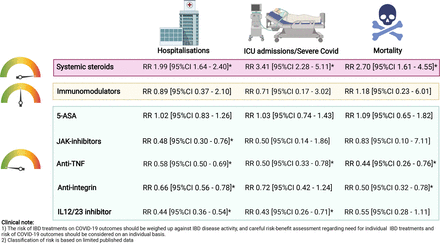
大约四分之一的IBD患者使用生物药物治疗,最初,这些疗法对COVID-19的影响存在不确定性。令人欣慰的是,随着大流行的发展和新数据的出现,越来越多的证据表明生物制剂对IBD患者是安全的(图1).
IBD治疗对COVID-19结果的影响。使用多变量逻辑回归模型计算相对风险,比较每种药物类别与未使用该药物治疗的患者的COVID-19疗效。ICU住院包括由ICU住院、机械通气和非COVID-19死亡组成的复合结局。指标上的颜色代表IBD药物对COVID-19结果的总体风险:绿色=低风险,琥珀色=中等风险,红色=高风险。*表示95% CI未超过1的显著结果。用参考数据创建的图。30 36和使用BioRender.com。5-ASA 5-aminosalicylic酸;IBD,炎症性肠病;ICU,重症监护病房;jak -抑制剂,Janus激酶抑制剂;RR,相对风险;肿瘤坏死因子。
Anti-TNF药物
TNF拮抗剂是IBD患者最常用的生物制剂,其使用与COVID-19风险增加无关。57此外,抗肿瘤坏死因子治疗的患者与非抗肿瘤坏死因子治疗的患者相比,没有显示出ICU住院、机械通气或死亡的风险增加34在美国、法国和丹麦的三个以人口为基础的研究中也有类似的发现。24日25日58
一些研究表明,生物治疗患者发生严重COVID-19的风险可能较低,这可能是由于这些药物在抑制COVID-19相关炎症并发症基础上的细胞因子炎症途径方面的作用。30 56 59在一项meta分析中,与使用其他非生物制剂治疗IBD的患者相比,生物制剂治疗IBD的患者住院(RR 0.34, 95% CI 0.19 - 0.61)、ICU住院(RR 0.49, 95% CI 0.33 - 0.72)和死亡率(RR 0.22, 95% CI 0.13 - 0.38)的综合相对风险较低。30.一项荟萃分析还发现,与皮质类固醇或5-ASA相比,接受抗tnf治疗的患者住院和入住ICU的风险降低。56
然而,接受抗肿瘤坏死因子治疗并联合免疫调节剂的患者出现COVID-19不良结局的风险增加。尽管法国一项全国性研究发现,接受抗肿瘤坏死因子单一治疗的患者与接受抗肿瘤坏死因子联合治疗的患者的住院死亡率相似,58SECURE-IBD数据报告,接受抗tnf联合治疗的患者发生严重COVID-19的风险高于接受抗tnf单一治疗的患者(8.8% vs 2.2%, RR 4.01, 95% CI 1.65 ~ 9.78)。35来自三个国际注册的不同IMIDs患者的汇总分析显示,抗tnf单药治疗似乎比其他常用的治疗方案(包括抗tnf联合治疗)具有最佳的安全性。60
Anti-integrins
关于维多珠单抗(一种抗整合素)对COVID-19结果影响的数据一直存在矛盾。一份报告显示,与单独使用5-ASA治疗的患者相比,vedolizumab治疗与发生COVID-19的风险增加相关(RR 1.70, 95% CI 1.16 - 2.48)。54SECURE-IBD的初步数据也表明,与抗tnf治疗的患者相比,vedolizumab治疗的住院风险增加(RR 1.39;95% CI 1.001至1.90),但没有发生严重COVID-19的风险。37 54
在来自SECURE-IBD的最新数据中,与未接受vedolizumab治疗的患者相比,vedolizumab治疗与住院或死亡风险降低相关(RR 0.66, 95% CI 0.56 - 0.78),且与发生严重COVID-19的风险无相关性。36与接受其他IBD药物治疗的患者相比,接受vedolizumab治疗的患者感染COVID-19的风险可能更高,这在一定程度上是因为抗整合素不仅与肠道中的效应记忆细胞结合,还与上呼吸道结合。61 62更有可能的是,最初的数据不足以检测使用不同IBD药物治疗的患者之间的真正差异。随着大流行期间使用维多珠单抗等较不常用处方药治疗的患者的数据增加,COVID-19不良结果增加的风险消失了。
Anti-interleukin 12/23代理
虽然我们对使用ustekinumab(一种白介素12/23抑制剂)治疗的患者的风险了解有限,但在SECURE-IBD中,与未使用ustekinumab治疗的患者相比,使用ustekinumab与较低的住院或死亡风险相关(RR 0.44, 95% CI 0.36 - 0.54)。36总的来说,目前的证据表明,与抗tnf相比,vedolizumab治疗(RR 0.85, 95% CI 0.56至1.28)和ustekinumab治疗(RR 1.25, 95% CI 0.56至2.80)的患者不存在发生严重COVID-19的风险增加的情况,36使用不同生物制剂治疗的患者住院的相对风险相似。58
Janus激酶抑制剂
Tofacitinib,一种被批准用于UC治疗的Janus激酶抑制剂(JAKi),与血栓形成和感染,特别是带状疱疹的更高风险相关。63关于其在COVID-19期间安全性的现有数据有限。在SECURE-IBD的亚组分析中,仅包括37例接受托法替尼治疗的IBD患者,与其他治疗方案相比,使用托法替尼与住院、ICU住院、机械通气或死亡的风险增加无关。38没有血栓事件的报道。然而,最近来自美国的一项针对包括IBD在内的大量IMIDs患者的社区研究发现,与使用其他生物制剂治疗的患者相比,31%接受JAKi治疗的患者发生严重COVID-19的风险增加(RR 3.35)。53令人欣慰的是,最近的数据显示托法替尼与较低的住院和死亡风险相关(RR 0.48, 95% CI 0.30 - 0.76)。36托法替尼也被证明是一种降低COVID-19死亡或呼吸衰竭风险的有效治疗方法。64
COVID-19对IBD的影响
COVID-19对IBD疾病活动的影响
很少有研究评估COVID-19对ibd相关疾病的病程、活动性和加重的影响,特别是对接受免疫调节剂的患者的影响。大多数病例系列或回顾性队列受到样本量小和对疾病活动性混杂因素调整不足的限制。在一个来自美国的队列中,118名发展为covid -19的IBD患者(62%为克罗恩病,55%为生物治疗)在covid -19后被随访至6个月。65略多于三分之一的患者报告了与COVID-19相关的胃肠道症状,但这可能与近三分之二的队列患者在感染COVID-19前后出现活动性IBD症状的事实相混淆。令人欣慰的是,在covid -19前后,疾病活度、内窥镜评估或实验室标记物没有显著变化。
在一项针对美国40家医疗机构的855458名患者的回顾性倾向评分匹配队列研究中,评估了实验室确认的SARS-CoV-2感染后发生IBD爆发的风险和重新发生IBD的风险。24使用SARS-CoV-2检测阴性的患者作为对照组。在4310例有COVID-19病史的IBD患者中,5.3%和6.8%的IBD症状分别在1个月和3个月内发作。与生物治疗无显著相关性。在3个月的随访中,有COVID-19病史的患者发生ibd相关疾病发作的可能性是无COVID-19病史的患者的1.3倍(95% CI 1.18 - 1.51)。这些观察结果可能是由于SARS-CoV-2的肠道感染和/或回肠和结肠组织中ACE2的上调导致疾病爆发。66 67在该队列中,774例(0.1%)患者在COVID-19后新诊断为IBD,低于无COVID-19病史的对照组(RR 0.55)。原因尚不清楚,但当分析仅限于COVID-19后至少6个月的诊断时,结果仍然显著。
IBD患者长时间COVID-19的风险
最近的证据表明,在急性SARS-CoV-2感染后,持续症状可持续数周。这种情况被称为长时间COVID-19或后急性COVID-19综合征,涉及呼吸、心血管、神经、胃肠道和肌肉骨骼系统等多个器官。68常见症状包括疲劳、肌痛、呼吸困难、心肌损伤、认知障碍和睡眠障碍。69来自不同地区的研究报告了长时间COVID-19发病率的变化,在60天内的发病率从33%到87%不等70 716个月或更长时间,35%到76%。72 73意大利的一项小型研究报告了从急性SARS-CoV-2感染中康复的IBD患者长时间COVID-19的临床特征。74患病率为39.6%,三分之二的患者出现衰弱,三分之一的神经系统表现,包括嗅觉丧失、衰老、记忆丧失、皮肤症状、肌痛,少数患者出现持续性呼吸困难或抑郁。
出现长时间COVID-19的IBD患者更多为女性,而其他人口统计学特征与无长时间COVID-19症状的患者没有区别。74长时间COVID-19的确切发病机制尚不清楚,然而,COVID-19后肠道菌群的变化可能是一个合理的解释,因为基线肠道菌群组成已被证明可以预测长时间COVID-19的风险。75随着越来越多的患者感染新变种的sars - cov -2,长期发展为COVID-19的IBD患者数量预计将大幅增加。长期COVID-19的发病机制及其对IBD患者的长期影响有待进一步研究。
COVID-19大流行期间IBD的管理
关于在COVID-19大流行期间管理IBD患者的国际和国家指南与大流行前的实践建议密切一致,特别是在尽量减少全身使用皮质类固醇方面。尽管这些建议主要基于专家意见,但随着新数据的出现,临床建议也会定期更新。76 - 82随着在全球多波COVID-19期间积累的新数据,关于IBD患者可能会受到COVID-19的不利影响,以及相反地,COVID-19可能会恶化IBD相关疾病活动的观点在很大程度上减弱了。在2019冠状病毒病大流行期间开展研究和制定指导方针的经验总结概述在箱1.
2019冠状病毒病大流行期间的经验教训
优化资源和基础设施
利用现有的研究基础设施,例如在当地和国际上从事研究的临床医生和护士组成的特定疾病网络。在2019冠状病毒病期间,这使得研究问题得以优先处理,多个国家的病例记录表格得以标准化,并提高了数据质量,加强了数据和实践建议。
安全的在线数据库,如研究电子数据捕获(REDCap),允许快速建立研究和监测登记,包括电子同意。考虑征求同意,以便将数据与社区和医院记录的国家数据库连接起来,并使患者可召回。
患者和公众的参与
如果需要面对面的研究访问,目标是尽量缩短临床医生和患者接触的时间,以降低感染风险,并在常规医院输液预约期间收集样本。如果当地资源允许,可以考虑远程采样,例如通过邮政手指穿刺血液检测试剂盒。
利用通讯、在线视频和其他面向患者的材料,最大限度地参与研究。在可能的情况下,将个体层面的研究结果反馈给患者,以保持动机,特别是纵向研究。
适应性和进化的研究问题
定期审查研究目的和目标,以随着大流行的演变处理初始和长期结果,例如在COVID-19大流行期间、疫苗开发和COVID-19长时间的风险。
数据将随着时间的推移而变化,在COVID-19大流行早期发布数据有助于发现我们理解中的直接差距。考虑通过在线注册表或仪表板实时发布特定于研究的数据,并以实时系统综述的形式正式发布数据,从而在大流行过程中对数据进行丰富和元分析。
已知诊断为IBD的患者
大多数国际组织建议,确诊为IBD的患者应继续接受大流行前的IBD治疗,这种治疗成功地诱导并维持了缓解。新诊断为IBD的患者,或已确定诊断并出现症状的患者,应根据大流行前的护理标准进行治疗。这些措施包括继续使用免疫调节剂、生物制剂、JAKi,并考虑在可能的情况下减少使用皮质类固醇治疗,并开始新启动的皮下治疗,以尽量减少住院次数。
在大流行之初,患者和医疗服务提供者对在医院进行维持性生物治疗时发生院内SARS-CoV-2感染的风险以及就诊对医疗资源的影响提出了担忧。83大多数针对IBD患者的指南都不建议在生物制剂之间切换,例如从静脉注射的英夫利昔单抗切换到皮下的阿达木单抗76 78不像那些针对风湿性疾病患者的。84 85这在一定程度上是因为,在第一种生物制剂已获得缓解后,用第二种生物制剂重新获得疾病缓解的时间较短,更有可能与抗药物抗体的产生有关,从而限制了IBD未来的治疗选择。86 - 88在一些地区,已成功开展了与大流行相关的项目,报告了在IBD患者中相同分子的不同给药途径之间的选择性切换,特别是从静脉注射英夫利昔单抗到皮下注射英夫利昔单抗(CT-P13)。89 90
新表现为急性严重UC的患者
考虑到疾病的严重程度、可能需要的免疫抑制程度以及在医院发展为COVID-19的风险,对新诊断为急性严重溃疡性结肠炎(ASUC)的患者进行管理尤其值得关注。在英国的两个RAND适当性小组支持现有的建议,特别是在这两名儿童中开始皮质类固醇治疗,升级到英夫利昔单抗,并及时进行手术干预,无论COVID-19状态如何91和成人92与炎症性肠病。
protection -ASUC研究是一项覆盖全英国、横跨60家急性二级保健医院的病例对照研究,招募了782名ASUC患者(新冠肺炎大流行期间398例,历史对照组384例),在大流行期间接受抢救治疗或手术的患者比历史队列中更多(55% vs 42%, p<0.001),在大流行期间接受抢救治疗的时间更短。93这一差异的原因是,与历史队列相比,大流行中更多地使用了生物制剂、环孢素或托法替尼的抢救和一级诱导疗法;两组的结肠切除术率相似。尽管与历史对照相比,大流行期间以门诊为基础的静脉类固醇初始给药途径的使用有所增加,但大多数患者仍作为住院患者进行管理。94虽然病例数量较少,但在作为住院患者治疗的个体和作为门诊患者管理的两个队列中结肠切除术的发生率是相当的。这些研究的结果表明,医疗保健提供者应该继续调整以医院为基础的治疗途径,以改善新诊断的IBD患者的护理,同时限制他们感染SARS-CoV-2的风险。95
IBD患者诊断为COVID-19
对一名检测结果为SARS-CoV-2阳性的IBD患者的管理,无论有无症状,仍然存在争议。专家一致建议对确诊的COVID-19患者修改IBD治疗。(图2)76 77 96指南的一般原则包括考虑逐渐减少口服皮质类固醇或改用布地奈德,辅以硫嘌呤、甲氨蝶呤和托法替尼,并将生物治疗推迟2周直到恢复。然而,这些建议大多仅以协商一致意见为基础,应尽可能利用最新数据对其进行个别考虑。尽管类固醇一直被认为是严重COVID-19的风险因素,但类固醇在管理住院的COVID-19患者方面已证明的益处表明,对于因COVID-19住院的IBD患者,不应总是停用类固醇。97
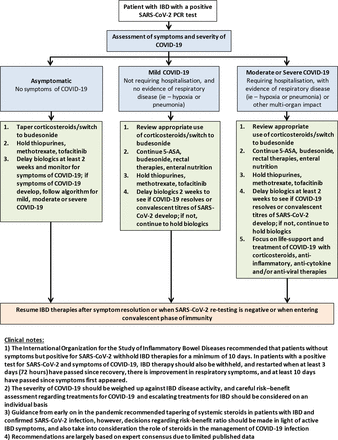
出现COVID-19感染的IBD患者的治疗注意事项。改编自最新的欧洲克罗恩病和结肠炎组织和美国胃肠病协会指南。76 775-ASA 5-aminosalicylic酸;炎症性肠病
国际炎症性肠病研究组织建议,无症状但SARS-CoV-2阳性的患者应至少暂停IBD治疗10天。96对于SARS-CoV-2检测阳性并出现COVID-19症状的患者,也应停止IBD治疗,并在恢复后至少3天(72小时)、呼吸道症状有所改善、且自首次出现症状以来至少10天之后重新启动IBD治疗。
弱势群体
炎症性肠病的孩子
与成人一样,接受免疫抑制的IBD儿童被认为是脆弱的,并具有与COVID-19发生不良结果的潜在更高风险。98令人欣慰的是,与成年IBD患者相比,他们没有出现更高的COVID-19发病率或相关发病率和死亡率。99 - 101与成人相比,儿童(包括患有IBD的儿童)COVID-19的病程较轻,儿童对COVID-19的不良结局较少。99与成人一样,建议对新确诊或经历疾病发作的儿童进行大流行前治疗,91 102因为在COVID-19期间的治疗延误与该年龄组的疾病爆发有关。103长期监测对于更好地理解儿童IBD与新发现的后covid -19病毒综合征(称为多系统炎症综合征)发展之间的关系很重要,104特别是那些正在接受免疫抑制治疗的人。105 106
患有IBD的孕妇
同样,接受免疫抑制的IBD孕妇也可能出现COVID-19不良结局的风险。107然而,在整个大流行期间,这一队列尚未显示出更高的COVID-19发病率或相关发病率和死亡率,与妊娠相关的不良结局也很少发生。100 108有限的研究报告了IBD和COVID-19患者的妊娠结局。109 110在第一种情况下,110一名在妊娠头三个月出现急性ASUC的妇女随后被检测出SARS-CoV-2阳性,并发生了自然流产。这一结果的确切原因尚不清楚,可能与UC严重恶化、COVID-19的影响、基因异常或上述因素的组合有关。在第二种情况下,109一名有轻微IBD症状的妇女在妊娠18周时感染了COVID-19。她有轻微的COVID-19症状,在COVID-19期间暂时停用阿达木单抗后,妊娠未受影响。在244例IBD孕妇(75%接受生物治疗)的回顾性队列中,仅报告了一例COVID-19病例。108到目前为止,患有IBD的孕妇的SARS-CoV-2感染的风险或不良后果似乎没有升高,但需要更大的现实队列才能得出更明确的结论。
IBD患者的内窥镜检查和疾病监测
在大流行早期,大多数指南都建议推迟IBD患者的常规或选择性内窥镜检查,111 - 115除新诊断(和中/重度疾病的高指数)的高危患者外,入院的患者有疾病发作、肠梗阻或硬化性胆管炎。116 - 120建议在手术前仔细对接受COVID-19检测的患者进行分诊,适当使用个人防护设备,由内镜工作人员重新处理内窥镜和附件。此外,在大流行高峰期间,首选使用粪便钙保护素和成像(MRI、CT或超声)的无创评估和监测方法。一项全英国范围内对全国内镜数据库的分析发现,大流行期间的内镜检查程序减少到大流行前正常水平的80%-95%,每周内镜检测到的癌症数量减少了58%,遗漏癌症的比例从19%(胰胆道)到72%(结直肠)不等。121在美国也观察到类似的趋势,结肠直肠癌的诊断率降低了约50%。122捕获ibd相关程序、调查和医院出诊的新数据继续显示,与大流行前相比,大流行期间这些活动的数量减少。123 124
随着各国从最近一波COVID-19中恢复过来,国家指南根据当地需求和资源,将大流行后获得内窥镜服务列为优先事项。125 - 128英国发布了更新的指南,根据内窥镜检查的指征和时间对患者进行分层。例如,对于间隔时间小于3年的患者,在原定预产期的6个月内进行肠镜检查;对于间隔时间为3年或更长时间的患者,在原定预产期的12个月内进行肠镜检查。129
实施家庭生物治疗输液已被用于减少大流行期间的医院出勤率。然而,在实践中,由于缺乏资源或适当的监测和协调护理的最低工作人员,建立这种服务的尝试具有挑战性。130基于家庭的生物药物和抗药物抗体治疗药物监测,即患者用手指穿刺进行小容量毛细血管内采血,被发现等同于医院或诊所的传统静脉穿刺。131这种以家庭为基础,以病人为主导的创新132 133是远程医疗的潜在有用的辅助工具,可能有助于安全管理IBD,同时保护患者免受SARS-CoV-2感染。130 134
SARS-CoV-2疫苗接种
新冠病毒疫苗的引入减少了新冠病毒的传播、住院和死亡人数。它们具有良好的耐受性,据报道,与一般人群相比,IBD患者接种疫苗后不良事件的发生率相似,没有增加疾病恶化的风险。135 - 137然而,先前的研究表明,肺炎球菌后疫苗反应受损15日18在接受英夫利昔单抗治疗的患者中接种流感疫苗,而不是vedolizumab138或ustekinumab。139因此,最初有人担心,使用免疫抑制药物的患者可能减弱了对新冠病毒疫苗的免疫应答,对新冠病毒感染的免疫保护较弱。大多数已发表的数据集中于对BNT162b2、mRNA-1273和ChAdOx1 nCoV-19疫苗的疫苗应答,因为这些疫苗在全世界最常用。保护的最佳关联,定义为保护个体免受疾病侵袭所需的免疫反应,140对SARS-CoV-2感染的影响仍有待确定。因此,体液和细胞免疫反应的替代品已被用来预测疫苗的疗效。这些包括中和抗体测试,141刺突(S)蛋白受体结合域(anti-S RBD)的抗体作为中和抗体的相关物,142以及T细胞研究作为细胞免疫的一种衡量手段。
接种SARS-CoV-2疫苗的体液反应
多项研究报告,在接受免疫抑制治疗的IBD患者中,使用两剂mRNA (BNT162b2, mRNA-1273)或腺病毒载体(ChAdOx1 nCoV-19)疫苗后,血清转换率很高,从81%到100%不等。图3).143 - 146在最近的一项针对9000多名IBD患者的meta分析中,汇集的血清转化率为0.96 (95% CI 0.94 ~ 0.97)。147在纳入的31项研究中,在第二剂SARS-CoV-2疫苗接种后28-179天的范围内确定了血清转换率。疫苗剂量和患者采样间隔的差异、不同抗体测定方法的使用以及复制抗体阈值以定义血清转换率的困难,使得在不同研究中对IBD患者接种疫苗后血清转换率的解释和背景分析具有挑战性。
炎症性肠病(IBD)治疗对SARS-CoV-2疫苗应答的影响通过多变量线性回归模型计算GMR峰值抗体浓度,比较每种药物类与健康对照组的峰值(S)抗体应答的大小。GMR被认为相当于抗体的折叠变化。红色阴影框代表IBD药物与减毒疫苗反应。根据参考数据创建的图。137 143-146 154使用BioRender.com。抗肿瘤坏死因子;5-ASA 5-aminosalicylic酸;GMR,几何平均比;jak -抑制剂,Janus激酶抑制剂。
接种SARS-CoV-2疫苗后的细胞介导免疫应答
细胞介导的免疫反应也可能有助于独立于体液反应的对SARS-CoV-2感染的保护性免疫。非免疫功能低下的研究148 149和免疫功能不全的150队列研究表明,强大的T细胞应答与更好的SARS-CoV-2感染预后相关。体液免疫和T细胞免疫的解耦已经在非免疫功能低下的个体中报道过,151如果T细胞反应没有受损,这可能与体液反应减弱的免疫功能低下患者直接相关。尽管IBD患者的数据有限,但初步研究令人欣慰。coral -IBD从303名接受一系列治疗的IBD患者中发现,抗s RBD抗体浓度和T细胞克隆反应对SARS-CoV-2疫苗的相关性很差,尽管他们发现接受抗tnf治疗的IBD患者与未接受治疗的患者相比,T细胞克隆深度增强。152CLARITY IBD研究是一项针对IBD患者的全英国前瞻性队列研究,研究了英夫利昔单抗和vedolizumab以及/或伴随免疫调节剂对IBD患者SARS-CoV-2获得、疾病和免疫的影响,报告了抗s RBD抗体和抗刺突T细胞反应的解偶联,然而,在使用一或两剂疫苗后,英夫利昔单抗治疗的患者与使用vedolizumab治疗的患者之间观察到类似的T细胞反应。146需要进一步的研究来证实这些发现,并确定T细胞疫苗应答对IBD患者的SARS-CoV-2免疫的相对贡献。
IBD药物和疫苗反应
接受抗肿瘤坏死因子治疗的患者
尽管接种疫苗后血清转换率很高,但与其他生物疗法相比,在接受抗tnf治疗的患者中观察到较低的SARS-CoV-2抗峰值(S)抗体浓度。在CLARITY IBD中,在两剂BNT162b2或ChAdOx1 nCoV-19疫苗后,2279例接受英夫利昔单抗治疗的患者的几何平均(几何SD)抗sars - cov -2 S抗体水平显著低于1031例接受维多珠单抗治疗的患者(BNT162b2(英夫利昔单抗566.7 U/mL vs维多珠单抗4555.3 U/mL)和ChAdOx1 nCoV-19(英夫利昔单抗184.7 U/mL vs维多珠单抗784.0 U/mL)疫苗)。146同时使用免疫调节剂治疗的患者抗sars - cov -2 S抗体浓度也较低。这种关联后来在以色列的一项前瞻性、对照多中心研究RECOVER中得到证实。137两剂BNT162b2疫苗后的抗体应答在73名健康对照者、67名抗tnf治疗者和118名非抗tnf治疗的IBD患者之间进行了比较。在第二剂疫苗接种后四周,抗tnf治疗的个体与健康对照组相比,SARS-CoV-2抗s IgG几何平均浓度显著降低。在这项研究中,当评估中和抗体和使用SARS-CoV-2尖刺伪粒子中和试验时,也看到了类似的观察结果。在RECOVER研究中,抗tnf的注射时间和抗tnf药物水平都与接种后的SARS-CoV-2抗s浓度无关,这表明SARS-CoV-2疫苗可能在抗tnf治疗周期的任何时间点注射。
接受非抗肿瘤坏死因子治疗的患者
使用其他生物和非tnf免疫抑制疗法治疗的IBD患者对SARS-CoV-2疫苗的抗体应答是否也减弱的数据继续出现。大多数研究显示,其他生物疗法对患者的疗效令人放心,但每种药物类别的样本量小,因此受到限制。在一项602例IBD患者(292例(48.3%)抗tnf治疗,112例(18.6%)vedolizumab治疗,91例(15.1%)ustekinumab治疗,51例(8.5%)硫嘌呤治疗和36例(6.0%)5- asa治疗)的单中心队列研究中,将第二次接种BNT162b2、CX-024414或ChAdOx1 nCoV-19疫苗后的抗体应答与168名健康对照组进行比较。153IBD患者和对照组的疫苗接种后血清阳性率相似,抗肿瘤坏死因子治疗和非抗肿瘤坏死因子治疗患者的抗sars - cov -2 IgG中位数水平无显著差异。这可能是由于每组患者数量有限和所使用的化验方法不同。
来自英国的VIP研究评估了362例接受免疫抑制治疗(78例(12.4%)硫嘌呤治疗,72例(19.9%)英夫利昔单抗/硫嘌呤治疗,63例(17.4%)英夫利昔单抗治疗,62例(17.1%)维dolizumab治疗,57例(15.7%)ustekinumab治疗,30例(8.3%)托法替尼治疗)的IBD患者和121名健康对照组在接种BNT162b2或ChAdOx1 nCoV-19疫苗后的抗sars - cov -2 S蛋白抗体应答。154与对照组相比,接受英夫利昔单抗、英夫利昔单抗/硫嘌呤和托法替尼治疗的患者抗sars - cov -2 S蛋白抗体的几何平均浓度显著降低(英夫利昔单抗:156.8 U/mL(几何SD 5.7);p<0.0001,英夫利昔单抗/硫嘌呤:111.1 U/mL(5·7);p<0·0001,托法替尼:429·5 U/mL(3·1);p=0·0012,对照:1578.3 U/mL(3.7))。相比之下,preventive - covid研究比较了317名接受一系列生物和非生物疗法治疗的IBD患者的抗体反应,只发现在接受糖皮质激素治疗的患者中,在两剂mRNA疫苗(BNT162b2, mRNA-1273)后,抗体反应减弱,而没有发现其他药物类别的患者。144在此探索性分析中无法进行正式的假设检验,因为只有13例患者正在接受布地奈德治疗。
在其他有IMIDs的患者队列中,包括银屑病、类风湿性关节炎和肾脏异常患者,也观察到在接种信使rna COVID-19疫苗后抗体应答降低,这并不令人惊讶。155这项对5360名患者(其中一些患者患有IBD)的系统综述的多因素荟萃回归显示,抗cd20治疗,而非抗tnf治疗(p=0.058)与两剂mRNA疫苗接种后降低SARS-CoV-2抗体浓度相关。这一发现在一定程度上可能是由不同的样本量、疾病包括、药物使用和抗体检测来解释的,有待进一步的数据来证实这些发现。
最近,在一项涉及111名IMIDs患者的多中心研究中,与健康对照组相比,使用鞘氨甘苷1-磷酸(S1P)调节剂治疗的患者在接种SARS-CoV-2疫苗后血清转换率较低。156尽管这些患者使用S1P调节剂治疗多发性硬化症,但S1P抑制剂奥扎尼莫(ozanimod)最近已获得监管机构批准用于UC的治疗。是否也会在使用ozanimod治疗的IBD患者中观察到减弱的血清转换率仍有待确定。
既往有SARS-CoV-2感染和不同疫苗类型的患者
在完全接种疫苗后,先前的SARS-CoV-2感染对抗体浓度和血清转换的影响在健康患者中显示出类似的影响方向,157没有IBD的患者接受免疫抑制疗法,158IBD患者。据报道,在接种单剂或两剂疫苗前感染过SARS-CoV-2 (S)的患者,无论治疗类别如何,抗SARS-CoV-2 (S)抗体浓度和血清转换率都更高。146 153 159与ChAdOx1 nCoV-19相比,接种BNT162b2疫苗与IBD患者更高的抗体反应有关,无论是否治疗。146 153值得注意的是,虽然尚不清楚使用硫嘌呤与接种ChAdOx1型nCoV-19疫苗的个体抗SARS-CoV-2抗体浓度较低有关,但基于mrna的SARS-CoV-2疫苗后抗体反应峰值较高,因此建议在免疫抑制队列中使用硫嘌呤。
持久性、疫苗有效性和突破性感染
疫苗诱导的SARS-CoV-2抗体随时间的衰减,如在非免疫抑制队列中观察到的,141 160 161可导致疫苗效力降低,并随后有突破性感染SARS-CoV-2的风险。162因此,在接受免疫抑制治疗的患者中,对SARS-CoV-2疫苗的血清学反应受损可能进一步影响这些患者的持久性和随后的疫苗有效性。在这方面,与vedolizumab治疗的患者相比,在两剂BNT162b2(英夫利昔单抗:26.8天(95% CI 26.2至27.5)vs vedolizumab: 47.6天(95% CI 45.5至49.8)和ChAdOx1 nCoV-19(英夫利昔单抗:35.9天(95% CI 34.9至36.8)vs vedolizumab: 58.0天(95% CI 55.0至61.3)p<0.0001)疫苗治疗后,CLARITY IBD的抗体半衰期较短。146将抗肿瘤坏死因子治疗患者的抗体半衰期与其他非抗肿瘤坏死因子治疗(包括乌斯特单抗、5-ASA和布地奈德以及维多珠单抗)进行比较(38天vs 74天,p=0.045),也观察到类似的结果。163相反,在同时接受生物和非生物治疗的IBD患者中,一项回顾性队列研究报告,在两剂基于mrna的疫苗(BNT162b2, mRNA-1273)后,疫苗有效性为80.4%。164与最初的疫苗试验相似。165 166在这个有IBD的退伍军人健康管理局的大型队列中,大多数患者(54.8%,8048/ 14697)只接受5-ASA治疗,且该研究是在主要循环变异为α (B1.1.7)时进行的。
在接受免疫抑制治疗的IBD患者中,突破性感染的发生率尚不清楚。与vedolizumab治疗的患者相比,CLARITY IBD报告了更多的英夫利昔单抗突破性感染(5.8% (2010 /3441)vs 3.9% (66/1682), p=0.0039),与SARS-CoV-2 PCR阳性的时间更短,146这一发现尚未在其他研究中得到证实。
另外两项队列研究发现,两剂疫苗接种后的突破性感染率没有差异。167 168以色列的一项病例对照研究评估了12109名接种了两剂BNT162b2疫苗的IBD患者。167作者报告称,与未接受这些治疗的IBD患者相比,接受抗tnf或皮质类固醇治疗的患者的突破性感染率或SARS-CoV-2 PCR阳性的时间没有差异(0.4% vs 0.3%, p=1.0)。同样,在一个大型的美国回顾性队列中,IBD患者与非IBD对照患者之间的突破性感染没有差异(0.36% vs 0.28%, RR 1.3 (95% CI 0.83 ~ 2.05))。168总的来说,只有不到1%的突破性感染患者需要住院治疗,无论是否接受IBD治疗。136 146
应谨慎解释突破性感染率的差异,因为不同研究之间的差异结果可能由研究期间疫苗类型、给药间隔、SARS-CoV-2流行率和显性变异发生率的差异解释。
第三剂量和担忧的变种
2021年11月26日,世卫组织将SARS-CoV-2的B.1.1.529或omicron变体指定为值得关注的变体。169由于其传播力的增强和人群免疫力的减弱,这种omicron变体正在推动大量的突破和SARS-CoV-2再感染。据估计,在接种SARS-CoV-2疫苗后,血清学反应需要比以前的SARS-CoV-2变体大40倍,才能获得保护性免疫。170由于大多数已发表的研究早于omicron和较新的SARS-CoV-2变体出现之前,171关于大多数国家建议IBD患者接种第三剂(或强化剂)SARS-CoV-2疫苗后抗体反应的数据几乎没有发表。
HERCULES队列是一项多中心、前瞻性、非随机研究,其初步数据评估了85名接受第三剂SARS-CoV-2 mRNA疫苗的IBD患者的血清学反应。172他们发现所有患者的血清都呈阳性,而且在第三次注射后,中位抗体浓度比两次注射后要高。值得注意的是,接受皮质类固醇、抗tnf、单一或联合治疗的患者,其SARS-CoV-2抗刺突IgG抗体浓度显著低于未接受这些治疗的患者(中位数38 (IQR 20-120) vs 73 (IQR 58-167), p=0.015)。在一项495名IBD患者的前瞻性队列研究中也观察到类似的发现,在第三剂SARS-CoV-2疫苗后,皮质类固醇的使用与较低的SARS-CoV-2刺突蛋白抗体相关(折叠变化:0.07 (95% CI 0.02至0.20)。173
到目前为止,还没有关于第四剂疫苗在IBD患者中的效果和疗效的数据。根据美国疾病控制与预防中心的建议,中度或严重免疫功能低下的12岁及以上的人,包括那些正在积极接受大剂量皮质类固醇或其他可能抑制免疫反应的药物治疗的人,应总共接种四剂新冠病毒疫苗。这四剂疫苗由三剂mRNA - cov -2疫苗的初级系列和一剂mRNA - cov -2疫苗的增强剂组成。174然而,第四剂疫苗对体液或细胞免疫反应的有效性以及药物如何影响随后的抗体衰减仍不清楚。
结论
总之,越来越多的数据表明,IBD患者发生COVID-19的风险没有增加,也没有在COVID-19感染后再次发生IBD的风险增加。然而,年龄较大、共病数量增加和全身皮质类固醇使用是IBD患者COVID-19不良结局的危险因素。研究表明,COVID-19对IBD疾病活动没有短期影响,但需要在更多更大的队列中进行验证,且COVID-19长期存在的风险尚不清楚。皮质类固醇的使用似乎与COVID-19不良结局的风险增加有关,但用于治疗IBD的大多数其他药物,包括生物制剂、美沙拉嗪和柳氮磺胺与COVID-19严重结局无关。有一些信号表明,抗肿瘤坏死因子疗法可能发挥保护作用。这些结果支持在COVID-19大流行期间,保持IBD患者服用最佳治疗其IBD的药物。
接种SARS-CoV-2疫苗的风险较低,强烈建议在IBD患者中接种SARS-CoV-2疫苗,但在一些IBD患者中,特别是服用抗tnf药物的患者,对SARS-CoV-2疫苗的保护性免疫反应减弱。接受抗tnf +免疫调节剂联合治疗和JAKi治疗的患者对SARS-CoV-2疫苗接种的抗体应答也较差,这使他们面临感染SARS-CoV-2的潜在风险增加。这些发现支持为IBD患者安排疫苗剂量的个性化方法。未来的研究应该探索与疫苗犹豫相关的因素及其在IBD群体中的影响,免疫抑制对疫苗有效性的长期影响,并寻找疫苗成功的预测生物标志物,以及第四剂疫苗的时间。关于长期疗效和降低血清学反应机制的进一步数据也有必要。
伦理语句
病人同意发表
参考文献
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
脚注
NAK和SCN是联合资深作者。
推特@SimengLin, @LouisHSLau, @nchanchlani1, @DrNickKennedy, @Siew_C_Ng
SL、LHL和NC贡献相当。
贡献者SL, LL和NC构思概念并起草手稿。NAK和SCN构思了概念,并对手稿进行了批判性的修改。所有作者都认可了手稿的最终版本。
资金SL由惠康GW4-CAT奖学金支持。NC感谢Crohn's & Colitis UK的支持。SCN由中华人民共和国香港特别行政区InnoHK,政府提供部分资金。
相互竞争的利益SL报告了来自辉瑞和Ferring的非财务支持,在提交的工作之外。LL没有要申报的利益冲突。NC没有要申报的利益冲突。NAK报告了来自F. Hoffmann-La Roche AG的赠款,来自Biogen的赠款,来自Celltrion Healthcare的赠款,来自Galapagos NV的赠款,来自immundiagnostics的非财政支持,来自AbbVie的赠款和非财政支持,来自Celltrion的赠款和个人费用,来自Janssen的个人费用和非财政支持,来自Takeda的个人费用,来自Falk博士的个人费用和非财政支持,在提交的工作之外。SCN曾担任Janssen, Abbvie, Takeda, Ferring, Tilotts, Menarini, Pfizer的发言人,并获得了奥林巴斯,Ferring, Janssen和Abbvie的研究资助,在提交的工作之外。
来源和同行评审委托;外部同行评议。
请求的权限
如果您希望重用这篇文章的任何部分或全部,请使用下面的链接,它将带您访问版权清除中心的RightsLink服务。您将能够快速获得价格和以多种不同方式重用内容的即时许可。