摘要gydF4y2Ba
虽然感染严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)对一些个体具有多效性和全身性影响gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba在美国,许多人的症状较轻。在这里,为了更全面地了解2019冠状病毒病(COVID-19)病理学中严重和轻度表型的区别及其起源,我们进行了一项全血保存单细胞分析方案,以整合血液中所有主要免疫细胞类型的贡献,包括中性粒细胞、单核细胞、血小板、淋巴细胞和血清内容。轻度COVID-19患者表现出干扰素刺激基因(ISGs)的协调表达模式gydF4y2Ba3.gydF4y2Ba而这些表达isg的细胞在严重疾病患者中是系统性缺失的。矛盾的是,与轻症患者相比,COVID-19重症患者产生非常高的抗sars - cov -2抗体滴度,并且病毒载量较低。对COVID-19重症患者血清的检查表明,这些患者独特地产生抗体,通过激活抑制细胞对干扰素反应的保守信号回路,在功能上阻断与轻度疾病相关的isg表达细胞的产生。在许多COVID-19患者中,过度的抗体反应使免疫系统与自身对抗,也许在其他病毒感染的个体中也是如此。我们的研究结果揭示了严重COVID-19患者免疫疗法的潜在靶点,以重新参与病毒防御。gydF4y2Ba
主要gydF4y2Ba
为了更好地了解对SARS-CoV-2的免疫反应生物学,我们将COVID-19患者(即SARS-CoV-2病毒检测呈阳性的患者)与出现类似呼吸道症状但未感染SARS-CoV-2的患者进行了比较。我们招募了21名SARS-CoV-2阳性的住院患者;临床表现相似,符合急性肺损伤或急性呼吸窘迫综合征,新冠病毒阴性(即由其他感染引起或原因不明)的住院患者11例;和14个健康的对照组。我们进一步根据其疾病的全部临床病程将这些患者分为“轻度-中度”疾病(需要短期住院,不需要机械通气和重症监护)或“重度”疾病(需要插管和重症监护)(图。gydF4y2Ba1gydF4y2Ba扩展数据图gydF4y2Ba1gydF4y2Ba,补充表gydF4y2Ba1克ydF4y2Ba).因此,我们的研究包括轻度-中度COVID-19患者(gydF4y2BangydF4y2Ba= 11),严重COVID-19患者(gydF4y2BangydF4y2Ba= 10),以及轻度-中度(gydF4y2BangydF4y2Ba= 6)或严重(gydF4y2BangydF4y2Ba= 5)与COVID-19无关的急性肺损伤或急性呼吸窘迫综合征。除1例患者外,所有表现为轻中度疾病的患者在住院期间均保持轻中度(扩展数据图)。gydF4y2Ba1gydF4y2Ba),表明在该队列中,轻度-中度和重度是稳定状态,而不是疾病的短暂阶段。gydF4y2Ba
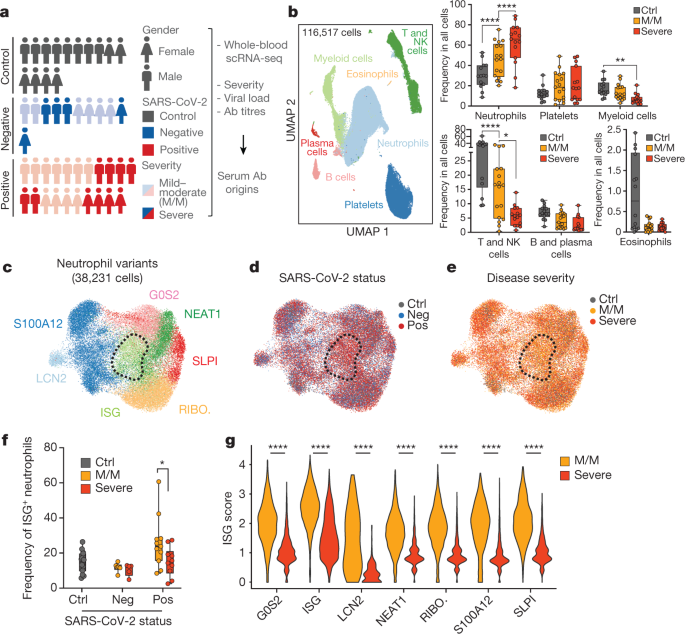
一个gydF4y2Ba,左,患者和健康对照个体的性别、SARS-CoV-2状态和疾病严重程度,右,研究设计说明。Ab抗体。gydF4y2BabgydF4y2Ba,左,统一流形近似和投影(UMAP)可视化116,517个细胞合并从整个队列与特定群体的细胞覆盖。右,这些细胞群在健康对照个体(Ctrl)、轻中度疾病患者(M/M)和严重疾病患者中的频率。gydF4y2BacgydF4y2Ba,中性粒细胞亚群UMAP显示。这些子集是根据它们的基因表达来命名的;日博。,enr我ched我nribosomal proteins.dgydF4y2Ba,gydF4y2BaegydF4y2Ba, SARS-CoV-2状态和疾病严重程度分别对中性粒细胞UMAP的覆盖。gydF4y2BafgydF4y2Ba, ISG频率gydF4y2Ba+gydF4y2Ba根据SARS-CoV-2状态(阳性或阴性)和疾病严重程度(对照,gydF4y2BangydF4y2Ba= 14;SARS-CoV-2-negative M / M,gydF4y2BangydF4y2Ba= 6;SARS-CoV-2-negative严重,gydF4y2BangydF4y2Ba= 5;SARS-CoV-2-positive M / M,gydF4y2BangydF4y2Ba= 11, sars - cov -2阳性严重gydF4y2BangydF4y2Ba= 10)。gydF4y2BaggydF4y2Ba在SARS-CoV-2阳性患者中,中性粒细胞亚型和疾病严重程度的ISG-signature评分。采用双向方差分析(ANOVA)和多重比较(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaegydF4y2Ba)或双面Wilcoxon检验(gydF4y2BafgydF4y2Ba).*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ****gydF4y2BaPgydF4y2Ba< 0.0001。对于箱形图gydF4y2BabgydF4y2Ba,gydF4y2BafgydF4y2Ba:中线,中间;盒子限制,第25和75百分位;胡须,最小值和最大值。gydF4y2Ba
由于大多数COVID-19死亡发生在急性呼吸窘迫综合征患者中,其特征是强烈的免疫反应,其中中性粒细胞、单核细胞和血小板的作用突出,因此我们重点收集了这些细胞和其他主要种群。因此,我们对所有个体的红细胞耗尽的血液样本进行了单细胞RNA测序(scRNA-seq)。经过合并、批量校正和去除孪晶后,我们的数据包含116,517个细胞(图2)。gydF4y2Ba1 bgydF4y2Ba扩展数据图gydF4y2Ba1 bgydF4y2Ba),其中我们鉴定出中性粒细胞、血小板、单核吞噬细胞、T细胞、自然杀伤细胞(NK)、B细胞、浆细胞和嗜酸性粒细胞(图。gydF4y2Ba1 bgydF4y2Ba扩展数据图gydF4y2Ba1 cgydF4y2Ba).我们证实中性粒细胞频率与疾病严重程度呈正相关,而淋巴细胞种群呈负相关gydF4y2Ba1克ydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba(无花果。gydF4y2Ba1 bgydF4y2Ba扩展数据图gydF4y2Ba1 dgydF4y2Ba).在这个分辨率水平上,SARS-CoV-2病毒呈阴性和阳性的个体之间的结果相似(扩展数据图)。gydF4y2Ba1 f-egydF4y2Ba)gydF4y2Ba
在中性粒细胞中,我们鉴定出7个亚型(图2)。gydF4y2Ba1 cgydF4y2Ba扩展数据图gydF4y2Ba2gydF4y2Ba),与之前的研究一致gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4 gydF4y2Ba.一种表达强烈干扰素刺激基因(ISG)签名的人群(以下称为ISG中性粒细胞)在COVID-19患者中高度富集,但在病情严重的患者中没有(图2)。gydF4y2Ba1 d, egydF4y2Ba扩展数据图gydF4y2Ba2 bgydF4y2Ba).独立伪时间分析(扩展数据图。gydF4y2Ba2 dgydF4y2Ba)将ISG亚型置于分化晚期,并表明这是唯一在轻中度疾病患者和重度疾病患者之间发生显著变化的状态(扩展数据图)。gydF4y2Ba2 egydF4y2Ba),特别是在SARS-CoV-2阳性的个体中(图2)。gydF4y2Ba1 fgydF4y2Ba扩展数据图gydF4y2Ba2摄氏度gydF4y2Ba).isg特征基因包括主要抗病毒调节因子,如gydF4y2BaISG15gydF4y2Ba而且gydF4y2BaIFITM3gydF4y2Ba后者编码干扰素诱导的跨膜蛋白3,限制病毒进入细胞质gydF4y2Ba5gydF4y2Ba.gydF4y2Ba
我们还分析了所有中性粒细胞中SARS-CoV-2阳性和阴性患者的差异表达基因(deg),以及轻中度疾病患者和重度疾病患者的差异表达基因。与sars - cov -2阳性的重症患者相比,isg标记基因在所有中性粒细胞亚群中均表现出较高的相对表达水平,特别是在轻-中度疾病患者中。gydF4y2Ba1克gydF4y2Ba扩展数据图gydF4y2Ba2 h ngydF4y2Ba).相比之下,与轻中度疾病患者相比,无论COVID-19状态如何,重症患者的中性粒细胞中单独的中性粒细胞脱颗粒基因程序上调(扩展数据图)。gydF4y2Ba2 o-pgydF4y2Ba).这表明,无论病原是什么,在所有呼吸道感染中都存在一个共同的脱颗粒增强程序,并且在轻度-中度COVID-19患者的所有中性粒细胞中都发生了ISG程序的全面诱导,而在重度COVID-19患者中没有这种诱导gydF4y2Ba3.gydF4y2Ba.gydF4y2Ba
对单核吞噬细胞(单核细胞、巨噬细胞、树突状细胞和浆细胞样树突状细胞)的评估得出了7组转录上不同的细胞亚群,这些亚群在我们的队列中均匀分布(扩展数据图)。gydF4y2Ba3 fgydF4y2Ba).我们发现,在COVID-19患者中,特别是在轻中度疾病患者中,经典单核细胞的isg表达簇富集,与中性粒细胞相似(图2)。gydF4y2Ba2gydF4y2Ba扩展数据图gydF4y2Ba4得了gydF4y2Ba).表达isg的单核细胞也表达与糖酵解相关的基因;相比之下,表达S100钙结合蛋白A12 (S100A12)的单核细胞亚群富集了与氧化磷酸化相关的基因,这与先前关于细菌性败血症的报道一致gydF4y2Ba6gydF4y2Ba(扩展数据图。gydF4y2Ba4 dgydF4y2Ba).对deg的分析表明,当整个单核吞噬细胞池被评估时,isg是与轻度-中度表型相关的显性基因(扩展数据图)。gydF4y2Ba4 egydF4y2Ba).gydF4y2Ba
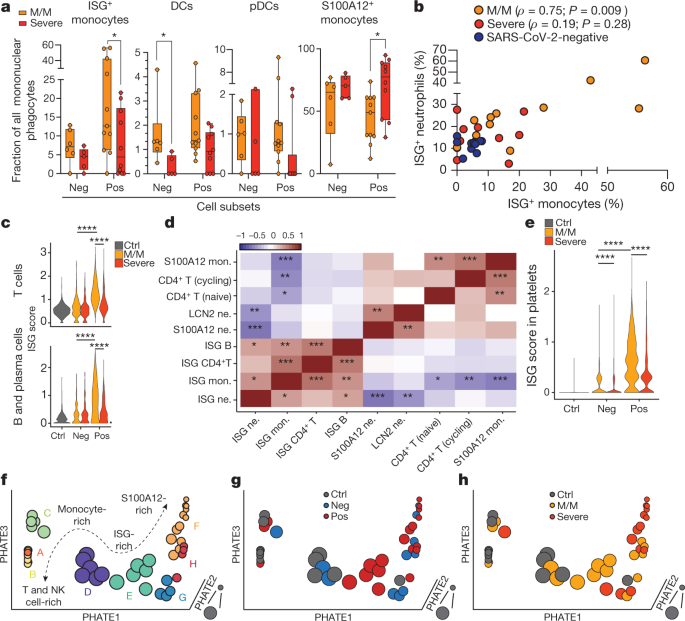
一个gydF4y2Ba轻-中度疾病患者(sars - cov -2阴性,gydF4y2BangydF4y2Ba= 6;SARS-CoV-2-positive,gydF4y2BangydF4y2Ba= 11)和严重疾病(sars - cov -2阴性,gydF4y2BangydF4y2Ba= 5;SARS-CoV-2-positive,gydF4y2BangydF4y2Ba= 10)。树突状细胞;pDCs,浆细胞样树突状细胞。中线,中间;盒子限制,第25和75百分位;胡须,最小值和最大值。gydF4y2BabgydF4y2Ba,散点图显示ISG之间的相关性gydF4y2Ba+gydF4y2Ba中性粒细胞和ISGgydF4y2Ba+gydF4y2Ba指示组患者的单核细胞亚群。gydF4y2BaPgydF4y2Ba值与斯皮尔曼秩相关系数(gydF4y2BaρgydF4y2Ba)显示(M/M,gydF4y2BangydF4y2Ba= 11;严重,gydF4y2BangydF4y2Ba= 10;SARS-CoV-2-negative,gydF4y2BangydF4y2Ba= 11)。gydF4y2BacgydF4y2Ba,根据SARS-CoV-2状态和疾病严重程度,所有T细胞(上)和所有B细胞和浆细胞(下)中ISG-signature评分的小提琴图。采用双侧Wilcoxon检验评估统计学意义。gydF4y2BadgydF4y2Ba,使用与ISG相关最多和最少的细胞子集之间的斯皮尔曼秩相关的相关矩阵gydF4y2Ba+gydF4y2Ba中性粒细胞(数据包括所有SARS-CoV-2阴性和阳性患者)。Mon.,单核细胞,ne。中性粒细胞。gydF4y2BaegydF4y2Ba,所有血小板的isg特征评分,根据SARS-CoV-2状态和疾病严重程度。gydF4y2BafgydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba,所有患者的三维PhEMD嵌入,以新生患者簇A-H着色(gydF4y2BafgydF4y2Ba)、SARS-CoV-2状态(gydF4y2BaggydF4y2Ba)和疾病严重程度(gydF4y2BahgydF4y2Ba).基于亲和的过渡包埋热扩散势。采用双尾Spearman秩相关检验(gydF4y2BabgydF4y2Ba)、多重比较的Kruskal-Wallis检验(gydF4y2Ba一个gydF4y2Ba)或双面Wilcoxon检验(gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba).*gydF4y2BaPgydF4y2Ba< 0.05, ****gydF4y2BaPgydF4y2Ba< 0.0001。gydF4y2Ba
表达ISG的频率(ISGgydF4y2Ba+gydF4y2Ba)单核细胞和ISGgydF4y2Ba+gydF4y2Ba在轻-中度COVID-19患者中,中性粒细胞之间的相关性很强(图2)。gydF4y2Ba2 bgydF4y2Ba扩展数据图gydF4y2Ba4 fgydF4y2Ba).T细胞和B细胞频率的综合分析(扩展数据图。gydF4y2Ba5gydF4y2Ba)显示,这两种细胞类型的ISG特征也显著富集,特别是在轻-中度COVID-19患者中(图2)。gydF4y2Ba2摄氏度gydF4y2Ba).ISG的频率gydF4y2Ba+gydF4y2Ba一个区室中的细胞与另一个区室中的细胞相互关联,例如ISGgydF4y2Ba+gydF4y2BaT细胞和ISGgydF4y2Ba+gydF4y2Ba中性粒细胞-仅存在于轻中度疾病患者(扩展数据图)。gydF4y2Ba4 ggydF4y2Ba).因此,所有患者的多种细胞类型的Spearman相关分析显示了相关的ISG集合gydF4y2Ba+gydF4y2Ba细胞群和其他细胞群的第二个抗相关块,特别是那些表达S100A12的细胞群(图2)。gydF4y2Ba二维gydF4y2Ba).gydF4y2Ba
我们的scRNA-seq全血数据集也允许我们识别血小板,并根据已建立的血小板特征基因将其分类为亚群(图2)。gydF4y2Ba1gydF4y2Ba扩展数据图gydF4y2Ba1 dgydF4y2Ba).对这些基因的分析发现了6个基因簇,其中3个(命名为“H3F3B”,“HIST1H2AC”和“RGS18”)仍然携带从亲本细胞(巨核细胞)获得的转录本。gydF4y2Ba7gydF4y2Ba(扩展数据图。gydF4y2Ba6 a、bgydF4y2Ba).在严重的COVID-19患者中,HIST1H2AC亚群仅少量耗尽,表明偏离了“年轻”细胞(扩展数据图)。gydF4y2Ba6摄氏度gydF4y2Ba).为了进一步研究这一发现,我们覆盖了的表达式gydF4y2BaBCL2L1gydF4y2Ba,它已被确定为血小板寿命的“分子钟”,并添加到我们的数据集中gydF4y2Ba8gydF4y2Ba.这表明富含组蛋白的H3F3B簇代表“年轻”血小板(扩展数据图。gydF4y2Ba6 dgydF4y2Ba)——这一结果得到了年轻的网状血小板转录本的第二个签名的支持gydF4y2Ba9gydF4y2Ba(扩展数据图。gydF4y2Ba6 egydF4y2Ba).基于H3F3B聚类的伪时间分析(扩展数据图。gydF4y2Ba6 f, ggydF4y2Ba)再次表明,在轨迹终点,来自所有疾病患者的血小板普遍过量(扩展数据图。gydF4y2Ba6小时gydF4y2Ba).虽然我们没有明确的ISGgydF4y2Ba+gydF4y2Ba集群(扩展数据图。gydF4y2Ba6我gydF4y2Ba),类似于髓样细胞和淋巴样细胞,轻中度疾病患者血小板中的isg标记值相对于严重疾病患者有所增加,特别是对于COVID-19患者(图2)。gydF4y2Ba2 egydF4y2Ba).gydF4y2Ba
血小板scRNA-seq还允许使用“血小板优先”方法鉴定血小板和非血小板之间的异型聚集物(扩展数据图)。gydF4y2Ba7得了gydF4y2Ba).这种方法揭示了与细胞相关的血小板转录物的存在,这些细胞也具有其他主要血细胞类型的特征(扩展数据图)。gydF4y2Ba7得了gydF4y2Ba).与原始数据集相比,我们发现在这个“血小板优先”对象中细胞类型的频率没有显著差异(扩展数据图。gydF4y2Ba7 egydF4y2Ba).这表明,至少在循环血液中,血小板与不同的其他细胞类型不加区别地聚集在一起,而不会偏向于某一种细胞类型。gydF4y2Ba
重症COVID-19整体评估gydF4y2Ba
在观察到在轻中度疾病患者中每种细胞类型的ISG表达谱都有所增加,但在重度疾病患者中整体减少后,我们转向了疾病状态的整体观点。PhEMD(“表型地球移动者的距离”)gydF4y2Ba10克ydF4y2Ba根据患者的细胞亚型频率对其进行包埋,结果显示有8组不同的患者。gydF4y2Ba2 fgydF4y2Ba扩展数据图gydF4y2Ba7 fgydF4y2Ba),其中从A到H的进展代表中性粒细胞相对频率普遍增加的患者。C、D、G、H组为单核细胞相对富集的患者。E组为ISG富集的患者gydF4y2Ba+gydF4y2Ba中性粒细胞,主要由sars - cov -2阳性的轻中度疾病患者组成(图。gydF4y2Ba2 g hgydF4y2Ba).相比之下,G组是患者的另一种“严重”命运,中性粒细胞高度富集,S100A12占优势gydF4y2Ba+gydF4y2Ba而不是ISGgydF4y2Ba+gydF4y2Ba中性粒细胞(扩展数据图。gydF4y2Ba7 fgydF4y2Ba).gydF4y2Ba
血清干扰素α (IFNα)检测不能解释ISG的丢失gydF4y2Ba+gydF4y2Ba在重症患者中观察到大量的IFNα产生(图2)。gydF4y2Ba3gydF4y2Ba).然而,研究小组gydF4y2Ba+gydF4y2Ba细胞群与较轻的COVID-19疾病严重程度密切相关,表现出较高的血清IFNα浓度和较低的血浆表面活性蛋白D (SP-D)水平(表明肺泡上皮损伤)(扩展数据图)。gydF4y2Ba8gydF4y2Ba).当与高维血浆蛋白水平面板进行比较时(扩展数据图。gydF4y2Ba8 cgydF4y2Ba),大多数ISGgydF4y2Ba+gydF4y2Ba细胞亚型聚集在一起,并与指示强烈的ISG和T辅助性1 (TgydF4y2BaHgydF4y2Ba1)响应(CXCL1, CXCL6, CXCL10, CXCL11, TNFB, IL-12B, MCP2和MCP4)。ISG状态的一个意想不到的反相关是针对SARS-CoV-2刺突和核衣壳蛋白的血清抗体浓度(图2)。gydF4y2Ba3 bgydF4y2Ba扩展数据图gydF4y2Ba8gydF4y2Ba).gydF4y2Ba
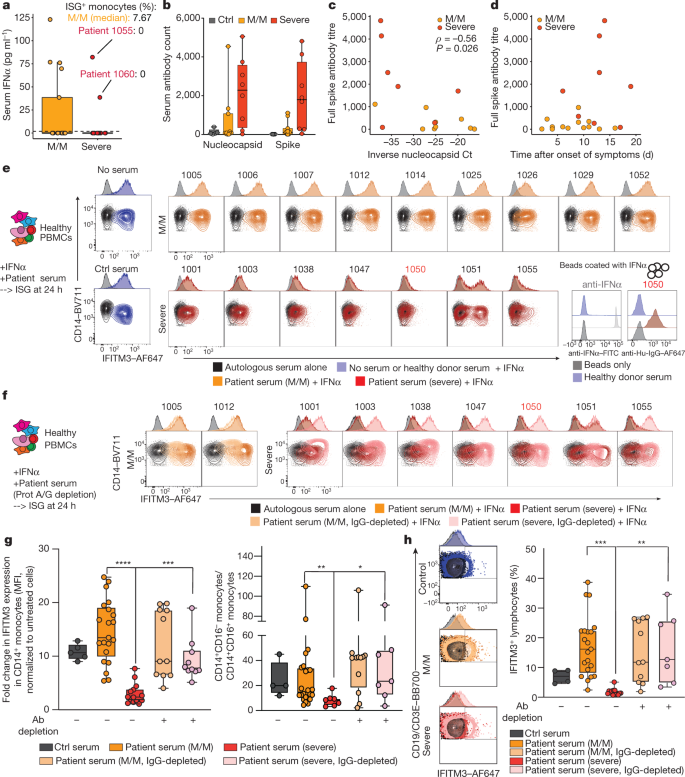
一个gydF4y2Ba、轻中度疾病患者血清IFNα浓度(gydF4y2BangydF4y2Ba= 17)或严重疾病(gydF4y2BangydF4y2Ba= 15),这些人的SARS-CoV-2呈阴性或阳性(通过酶联免疫吸附试验(ELISA)测定)。患者1055和1060用红色突出显示,以及他们的ISG频率gydF4y2Ba+gydF4y2Ba单核细胞(图;gydF4y2Ba2摄氏度gydF4y2Ba),轻中度COVID-19患者的中位数频率也是如此。中线,中间;盒子限制,第25和75百分位;胡须,1.5 ×四分位范围。gydF4y2BabgydF4y2Ba, Luminex法检测患者血清中抗sars - cov -2抗体(抗刺突蛋白和核衣壳蛋白)水平。gydF4y2BacgydF4y2Ba,显示SARS-CoV-2阳性患者的病毒载量与结合SARS-CoV-2核衣壳蛋白的抗体水平的散点图,疾病严重程度重叠。抗体水平(抗SARS-CoV-2刺突蛋白的全抗体滴度)显示为Luminex测定的任意单位中位数荧光强度(MFI);病毒载量用倒数表示gydF4y2BaCgydF4y2BatgydF4y2Ba以SARS-CoV-2核衣壳序列为靶点扩增的定量PCR反转录(qRT-PCR)编号。采用Spearman方法计算相关系数和显著性。无法获得数据的患者被排除在外(M/M,gydF4y2BangydF4y2Ba= 9;严重,gydF4y2BangydF4y2Ba= 7)。gydF4y2BadgydF4y2Ba,显示针对SARS-CoV-2刺突蛋白的完整抗体滴度相对于症状出现后几天的散点图。无法获得数据的患者被排除在外(M/M,gydF4y2BangydF4y2Ba= 14;严重,gydF4y2BangydF4y2Ba= 8)。gydF4y2BaegydF4y2Ba用IFNα和健康供体或轻中度或重度COVID-19患者血清培养健康pmcs后,单核细胞CD14和IFITM3表达等高线图和直方图。患者标识符(1005、1006等)显示在顶部。gydF4y2BafgydF4y2Ba,用蛋白A/G珠预处理轻度-中度(浅黄色)或重度(粉红色)COVID-19患者血清后,在与pbmc培养前,单核细胞CD14和IFITM3表达的等高线图和直方图,以耗尽IgG水平。gydF4y2BaggydF4y2Ba,左,IFITM3在CD14中表达的Fold变化gydF4y2Ba+gydF4y2Ba单核细胞(控制,gydF4y2BangydF4y2Ba= 5;M / M,gydF4y2BangydF4y2Ba= 21;严重,gydF4y2BangydF4y2Ba= 14;M / M耗尽,gydF4y2BangydF4y2Ba= 11;严重的枯竭,gydF4y2BangydF4y2Ba= 10)。对,经典单核细胞与中间单核细胞的比例(对照,gydF4y2BangydF4y2Ba= 4;M / M,gydF4y2BangydF4y2Ba= 24;严重,gydF4y2BangydF4y2Ba= 7;M / M耗尽,gydF4y2BangydF4y2Ba= 11;严重的枯竭,gydF4y2BangydF4y2Ba= 7),来自两个不同的实验和两个不同的健康捐赠者。gydF4y2BahgydF4y2Ba,左为合并CD3后IFITM3表达的等高线图和直方图gydF4y2Ba+gydF4y2BaCD19gydF4y2Ba+gydF4y2Ba用IFNα和健康供体或SARS-CoV-2阳性患者的血清培养健康pmcs和淋巴细胞。对,IFITM3在淋巴细胞中的诱导。统计意义gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba采用双因素方差分析和多重比较进行评估。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001, ****gydF4y2BaPgydF4y2Ba< 0.0001。对于箱形图gydF4y2BabgydF4y2Ba,gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba:中线,中间;盒子限制,第25和75百分位;胡须,最小值和最大值。gydF4y2Ba
这种反相关性是明显的,并且在严重COVID-19患者血清中较高水平的IgG抗体或免疫复合物中没有强烈反映(扩展数据图)。gydF4y2Ba8 d-fgydF4y2Ba).我们认为严重COVID-19患者具有更高水平的潜在中和抗体是一个悖论。这一发现似乎与之前的报告相矛盾,这些报告显示病毒载量与COVID-19的严重程度和死亡率有关gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba-这种差异可以解释为这些研究检查了高死亡率的患者,这在我们的队列中是非常罕见的事件(补充表)gydF4y2Ba1克ydF4y2Ba).入院当天,两种抗体(即针对SARS-CoV-2刺突和核衣壳蛋白)的特异性与从鼻拭子评估的病毒载量呈反相关(图2)。gydF4y2Ba3 cgydF4y2Ba扩展数据图gydF4y2Ba8 bgydF4y2Ba),与这些中和抗体相一致(尽管没有确切的证据)。据报道,抗体滴度增加和病毒载量下降是疾病后期的一个特征gydF4y2Ba13gydF4y2Ba,我们考虑了我们观察到的轻中度疾病只是先于严重疾病的假设。然而,我们发现,随着时间的推移,与轻中度疾病患者相比,重症COVID-19患者的抗体滴度始终较高——甚至在症状出现两周后(图2)。gydF4y2Ba3 dgydF4y2Ba扩展数据图gydF4y2Ba8 egydF4y2Ba) -在我们的21例轻中度疾病患者中,只有1例继续发展为严重疾病(扩展数据图。gydF4y2Ba1 bgydF4y2Ba).最后,我们观察到症状发作日期与ISG的存在之间没有统计学相关性gydF4y2Ba+gydF4y2Ba细胞群(扩展数据图。gydF4y2Ba8gydF4y2Ba).这些因素似乎反对轻度-中度和重度状态之间的简单时间关系,并引导我们研究血清中这种状态分裂的系统病因。gydF4y2Ba
抗体拮抗ISG反应gydF4y2Ba
考虑到这种抗体的增强,我们首先询问了重症COVID-19患者的血清是否也含有抗ISG抗体gydF4y2Ba+gydF4y2Ba通过将血清直接应用于健康个体的外周血单个核细胞(pmcs),与IFNα和不含IFNα培养(扩展数据图)。gydF4y2Ba9模拟gydF4y2Ba).我们在两名轻中度COVID-19患者和两名重度COVID-19患者的血清中检测到结合ifn处理细胞的抗体(扩展数据图)。gydF4y2Ba9gydF4y2Ba).然而,不同细胞类型的染色差异很大(扩展数据图。gydF4y2Ba9 cgydF4y2Ba),无论有无IFNα刺激,这表明每个患者可能都有独特的特异性组合。例如,虽然1050号患者的血清没有染色ISGgydF4y2Ba+gydF4y2Ba我们在该患者中发现了抗IFNα抗体的证据(图2)。gydF4y2Ba3 egydF4y2Ba)——这与最近的一项研究一致gydF4y2Ba14gydF4y2Ba该研究还发现,大约12%的COVID-19患者体内存在抗ifn α抗体。该患者在我们的队列中是独一无二的,IFNα反应不能解释缺乏ISGgydF4y2Ba+gydF4y2Ba大多数严重COVID-19患者的细胞。gydF4y2Ba
我们以IFITM3为标记物,分别检测了重症COVID-19患者血清中的因子是否影响IFNα对isg标记基因的诱导。因此,我们将5%的患者血清添加到IFNα刺激的健康pmcs样本中,发现来自健康对照个体或来自轻-中度COVID-19患者的血清对分化没有影响(通过IFITM3水平或CD14频率测量)gydF4y2Ba+gydF4y2BaCD16gydF4y2Ba+gydF4y2Ba),所有来自严重COVID-19患者的检测血清均有显著影响,从完全阻断到部分抑制IFNα反应(图2)。gydF4y2Ba3 e, ggydF4y2Ba扩展数据图gydF4y2Ba9 d, egydF4y2Ba).gydF4y2Ba
为了测试重症COVID-19患者血清中的抗体是否与IFNα反应的抑制有关,我们用蛋白A和蛋白G(蛋白A/G)珠预先吸附患者血清,以消耗血清中的抗体。这缓解了IFITM3诱导的阻塞,并恢复了干扰素刺激的单核细胞的总产量(图。gydF4y2Ba3 f, ggydF4y2Ba).在包括淋巴细胞在内的其他人群中,ifn α依赖的ISG签名生成也观察到类似的抗体吸收阻断和释放(图2)。gydF4y2Ba3 hgydF4y2Ba扩展数据图gydF4y2Ba9 fgydF4y2Ba).这是有可能的,因为稳健的IFN反应依赖于初始干扰素-α受体(IFNAR)信号传递的正反馈环gydF4y2Ba15gydF4y2Ba淋巴细胞中的IFN反应受益于单核细胞中IFNAR信号的扩增。我们还证实了对ISG生成的抑制作用gydF4y2Ba+gydF4y2Ba在第二个验证队列中,由8名轻中度COVID-19患者和6名重度COVID-19患者组成(扩展数据图)。gydF4y2Ba10gydF4y2Ba,补充表gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
IFNAR信号通路FCγRIIb的拮抗作用gydF4y2Ba
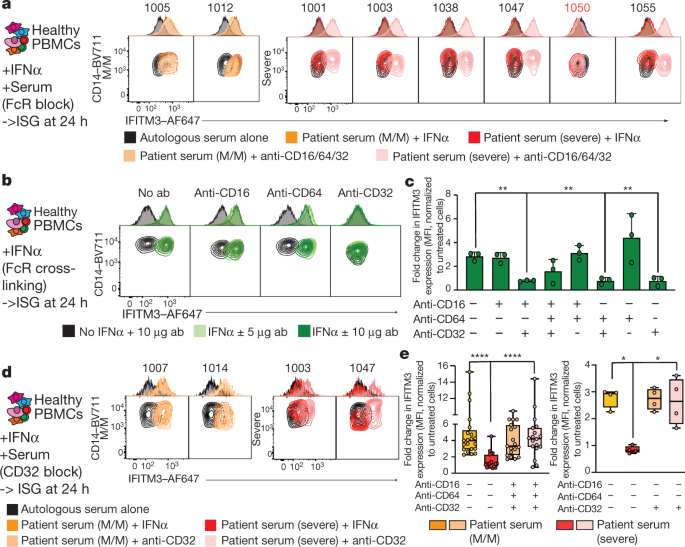
在探索这一结果的机制时,我们发现,在IFNα和患者血清培养期间,用Fc受体阻断抗体(CD16、CD64和CD32)处理pmcs,可以恢复用重症COVID-19患者血清培养的细胞中IFITM3的诱导(图2)。gydF4y2Ba4 a, egydF4y2Ba)和验证(扩展数据图。gydF4y2Ba10 bgydF4y2Ba)军团。阻断Fc受体不仅可以恢复IFITM3的诱导,还可以恢复其他isg的诱导,如IFI27、ISG15和MX1(扩展数据图)。gydF4y2Ba10 cgydF4y2Ba).这些结果,以及与严重COVID-19患者血清培养的pmcs细胞死亡没有增加(扩展数据图)。gydF4y2Ba10 dgydF4y2Ba),提示严重疾病患者血清中存在的抗体触发Fc受体信号,抑制IFNAR参与后的转录反应。gydF4y2Ba
一个gydF4y2Ba在存在或不存在抗cd16、抗cd64和抗cd32抗体(抗cd16 /64/32)以阻断Fc受体(FcRs)的情况下,用IFNα和健康供体或轻-中度或重度COVID-19患者的血清培养健康pmcs后,单核细胞CD14和IFITM3表达的等高线图和直方图。患者标识符显示在顶部。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba, CD14和IFITM3表达等高线图和直方图(gydF4y2BabgydF4y2Ba)和IFITM3表达的折叠变化(gydF4y2BacgydF4y2Ba)在CD14gydF4y2Ba+gydF4y2BaIFNα加或不加5 μg、10 μg ml、不加或不加IFNα的健康pmcs培养后的单核细胞gydF4y2Ba−1gydF4y2Ba抗cd16、抗cd32或抗cd64抗体单独或联合交联并激活Fc受体。结果gydF4y2BacgydF4y2Ba来自两个独立的实验和两个不同的细胞供体,包括其中一个供体的两个抗体数量(gydF4y2BangydF4y2Ba= 3次实验)。数据为均数±标准差。gydF4y2BadgydF4y2Ba中所述的中和试验gydF4y2Ba一个gydF4y2Ba,但只添加了抗cd32抗体。gydF4y2BaegydF4y2Ba,实验中IFITM3表达的变化gydF4y2Ba一个gydF4y2Ba(左)(五个独立的实验和三个不同的捐赠者)和gydF4y2BadgydF4y2Ba(右)(一个实验和两个不同的捐赠者)。中线,中间;盒子限制,第25和75百分位;胡须,最小值和最大值。统计意义gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba采用双向方差分析和多重比较进行评估。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ****gydF4y2BaPgydF4y2Ba< 0.0001。gydF4y2Ba
我们认为这种机制可能是抗体生成下调干扰素级联的基本途径,因此我们测试了通过交联激活Fc受体是否能拮抗IFNα对IFITM3的诱导。与CD16和CD64单独交联的PBMCs相比,CD32单独交联的PBMCs对IFITM3的诱导明显减少(图2)。gydF4y2Ba4 b, cgydF4y2Ba扩展数据图gydF4y2Ba10 egydF4y2Ba),而所有三种Fc受体的交联一起诱导促炎细胞因子的产生(扩展数据图。gydF4y2Ba10 fgydF4y2Ba).gydF4y2Ba
回到对重症COVID-19患者血清的影响,我们发现,在重症COVID-19患者血清存在的情况下,单独阻断CD32可以恢复用IFNα培养的pmcs中IFITM3的诱导。gydF4y2Ba4 d, egydF4y2Ba).先前的研究表明,Fcγ受体IIb的阻断(Fcγ riib;也被称为CD32B)阻断导致树突状细胞和单核细胞的干扰素样反应gydF4y2Ba16gydF4y2Ba而激活Fc受体Fcγ riia (CD32A)的结合则引发病毒免疫gydF4y2Ba17gydF4y2Ba.与之前的研究一致,我们发现阻断FCγRIIb,而非FCγRIIa,可以挽救重症COVID-19患者血清培养的单核细胞中IFITM3的诱导(扩展数据图)。gydF4y2Ba10克gydF4y2Ba).gydF4y2Ba
总之,我们的研究结果表明,在严重COVID-19患者中,抑制表达isg的免疫细胞群体的表型与他们的抗体通过FCγRIIb信号拮抗IFNAR信号相对应。在我们的队列中,这种一般抗体介导的作用几乎体现在所有严重疾病患者中,而对抗细胞因子IFNα本身的抗体仅在七分之一的患者中看到,这些抗体阻断了ISG功能,但不通过Fc受体(图2)。gydF4y2Ba4gydF4y2Ba).在特异性方面,值得注意的是,最近的研究强调,COVID-19患者的自身抗体与磷脂等多种靶标结合gydF4y2Ba18gydF4y2Ba还有内皮蛋白gydF4y2Ba19gydF4y2Ba但并不是所有患者都出现了每种特异性。我们的工作同样发现,抗体与各种免疫细胞结合,在某些感染过程中,B细胞室的不完全耐受性可能包括对许多宿主蛋白质的识别,包括免疫细胞上的蛋白质。尽管研究COVID-19中抗体特异性的可能多样性很重要,但抗体的集中修饰(它改变了抗体对Fc受体亚型的选择性)和IgG亚型的差异选择性也正在成为COVID-19严重程度的显著特征gydF4y2Ba20.gydF4y2Ba.我们推测,血清中这些IgG亚类的不同水平,加上不同Fc受体的不同亲和力,可能导致通过抑制Fc γ riib产生更强的信号。需要进一步的工作来描述这些IgG亚类的相对贡献及其特异性。无论如何,我们的研究表明,在严重COVID-19患者中,这种全球性的ISG原型靶向可能可以通过利妥昔单抗等药物来减少B细胞反应gydF4y2Ba21gydF4y2Ba-可能在恢复期个体血清存在的情况下,通过静脉注射IgG (IVIG)与血清抗体竞争Fc受体接合gydF4y2Ba22gydF4y2Ba,或快速发展临床上阻断FCγRIIb的抗体。gydF4y2Ba
方法gydF4y2Ba
数据报告gydF4y2Ba
没有使用统计方法来预先确定样本量。实验不是随机的,研究人员在实验和结果评估期间没有对分配盲目。gydF4y2Ba
患者、参与者、严重程度评分和临床数据收集gydF4y2Ba
加州大学医院收治的已知或推定患有COVID-19的患者在住院3天内接受了筛查。患者或指定的代理人提供了参与研究的知情同意。本研究包括2020年4月8日至5月1日在COMET (COVID-19有效治疗的多免疫分型项目;gydF4y2Bahttps://www.comet-study.org/gydF4y2Ba)就读于加州大学旧金山分校(UCSF)。COMET是一项前瞻性研究,旨在描述住院患者特定免疫评估与COVID-19临床病程之间的关系。健康捐赠者(对照组)为成年人,既往无COVID-19诊断或近期无与COVID-19一致的症状。该分析包括直接、通过代孕或按照区域伦理研究委员会和《赫尔辛基宣言》批准的方案提供知情同意的参与者的样本。对于住院患者,临床数据从电子病历中提取为标准化的病例报告表格。我们在取样时和住院结束时都使用了严重程度评分(扩展数据图)。gydF4y2Ba1gydF4y2Ba).在这两种情况下,严重程度评估基于三个主要参数:护理水平、机械通气需求和机械通气时间。轻、中度疾病患者是指住院期间不需要机械通气且ICU住院时间不超过1天的标准病房或重症监护病房患者。重症患者是指需要重症监护和机械通气(一般5天或以上)的患者。因此,我们的验证队列由21例COVID-19患者组成(11例轻-中度和10例重度);11例临床表现相似但未感染COVID-19的患者(6例轻-中度,5例重度);和14个健康的对照组。我们还收集并使用了由14名SARS-CoV-2阳性患者组成的验证队列的血清。收集样本,评估严重程度,如前所述的初始队列。该发现队列由8例轻中度COVID-19患者和6例重度COVID-19患者组成。 Information on age, sex, type of infection, day of onset, viral load and complete blood cell count is listed in Supplementary Table1克ydF4y2Ba.该研究由UCSF机构审查委员会批准:IRB 20-30497。gydF4y2Ba
血液细胞的分离和scRNA-seq处理gydF4y2Ba
对新鲜全血进行scRNA-seq以保存粒细胞。简而言之,外周血采集到EDTA管(BD, 366643)。全血经500 μl的外周血经RBC裂解缓冲液(Roche, 11-814-389-001)处理后制成。然后对细胞进行计数,每个个体直接将15,000个细胞装入Chromium Controller中,按照制造商的说明将单个细胞划分为纳升级别的凝胶乳剂珠(GEMs)。在GEM划分之前,一些样本被聚集在一起(每个样本15,000个细胞)。使用Chromium Single Cell 5’Reagent Kit (v.5.1) (10X Genomics)进行反转录、cDNA扩增和基因表达文库构建(遵循10X Genomics提供的详细方案)。文库在Illumina NovaSeq6000上测序,R1使用28个周期,R2使用98个周期。所有样本均被囊化,抽血后6 h内生成cDNA。gydF4y2Ba
PBMC与患者血清共培养实验及流式细胞仪分析gydF4y2Ba
使用polymorphism prep (Alere Technologies)从健康献血者的edta抗凝全血中分离出pmcs,并重新悬浮在培养基中(RPMI 1640 + 10% FBS)。为了检测干扰素刺激的中和作用,将自体血清或临床研究参与者的血清(10 μl)镀上IFNα (Stemcell IFNα- 2a;终浓度1 pg μlgydF4y2Ba−1gydF4y2Ba),总体积为200 μl,再加入2.5 × 10gydF4y2Ba5gydF4y2BaPBMCs。孵育24 h后,流式细胞术检测pmcs中ifn α诱导的IFITM3的上调以及CD14和CD16的水平和组分。在表面染色和添加固定活/死紫染料(赛默飞世尔科学,L34955)后,按照制造商的说明,使用eBioscience Foxp3/转录因子染色缓冲组(赛默飞世尔科学,00-5523-00)进行细胞内IFITM3检测。Fc受体阻断实验中,Fc受体被未偶联的抗cd16阻断(克隆3G8;生物基因,302002),anti-CD32(克隆FUN-2;bilegend, 303202), anti-CD64(克隆10.1;BioLegend, 305002), anti-CD32A(克隆IV.4;BioXcell)和抗cd32b /C(克隆S18005H;生物传说),每个抗体0.5 μg。IFNα (1 pg μl)孵育24 hgydF4y2Ba−1gydF4y2Ba),流式细胞术检测外周血单核细胞ifn α诱导的IFITM3的上调,CD14和CD16的水平和分数。用于血清染色测定,pmcs用培养基或1-100 pg ml培养gydF4y2Ba−1gydF4y2Ba收集样品,用未偶联的抗cd16阻断Fc受体(克隆3G8;生物基因,302002),anti-CD32(克隆FUN-2;bilegend, 303202)和anti-CD64(克隆10.1;BioLegend, 305002)抗体在冰上放置20分钟。在用荧光激活细胞分选(FACS)缓冲液(2%胎牛血清,1mm EDTA, PBS)洗涤一步后,用未结合的AffiniPure驴抗人IgG (Jackson Immunoresearch;709-005-149)在室温下放置15分钟。用FACS缓冲液洗涤后,将pmcs在冰上进行表面标记染色30分钟。染色孵育后,用FACS缓冲液(1500 rpm, 5 min, 4℃)洗涤细胞3次,用5 μl自体血清或临床研究参与者血清在冰上孵育30 min。用FACS缓冲液清洗细胞后,使用AffiniPure驴抗人IgG-Alexa Fluor 647抗体(Jackson Immunoresearch, 709-605-149)检测细胞结合抗体,该抗体与细胞一起在冰上孵育30分钟。再次清洗细胞,在1 μg ml中重悬gydF4y2Ba−1gydF4y2BaDAPI解决方案的活/死区分。使用以下抗体进行流式细胞分析:抗人CD3-BB700(克隆SK7;BD Biosciences, 566575),抗人CD14-BV711(克隆MSE2;生物传奇,301838),抗人CD15-BV786(克隆W6D3;BD生物科学,741013),抗人CD16-BV605(克隆3G8;bilegend, 302040),抗人CD19-BV785(克隆HIB19;生物基因,302240),抗人CD45-APCeFluor780(克隆HI30;赛默飞世尔科技公司,47-0459-42),抗人类IFITM3-AlexaFluor 647(克隆EPR5242;Abcam ab198573)。gydF4y2Ba
外周血单核细胞fc受体交联实验gydF4y2Ba
平底聚苯乙烯板(96孔)在4°C下涂上10或5 ug ml过夜gydF4y2Ba−1gydF4y2Ba抗cd16的组合(克隆3G8;生物基因,302002),anti-CD32(克隆FUN-2;bilegend, 303202)和anti-CD64(克隆10.1;BioLegend, 305002)在PBS中稀释。在PBMC电镀前,用PBS洗板三次,电镀过程如上所述。每孔总共25万个pmcs被短暂旋转,并在37°C下孵育15分钟,以允许包被抗体接合。然后将IFNα加入孔中,在37℃下孵育24 h,然后按上述方法进行流式细胞术。gydF4y2Ba
统计分析和数据可视化gydF4y2Ba
使用GraphPad Prism或R软件包进行统计分析。使用非参数Mann-Whitney检验来检验两组之间的零假设,以解释数据的非正态分布。同样,多组比较采用双因素方差分析或非参数Kruskal-Wallis检验,再进行多组比较。在每个图形图例中还指出了具体的统计检验及其产生的显著性水平。使用R包Seurat和ggplot2 (v.3.1.0), GraphPad Prism和Adobe Illustrator生成图形。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
报告的数据载于本条款及其相关补充信息中。cell - ranger处理的原始特征条形码矩阵可在基因表达集合(GEO)上获得,并具有登录号gydF4y2BaGSE163668gydF4y2Ba和所有10X库的原始FASTQ文件已保存在序列读取存档(Sequence Read Archive, SRA)中,并带有登录号gydF4y2BaSRP299788gydF4y2Ba.gydF4y2Ba
代码的可用性gydF4y2Ba
用于处理所有数据的脚本,以及每个患者的相关临床信息,可在gydF4y2Bahttps://github.com/UCSF-DSCOLAB/combes_et_al_COVID_2020gydF4y2Ba.gydF4y2Ba
改变历史gydF4y2Ba
2021年8月2日gydF4y2Ba
对本文的更正已发表:gydF4y2Bahttps://doi.org/10.1038/s41586-021-03718-6gydF4y2Ba
参考文献gydF4y2Ba
马修,D.等人。对COVID-19患者的深度免疫分析揭示了具有治疗意义的不同免疫类型。gydF4y2Ba科学gydF4y2Ba369gydF4y2Ba, eabc8511(2020)。gydF4y2Ba
Schulte-Schrepping, J.等人。重症COVID-19的特征是骨髓细胞间隔失调。gydF4y2Ba细胞gydF4y2Ba182gydF4y2Ba, 1419-1440(2020)。gydF4y2Ba
Hadjadj, J.等人。重症COVID-19患者I型干扰素活性受损和炎症反应。gydF4y2Ba科学gydF4y2Ba369gydF4y2Ba, 718-724(2020)。gydF4y2Ba
Zilionis, R.等人。人类和小鼠肺癌的单细胞转录组学揭示了个体和物种间保守的髓系种群。gydF4y2Ba免疫力gydF4y2Ba50gydF4y2Ba, 1317-1334(2019)。gydF4y2Ba
黄,i.c.等。ifitm介导的丝状病毒、SARS冠状病毒和A型流感病毒限制的独特模式。gydF4y2Ba公共科学图书馆PathoggydF4y2Ba.gydF4y2Ba7gydF4y2Ba, e1001258(2011)。gydF4y2Ba
雷耶斯等人。细菌性败血症的免疫细胞特征gydF4y2Ba地中海Nat。gydF4y2Ba.gydF4y2Ba26gydF4y2Ba, 333-340(2020)。gydF4y2Ba
Davizon-Castillo, P., Rowley, J. W. & Rondina, m.t.巨核细胞和血小板转录组学在人类健康和疾病中的发现。gydF4y2BaArterioscler。Thromb。Vasc。医学杂志gydF4y2Ba.gydF4y2Ba40gydF4y2Ba, 1432-1440(2020)。gydF4y2Ba
梅森,K. D.等。程序性无核细胞死亡限制血小板寿命。gydF4y2Ba细胞gydF4y2Ba128gydF4y2Ba, 1173-1186(2007)。gydF4y2Ba
Bongiovanni, D.等人。网状血小板的转录组分析揭示了血栓形成前的特征。gydF4y2BaThromb。HaemostgydF4y2Ba.gydF4y2Ba119gydF4y2Ba, 1795-1806(2019)。gydF4y2Ba
陈,W. S.等。揭示单细胞癌症标本的变异轴。gydF4y2BaNat方法。gydF4y2Ba17gydF4y2Ba, 302-310(2020)。gydF4y2Ba
Pujadas, E.等人。SARS-CoV-2病毒载量预测COVID-19死亡率。gydF4y2Ba和出版的《柳叶刀》杂志上。地中海gydF4y2Ba.gydF4y2Ba8gydF4y2Ba, e70(2020)。gydF4y2Ba
Hue, S.等。COVID-19急性呼吸窘迫综合征患者先天性免疫反应失控和适应性免疫反应受损。gydF4y2Ba点。j .和。暴击。保健医疗gydF4y2Ba.gydF4y2Ba202gydF4y2Ba, 1509-1519(2020)。gydF4y2Ba
王毅,等。病毒载量和抗体反应与COVID-19严重程度的动力学gydF4y2Baj .中国。投资gydF4y2Ba.gydF4y2Ba130gydF4y2Ba, 5235-5244(2020)。gydF4y2Ba
混蛋,p等人。威胁生命的COVID-19患者的I型干扰素自身抗体。gydF4y2Ba科学gydF4y2Ba370gydF4y2Ba, eabd4585(2020)。gydF4y2Ba
Michalska, A., Blaszczyk, K., Wesoly, J. & Bluyssen, H. A. R.一种正反馈放大电路,调节干扰素(IFN)刺激的基因表达并控制I型和II型IFN反应。gydF4y2Ba前面。ImmunolgydF4y2Ba.gydF4y2Ba9gydF4y2Ba, 1135(2018)。gydF4y2Ba
Dhodapkar, K. M.等。在人树突状细胞和单核细胞中选择性阻断抑制性Fcγ受体(Fcγ riib)诱导I型干扰素反应程序。gydF4y2BaJ.实验医学gydF4y2Ba.gydF4y2Ba204gydF4y2Ba, 1359-1369(2007)。gydF4y2Ba
Bournazos, S., Corti, D., Virgin, H. W. & Ravetch, J. V. fc优化抗体诱导CD8免疫病毒呼吸道感染。gydF4y2Ba自然gydF4y2Ba588gydF4y2Ba, 485-490(2020)。gydF4y2Ba
左杨,等。COVID-19住院患者血清中的血栓前自身抗体。gydF4y2Ba科学。Transl。地中海gydF4y2Ba.gydF4y2Ba12gydF4y2Ba, eabd3876(2020)。gydF4y2Ba
coniglio, C. R.等人,COVID-19儿童多系统炎症综合征的免疫学研究。gydF4y2Ba细胞gydF4y2Ba183gydF4y2Ba, 968-981(2020)。gydF4y2Ba
Chakraborty, S.等人。重症COVID-19患者促炎IgG Fc结构gydF4y2BaNat。ImmunolgydF4y2Ba.gydF4y2Ba22gydF4y2Ba, 67-73(2021)。gydF4y2Ba
黄,H., Benoist, C. & Mathis, D.利妥昔单抗在炎症性关节炎小鼠模型中特异性地消耗短暂的自反应浆细胞。gydF4y2Ba国家科学院学报美国gydF4y2Ba107gydF4y2Ba, 4658-4663(2010)。gydF4y2Ba
John Looney, R. & Huggins, J.使用静脉注射免疫球蛋白G (IVIG)。gydF4y2BaPract最好。中国>,HaematolgydF4y2Ba.gydF4y2Ba19gydF4y2Ba, 3-25(2006)。gydF4y2Ba
同时,A.-C。et al。单细胞RNA-seq揭示了新型的人类血液树突状细胞、单核细胞和祖细胞。gydF4y2Ba科学gydF4y2Ba356gydF4y2Ba, eaah4573(2017)。gydF4y2Ba
Argüello, R. J.等。SCENITH:一种基于流式细胞术的方法,以单细胞分辨率功能分析能量代谢。gydF4y2Ba细胞金属底座gydF4y2Ba.gydF4y2Ba32gydF4y2Ba, 1063-1075(2020)。gydF4y2Ba
确认gydF4y2Ba
我们感谢Krummel实验室和ImmunoX的所有成员在开展这项研究时的讨论和指导,我们感谢G. Andreoletti在计算分析方面的讨论和指导。这项工作得到了UCSF免疫x计划和NIH的资金支持(R01 AI52116-S1 (M.F.K.) 3U19AI077439-13S1 (D.J.E.)和NHLBI R35 HL140026 (C.C.))。K.H.H.由美国癌症协会博士后奖学金(133078-PF-19-222-01-LIB)支持。A.R.是癌症研究所欧文顿博士后研究员,由癌症研究所支持(奖励编号CRI2940)。该项目部分得益于陈-扎克伯格基金会2019-202665号的资助。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
财团gydF4y2Ba
贡献gydF4y2Ba
a.j.c., t.c., n.f.k., k.h.h., a.r., a.a.r., w.s.c., n.w.c., S.J.C.和M.F.K.进行并监督实验,生成和分析数据,并通过提供图表和表格对手稿做出贡献。a.j.c., t.c., n.f.k., k.h.h., a.r., A.A.R.和M.F.K.可以完全访问研究中的所有数据,并对数据的完整性和分析的准确性负责。a.j.c., t.c., n.f.k., k.h.h., a.r., A.A.R.和W.S.C.对数据进行了计算分析。A.J.C t.c., K.H.H,风险投资者,N.W.C, D.K, G.C.R,其子as, j.t. K.J.H.-G。, P.M.-S。,W.S.Z., D.S.L. and Y.S. were part of the early-morning COVID-19 processing team who performed the whole-blood single-cell sequencing. The UCSF COMET Consortium included all other scientists involved in the generation of data included in this study. C.L. provided data on viral loads obtained from nasal swabs of patients with COVID-19. C.J.Y., M.R.L. and S.J.C. provided blood from healthy donors and helped with PBMC preparation. N.K.S., K.W.I., R.Y., M. Magnen, L.R., A.L., C.R.Z. and R.P.L. performed assays of SARS-CoV-2 infection and serum antibodies and cytokines. M.R.W. and M. Matthay oversaw studies of serum cytokines and antibodies from the COVID-19 patient cohort and provided intellectual input. P.G.W., D.J.E., G.K.F., C.C., C.L., C.H., K.K and M.F.K. are leadership members of the COMET study and were actively involved in the establishment of the pipeline and patient consent and the direction of projects. P.G.W., C.C., C.M.H., A.W. and S.C. actively participated in the enrolment of patient and control cohorts. A.J.C., T.C., N.F.K., K.H.H., A.R., A.A.R., W.S.C. and M.F.K. wrote the manuscript. A.J.C., A.A.R. and M.F.K. supervised the project. All authors edited and critically revised the manuscript for important intellectual content and gave final approval for the version to be published.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
额外的信息gydF4y2Ba
同行评审信息gydF4y2Ba自然gydF4y2Ba感谢Petter Brodin, Eric Meffre和其他匿名审稿人对这项工作的同行评审所做的贡献。同行评审报告是可用的。gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
扩展的数据图形和表格gydF4y2Ba
图1使用全血scRNA-seq对入院时出现呼吸道症状的患者进行免疫分型。gydF4y2Ba
一个gydF4y2Ba,患者症状图:采样当天(入院第一天)的症状为黑色;整个住院期间的症状显示为绿色。在文章的其余部分,我们根据整个住院期间(绿色)将患者分为轻、中度和重度。gydF4y2BabgydF4y2Ba,在批量校正前(左)和后(中),使用全局对象UMAP中的邻居多样性评分量化批量效应,以及中性粒细胞UMAP图(右),如图所示。gydF4y2Ba1 b, cgydF4y2Ba,采用邻域分集法。gydF4y2BacgydF4y2Ba,图中全球居群表达的标志性基因的点图表示。gydF4y2Ba1 bgydF4y2Ba.MPC,单核吞噬细胞。gydF4y2BadgydF4y2Ba,疾病严重程度与人群频率之间的Spearman相关性比较,通过10X scRNA-seq分析(10X)或全血细胞计数计算。无法获得完整血细胞计数的患者被排除在外。采用Spearman方法计算显著性。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001 (gydF4y2BangydF4y2Ba= 29)。gydF4y2BaegydF4y2Ba,图中全球种群的频率。gydF4y2Ba1 bgydF4y2Ba根据SARS-CoV-2状态(对照,gydF4y2BangydF4y2Ba= 14;SARS-CoV-negative,gydF4y2BangydF4y2Ba= 11;SARS-CoV-positve,gydF4y2BangydF4y2Ba= 21)。gydF4y2Ba
图2重症COVID-19患者中性粒细胞缺乏干扰素反应。gydF4y2Ba
一个gydF4y2Ba,中性粒细胞亚群之间的顶部deg点图。gydF4y2BabgydF4y2Ba,健康对照组中性粒细胞中中性粒细胞亚群的频率(gydF4y2BangydF4y2Ba= 14), SARS-CoV-2阴性患者(gydF4y2BangydF4y2Ba= 11)和SARS-CoV-2阳性患者(gydF4y2BangydF4y2Ba= 21。gydF4y2BacgydF4y2Ba, LCN2的频率,S100A12, RIBO。,NEAT1, G0S2 and SLPI neutrophils among all neutrophils, by SARS-CoV-2 status and disease severity (SARS-CoV-2-negative M/M,ngydF4y2Ba= 6;SARS-CoV-2-negative严重,gydF4y2BangydF4y2Ba= 5;SARS-CoV-2-positive M / M,gydF4y2BangydF4y2Ba= 11, sars - cov -2阳性严重,gydF4y2BangydF4y2Ba= 10)。gydF4y2BadgydF4y2Ba,中性粒细胞亚群伪时间轨迹。gydF4y2BaegydF4y2Ba,健康对照个体中所有中性粒细胞中中性粒细胞亚群在伪时间轨迹后期阶段的频率(gydF4y2BangydF4y2Ba= 14),轻中度疾病患者(gydF4y2BangydF4y2Ba= 17)和重症患者(gydF4y2BangydF4y2Ba= 15)。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba,健康对照个体中中性粒细胞亚群的频率(gydF4y2BangydF4y2Ba= 14),轻中度疾病患者(gydF4y2BangydF4y2Ba= 17)和重症患者(gydF4y2BangydF4y2Ba= 15)在轨迹的整体开始或后期状态(gydF4y2BafgydF4y2Ba)或在伪时间的特定早期阶段(gydF4y2BaggydF4y2Ba).gydF4y2BahgydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba,显示deg的火山图(gydF4y2BahgydF4y2Ba,gydF4y2BajgydF4y2Ba)和显示基因本体(GO)术语富集的条形图(gydF4y2Ba我gydF4y2Ba,gydF4y2BakgydF4y2Ba)在来自SARS-CoV-2阳性患者和SARS-CoV-2阴性患者的所有中性粒细胞中(gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba),或轻、中度疾病患者与严重疾病患者(gydF4y2BajgydF4y2Ba,gydF4y2BakgydF4y2Ba).gydF4y2BalgydF4y2Ba- - - - - -gydF4y2BapgydF4y2Ba, isg签名分数(gydF4y2BalgydF4y2Ba- - - - - -gydF4y2BangydF4y2Ba)和中性粒细胞脱粒(gydF4y2BaogydF4y2Ba,gydF4y2BapgydF4y2Ba)在健康对照组、轻-中度疾病患者和严重疾病患者(gydF4y2BaogydF4y2Ba);根据SARS-CoV-2状态和疾病严重程度(gydF4y2BalgydF4y2Ba,gydF4y2BapgydF4y2Ba);或在所有患者的不同严重程度的特定中性粒细胞亚型(gydF4y2Ba米gydF4y2Ba)或仅对SARS-CoV-2呈阴性的患者(gydF4y2BangydF4y2Ba).采用双因素方差分析和多重比较评估统计学意义(gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba)或双尾Wilcoxon检验(gydF4y2BalgydF4y2Ba).*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001, ****gydF4y2BaPgydF4y2Ba< 0.0001。箱形图:中线,中位数;盒子限制,第25和75百分位;胡须,最小值和最大值。gydF4y2Ba
扩展数据图3我们队列中外周血单核吞噬细胞亚群的特征。gydF4y2Ba
一个gydF4y2Ba,在血单个核吞噬细胞亚群中识别的簇之间的顶部deg的点图表示。gydF4y2BabgydF4y2Ba,从整个数据集中分离出的19,289个单核吞噬细胞的UMAP可视化(左),并按SARS-CoV-2状态分割(右)。gydF4y2BacgydF4y2Ba,在UMAP图的单个核吞噬细胞对象中,使用邻居多样性评分定量批量校正前后的批量效应gydF4y2BabgydF4y2Ba,采用邻域分集法。gydF4y2BadgydF4y2Ba,从单个核吞噬细胞数据集中鉴定的每个簇的单细胞测序中检测到的独特基因数量(底部)和独特分子数量(顶部)的小提琴图。gydF4y2BaegydF4y2Ba先前描述的来自健康个体的血液单核吞噬细胞特征的叠加gydF4y2Ba23gydF4y2Ba在单核吞噬细胞上的UMAP图gydF4y2BabgydF4y2Ba.gydF4y2BafgydF4y2Ba,之前发现的由血液单核吞噬细胞表达的典型基因的小提琴图,用于在单核吞噬细胞数据集中识别的每个簇。gydF4y2Ba
重症COVID-19的定义是多种细胞类型之间缺乏一致的干扰素反应。gydF4y2Ba
一个gydF4y2Ba,健康对照组中所有单核吞噬细胞中单核吞噬细胞亚群的频率(gydF4y2BangydF4y2Ba= 14), SARS-CoV-2阴性患者(gydF4y2BangydF4y2Ba= 11)和SARS-CoV-2阳性患者(gydF4y2BangydF4y2Ba= 21)。gydF4y2BabgydF4y2Ba, 19,289个单核吞噬细胞的UMAP可视化显示(左),按疾病严重程度分裂(右)。gydF4y2BacgydF4y2Ba、经典单核细胞、循环单核细胞、非经典单核细胞和C1Q的频率gydF4y2Ba+gydF4y2BaSARS-CoV-2阴性患者中所有单核吞噬细胞中的非经典单核细胞(M/M,gydF4y2BangydF4y2Ba= 6;严重,gydF4y2BangydF4y2Ba= 5)和SARS-CoV-2阳性患者(M/M,gydF4y2BangydF4y2Ba= 11;严重,gydF4y2BangydF4y2Ba= 10),按疾病严重程度划分。gydF4y2BadgydF4y2Ba,前面描述的叠加gydF4y2Ba24gydF4y2Ba扩展数据图中单个核吞噬细胞的糖酵解和氧化磷酸化基因标记。gydF4y2Ba3 bgydF4y2Ba.gydF4y2BaegydF4y2Ba,火山图显示轻中度疾病患者(右)和重症患者(左)所有单核吞噬细胞差异基因表达分析结果。gydF4y2BafgydF4y2Ba,所有SARS-CoV-2阴性患者中所有中性粒细胞和单核细胞亚型的频率之间使用Spearman秩相关的相关矩阵(gydF4y2BangydF4y2Ba= 11)和所有SARS-CoV-2阳性患者(gydF4y2BangydF4y2Ba= 21)。gydF4y2BaggydF4y2Ba,中性粒细胞与CD4之间的散点图gydF4y2Ba+gydF4y2BaT细胞ISGgydF4y2Ba+gydF4y2Ba在指定的患者组(M/M,gydF4y2BangydF4y2Ba= 11;严重,gydF4y2BangydF4y2Ba= 10;SARS-CoV-2-negative,gydF4y2BangydF4y2Ba= 11)。采用双因素方差分析和多重比较评估统计学意义。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001, ****gydF4y2BaPgydF4y2Ba< 0.0001。箱形图:中线,中位数;盒子限制,第25和75百分位;胡须,最小值和最大值。gydF4y2Ba
图5我们队列中外周血T和B淋巴细胞亚群的特征。gydF4y2Ba
一个gydF4y2Ba,在T细胞子集和NK细胞子集中识别的簇之间的顶部deg点图。gydF4y2BabgydF4y2BaUMAP显示了从整个数据集中分离出来的16,708个T和NK细胞,显示了不同的亚群,并根据其身份进行了着色。gydF4y2BacgydF4y2Ba, UMAP的覆盖gydF4y2BabgydF4y2Ba所有T和NK细胞,以疾病严重程度着色,强调在合并所有患者的数据集时缺乏批量效应。gydF4y2BadgydF4y2Ba, ISG的丰度gydF4y2Ba+gydF4y2Ba在健康对照组的所有T细胞和NK细胞中(gydF4y2BangydF4y2Ba= 13), SARS-CoV-2阴性患者(gydF4y2BangydF4y2Ba= 9)和SARS-CoV-2阳性患者(gydF4y2BangydF4y2Ba= 15)(上);在健康对照组中,轻度-中度疾病患者(gydF4y2BangydF4y2Ba= 14)和重症患者(gydF4y2BangydF4y2Ba= 9)(下)。gydF4y2BaegydF4y2Ba在健康对照组、SARS-CoV-2阴性患者和SARS-CoV-2阳性患者中,ISG-signature评分。gydF4y2BafgydF4y2Ba,在B和浆细胞亚群中识别的簇之间的顶部deg点图。gydF4y2BaggydF4y2BaUMAP可视化显示了从整个数据集中分离出来的4380个B细胞和浆细胞,显示了不同的亚群,并根据其身份进行了着色。gydF4y2BahgydF4y2Ba,之前发现的由B细胞和浆细胞表达的典型基因的小提琴图。gydF4y2Ba我gydF4y2Ba,健康对照个体中所有B细胞和浆细胞中已识别的群集频率(gydF4y2BangydF4y2Ba= 14)和轻-中度疾病患者(gydF4y2BangydF4y2Ba= 17)和重症患者(gydF4y2BangydF4y2Ba= 15)。采用Kruskal-Wallis检验(gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba)或多重比较的双向方差分析(gydF4y2Ba我gydF4y2Ba).*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001, ****gydF4y2BaPgydF4y2Ba< 0.0001, NS,不显著。箱形图:中线,中位数;盒子限制,第25和75百分位;胡须,最小值和最大值。gydF4y2Ba
扩展数据图6我们队列中外周血血小板亚群的特征。gydF4y2Ba
一个gydF4y2Ba,在血小板子集中识别的聚类之间的顶部deg点图。gydF4y2BabgydF4y2BaUMAP显示了从整个数据集中分离出来的16,903个血小板,显示了不同的子集,并根据其身份进行了着色。gydF4y2BacgydF4y2Ba,健康对照个体中所有血小板中已识别的聚类的频率(gydF4y2BangydF4y2Ba= 14)以及所有轻中度疾病患者(gydF4y2BangydF4y2Ba= 17)和严重疾病(gydF4y2BangydF4y2Ba= 15)。gydF4y2BadgydF4y2Ba,所有血小板染色的UMAP可视化gydF4y2BaBCL2L1gydF4y2Ba(上)和小提琴情节gydF4y2BaBCL2L1gydF4y2Ba所有确定的血小板亚群的表达水平。gydF4y2BaegydF4y2Ba,小提琴的基因图识别年轻,网状血小板gydF4y2Ba9gydF4y2Ba在血小板数据集中。gydF4y2BafgydF4y2Ba,所有血小板UMAP可视化,伪时间轨迹叠加。gydF4y2BaggydF4y2Ba中每个血小板细胞亚群的相对假时间的小提琴图gydF4y2Ba一个gydF4y2Ba.gydF4y2BahgydF4y2Ba,所有血小板相对假时间的小提琴图,按疾病严重程度分割。gydF4y2Ba我gydF4y2Ba,所有血小板UMAP可视化,以ISG评分着色。采用双因素方差分析和多重比较评估统计学意义。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001, ****gydF4y2BaPgydF4y2Ba< 0.0001, NS,不显著。箱形图:中线,中位数;盒子限制,第25和75百分位;胡须,最小值和最大值。gydF4y2Ba
图7利用scRNA-seq评估COVID-19患者的血小板聚集量并确定免疫状态。gydF4y2Ba
一个gydF4y2Ba,“血小板优先”评估大纲,以识别整个全血scRNA-seq数据集中的血小板聚集物。52,757个假定的血小板聚集物的UMAP可视化与特定人群重叠。在本研究中,没有应用双重去除过滤步骤来包括所有异型细胞-细胞聚集物(步骤1)。接下来是保留所有具有多个血小板特异性转录物PF4或PPBP的细胞(步骤2)。步骤2保证了包含血小板的细胞事件和聚集物的分析。与图中的原始数据集一样。gydF4y2Ba1 bgydF4y2Ba,使用Harmony完成数据集成(步骤3),然后使用Seurat v.3管道分析“血小板优先”对象(步骤4)。gydF4y2BabgydF4y2Ba,在“血小板优先”对象中识别的集群之间的顶部deg的点图表示。gydF4y2BacgydF4y2Ba,在“血小板优先”对象中识别的群集中线粒体和核糖体基因百分比的小提琴图。gydF4y2BadgydF4y2Ba,样本间的双态率推断涉及血小板的异型双态表明,血小板聚集发生在体内。双,紧身上衣,gydF4y2BangydF4y2Ba= 5个库。合成天然气、单线态gydF4y2BangydF4y2Ba= 5个库。gydF4y2BaegydF4y2Ba,底部为整个队列合并对象内细胞型频率的散点图,如图所示。gydF4y2Ba1 bgydF4y2Ba(gydF4y2BaxgydF4y2Ba轴)与“血小板优先”对象内相同的细胞类型频率(gydF4y2BaygydF4y2Ba轴)。身份线gydF4y2BaxgydF4y2Ba=gydF4y2BaygydF4y2Ba是作为参考绘制的。每个点代表来自健康对照个体的样本(gydF4y2BangydF4y2Ba= 14)或SARS-CoV-2阳性患者的样本,圆点按疾病严重程度(M/M,gydF4y2BangydF4y2Ba= 11;严重,gydF4y2BangydF4y2Ba= 10)。皮尔森的gydF4y2BargydF4y2Ba相关系数和双尾gydF4y2BaPgydF4y2Ba值为每个单元格类型显示。上面是gydF4y2BaygydF4y2Ba/gydF4y2BaxgydF4y2Ba每个健康对照或患者样本的比例,按疾病严重程度分开。gydF4y2BafgydF4y2Ba,细胞分数直方图表示给定组中所有患者每种免疫细胞亚型的相对频率(即细胞分数)的bin平均值,颜色如图所示。gydF4y2Ba2 fgydF4y2Ba.统计意义gydF4y2BaegydF4y2Ba是用片面的学生gydF4y2BatgydF4y2Ba以及(gydF4y2BadgydF4y2Ba)或多重比较的双向方差分析(gydF4y2BaegydF4y2Ba).*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001, ****gydF4y2BaPgydF4y2Ba< 0.0001, NS,不显著。箱形图:中线,中位数;盒子限制,第25和75百分位;胡须,最小值和最大值。gydF4y2Ba
图8结合scRNA-seq、临床血计数和血浆细胞因子水平对COVID-19患者外周血谱进行整体评估。gydF4y2Ba
一个gydF4y2Ba,所有亚型频率之间的斯皮尔曼相关系数矩阵(在主要细胞类型之外;例如,ISGgydF4y2Ba+gydF4y2Ba从scRNA-seq中获得的中性粒细胞)与患者元数据、病毒载量、抗体滴度和血清分析物水平(不包括健康对照个体)的对比。在每次比较中,数据不可用的患者被排除在相关分析之外。两个轴上的变量通过分层聚类排序,计算出的树状图显示子类型频率。这个树状图被分为六组,其中一组包含ISGgydF4y2Ba+gydF4y2Ba用棕色突出显示的子类型。通常与严重程度相关的临床变量用红色突出显示;那些通常与严重程度反相关的用棕色突出显示(gydF4y2BangydF4y2Ba相关性比较范围从gydF4y2BangydF4y2Ba= 14-32人)。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.005, ***gydF4y2BaPgydF4y2Ba< 0.0005。gydF4y2BabgydF4y2Ba,散点图显示SARS-CoV-2阳性患者队列中病毒载量与结合SARS-CoV-2核衣壳蛋白的抗体水平,严重程度重叠。抗体水平显示为Luminex实验中MFI的任意单位;病毒载量用倒数表示gydF4y2BaCgydF4y2BatgydF4y2BaqRT-PCR扩增SARS-CoV-2核衣壳序列。采用Spearman方法计算相关系数和显著性。无法获得数据的患者被排除在外(M/M,gydF4y2BangydF4y2Ba= 9;严重,gydF4y2BangydF4y2Ba= 7例)。gydF4y2BacgydF4y2Ba,所有亚型频率之间的斯皮尔曼相关系数矩阵(在主要细胞类型之外;例如,ISGgydF4y2Ba+gydF4y2Ba从scRNA-seq中获得的中性粒细胞(占所有中性粒细胞的百分比)与血浆中蛋白质分析物丰度(使用Olink法在逐个患者的基础上测量,不包括健康对照个体)。在每次比较中,数据不可用的患者被排除在相关分析之外。两个轴上的变量通过层次聚类进行排序。研究小组gydF4y2Ba+gydF4y2Ba与频率密切相关的亚型和蛋白质用棕色突出显示;与ISG强反相关的亚型和蛋白gydF4y2Ba+gydF4y2Ba子类型以红色突出显示(gydF4y2BangydF4y2Ba所有比较= 31)。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.005, ***gydF4y2BaPgydF4y2Ba< 0.0005。gydF4y2BadgydF4y2Ba,通过ELISA吸光度读数计算患者血清中总IgG水平。(gydF4y2BangydF4y2Ba对照组、中度和重度分别为4、19和16)。gydF4y2BaegydF4y2Ba,研究入组后,纵向测量患者血清中抗尖刺抗体和抗核衣壳抗体水平。连接点代表单个个体的跟踪。(gydF4y2BangydF4y2BaMM/severe在第0、4、7、14、21和27天分别为11/8、7/8、6/7、3/7、1/5和0/3)。gydF4y2BafgydF4y2BaELISA检测患者血清中的循环免疫复合物(CICs)水平,C1Q用于捕获CICs和抗人IgG二抗。水平表示为每毫升热聚集人丙种球蛋白当量(eq/ml) (gydF4y2BangydF4y2Ba对照组= 3,重度= 11,重度= 9)。采用双侧Wilcoxon检验评估统计学意义。箱形图:中线,中位数;盒子限制,第25和75百分位;胡须,最小值和最大值。gydF4y2Ba
图9使用COVID-19患者血清对干扰素刺激的健康pbmc进行染色和中和试验。gydF4y2Ba
一个gydF4y2Ba,等高线图和CD14直方图gydF4y2Ba+gydF4y2Ba健康献血者血液中的单核细胞经IFNα培养诱导ISGs表达,并与健康献血者或轻、中、重度COVID-19患者血清染色,抗人IgG二次染色。gydF4y2BabgydF4y2Ba,血清CD14染色的几何MFIgydF4y2Ba+gydF4y2Ba单核细胞经IFNα处理,定量数据gydF4y2Ba一个gydF4y2Ba(控制,gydF4y2BangydF4y2Ba= 4;M / M,gydF4y2BangydF4y2Ba= 9;严重,gydF4y2BangydF4y2Ba= 7).中心线,中位数;盒子限制,第25和75百分位;胡须,最小值和最大值。gydF4y2BacgydF4y2Ba血清染色实验汇总表。在非刺激和ifn α刺激的健康pmcs中,抗人IgG-AlexaFluor647几何MFI相对于异体健康供体血清的倍增变化被列出为每种分析的细胞类型。表格数据单元格根据折叠变化的程度进行颜色编码;绿色,折变> 2;黄色,2 >折变> 1.2;红色,折叠变化< 1.2。gydF4y2BadgydF4y2Ba, pbmc的门控策略,以识别不同的亚种群。gydF4y2BaegydF4y2Ba轻度-中度(橙色)和重度(红色)COVID-19患者血清对中间型CD14单核细胞向经典型CD14单核细胞转变的调节。每个图代表一个血清样本。代表性实验来自三个独立的试验和两个不同的健康PBMC捐赠者。gydF4y2BafgydF4y2Ba, IFITM3通过CD3表达gydF4y2Ba+gydF4y2BaCD19gydF4y2Ba+gydF4y2Ba健康捐赠者的淋巴细胞,用IFNα和健康捐赠者(蓝色)或轻-中度(橙色)或重度(红色)COVID-19患者的血清培养。轻度-中度(淡黄色)和重度(粉红色)血清在与pbmc孵育前用蛋白A/G预处理。每个图代表一个血清样本。代表性实验来自两个独立的试验和两个不同的健康PBMC捐赠者。为gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba,显示了两个代表性实验之一的数据。NS,非重要。gydF4y2Ba
图10重症COVID-19患者中存在的抗体通过FCγRIIb拮抗IFNAR信号。gydF4y2Ba
一个gydF4y2Ba,轻、中、重度COVID-19患者血清ISG中和检测见图。gydF4y2Ba3 egydF4y2Ba这里使用了来自验证队列患者的血清。gydF4y2BabgydF4y2Ba,在存在抗cd16、抗cd64和抗cd32抗体阻断Fc受体的情况下,用轻中度或重度疾病患者的血清检测ISG中和情况,如图所示。gydF4y2Ba4gydF4y2Ba这里使用了来自验证队列患者的血清。gydF4y2BacgydF4y2Ba, qPCR分析gydF4y2BaIFI27gydF4y2Ba,gydF4y2BaISG15gydF4y2Ba而且gydF4y2Bamx₁gydF4y2Ba用IFNα治疗的健康供体外周血单核细胞中基因的表达,并加入轻度-中度或重度疾病患者的血清,有或没有Fc受体阻断(图2)。gydF4y2Ba4gydF4y2Ba).折叠变化相对于未治疗的健康供体pbmc。gydF4y2BangydF4y2Ba每组3个。数据为均数±s.e.m。gydF4y2BadgydF4y2Ba, CD14绝对计数gydF4y2Ba+gydF4y2Ba图中所示的实验单核细胞。gydF4y2Ba4gydF4y2Ba(gydF4y2BangydF4y2Ba=每组16人)。gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba、单核细胞CD14和IFITM3表达等高线图和直方图(gydF4y2BaegydF4y2Ba)和Luminex定量上清液中IL-6和IL-8 (gydF4y2BafgydF4y2Ba)图中所示的实验。gydF4y2Ba4 b, cgydF4y2Ba.gydF4y2BaggydF4y2Ba, IFITM3百分比变化的FoldgydF4y2Ba+gydF4y2BaCD14gydF4y2Ba+gydF4y2BaIFNα刺激后的单核细胞,归一化至未处理细胞(在两个不同的PBMC供体上进行一次实验;gydF4y2BangydF4y2Ba=每组8个)。统计意义gydF4y2BacgydF4y2Ba,gydF4y2BaggydF4y2Ba采用双向方差分析和多重比较进行评估。*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01, ***gydF4y2BaPgydF4y2Ba< 0.001, ****gydF4y2BaPgydF4y2Ba< 0.0001, NS,不显著。箱形图:中线,中位数;盒子限制,第25和75百分位;胡须,最小值和最大值。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
库姆斯,a.j.,库劳,T,库恩,N.F.gydF4y2Baet al。gydF4y2Ba重症COVID-19患者保护性免疫状态的全球缺失和靶向。gydF4y2Ba自然gydF4y2Ba591gydF4y2Ba, 124-130(2021)。https://doi.org/10.1038/s41586-021-03234-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41586-021-03234-7gydF4y2Ba
进一步的阅读gydF4y2Ba
转录组数据的综合分析揭示了COVID-19疾病中的血小板反应gydF4y2Ba
科学报告gydF4y2Ba(2022)gydF4y2Ba
儿童SARS-CoV-2感染的免疫学研究gydF4y2Ba
自然免疫学gydF4y2Ba(2022)gydF4y2Ba
COVID-19的免疫干预:时间问题?gydF4y2Ba
粘膜免疫gydF4y2Ba(2022)gydF4y2Ba
sars - cov -2-宿主相互作用的可执行网络预测药物联合治疗gydF4y2Ba
数字医学gydF4y2Ba(2022)gydF4y2Ba
SARS-CoV-2感染的单细胞免疫gydF4y2Ba
自然生物技术gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba