摘要
在发达国家,胰腺癌(PC)是癌症相关死亡的主要原因,由于大多数患者在诊断时已患有不治之症,因此开发一种早期发现的筛查方法是当务之急。由于其代谢的重要性,胰腺功能的改变可能会影响肠道菌群的组成,可能产生PC的生物标志物。然而,如果这些生物标记物针对的是疾病的晚期,可能涉及胆道阻塞或糖尿病等共病,那么它们的作用可能是有限的。在这项研究中,我们分析了30名胰腺癌患者、6名癌前病变患者、13名健康受试者和16名非酒精性脂肪肝患者的粪便微生物群,使用细菌16S rRNA基因扩增子测序。PC和对照组有14种细菌特征,其中一些与最近中国队列研究的发现相同。基于菌群的随机森林模型对PC样品和对照样品进行分类,AUC为82.5%。然而,研究对象间的变异性很高,只有一小部分pc相关的微生物信号在癌前胰腺病变患者中也被观察到,这意味着基于微生物的这种病变的早期检测将具有挑战性。
简介
胰腺癌(PC)在美国和欧盟分别是癌症相关死亡的第4和第5大原因1,2.与由于筛查和早期发现而降低结肠癌发病率相比,PC年龄标准化率一直保持稳定,这表明只有通过开发新的治疗方法或通过预防和早期发现才能提高预期寿命3..据估计,胰腺癌的发展超过十年4,5在美国,早期干预的机会确实存在。
目前预防和早期发现PC的主要途径是依靠先进的胰腺影像学来发现癌前病变6,7.由于这种方法难以在大范围的人群中进行筛选,人们投入了大量的精力来识别体液中的分子、蛋白质组或代谢组特征8,这可能是早期PC的生物标志物。
开发癌前标志物的另一种策略是确定驻留在人体的微生物种群的变化,通常称为“微生物群”。Farrel等.9与健康对照组相比,首次证明了PC患者口腔微生物组的变化;然而,最佳病例特异性为82.1%,这种微生物特征虽然令人印象深刻,但不足以诊断罕见发病率疾病,如PC。虽然口腔微生物群可能只与胰腺功能间接相关,但肠道微生物群直接受胰腺分泌物的影响,从根本上影响消化和代谢。因此,即使是胰腺组织的微小变化也可能引起肠道代谢物浓度的变化,这极有可能被肠道微生物群落所感知。由于在半自动化的平台上,粪便样本可以很容易地对肠道微生物群进行分析,这种方法因其简单而吸引人,最近由任提出等.10该研究比较了PC患者的粪便微生物群和来自中国的匹配对照。然而,尽管pc相关的粪便微生物特征被清楚地证明了,但与Farrel所显示的口腔特征相比,其特异性和敏感性并没有真正的提高。
总的来说,这些数据表明,虽然pc相关的微生物特征很容易观察到,但它们转化为预测性生物标志物并不简单。人体肠道微生物群在不同的研究对象之间有很大的差异,并受环境的强烈影响11.因此,虽然在统计上具有显著意义的微生物特征的特定患者群体是明显的,但其诊断目的的实际价值将取决于几个额外的因素。首先,这种模式应该是稳健的,能够将感兴趣的条件与其他广泛的条件区分开来,而不仅仅是与健康的对照受试者。在这方面,应该记住的是,PC患者经常表现出共病,从肥胖、糖尿病和胰腺炎,被认为是疾病的危险因素,到胆道阻塞,这是该疾病的常见后果。其次,该模式必须在具有特定临床条件的所有患者中合理一致。在这里,我们必须仔细研究个体之间的差异在同一批人,还有之间的研究队列——因为来源和地理位置,以及个人饮食和生活方式习惯,都会影响微生物群。最后,这种模式在疾病早期阶段应该是明显的;在PC的情况下,在进展为不可治愈的癌症之前,在癌前病变患者中应该有一个理想的生物标志物。
在这项研究中,我们在以色列队列中检测了PC的肠道微生物组变化及其作为生物标志物的潜力。我们将PC患者的微生物组与癌前病变组(PCL)进行比较,PCL是由非酒精性脂肪肝(NAFLD)患者和健康对照组组成的一组。我们还将微生物组组成与一系列临床背景条件,以及胆道阻塞和肝损伤的血清生化标记相关联。最后,我们评估了我们队列内以及以色列和中国队列之间的微生物变异。
材料和方法
主题
有胰腺癌(n = 30)或癌前病变(n = 6)的患者在Rambam卫生保健校园或Meir医疗中心的外科病房或胃肠科诊所就诊。通过EUS获得的组织学标本或术后病理评估证实诊断。癌前病变(PCL)按标准临床标准定义为伴有主胰管或侧支管扩张的囊性病变;PCL组包括4例低级别导管内乳头状黏液性肿瘤(IPMN)、1例多灶性IPMN和1例胰腺上皮内瘤变(panIN)。对照受试者(n = 13)从Rambam卫生保健校园的健康志愿者和在Meir医疗中心接受结肠镜筛查的个体中招募;年龄在50岁以下的人被排除在分析之外。另一组对照组来自Kaplan医学中心(n = 16)的非酒精性脂肪性肝病(NAFLD,超声诊断,男性丙氨酸氨基转移酶(ALT)水平≥30 U/L,女性≥19 U/L)患者。在采样前8周内接触抗生素、既往有癌症、胰腺炎、急性或慢性肠道炎症史或携带已知癌症相关突变的个体被排除在分析之外。本研究获得了Rambam医疗园区和Meir医疗中心伦理委员会的批准(研究批准号:0345-12-RMB),所有试验均按照相关指南和法规进行。本研究的每位参与者都提供了书面知情同意书。
样品处理和DNA测序
PC、PCL和NAFLD患者的样本在诊断后和任何治疗前尽快收集,并保存在−80°C的医疗设施中。接受结肠镜检查的健康受试者的样本在两周内被收集,并冰冻运输到医疗设施,在那里它们像上面一样储存。样品在干冰上被运送到研究设施。粪便样本在获得后储存在医学研究所,温度为- 80°C。根据HMP(人类微生物组项目)指南,使用PowerSoil™DNA提取试剂盒(MOBIO)提取DNA。如前所述,16S rRNA基因用通用原核引物进行PCR扩增,引物包含5端共同序列12(CS1-341F 5 ' - acacgacatggttctacannnncctacgggaggcagcag和CS2-806R 5 ' -TACGGTAGCAGAGACTTGGTCTGGACTACHVGGGTWTCTAAT)。24个PCR周期(95°C 15秒。,53. °C sec. 15, 72 °C 15 sec) were conducted using the PCR mastermix KAPA2G Fast™ (KAPABiosystems); successful amplification was verified by agarose gel electrophoresis. Paired-end deep sequencing of the PCR products was performed on an Illumina MiSeq platform at the University of Illinois at Chicago Sequencing Core (UICSQC). Sequencing depth ranged from 1070 to 31118 sequences per sample; to ensure data evenness, data was initially rarefied to 3 optional sequences depths: 1070 (retaining all study samples), 3000 (discarding 3 samples), and 9000 (discarding 4 samples). Similar microbial patterns were observed across all three optional depths. Data was thus rarefied to 1070 seqs/sample, so as to retain all samples.
数据分析
对解复用的原始序列进行质量过滤(去除PHRED质量评分< 20的碱基)、长度过滤(丢弃小于380 bp的序列)并使用PEAR进行合并13.然后,数据处理与定制工作流结合定量洞察微生物生态学(QIIME)包14和VSEARCH15,并且根据UPARSE管道中描述的策略16.简而言之,将扩增引物移除,并使用QIIME脚本将数据转换为单个FASTA文件。使用VSEARCH在99%的身份下进行重复和OTU提取;为了减少虚假OTU的形成,只有出现超过5次(100%相似度)的序列才被允许形成新的OTU。嵌合OTUs,由UCHIME识别17使用黄金。Fa数据库作为参考,被删除。将剩下的(非嵌合)OTU的质心序列作为数据库,将所有序列(包括单例)与此数据库进行映射,形成OTU计数表。分类分配(使用UCLUST算法18)、稀疏度和UniFrac计算使用QIIME完成。微生物生态学中常用的几种相似度指标(Bray-Curtis、Jaccard、丰度加权和非加权UniFrac指数)用于计算每对样品之间的距离;PC菌群与所有对照样品的分离程度用ANOISM概率检验进行评估。与Ren的数据集成等.10利用OTU级别的分类信息进行了研究。简单地说,我们首先使用RDP分类器(Ren中使用的方法)为我们研究中定义的otu重新分配分类法等.研究10.在每一项研究中,我们将分配给单一实体的相同分类法的OTU分解,保存丰度信息,并在每项研究中实现包含唯一分类法分类的OTU丰度表。然后将两个表转换为相对丰度(通过总和归一化,TSS),最后按类群名称合并到一个单独的RA表,用于如下所述的分析。
统计分析
R素食19软件包计算Shannon多样性指数、Bray-Curtis/Jaccard距离矩阵和ANOSIM概率检验。使用基R函数cmdscale构建PCoAs,并用ggplot2绘制20.包中。利用hclust R函数和UPGMA方法对每个距离矩阵进行样本的层次聚类,R包进行扩展21是用来绘图的。的randomForest22和pROC23软件包用于建立分类模型和绘制ROC曲线。Kruskal-wallis统计检验、Spearman相关和Benjamini-Hochberg24多假设检验的修正均采用R基函数;包dunn.test25使用邓恩检验比较多组之间的值。p值< 0.05或q值< 0.2被认为显著。LEfSe26应用该细菌类群对两组间的差异进行了鉴别;第1步(Kruskal-Wallis)的p值设为0.05,LDA最小阈值设为3。
结果
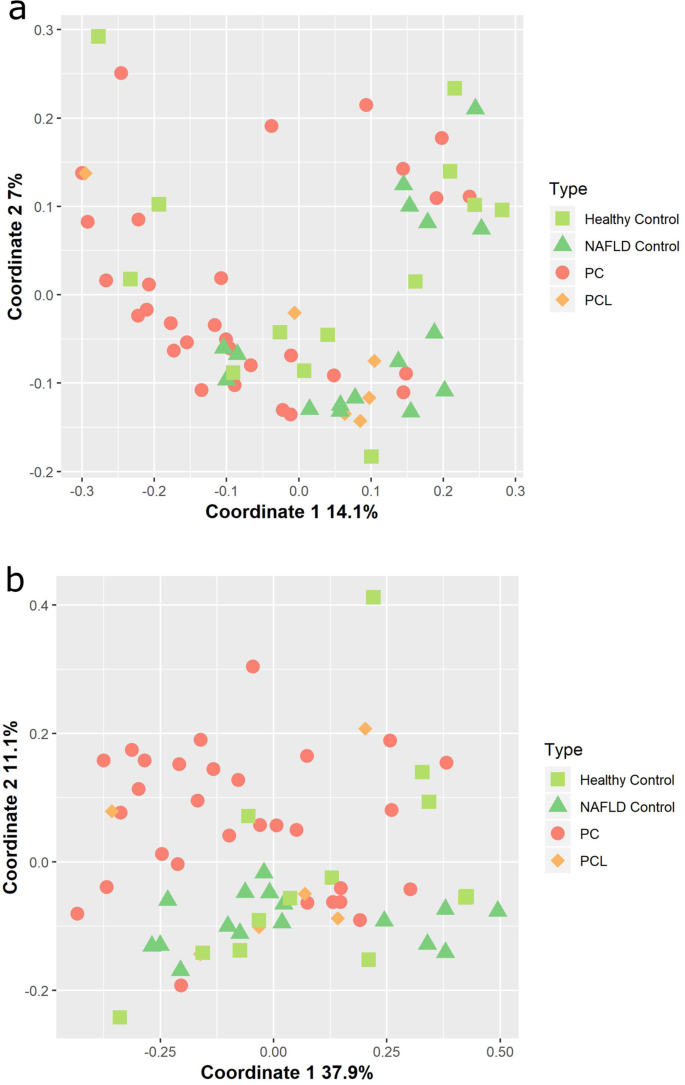
这项研究的队列由30名PC患者和两个对照组组成:一个是健康受试者(n = 13),另一个是非酒精性脂肪性肝病(NAFLD)患者,n = 16。由于肠道微生物群可能对肝功能高度敏感,而肝功能在晚期PC中往往受损,因此,没有胰腺疾病的NAFLD患者被用作额外的严格对照组。另外6例患者被诊断为癌前胰腺病变(PCL)。患者信息汇总见表1;有关癌症分期的其他资料,如有,载于补充表S1.细菌16S rRNA基因的深度扩增子测序用于评估与每组相关的微生物种群的特定特征;显示所有四个类群详细分类组成的条形图见补充图。S1.PC组、PCL组与健康对照组间alpha多样性差异无统计学意义(Shannon值中位数:PC = 2.89, PCL = 3.04, control = 3.1)。然而,NAFLD组的多样性略高于其他所有组(p = 0.01, Shannon中位数= 3.3,补充图。S2).
PC患者与对照组的微生物群存在较大差异
PC患者是一个异质性的群体,除了PC带来的并发症,通常还患有一系列的背景疾病,如糖尿病(表2)1).因此,PC患者样本的微生物组成是高度可变的。然而,与对照组(NAFLD或健康组)相比,PC患者的微生物组有一些普遍的变化是明显的。拟杆菌门和厚壁菌门这两种人类肠道中占主导地位的细菌门在PC患者中的比例高于任何对照组。S2).此外,在将PC组与健康对照组进行ANOSIM概率检验(丰度加权UniFrac: p = 0.013, R = 15%;unweighted-UniFrac: p = 0.04, R = 13%)。应用原理坐标分析(PCoA)对所有患者组的这一趋势进行可视化表示(图1)。1).值得注意的是,虽然健康组和NAFLD对照组的PC样本有明显的分离,但这些组之间也有大量的重叠。这种重叠,与相对较低的ANOSIM R值一致,意味着在确定肠道微生物组成方面有其他因素的参与;下面将详细讨论这个问题。PCL组人数太少,无法纳入统计学显著性检验,似乎与PC组和对照组重叠(图1)。1;参见补充图中样本的分层聚类。S3).
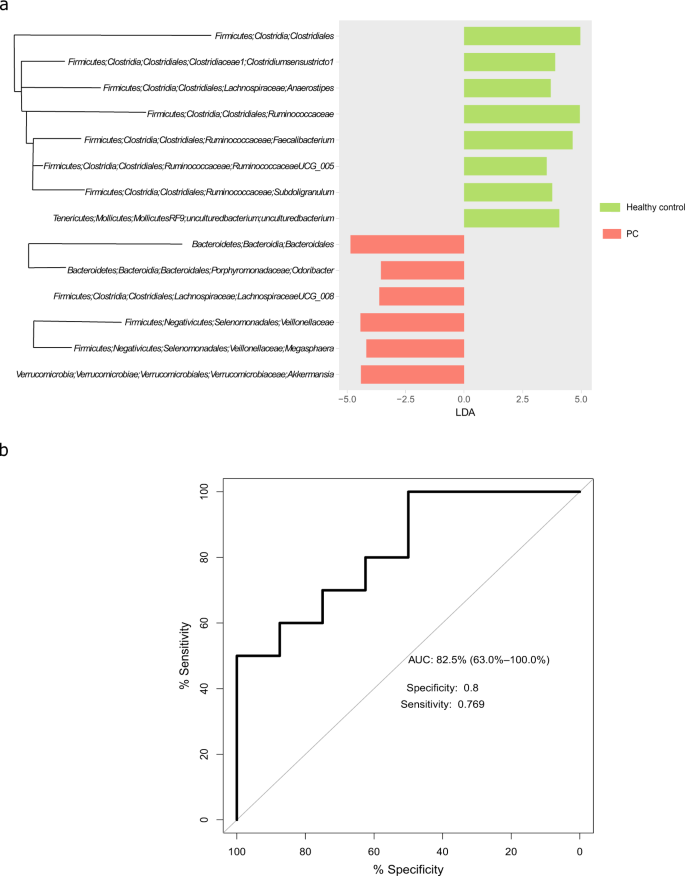
与PC相关的特定微生物模式
已经完善的特征分析工具LEfSe[线性判别分析(LDA)效应量]26,用于识别PC患者与健康对照组之间差异分布的特征(图。2).在大多数系统发育水平上,区分PC与健康对照的特征是明显的。在PC组中观察到属于厚壁菌门的细菌目、科和属的显著不足,从而证实了在门水平上观察到的PC患者中厚壁菌门/拟杆菌门比率下降的趋势。
PC组与NAFLD组的比较得出了类似的结果,与NAFLD组相比,PC组中厚壁菌门的类群出现了多次减少(补充图。S4).然而,拟杆菌门的类群往往在NAFLD和PC中都有较高的发病率,并没有区分这两个类群。
采用随机森林算法,根据PC与健康对照的特征构建分类模型,并通过LEfSe进行识别。由于该算法的性能随着样本量的增加而大大提高,因此我们使用了健康组、NAFLD组和PC组的所有样本进行分析(n = 59),本次将NAFLD组和健康组均定义为“对照组”。随机选取70% (n = 41)的样本用于训练分类器,其余18个样本用于验证(图5)。2 b).尽管对照组具有异质性,但验证集的AUC值为82.5% (CI: 63.6%-100%),特异性为0.8,敏感性为0.77。
影响微生物组的其他临床因素
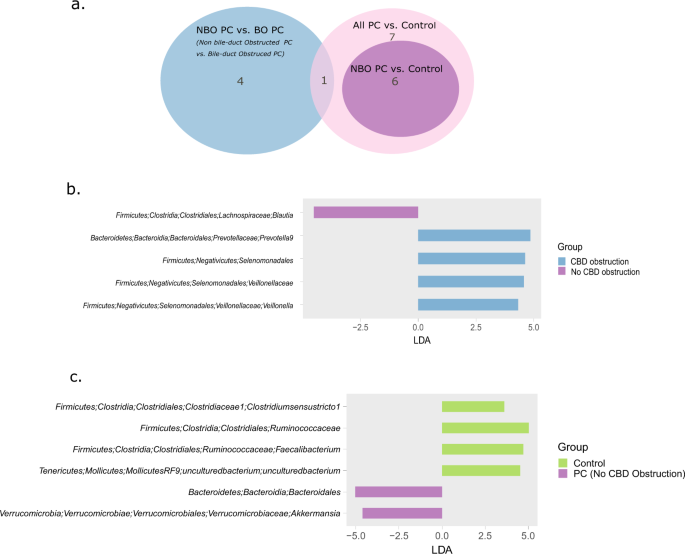
由于在PC患者中经常发现的一些背景条件之前已被证明会影响微生物组,我们继续研究PC相关的微生物模式是否依赖于其他临床因素。首先,我们使用ANOSIM概率检验来检验胆管阻塞、糖尿病、高脂血症、高血压和胆囊异常这五个临床变量对PC患者微生物组的影响。见补充表S2(p = 0.03, R = 13%,布雷-柯蒂斯距离指数;对于测试的其他临床因素,p值范围从0.2到0.8)。为了推断胆管阻塞是否是影响PC菌群的主要因素,我们重复了Control vs. PC ANOSIM显著性检验,仅使用无胆管阻塞的PC患者的样本(n = 16)。对照组和非梗阻PC之间的分离仍显著,但较弱(ANOSIM p = 0.01, R = 13%,布雷-柯蒂斯指数)。
然后使用LEfSe生物标志物发现工具来确定胆管阻塞(BO, n = 11)与非胆管阻塞(NBO, n = 16) PC之间的差异,以及健康对照(n = 13)与NBO PC之间的差异。然后,这两个标记分类群的子集可以与从所有PC(包括BO和NBO PC)中区分健康对照的整个分类群进行比较。2).值得注意的是,pc相关分类群和胆道阻塞相关分类群之间很少有重叠。3).只有1个分类单元,即细孔菌科(Veillonellaceae)被发现与胆道梗阻和PC均相关;然而,这个科的不同属与每个条件相关:属韦永氏球菌属与胆道梗阻相关(图。3 b),而属Megasphaera与PC有关。相反,区分无阻塞PC与对照的类群集合再现了所有PC与对照的大部分微生物特征(图。3 a, c).
额外的微生物组变化可能是PC的次要后果
胆管梗阻通常导致血清胆红素水平升高(胆红素梗阻患者直接胆红素水平:0.13 mg/dl, sd: 0.08;梗阻患者:2.6 mg/dl,中位数:2.5;Kruskal-Wallis p = 0.004),我们还检查了细菌属与血清胆红素水平之间的相关性(补充表)S3).有趣的是,几乎所有(16/17)最强的相关性都是负的,而且主要涉及的属梭菌属的顺序(斯皮尔曼的R =−0.5,p = 0.009为最强相关性)。唯一的积极的发现细菌与胆红素之间存在相关性Prevotella9,与我们在章节中确定的胆道阻塞相关的属相同”。影响微生物组的其他临床因素(Spearman 's R =−0.36,p = 0.065)。然而,经过多重假设检验的p值校正(最佳q值0.23,FDR24).当将该属与GGT酶血清水平(胆道阻塞的另一种通常较早的标记物)相关联时,得到了类似的概况,但在统计上更可靠2).
由于胰腺癌和胆管阻塞通常也与肝酶水平升高有关,我们继续将微生物组成与血清肝酶水平联系起来,作为肝功能受损的标志。本队列中PC患者均可使用AST和ALT。由于我们发现这两种标记物具有很强的相互相关性(Pearson 's R = 0.9, p = 5.4E-11),并且由于我们在两种测定中观察到相似的微生物/酶水平相关性,因此只显示了与ALT的相关性(表3.).
肝损伤标志物与微生物组的相关性与观察到的胆道阻塞标志物与微生物组的相关性相似。微生物类群的相对丰度和肝酶血清水平之间所有最强的关联都是负相关的3.),唯一的例外普氏菌9.由于细菌的组成是基于相对丰度,一个分类单元的大量增加可能被错误地解释为其他分类单元的减少。为了解释这种可能性,我们在删除后重复相关分析普氏菌9从数据和重新计算所有其他类群的相对丰度,在没有它。这一过程对相关性分析结果几乎没有影响(显著相关类群的Rho值变化小于5%)。综上所述,这些数据表明pc相关的肝脏损伤破坏了正常的肠道平衡,导致多种正常肠道细菌减少。
非酒精性脂肪肝患者队列(n = 16)也可进行肝脏检测和胆红素水平,从而分析独立于PC状态的微生物组/功能标志物相互作用。需要注意的是,对于脂肪肝患者,所有5个生化指标的患者间变异都远低于PC患者(补充表)S4).话虽如此,我们仍然观察到与胆道阻塞标志物(胆红素和GGT)相关的微生物组,但与PC患者的性质不同。具体来说,只有一个分类单元与GGT相关(Lachnoclostridium, R =−0.764,p = 0.001, q = 0.077)。一些类群与胆红素相关(表4);但是,在PC患者中,我们观察到梭状芽胞杆菌属的多个阴性减少,而在脂肪肝患者中仅为属Dialister的,Selemondales顺序,与胆红素呈负相关。相反,我们在脂肪肝组中观察到三种阳性的微生物/胆红素相关性,但没有一种普氏菌9.脂肪肝患者组与AST或ALT均无相关性。
Intra-cohort变异
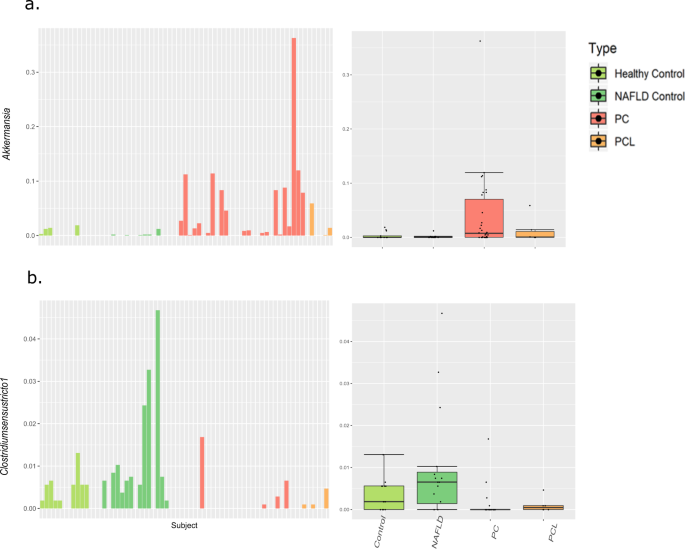
为了探索与PC相关的微生物模式可能的诊断价值,我们重点研究了在LEfSe分析中已确定的10个细菌属,与健康对照相比,这些细菌属在PC中要么代表性不足,要么代表性过高(见“与PC相关的特定微生物模式”,无花果。2).我们在更广泛的背景下仔细检查了这些潜在的生物标志物属,比较了它们在多个受试者组中的丰度模式——NAFLD受试者组(n = 16),癌前胰腺病变组(PCL, n = 6),以及我们的原始PC组和健康对照组。从这个角度来看,与健康组和脂肪肝对照组相比,PC和PCL有前途的生物标志物应该显示出类似的趋势。为了解决一致性问题,我们还检查了在我们的队列中每个受试者中这些歧视属的相对丰度(关于PC、PCL、NAFLD和健康组的汇总箱图,以及每个PC鉴别属的各受试者柱状图,见补充图。S5).
在大多数情况下,我们检查的属在NAFLD对照组中显示出与健康对照组相同的趋势。例外的是Megasphaera而且Lachnospiraceae UCG_008两者在NAFLD和PC中均有过代表。然而,大多数潜在的生物标志物属在PCL组和PC组中没有表现出类似的趋势。此外,所有的歧视分类在个体之间、在所有的研究对象组中都是高度可变的。这些趋势如图所示。4,以两个区别属为例:Akkermansia,在我们的数据集中与PC相关(图。4);而且狭义梭状芽孢杆菌1在我们的数据集中,与健康受试者相关(图。4 b).
Inter-cohort比较
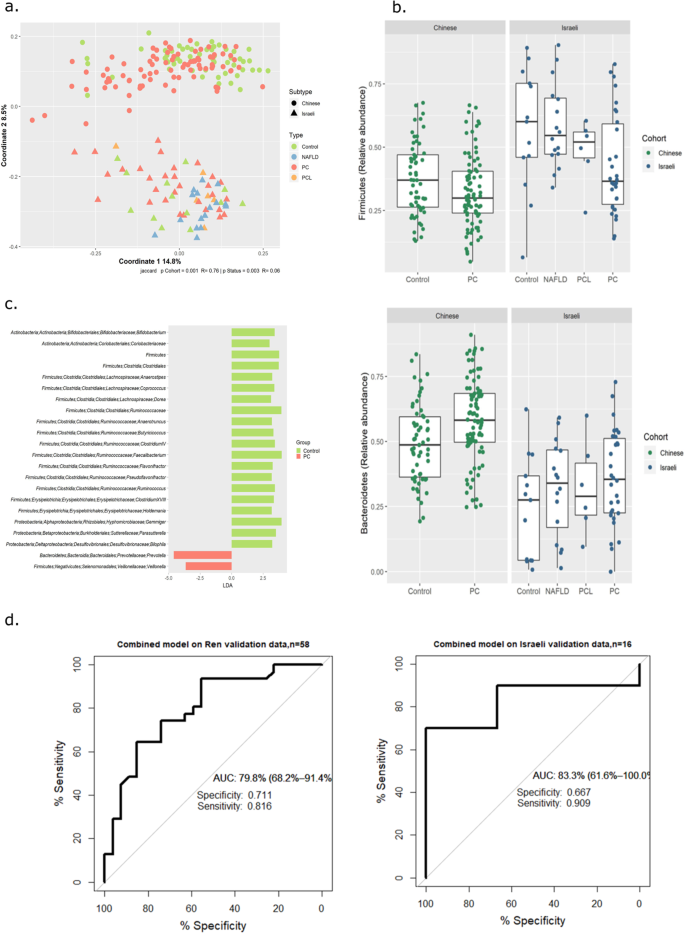
这些结果在一定程度上与任教授最近发表的研究结果相呼应等.10在一项比较PC患者和对照组的中国队列的类似研究中。两个队列在门水平上表现出相似的趋势,PC患者拟杆菌门(Bacteroidetes)增加,厚壁菌门(Firmicutes)减少。这种相似性在某种程度上延伸到了更精细的分类层次;厌氧菌属和属Erysipelotrichaeceae而且Clostridiaceae而属属于Veillonellaceae在两组人群中,个人电脑的发病率都有所上升。
为了更详细地探索队列间的相似性和差异性,我们将我们的数据与Ren研究中公开提供的数据合并(方法部分),形成一个统一的数据集进行分析。值得注意的是,样品来源(以色列或中国)对样品组成的影响最大。5).这种影响部分是由两个队列中较少常见的肠道分类群的不同表现所驱动的(39个分类群是中国队列所独有的,63个是以色列队列所独有的);在整个中国队列中,与以色列队列相比,拟杆菌门类群丰度大幅增加,厚壁菌门类群丰度降低(p < e−6).由于后一个特征,当用我们的数据训练的随机森林分类器应用到中文数据时,所有的中文样本(PC而且对照组)归为PC。尽管如此,在在每个队列中,都清晰地观察到类似的pc相关模式(图。5 b).一个建立在集成数据集上的随机森林分类器(首先使用LEfSe为该数据集识别最相关的特征,如图2所示)。5度)能够对以色列和中国样本进行分类,特异性分别为0.66和0.71,敏感性分别为0.9和0.81(图5)。5 d).这些值虽然没有单独从每个数据集获得的值高,但比随机数据集的值好得多,并且支持这样一种观点,即在两个独立的人类群体中,个人电脑特异性生物失调是明显的。
在两个队列的综合分析中,起源和疾病影响都很明显。数据来自一个中国群体10与我们的数据集整合形成一个合并数据集进行分析。(一个) Jaccard距离矩阵的PCoA。(b)跨队列和类型的关键门箱图。(c) LEfSe分析在集成数据集中识别疾病区分类群。(d)基于(c)中识别的特征构建的随机森林模型的ROC。在箱线图中,直线表示中位数相对丰度,方框表示3理查德·道金斯和1圣分位数,须表示±1.5*IQR,离群点表示为点。
讨论
在过去十年中,微生物组表征分子方法的进步刺激了探索人类肠道微生物组组成的研究的扩展。总的来说,这些研究表明肠道微生物群是一个复杂的环境,受许多遗传和环境因素的影响11,27,28.虽然个体之间的微生物群差异很大,但大多数这种差异都属于所谓的“健康肠道微生物群”的范围。微生物失调,或对这种平衡的偏离,已被描述为多种疾病,其中包括糖尿病29、肝硬化30.以及炎症性肠病31.
在这项研究中,我们在一个以色列队列中发现了一个独特的pc相关肠道微生物组特征,主要表现为在健康肠道中流行的几个细菌科中代表性不足Clostridiacea,Lachnospiraceae,Ruminococcaceae;和过度表现Veillonellaceae,Akkermansia而且Odoribacter.这一特征与常见的PC共病不同,后者也影响微生物组,如胆管阻塞和肝损伤。
我们队列中与pc相关的一些微生物特征与之前在中国队列中进行的研究相似10.当整合这两个数据集进行联合分析时,我们发现以色列和中国队列之间的微生物组成有广泛的差异。这些差异可能不仅是由饮食和民族出身造成的,也与研究方法的差异有关;特别是不同的DNA提取方法。然而,在这两个队列中存在相似的趋势表明,许多与pc相关的微生物模式是高度稳健的。
微生物组研究的一个有前途的方面是利用微生物模式开发基于细菌“生物标记物”的诊断工具的可能性。然而,将与疾病相关的微生物特征转化为有效的诊断生物标志物并不简单,必须解决潜在的混淆问题,如不同来源的队列之间以及每个队列中的个体之间的内在变异性。在我们的综合队列分析中,我们发现来源的强烈影响说明了特定的分类器应该针对特定的患者群体进行训练。然而,即使在“最好的”情况下,我们的微生物分类器的特异性在0.7到0.8之间;任志强也报告了类似的价值等.对于像PC这样的低发病率疾病(优势比约为1:2000),这些特异性值将转化为每一个真实诊断约4000个假阳性。LDA确定的健壮的疾病相关特征的存在和这些相同特征的有限分类能力之间的差异,可能源于个体间微生物特征的高变异性。
由于晚期PC几乎不可能治疗,PC生物标志物的一个重要标准是在非常早期的阶段识别疾病。本研究的一个主要局限性是PCL组的规模较小,没有提供足够的统计能力。未来的研究招募了更多的癌症前期病变或非常早期PC的受试者,从而可能揭示更多的微生物模式。然而,PC对肠道微生物群的影响可能主要是通过胰腺外分泌分泌对消化系统的改变介导的,因此,随着肿瘤大小的增加,PC对肠道微生物群的影响可能会增加。因此,在试图识别早期PC时,我们在将稳健的微生物模式转化为实际PC分类时遇到的困难可能更大。然而,一种可行的方法可能是将几种微生物特征与其他非侵入性生物标志物结合起来,如血清生物标志物CA19-9(在PC检测中使用有限)或尿路生物标志物目前正在研究中32,以提高准确性。
总结
在本研究中观察到一个独特的pc相关的粪便微生物组特征,类似于此前在中国队列中报道的结果。然而,考虑到PC的低发病率和在队列内和队列之间微生物组的高变异性,利用微生物模式进行诊断可能只有结合额外的生物标记物才可行。
数据可用性
在本研究过程中产生和分析的数据集可根据合理要求从通讯作者处获得。所有序列数据可从ncbi序列读取档案(SRA)中获得,生物项目ID: PRJNA575620。
参考文献
西格尔,R. L.,米勒,K. D.和杰马尔,A.癌症统计,2018年。CA. Cancer J. Clin。687-30(2018)。
Ferlay, J。等.欧洲癌症发病率和死亡率模式:2012年对40个国家的估计。欧元。j .癌症49, 1374 - 403(2013)。
Sakorafas, G. H., Tsiotos, G. G., Korkolis, D. & Smyrniotis, V.胰腺癌发展高危人群:管理选择和手术的作用。Surg.杂志。21e49-58(2012)。
Haeno, H。等.胰腺癌的计算模型揭示了转移动力学,建议最佳的治疗策略。细胞148, 362 - 75(2012)。
Yachida, S。等.远处转移发生在胰腺癌遗传进化的晚期。自然4671114 - 7(2010)。
散发性胰腺癌的前体病变:PanIN, IPMN和MCN。生物医学Res....2014(2014)。
Zamboni, G, Hirabayashi, K, Castelli, P. & Lennon, am .胰腺癌前病变。Pract最好。中国>,杂志。27, 299 - 322(2013)。
周,B。等.胰腺癌的早期检测:我们现在在哪里,我们要去哪里?Int。j .癌症141, 231 - 241(2017)。
法雷尔,J·J。等.口腔菌群的变化与包括胰腺癌在内的胰腺疾病有关。肠道61582 - 8(2012)。
任振华,蒋军,谢宏华,李安,吕宏。中国胰腺癌患者Miseq测序的肠道微生物图谱分析。8, 95176 - 95191(2017)。
Yatsunenko, T。等.跨越年龄和地域的人类肠道微生物组。自然486, 222 - 227(2012)。
Ayeni, f。等.来自尼日利亚巴萨农村和城市居民的婴儿和成人肠道微生物和代谢组。细胞的代表。23, 3056 - 3067(2018)。
张杰、科伯特、弗卢里和Stamatakis等。PEAR:一种快速、准确的Illumina对端reAd合并算法。生物信息学30., 614 - 620(2014)。
Caporaso, j·G。等.QIIME允许对高通量群落测序数据进行分析。Nat方法。7335 - 6(2010)。
Rognes, T., Flouri, T., Nichols, B., Quince, C.和Mahé, F. VSEARCH:宏基因组学的多功能开源工具。PeerJ Prepr。4e2409v1(2016)。
埃德加,R. C. UPARSE:从微生物扩增子读取的高度精确的OTU序列。Nat方法。10, 996 - 998(2013)。
Edgar, R. C. UCHIME2:扩增子测序的改进嵌合体预测(2016)。
搜索和聚类的数量级比BLAST快。生物信息学26, 2460 - 2461(2010)。
Oksanen, J。等.素食:社区生态方案(2019年)。
韦翰,H。等.ggplot2:使用图形语法创建优雅的数据可视化(2019)。
Galili, T. & Jefferis, G. denextend:在R.(2019)中扩展“树状图”功能。
原作利奥·布雷曼,F.,卡特勒,A.,葡萄酒安迪·劳,R. &维纳。,M. randomForest: Breiman and Cutler’s Random Forests for Classification and Regression (2018).
罗宾,X。等.pROC:显示和分析ROC曲线(2019)。
控制错误发现率:多重测试的一种实用而强大的方法。皇家统计学会杂志57, 289 - 300(1995)。
Dinno,邓恩。检验:使用等级和的邓恩多重比较检验(2017)。
Segata, N。等.宏基因组生物标志物的发现和解释。基因组医学杂志。12R60(2011)。
Deschasaux, M。等.描述来自不同种族但地理位置相同的人群的肠道菌群组成2,https://doi.org/10.1038/s41591-018-0160-1.
Turroni, S。等.哈扎族狩猎-采集者的粪便代谢组:宿主-微生物组的综合观点。科学。代表。61 - 9 (2016)。
微生物群和糖尿病:一种不断发展的关系。肠道63, 1513 - 1521(2014)。
Kakiyama G。等.肝硬化患者肠道菌群对粪便胆汁酸谱的调节。j .乙醇。58, 949 - 955(2013)。
摩根,x C。等.炎症性肠病中肠道菌群的功能障碍及其治疗。基因组医学杂志。13R79(2012)。
氡,t . P。等.尿液中三生物标记物的鉴定用于胰腺腺癌的早期检测。中国。癌症Res。21, 3512 - 3521(2015)。
确认
作者要感谢伊利诺伊大学芝加哥测序中心(UICSQC),特别是高级研究专家王卫华(WeiHua Wang)和主任Stefan Green博士,他们为所有序列数据的生成提供了帮助。这项研究得到了由以色列癌症协会提供的Martin A Saginor先生纪念和荣誉奖学金的支持,并得到了以色列科技部的拨款。FK的部分资金来自特拉维夫大学萨克勒医学院的Josefina Maus和Gabriela Cesarman肝脏疾病研究主席。
作者信息
作者和联系
贡献
E.H.和U.G.构思并计划了这项研究。E.H.协调招募PC患者和健康对照者,以及对PC患者及其可用数据的深入临床调查。N.K.和L.R.负责DNA提取、测序准备和数据分析。t.d., i.l., Y.K.和A.S.参与了PC样品的收集。N.R, H.K.和Y.M.招募了NAFLD患者,获得并分析了微生物和临床数据。F.K, e.h., L.R.和U.G.准备了手稿和数据。所有作者审阅了此手稿。
相应的作者
道德声明
相互竞争的利益
作者声明没有竞争利益。
额外的信息
出版商的注意施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的使用范围,您将需要直接从版权所有者那里获得许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.
关于这篇文章
引用这篇文章
Half, E., Keren, N., Reshef, L。et al。胰腺癌患者粪便微生物组特征。Sci代表916801(2019)。https://doi.org/10.1038/s41598-019-53041-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598-019-53041-4
进一步的阅读
乳腺肿瘤改变粪便细菌组,允许肠道细菌易位
BMC癌症(2022)
胰导管腺癌中糖代谢与KRAS突变的相互作用
细胞死亡与疾病(2022)
内镜超声引导细针活检作为研究胰腺导管腺癌肿瘤内微生物群的工具:一项初步研究
科学报告(2022)
口腔微生物群与非裔美国人胰腺癌风险的关系
英国癌症杂志(2022)
在衰老和疾病的背景下,肠道微生物群和细胞衰老之间的相互关系:观点和治疗机会
益生菌和抗菌蛋白(2022)