条文本
摘要
目标导管内乳头状粘液性肿瘤(IPMNs)是一种胰腺囊肿,可发展为侵袭性胰腺癌。肿瘤发生与口腔微生物组改变之间的关联已被报道。本研究旨在研究胰腺囊性肿瘤(PCN)手术患者队列中潜在的囊内胰腺微生物群。
设计在胰腺手术中收集疑似PCN患者的成对囊肿液和血浆(n=105)。通过qPCR、PacBio测序(n=35)和白细胞介素(IL)-1β定量对细菌DNA进行定量和定性评估。这些数据与诊断、病变严重程度、临床和实验室情况相关,包括质子泵抑制剂(PPI)的使用和有创内窥镜检查的历史。
结果与非IPMN的PCNs相比,伴有重度异常增生的IPMN和伴有癌症的IPMN的囊内细菌16S DNA拷贝数和IL-1β蛋白数量显著升高。尽管囊内菌群组成存在较大的人际变异,但细菌网络和线性判别分析效应量分析表明,口腔细菌类群共现和富集,包括梭菌属nucleatum而且Granulicatella adiacens有高度发育不良的IPMN的囊肿液囊内细菌DNA升高与侵入性内窥镜手术相关,但不限于,与PPI和抗生素的使用无关。
结论总的来说,这些发现值得进一步研究口腔细菌在胰腺癌囊性前体中的作用,并对胰腺囊肿的病因病理和治疗具有附加价值。
- 胰腺肿瘤
- 细菌易位
- 炎症
- 胰腺癌手术
- 内镜手术
这是一篇开放获取的文章,根据创作共用署名非商业(CC BY-NC 4.0)许可证发布,该许可证允许其他人以非商业方式分发、混音、改编、在此基础上进行构建,并以不同的条款许可其衍生作品,前提是正确引用原始作品,给予适当的荣誉,任何更改都已注明,并且使用是非商业性的。看到的:http://creativecommons.org/licenses/by-nc/4.0/.
数据来自Altmetric.com
本研究的意义
关于这个问题我们已经知道了什么?
导管内乳头状粘液瘤(IPMN)是一种胰腺囊性肿瘤,表现为不同程度的细胞发育不良直至癌变。
口腔微生物群的改变与胰腺癌发展风险的增加有关。
肿瘤组织中的微生物组可能通过局部免疫调节促进肿瘤发生。
新的发现是什么?
胰腺囊内细菌DNA和白细胞介素-1β升高与IPMN和肿瘤分级的协同作用相关。
胰腺囊肿液微生物组显示口腔细菌共生和富集。
胰腺囊内细菌负荷升高与侵入性内镜手术相关,但不限于此,与使用质子泵抑制剂和抗生素无关。
在可预见的未来,它会对临床实践产生怎样的影响?
囊内细菌DNA检测可能对指导IPMN的治疗有附加价值。
减少胰腺炎症微生物组可能是IPMN患者的潜在治疗策略。
简介
胰腺囊性肿瘤(PCN)在普通人群中越来越多地被发现。它们构成了一个具有临床挑战性的实体,有可能发展为侵袭性癌症。1 2在pcn中,导管内乳头状粘液瘤(IPMN)最为常见。3 - 5IPMNs是上皮起源的胰腺囊肿,其特征是恶性转化,从低级别异常增生(LGD)到高级别异常增生(HGD),并进一步向浸润性癌转变,遵循腺瘤-癌的顺序。5个6IPMN可以作为胰腺癌的早期检测标志物,但由于大多数疑似IPMN为良性病变或低级别瘤变,治疗策略是保守或手术切除胰腺。不幸的是,术前预测PCN类型,特别是IPMN肿瘤分级的准确性仍然不理想,通常只有在手术后才能最终诊断。1 5 7-9
在寻找支持PCN分化诊断的分子标记方面已经取得了很大进展。恶性进展风险较高的患者10 11通常表现出典型的囊肿特征,例如,令人担忧的特征,异常的囊肿液细胞学,血清癌胚抗原水平,炎症细胞因子或KRAS或GRAS基因突变。1这些发现促进了对pcn恶性转化的致癌机制的认识,对疾病管理和癌症预防具有重要意义。
新的发现表明,与正常胰腺相比,癌变胰腺组织的细菌丰度可以增加。12这对临床有影响,因为细菌喜欢梭菌属癌组织中的物种与胰腺癌预后不良相关13瘤内细菌可以代谢抗癌药物吉西他滨,从而降低治疗效果。14使用内镜超声细针抽吸(EUS-FNA)胰腺囊肿液,最近的一项回顾性研究表明,来自PCNs的囊肿液具有独特的微生物群,与囊肿类型、临床或生化参数无关。15然而,EUS-FNA程序通过口腔和食道收集GI标本,造成样本被口腔和肠道菌群污染的风险。
作为EUS-FNA方法的一种替代方法,我们在这里提出了一项基于胰腺切除术时收集的囊肿液和血浆样本的前瞻性研究,以研究胰腺微生物组。共有105例PCN患者接受了胰腺切除术,随后的组织学诊断得到了验证。
方法
道德的考虑
所有研究参与者在样本采集前均给予书面知情同意。
研究总体和样本收集
根据术前诊断,在瑞典斯德哥尔摩卡罗林斯卡大学医院接受手术胰腺切除术的105例疑似胰腺囊性病变的患者,在手术当天收集囊肿液和外周血液活检。临床和实验室数据由临床医生从电子期刊中提取。手术后立即从切除的胰腺中抽取囊肿液,并立即在- 80°C保存,直到进一步处理。空腹静脉血采集K2根据制造商的说明进行EDTA管(BD Vacutainer)和Ficoll Paque PLUS (GE生命科学)密度梯度离心,分离血浆部分,在−80°C冷冻,直到进一步分析。
DNA提取和微生物区系分析
微生物DNA使用ZymoBIOMICS DNA Miniprep试剂盒(zyymo Research, Irvine, California, USA)在生物流柜中从囊肿液和血浆中分离。使用AllPrep DNA/RNA FFPE试剂盒(Qiagen, Sollentuna, Sweden)从福尔马林固定石蜡包埋(FFPE)胰腺组织切片中分离DNA。如前所述,用TaqMan qPCR定量细菌16S DNA基因拷贝数。16通过PacBio单分子实时全长16S rRNA基因测序(GATC Biotech, Konstanz, Germany)评估囊肿液微生物成分和多样性。所有DNA样本在发送到GATC之前都进行了编码,没有可以揭示样本分类的信息。
白细胞介素-1β和脂多糖的定量
采用人白细胞介素(IL)-1β/IL- 1f2 ELISA试剂盒(R&D Systems)定量测定血浆和囊肿液IL-1β水平。采用热基因重组因子C内毒素检测法(Lonza,法轮,瑞典)定量测定囊肿液中的细菌脂多糖(LPS)。
详细的主题描述,组织病理学诊断,分析,微生物分析和统计方法可以在网上找到补充材料.
结果
患者队列概述和基于诊断的组比较
共有105例诊断为PCN的患者接受了胰腺切除术。切除组织标本的最终胰腺诊断为非IPMN囊肿(n=21),包括粘液性囊性肿瘤(MCN)和浆液性囊性肿瘤(SCN), IPMN囊肿(n=57)或IPMN囊肿伴侵袭性癌症(以下简称癌症;n = 27)。根据术前临床和影像学检查结果与术后组织学确诊结果的比较,非IPMN、IPMN和癌症的术前诊断准确率分别为52.4%、94.7%和51.9% (表1).与IPMN和癌症组相比,非IPMN组平均更年轻,女性代表更多。与非ipmn患者相比,癌症患者血清s - ca19 - 9、血红蛋白A1c、白蛋白和胆红素水平也更高。
囊内细菌DNA数量与囊性病变严重程度相关
成对的囊肿液和血浆检测细菌16S基因拷贝数。与非IPMN相比,在IPMN和Cancer的囊肿液中发现的细菌DNA拷贝明显更高(几何均值高10.1倍,p=0.0042),几何均值高11.4倍,p=0.0008,趋势p= 0.0067。同样,细菌dna阳性的囊肿样本比例也逐渐增加(χ2测试,p=0.0033)与囊肿病变严重程度-从非IPMN的33.0%到IPMN的59.6%和癌症的81.5% (图1一个).在比较非IPMN和IPMN时,囊肿液中的炎症标志物IL-1β也有类似的增加(p=0.029),癌症(p=0.0024) (图1 b).囊内细菌DNA含量的升高伴随着囊液中IL-1β水平的升高,Spearman正相关(r=0.51, p<0.0001) (图1 c).这似乎是一种局部而非全身性的影响,因为在所有组的血浆中都发现16S DNA和IL-1β含量非常低(图1 d-f),这与这些组别的低循环C反应蛋白水平一致(表1).此外,与非IPMN相比,IPMN中细菌LPS的数量增加(p=0.049)和Cancer (p=0.013),并与囊肿液样品中的16S DNA (r=0.58, p=0.0004)和IL-1β (r=0.44, p=0.0096)呈正相关(见在线)补充图1).接下来,根据组织病理学评价将IPMN组进一步分为HGD组和LGD组。我们发现,与IPMN LGD相比,IPMN HGD的囊肿液中的16S DNA拷贝量显著增加(几何平均值高17.7倍,p=0.02), IL-1β浓度也显著增加(增加103.2倍,p=0.0032)。图2A, B).同样,这种影响仅在囊肿液中被注意到,而在成对的患者血浆中没有。
在“非IPMN”(n=21)、“IPMN”(n=57)、“IPMN癌症”(n=27)患者以及“非IPMN”(n=10)、“IPMN”(n=15)、“IPMN癌症”(n=7)患者的配对血浆(D, E)中(A)细菌16S DNA和(B) IL-1β的囊内数量。虚线表示检测截止值。每组16S DNA的几何平均值和IL-1β的平均值。(C)囊肿液和(F)血浆中16S DNA与IL-1β含量的Spearman相关性分析,呈非线性拟合曲线(实线)和95%可信区间(虚线)。采用Kruskal-Wallis检验和Dunn 's多重比较检验,*p<0.05, **p<0.01, ***p<0.001,差异有统计学意义。IL,白介素;导管内乳头状粘液性肿瘤;LLD,检测下限;未确定。
分别用TaqMan qPCR和ELISA法测定了' IPMN LGD' (n=45)和' IPMN HGD' (n=14)的(A)总细菌16S DNA中位数和(B) IL-1β在' IPMN LGD' (n=35)和' IPMN HGD' (n=10)囊肿液样品中的分布。组间比较采用Mann-Whitney U检验,*p<0.05, **p<0.01。虚线表示检测截止值。HGD,高度发育不良;IL,白介素;导管内乳头状粘液性肿瘤;LGD,低度发育不良;LLD,检测下限。
成分分析显示PCN微生物群高度多样化
与非IPMN相比,IPMN和癌症中细菌DNA数量增加的发现促使我们研究细菌DNA阳性的囊肿液样品的组成。我们询问了微生物组成是否会因PCN类型和/或疾病进展而有所不同。利用PacBio技术对细菌16S rRNA全长基因进行测序。由于在构建全长16S rRNA基因文库之前和之后应用了DNA数量和质量阈值,来自35例IPMN低级别肾病(n=14)或IPMN高级别肾病(n=8)和癌症(n=14)患者的囊肿液样本进行了微生物组分析。我们发现,在操作分类单位(OTU)水平上,这3个群体在Chao1丰富度、Shannon多样性和倒Simpson指数上均无显著差异(图3 a - c).在门水平上,IPMN的LGD以变形菌门(Proteobacteria)为主,而IPMN的HGD和Cancer则以厚壁菌门(Firmicutes)或变形菌门(Proteobacteria)为主。图3 d).在属水平上,微生物组成的相对丰度表现出个体间的差异,在诊断组之间没有明显的差异(图3 e).

在操作分类单元(OTU)水平上显示每个诊断组的(A) Chao1丰富度(白色)、(B) Shannon熵(浅灰色)和(C)倒辛普森(深灰色)指数的箱形图。柱状图显示每个样品在(D)门水平和(E)属水平上OTUs的相对丰度。HGD,高度发育不良;导管内乳头状粘液性肿瘤;低级别发育不良。
网络分析显示口腔病原体共丰度
我们注意到,即使在同一诊断组内,囊液微生物群落也存在人际差异,这可以通过显示单个样本之间OTU水平的Bray-Curtis差异的聚类热图进行可视化。这种差异与近期抗生素治疗、质子泵抑制剂(PPI)使用和既往侵入性内镜手术等因素无关。图4一).细菌组成不能根据其相应的诊断完全分离样品,尽管总体IPMN HGD似乎突出,如基于OTU相对丰度的主坐标分析(PCoA)图所示,显示前四个维度(图4B, C).的确,相似性分析的非参数分析证实了IPMN HGD的组成不同于其他两组(在999个排列上p=0.002)。
(A)聚类热图显示样本间的Beta多样性,显示每个样本在OTU水平上的Bray-Curtis差异,水平上以诊断组为特征,垂直上以术前1个月以前的内镜手术、PPI使用和抗生素药物为特征。(B) PCoA蜘蛛图显示维度1和2和(C)维度3和4。样本根据最终诊断进行着色(黄色=IPMN低级别肾病,橙色=IPMN高级别肾病,红色=IPMN癌症)。(D)细菌共现和反现在网络中可视化,节点表示细菌种类(按门着色,大小对应平均相对丰度),边表示相互作用(绿色=共现,红色=互斥),由>3种方法支持,q<0.01有统计学意义。HGD,高度发育不良;导管内乳头状粘液性肿瘤;LGD,低度发育不良;PPI,质子泵抑制剂。
使用五种不同的相似或不相似指标进行严格的网络分析,以在物种水平上更深入地了解相关细菌种群。虽然所有样品的微生物组成存在明显差异,但由38个物种组成的网络具有显著的共现性和反现性(支持方法≥4种,q<0.01)。口腔病原体梭菌属nucleatum与其他10个物种共存,包括粘质沙雷氏菌,微小帕维单胞菌,普氏菌melaninogenica,副溶血性嗜血杆菌,心绞痛链球菌,柏氏杆菌sp。HMT322、抗坏血克氏杆菌、腐蚀艾肯氏杆菌、简明弯曲杆菌而且弯曲杆菌showae,其中许多是已知的口服物种。值得注意的是,Granulicatella adiacens与另一种口腔细菌同时发生p . melaninogenica,同时显示互斥与链球菌parasanguinis,无色菌xylosoxidans,绿色空气球菌,奥斯陆莫拉菌,酸性代尔夫特菌而且SphingomonasHMT004 sp。该网络还包括其他口腔物种,如放线菌odontolyticus,Porphyromonas pasteri而且Gemella haemolysans(图4 d).
与疾病严重程度相关的细菌生物标志物的鉴定
线性判别分析效应量分析17鉴定出15个细菌属在三个诊断组间差异丰富。该属的IPMN HGD高度富集Granulicatella,沙雷氏菌属而且梭菌属,但低Methylobacterium, Sphingomonas而且丙酸菌属.后三者在LGD和Cancer (图5 g).
(A)表示线性判别分析效应量结果的分支图,确定了三个诊断类别之间差异丰富的15个特征(红色=癌症,橙色=IPMN HGD,黄色=IPMN LGD)。(B-G)小提琴图显示每个诊断组所选差异丰度细菌属的相对丰度分布和中位数。的验证梭菌属nucleatum用TaqMan qPCR在(H)囊肿液和(I) 25个福尔马林固定的PCN组织样本(非IPMN n=9, IPMN LGD n=6, IPMN HGD n=4,癌症n=6)中提取的DNA进行基因组定量。采用Kruskal-Wallis检验和Dunn 's多重比较检验,差异有统计学意义**p<0.01。HGD,高度发育不良;导管内乳头状粘液性肿瘤;LGD,低度发育不良;PCN,胰腺囊性肿瘤。
因为f . nucleatum据报道与肿瘤发生有关,13我们验证了f . nucleatum对PCN囊液标本(n=99)进行定向qPCR检测,证实HGD组中HGD含量显著增加f . nucleatum囊肿液中的基因组拷贝数(图5 h).作为f . nucleatum也可能存在于细胞内,来自25例PCN患者的FFPE样本(见在线补充表1),经验证其肿瘤组织含量为>40%,并采用qPCR进行检测。这证实了f . nucleatum主要检测IPMN、HGD和癌损组织(图5我).
囊内细菌DNA数量及组成与临床因素的相关性
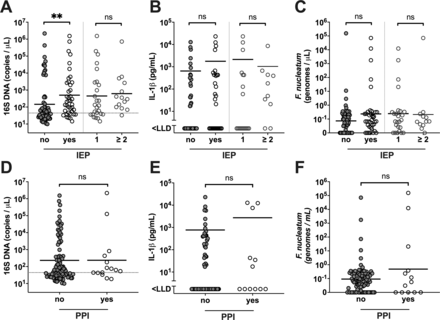
接下来,我们研究了可能影响胰腺囊肿液中细菌DNA数量的临床因素。对记录在案的抗生素和PPI使用情况,或既往的侵入性内镜手术(IEP),包括EUS-FNA,内镜逆行胰管胆管造影(ERCP)和经皮肝穿刺胆管造影(PTC)进行相关性分析,这些可能是细菌“播下”胰管的潜在途径。我们的结果表明,术前有IEP病史的患者囊内16S基因拷贝也显著升高(p=0.0017) (图6),虽然这似乎与IEP的数目无关,f . nucleatum基因组拷贝数或IL-1β浓度(图6B, C).此外,当我们根据患者的IEP史对患者进行分层时,与SCN良性肿瘤组相比,IPMN HGD和从未有过IEP的癌症患者的囊内细菌16S DNA也明显更高(p=0.0268),这与当前队列中所有患者的观察结果相似(见在线)补充图2A, B).在有或没有IEP手术史的患者中,16S DNA和IL-1β之间的可比性正相关支持了这一点(见在线)补充图2C, D).PPI的使用与肠道菌群组成的改变以及细菌易位和肠道感染风险的增加有关,18 19对囊内细菌16S DNA、IL-1β或f . nucleatum数量(图6 d-f).使用PPI或抗生素,以及既往IEP均与囊内微生物多样性无关(图4一),并且在有或没有IEP的组之间没有观察到alpha-多样性的差异(未显示)。采用线性模型的多元分析(MaAsLin)分析显示,细菌属的相对丰度与临床参数(包括IEP病史、使用PPI和术前<1个月使用抗生素)之间没有统计学意义上的相关性(未显示)。
患者分层基于既往的胰腺侵入性手术(IEP),分为“否”(n=65)和“是”(n=40),包括“1”IEP (n=26)和“≥2”(n=14),或使用质子泵抑制剂(PPI),分为“否”(n=90)和“是”(n=15)。显示囊内(A) 16S DNA数量,(B)白介素(IL)-1β数量和(C)梭菌属nucleatum(D) 16S DNA数量,(E) IL-1β数量,(F)f . nucleatum基因组拷贝,用几何平均值表示每组PPI使用分层。“no”组与“yes”组、“1”组与“≥2”组分别采用Mann-Whitney U检验,差异有统计学意义,**p<0.01。LLD,检测下限;Ns,不显著。
讨论
在这项对手术切除的PCN抽吸胰腺囊肿液的前瞻性评估中,我们发现,与其他PCN类型相比,IPMN和IPMN合并侵袭性癌症组的囊内细菌DNA和IL-1β浓度显著升高。具体而言,细菌DNA和IL-1β浓度在囊内呈显著正相关,但在配对患者血浆中不存在,并且在诊断为IPMN HGD的患者中最高。值得注意的是,非ipmn,包括SCN(良性)和MCN胰腺肿瘤,细菌DNA和IL-1β含量低。有趣的是,与IPMN相比,它们不与胰腺导管系统交流,后者与肠道排水和交流。我们的发现与先前关于胰腺囊肿液细胞因子的研究一致,该研究表明IL-1β水平可以区分低风险(IPMN LGD)和高风险(IPMN HGD和癌症)病变。20.已知促炎细胞因子IL-β的释放仅限于对病原体相关分子模式(PAMPs)作出反应的单核细胞。微生物核酸和细胞壁成分是一组重要的il -1β刺激PAMPs,包括微生物基因组、未甲基化的CpG DNA基序、LPS和革兰氏阳性/革兰氏阴性细菌的肽聚糖。21在IPMN HGD和Cancer组中检测到的高囊内IL-1β浓度,及其与细菌DNA和LPS水平的正相关,因此表明胰腺囊肿微生物组在调节局部肿瘤环境中的作用。这反过来表明胰腺微生物组的炎症潜力与全身感染无关,正如配对血浆数据所表明的那样。
有趣的是,当对整个队列进行检查时,囊内细菌DNA数量的升高似乎与先前的IEP有关。由于具有更晚期或恶性病变的IPMN患者可能接受了更有侵入性的内镜手术,因此可能会出现选择偏倚,我们根据既往的iep对队列进行了分层。我们发现,在IPMN和癌症组中,从未接受过任何胰腺侵入性手术的患者,实际上在他们的胰腺囊肿液中也显示出更高的16S DNA负荷和IL-1β负荷。因此,目前的研究不能排除IEP (ERCP、PTC或EUS-FNA)可能是细菌易位进入胰腺的医源性途径。但是,IEP患者和非IEP患者囊内细菌DNA数量和组成没有明显差异,进一步支持可能存在其他细菌易位途径。
我们的网络分析表明,囊内胰腺微生物组含有已知栖息于人类口腔的共存细菌物种,包括g . adiacens,f . nucleatum,micra, E. corrosion, H.副溶血性蜱,A. oldontolyticus, P. melaninogenica而且弯曲杆菌ssp。22这些物种中有几种存在于引起牙周炎和牙龈炎的生物膜中,也与全身性疾病的风险增加有关。23在PCN和胰腺癌(PC)组织中存在细菌之前已经被证明过。12 14 15尽管最近研究表明,丰富的胰腺微生物组可能通过诱导瘤内免疫抑制来推动PC的疾病进展,12这是首次发现细菌DNA数量与IPMN的肿瘤分级严重程度相关。据我们所知,从低风险的IPMN LGD到高风险的IPMN HGD的转变,细菌存在增加或微生物群落改变,随后的免疫信号还没有报道,值得进一步研究。目前发现的高丰度f . nucleatum在囊肿液和组织中均见HGD是否符合f . nucleatum被认为是一种致癌细菌24更多的研究应该集中在阐明其在肿瘤发生中的早期参与。除此之外,已知胰腺肿瘤微环境具有缺氧和免疫抑制特性,支持厌氧细菌的优先生长,如f . nucleatum在结直肠癌中也有报道。25日26日
口腔病原体和炎症(牙周炎)与PC风险增加有关,主要是通过与胰腺癌发病率和唾液微生物群组成或血清流行率的关联研究Porphyromonas gingivalis抗体。的观众具体来说,是口头的p . gingivalis,Aggregatibacter actinomycetemcomitans,以及循环抗体对抗p . gingivalis与更高的PC风险相关。最近的一项荟萃分析得出结论,即使在调整了常见的危险因素后,牙周炎和PC之间也存在普遍的正相关。31此外,肠道菌群失调、细菌易位和炎症与包括PC在内的几种胰腺疾病有关。32唾液水平增加g . adiacens与健康个体相比,与胰腺炎和PC有关。33与这些发现一致,我们所描述的囊内微生物组包括几种共存的细菌种类,如f . nucleatum,c . showae,p . melaninogenica,g . adiacens而且嗜血杆菌56这种疾病之前曾被认为与其他人类恶性肿瘤有关。34-36关于为什么胰腺囊肿微生物组包括口腔细菌种类的可能解释值得研究,包括胰腺和唾液腺共享的功能相似性,37可能会创造一个吸引类似微生物的生物环境。
我们的研究表明,IPMN合并低级别瘤、高级别瘤和IPMN癌的囊肿液中可以存在不同的细菌群落。虽然这些疾病组在门水平上表现出明显的微生物组成差异,但在较低的分类水平上,群落结构的高度人际差异变得清晰。这与Li先前报道的不同类型PCN(包括MCN和SCN)的胰腺“核心微生物组”形成对比等,15尽管我们的技术方法不同,但在我们的样品中检测到相似的细菌类群。尽管有较高的人际差异和我们相对较小的样本量,我们的结果显示富集Fusobacteria, Granulicatella而且沙雷氏菌属在IPMN HGD中,这些口腔细菌在囊肿前体发展为PC过程中的潜在作用值得进一步研究。
本研究的优势在于,结合组织学确诊,收集了切除术后吸入的囊肿液,通过内镜探查减少了样本污染的风险,同时最大限度地提高了诊断的准确性。此外,液体活检的收集和储存采用了良好控制和标准化的程序。我们目前研究的局限性在于,每位患者只能抽取一个囊肿,而IPMN可以是单灶性或多灶性,具有独立产生的囊肿,可能包含不同级别的发育不良和不同的恶性潜能。2 38 39由于组织学检查考虑的是整个切除标本,实际取样的囊肿可能不能完全代表多灶型IPMN。我们实验室的初步数据表明,从同一患者的不同胰腺部位提取的液体中有相似的微生物特征(n=2;未发表的观察结果),但未来应考虑对胰腺导管系统中微生物组组成变异的研究。此外,从囊肿液和血浆中获得的细菌DNA数量和质量普遍较低,因此在qPCR和基于扩增子测序的微生物组成分析等分析中容易受到环境污染。40为了解决这一问题,我们应用了严格的DNA数量和质量过滤器,同时保持足够的样本数以进行统计分析,并使用适当的阴性对照进行并行分析。然而,特定细菌类群的相对丰度与疾病参数之间的绝对最优相关性,需要更大的样本量和多个位点的样本来证明是否存在不同的疾病特异性囊内微生物群。根据我们目前的微生物群数据,我们估计每个患者组的样本量为>70,才能达到0.8的幂。
在可预见的将来,我们的结果可能会对临床实践产生影响。首先,在诊断为IPMN的患者中,应该推荐其他方法来减少口腔病原体的全身传播,例如,通过使用局部口服防腐剂和/或定期口腔护理来控制感染,进行侵入性内窥镜检查,尽量减少口腔细菌的携带。第二,采用唾液生物标志物检测或血清学29日33在目前的研究中发现的细菌可以为IPMN与胰腺其他囊性病变的区分铺平道路,以减少不必要的手术。这是特别重要的,可以平衡当前IPMN过度治疗的问题,同时防止胰腺微生物组的潜在持久变化,这可能有助于细胞转化和未来PC对化疗的耐药性。14
此外,胰腺囊性微生物组检测在指导IPMN的治疗方面具有附加价值,特别是在随访期间,因为IPMN切除术后5-10年可能复发。需要进一步的研究来评估术后胰腺的高细菌负荷和炎症是否与IPMN复发风险增加有关。这可能会进一步提高切除术后的无病生存率,目前LGD的无病生存率为5.4%-10%;52个月,在IPMN患者中HGD/cancer为>的50%;29个月。1值得注意的是,DNA检测(16S和/或靶向口腔细菌复合)非常快,即2-3小时,而传统的组织病理学需要数周,可以更好地支持有效和及时的决定。
然而,如果微生物组检测完全适用于临床实践,有一些重要的考虑因素。首先,需要采取严格的实验室质量控制措施,防止环境污染,以确保测序的准确性和数据的可靠性。此外,胰腺微生物组数据库和/或包括大量描述良好的患者的多中心研究可能允许检测隐藏在当前队列变异背后的“核心”病原菌群。27 29 30
为了更好地了解各种pcn的疾病进展,仍有许多工作要做。1本研究中提出的发现可能不会直接导致将囊内微生物群作为“恶性肿瘤的预测工具”的临床应用,但它们可能会改变临床医生对PCN发生和进展中被忽视的微生物作用的看法。实验(干预)研究对于阐明这里发现的细菌是否在IPMN进展中起驱动作用很重要,如果是这样,抗生素治疗受IPMN影响的患者是否将是在不久的将来降低恶性肿瘤进展风险的重要选择。胰腺侵入性内窥镜手术作为一种潜在的细菌易位医源性途径,其对肿瘤复发和进展的影响值得进一步研究。
致谢
作者要感谢所有患者使这项研究成为可能。作者还要感谢卡罗林斯卡大学医院的Sam Ghazi提供的技术支持和咨询。
参考文献
脚注
贡献者研究设计:MDC、MSC、RV、RAG。样品采集加工:MDC, AH, HD, RAG, KH, ZA, CFM。临床资料收集及解释:ZA、RV、AH、CFM、RAG。实验室工作:RAG, HD, HA, KH, LL。生物信息分析与统计:LWH, RAG。稿件准备:RAG, MSC, RV, KH。最终草案提交批准:RAG, AH, HA, LL, HD, KH, LWH, ZA, RV, CFM, MDC, MSC。
资金这项工作得到了瑞典癌症协会的支持(CAN2016/731 to MSC) (CAN 2014/634, CAN 2015/621, CAN 2017/409, CAN 2017/419 to MDC)。Ruth och Richard Julins基金,卡罗林斯卡研究所基金,KI KID基金,SOF KI/SLL för odontologisk forskning(给MSC)。斯德哥尔摩郡议会(ALF SLL20150113)(致MDC)。
相互竞争的利益没有宣布。
伦理批准该研究遵循赫尔辛基公约和良好临床实践,并获得了斯德哥尔摩区域伦理委员会的批准(Dnr. 2015/1580-31/1)。
出处和同行评审不是委托;外部同行评审。
患者发表同意书不是必需的。