条文本
摘要
客观的如果GORD导致食管鳞状细胞转化为柱状细胞,则可能发生Barrett化生。酸和胆汁暴露上调食管鳞状细胞柱状分化基因,如CDX2,但不知道这类暴露是否下调鳞状分化基因,如SOX2。除了胃酸和胆汁液外,goord患者的食管中也有高浓度的一氧化氮(NO)。本研究旨在确定酸、胆盐和NO如何影响影响食道细胞表型的基因。
设计Barrett食管患者的食管鳞状细胞暴露于酸性胆盐或NOC-9 (NO供体)。采用定量RT-PCR检测SOX2、p63(鳞状转录因子)和CDX2 mrna。通过蛋白印迹法评价SOX2及其调控Akt通路蛋白。二硫苏糖醇阻断了NO的s -亚硝基化作用。对手术诱导的GORD大鼠的食管进行SOX2免疫组化,这些大鼠分别饲喂添加亚硝酸盐和不添加亚硝酸盐的饲料。
结果在食管鳞状细胞中,NO显著降低了SOX2蛋白,并导致SOX2 mRNA明显低于酸性胆盐。NO还降低了p63,增加了CDX2的表达。NO引起Akt的s -亚硝基化,阻断其磷酸化。LY294002或Akt siRNA抑制Akt信号通路降低SOX2 mRNA。亚硝酸盐饲粮的大鼠食管SOX2染色较正常饲粮的大鼠弱。
结论在食管鳞状细胞中,NO通过Akt s -亚硝基化作用阻断SOX2的表达。NO还能增加CDX2,降低p63的表达。NO可能通过触发阻止鳞分化的分子事件,同时促进肠道分化,从而参与Barrett的发病。
- 巴雷特的化生
- 胃食管返流疾病
- 一氧化氮
来自Altmetric.com的统计
视频摘要
本研究的意义
关于这个问题,我们已经知道了什么?
有证据表明,成熟的食管鳞状细胞或其祖细胞在GORD的影响下转化为柱状细胞,形成Barrett食管。
许多研究表明,暴露于酸和胆盐的食管鳞状细胞增加了参与柱状细胞分化的基因(如CDX2)的表达,但这些有害物质如何影响参与鳞状细胞分化的基因(如SOX2)的表达尚不清楚。
除了食管异常暴露于酸和胆汁之外,GORD患者食管中还可能有高浓度的一氧化氮(NO),但目前尚不清楚NO是如何参与巴雷特化生的发病机制的。
新的发现是什么?
在Barrett食管非肿瘤性食管鳞状上皮细胞系中,NO增加CDX2的表达,降低p63的表达,并显著降低SOX2的表达。
NO通过引起Akt蛋白的s -亚硝基化来阻断Akt的激活,Akt信号通路的降低降低了SOX2的表达。
NO下调食管鳞状细胞中SOX2表达的体外观察在反流性食管炎大鼠模型中得到支持,该模型中动物饲喂添加亚硝酸盐和抗坏血酸的饲料,SOX2在食管鳞状细胞中的染色减弱。
在可预见的未来,它会对临床实践产生怎样的影响?
我们已经证明NO在食管鳞状细胞中触发一系列分子事件,可以抑制鳞状细胞分化,同时促进肠道分化,这一组合可能有助于巴雷特化生的发病机制。
本研究为研究减少食管远端NO生成以预防Barrett食管发展的干预措施提供了理论依据。
简介
Barrett食管是一种易发生腺癌的化生柱状上皮取代被GORD破坏的食管鳞状上皮的疾病。1在西方国家,有2%-7%的成年人患有巴雷特食道,是食道腺癌的主要危险因素。在过去40年里,食道腺癌的发病率增长速度是所有癌症中最高的。2 - 6
巴雷特食管的细胞来源尚不清楚。一种假说认为,巴雷特化生是由胃贲门的柱状祖细胞发展而来,这些细胞迁移到食道,取代gord损伤的鳞状细胞。7,8另一种假说认为,Barrett上皮生的发生要么是转分化的结果,即成熟的食管鳞状细胞转化为柱状细胞;要么是转分化的结果,即食管中不成熟的祖细胞被重新编程,发生异常的柱状分化,而不是正常的鳞状分化。9,10对于柱状化生的发展,转分化和转移都涉及到食道原生细胞的改变,而迁移假说涉及到起源于胃的细胞。
许多间接证据表明,食管细胞的转分化或转移参与了Barrett化生的发病机制。柱状上皮排列在早期胚胎食道上,在小鼠模型中,胚胎食道的外植体在培养5天后失去柱状标记,开始表达鳞状标记,一些细胞同时表达柱状和鳞状标记。11这些数据表明,在正常胚胎发育过程中,食管鳞状上皮由柱状上皮直接转化而来。由此推断,gord诱导的成人这一过程的逆转可能导致巴雷特食道。
在巴雷特食管患者中,食管鳞状上皮和化生柱状上皮交界处的活组织检查可以通过扫描电子显微镜显示同时具有鳞状和柱状特征的细胞,12,13光镜可以显示一种特殊的多层上皮,基底层为鳞状细胞,表面为柱状细胞。有人认为这些变化代表Barrett食管鳞状到柱状化生的过渡阶段。14
研究表明,在体内暴露于胃食管反流或在体外暴露于酸和胆盐的食管鳞状细胞和组织,其与柱状细胞表型(如CDX2和Sonic Hedgehog途径靶基因SOX9和FOXA2)的发展相关的转录因子的表达增加,这进一步证明了巴雷特氏上皮生发病机制中转分化或转转移的证据。15 - 20在手术诱导的反流性食管炎大鼠模型中,食管基底层鳞状细胞表达Cdx基因先于肠化生的发展。20.当巴雷特食管患者暴露于酸和胆盐时,他们的食管鳞状细胞系的CDX2表达增加,19在Barrett食管患者的食管鳞状上皮中发现CDX2的表达。19,21
上面讨论的研究集中在GORD如何通过上调决定柱状细胞表型的基因来促进Barrett化生的发展。然而,巴雷特化生的发病机制似乎也与参与鳞状上皮分化的SOX2等基因的下调有关,这是一种促进分层鳞状上皮发育的转录因子。22经基因工程表达低水平食道Sox2的小鼠在食道中形成斑块状柱状衬,其区域类似于人类多层上皮。14,22目前尚不清楚GORD如何影响SOX2等鳞状上皮分化基因的表达。
最后,关于GORD如何可能成为Barrett发病机制的基础的研究主要集中在酸和胆盐(胃液的主要有害成分)对食道细胞的影响。然而,在食道食道食道中高浓度的NO可能是由绿叶蔬菜和其他食物中的硝酸盐引起的。23这种NO可以与氧气反应生成有毒的活性氮(RNS)。24相对较少的研究专门关注NO在巴雷特化生发病机制中的作用。现在,我们已经探索了酸、胆盐和NO可能影响SOX2在非肿瘤性食管鳞状细胞系中的表达的机制,并将我们的体外研究结果与反流性食管炎大鼠模型的体内数据相关联。我们发现NO在食管鳞状细胞中触发分子事件,可以抑制鳞状细胞分化,同时促进肠道分化,这一组合可能导致巴雷特食管的发展。
材料和方法
细胞系
我们使用了两种非肿瘤性的端粒酶永生的食管鳞状上皮细胞系(正常食管鳞状上皮(NES)-B3T, NES- b10t,从两名Barrett食管患者的远端鳞状内衬食管的内镜活检标本中创建)。19,25所有细胞系在37°C 5% CO中保持2孵化器。
酸性胆盐和NO暴露
单个实验中,NES细胞单独在中性培养基(pH 7.2)中培养;6-(2-羟基-1-甲基-2-亚硝基肼)- n -甲基-1-己基胺(NOC-9;Sigma, St Louis, Missouri, USA),这是一种小分子NO供体;或中性培养基,并定期暴露在酸性培养基(pH 5.5)中,酸性培养基中含有前面所述的共轭胆汁酸混合物。26如前所述,未使用ISO-NO Mark II NO仪表和ISO-NO传感器(WPI, Florida, USA)进行测量。27
半定量和定量实时PCR (qRT-PCR)
半定量和qRT-PCR如前所述进行。28引物序列(表1)使用Primer Express (Applied BioSystems, Foster City, California, USA)设计,并由Integrated DNA Technologies (Coralville, Iowa, USA)制造。
蛋白质提取和免疫印迹
用一抗(见在线补充表S1)对蛋白质提取物进行免疫印迹分析,在4°C下过夜。作为负载对照,膜被剥离并用小鼠抗-β-微管蛋白重新检测(Sigma, St. Louis, Missouri, USA)。
抑制Akt信号通路
使用高选择性药理抑制剂LY294002 (Cell Signaling, Danvers, Massachusetts, USA)抑制Akt信号29或特定的Akt siRNA (Thermo Scientific, Waltham, Massachusetts, USA),根据制造商说明。
雷帕霉素-里克托激酶测定的机制靶点
为了确定NOC-9是否可能通过降低雷帕霉素的rictor机制靶点(mTOR)活性来降低Akt的磷酸化,我们使用了体外激酶试验。30.在免疫沉淀rictor后,加入外源性活性Akt/PKB1蛋白(可被免疫沉淀rictor磷酸化Ser473),并对磷酸化Akt Ser473进行western blot,作为rictor- mtor活性的指标。
S-nitrosylation Akt的
在s -亚硝基化过程中,NO将蛋白质半胱氨酸硫醇转化为s -亚硝基硫醇,可以用生物素开关法检测到。还原剂二硫苏糖醇(DTT;Invitrogen公司,卡尔斯巴德,加利福尼亚州,美国)。31
反流性食管炎大鼠模型的免疫组化研究
在免疫组化研究中,我们使用先前收集的大鼠食管鳞状组织切片,这些大鼠的手术诱导反流性食管炎分别喂食添加或不添加如上所述NO的饮食。32术后4周,从饮食中添加NO的动物(n=6)和未添加NO的动物(n=8)中获得组织切片。32在这个时间点上,饲料中添加NO的6只动物发生了肠化生,而饲料中不添加NO的8只动物则没有。32组织用1:100稀释的SOX2 (Abcam, Cambridge, Massachusetts, USA)孵育,以二氨基联苯胺为底物观察目标蛋白。由两名GI病理学家(AA, RDO)对治疗组盲法进行组织评估和评分。
数据分析
定量数据用平均值±SEM表示。统计分析采用无配对的Student's t检验,或采用方差分析和Student- newman - keuls多重比较检验进行多次比较。p值≤0.05被认为是所有分析的显著值(更多的细节可以在在线补充材料和方法部分找到)。
结果
NOC-9可显著抑制Barrett食管鳞状细胞中SOX2 mRNA和蛋白的表达
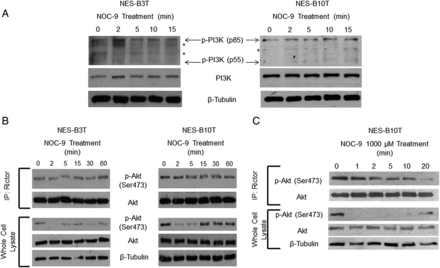
暴露于酸性胆盐显著降低了NES-B10T细胞中SOX2 mRNA的表达,但对NES-B3T细胞无影响(图1A).相反,暴露于NOC-9使两种细胞系中的SOX2 mRNA表达量显著低于未处理的对照细胞和酸性胆盐处理的细胞(图1A). NOC-9还降低了两种食管鳞状细胞中的SOX2蛋白水平(图1B).在回顾这些数据后,考虑到NOC-9对SOX2 mRNA和蛋白的持续和深刻抑制,我们选择使用NOC-9(而不是酸性胆盐)进行所有进一步的实验。
NOC-9可抑制Barrett食管患者食管鳞状细胞(正常食管鳞状细胞(NES)-B3T和NES- b10t)中SOX2 mRNA和蛋白的表达。图中显示了NES细胞系中具有代表性的(A) SOX2 mRNA的qRT-PCR和(B) SOX2蛋白的western blotting实验,在用酸性胆盐(A和B)或500 μ M NOC-9处理5天后,每天3次,每次1小时;在第二天(第6天)收集mRNA或蛋白质。柱状图表示平均值±SEM。与未处理对照组相比,***p≤0.001;+++p≤0.001与酸性胆盐处理细胞比较。(C)连续测量含有NOC-9的培养基在250、500和1000 μ M下产生的一氧化氮(NO)浓度。
我们测量了含有NOC-9的培养基产生的NO浓度,发现250、500和1000 μ M的NOC-9剂量分别产生15、30和60 μ M的NO峰值浓度(图1C).在摄入硝酸盐后的GORD和Barrett食管患者的食道腔中检测到这种浓度。33NOC-9暴露后2分钟内NO浓度达到峰值(图1C)。
noc -9介导的SOX2的减少与TA和p63 ΔN亚型mRNA的表达减少以及CDX2 mRNA的表达增加有关
P63是食管分层鳞状上皮发育和维持所需的转录因子。22,34p63基因编码两种主要的蛋白异构体TAp63和ΔNp63, p63基因的表达通常与食管中SOX2的表达相关。为了确定NOC-9是否降低p63和SOX2,我们使用qRT-PCR检测了p63亚型的mRNA表达。NOC-9显著降低NES-B3T和NES-B10T细胞中的TAp63和ΔNp63 mrna (图2A, B). CDX2,一种决定肠道发育的转录因子,似乎与SOX2呈反比关系。35,36因此,NOC-9处理导致SOX2表达减少,导致NES-B3T和NES-B10T细胞中CDX2 mRNA表达增加,但这种增加仅在NES-B3T细胞中达到统计学意义(图2C)。
NOC-9抑制正常食管鳞癌(NES)细胞中TA和p63 ΔN亚型mRNA表达,增加CDX2 mRNA表达。图中为NES细胞系中(A) TAp63、(B) ΔNp63和(C) CDX2 mRNA表达的qRT-PCR代表性实验,用500 μ M NOC-9处理5天后,每日3次,1 h;在第二天(第6天)收集mrna。柱状图表示均值±SEM。*p与未处理对照组比较≤0.05;与未处理对照组相比,***p≤0.001。
在手术诱导的反流性食管炎大鼠模型中,no添加饮食降低了SOX2在远端鳞状食管中的表达
采用食管空肠吻合术和胃空肠吻合术诱导胃-十二指肠-食管反流,大鼠出现类似Barrett食管的反流性食管炎和柱状化生。32添加no可加速化生的发展。为了确定NO对该模型中食管Sox2表达的影响,我们在术后饮食中添加NO和不添加NO的大鼠远端鳞状排列食管进行了Sox2的免疫组化。32我们发现Sox2染色主要存在于所有动物鳞状上皮的基底和基底上细胞的细胞核中(图3).no添加组Sox2染色强度(0.83±0.17 SEM)弱于正常组(1.25±0.16)(图3).
在反流性食管炎大鼠模型中,饮食中补充一氧化氮(NO)可降低Sox2在远端鳞状食管中的表达。手术诱导的反流性食管炎大鼠术后4周的远端鳞状食管代表性显微照片,分别饲喂添加(下面板)或不添加(上面板)NO的饮食。两组H&E染色均见炎性改变。Sox2染色主要可见于基底细胞和基底上细胞的细胞核中,在no添加饲料的大鼠中,Sox2染色强度较弱。
NOC-9不会引起BMP信号的增加
在非食道细胞中,骨形态发生蛋白(BMP)通路信号通路的激活与SOX2表达的降低有关。35,37因此,我们研究了NOC-9是否可以通过激活BMP信号来降低SOX2在NES细胞中的表达。我们对SMAD1/5/8的磷酸化形式进行了western blot, SMAD1/5/8是BMP通路信号转导的一个指标。我们发现在NOC-9处理后NES-B3T或NES-B10T细胞中p-SMAD1/5/8没有增加(图4).这表明NOC-9在食管鳞状细胞中并没有通过增加BMP通路信号来降低SOX2的表达。
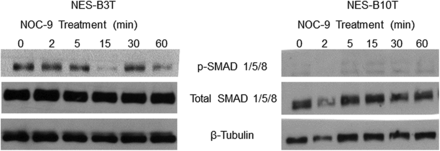
NOC-9处理不会增加正常食管鳞状上皮细胞的骨形态发生蛋白(BMP)通路信号。磷酸化和总SMAD蛋白印迹的代表性实验。NOC-9 (500 μ M)给药时间为0,结果显示NOC-9给药后各时间点的作用。
NOC-9降低磷酸化Akt的表达,Akt信号调节SOX2的表达
Akt信号的抑制与非食道细胞中SOX2表达的降低有关。38,39为了完全激活,Akt必须在两个不同的位点被磷酸化,即苏氨酸308 (Thr308)和丝氨酸473 (Ser473)。40我们用NOC-9处理NES细胞,并测定了对Akt磷酸化的两个位点的影响。在两种细胞系中,NOC-9在暴露后2和5分钟降低了Ser473位点和Thr308位点的磷酸化akt (图5A).为了证实Akt信号确实与食管鳞状细胞中SOX2的表达有关,我们使用药理学抑制剂LY294002或特定的siRNA抑制Akt,并通过qRT-PCR评估SOX2的表达。半定量RT-PCR检测siRNA抑制Akt表达的效率。LY294002显著降低NES-B10T细胞中SOX2的表达(图5B),在NES-B3T和NES-B10T细胞中使用siRNA对抗Akt证实了这一发现(图5C).这些数据表明,NOC-9降低Akt在Thr308和Ser473位点的磷酸化,Akt信号通路介导Barrett食管患者食管鳞状细胞中SOX2的表达。
NOC-9处理降低了正常食管鳞(NES)细胞中Akt Ser473和Thr308位点的磷酸化,抑制Akt信号通路降低了SOX2 mRNA的表达。(A) phospho-Akt Ser473和Thr308蛋白印迹的代表性实验。NOC-9 (500 μ M)给药时间为0,结果显示NOC-9给药后各时间点的作用。(B) LY294002处理24 h或(C)特定Akt siRNA处理48 h的NES细胞中SOX2 mRNA的qRT-PCR代表性实验;半定量RT-PCR显示Akt在48小时被siRNA敲除。柱状图表示均值±SEM。*p与未处理对照组比较≤0.05;**p与未处理对照比较≤0.01;与未处理对照组相比,***p≤0.001。
NOC-9在不影响PI3激酶或rictor-mTOR活性的情况下快速降低Akt的磷酸化
PI3激酶活性通过将Akt和PDK1(3-磷酸肌苷依赖性激酶-1)召集到质膜上启动Akt的磷酸化,PDK1磷酸化Akt的Thr308位点。30.,40我们探索了NOC-9是否可以通过抑制PI3激酶的激活(磷酸化)来降低Akt的磷酸化,发现NOC-9在两个细胞系中都没有引起PI3激酶磷酸化的明显降低(图6一个)。
在正常食管鳞癌(NES)细胞中,早期noc -9诱导的Akt磷酸化降低与PI3激酶或雷帕霉素(mTOR)机制靶标复合物活性的影响无关。(A)磷酸化和总PI3K蛋白印迹的代表性实验;*非特异性条带(B)在rictor-mTOR活性测定(上印迹)或500 μ M NOC-9处理的细胞的全细胞裂解液(下印迹)中总磷酸化akt Ser473的western印迹的代表性实验或(C) 1000 μ M NOC-9处理的ns - b10t细胞的western印迹。NOC-9 (500 μ M或1000 μ M)在第0时间点给药,结果显示在给药后的指定时间点起作用。
Akt Ser473位点的磷酸化是由含有rictor (mTOR的雷帕霉素不敏感伴生物)的mTOR复合物完成的。30.为了确定NOC-9是否可能通过降低rictor- mtor活性来降低Akt的磷酸化,我们使用了一种体外激酶试验,从NOC-9处理过的NES细胞中免疫沉淀rictor,然后添加外源性活性的Akt/PKB1蛋白(该蛋白可在Ser473处被免疫沉淀rictor磷酸化),并对磷酸化Akt Ser473进行western blot,作为rictor- mtor活性的指标。我们还比较了NOC-9通过免疫沉淀rictor磷酸化外源性Akt和在全细胞裂解物中磷酸化内源性Akt的时间过程。在任何时间点,NOC-9对免疫沉淀rictor磷酸化外源性Akt的Ser473位点几乎没有影响(图6B;上的屁股)。相比之下,NOC-9处理仅2分钟后,内源性Akt Ser473位点的磷酸化在整个细胞裂解物中明显下降(低印迹)。当细胞用更高浓度的NOC-9 (1000 μ M而不是500 μ M)处理时,这些效应更加明显。图6C).高浓度的NOC-9几乎在1分钟内消除了Akt Ser473位点的磷酸化,而NOC-9对免疫沉淀rictor的作用直到很长时间后才显现出来。这些结果表明,NOC-9在NES细胞中降低Akt磷酸化的快速作用与对PI3激酶或rictor-mTOR活性的影响无关。
NOC-9引起Akt的s -亚硝基化
已知NO通过s -亚硝基化使Akt蛋白失活,在s -亚硝基化过程中NO将半胱氨酸硫醇转化为s -亚硝基硫醇。31,41还原剂DTT可以阻断这种s -亚硝基化。41我们在DTT存在或不存在的情况下,用NOC-9处理NES-B3T和NES-B10T细胞,发现DTT减弱或取消了磷酸化akt Ser473 (图7A、B、顶板)和Thr308 (图7A, B,底部面板)在2和5分钟。为了证实这些结果是s -亚硝基化的结果,我们对NOC-9处理过的NES-B10T细胞进行了生物素开关测定。我们发现,在抗坏血酸存在的情况下,NOC-9处理过的细胞中生物素化Akt的水平在暴露后2和5分钟升高(证实了s -亚硝基化)。图7C).这些研究结果表明NO导致Akt的s -亚硝基化,从而干扰其Ser473和Thr308位点的磷酸化。基于我们的研究结果,我们提供了一个简要的机制模型图8.
NOC-9处理诱导Akt s -亚硝基化,干扰其在正常食管鳞(NES)细胞中的磷酸化。在(A) NES-B3T和(B) NES-B10 T细胞中添加或不添加二硫苏糖醇(DTT)的总akt和磷酸化akt Ser473和Thr308蛋白印迹的代表性实验。(C) NES-B10T细胞中具有代表性的生物素开关测定。值得注意的是,抗坏血酸处理过的细胞中出现生物素化的Akt,证实了s -亚硝基化。NOC-9 (500 μ M)给药时间为0,结果显示NOC-9给药后各时间点的作用。
演示一氧化氮(NO)对食管鳞状细胞中Akt、SOX2、p63(虚线)和CDX2(虚线)影响的示意图模型。NO引起Akt s -亚硝基化(SNO), SNO阻断其被PI3K和雷帕霉素rictor机制靶点(mTOR)激活,导致SOX2 mRNA和蛋白表达降低。已知SOX2能促进分层鳞状上皮的发育。NO也减少p63亚型的表达,这也是分层鳞状上皮的发展所必需的。同时NO增加CDX2的表达,促进肠道分化。因此,NO触发抑制鳞状上皮分化的分子事件,同时促进肠道分化,这一组合可能导致巴雷特食管肠化生的发展。
讨论
在Barrett食管患者的食管鳞状上皮细胞中,我们已经证明,暴露于酸性胆盐或生理相关浓度的NO会抑制SOX2 mRNA的表达。然而,与酸性胆盐相比,NO的这些转录抑制作用明显更强,并且NO也显著降低了SOX2蛋白的表达。我们已经证明NO导致Akt蛋白的s -亚硝基化,从而阻断其Thr308和Ser473位点的磷酸化,并且干扰Akt信号在食管鳞状细胞中减少了SOX2的表达。我们还发现,手术诱导的反流性食管炎大鼠的鳞状排列的远端食管,在喂食添加NO的饲料时,SOX2染色减少。最后,我们证实NO降低了食管鳞状细胞中p63亚型的mRNA表达,而增加了CDX2的mRNA表达。因此,NO在促进食道内肠道分化的同时,触发抑制鳞状上皮分化的分子事件。这些观察阐明了饮食中硝酸盐在食道中产生的NO可能促进巴雷特化生的分子机制。
在早期的报道中,我们提出由GORD激活的食道分子通路的个体差异可能决定了GORD是否因Barrett化生的发展而复杂化。16,19我们观察到,患有和不患有巴雷特食管的患者的食管鳞状细胞对有害刺激的反应不同,因此提出了这个建议。例如,酸性胆盐增加了巴雷特食管患者食管鳞状细胞中CDX2的表达,但在没有巴雷特食管的GORD患者中没有。19我们还观察到患有巴雷特氏食管和不患有巴雷特氏食管的患者的食管鳞状细胞通过Hedgehog信号传递的差异,Hedgehog是一种关键的发育通路,可影响决定肠道表型的基因。16基于这些观察,我们选择使用来自Barrett食管患者的食管鳞状细胞系进行本报告中描述的研究。
大多数关于反流胃液中有毒物质如何促进巴雷特化生的研究都集中在这些物质如何增加决定柱状细胞表型(如CDX2)的转录因子的表达。然而,鳞状到柱状化生的发病机制似乎也与决定鳞状细胞表型的转录因子表达减少有关,但很少有研究涉及这个问题。我们已经集中研究了有毒物质如何影响SOX2,这是一种内胚层转录因子,在胚胎中分层鳞状上皮的形成中起着关键作用。22在经基因改造表达食管Sox2水平<正常水平50%的小鼠中,胚胎食管发育出柱状衬区,有多层上皮灶,类似于Barrett食管中描述的那些,食管表达腺胃中正常表达的基因(如三叶因子1和2,Muc5B)。22,42因此,基因诱导的小鼠胚胎食道中SOX2的减少使其基因表达模式和组织学特征向柱状表型转变。在动物模型和巴雷特食管患者的反流性食管炎中发现了食管SOX2表达的降低。14然而,关于反流可能下调SOX2的机制知之甚少。
为了研究反流胃液中的有毒物质如何影响影响细胞表型的基因在食管的表达,我们用酸性胆盐或NO供体NOC-9处理食管鳞状细胞,使用设计的浓度和暴露时间来模拟典型的反流发作。23,43-46尽管大多数关于这一问题的研究主要集中在酸和胆盐的影响上,但食道中的NO可以与氧气反应形成RNS,具有相当大的毒性作用。24NO是由硝酸盐(NO3.−)主要从绿叶蔬菜中摄取。其中一些硝酸盐集中在唾液腺并分泌到口腔中,在口腔中细菌将回收的硝酸盐还原为亚硝酸盐(NO2−).吞咽时,亚硝酸盐遇到酸性胃液含有抗坏血酸,一种强大的还原剂,亚硝酸盐迅速转化为NO。在一项对健康志愿者的研究中,他们摄入了在典型沙拉中发现的一定量的硝酸盐,潜在的基因毒性NO浓度(高达50 μ M)在胃-食管交界处产生,吞咽唾液中的亚硝酸盐通常在这个位置与酸性胃液相遇。23在GORD和Barrett食管患者中,经常有酸回流到食管,在摄入硝酸盐后会产生高浓度的食管NO(高达60 μ M)。33我们发现酸性胆盐和NO均能抑制食管鳞状细胞中SOX2的表达,但NO对SOX2的抑制作用明显大于酸性胆盐。
转录因子p63,肿瘤抑制基因的同源物p53,是食管分层鳞状上皮发育和维持所必需的。22,34,47敲除p63的胚胎小鼠发育出由柱状细胞排列的食道。48p63基因编码两种功能独特的蛋白质异构体,TAp63和ΔNp63。鳞状癌细胞系的研究表明,SOX2和ΔNp63蛋白在物理上相互作用,并在功能上协同调节下游靶基因得分。34我们发现,暴露于NO,除了降低SOX2的表达外,还降低了食管鳞状细胞中p63 TA和ΔN亚型mRNA的表达。
决定肠型柱状细胞表型的转录因子SOX2和CDX2似乎具有相反的关系。35,36SOX2的下调和CDX2的上调与胃内肠化生有关。35,49,50进一步支持这些转录因子的反向关系,我们发现暴露于NO显著降低了我们食管鳞状细胞中的SOX2和增加了CDX2 mRNA的表达。我们还分析了手术诱导的GORD大鼠的鳞状衬食管远端组织标本,这些大鼠的饮食中添加或不添加NO。我们发现,与正常饮食的大鼠相比,饲粮添加no的大鼠的SOX2核染色更弱。此外,在术后4周,no添加饲粮的大鼠发生肠化生,Cdx2表达明显高于正常饲粮的大鼠。32
在某些非食道细胞中,SOX2表达的降低与BMP通路信号的激活或Akt信号的抑制有关。35,38,39我们发现NO没有引起BMP信号的明显激活,但却显著抑制了Akt的激活。Akt是一种丝氨酸/苏氨酸激酶,在包括细胞分化在内的多种细胞过程中具有重要的调节作用。51最近的研究表明,Akt信号是SOX2表达和功能的关键调控因子。41,52与这些报道一致的是,我们发现使用药理学抑制剂或特定siRNA抑制Akt信号可以降低食管鳞状细胞中SOX2 mRNA的表达。
Akt通过Thr308位点(位于蛋白的活化t -环)和Ser473位点(位于蛋白c端尾巴的疏水基程)的磷酸化被激活。30.,40Thr308位点的磷酸化是由PI3K启动的,PI3K将Akt和PDK1召集到质膜上,PDK1在质膜上磷酸化Akt的Thr308位点。40Akt Ser473位点的磷酸化是通过rictor-mTOR复合物的激酶活性来完成的,这一事件也可能依赖于PI3K的活性。30.,40我们发现NO通过引起Akt蛋白的s -亚硝基化来干扰Akt在食管鳞状细胞中的信号传导。s -亚硝基化是NO与蛋白质半胱氨酸残基的共价结合,形成s -亚硝基硫醇,通过影响蛋白质构象干扰蛋白质功能。53,54Akt的s -亚硝基化会破坏其激酶活性,可被还原剂DTT阻断。31,41我们发现DTT阻断了noc -9诱导的Akt Thr308和Ser473位点磷酸化的降低,表明Akt的s -亚硝基化干扰了其磷酸化。可以想象,PI3K的s -亚硝基化可能会干扰Akt信号,但我们发现NOC-9处理并没有导致食管鳞状细胞中磷酸化的PI3K减少。通过体外激酶试验,我们还发现NOC-9对rictor-mTOR磷酸化外源性Akt Ser473位点的能力没有明显的早期影响。此外,高浓度NOC-9几乎在2分钟内消除了内源性Akt Ser473位点的磷酸化,而在这个时间点NOC-9并不影响rictor-mTOR磷酸化外源性Akt Ser473位点的能力。这些观察结果表明,NO并没有通过降低PI3K或rictor-mTOR活性来降低Akt的磷酸化,进一步支持Akt蛋白s -亚硝基化作为NO干扰Akt磷酸化和信号传导的机制。
总之,在Barrett食管患者的食管鳞状细胞中,我们发现NO导致Akt s -亚硝基化,从而阻止其被PI3K和rictor-mTOR激活,我们还发现NO降低了Akt的转录靶点SOX2的表达。NO也会降低p63的表达,而p63和SOX2一样,是分层鳞状上皮发育所必需的。同时NO增加CDX2的表达,促进肠道分化。因此,NO触发抑制鳞状上皮分化的分子事件,同时促进肠道分化,这一组合可能导致巴雷特食管肠化生的发展。这些观察结果为研究减少食管远端NO生成以预防Barrett食管的干预措施提供了理论依据。
参考文献
脚注
KA和XH贡献相等。
贡献者本文所有作者均符合作者标准,并已批准投稿。具体贡献如下:KA:研究设计;技术和物资支持;数据分析和解释;对稿件进行批判性修改;重要的知识内容;起草的手稿。XH:研究设计;技术和物资支持;数据分析和解释; critical revision of manuscript; important intellectual content; drafting of manuscript. AA: study design; technical and material support; analysis and interpretation of data; critical revision of manuscript; important intellectual content; drafting of manuscript. XZ, CY, EC, QZ, KBD, THP, DHW, KI and TS: technical and material support; important intellectual content. RDO: analysis and interpretation of data; critical revision of manuscript; important intellectual content. SJS: study concept; analysis and interpretation of data; critical revision of manuscript; important intellectual content. RFS: study concept/design; analysis and interpretation of data; critical revision of manuscript; important intellectual content; drafting of manuscript.
资金这项工作得到了美国退伍军人事务部生物医学实验室研究项目(SJS)的优秀评审奖#BX002666的支持,美国国立卫生研究院(R01-DK63621和R01-CA134571授予RFS和SJS。K12 HD-068369-01和K08-DK099383到EC;R01-DK097340 D.H.W.)
相互竞争的利益没有宣布。
来源和同行评审不是委托;外部同行评议。