条文本gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2BaCOVID-19后的长期并发症很常见,但病毒清除后持续症状的潜在原因尚不清楚。gydF4y2Ba
客观的gydF4y2Ba研究肠道微生物组组成是否与急性后COVID-19综合征(PACS)有关,PACS的定义是在SARS-CoV-2病毒清除4周后至少有一种持续症状。gydF4y2Ba
方法gydF4y2Ba我们对106例COVID-19严重程度从入院到6个月的患者和68例非COVID-19对照组进行了前瞻性研究。我们使用散弹宏基因组测序分析了258个样本的粪便微生物组,并将结果与6个月的持续症状相关联。gydF4y2Ba
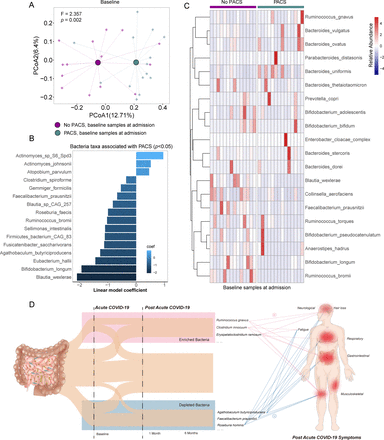
结果gydF4y2Ba6个月时,76%的患者患有PACS,最常见的症状是疲劳、记忆力差和脱发。入院时肠道菌群组成与PACS的发生有关。没有PACS的患者在6个月时肠道微生物组的恢复情况与非covid -19对照组相当。PACS患者肠道微生物组的特点是较高水平的gydF4y2Ba瘤胃球菌属gnavusgydF4y2Ba,gydF4y2Ba拟杆菌vulgatusgydF4y2Ba以及较低水平的gydF4y2BaFaecalibacterium prausnitziigydF4y2Ba.持续性呼吸道症状与机会性肠道病原体相关,神经精神症状和疲劳与院内肠道病原体相关,包括gydF4y2Bainnocuum梭状芽胞杆菌gydF4y2Ba而且gydF4y2Ba放线菌naeslundiigydF4y2Ba(所有p < 0.05)。产生丁酸盐的细菌,包括gydF4y2Ba双歧杆菌pseudocatenulatumgydF4y2Ba而且gydF4y2BaFaecalibacterium prausnitziigydF4y2Ba6个月时与PACS呈最大负相关。gydF4y2Ba
结论gydF4y2Ba这些发现为COVID-19长期并发症患者肠道微生物组的组成变化提供了观察性证据。应进一步研究调节微生物群是否能促进急性后COVID-19综合征的及时康复。gydF4y2Ba
- 新型冠状病毒肺炎gydF4y2Ba
- 肠道微生物gydF4y2Ba
数据可用性声明gydF4y2Ba
数据可以在一个公共的、开放访问的存储库中获得。原始数据存放在NCBI序列读取档案:PRJNA714459的BioProject中。gydF4y2Ba
在2019冠状病毒病(covid-19)大流行期间或由BMJ另行确定之前,本文根据BMJ的网站条款和条件免费供个人使用。阁下可使用、下载及列印文章作任何合法及非商业用途(包括文字及数据挖掘),但须保留所有版权声明及商标。gydF4y2Ba
https://bmj.com/coronavirus/usagegydF4y2Ba数据来自Altmetric.comgydF4y2Ba
本研究的意义gydF4y2Ba
关于这个问题我们已经知道了什么?gydF4y2Ba
据报道,COVID-19患者恢复期后症状持续。gydF4y2Ba
新出现的证据支持肠道生态失调在COVID-19感染严重程度中的潜在作用。gydF4y2Ba
SARS-CoV-2急性感染后对肠道微生物组的长期影响以及肠道微生物组组成是否影响不同严重程度COVID-19感染的康复患者持续症状的风险尚不清楚。gydF4y2Ba
新的发现是什么?gydF4y2Ba
我们的研究结果表明,一个人的肠道微生物组状况可能会影响他们对COVID-19长期并发症的易感性。gydF4y2Ba
肠道微生物组模式反映了急性后COVID-19综合征(PACS)患者的不同症状。gydF4y2Ba
入院时独特的肠道菌群组成与6个月时PACS的发生相关。gydF4y2Ba
在可预见的未来,它会对临床实践产生怎样的影响?gydF4y2Ba
这些发现为肠道微生物组与COVID-19感染后长期后遗症之间的复杂关系提供了新的见解。gydF4y2Ba
基于微生物组的分析可作为急性后COVID-19综合征发生早期风险分层的工具。gydF4y2Ba
简介gydF4y2Ba
COVID-19急性感染期间的临床特征有很好的描述,但对COVID-19的长期并发症知之甚少。以COVID-19发病后长期并发症和/或持续症状为特征的急性后COVID-19综合征(PACS)越来越被认识到。gydF4y2Ba1 - 3gydF4y2Ba多达四分之三的患者在康复后6个月至少出现一种症状,常见的症状包括疲劳、肌肉无力和睡眠困难。gydF4y2Ba4gydF4y2Ba
PACS发展背后的原因在很大程度上尚不清楚。免疫和炎症反应的紊乱、急性病毒感染引起的细胞损伤或重症后疾病后遗症可能导致COVID-19感染后的长期症状。gydF4y2Ba5gydF4y2Ba越来越多的证据表明,肠道生态失调与COVID-19感染的严重程度有关,并在疾病缓解后持续存在。gydF4y2Ba6gydF4y2Ba一些研究表明,胃肠道在COVID-19中有很大的参与,包括胃肠道中ACE2的表达增强gydF4y2Ba7gydF4y2Ba以及感染SARS-CoV-2的受试者肠道菌群扰动。gydF4y2Ba8gydF4y2Ba与非COVID-19对照组相比,COVID-19患者的粪便微生物群落发生了显著变化,其特征是机会性病原体富集,有益共生菌耗尽。gydF4y2Ba8 9gydF4y2Ba几种已知具有免疫调节潜能的肠道共生菌,如gydF4y2BaFaecalibacterium prausnitziigydF4y2Ba,gydF4y2Ba真细菌rectalegydF4y2Ba双歧杆菌在患者中代表性不足,在疾病解决后1个月收集的样本中,这些细菌仍然很低。gydF4y2Ba10gydF4y2Ba
由于胃肠道是人体最大的免疫器官,居住微生物引起的COVID-19感染的异常免疫反应可能会影响恢复过程。新出现的证据支持肠道生态失调在COVID-19感染严重程度中的潜在作用。gydF4y2Ba6gydF4y2Ba我们在此研究了急性COVID-19后肠道微生物群组成的变化及其与持续症状的关系。gydF4y2Ba
材料与方法gydF4y2Ba
研究人群gydF4y2Ba
这项前瞻性队列研究在中国香港的三家区域医院(威尔斯亲王医院、基督教联合医院和仁济医院)进行。在2020年2月1日至8月31日期间,所有经鼻咽拭子、鼻拭子、深喉唾液、痰液或气管吸出的SARS-CoV-2逆转录聚合酶链反应(RT-PCR)检测阳性,确诊为COVID-19的患者均被纳入研究。根据当地政府的政策,所有确诊的COVID-19患者都必须入院。符合以下条件之一的患者可以出院:两次相同类型的临床标本(呼吸道或粪便)经RT-PCR检测新冠病毒核酸至少24小时阴性或新冠病毒抗体检测阳性。患者在住院期间接受相同的抗生素(阿莫西林克拉维酸)。无法联系到患者、拒绝参与研究或随访前死亡的患者被排除在外。从香港医院管理局临床管理系统的电子病历中提取人口统计学、临床和实验室数据。COVID-19感染的严重程度分为(1)轻度,如果影像学没有肺炎证据;(2)有肺炎伴发热及呼吸道症状者为中度;(3)重度,呼吸频率≥30/min,呼吸环境空气时氧饱和度≤93%,或动脉血氧压/吸氧分数≤300 mm Hg (1 mm Hg=0.133 kPa); or (4) critical, if there was respiratory failure requiring mechanical ventilation, shock, or organ failure requiring intensive care.11gydF4y2Ba
PACS被定义为在清除SARS-CoV-2 4周后,至少有一种无法用替代诊断解释的持续症状。我们评估了covid后最常见的30种症状gydF4y2Ba12日13gydF4y2Ba在发病后3及6个月(gydF4y2Ba在线补充表1gydF4y2Ba).6分钟步行距离测试是对有氧能力和耐力的简单功能评估,在从COVID-19中康复的一部分患者出院6个月后进行。这些数据与肠道菌群分析相关。gydF4y2Ba
补充材料gydF4y2Ba
鉴于饮食已知会影响肠道微生物组,我们记录了所有COVID-19患者住院期间的饮食记录。每间医院的医院膳食服务均提供标准化膳食,膳食成分及模式均与香港华人常见的饮食习惯一致(gydF4y2Ba在线补充表2gydF4y2Ba).出院后,新冠肺炎患者被建议继续保持与香港华人日常习惯饮食一致的多样化和标准的中式饮食。gydF4y2Ba
补充材料gydF4y2Ba
对照是在COVID-19大流行之前(2019年9月至2019年11月)通过广告从社区和威尔士亲王医院的内镜中心招募的,受试者进行了正常的结肠镜检查(在肠道准备前收集粪便),收集方案相同。我们选择了年龄和性别匹配、合并症相似和标准饮食模式的对照组,以比较患有和未患有COVID-19感染的受试者之间的肠道菌群组成。对照的人口统计学和共病列于gydF4y2Ba在线补充表3gydF4y2Ba.非covid -19对照的排除标准为(1)过去6个月内使用抗生素;(2)过去3个月有否使用泻药或止泻药;(3)最近的饮食变化(例如,成为素食主义者/纯素食主义者);(4)已知的复杂感染或败血症;(5)已知严重器官衰竭史(包括失代偿性肝硬化、恶性疾病、肾衰竭、癫痫、活动性严重感染、艾滋病);(6)过去6个月内的肠道手术(不包括与肛周疾病相关的结肠镜检查/手术);(7)存在回肠造口/造口;(8)目前怀孕。gydF4y2Ba
补充材料gydF4y2Ba
共收集258份粪便样本并进行测序。所有来自COVID-19患者和对照组的样本同时处理和分析。gydF4y2Ba
这项研究是根据赫尔辛基宣言进行的。所有患者均提供书面知情同意书。该研究获得香港中文大学-新界东集群联合临床研究伦理委员会(CREC参考编号:: 2020.076)。gydF4y2Ba
粪便样本gydF4y2Ba
在入院时、出院后1个月和6个月连续采集粪便样本。住院患者的粪便样本由医院工作人员采集,出院患者在出院后1个月和6个月随访当日提供粪便样本或在家中自行采样,并在收集后24小时内快递至医院。在抗生素治疗前收集基线(入院时收集粪便)样本。所有样品都收集在含有防腐剂介质(猫。63700, Norgen Biotek Corp,加拿大安大略省),并立即储存在−80°C,直至加工。我们之前已经证明,使用这种防腐介质收集的粪便产生的肠道菌群组成数据与立即存储在−80°C的样品获得的数据相当。gydF4y2Ba14gydF4y2Ba
粪便DNA提取和测序gydF4y2Ba
详细的方法在Zuo中有描述gydF4y2Baet al。gydF4y2Ba8gydF4y2Ba将粪便颗粒添加到1 mL十六烷基三甲基溴化铵缓冲液中,旋涡30 s,然后在95°C下加热5 min。之后,用珠粒以最大速度彻底涡旋样品15分钟。然后,在样品中加入40µL蛋白酶K和20µL RNase A,混合物在70°C下孵育10 min。然后在13000离心得到上清液gydF4y2BaggydF4y2Ba5 min后放入Maxwell RSC机进行DNA提取。提取的DNA进行DNA文库构建,采用Nextera DNA Flex文库制备试剂盒(Illumina, San Diego, California, USA),经过末端修复、尾部加A、纯化、PCR扩增等步骤完成。文库随后在香港中文大学微生物研究中心的Illumina NextSeq 550测序仪(150碱基对末端)上进行测序。本研究生成的原始序列数据可在BioProject的序列读取档案中获取:PRJNA714459。gydF4y2Ba
生物信息学gydF4y2Ba
使用Trimmomatic V.39对原始序列数据进行质量过滤,以去除适配器、低质量序列(质量分数<20)、读取短于50个碱基对。使用Kneaddata (V.0.7.2gydF4y2Bahttps://bitbucket.org/biobakery/kneaddata/wiki/HomegydF4y2Ba,参考数据库:GRCh38 p12),默认参数。在此之后,使用MetaPhlAn3版本3.0.5从质量过滤的正向读取中推断出微生物群组成谱。GNU平行gydF4y2Ba15gydF4y2Ba用于并行分析作业,以加速数据处理。Alpha多样性指标(Shannon多样性,Chao1丰富度)使用phyloseq包,版本1.26.0计算。平均丰度和流行率分别小于0.1%和3%的物种被过滤掉。gydF4y2Ba
统计分析和推断肠道菌群组成gydF4y2Ba
连续变量以中位数(IQR)表示,而分类变量以数字(百分比)表示。使用Χ分析亚组间的定性和定量差异gydF4y2Ba2gydF4y2Ba或适用于分类参数的Fisher精确检验和连续参数的Mann‐Whitney检验。利用logistic回归估计95% CI的比值比和调整比值比(aOR),以检查与PACS发生相关的临床参数。将站点按物种计数和相对丰度表输入R V.3.5.1进行统计分析。这里我们应用了微功率,gydF4y2Ba16gydF4y2Ba基于置换多元方差分析(PERMANOVA)的模拟方法进行β-多样性比较,以评估本研究对68例有或没有PACS的患者的影响大小和统计效力。该样本量提供了80%的功率来检测0.015%的效应量(校正的决定系数ω2)和90%的功率来检测ω2=0.006的差异。利用主坐标分析(PCoA)对基于物种水平成分分布的样本进行了聚类分析。使用PERMANOVA评估肠道菌群组成与患者参数之间的相关性。使用线性判别分析效应量和线性模型(MaAsLin2)统计框架的多变量分析,确定特定微生物物种与患者参数的相关性,该统计框架在Huttenhower Lab Galaxy实例中实现(gydF4y2Bahttp://huttenhower.sph.harvard.edu/galaxy/gydF4y2Ba).PCoA, PERMANOVA和Procrustes分析在素食R包V.2.5-7中实现。gydF4y2Ba
结果gydF4y2Ba
急性后COVID-19综合征gydF4y2Ba
在2020年2月1日至8月31日期间,我们从香港三家地区医院招募了106名患者,并对他们进行了6个月的随访。中位年龄为48.3岁(IQR 33-62岁),女性56岁(52.9%)(gydF4y2Ba表1gydF4y2Ba).在患者中,高血压(17%)是最常见的共病,其次是2型糖尿病(15.1%)。大多数患者在住院期间病情轻至中度(81.1%),25例患者(23.6%)在住院期间使用了抗生素。总体而言,86例(81.1%)和81例(76.4%)COVID-19患者在3个月和6个月时报告了PACS。6个月时最常见的症状是疲劳(31.3%)、记忆力差(28.3%)、脱发(21.7%)、焦虑(20.8%)和睡眠困难(20.8%);gydF4y2Ba图1一个gydF4y2Ba).6个月时,有无PACS患者在年龄、性别、合并症、抗生素使用、抗病毒药物使用和COVID-19严重程度方面无显著差异(gydF4y2Ba图1 bgydF4y2Ba,gydF4y2Ba在线补充表4和5gydF4y2Ba,gydF4y2Ba在线补充图1gydF4y2Ba).gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
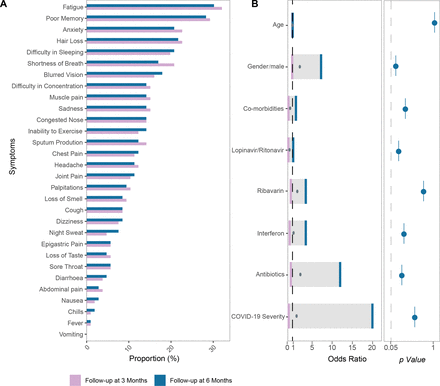
病毒清除后急性COVID-19综合征(PACS)。(A)急性COVID-19后3个月和6个月106例患者30种症状的比例;(B) PACS发展相关因素的多变量分析。中间的圆点表示平均值,方框表示上下四分位范围。gydF4y2Ba
106例COVID-19康复患者临床特征分析gydF4y2Ba
COVID-19患者肠道微生物组成的改变在疾病缓解后持续了6个月gydF4y2Ba
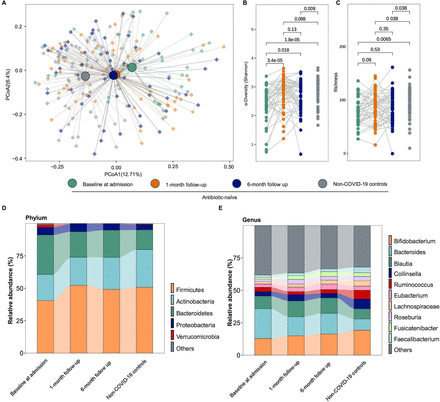
106例COVID-19患者中,68例在入院时采集粪便样本(n=47),随访1个月(n=64)和6个月(n=68)进行肠道菌群分析。在9个月的随访中,还收集了11名患者的粪便样本(gydF4y2Ba在线补充表6gydF4y2Ba).我们首先在随访中检查了COVID-19患者的肠道微生物组组成,没有(gydF4y2Ba图2gydF4y2Ba)或与(gydF4y2Ba在线补充图2gydF4y2Ba)住院期间使用抗生素。未使用抗生素患者6个月时肠道菌群组成仍有明显差异(gydF4y2Ba图2一个gydF4y2Ba), 6个月时细菌多样性(Shannon指数)和Chao1丰富度显著低于非covid -19对照组(gydF4y2Ba图2 b, CgydF4y2Ba).在未使用抗生素的患者中,1个月和6个月的肠道微生物组组成显示出几乎相同的聚类中心(p=0.555,gydF4y2Ba图2一个gydF4y2Ba),但与非covid -19对照样本不同(gydF4y2Ba图2一个gydF4y2Ba,gydF4y2Ba在线补充表7gydF4y2Ba).此外,在疾病缓解后1个月、6个月和9个月分析的样本中,肠道菌群组成稳定(gydF4y2Ba在线补充图3gydF4y2Ba,gydF4y2Ba在线补充表8gydF4y2Ba).我们观察到由前五个门定义的肠道微生物群的失调和异质性(gydF4y2Ba图2 dgydF4y2Ba)以及与非COVID-19对照组相比,初使用抗生素的COVID-19患者在1个月和6个月时最常见的10个属(gydF4y2Ba图2 egydF4y2Ba).成员的相对数量gydF4y2Ba瘤胃球菌属gydF4y2Ba而且gydF4y2Ba双歧杆菌属gydF4y2BaCOVID-19患者显著低于非COVID-19对照组(平均3.02% vs 6.75%,平均16.36% vs 19.22%, p<0.001,曼-惠特尼检验;gydF4y2Ba图2 egydF4y2Ba).gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
SARS-CoV-2阴性患者住院患者(antibiotic-naïve)和非covid -19患者肠道微生物群组成的差异及其随访粪便。(A) COVID-19患者SARS-CoV-2阴性前后与非COVID-19患者肠道菌群组成的主坐标分析(PCoA)。(B)多样性和丰富度(C)病毒清除后1个月和6个月COVID-19患者肠道微生物群的分析。(D) SARS-CoV-2阴性后1个月及6个月以上住院患者粪便中检测到的前5门和前10个微生物属的平均相对丰度(E)。gydF4y2Ba
在随访6个月时检查抗生素的效果时,antibiotic-naïve患者和抗生素治疗患者的整体肠道菌群组成相似(p=0.351, (gydF4y2Ba在线补充图2DgydF4y2Ba).在基线时,antibiotic-naïve和抗生素治疗患者之间的微生物组组成没有显著差异(gydF4y2Ba在线补充图2BgydF4y2Ba),而在随访1个月时,整体肠道菌群组成明显不同(gydF4y2Ba在线补充图2CgydF4y2Ba).患者接受抗生素治疗4 ~ 12天,根据医生的判断,平均为7.89天(IQR 6-11)。我们发现肠道菌群组成与抗生素治疗时间之间没有显著相关性(gydF4y2Ba在线补充图2E,FgydF4y2Ba).这些数据表明,抗生素对COVID-19患者肠道微生物群的影响没有持续超过6个月。gydF4y2Ba
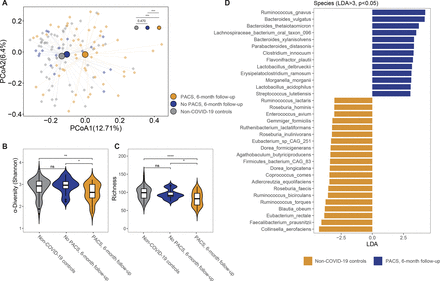
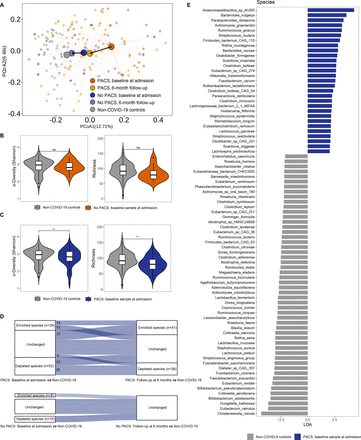
PACS患者有明显的肠道菌群失调gydF4y2Ba
68例COVID-19患者在6个月时进行了粪便样本分析,其中50例(73.5%)患有PACS (gydF4y2Ba在线补充图4gydF4y2Ba).我们检测了病毒载量,发现病毒载量(包括粪便和呼吸道样本)与PACS发展之间没有显著相关性(gydF4y2Ba在线补充图5gydF4y2Ba).在6个月的随访中,我们在有和没有PACS的患者中发现了两个不同的肠道微生物群(gydF4y2Ba图3A及4AgydF4y2Ba, p < 0.05)。没有PACS的患者显示恢复的肠道微生物组与非covid -19对照组相当(gydF4y2Ba图3A及4AgydF4y2Ba, p=0.470),而在6个月时,PACS患者的肠道微生物组组成与非covid -19对照组仍然不同(gydF4y2Ba图3一gydF4y2Ba, p < 0.001)。随访6个月时,PACS患者的细菌多样性和丰富度(分别用Shannon指数多样性和Chao1丰富度指数衡量)明显低于无PACS患者和对照组(gydF4y2Ba图3 b, CgydF4y2Ba).此外,发生PACS的患者入院时肠道微生物菌群的Shannon多样性和丰富度明显低于非covid -19对照组(gydF4y2Ba图4 cgydF4y2Ba),但无PACS患者与对照组之间Shannon多样性和丰度无差异(gydF4y2Ba图4 bgydF4y2Ba).在PACS患者中检测到的肠道细菌种类中,基线和随访样本中有28种细菌减少,14种细菌富集(gydF4y2Ba图4 d, EgydF4y2Ba,gydF4y2Ba在线补充表9和10gydF4y2Ba).在6个月时,PACS患者的心肌梗死水平明显降低gydF4y2Ba空气蚤,普氏弓形虫,大叶苞叶gydF4y2Ba以及更高层次的gydF4y2Ba瘤胃球菌属gnavusgydF4y2Ba而且gydF4y2Ba拟杆菌vulgatusgydF4y2Ba比非covid -19对照组(p<0.05, LefSe >2;gydF4y2Ba图3 dgydF4y2Ba,gydF4y2Ba在线补充表10gydF4y2Ba).无PACS的受试者入院时仅显示25种细菌改变,6个月后完全恢复(gydF4y2Ba图4 dgydF4y2Ba,gydF4y2Ba在线补充表11gydF4y2Ba).据报道,PACS患者表现出多种持续性生化病理生理。我们使用HUMAnN3研究了肠道细菌组的功能改变。通过MaAslin2分析,我们发现PACS患者与非covid -19对照组之间32个MetaCyc通路的相对丰度存在显著差异(p<0.05;gydF4y2Ba在线补充表12gydF4y2Ba).PACS患者的肠道微生物组中尿素循环途径、l -瓜氨酸生物合成途径和l -鸟氨酸生物合成途径的丰度增加Ⅱ途径(gydF4y2Ba在线补充图6gydF4y2Ba,gydF4y2Ba在线补充表12gydF4y2Ba).gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
伴有和不伴有急性后COVID-19综合征(PACS)的COVID-19患者6个月时肠道菌群组成;(A)有和没有PACS的COVID-19患者6个月时肠道菌群组成的主坐标分析(PCoA)。(B)细菌多样性和丰富度。(C)有和没有PACS患者肠道菌群组成的分析。(C) PACS患者6个月时肠道微生物组中鉴别类群的线性判别分析效应量分析。LDA,线性判别分析。gydF4y2Ba
病毒清除后不同时间点基线和随访样本肠道菌群组成的差异(A)在SARS-CoV-2阴性逆转录-定量聚合酶链反应前后,伴有或不伴有COVID-19急性后综合征(PACS)的COVID-19患者与非COVID-19受试者肠道菌群组成的主坐标分析(PCoA)。(B)与非COVID-19受试者相比,COVID-19患者基线时肠道微生物群的多样性和丰富度分析(分别用Simpson多样性和Chao1丰富度指数衡量)。(C)随访6个月时,COVID-19患者与非COVID-19患者肠道菌群的多样性和丰富度分析。(D)有或没有PACS的COVID-19患者在病毒清除后6个月的肠道微生物组成从基线到随访的变化。(E)基线时PACS康复患者肠道微生物组的线性判别分析效应量。gydF4y2Ba
肠道微生物组成反映了PACS患者的不同症状gydF4y2Ba
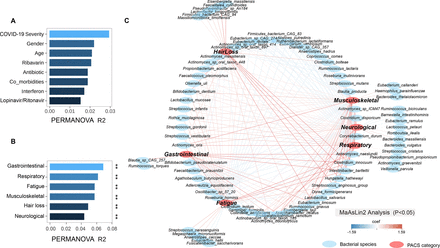
接下来,我们检查了6个月时肠道微生物组的组成及其与不同症状的关系。根据PERMANOVA,肠道成分与住院期间的药物治疗或疾病严重程度无关(gydF4y2Ba图5一个gydF4y2Ba,gydF4y2Ba在线补充表13gydF4y2Ba).我们将PACS的症状分为呼吸系统(咳嗽、痰液、鼻塞/流鼻涕、呼吸短促)、神经精神系统(头痛、头晕、味觉丧失、嗅觉丧失、焦虑、注意力难以集中、睡眠困难、悲伤、记忆力差、视力模糊)、胃肠系统(恶心、腹泻、腹痛、上腹疼痛)、皮肤系统(脱发)、肌肉骨骼系统(关节疼痛、肌肉疼痛)和疲劳。我们使用多元关联线性模型(MaAsLin2)检测单个细菌类群与不同类型症状的相关性。不同的症状与不同的肠道微生物组模式相关(gydF4y2Ba图5 bgydF4y2Ba,gydF4y2Ba在线补充表14gydF4y2Ba).共有81种细菌与不同类型的PACS相关,许多细菌与两类以上的持续性症状相关(gydF4y2Ba图5 cgydF4y2Ba,gydF4y2Ba在线补充表15gydF4y2Ba).在6个月时,持续性呼吸道症状患者的肠道微生物组组成与一些机会致病菌呈正相关,包括gydF4y2Ba心绞痛链球菌,前庭链球菌,戈登链球菌gydF4y2Ba而且gydF4y2Badisporicum梭状芽胞杆菌gydF4y2Ba而大量与机会性感染有关的医院病原体包括gydF4y2Bainnocuum梭状芽胞杆菌gydF4y2Ba而且gydF4y2Ba放线菌naeslundiigydF4y2Ba,与神经精神症状和疲劳相关。产生丁酸盐的物种,例如gydF4y2BaRoseburia inulinivoransgydF4y2Ba而且gydF4y2BaFaecalibacterium prausnitziigydF4y2Ba与非covid -19对照组相比,6个月时持续脱发的患者(n=23)显著减少(p<0.05)。gydF4y2Ba在线补充表16gydF4y2Ba).此外,已知对宿主免疫有益的多种细菌种类的相对丰度包括gydF4y2Ba假atenulatum双歧杆菌,F. prausnitzii, R. inulinivoransgydF4y2Ba而且gydF4y2BaRoseburia hominisgydF4y2Ba6个月时与PACS呈最大负相关(gydF4y2Ba图5 cgydF4y2Ba,gydF4y2Ba在线补充表15和16gydF4y2Ba.gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
补充材料gydF4y2Ba
影响患者清除病毒后随访粪便中肠道微生物群的因素(A)通过置换多元方差分析(PERMANOVA)检验确定受试者元数据对肠道微生物组组成的影响大小。(B)通过PERMANOVA检验确定肠道微生物组组成与急性后COVID-19综合征(PACS)不同亚群之间的总体关联。(C) 6个月时不同种类的PACS与细菌种类的关系。MaAsLin,线性模型的多元关联。gydF4y2Ba
6分钟行走测试常用于确定患者的功能能力。gydF4y2Ba4gydF4y2Ba先前的研究表明,恢复期后微生物丰富度较低的患者肺功能受损,gydF4y2Ba6gydF4y2Ba但COVID-19后步行距离缩短6分钟的原因尚不清楚。在68名COVID-19患者中,他们在6个月的随访中提供了粪便样本,其中52人在6个月时进行了6分钟行走测试评估。有PACS患者6分钟的中位步行距离显著低于无PACS患者(平均382米vs 464米,p<0.001)。gydF4y2Ba在线补充图7AgydF4y2Ba).我们观察到步行距离与致病菌种类的显著负相关(例如,gydF4y2Bainnocuum梭状芽胞杆菌gydF4y2Ba,gydF4y2Babolteae梭状芽胞杆菌gydF4y2Ba)在不同的人群中,它们可能具有致病性或与疾病风险相关gydF4y2Ba17 18gydF4y2Ba(p < 0.05,gydF4y2Ba在线补充图7BgydF4y2Ba).步行距离与肠道微生物组的几种短链脂肪酸和丁酸生产者正相关,包括gydF4y2Ba双歧杆菌pseudocatenulatumgydF4y2Ba,gydF4y2Ba19gydF4y2BaRoseburia inulinivoransgydF4y2Ba20.gydF4y2Ba而且gydF4y2Ba拟杆菌ovatusgydF4y2Ba,gydF4y2Ba21gydF4y2Ba暗示在清除病毒后,人与肠-肺-微生物轴之间的有益共生。gydF4y2Ba
补充材料gydF4y2Ba
入院时肠道菌群组成可预测PACSgydF4y2Ba
我们确定了入院时肠道微生物组是否影响PACS的发展。我们在PACS患者和非PACS患者的入院样本中观察到两种明显不同的细菌群(gydF4y2Ba图6gydF4y2Ba, p < 0.05)。与PACS患者相比,无PACS患者的基线肠道细菌组成丰富了19种细菌,其特征包括属gydF4y2Ba双歧杆菌属gydF4y2Ba,gydF4y2BaBlautiagydF4y2Ba而且gydF4y2Ba拟杆菌gydF4y2Ba(gydF4y2Ba图6 b, CgydF4y2Ba, p<0.05,线性判别分析效应量>2,gydF4y2Ba在线补充表17gydF4y2Ba).入院时,发生PACS的患者肠道细菌的Shannon多样性和丰度明显低于非covid -19对照组(gydF4y2Ba图4 cgydF4y2Ba).总共有13种细菌,包括gydF4y2BaBlautia wexleraegydF4y2Ba而且gydF4y2Ba双歧杆菌longumgydF4y2Ba入院时与6个月时的PACS呈负相关,表明这些物种在SARS-CoV-2感染的恢复中具有假定的保护作用(gydF4y2Ba图6 b, CgydF4y2Ba),而gydF4y2Ba放线菌sp S6 Spd3gydF4y2Ba,gydF4y2Ba放线菌johnsoniigydF4y2Ba而且gydF4y2BaAtopobium parvulumgydF4y2Ba与PACS呈正相关。我们发现细菌种类重叠,比如gydF4y2Ba大鼠鼠,小鼠鼠,丹毒鼠gydF4y2Ba从基线到随访,该指标保持不变,并表现出与几种PACS症状相关,进一步表明肠道微生物组的改变与COVID-19患者的恢复过程之间存在联系(gydF4y2Ba图6 dgydF4y2Ba).这些发现共同表明,入院时个体的肠道微生物组配置可能会影响受试者对COVID-19长期并发症的易感性。gydF4y2Ba
补充材料gydF4y2Ba
COVID-19患者入院6个月时有或无任何持续症状时的肠道菌群组成(A)清除SARS-CoV-2后6个月有或无持续症状的COVID-19患者肠道微生物群组成的主坐标分析(PCoA)。(B)住院期间确诊SARS-CoV-2逆转录-定量聚合酶链反应阳性的首次粪便样本肠道菌群组成。(C) COVID-19康复患者的持续症状与基线微生物特征之间的相关性,由线性模型的多变量相关性确定(p<0.05)。(D)肠道微生物组与急性后COVID-19综合征发展之间的关系示意图。gydF4y2Ba
讨论gydF4y2Ba
据我们所知,这是第一项证明从COVID-19康复后6个月持续肠道生态失调的研究,以及改变的肠道微生物群与常见挥之不去的症状之间的联系。我们的研究在评估急性COVID-19后的持续症状及其与不同COVID-19严重程度(包括轻度疾病)患者肠道微生物群改变的关系方面是新颖的。一个优势是从入院到6个月使用鸟枪宏基因组测序对肠道微生物群进行前瞻性评估,并收集完整的临床数据。在香港,与COVID-19相关的死亡病例很少,研究对象来自三家地区医院,这些医院管理着香港大多数COVID-19患者,因此队列中不太可能存在选择偏差。样本量小是本研究的局限性,我们的发现应在不同人群的更大队列中得到证实。gydF4y2Ba
特定的肠道微生物组与PACS的存在相关,这表明人类肠道微生物组可能在PACS的发展中发挥重要作用。肠道微生物在急性肺损伤中的潜在作用,通过细菌的肠肺易位,gydF4y2Ba22gydF4y2Ba免疫和炎症的调节,gydF4y2Ba23gydF4y2Ba提示在PACS风险分层中基于微生物组的概况的可能性。丰富的多种共生菌有利于宿主免疫,包括gydF4y2BaC.空气faciens, F. prausnitzii, E . rectalegydF4y2Ba而且gydF4y2Bab . obeumgydF4y2Ba与PACS发育呈显著负相关。gydF4y2Baf . prausnitziigydF4y2Ba已知PACS患者中缺失的蛋白具有免疫调节特性,并有助于宿主防御,包括通过抑制NF-kB途径来降低炎症反应,gydF4y2Ba24gydF4y2Ba干扰白介素8合成,抑制白介素8分泌,gydF4y2Ba25gydF4y2Ba而gydF4y2BaBlautia obeumgydF4y2Ba源自属gydF4y2BaBlautiagydF4y2Ba可以起到消炎作用。gydF4y2Ba26日27日gydF4y2Ba不同厚壁菌门细菌在上调或下调小鼠肠道ACE2表达方面具有不同的作用gydF4y2Ba28gydF4y2Ba而且gydF4y2Baf . prausnitziigydF4y2Ba与诱导白细胞介素-10(一种抗炎细胞因子)的能力相关。gydF4y2Ba29gydF4y2Ba此外,一系列产生丁酸盐的细菌的存在与6分钟步行距离测试密切相关,这意味着这些微生物在减少急性感染后的全身并发症方面具有潜在的有益作用。由于呼吸道是COVID-19的主要靶器官,我们发现肠道中的某些链球菌与持续的肺部症状(包括呼吸困难)之间存在关联并不令人惊讶。gydF4y2Ba
我们的数据与先前的研究一致,这些研究报告了从胃肠道、炎症和代谢疾病到神经和呼吸系统疾病的慢性疾病中肠道微生物组的扰动。gydF4y2Ba30.gydF4y2Ba据报道,大约20%的COVID-19幸存者出现脱发。急性COVID-19后出现脱发的患者粪便微生物群的组成减少了产生丁酸盐的物种,如gydF4y2Bar . inulinivoransgydF4y2Ba而且gydF4y2Baf . prausnitzii。gydF4y2Ba丁酸盐之前已被证明对大脑可塑性和功能产生有益的适应,gydF4y2Ba31gydF4y2Ba产生丁酸盐的微生物可以保护宿主免受压力的许多负面影响,包括脱发和类似焦虑的行为。gydF4y2Ba32 33gydF4y2Ba我们对细菌类群及其与特定急性后症状的关系的发现表明,不同的微生物模式可能有助于不同PACS症状的发展。因此,微生物组可以潜在地作为预测特定急性后COVID-19症状发展的代理。gydF4y2Ba
在这项研究中,我们发现多种有益细菌种类的丰度与6个月时PACS的发展之间存在很强的负相关。几个共生体的损失,包括属gydF4y2Ba双歧杆菌gydF4y2Ba,gydF4y2BaRoseburiagydF4y2Ba而且gydF4y2BaFaecalibacteriagydF4y2Ba已知具有免疫调节功能,尤其与COVID-19康复患者的持续症状有关。后两种细菌是重要的短链脂肪酸生产者和维持免疫稳态的主要参与者。这些脂肪酸已被证明可以改变趋化性和吞噬作用,诱导活性氧,改变细胞增殖和功能,并具有抗菌和抗炎作用。虽然观察到的相关性是令人鼓舞的,但本研究的力量可能受到与COVID-19无关但可能影响细菌微生物群的未知因素的限制,包括宿主环境、饮食、生活方式、药物治疗(尽管所有受试者在随访期间没有服用任何抗生素,其共病也没有差异)以及患者对问卷的主观回答可能存在的偏差。由于患者出院后没有重复进行病毒检测,我们无法确定有PACS和没有PACS的患者的病毒活动持续时间。需要进一步的研究来了解微生物调节是否以及如何减轻PACS的负担。需要结合饮食、血清学和免疫学数据的研究,以进一步阐明急性COVID-19感染后持续症状的机制。gydF4y2Ba
总之,肠道微生物组组成的改变与COVID-19患者在清除SARS-CoV-2病毒后长达6个月的持续症状密切相关。考虑到当前大流行期间有数百万人感染,我们的发现为考虑调节微生物群以促进及时恢复和减轻急性后COVID-19综合征的负担提供了强大的动力。gydF4y2Ba
数据可用性声明gydF4y2Ba
数据可以在一个公共的、开放访问的存储库中获得。原始数据存放在NCBI序列读取档案:PRJNA714459的BioProject中。gydF4y2Ba
伦理语句gydF4y2Ba
患者发表同意书gydF4y2Ba
伦理批准gydF4y2Ba
该研究获得香港中文大学-新界东集群联合临床研究伦理委员会(CREC参考编号:: 2020.076)。该研究是根据赫尔辛基宣言和良好临床实践规则进行的。在研究方案得到充分解释后,所有参与者都签署了书面知情同意书。gydF4y2Ba
致谢gydF4y2Ba
我们感谢在中国香港特别行政区威尔士亲王医院和基督教联合医院隔离病房工作的所有医护人员。我们感谢Joey Chan、Lok张Chu、Wenye Xu、Chun Pan张和其他工作人员/学生为这项研究做出的技术贡献,包括样本收集、库存和处理;以及Arthur Chung和Hui Zhan在DNA提取和测序方面的协助。gydF4y2Ba
参考文献gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
- ↵gydF4y2Ba
补充材料gydF4y2Ba
-
补充数据gydF4y2Ba
此网页文件由BMJ出版集团从作者提供的电子文件制作而成,并没有对内容进行编辑。gydF4y2Ba
- 数据补充1gydF4y2Ba
- 数据补充2gydF4y2Ba
- 数据补充3gydF4y2Ba
- 数据补充4gydF4y2Ba
- 数据补充5gydF4y2Ba
- 数据补充6gydF4y2Ba
- 数据补充7gydF4y2Ba
- 数据补充8gydF4y2Ba
- 数据补充9gydF4y2Ba
- 数据补充10gydF4y2Ba
- 数据补充11gydF4y2Ba
- 数据补充12gydF4y2Ba
- 数据补充13gydF4y2Ba
- 数据补充14gydF4y2Ba
- 数据补充15gydF4y2Ba
- 数据补充16gydF4y2Ba
- 数据补充17gydF4y2Ba
- 数据补充18gydF4y2Ba
- 数据补充19gydF4y2Ba
- 数据补充20gydF4y2Ba
- 数据补充21gydF4y2Ba
- 数据补充22gydF4y2Ba
- 数据补充23gydF4y2Ba
- 数据补充24gydF4y2Ba
脚注gydF4y2Ba
推特gydF4y2Ba@wingyanjoycegydF4y2Ba
QL、JWYM和QS的贡献相当。gydF4y2Ba
调整通知gydF4y2Ba这篇文章在Online First发表后已被更正。从属关系已经更新。gydF4y2Ba
贡献者gydF4y2BaQL和JWYM对研究进行了构想和设计,并对数据的完整性和稿件的准备负责。QL和QS进行微生物组分析。QL是本文的担保人。YKY对微生物的重要知识内容进行了批判性的修改。GC-YL和SSSN有助于临床资料的收集。AYLL参与了临床数据的分析。FZ和WL对宏基因组测序有贡献。DS-CH和PC对研究设计做出了贡献。SCN和FKLC为研究设计、指导、指导和稿件撰写做出了贡献。gydF4y2Ba
资金gydF4y2Ba本项目由香港中文大学医学院“肠道微生物组研究”种子基金及中国香港特别行政区政府“InnoHK@Health”资助。gydF4y2Ba
相互竞争的利益gydF4y2Ba没有宣布。gydF4y2Ba
出处和同行评审gydF4y2Ba不是委托;外部同行评审。gydF4y2Ba
补充材料gydF4y2Ba此内容由作者提供。它没有经过BMJ出版集团有限公司(BMJ)的审查,也可能没有经过同行评审。讨论的任何意见或建议仅是作者的意见或建议,不被BMJ认可。BMJ不承担因对内容的任何依赖而产生的所有责任和责任。如果内容包括任何翻译材料,BMJ不保证翻译的准确性和可靠性(包括但不限于当地法规、临床指南、术语、药品名称和药物剂量),并且对因翻译和改编或其他原因引起的任何错误和/或遗漏不负责。gydF4y2Ba
请求的权限gydF4y2Ba
如果您希望重用本文的任何或全部内容,请使用下面的链接,该链接将带您到版权清除中心的RightsLink服务。您将能够快速获得价格和即时许可,以多种不同的方式重用内容。gydF4y2Ba