条文本
摘要
客观的我们评估了法莫替丁是否能改善轻中度COVID-19门诊患者的炎症和症状恢复。
设计随机、双盲、安慰剂对照、完全远程、2期临床试验(NCT04724720)在2021年1月至2021年4月期间从两个美国中心招募确诊COVID-19的有症状的未接种疫苗的成年门诊患者。患者自行服用80 mg法莫替丁(n=28)或安慰剂(n=27),每天口服3次,连续14天。终点是(原发性)或(继发性)症状缓解的时间,以及炎症的缓解(探索性)。
结果意向治疗组55例患者(中位年龄35岁(IQR: 20);女性35人(64%);非裔美国人18人(33%);14名西班牙裔(26%),52名(95%)完成了试验,提交了1358份电子症状调查。到症状缓解的时间没有统计学上的改善(p=0.4)。服用法莫替丁的患者症状缓解率提高(p<0.0001)。估计法莫替丁组在8.2天(95% CI: 7至9.8天)和安慰剂组在11.4天(95% CI: 10.3至12.6天)时,总体基线症状评分降低了50%。差异与患者的性别、种族或民族无关。发生5例自限性不良事件(法莫替丁,n=2 (40%);安慰剂,n=3(60%))。 On day 7, fewer patients on famotidine had detectable interferon alpha plasma levels (p=0.04). Plasma immunoglobulin type G levels to SARS-CoV-2 nucleocapsid core protein were similar between both arms.
结论法莫替丁在轻中度COVID-19门诊患者中安全且耐受性良好。法莫替丁在不降低抗sars - cov -2免疫力的情况下,导致症状和炎症的早期消退。需要进行额外的随机试验。
- 新型冠状病毒肺炎
- 临床试验
- 炎症
- 干扰素
数据可用性声明
如有合理要求,可提供资料。评估i型干扰素反应的基因列表见表S5。
这是一篇根据知识共享署名4.0 (CC BY 4.0)许可发布的开放获取文章,该许可允许其他人出于任何目的复制、再发布、再混合、转换和构建此作品,前提是正确引用原始作品,提供许可链接,并指出是否进行了更改。看到的:https://creativecommons.org/licenses/by/4.0/.
来自Altmetric.com的统计数据
本研究的意义
关于这个问题我们已经知道了什么?
COVID-19是由SARS-CoV-2引起的。
细胞因子释放导致COVID-19患者炎症和预后不良。
法莫替丁是一种组胺2受体拮抗剂,在全球范围内用于减轻胃反流症状和治疗胃溃疡。
在实验室研究中,法莫替丁减少了病毒感染的上皮细胞释放i型干扰素。
在一些回顾性研究和病例系列中,法莫替丁改善了COVID-19患者的预后,但缺乏临床试验的证据。
有什么新发现?
在这项随机、双盲、安慰剂对照的临床试验中,口服法莫替丁是安全且耐受性良好的。
使用法莫替丁治疗轻至中度COVID-19症状的患者症状缓解更快。
法莫替丁诱导COVID-19患者i型干扰素水平的早期消退。
本研究的意义
在可预见的未来,它会对临床实践产生怎样的影响?
较少患者的高密度数据研究可以改善全球更多机构参与临床试验的机会,并且需要更少的资源。
在缺乏有效替代品的情况下,法莫替丁可能被视为治疗有症状的COVID-19门诊患者的一种方法。
需要更多的临床试验,并可能利用本研究产生的知识。
介绍
寻找安全、有效和负担得起的COVID-19治疗方法仍然是全球卫生重点。COVID-19是一种大流行疾病,迄今全球估计有3.19亿例病例和550万例死亡。1为应对COVID-19而采取的限制性公共卫生措施对社会造成了前所未有的负面影响。2
COVID-19是由SARS-CoV-2引起的。3.在进入体内时,SARS-CoV-2与广泛表达的ACE2对接4个5并被内化到细胞中。6 7病毒复制会导致细胞死亡,并影响免疫系统。8toll样受体3 (TLR3)结合病毒双链RNA,导致活化B细胞的核因子kappa轻链增强子定向转录激活i型干扰素和细胞因子的产生。9日10在大多数情况下,由此产生的炎症和适应性免疫系统的激活导致病毒清除,炎症的早期消退和在轻度甚至无症状疾病期后获得性免疫。11然而,有相当一部分患者经历了中度或严重的COVID-19,这是由次优免疫激活或未消除的炎症和免疫过度激活引起的,通常被称为“细胞因子风暴”。10这也许可以解释为什么易患炎症的因素12都是导致COVID-19预后不良的风险因素。13
COVID-19的预防和治疗可分为疫苗接种、抗病毒药物和宿主反应调节剂三类。接种疫苗可以增强免疫系统,降低疾病的严重程度和死亡率,防止疾病的传播。14日15不幸的是,它们的有效性可能会受到病毒变体的影响,如Delta或Omicron。16日17疫苗的吸收受到不一致性、成本以及供应和分配障碍的限制。18类似的因素可能会削弱新兴抗病毒药物的全球影响,这些药物最近在减少具有不良预后风险因素的患者的住院和死亡方面显示出有希望的结果。月19 - 21日在住院患者中,使用抗炎药物和免疫抑制剂可以调节持续的宿主炎症反应。例如,地塞米松降低了住院的COVID-19氧依赖患者的死亡率。22它已被证明可调节严重COVID-19患者的干扰素编程。23在COVID-19门诊患者中,选择性血清素再摄取抑制剂氟伏沙明减少了住院率,但机制尚不清楚。24
法莫替丁是一种广泛可用、安全、低成本的COVID-19候选药物。这种选择性组胺h2受体(H2R)拮抗剂以tlr3依赖的方式减少了sars - cov -2感染上皮细胞中i型干扰素的释放。9在一些住院患者的回顾性队列研究中,法莫替丁作为抗酸剂摄入与改善临床结果相关。25日26日但一些研究没有发现任何影响或负面关联。27在未接种疫苗的中度COVID-19门诊患者的病例系列中,口服法莫替丁80毫克,每天3次,耐受性良好,并与症状和生理迅速改善有关。28因此,法莫替丁经常被开给未住院的COVID-19患者,没有临床试验数据支持生物学或临床疗效。
我们进行了一项随机、双盲、安慰剂对照的2期临床试验,口服法莫替丁(80毫克,每天3次),并深入分析了入组的各种轻度至中度症状的未住院的COVID-19患者。我们设计了一个完全远程的临床试验策略,以减少患者的负担和公众和医护人员的暴露。我们的目的是评估法莫替丁对缓解COVID-19患者症状和炎症的益处。
方法
关于方法的详细资料载于在线补充文件1.
研究设计
这项随机、双盲、安慰剂对照、完全远程的2期临床试验(图1一个)已在美国国立卫生研究院的临床试验数据库(NCT04724720).在获得同意后,为患者提供专用的电子片剂设备,以电子方式提交长达28天的17种症状评分:缺乏精力、呼吸短促、咳嗽、头痛、嗅觉或味觉丧失、食欲不振、呼吸困难、腹泻、喉咙痛、肌肉痛、声音嘶哑、流鼻涕/鼻塞、胸闷、腹痛、恶心、头晕和眼睛不适。每个症状由患者按顺序评分:0=无,1=轻度,2=中度,3=严重。当出现持续的症状缓解时,允许停止每日症状评分。患者还在家中使用电子设备获取并提交每日血氧饱和度、峰值肺活量、体重和体温读数,持续28天。
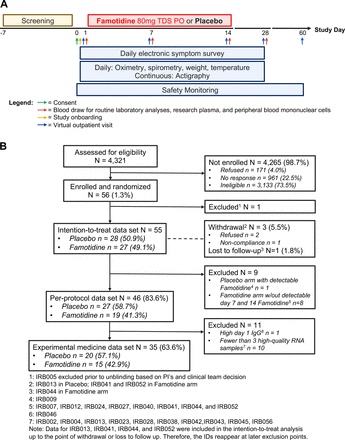
审判的概述。(A)试验示意图和(B) CONSORT图。院校审查委员会;PO, per os,即口服;TDS,一天三次。
从同意后的第一天(第1天)开始,为期14天的研究药物摄入,随后是14天的持续日常监测,并在第60天进行最后的电话安全咨询和症状回顾。
在第1、7、14和28天,由患者住所的流动采血服务采集血液样本和鼻咽拭子。第1天的远程抽血时间安排在患者第一剂研究药物之前。这些抽血用于分离外周血单个核细胞(PBMCs),分析全血细胞计数,并分离血浆进行所有生化、法莫替丁和干扰素α分析。
患者招募和患者
我们筛选并纳入了来自两个美国站点的患者:Northwell Health (NH)和New York City Health and Hospitals Corporation (New York Health+Hospitals或NYCHHC)。从实验室名单、急诊科出院名单(NH)或COVID-19隔离酒店入住名单(NYCHHC)中确定候选人,并由筛查小组成员通过电话或护理人员亲自在酒店与候选人联系(在线补充图S1A).入组患者至少18岁,在随机分组前不到72小时有实验室确诊的COVID-19诊断(RT-PCR),至少有三种中度严重症状,持续1-7天,能够使用电子设备。排除标准为抗sars - cov -2疫苗接种史、接受COVID-19抗体或类固醇治疗、已知自身免疫性疾病(即诊断为类风湿性关节炎、系统性红斑狼疮或类似疾病)、QTc间隔时间延长或肾小球滤过率低于60 mL/min/1.73 m2筛查时怀疑有吞咽困难和法莫替丁摄入。孕妇符合入组条件。
中心随机化、数据存储、试验协调、药物警戒、患者随访和试验监测试剂盒的运送由诺斯韦尔临床研究卫生办公室进行。研究的所有方面均按照《赫尔辛基宣言》进行,包括其所有相关修正案、国际协调会议良好临床实践指南以及纽约州和美国所有相关法律和指令。一名独立监督员审查了所有研究数据。一个独立的数据安全和监测委员会(DSMB)监督招聘、受试者安全和结果。
数据安全
所有患者都有一个唯一的研究ID, IRB001至IRB056,患者报告的数据使用研究ID通过安全数据链接提交,符合1996年健康保险可移植性和责任法案(HIPAA)的方式,到一个安全的数据存储门户。然后在分析之前将数据与完整的REDCap试验数据库相结合。
随机化和掩蔽
我们使用由Northwell临床研究办公室生成的中心区随机化方法,将患者按1:1的比例随机分配到安慰剂或法莫替丁治疗组。按患者性别和研究地点分层。试验参与者、调查人员和试验工作人员在整个研究期间和临床数据分析期间保持盲法。
治疗、一致性和毒性评价
尺寸#000不透明白色胶囊(无明胶胶囊)填充微晶纤维素(Avicel, FMC公司,麦迪逊,威斯康辛州,美国)或法莫替丁80毫克(20毫克tablets×4;由Alchem实验室按照现行的良好生产规范(在线补充图S1B).从第一天开始,患者每天自我服用三粒胶囊,间隔约8小时,持续14天。
为了评估毒性,通过远程医疗会诊对患者进行检查,并监测全血细胞计数、血清肝化学和血清肌酐以及估计的肾小球滤过率。所有结果和不良事件均由盲法首席研究者和盲法临床团队进行审查并采取行动。盲法DSMB审查了所有不良事件,没有遇到需要解除盲法的事件。
统计分析和缺失数据
数据收集于2021年8月30日下载的REDCap数据库和2021年5月12日下载的VitalCare症状调查。对经血浆分析确认法莫替丁摄入的亚组患者,采用意向治疗(ITT)分析和方案分析(PP)分析所有症状相关终点和一般炎症终点。采用SAS V.9.4 (SAS Institute)软件进行统计学分析,显著性水平设为0.05。我们认为数据的缺失是随机的,不会对缺失的数据进行推断。
端点
这些终点是与美国食品和药物管理局密切合作开发的。考虑了使用较少的数据点并比较捕获持续临床恢复的单一终点或使用所有调查提供的每日总症状评分并比较随时间的模拟症状变化的优点和缺点。我们共同决定将这两个症状缓解终点作为主要终点和第一次要终点,这反映了该2期试验在一定程度上旨在为未来的研究确定最有力的终点。
第28天症状缓解的累积发生率
症状缓解的时间定义为从治疗开始到第一次达到症状缓解或最后一次随访,直至第28天,以先发生者为准。症状缓解定义为症状总评分首次≤3分,且连续2天无个体症状评分为>1分。法莫替丁组和安慰剂组采用分层对数秩检验进行比较。29由于所有的测量都是通过一个地点进行监测的,诺斯韦尔健康中心,在模型中只有性别分层,而不是性别和研究地点。
症状评分的相对变化
从第0天到第28天,使用混合随机效应模型评估症状缓解的递减率,假设ln(评分+1)随时间呈线性变化,并将其应用于总体症状评分以满足正态性模型假设。模型中调整的因素包括时间(研究天数)、治疗组和性别。考虑用Toeplitz协方差结构来模拟同一患者纵向测量之间的相关性。选取基于收敛状态和Arkaike信息准则。其他考虑的结构包括复合对称(CS)、异质CS、一阶自回归(AR(1))、异质AR(1)和非结构化。采用治疗组与时间之间的双向相互作用项来模拟每个治疗组的不同变化率。为了探索性别、种族和民族群体之间两个研究组之间的变化率差异是否相似,在线性混合效应模型中进一步检验了相应的三方交互项。
个体症状缓解
在第7天、第14天、第21天和第28天,估计基线(第0天)为>.1的每个个体症状的累积缓解发生率(症状评分连续两天降至≤1)。腹泻症状未包括在本分析中,因为其基线患病率较低,且所有患者在第7天前均无症状。分析方法与主要终点分析相对应。
C反应蛋白(CRP)和铁蛋白水平的相对变化
在第1、7、14和28天检测CRP和铁蛋白水平。低于检测限的值被视为缺失。采用线性混合效应模型比较各治疗组不同时间点的水平。为满足正态性假设,采用对数变换,即ln(level)。模型中调整的因素包括时间(研究天数)、治疗组和性别。时间被视为一个离散变量。使用治疗组与时间之间的相互作用项来估计每个治疗组中铁蛋白随时间的相对变化。基于相似策略,模型中选择的协方差结构为CS。
功率计算
功率计算是基于治疗组和安慰剂组在第28天症状缓解的累积发生率分别为80%和50%的假设。基于这一假设,使用双侧log-rank检验,84例患者将达到92.34%的检测这种差异的能力,i型误差控制在0.05。
血浆法莫替丁水平
采用液相色谱-质谱法和同位素标记内标法测定法莫替丁血浆浓度。
从PBMCs中分离RNA
使用PureLink RNA Mini Kit (Cat. 1)从pbmc中分离RNA。12183025号,赛默飞世尔科技公司,美国马萨诸塞州沃尔瑟姆)。
RNA测序分析
RNA测序文库是在反转录成反链特异性cDNA文库之前通过poly(A)捕获生成的。测序(100 bp,配对端)在NextSeq 2000机器上使用P3试剂盒(Illumina, San Diego, California, USA)进行。读取比对和定量使用nf-core/rnaseq管道V3.0实现。30.简而言之,使用带有STAR的GENCODE v36参考注释将read对齐到GRCh38参考。31和RSEM32用于基因水平的定量。在edgeR中实现基因计数矩阵归一化,以生成m值的修剪平均值(TMM)-每百万表达值的归一化转录本,适用于样本间和样本内分析。33使用已建立的干扰素应答基因集进行单样本基因集富集分析;9在R的基因集变异分析包中实现。34
资金来源和研究设备提供者的作用
资助者和申办者未参与试验设计、数据积累、分析或稿件准备。设备供应商(VitalTech)只参与了患者入职和符合hipaa的数据提交的未识别的原始数据。统计学家和研究调查人员可以使用原始数据。通讯作者拥有所有数据的完全访问权,并对稿件提交负有最终责任。
病人及公众参与
患者或公众未直接参与本研究,包括但不限于试验设计、患者招募、试验进行、数据分析和稿件准备。
数据访问
如有合理要求,可提供累积的纵向症状数据。评估i型干扰素反应的基因列表见在线补充表S5.
结果
在2021年1月至2021年4月期间,56名患者入组(图1 b),并将55名参与者纳入ITT分析(安慰剂n=28;法莫替丁n = 27)。46例患者继续进行PP分析(安慰剂n=27;法莫替丁组n=19), 35例患者有足够数量的高质量RNA和血浆样本用于实验医学/探索性分析(安慰剂组n=20;法莫替丁n = 15)。总体而言,ITT分析中随时间的数据缺失率为9.9%(安慰剂为7.3%;法莫替丁12.8%)和5.6%的PP分析。
表1总结了法莫替丁和安慰剂ITT组患者基线特征的比较。女性患者参加研究的可能性几乎是男性的两倍。研究人群高度多样化,匹配入组的黑人/非裔美国人(33%)、混血儿(22%)和西班牙裔(26%)患者。患者水平中位基线总症状评分(中位±IQR:法莫替丁:18±13;安慰剂:18±10)和随机化前的平均症状持续时间(中位数±IQR:法莫替丁:4±2;安慰剂组(4±3)也密切匹配。大多数患者的生理指标在正常范围内,包括平均血氧饱和度为99%。PP组和实验组的特点(在线补充表S1A、B)与ITT组的结果非常相似。
ITT组55例患者共提交了1358份电子症状调查表(PP组n=1215)。基线时的症状频率(计数得分至少为1的症状)在研究组之间均匀分布(在线补充图S1C,D).患者最常报告的症状是缺乏活力、肌肉疼痛、咳嗽、流鼻涕和呼吸短促。
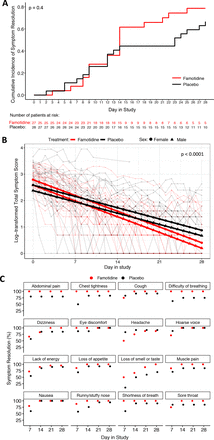
法莫替丁组和安慰剂组患者在ITT和ITT两组中,到研究第28天症状缓解的时间(主要终点)无显著差异(p值=0.4;图2一个)或PP (p值=0.3;在线补充图S2A)分析,尽管从第14天开始,安慰剂组中仍有症状的患者大约是对照组的两倍。
意向治疗症状解决分析。(A)绘制了主要试验终点中定义的两个研究组总症状缓解的累积发生率。法莫替丁组和安慰剂组采用分层log-rank检验进行比较。(B)对数变换后的患者总症状评分(细线)及其基于线性混合效应模型的估计平均值为每个研究组。显示研究中组与日交互期的p值。(C)显示每个研究组在第7天、第14天、第21天和第28天每个个体症状缓解的估计累积发生率。腹泻的结果不包括在内,因为在显示的时间点,两组都没有有症状的患者。所有没有剩余症状患者的时间点显示为100%症状消退。
比较总症状评分的线性变化率,使用患者提交的所有1358个纵向症状评分的数据,显示两组之间的变化模式非常显著不同,法莫替丁组更有利。法莫替丁组ln(评分+1)的估计变化率为- 0.085 (95% CI: - 0.099至- 0.071),安慰剂组为- 0.061 (95% CI: - 0.067至- 0.055)(p<0.0001;图2 b).法莫替丁组达到50%症状缓解的估计时间为8.2天(95% CI: 7至9.8天),安慰剂组为11.4天(95% CI: 10.3至12.6天)。PP分析提供了非常相似的具有统计学意义的结果,支持法莫替丁组(在线补充图S2B).重要的是,进一步的探索性亚组分析显示,两性和所有种族(p=0.6)和种族(p=0.6)亚组在两个研究组之间具有相似的趋势差异,然而,该分析的患者数量很少。在性别分析中,(研究)*(治疗)*(性别)相互作用项的天数显示男性患者的获益大于男性患者(p=0.07)。
法莫替丁对早期症状缓解的影响以个体症状水平为次要终点。排除腹泻症状,因为其基线患病率低,所有患者在第7天前无症状。总的来说,使用法莫替丁的患者16种症状中有14种症状缓解(87.5%),而使用安慰剂的患者16种症状中有2种症状缓解(12.5%)。图2 c,在线补充表S2A).PP分析也得到了类似的结果(在线补充图S2C,表S2B).其中,法莫替丁与较早出现精力不足、嗅觉或味觉丧失、呼吸困难、胸闷和肌肉疼痛有关,而服用安慰剂的患者较早出现头痛症状,这是法莫替丁的已知副作用。
接下来我们评估了法莫替丁的安全性。未观察到严重的不良反应。在28天的研究期间,5名患者分别发生了5起可能与药物相关的不良事件。两名患者,每组一名,肝功能血清标志物轻度升高。法莫替丁组1例患者恶心呕吐1天,停药24小时后缓解,重新用药后未复发。在安慰剂组中,一名患者出现轻度血小板减少症,另一名患者出现8天无痒荨麻疹。所有这些事件都是自发解决的,并通过中断研究药物进行管理。我们观察到11例患者中性粒细胞减少(中性粒细胞计数<1500/µL)。在法莫替丁组中,所有3例在第1天出现中性粒细胞减少的患者在第7天中性粒细胞计数正常;在安慰剂组中,在第1天出现中性粒细胞减少的8名患者中有3名在以后的时间点仍保持中性粒细胞减少。
在临床结果和替代结果方面,两组研究均未发生死亡、住院,因此也没有患者入住重症监护病房。在研究期间,急诊科对症状性缺氧的一次评估发生在安慰剂组。大多数实验室测量值在正常范围内。CRP (在线补充表S3).然而,在ITT分析中,与安慰剂组的第1天相比,铁蛋白在第7天显著升高(+21%;P =0.008),但法莫替丁组差异较小且无统计学意义(+13%;p = 0.09) (表2).与第1天相比,两组患者在第28天的铁蛋白含量均有统计学意义的降低(33%;两组P <0.001)。PP分析的效应量相似(在线补充表S4).
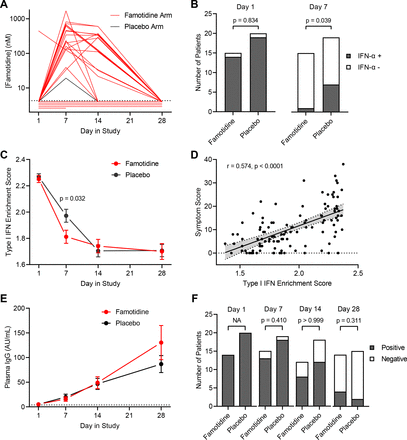
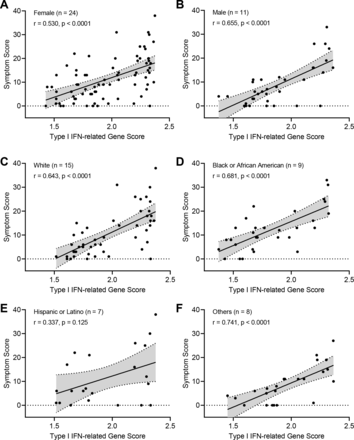
为了检验法莫替丁在实验药物组中的生物学效应,我们使用质谱法测定治疗期间血浆法莫替丁水平和pbmc的RNA可用性(图1B和3A).法莫替丁组中有5例患者血浆法莫替丁未检测到,表明可能未坚持服药;而安慰剂组的一名患者在第7天的血浆法莫替丁水平较小但明显,可能是由于非处方使用法莫替丁。法莫替丁组患者血浆法莫替丁浓度范围为0.02 ~ 1.69µM (IQR=0.13 ~ 0.57µM)。这些水平与每天口服三次法莫替丁80mg的药代动力学一致,并且由于与药物摄入和法莫替丁的消除半衰期(4小时)相关的流动放血时间的变化,采样间隔范围很宽。35在研究第1天,两个研究组的大多数患者血浆中可检测到α干扰素水平,但法莫替丁组第7天血浆中可检测到α干扰素的患者明显减少(p=0.039;图3 b).为了正交验证这一发现,我们对患者pbmc进行了RNA测序,并计算了包含29个基因的i型干扰素基因评分(在线补充表S5),服用法莫替丁的患者在第7天显著降低(p=0.032;图3 c).2 '−5 '寡聚腺苷酸合成酶(OAS1-3)是i型干扰素的重要第二信使,在服用法莫替丁的患者的第7天转录水平也显著降低(在线补充图S3).i型干扰素评分与总症状评分相关,提示患者报告的症状严重程度与持续的干扰素介导的炎症有关(图3 d对女性、男性、白人、黑人、西班牙裔和其他人群的观察(图4).为探讨法莫替丁对适应性免疫的影响,定量测定了SARS-CoV-2核衣壳核心蛋白(图3 e)和通过RT-PCR检测深鼻拭子病毒RNA清除病毒(图3 f),发现两个研究组之间没有显著差异。
法莫替丁对炎症和免疫的影响。(A)法莫替丁组和安慰剂组的纵向血浆法莫替丁水平显示。(B)显示了试验第1天和第7天每组血浆中可检测到干扰素α水平的受试者人数。χ统计比较2测试。(C)第1,7,14和28天外周血单核细胞(PBMCs)表达的i型干扰素应答基因的富集评分。(D)评估i型干扰素症状评分与富集评分的相关性。统计学比较采用Spearman秩分析法。(E)绘制每个研究组第1、7、14和28天对SARS-CoV-2核心蛋白反应的g类免疫球蛋白水平(平均值和平均值的SE)。(F)显示了每个试验组在第1、7、14和28天从鼻拭子中提取rt - pcr可检测到病毒RNA的研究参与者人数。IFN:干扰素,IgG: G型免疫球蛋白。
患者分类水平上症状评分与ⅰ型干扰素信号相关性分析。(A-F)评估适应症组患者i型干扰素症状评分与富集评分的相关性。显示每组的患者计数。患者能够自我分配到一个以上的种族/民族组,因此C-F组的总患者人数大于35人,即试验中实验医学部分的患者总数。统计学比较采用Spearman秩分析法。干扰素:干扰素。
讨论
这项随机、双盲、安慰剂对照的2期临床试验研究了轻度至中度COVID-19患者口服法莫替丁(80毫克,每天3次)14天的效果。与临床前机制工作一致,9我们发现法莫替丁导致i型干扰素升高的早期解决,而不降低抗病毒免疫。法莫替丁改善了16个评估症状中的14个的缓解,并导致症状恢复率的统计学显著增加。
我们的研究有局限性。虽然所选择的症状缓解的主要终点未达到统计阈值,但该分析显示,安慰剂组从第14天起仍有症状的患者是对照组的两倍。此外,我们研究的大多数患者,通过生理和标准实验室测量,只有轻微的疾病。后续研究可能应该集中在疾病严重程度中等或症状恶化的患者身上。在我们的试验中,年龄超过65岁或超过55岁且有合并症的患者接受抗体治疗,这反过来导致被排除在本研究之外。此外,我们的患者在研究之前或研究期间没有接种SARS-CoV-2疫苗,也没有感染目前导致大多数全球病例的SARS-CoV-2变体。然而,与疫苗接种或抗病毒治疗相关的研究结果相比,我们的结果可能受病毒变异出现的影响较小,与突破性感染患者的相关性更大17个36因为有证据表明法莫替丁针对的是宿主而不是病毒。9 37
在临床试验中,数据集的力量是研究设计中的一个重要考虑因素,它不仅仅是基于入组患者的数量。使用患者罕见事件作为终点的研究,例如轻至中重度COVID-19患者的住院或死亡,需要大量患者来产生少量终点相关事件。24我们获得并使用了大量的纵向数据38从每个病人那里。因此,来自55名患者的1358个数据点被用于症状评分模型的变化率,以检查两组的差异。在操作上,使用来自更少患者的更多数据意味着更多的机构可以独立参与治疗假设检验。我们的工作表明,包括获取生物样本在内的完全远程试验可以在较短的时间内以合理的成本(估计总成本< 150万美元)交付。在一项完全远程、双盲、安慰剂对照试验中,我们将药理学证实的治疗一致性与药物诱导的炎症消退和患者报告的症状的生物学读数相结合。这可能是未来COVID-19和其他疾病早期临床试验的模板。事实上,我们发现症状评分和炎症评分之间存在普遍的强相关性,这表明可以使用患者报告的纵向结果测量和线性混合模型来评估治疗效果,从而进行信息丰富的COVID-19治疗试验。这是纳入资源较少的医疗保健系统的相关考虑因素。如果使用我们的研究范式,全球分布的研究小组可以测试更多的治疗方法。研究还可以扩展到患者较少的重要群体,例如孕妇和儿科患者,这些患者通常没有得到包括COVID-19在内的临床试验的覆盖。 For example, evidence-based treatment options for pregnant women with COVID-19 and for the COVID-19-induced multisystem inflammatory syndrome in children are needed, and famotidine is safe during pregnancy and in children though doses will need to be optimised.35
我们的研究还有其他优势。法莫替丁是一种安全、低成本、可广泛获得的药物,具有良好的耐受性和最小的已知药物-药物相互作用35这已经被全世界数以百万计的病人接受了。这些特征是相关的,因为在未住院的患者中,为防止一次严重事件而需要治疗的人数很高。因此,治疗应该具有最小的风险、副作用和成本。考虑到来自不同背景的均衡患者群体,包括非洲裔美国人和西班牙裔患者,他们患COVID-19的不良后果的风险更高,我们的研究结果应该可以很好地推广。13我们还注意到,安慰剂组的患者仍有较高的症状风险,这表明法莫替丁可能用于预防长期COVID-19。事实上,持续的炎症对病毒性疾病可能是有害的39H2R阻断的生物效应很可能是可转移的。
根据机械实验室研究,9H2R的阻断导致血浆中干扰素α水平升高的可检测的早期恢复,可能是通过调节器官组织的炎症。在与covid -19无关的临床研究中,干扰素α与铁蛋白上调有关。40 41因此,在本研究的安慰剂组中,铁蛋白在第7天的较大增加可以用一个机制序列来解释。铁蛋白已被认为是COVID-19的生物标志物42并可用于未来的法莫替丁试验。
本研究通过测定血浆法莫替丁水平收集了重要信息。测量的治疗一致性为76%,与其他门诊试验保持一致。43安慰剂组的一名患者检测到法莫替丁水平,可能是由于无意中摄入了非处方法莫替丁。由于研究设计,即使用血浆法莫替丁水平来识别PP群体,因此PP组中安慰剂组的退出率小于法莫替丁组。血浆法莫替丁水平大多高于法莫替丁介导的H2R阻断的IC50水平(0.039µM)。44因此,每天口服三次法莫替丁80mg可能实现持续的H2R阻断。相比之下,大剂量给药其他H2R受体拮抗剂,如西咪替丁,可能不会导致充分的H2R阻断。9也许可以解释为什么回顾性队列研究没有发现阶级效应。
i型干扰素应答在COVID-19中具有双重作用,需要仔细考虑i型干扰素释放的慢性性。23日45初始升高对有效免疫至关重要46个47先天性i型干扰素免疫或抗干扰素α抗体错误的患者患严重COVID-19的风险更高。48 49这些结果表明,如果预防性地服用高剂量法莫替丁,即在开始抗病毒免疫之前服用,概念上存在风险。用于治疗反流的法莫替丁以每天10-40毫克的低剂量服用,这可能不足以抑制抗病毒i型干扰素反应。这也许可以解释为什么在一些回顾性队列研究中发现法莫替丁可以有效降低死亡、插管或严重并发症的HR。25日26日但在其他国家却不是这样。27另一方面,持续的α干扰素升高导致非感染组织的损伤和更差的临床结果。50在SARS-CoV和MERS-CoV感染的小鼠模型中,干扰素反应延迟与更严重的症状和较差的预后相关。51 52同样,在患者中,延迟给药吸入干扰素α与临床结果恶化有关。53总之,这些发现提示了一种模式,即在症状出现后和干扰素反应对控制病毒血症至关重要的时间窗口之外给予大剂量法莫替丁治疗,可以在不增加住院或死亡风险的情况下改善结果。未来的研究应包括对延迟发病的有症状疾病患者,即在症状出现前7天以上PCR检测呈阳性的患者开始给予法莫替丁。
法莫替丁可能仍然是一种用于治疗COVID-19的药物,无论是由医生开处方还是由患者自行服用。我们的发现可能支持法莫替丁的使用,因为我们表明法莫替丁耐受性良好,并且在不损害免疫力的情况下加速症状和炎症的消退。我们承认,进一步的研究和临床试验仍然是一个优先事项。
数据可用性声明
如有合理要求,可提供资料。评估i型干扰素反应的基因列表见表S5。
伦理语句
患者同意发表
伦理批准
该研究涉及人类参与者,并已获得Northwell卫生机构审查委员会IRB#: 20-1155的批准。参与者在参加研究前给予知情同意。
致谢
我们非常感谢所有参与的患者。我们感谢所有为试验的建立和实施做出贡献的卫生保健工作者和同事。感谢三位同行审稿人提供的建设性意见。Hallie Kassan和Laurence Epstein博士、David Bernstein博士、Kent Kwoh博士和Paul Christos博士作为DSMB的成员提供了独立的审查。NYCHHC的Christine Flaherty和Mitchell Katz博士;NH的Emma Grace Lao、Randolph DiLorenzo博士和David Battinelli博士;冷泉港实验室(CSHL)的Michael Wigler博士和Bruce Stillman博士提供了研究支持和建议。李晓宁博士在从石溪大学辞职前提供了统计支持。Edward Williams博士和Simon tavar
参考文献
补充材料
-
补充数据
这个仅限网络的文件由BMJ出版集团从作者提供的电子文件中制作而成,并没有为内容进行编辑。
脚注
推特@taeh00nha
CMB、SN和XZ贡献相同。
DAT和KJT贡献相同。
贡献者TJ是主要研究者,设计试验,领导试验管理,监督数据分析,撰写手稿,并担任担保人。JY是试验首席统计学家,参与了试验设计,监督了研究报告的编写,参与了手稿的编写,是试验管理小组的成员。XZhan参与了统计分析、研究报告、试验数据分析、插图和总结。TH对统计分析有贡献。CMB、SN、RJD、HA、MER、JC和TJ有助于患者筛查、入组和研究护理。SN是同意的医生。ECvG协助试验设计。JC负责药物警戒。CMB、SN、RJD、NJ-M、SP、CBS、SSF、MGR、CP、JBP、GG、JMC、JC、JRM、JY、DAT、KJT、TJ参与试运行。CMB和TJ准备了提交给监管机构批准的意见书。 XZhao, BRD, SOK, MF, NM, SG, JBP, ASHC and TJ performed and analysed the experimental medicine part of the study. DAT and TJ secured funding. All authors read, edited and approved the final manuscript.
资金感谢潘兴广场基金会、Emergent Ventures Fast Grant和Dr Lee MacCormick Edwards慈善基金会的资助。NH、NYCHHC和CSHL承诺为研究提供资源。这项工作是在CSHL质谱和CSHL功能基因组学共享资源的帮助下完成的,由癌症中心支持基金5P30CA045508支持。以下奖学金由作者确认:SOK: CSHL Starr百年奖学金(编号:N/A);MF: La Caixa基金会奖学金(ID 100010434)和MRC CU研究奖学金(奖励编号:N/A);KJT: NIH支持,R35GM118182-06。
相互竞争的利益没有宣布。
出处和同行评审不是委托;外部同行评审。
补充材料本内容由作者提供。它没有经过英国医学杂志出版集团有限公司(BMJ)的审查,也可能没有经过同行评审。讨论的任何意见或建议仅仅是作者的意见或建议,不被BMJ认可。BMJ不承担所有的责任和责任,因为任何依赖放置在内容上。如果内容包含任何翻译材料,BMJ不保证翻译的准确性和可靠性(包括但不限于当地法规,临床指南,术语,药物名称和药物剂量),并且不对翻译和改编或其他方式引起的任何错误和/或遗漏负责。
请求的权限
如果您希望重用这篇文章的任何或全部,请使用下面的链接,这将带您到版权清算中心的RightsLink服务。您将能够得到一个快速的价格和即时许可,以许多不同的方式重用的内容。