摘要
Follistatin-like 1 (FSTL1)是一种在发育和疾病过程中表达变化的分泌糖蛋白,主要表现在心血管疾病、癌症和关节炎等疾病中。过去几年,FSTL1的心脏保护作用得到了广泛的研究,但其作用机制仍不清楚。FSTL1参与多种信号通路和生物过程,包括血管化和免疫反应的调节,这一特征使其研究复杂化。与DIP2A、TLR4和BMP受体的结合已被证实,但可能存在其他分子伙伴。在癌症进展和类风湿性关节炎期间,关于FSTL1的增殖、凋亡、迁移和炎症作用的数据已经被报道。这一争议可能在于FSTL1广泛的转录后调控。在灵长类动物中,FSTL1初级转录本也编码一个microRNA (miR-198), 3'UTR中存在多个microRNA结合位点。FSTL1蛋白和miR-198之间的表达转换是肿瘤转移和伤口愈合的重要调节因子。FSTL1的糖基化状态是心肌细胞生物活性的决定因素,在心肌细胞中,糖基化形式促进增殖,非糖基化工作抗凋亡。此外,糖基化状态表现出物种和组织之间的差异,这可能是体外研究中观察到的差异的基础。 Finally, regulation at the level of protein secretion has been described.
简介
Follistatin-like 1 (FSTL1)是分泌蛋白中的一种糖蛋白,富含半胱氨酸(SPARC)家族。在文献中,FSTL1有许多不同的名称[1].两组独立发现了FSTL1,并将其命名为(I)转化生长因子(TFG)-β诱导克隆36 (TSC36),从小鼠成骨细胞分离[2和(II)大鼠胶质瘤分泌的卵泡他汀相关蛋白(FRP) [3.].FSTL1由一个分泌信号、一个Follistatin-和一个Kazal-like结构域、两个EF-hand结构域和一个von Willebrand因子C型结构域(http://www.uniprot.org/uniprot/Q12841).人(Genbank: Q12841, 308 Aa)与小鼠(Genbank: Q62356;306个Aa)蛋白序列显示,分泌信号(人:Aa 1-20,小鼠:Aa 1-18)是最具物种多样性的,而其余272个Aa具有非常高的相似性(94.4%)。在小鼠Fstl1序列中,存在3个n -糖基化的潜在位点和2个o -糖基化的潜在位点,体外研究表明,只有3个天冬氨酸残基Asp142, Asp173和Asp178N-glycosylated。此外,这些位点的糖基化表现出细胞类型的特异性[4].人血浆n -糖蛋白组分析仅发现一种糖化形式的FSTL1175和Asp180)所使用的三个地点[5].从泌胃开始,Fstl1 mRNA在整个小鼠胚胎中广泛表达,在妊娠末期,其表达仅限于大多数组织的间充质成分[6].在成年小鼠中,Fstl1 mRNA的最高水平出现在心脏、肺和皮下白色脂肪组织中[7].有趣的是,在包括心血管疾病在内的各种疾病中,FSTL1的表达随着其水平和模式的变化而变化[8,9,10,11,12,13,14,15,癌症进展[16,17,18,19,20.,21,22],以及系统性自身免疫疾病[23,24,25,26].对超过60,000人的外显子体的分析显示,功能丧失不耐受的估计概率为0.96 (http://exac.broadinstitute.org/gene/ENSG00000163430),反映在纯合子的功能缺失突变从未被观察到,杂合子的功能缺失突变只在35个个体中被描述过。与此相一致的是,研究发现小鼠Fstl1的功能中断会导致呼吸窘迫和出生后数小时内死亡。基因敲除小鼠显示的表型似乎表明FSTL1在BMP信号中具有重要的抑制作用[27,28].多个TGFβ超家族受体以及椎间盘相互作用蛋白2同源物A (DIP2A)已被证明与FSTL1相互作用[28,29,30.].然而,使用其他转基因模型,FSTL1已涉及多种信号通路,其在疾病中的作用尚不清楚[1].最近,一项关于FSTL1在心脏再生中的作用的研究表明,根据该蛋白翻译后修饰的不同,其对心肌细胞增殖和细胞凋亡的保护作用不同[13,为之前看似矛盾的数据的解释开辟了一个新的视角。此外,转录后调控在该蛋白的表达中起着重要作用[31],并在FSTL1 mRNA的3'UTR中发现了多个功能性mirna结合位点[24,32,33].因此,我们对报道FSTL1在发育和疾病中的各种作用的研究进行了综述,同时试图澄清有时相互矛盾的结果。
心血管系统
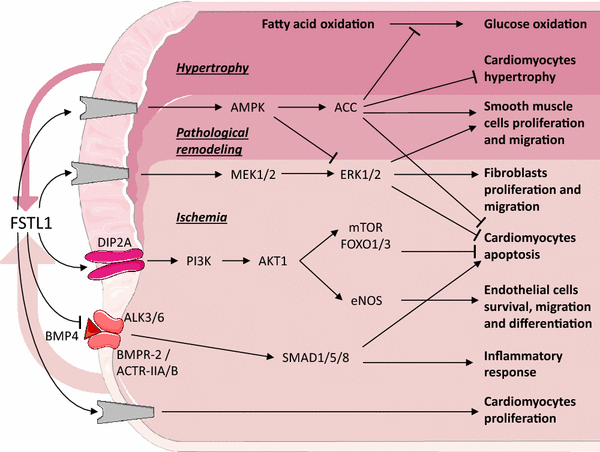
心血管疾病(CVD),如心力衰竭(HF)和冠状动脉疾病,是一组影响心脏和血管的疾病。心血管疾病是西方国家的主要死亡原因[34].为了清晰起见,我们在下面的文本中附带了一个摘要图(图。1).
Follistatin-like 1在心血管疾病中的作用心血管疾病中与FSTL1相互作用的已知信号通路示意图。灰色成分表示未知受体。彩色箭头表示分泌的Fstl1(宽度与数量相关)。彩色区域定义了不同的条件。
临床意义
在人类中,FSTL1在心脏和血管疾病(如心衰)期间循环浓度增加[9,35], HF与保留射血分数(HFpEF) [15],急性冠状动脉综合症[36],以及慢性阻塞性肺疾病[37].在ACS患者中,血清中FSTL1水平的升高与死亡率相关[36].此外,研究发现循环血液中FSTL1的水平与慢性心衰的严重程度相关[35,38].尽管FSTL1对HF的预后值为负,但研究发现,接受左心室辅助装置(LVAD)联合药物治疗的终末期HF患者,在LVAD植入时FSTL1水平较高,出现了射血分数的恢复和恢复[9].这一发现表明FSTL1可以作为药物开发的治疗靶点,FSTL1的血清浓度可以作为CVD的预后生物标志物[35,39].
心脏发展
RNA-Seq数据(https://www.ncbi.nlm.nih.gov/gene/11167)表明FSTL1 mRNA在成人心脏中有表达,但尚未建立其表达模式。然而,免疫组化数据显示,FSTL1存在于心肌内血管的血管内皮细胞和较大血管的平滑肌细胞中,在心肌细胞中含量较低但显著[9].此外,FSTL1在人心脏发育过程中的表达模式仍有待建立。在小鼠和鸡的早期发育过程中,Fstl1在整个心脏中表达,随后主要限于非心肌成分的表达,在心肌细胞中表达量较低[6,40].小鼠中Fstl1纯合子缺失导致新生儿心脏整体增大[27].这种增大是由于心肌细胞的增生还是肥大尚不清楚,目前正在进行评估。
心肌梗死
在心肌梗死(MI)期间,流向部分心肌的血液被中断,导致局部缺血,而长时间的缺血导致心肌细胞死亡[41].死亡的心肌细胞引发炎症反应,随后是一个修复过程,导致非肌肉瘢痕组织的形成,从而降低心脏收缩力和输出量[42].
永久性阻断左前降支(LAD)诱发小鼠心肌梗塞后,Fstl1在心脏中短暂高表达,尤其是在缺血区。心肌梗死后1周,Fstl1的mRNA表达达到最高水平,心肌梗死后1个月,Fstl1在心脏远端区恢复正常,而在梗死区,Fstl1的mRNA表达水平持续较低[10,14].非心肌细胞已被证明是心脏中Fstl1的主要来源,在心肌细胞中也可检测到低水平的Fstl1 [13,14].由于Fstl1主要在缺血区表达,血清水平似乎反映了梗死面积的大小。这也可能是观察到的ACS患者中FSTL1水平升高与死亡率之间的相关性的基础[36].然而,作为FSTL1来源的其他器官也不能排除。在心肌梗死后的愈合过程中,心外膜作为信号分子的来源发挥着重要作用,并向梗死区提供细胞[10,43].Fstl1在覆盖梗死组织的心外膜和填充梗死瘢痕的衍生间充质细胞中短暂表达[10,13].
在永久性和短暂性LAD结扎小鼠模型中,通过重组腺病毒在肝脏中过表达Fstl1来评估局部产生和循环的Fstl1蛋白对存活和再生有积极作用,从而显著减小梗死面积[8,13].为了研究FSTL1的有益作用,大肠杆菌产生的人FSTL1在小鼠模型中静脉给药或诱导缺血或再灌注后;为了验证其在大型动物身上的治疗效果,一个猪模型在缺血后的前10分钟内经历了45分钟的缺血和24小时的再灌注和冠状动脉内给药FSTL1。在两种模型中,FSTL1可减少缺血损伤并改善再灌注后的心脏性能[11].将胶原蛋白贴片应用于梗死心脏可以改善恢复,当贴片富含心外膜来源的培养基或细菌产生的重组FSTL1蛋白时,恢复效果会进一步提高。添加细菌产生的FSTL1可显著减少梗死面积,从而增加心肌梗死后的生存率[13].在猪中,在缺血/再灌注1周后将含有FSTL1的胶原蛋白贴片应用于心室也被发现能促进再生反应[13].在培养的新生大鼠心肌细胞(NRCM)中,重组蛋白通过(I) MEK1/2(丝裂原激活蛋白激酶)和ERK1/2(细胞外信号调节激酶)信号通路,(II) DIP2A、PI3K(磷酸肌醇3激酶)和AKT1 (rac - α丝氨酸/苏氨酸蛋白激酶)途径,通过激活下游效应子mTOR和FOXO1/3,减少缺氧/再氧诱导的细胞凋亡[8,44和(III) AMPK (amp激活蛋白激酶)磷酸化,以及间接通过(IV)抑制bmp -诱导的细胞凋亡和(V)减少促炎细胞因子表达[11].有趣的是,在Wei及其同事的研究中观察到细菌和真核产生的FSTL1之间的效果差异[13].应该注意的是,细菌产生的蛋白质不糖基化,而真核产生的蛋白质是糖基化的。非糖基化的FSTL1增加了NRCM的增殖,而糖基化的蛋白,与之前的报道一致[8,11],保护NRCM不受过氧化物酶诱导的细胞凋亡[13].体外实验表明,糖基化FSTL1通过ERK1/2磷酸化促进成纤维细胞增殖和迁移[14].删除Fstl1使用S100A4-Cre小鼠系的部分成纤维细胞群体的心脏功能与对照组相比没有影响。然而,在心肌梗死诱导后,急性期(即心肌梗死后的头7天)内死于心脏破裂的小鼠数量从野生型的25%翻了一番,增至50%Fstl1废弃的动物。尽管心肌成纤维细胞数量减少,细胞外基质蛋白的合成和成熟减少,但心功能分析未发现任何显著差异[14],表明最初的补救反应被废除。
心脏肥大
心脏肥厚的特征是由于个别心肌细胞体积增加而导致心壁异常增厚[45].
小鼠横主动脉缩窄(TAC)后Fstl1表达上调,导致压力超载诱导肥大[12]或通过醛固酮输注引起高血压诱发的HFpEF [15].在这两种模型中,心肌细胞是Fstl1的主要来源[12,15].用Sf9昆虫细胞中产生的重组糖基化人FSTL1处理成年大鼠心肌细胞,可以消除醛固酮刺激诱导的蛋白质合成和Nppa(也称为ANF或ANP)表达的增加,这表明FSTL1可以防止心肌细胞的肥厚。在HFpEF小鼠中,通过腺病毒传递介导的肝脏中过表达的循环Fstl1水平升高,显著减少心肌细胞肥大并改善心功能[15].特定的删除Fstl1使用α肌球蛋白重链(αMHC) -Cre小鼠系的心肌细胞,与对照窝鼠相比,没有显示出结构或功能上的差异[12,15].然而,当这些小鼠受到TAC刺激时,心肌肥厚增强,心室功能下降[12].另一方面,当这些小鼠接受非肾部切除并连续4周注射醛固酮时,HFpEF发生[15].有趣的是,在后一种模型中,Fstl1在HFpEF发展中的作用独立于心脏纤维化的变化,但在心脏肥厚的发展中至关重要[15].体外实验表明,Fstl1对心肌细胞肥大的抑制作用是由AMPK和乙酰辅酶a羧化酶(ACC)磷酸化介导的[12].
在心脏病发作期间,心肌细胞的能量消耗由脂肪酸转变为葡萄糖[46].当狗的快速起搏引起心力衰竭时,也观察到这种代谢开关。单剂量或长期(14天)输注糖基化人FSTL1 (CHO细胞)治疗这些狗抑制了从脂肪酸氧化到葡萄糖氧化的病理转变。这种作用是短暂的,因为在血液中清除FSTL1后,葡萄糖的消耗增加,脂肪酸的消耗减少。此外,AMPK抑制剂的输注中和了FSTL1的作用[47].
血管系统
在之前提到的一些关于心肌梗死和心肌肥厚的研究中,小鼠也显示出Fstl1的促血管生成作用,但其潜在机制未被研究[12,13,14].在小鼠缺血后肢模型中也发现了类似的促血管生成作用,发现在骨骼肌细胞中诱导Fstl1表达[48].在后者小鼠模型中发现腺病毒介导的Fstl1过表达可刺激血运重建。有趣的是,腺病毒介导的Fstl1在非缺血性肌肉中过表达并没有改变其血管化。在该后肢缺血模型中,发现糖基化Fstl1通过磷脂酰肌醇-3激酶(PI3K)、AKT和内皮一氧化氮合酶(eNOS)激活促进内皮细胞存活、迁移并分化为血管网络样结构[48].当时,传递细胞外Fstl1信号到细胞内的受体尚不清楚,但最近,DIP2A被确定为PI3K和AKT1磷酸化上游的潜在细胞表面受体[44].有趣的是,在肺动脉高压期间的平滑肌细胞(SMCs)中观察到FSTL1的相反作用[37]和血管损伤[49,50].在后两个模型中,FSTL1阻止了病理性血管重构,这是通过诱导AMPK和抑制ERK磷酸化介导的SMC增殖和迁移减少的结果[37,49,50].对HUVEC细胞的研究表明,FSTL1影响血管内皮细胞极化,但不影响迁移和管的形成[51].
二尖瓣病
二尖瓣疾病是全世界发病率、心力衰竭和死亡的主要原因[52].删除Fstl1从内皮/心内膜谱系使用Tie2-Cre小鼠系导致二尖瓣功能障碍、HFpEF和死亡[53].功能障碍的二尖瓣叶变长变厚,提示心内膜向间质转变时间延长导致瓣细胞增殖增强和间质细胞形成,瓣增大本身可能是由于TGF-β和BMP信号增强。是否观察到HFpEF的发展是删除的直接后果Fstl1或二尖瓣功能失调性的二次效应或增强的TGF-β和BMP信号,尚不清楚[53].在这一点上需要注意的是,在一项全基因组关联研究的meta分析中,没有发现FSTL1,该研究识别出23个位点,具有与人类二尖瓣脱垂相关的暗示证据[54].
总之
FSTL1是一种具有保护和再生能力的分泌糖蛋白,在CVD过程中循环浓度增加。在健康动物模型中,Fstl1过表达或低表达(低形态或杂合子的KO)是可以容忍的,而在病理条件下,额外的Fstl1可以防止广泛的心脏损伤和异常的血管重构。缺乏Fstl1会加剧心脏损伤。最重要的是,Fstl1以细胞类型特异性的方式影响多种途径,根据蛋白质的糖基化状态观察到不同的影响。这些结果表明,FSTL1可能不仅仅是一种生物标志物,而且可能是开发CVD新疗法的一个有趣的候选者。
癌症和肿瘤
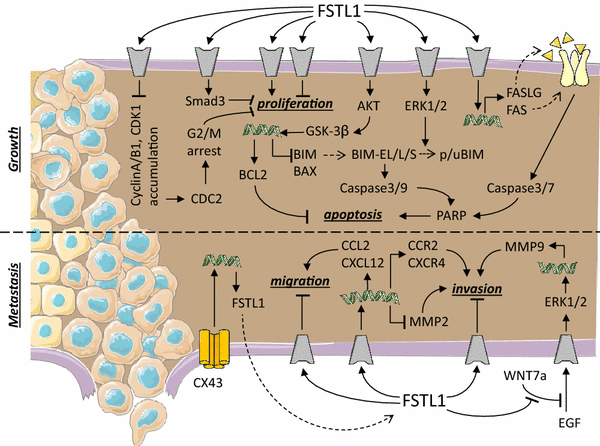
癌症的特征是由基因变化引起的生长调节失衡。当癌细胞不转移到周围组织时,这种肿瘤被称为良性肿瘤。当癌细胞获得迁移的附加属性,允许它们入侵其他组织时,它们就变成恶性细胞,这被称为转移。如果不及时治疗,肿瘤转移是癌症患者死亡的主要原因[1,55,56].为了清晰起见,我们在下面的文本中附带了一个摘要图(图。2).
Follistatin-like 1在癌症和肿瘤中的作用。在癌症生长和转移过程中与FSTL1相互作用的已知信号通路示意图。灰色成分表示未知受体。螺旋结构代表基因表达。虚线箭头表示从mRNA到蛋白质的转译。虚线分隔了不同的过程:肿瘤生长和转移。
临床意义
与健康组织相比,在各种类型癌症的活检中发现FSTL1的表达水平降低,如前列腺癌[16],卵巢,子宫内膜[19],肾脏[20.,21,57]、鼻咽癌[22]及肺腺癌[58].在子宫内膜和卵巢肿瘤中,观察到较差的预后特征与FSTL1水平下降之间的趋势[19].在透明细胞肾细胞癌(ccRCC)中,高水平的FSTL1表达与良好的术后生存相关(危险比= 0.325;p= 0.030)。使用逆转录病毒介导的短发夹RNA在ccRCC细胞系中敲除FSTL1导致锚地独立生长和侵袭。进一步分析表明,FSTL1的肿瘤抑制功能是通过抑制NF-κB和HIF-2α信号通路介导的[57].此外,与这些新发现相一致的是FSTL1与其表达下调相关的基因与肾细胞癌风险增加和预后不良相关[21].有趣的是,在鼻咽癌(NPC)细胞系和肿瘤活检中,FSTL1 mRNA水平的降低与近端启动子CpG岛的高甲基化相关(−166到+ 332 bp),也与致瘤性增加相关。使用去甲基化剂恢复FSTL1 mRNA水平降低了肿瘤的致瘤性。鼻咽癌肿瘤中Fstl1表达水平的降低反映在Fstl1血清水平的降低上[22].肺腺癌患者中FSTL1表达水平低,预后价值较差(危险比= 2.09;p= 0.022),但未观察到FSTL1表达与鳞状细胞癌生存率之间的相关性[58].
另一方面,与健康对照组织相比,在脑癌细胞中观察到FSTL1表达增加[18,在成纤维细胞中,但在结肠肿瘤的上皮细胞中没有[59],用于去势复发性前列腺癌[60],在大多数肝细胞癌(HCC)的病例中[61]、头颈部鳞状细胞癌(HNSCC) [62],以及食管鳞状细胞癌[63].与原发性乳腺癌相比,FSTL1在转移性脑瘤中表达更高[64].FSTL1在正常脑组织和II级或III级胶质瘤的弥漫性浸润星形胶质细胞中表达水平未达可检测水平,但在IV级胶质瘤(称为胶质母细胞瘤)中表达水平较高[18].研究发现FSTL1的水平与星形细胞瘤的恶性程度相关,其与p53的共表达具有负面的预后价值[18].在HCC中,高水平的FSTL1与较大的肿瘤、晚期肿瘤/淋巴结/转移(TNM)分期、转移和较差的术后预后相关(危险比= 1.84;p= 0.015) [61].在鼻咽癌和ESCC患者中,高水平的Fstl1与较低的生存前景相关[62,63].
大多数来自人类肿瘤的细胞系表达的FSTL1水平低于永生化的非成瘤性成纤维细胞[65].使用ras、myc或fos等致癌基因体外转染成纤维细胞(小鼠NIH3T3和大鼠208F)可诱导成肿瘤表型并下调Fstl1表达,提示其具有肿瘤抑制作用[2,65,66].对具有不同表现型侵袭性的人类癌细胞系的比较显示出相反的结果:前列腺癌细胞系LNCaP的FSTL1表达水平低于更具侵袭性的C4-2变体[17],而侵袭性较低的非小细胞肺癌(NSCLC)细胞的FSTL1平均表达水平高于恶性程度较高的小细胞肺癌(SCLC)细胞[67].然而,在腺癌或鳞状癌的NSCL细胞系中观察到FSTL1表达水平的高度变异性。
总之,关于FSTL1表达水平及其在不同肿瘤中的作用的数据从生长抑制或诱导、从侵袭性到静止性都有很大的差异。因此,FSTL1的表达水平应谨慎对待,而不是与特定的表型相关。
肿瘤生长
关于肿瘤生长的不平衡,在体外操纵细胞系中FSTL1表达水平的结果也有相互矛盾的报道。
转染肺非小细胞肺癌细胞系(PC-14和H446) [58,67,68],卵巢,子宫内膜[19], NPC [22],以及乳癌[64含有FSTL1的细胞系通过一种未知的信号通路降低了它们的生长速率。在卵巢或子宫内膜细胞中过表达FSTL1也被发现通过死亡受体启动途径增加凋亡率。在这些细胞中,Fas细胞表面死亡受体(Fas或第一凋亡信号受体)及其配体(FASLG) mRNA的增加导致裂解(激活)PARP、Caspase-3和Caspase-7的增加[19].ccRCC中FSTL1的下调[57和乳腺癌[64细胞促进增殖。Smad2/3的磷酸化是介导FSTL1抑制增殖的途径之一[64].在裸鼠体内注射稳定转染FSTL1的鼻咽癌细胞,与未转染的细胞相比,肿瘤发生率相似。然而,与对照细胞相比,转染fstl1的鼻咽癌细胞的肿瘤生长速度较低[22].在非小细胞肺癌中观察到类似的体内结果;当FSTL1在CL1-5细胞系中过表达时,肿瘤生长受到抑制;当FSTL1在CL1-0细胞系中表达下调时,肿瘤生长得到促进[58].
使用siRNA降低人NSCLC细胞系(NCI-H460和A549)中FSTL1的水平可诱导细胞周期蛋白的积累,如细胞周期蛋白A、细胞周期蛋白B1、CDK1和磷酸化的CDC2,并导致G2/M阻滞[69].在同一研究中,也报道了细胞凋亡增加。凋亡的增加是由ERK1/2磷酸化水平的降低、剪切(激活)Caspase-3、Caspase-9和PARP的增加以及促凋亡因子BIM-EL的积累介导的[69].FSTL1在人肝细胞癌(Huh7)细胞系中过表达可促进其增殖,从而抑制细胞凋亡。研究发现,抑制凋亡是激活AKT/GSK-3β信号的结果,其结果是抗凋亡蛋白BCL-2增加,促凋亡蛋白BIM和BAX减少[61].在ESCC细胞(KYSE-150)中也报道了类似的结果,FSTL1对bmp信号通路的抑制作用和化学耐药可以被证明[63].小鼠MC3T3成骨细胞前体细胞中FSTL1的过表达[65或大鼠208F成纤维细胞[66],而不影响细胞形态和增殖。尽管在鳞状细胞癌(SCC12)细胞系中FSTL1的下调在体外不影响增殖率,但在裸鼠体内注入FSTL1后,它们会形成更大的肿瘤[62].
转移
肺内FSTL1过表达(PC-14系和H446) [67,68],卵巢,子宫内膜[19],或NPC [22细胞系不仅降低了它们的增殖能力,还降低了它们迁移和入侵侧翼组织的能力。这种迁移能力的降低伴随着金属蛋白酶-2 (MMP-2)表达的减少[19,66].与这些结果一致的是,ccRCC细胞中FSTL1的下调被证明会导致迁移能力和组织侵袭能力的降低[57].
利用siRNA下调人黑色素瘤细胞中FSTL1的表达,会抑制与迁移相关的基因的表达,如CCL2和CXCL12,以及与骨转移形成相关的基因的表达,如CCR2和CXCR4 [70].与这些观察结果一致,用重组糖基化FSTL1刺激这些黑素瘤细胞诱导其迁移能力和分化为骨表型。与转移型乳腺癌细胞MDA-MB-231相比,FSTL1在乳腺癌细胞系MDA-MB-231中的表达也较低[64].体内研究进一步表明,与注射对照siRNA相比,将FSTL1 siRNA注射到皮下肿瘤中抑制肿瘤生长和骨转移的形成,提高小鼠存活率[70].FSTL1在ESCC细胞(KYSE-150)中过表达促进了肿瘤的生长和转移。体外分析显示炎症(图。3.)和上皮-间质转化过程受到FSTL1的强烈影响[57,63].最近一项关于FSTL1转移效应的研究表明,FSTL1特异性地与WNT7a相互作用,并拮抗其对内皮生长因子介导的ERK磷酸化的抑制作用,进而诱导MMP9的表达[62,这是细胞迁移的先决条件。Connexin-43在肺巨细胞癌中过表达抑制其转移能力。添加抗FSTL1蛋白的抗体可逆转这种抑制作用[71].这些观察结果需要谨慎对待,因为它们可能指向调控细胞入侵的两个独立信号通路。
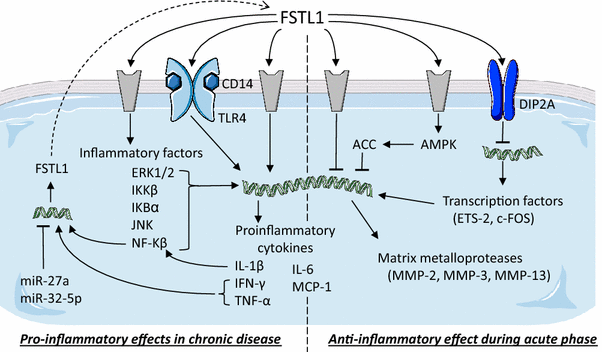
Follistatin-like 1在免疫疾病中的作用炎症过程中与FSTL1相互作用的已知信号通路示意图。灰色成分表示未知受体。螺旋结构代表基因表达。虚线箭头表示从mRNA到蛋白质的转译。虚线将FSTL1的两种相反的作用分开:促进作用和抗炎作用。
总之
由于不同细胞系和癌症的异质性以及肿瘤发展的多种机制的复杂性,我们对FSTL1在癌症发展和进展中的作用的认识仍然是碎片化和有限的。产瘤细胞系的起源似乎是FSTL1作用不同(有时相反)的主要决定因素。
免疫疾病
免疫系统是组织、细胞和过程的集合,在受到有机体、外来细胞和毒素的入侵时,免疫系统提供特定的反应来保护机体。免疫系统各部分功能障碍常导致免疫功能紊乱。系统性自身免疫性疾病(SADs)是一种疾病特有的自身免疫导致正常组织功能丧失或破坏的疾病。FSTL1在炎症过程中的作用已经在几个模型中进行了研究,据报道其既具有促炎作用又具有抗炎作用。为了清晰起见,我们在下面的文本中附带了一个摘要图(图。3.).
临床意义
在许多SADs中发现高浓度的FSTL1,如类风湿关节炎(RA) [23,24],特别是全身发作的幼年风湿性关节炎[25],骨关节炎[26,以及Sjögren 's综合征[23].RA患者滑膜组织高水平表达FSTL1,与疾病的临床和血清学参数呈正相关[72].在RA患者的血清中,针对FSTL1的抗体出现的频率(30%)高于其他SADs,如系统性硬化症(17%),系统性红斑狼疮(10%)和Sjögren综合征(10%)。在OA或多发性肌炎/皮肌炎患者或健康对照组中未发现FSTL1抗体[73].除了RA中FSTL1的血清水平升高外,迄今未发现FSTL1的多态性与RA易感性有关[74],表明FSTL1过表达是RA的结果而不是原因。
川崎病患者表现为全身血管炎症。与对照组相比,川崎病急性期患者血浆FSTL1水平明显升高。在静脉注射免疫球蛋白治疗后,FSTL1水平随着时间的推移缓慢下降[75].有趣的是,FSTL1水平与发生冠状动脉动脉瘤的高风险相关[75],这是发病率和死亡率的主要原因[76].
腰椎间盘突出症(LDH)是一种影响脊柱的医学疾病,它是指椎间盘外纤维环的破裂,使中间部分的软部分凸出受损的外环以外,引起炎症。与脊柱侧凸患者和健康对照组相比,LDH患者的血清FSTL1水平更高,并与视觉模拟量表上的疼痛量相关[77].
关节炎
为了评估FSTL1在关节炎中的作用,使用了两种不同的动物模型,结果产生了明显矛盾的效果。在胶原诱导关节炎(CIA)模型中,小鼠经皮内注射完全弗氏佐剂和牛II型胶原蛋白乳剂免疫,21天后给予强化或二次免疫[78];在该小鼠模型中,FSTL1被发现促进炎症。在抗II型胶原蛋白抗体诱导关节炎(CAIA)模型中,小鼠腹腔内注射针对II型胶原蛋白的单克隆抗体鸡尾酒,72 h后注射内毒素(LPS) [79];在这个急性破坏性关节炎模型中,FSTL1被发现具有抗炎作用。在这两种关节炎模型中报道的不同效果可能是由于疾病发展和FSTL1评估治疗潜力的差异;在CIA模型中,腺病毒介导的小鼠Fstl1 (Ad-mFstl1)过表达,在CAIA模型中,给予重组的非糖基化Fstl1。
Fstl1通常在滑膜中表达,但在CIA早期,Fstl1在侵蚀骨边缘的成纤维细胞和间充质系细胞中高度过表达,包括骨细胞、软骨细胞和脂肪细胞,但在造血系细胞中不表达,如巨噬细胞、中性粒细胞或T细胞[25,80,81].Ad-mFstl1增加了促炎细胞因子IFN-γ、肿瘤坏死因子α (TNF-α)、白细胞介素-1β (IL-1β)和6 (IL-6)的分泌,导致滑膜炎(滑膜炎症)的诱导,滑膜和周围组织的炎症细胞浸润。体外和体内实验均显示IL-1β通过NF-κB诱导Fstl1表达[82],提示炎症反应与Fstl1表达之间存在正反馈。在CIA小鼠中,Ad-mFstl1加重关节炎的严重程度,而抗mfstl1 IgG则中和内源性Fstl1并降低疾病的严重程度[81,82].通过CD14-TLR4途径介导的类似促炎作用,也在由转基因t细胞传递Fstl1的CIA小鼠中发现[83].此外,研究发现FSTL1具有物种特异性:重组人蛋白(HEK293和HT-1080)可诱导RA患者滑液细胞中IL-6的表达,但不能诱导小鼠NIH-3T3细胞表达,反之亦然[83].有趣的是,小鼠和人类的蛋白质非常相似(94.4%),尽管效果差异可能在于这个微小的差异,但也许,两种蛋白质不同的糖基化状态在决定其观察到的生物活性方面起着主要作用。
在CAIA小鼠模型中,在关节炎的早期阶段观察到Fstl1表达的增加。在这个模式中,管理大肠杆菌重组人FSTL1显示抗破坏和抗炎作用,减少滑膜细胞浸润和保留软骨蛋白多糖。用FSTL1处理滑膜细胞和关节会导致转录因子c-Fos和Ets-2以及下游基质金属蛋白酶,如Mmp-3的下调[84,85].与这些观察结果一致的是,当细胞用从小鼠或RA患者获得的针对FSTL1的抗体处理时,观察到这些基因的上调[84,85].有趣的是,与健康对照组相比,RA患者中c-FOS和ETS-2的表达水平都更高[86].体外实验表明,FSTL1结合DIP2A受体介导c-FOS的下调[84].奇怪的是,在骨髓来源的巨噬细胞分化为破骨细胞的过程中,Fstl1诱导c-Fos的转录[87],表明Fstl1在正常发育和病理条件下发挥着不同的作用。在CAIA模型中,与CIA模型一样,IL-6的表达减少[85],但需要注意的是,在CAIA小鼠模型中,IL-6与关节炎的进展无关[88].
促炎效应
在细菌诱导的脓毒性休克小鼠模型中,内毒素(LPS)给药后脚垫诱导Fstl1和IL-1β的表达。在对照组小鼠和转基因小鼠中Fstl1经他莫昔芬治疗后,IL-1β仍然很低或检测不到[89].FSTL1在培养的单核细胞和巨噬细胞中或在感染性休克小鼠模型中过表达诱导caspase-1和NLRP3(核苷酸结合域富含亮氨酸重复序列(NLR)家族,pyrin结构域含有3)的表达,证实FSTL1介导促炎事件[89].在培养的脂肪细胞、巨噬细胞和髓核细胞中,FSTL1的促炎作用是通过信号级联IKKβ、IκBα、NF-κB、JNK和ERK1/2介导的,从而诱导IL-1β、IL-6、TNF-α、MCP(单核细胞趋化蛋白)-1、COX(环氧合酶)-2、MMP-13和iNOS(诱导氮氧化物合酶)的表达[22,77,87,90].此外,TNF-α刺激髓核细胞可诱导FSTL1分泌[77],再次表明炎症反应存在正反馈循环。用糖基化重组FSTL1治疗骨髓来源的巨噬细胞能以剂量依赖性的方式增加细胞增殖[87].在一起。这些数据表明,FSTL1不仅通过诱导细胞因子的产生,还通过诱导炎症细胞的增殖来促进炎症。
抗炎效果
使用低形态小鼠模型观察Fstl1表达水平的降低,发现对肾脏中促炎细胞因子(如TNF-α、IL-6和IL-1β)的水平没有影响[91].然而,在肾损伤小鼠模型中,循环的Fstl1似乎调节免疫反应:在顺铂肾毒性模型中,Fstl1抑制促炎细胞因子的合成,如IL-1β [91在肾次全切除模型中,Fstl1降低TNF-α、IL-6和MCP-1(单核细胞趋化蛋白-1)的表达[92].体外人体系膜细胞实验表明,这种抗炎作用是由AMPK的磷酸化和乙酰辅酶a羧化酶(ACC)的激活介导的[92].
在心血管损伤时,给药Sf9昆虫细胞中产生的重组糖基化人FSTL1可以减少促炎细胞因子的表达。NRCM和巨噬细胞的体外研究表明,这种炎症反应是通过(I)诱导AMPK磷酸化和下游ACC激活介导的,(II)通过抑制BMP4信号通路介导的,BMP4信号通路通过pSmad1/5/8增加TNF-α和IL-6的表达[11].小鼠股动脉结扎后,使用肌肌酸激酶(MCK) -Cre小鼠系删除来自肌肉细胞的Fstl1表达,炎症反应增强。促炎细胞因子TNF-α、IL-1β和MCP-1的表达以及单核细胞和巨噬细胞浸润的增加证明了这一点[50].
在宿主抗移植物病中,FSTL1也被发现发挥作用。FSTL1的上游形态形成因子TGF-β在异体移植物耐受性中发挥核心作用[2,93].与此一致的是,FSTL1已被证明在心脏移植后的供者特异性输血中被诱导,可能是CD8浸润的结果+T细胞。值得注意的是,T细胞的浸润与手术引起的炎症反应无关。静脉注射表达FSTL1的腺病毒可降低促炎细胞因子(IL-17A、IL-6和IFN-γ)的表达,延长移植患者的生存期[93].在癌症进展过程中也观察到类似的作用,其中FSTL1在免疫功能障碍调节胸腺细胞成熟中发挥重要作用:体内抑制FSTL1会增加肿瘤特异性CD8+t细胞反应[70].
总之
FSTL1在炎症过程中被观察到具有双重功能,在急性期作为抗炎因子,但在长期和慢性疾病中具有促炎作用。这可能是由于不同信号通路的激活:最初,FSTL1结合DIP2A受体,通过下调转录因子c-FOS和ETS-2,阻止mmp对组织的降解;随后,FSTL1通过TLR4/CD14通路、AMPK通路的激活、bmp信号通路的抑制等途径激活炎症反应。但也不能排除在调控过程中还涉及到额外的内生或外生因素。
其他疾病中的FSTL1
纤维化
纤维化是指在反应和/或修复过程中,器官或组织中形成过多的结缔组织。与健康组织相比,在特发性肺纤维化患者和博莱霉素诱导的肺损伤等小鼠模型中,FSTL1表达增加[94,95,96CCl),4单侧输尿管梗阻后的肝损伤和肾损伤[97].Haplodeficiency的Fstl1或使用siRNA降低Fstl1的表达会导致肺和肝损伤中胶原蛋白积累的减少[95,97].对纤维化的影响最可能是由于FSTL1破坏了TGF-β/BMP的平衡,因为FSTL1能够抑制smad1 /5/8介导的BMP4信号通路,并通过Smad2/3介导的TGF-β1信号通路刺激FSTL1的表达[28,95].在肾切除术过程中,腺病毒介导的循环Fstl1过表达减少了肾脏纤维化的形成和纤维化标志物的表达,如TGF-β1、胶原- i、胶原- iii和结缔组织生长因子[92].需要注意的是,与最初的研究不同,在最初的研究中,小鼠在诱导纤维化1-2周后分析[95,97,之后的研究分析了术后2个月的小鼠[92].这种对纤维化发展的相反作用与免疫疾病的研究一致,在免疫疾病的急性或慢性阶段,FSTL1也显示出相反的作用。
肺部发育与哮喘
在小鼠发育和成年小鼠中,Fstl1 mRNA在肺间充质细胞、血管和气道平滑肌细胞、气道上皮杯状细胞和内皮细胞中表达[6,98].一旦Fstl1的功能中断,新生儿会因呼吸窘迫而死亡,表现为气管软化、发育不良和气管软骨环缺失。在肺组织内,发现肺泡壁增厚和空气腔减少。此外,成熟表面活性剂蛋白的水平降低,似乎损害了气道上皮细胞的分化[27,28].
哮喘是一种慢性呼吸道疾病,其特征是气道炎症、气道重构和高反应性。哮喘患者痰液蛋白组学分析显示,FSTL1是表达量最高的蛋白之一[99].哮喘患者死后肺的组织学分析显示肺泡巨噬细胞中FSTL1的表达[One hundred.].此外,与健康对照组相比,哮喘患者血浆和支气管肺泡灌洗液中FSTL1水平升高[101].FSTL1浓度与肺功能参数呈负相关,与气道重塑标志物呈正相关。有趣的是,在吸入皮质类固醇和长效β受体激动剂治疗和/或口服白三烯受体拮抗剂治疗1个月后,血浆FSTL1水平显著下降并恢复到对照水平[101].与此同时,长期而非急性受过敏原刺激的小鼠显示Fstl1表达增加[One hundred.].Haplodeficiency的Fstl1[102]或删除Fstl1从巨噬细胞/髓系细胞使用Lys-Cre小鼠系[One hundred.减少炎症(图。3.)和ova挑战小鼠的气道重建,而当小鼠使用重组糖基化FSTL1治疗时,观察到相反的效果,尽管在本研究中,尚不清楚使用的是人蛋白还是小鼠蛋白[One hundred.].Fstl1在慢性而非急性哮喘小鼠模型中的表达增加与先前报道的结果一致,表明Fstl1在关节炎的急性和慢性炎症中发挥不同的作用[One hundred.].
自噬和上皮-间质转化是两个相关的生物学过程[103].通过电镜分析和自噬生物标记物(Beclin-1和微管相关蛋白1A/ 1b轻链3)发现,重组FSTL1蛋白刺激的人支气管上皮细胞系16HBE中自噬体的形成增加。这些细胞的FSTL1刺激诱导E-cadherin表达切换到N-cadherin表达,指向内皮向间质转变。有趣的是,当这些细胞也被自噬抑制剂处理时,不仅自噬,而且内皮到间质的转变也被减弱[102].
肥胖
研究发现,血清FSTL1水平与体重指数相关,超重和肥胖受试者的FSTL1水平高于对照组[90].在前脂肪细胞(3T3-L1)向脂肪细胞分化过程中,Fstl1表现为短暂的短量高表达,随后在mRNA和蛋白水平上下调至背景水平[7,104].无论是通过阻止Fstl1表达的初始峰值,还是通过在诱导脂肪形成过程中保持培养液中Fstl1的高水平,3T3-L1细胞的分化被阻断[104].两种不同的机制已经被确认与Fstl1表达的调控直接相关。最近发现Fstl1的分泌是通过纤毛调节的。当3T3-L1前脂肪细胞中纤毛发生所必需的基因BBS4或IFT88被敲除时,Fstl1 mRNA和蛋白水平下调,细胞无法进行正确的脂肪发生[104].
第二种机制与3T3-L1细胞向脂肪细胞分化过程中促炎细胞因子IL-6、IL-8和MCP-1的下调有关[90].在3T3-L1脂肪细胞中加入tnf - α可诱导其去分化,并伴有Fstl1 mRNA和蛋白的重新表达[7以及促炎细胞因子的上调[90].促炎细胞因子和抗炎细胞因子比例的变化被认为是肥胖中观察到的慢性炎症的基础,而慢性炎症会导致胰岛素抵抗和其他肥胖相关疾病[105].这与在关节炎中报道的影响非常相似,指出FSTL1在调节促炎细胞因子和抗炎细胞因子平衡中的作用。
另一种尚未探索的替代机制可能是通过微RNA (miRNA)调节。与脂肪细胞的分化一样,在体外C2C12成肌细胞的肌形成过程中也观察到类似的Fstl1下调。在成肌细胞中,Fstl1 mRNA的下调受肌肉特异性miR-206的调控[32].此外,据报道,在脂肪形成过程中,microRNAs调节基因表达水平[106],当扫描FSTLl1的3'UTR,寻找microRNAs的潜在结合位点时,可以找到候选的mirna结合位点(补充表1)。
中枢神经系统
在小鼠发育过程中,Fstl1在中枢神经系统的所有组成部分都有局部表达[107,并参与径向胶质支架的形成[108].在背根神经节中,Fstl1参与维持身体感觉的正常阈值:它由传入轴突分泌,并激活Na的α1亚基+K+- atp酶,抑制突触传递。神经缺失Fstl1使用Nav1.8-Cre小鼠引起宽动态范围神经元和痛觉神经元超敏反应[109].
FSTL1和microRNAs
MicroRNAs (miRNAs)是短(~ 22nt)内源性非编码RNA,可调节信使RNA (mRNA)降解和/或翻译抑制[110].一些研究强调了miRNA和miRNA结合位点在人类疾病中的相关性[111].miR-198编码于人FSTL1初级转录本的3'UTR中[112].因此,FSTL1 mRNA不仅编码FSTL1蛋白,还编码miRNA。尽管FSTL1蛋白在从蜱虫到人类的进化过程中高度保守[29],编码的miRNA只在灵长类动物中发现。此外,在硅胶分析中发现在FSTL1 mRNA的3'UTR中有多个mirna结合位点,其中三个位点已经进行了功能分析(miR-206 [32, miR-32-5p [33和miR-27a [24)(表1).在补充表1中列出了人类FSTL1 3'UTR中与临床相关的mirna结合位点的预测列表。
在正常健康的人体表皮中,FSTL1 mRNA表达,但该蛋白存在于低到几乎无法检测到的水平。与此相反,miR-198在该组织中表达。在伤口愈合过程中,观察到miR-198向FSTL1蛋白表达的转换,而FSTL1 mRNA水平没有变化。TGF-β1通过kh型剪接调节蛋白(KHSRP)间接调控这一开关。在愈合的皮肤中,FSTL1蛋白在再上皮形成过程中促进角质形成细胞的迁移。有趣的是,在糖尿病患者的慢性溃疡伤口中,未观察到FSTL1蛋白表达[113].在头颈部鳞状细胞癌中观察到FSTL1与miR-198比值的失调,其中FSTL1蛋白持续存在,并具有上述后果[62].MiR-198也参与抑制结直肠癌的生长[114]和肺腺癌A549细胞增殖[115],但FSTL1与miR-198在该癌症类型中的关系尚未得到研究。
MiR-206是骨骼肌发生过程中表达最丰富的miRNAs之一[116].在鸡中,FSTL1(也称为Flik)的表达在胚胎肌组形成过程中被下调,这表明FSTL1在肌肉发生过程中发挥了作用[117];然而,FSTL1在这一过程中的作用尚未被研究。Tapscott组发现骨骼肌细胞分化由转录因子MyoD协调,FSTL1表达减少[118].这一过程似乎是由miR-206的诱导介导的,miR-206与FSTL1 mRNA的3'UTR结合[32].
在分枝杆菌感染过程中,miR-32-5p负调控炎症反应[119并促进被感染巨噬细胞的存活。MiR-32-5p与降低FSTL1 mRNA和蛋白水平的3'UTR结合(图。3.).FSTL1的重新表达完全逆转了miR-32-5p对炎症细胞因子分泌的抑制作用,表明抑制FSTL1是抗炎作用的中介因子[33].然而,升高的Fslt1蛋白水平似乎对释放的细胞因子水平没有影响。
与健康对照组相比,RA患者的血清、滑膜组织和成纤维细胞样滑膜细胞中miR-27a水平明显较低,而FSTL1水平较高。转染miR-27a的成纤维细胞样滑膜细胞可抑制细胞迁移和侵袭,并下调TLR4、NF-κB和MMPs。进一步的分析表明,这些效应是mir -27a介导的通过3'UTR靶序列下调FSTL1表达的结果。3.).此外,通过腺病毒载体过表达FSTL1可以挽救miR-27a效应[24].
结束语
从临床角度来看,重要的是要考虑到在癌症和心血管疾病等病理条件下,不仅单个细胞的增殖和迁移等行为很重要,而且细胞之间的旁分泌交流、炎症和血管化也很重要。由于FSTL1已被证明参与多种信号通路和过程,在特定细胞类型和特定条件下观察到的结果应根据其具体的优点来考虑,而不是一般化。
FSTL1是一种分泌性糖蛋白,在病理条件下表达改变。它参与TGF-β/BMP平衡、免疫应答和Wnt信号通路等重要信号通路的调控。在人类中,它的功能是严格控制的。在灵长类动物中,已经确定了一个额外的转录后调节水平;初级转录本作为FSTL1蛋白的前体或作为pre-microRNA。这些可选功能似乎是相互排斥的。此外,在FSTL1 mRNA的3'UTR中已经发现了多个microrna结合位点,并在多个模型中显示了它们对FSTL1表达的抑制作用。最后,在翻译后水平上,FSTL1也受糖基化的调节,低聚糖链的结构显示了物种和细胞特异性的影响功能。在实验设计和解释文献中明显矛盾的数据时,考虑到所有这些变量是非常重要的。因此,未来需要深入分析FSTL1的mRNA表达与功能分泌蛋白的关系以及低聚糖链的组成与FSTL1所观察到的生物学效应之间的关系,以推动FSTL1在临床的应用。
参考文献
Sylva M, Moorman AF, van den Hoff MJ (2013) Follistatin-like 1在脊椎动物发育中的作用。出生缺陷与今日胚胎99(1):61-69。https://doi.org/10.1002/bdrc.21030
Shibanuma M, Mashimo J, Mita A, Kuroki T, Nose K(1993)从小鼠成骨细胞系克隆一组转化生长因子- β 1调节基因,其中一个似乎编码卵泡他汀相关多肽。中国生物医学工程学报(1):37 - 38
Zwijsen A, Blockx H, Van Arnhem W, Willems J, Fransen L, Devos K, Raymackers J, Van De Voorde A, Slegers H(1994)大鼠C6胶质瘤分泌卵泡素相关蛋白(FRP)的表征。人类同源体的克隆和序列。中国生物医学工程学报,32 (3):366 - 366
Hambrock HO, Kaufmann B, Muller S, Hanisch FG, Nose K, Paulsson M, Maurer P, Hartmann U (2004) TSC-36/Flik的结构表征:两种电荷异构体分析。中国生物医学工程学报29(6):369 - 369。https://doi.org/10.1074/jbc.m309318200
Liu T, Qian WJ, Gritsenko MA, Camp DG 2nd, Monroe ME, Moore RJ, Smith RD(2005)用免疫亲和减法、肼化和质谱分析人血浆n -糖蛋白组。蛋白质组学杂志4(6):2070-2080。https://doi.org/10.1021/pr0502065
Adams D, Larman B, Oxburgh L(2007)小鼠Follistatin-like 1 (Fstl1)的发育表达:肾和肺器官发生过程中的动态调控。基因表达谱7(4):491-500
吴颖,周松,Smas CM(2010)分泌糖蛋白follistatin-like 1 (Fstl1)表达下调是前脂肪细胞向脂肪细胞转化的一个强大标志。Mech Dev 127(3-4): 183-202。https://doi.org/10.1016/j.mod.2009.12.003
Oshima Y, Ouchi N, Sato K, Izumiya Y, Pimentel DR, Walsh K (2008) Follistatin-like 1是一种由akt调节的心脏保护因子,由心脏分泌。发行量117 (24):3099 - 3108
Lara-Pezzi E, Felkin LE, Birks EJ, Sarathchandra P, Panse KD, George R, Hall JL, Yacoub MH, Rosenthal N, Barton PJ(2008)心力衰竭中follistatin相关基因的表达改变。内分泌科149 (11):5822 - 5827
van Wijk B, Gunst QD, Moorman AF, van den Hoff MJ(2012)激活心外膜的心脏再生。科学通报7(9):e44692。https://doi.org/10.1371/journal.pone.0044692
小仓Y,大内N,大石K,柴田R,片冈Y, Kambara T, Kito T,丸山S,汤浅D,松尾K, Enomoto T,植村Y, Miyabe M,石井M,山本T,清水Y, Walsh K, Murohara T (2012) follistatin-like 1对临床前模型心肌缺血损伤的治疗作用。发行量126(14):1728 - 1738。https://doi.org/10.1161/circulationaha.112.115089
Shimano M, Ouchi N, Nakamura K, van Wijk B, Ohashi K, Asaumi Y, Higuchi A, Pimentel DR, Sam F, Murohara T, van den Hoff MJ, Walsh K(2011)心肌细胞卵泡素样1在减轻压力过载后肥厚中的作用。中国科学:地球科学108(3):369 - 369。https://doi.org/10.1073/pnas.1108559108
Wei K, Serpooshan V, Hurtado C, Diez-Cunado M, Zhao M, Maruyama S, Zhu W, Fajardo G, Noseda M, Nakamura K, Tian X, Liu Q, Wang A, Matsuura Y, Bushway P, Cai W, Savchenko A, Mahmoudi M, Schneider MD, van den Hoff MJ, Butte MJ, Yang PC, Walsh K, Zhou B, Bernstein D, Mercola M, Ruiz-Lozano P(2015)成年哺乳动物心外膜FSTL1重建再生心脏。自然525(7570):479 - 485。https://doi.org/10.1038/nature15372
Maruyama S, Nakamura K, Papanicolaou KN, Sano S, Shimizu I, Asaumi Y, van den Hoff MJ, Ouchi N, Recchia FA, Walsh K (2016) Follistatin-like 1促进心脏成纤维细胞激活并保护心脏不破裂。EMBO Mol Med:949 - 966。https://doi.org/10.15252/emmm.201506151
Tanaka K, Valero-Munoz M, Wilson RM, Essick EE, Fowler CT, Nakamura K, van den Hoff M, Ouchi N, Sam F (2016) Follistatin like 1在保留射血分数的心力衰竭中调节肥厚。JACC Basic transsci 1(4): 207-221。https://doi.org/10.1016/j.jacbts.2016.04.002
Meehan KL, Holland JW, Dawkins HJ(2002)正常和恶性前列腺组织的蛋白质组学分析,以识别癌症中丢失的新蛋白质。前列腺癌50(1):54 - 63。https://doi.org/10.1002/pros.10032
Trojan L, Schaaf A, Steidler A, Haak M, Thalmann G, Knoll T, Gretz N, Alken P, Michel MS(2005)通过人前列腺癌细胞系的遗传谱分析鉴定前列腺癌转移相关基因。抗癌文献25(1A): 183-191
Reddy SP, Britto R, Vinnakota K, Aparna H, Sreepathi HK, Thota B, Kumari A, Shilpa BM, Vrinda M, Umesh S, Samuel C, Shetty M, Tandon A, Pandey P, Hegde S, Hegde AS, Balasubramaniam A, Chandramouli BA, Santosh V, Kondaiah P, Somasundaram K, Rao MR(2008)通过转录组分析发现具有诊断和预后价值的新型胶质母细胞瘤标志物。临床癌症杂志14(10):2978-2987。https://doi.org/10.1158/1078-0432.ccr-07-4821
陈庆坤,颜海燕,叶培萍,刘文文,薛伟昌,安培平(2009)卵泡他汀样1在卵巢和子宫内膜癌发生中的抑癌作用:差异表达和功能分析。致癌30 (1):114 - 121
谭鑫,翟勇,常伟,侯娟,何珊,林玲,于燕,徐东,肖军,马琳,王国,曹涛,曹刚(2008)透明细胞肾细胞癌临床标本原代培养中转移相关基因表达的全局分析。癌症杂志23(5):1080-1088。https://doi.org/10.1002/ijc.23637
刘艳,韩霞,于艳,丁艳,倪超,刘伟,侯旭,李铮,侯娟,沈冬,尹俊,张宏,Thompson TC,谭曦,曹刚(2016)一种遗传多态性影响肾细胞癌的风险和预后:与卵泡他汀样蛋白1表达的关系。Sci Rep:26689。https://doi.org/10.1038/srep26689
周曦,肖曦,黄婷,杜晨,王松,莫燕,马娜,村田明,李斌,文伟,黄刚,曾曦,张震(2016)follistatin-like 1表观遗传失活介导鼻咽癌肿瘤免疫逃避。Oncotarget 7(13): 16433 - 16444。https://doi.org/10.18632/oncotarget.7654
李东,王燕,徐楠,魏强,吴敏,李霞,郑鹏,孙松,金燕,张刚,廖锐,张鹏(2011)类风湿关节炎患者folli他汀样蛋白1在全身自身免疫性疾病中的表达升高,并与疾病活动度相关。关节炎Res Ther 13(1):17。https://doi.org/10.1186/ar3241
史道林,史光荣,谢军,杜旭铮,杨红(2016)MicroRNA-27a通过靶向类风湿性关节炎中folli他汀样蛋白1抑制成纤维细胞样滑膜细胞的迁移和侵袭。摩尔细胞39(8):611-618。https://doi.org/10.14348/molcells.2016.0103
Wilson DC, Marinov AD, Blair HC, Bushnell DS, Thompson SD, Chaly Y, Hirsch R (2010) Follistatin-like protein 1是一种间充质来源的炎症蛋白,可能是全身发作幼年类风湿性关节炎的生物标志物。风湿性关节炎62(8):2510-2516
王赟,李东,徐楠,陶伟,朱锐,孙锐,范伟,张鹏,董涛,于玲(2011)folli他汀样蛋白1:反映骨关节炎患者关节损伤严重程度的血清生化标志物。关节炎Res Ther 13(6):R193。https://doi.org/10.1186/ar3522
Sylva M, Li VS, Buffing AA, van Es JH, van den Born M, van der Velden S, Gunst Q, Koolstra JH, Moorman AF, Clevers H, van den Hoff MJ (2011) BMP拮抗剂follistatin-like 1是骨骼和肺器官发生所必需的。科学通报6(8):e22616。https://doi.org/10.1371/journal.pone.0022616
耿勇,董勇,于敏,张亮,闫欣,孙俊,乔玲,耿宏,中岛明,田富一,池川生,高翔,陈一刚,江东,宁伟(2011)Follistatin-like 1 (Fstl1)是一种骨形态发生蛋白(BMP) 4信号拮抗剂,可控制小鼠肺发育。中国科学:地球科学27(3):369 - 369。https://doi.org/10.1073/pnas.1007293108
周健,廖敏,田中明,宣旭,藤崎克(2006)蜱中卵泡素相关蛋白的鉴定Haemaphysalis longicornis及其对蜱虫产卵的影响。基因372:191 - 198
Tanaka M, Murakami K, Ozaki S, Imura Y, Tong XP, Watanabe T, Sawaki T, Kawanami T, Kawabata D, Fujii T, Usui T, Masaki Y, Fukushima T, Jin ZX, Umehara H, Mimori T (2010) DIP2盘相互作用蛋白2同源物A(果蝇)是folli他汀相关蛋白/ folli他汀样1的候选受体分析其与tgf - β超家族蛋白的结合。中国科学院学报(自然科学版)27 (4):359 - 361
Mouillet JF, Mishima T, paaffaro AM, Parks TW, Ziegler JA, Chu T, Sadovsky Y(2015)胎盘滋养层中FSTL1转录本的表达及转录后调控。胎盘36(11):1231 - 1238。https://doi.org/10.1016/j.placenta.2015.09.005
Rosenberg MI, Georges SA, Asawachaicharn A, Analau E, Tapscott SJ (2006) MyoD通过诱导miR-206的转录抑制Fstl1和utn的表达。《细胞生物学杂志》(1):77-85。https://doi.org/10.1083/jcb.200603039
张志明,张爱仁,徐敏,娄婕,邱文华(2017)TLR-4/miRNA-32-5p/FSTL1信号通路调控分枝杆菌存活和炎症反应结核分枝杆菌来华的巨噬细胞。Exp Cell Res 352(2): 313-321。https://doi.org/10.1016/j.yexcr.2017.02.025
本杰明EJ, Blaha MJ, Chiuve SE, Cushman M, Das SR,托R, de Ferranti SD,弗洛伊德J, Fornage M, Gillespie C, Isasi CR,吉梅内斯MC,乔丹LC,贾德,拉克兰D,李奇曼JH, Lisabeth L,刘年代,Longenecker CT,麦基RH,松下K,研究D, Mussolino我,纳西尔K, Neumar RW,印度L, Pandey DK, Thiagarajan RR,李维斯MJ, Ritchey M,罗德里格斯CJ,罗斯GA,罗莎蒙德WD,萨松C, Towfighi,曹CW,特纳MB, Virani党卫军,Voeks JH, Willey生理改变,威尔金斯特里,吴JH,阿尔及尔嗯,黄党卫军,Muntner P,美国心脏协会统计协会,中风统计研究(2017)心脏病和中风统计- 2017更新:一份来自美国心脏协会的报告。发行量135 (10):e146-e603。https://doi.org/10.1161/cir.0000000000000485
El-Armouche A, Ouchi N, Tanaka K, Doros G, Wittkopper K, Schulze T, Eschenhagen T, Walsh K, Sam F (2011) Follistatin-like 1在慢性收缩期心力衰竭中的作用:左心室重构的标志。Circ心力衰竭4(5):621-627。https://doi.org/10.1161/circheartfailure
Widera C, Horn-Wichmann R, Kempf T, Bethmann K, Fiedler B, Sharma S, Lichtinghagen R, Leitolf H, Ivandic B, Katus HA, Giannitsis E, Wollert KC(2009)通过免疫荧光三明治法评估健康人群和急性冠状动脉综合征患者中follistatin-like 1的循环浓度。临床化学55(10):1794-1800。https://doi.org/10.1373/clinchem.2009.129411
张伟,王伟,刘婧,李婧,王婧,张莹,张铮,刘莹,金燕,李婧,曹娟,王超,宁伟,王婧(2017)folli他汀样1对缺氧诱导的小鼠肺动脉高压有保护作用。Sci Rep 7:45820。https://doi.org/10.1038/srep45820
李伯林,安金东,冯松,葛伟(2016)慢性心力衰竭患儿血清卵泡他汀样蛋白1的变化及其临床意义。中国党与二客杂志18(2):136-140
Widera C, Giannitsis E, Kempf T, Korf-Klingebiel M, Fiedler B, Sharma S, Katus HA, Asaumi Y, Shimano M, Walsh K, Wollert KC(2012)通过表达克隆鉴定follistatin-like 1作为生长分化因子15基因激活因子和急性冠状动脉综合征预后生物标志物。临床化学58(8):1233-1241。https://doi.org/10.1373/clinchem.2012.182816
van den Berg G, Somi S, Buffing AA, Moorman AF, van den Hoff MJ(2007)鸡心脏发育过程中卵泡抑素和卵泡抑素样1基因的表达模式:在瓣膜发生和晚期心肌细胞形成中的潜在作用。Anat Rec (Hoboken) 290(7): 783-787
Thygesen K, Alpert JS, Jaffe AS, Simoons ML, Chaitman BR, White HD(2012)心肌梗死的第三个通用定义。Glob Heart 7(4): 275-295。https://doi.org/10.1016/j.gheart.2012.08.001
Bhatt AS, Ambrosy AP, Velazquez EJ(2017)心肌梗死后不良重构与逆向重构。Curr Cardiol Rep 19(8):71。https://doi.org/10.1007/s11886-017-0876-4
Di Meglio F, Castaldo C, Nurzynska D, Romano V, Miraglia R, Bancone C, Langella G, Vosa C, Montagnani S(2010)心外膜间皮上皮-间充质转变是成人心脏cd111阳性干细胞的来源。《分子细胞心血管杂志》49(5):719-727
Ouchi N, Asaumi Y, Ohashi K, Higuchi A, Sono-Romanelli S, Oshima Y, Walsh K (2010) DIP2A作为FSTL1受体的功能。中国生物医学工程学报(10):727 - 727。https://doi.org/10.1074/jbc.m109.069468
Lorell BH, Carabello BA(2000)左心室肥厚:发病机制、检测和预后。发行量102 (4):470 - 479
Taegtmeyer H, Young ME, Lopaschuk GD, Abel ED, Brunengraber H, Darley-Usmar V, Des Rosiers C, Gerszten R, Glatz JF, Griffin JL, Gropler RJ, Holzhuetter HG, Kizer JR, Lewandowski ED, Malloy CR, Neubauer S, Peterson LR, Portman MA, Recchia FA, Van Eyk JE, Wang TJ,美国心脏协会基础心血管研究委员会(2016)评估心脏代谢:来自美国心脏协会的科学声明。Circ Res 118(10): 1659-1701。https://doi.org/10.1161/res.0000000000000097
Seki M, Powers JC, Maruyama S, Zuriaga MA, Wu CL, Kurishima C, Kim L, Johnson J, Poidomani A, Wang T, Munoz E, Rajan S, Park JY, Walsh K, Recchia FA(2018)起搏性心力衰竭中循环FSTL1急性和慢性升高使能量底物代谢正常化。Circ心脏衰竭11(1):e004486。https://doi.org/10.1161/circheartfailure.117.004486
Ouchi N, Oshima Y, Ohashi K, Higuchi A, Ikegami C, Izumiya Y, Walsh K (2008) Follistatin-like 1是一种分泌的肌肉蛋白,通过一氧化氮合酶依赖机制促进缺血组织内皮细胞功能和血管重建。中国生物医学工程学报33 (4):433 - 434
刘松,王亮,王伟,林杰,韩杰,孙辉,郭辉,孙瑞,吴强(2006)TSC-36/FRP抑制血管平滑肌细胞增殖和迁移。Exp Mol Pathol 80(2): 132-140。https://doi.org/10.1016/j.yexmp.2005.07.005
Miyabe M, Ohashi K, Shibata R, Uemura Y, Ogura Y, Yuasa D, Kambara T, Kataoka Y, Yamamoto T, Matsuo K, Joki Y, Enomoto T, Hayakawa S, Hiramatsu-Ito M, Ito M, van den Hoff MJ, Walsh K, Murohara T, Ouchi N(2014)血管损伤后肌肉源性follistatin-like 1减少新生内膜形成的作用。Cardiovasc Res。https://doi.org/10.1093/cvr/cvu105
杨颖,穆婷,李婷,谢珊,周娟,刘敏,李东(2017)FSTL1对乳腺癌细胞和血管内皮细胞增殖和活力的影响。胸癌8(6):606-612。https://doi.org/10.1111/1759-7714.12491
莱文RA, Hagege AA,法官DP Padala M, Dal-Bianco JP, Aikawa E, Beaudoin J,比绍夫J, Bouatia-Naji N, Bruneval P,屠夫JT, Carpentier, Chaput M,切斯特啊,Clusel C,德尔FN,迪茨HC,蒂娜C,敢R, Fernandez-Friera L, Handschumacher医学博士,詹森莫Jeunemaitre XP, Le Marec H, Le唐龙的T, Markwald RR, Merot J,重新E,米兰DP,内里T,诺里斯RA,钟声D, Perrocheau M, Probst V, Puceat M,罗森塔尔N,索利斯J, Schott JJ, Schwammenthal E, Slaugenhaupt SA歌JK,雅库巴MH,Leducq二尖瓣跨大西洋网络(2015)二尖瓣疾病形态学和机制。心脏12(12):689-710。https://doi.org/10.1038/nrcardio.2015.161
Prakash S, Borreguero LJJ, Sylva M, Flores Ruiz L, Rezai F, Gunst QD, de la Pompa JL, Ruijter JM, van den Hoff MJB(2017)心内膜/内皮谱系中Fstl1 (follistin - like 1)的缺失导致二尖瓣疾病。动脉血栓血管生物学杂志254:116-130。https://doi.org/10.1161/atvbaha.117.309089
塔克迪娜C, Bouatia-Naji N, N,德尔FN,注意K,敢R, Perrocheau M, Fernandez-Friera L,索利斯J, Le唐龙的T,陈MH Probst V,博斯Y, Pibarot P, Zelenika D,莱斯罗普M, Hercberg年代,Roussel R,本杰明EJ,阀盖F,瞧SH, Dolmatova E, F西莫内特,Lecointe年代,Kyndt F,贺东R, Le Marec H, Froguel P, Ellinor PT, Vasan RS, Bruneval P, Markwald RR,诺里斯RA,米兰DJ, Slaugenhaupt SA Levine RA, Schott JJ, Hagege AA,法国MVP, Jeunemaitre X,Leducq二尖瓣跨大西洋网络(2015)遗传关联分析突出了二尖瓣脱垂的生物途径。科学通报47(10):1206-1211。https://doi.org/10.1038/ng.3383
Liotta LA, steler - stevenson WG(1991)肿瘤侵袭和转移:阳性和阴性调控的不平衡。巨蟹座Res 51(18增补):5054 - 5059s
Woodhouse EC, Chuaqui RF, Liotta LA(1997)转移的一般机制。巨蟹座80(8期增刊):1529-1537
刘勇,谭鑫,刘伟,陈晓,侯晓,沈东,丁勇,尹俊,王丽,张宏,余勇,侯俊,Thompson TC,曹刚(2018)Follistatin-like protein 1在透明细胞肾细胞癌中的抑癌作用。中华癌症杂志37(1):2。https://doi.org/10.1186/s40880-018-0267-2
邱静,苏春春,杨永华,杨春春,黄淑娟,于丽丽,肖敏(2017)FSTL1-BMP4-Smad信号减弱预示肺腺癌不良预后,而非鳞状细胞癌。科学通报7(1):9830。https://doi.org/10.1038/s41598-017-10366-2
Torres S, Bartolome RA, Mendes M, Barderas R, Fernandez-Acenero MJ, Pelaez-Garcia A, Pena C, Lopez-Lucendo M, Villar-Vazquez R, de Herreros AG, Bonilla F, Casal JI(2013)癌症相关成纤维细胞的蛋白质组分析确定了结肠直肠癌的新促炎特征和预后标志物。临床癌症杂志19(21):6006-6019。https://doi.org/10.1158/1078-0432.ccr-13-1130
Su S, Parris AB, Grossman G, Mohler JL, Wang Z, Wilson EM(2017)前列腺癌中雄激素受体和黑色素瘤抗原a11上调follistatin-like 1。前列腺癌77(5):505 - 516。https://doi.org/10.1002/pros.23288
杨伟,吴颖,王超,刘铮,徐敏,郑霞(2017)FSTL1通过AKT/ gsk - 3β依赖性的方式减少肝细胞癌细胞凋亡,促进肿瘤进展。癌症生物标志物20(1):75-85。https://doi.org/10.3233/CBM-170132
Sundaram GM, Ismail HM, Bashir M, Muhuri M, Vaz C, Nama S, Ow GS, Vladimirovna IA, Ramalingam R, Burke B, Tanavde V, Kuznetsov, Lane EB, Sampath P (2017) EGF可以调控miR-198/FSTL1伤口愈合开关,引导两种方向的转移通路。J经验医学。https://doi.org/10.1084/jem.20170354
刘春梅,吴基基,王涛,童明,李秋青,明晓燕,罗珊婷,李np,张AL,秦YR,陈坤华,宁伟,管晓燕,马松(2017)FSTL1通过NFkappaB-bmp信号串音促进食管鳞癌转移和化疗耐药。Cancer Res 77(21): 5886-5899。https://doi.org/10.1158/0008-5472.CAN-17-1411
安杰,王亮,赵颖,郝强,张颖,张娟,杨超,刘亮,王伟,方达,陆涛,高原(2017)FSTL1对乳腺癌细胞系MDAMB231及其脑转移变异MDAMB231BR细胞增殖的影响。Oncol Rep 38(5): 3001-3010。https://doi.org/10.3892/or.2017.6004
Mashimo J, Maniwa R, Sugino H, Nose K(1997)人类癌细胞中一种新的TGF beta1诱导和ras-切割基因TSC-36的表达减少。癌症杂志113(1-2):213-219
Johnston IM, Spence HJ, Winnie JN, McGarry L, Vass JK, Meagher L, Stapleton G, Ozanne BW(2000)转录因子AP-1对多基因入侵程序的调控:下调基因TSC-36的再表达可抑制入侵。致癌基因19(47):5348 - 5358。https://doi.org/10.1038/sj.onc.1203927
Sumitomo K, Kurisaki A, Yamakawa N, Tsuchida K, Shimizu E, Sone S, Sugino H (2000) TGF-beta1诱导基因TSC-36的表达在人肺癌细胞株中引起生长抑制。癌症杂志155(1):37-46
倪霞,曹霞,吴燕,吴娟(2018)FSTL1对非小细胞肺癌肿瘤细胞增殖、侵袭和生存的抑制作用。Oncol Rep 39(1): 13-20。https://doi.org/10.3892/or.2017.6061
Bae K, Park KE, Han J, Kim J, Kim K, Yoon KA (2016) follistatin-like 1抑制引起的人肺癌细胞有丝分裂细胞死亡与灭活Erk1/2上调Bim相关。Oncotarget 7(14): 18076 - 18084。https://doi.org/10.18632/oncotarget.6729
Kudo-Saito C,福娃T, Murakami K, Kawakami Y(2013)靶向FSTL1可防止肿瘤骨转移和由此引起的免疫功能障碍。Cancer Res 73(20): 6185-6193。https://doi.org/10.1158/0008-5472.CAN-13-1364
赵伟,韩海红,张志强(2011)connexin43抑制肺癌细胞侵袭转移与组蛋白乙酰化介导follistatin-like 1分泌有关。中国生物医学工程学报43(10):1459-1468。https://doi.org/10.1016/j.biocel.2011.06.009
李晓燕,王晓燕,王晓燕,王晓燕(2001)类风湿关节炎患者滑膜组织中ID家族基因的表达。中国生物化学学报,28(2):436-442。https://doi.org/10.1006/bbrc.2001.4974
田中明,尾崎生,大田F,森K,大久保M,中尾K(1998)全身风湿性疾病中卵泡他汀相关蛋白的克隆。国际免疫杂志10(9):1305-1314
Ehara Y, Sakurai D, Tsuchiya N, Nakano K, Tanaka Y, Yamaguchi A, Tokunaga K (2004) follistatin相关蛋白基因(FRP)在类风湿关节炎的滑膜组织中表达,但其多态性与遗传易感性无关。临床经验风湿醇22(6):707-712
Gorelik M, Wilson DC, Cloonan YK, Shulman ST, Hirsch R(2012)川崎病血浆卵磷脂样蛋白1升高,可能预示冠状动脉瘤的形成。中华儿科杂志61(1):116-119。https://doi.org/10.1016/j.jpeds.2012.01.011
Newburger JW, Takahashi M, Burns JC(2016)川崎病。《中国心血管杂志》32(4):447 - 447。https://doi.org/10.1016/j.jacc.2015.12.073
刘艳,魏娟,赵艳,张艳,韩艳,陈斌,程凯,贾娟,聂磊,程磊(2017)Follistatin-like蛋白1通过与MAPK和NFkappaB信号通路相互作用促进髓核细胞炎症反应。Oncotarget 8(26): 43023 - 43034。https://doi.org/10.18632/oncotarget.17400
Brand DD, Latham KA, Rosloniec EF(2007)胶原诱导关节炎。Nat协议2(5):1269-1275。https://doi.org/10.1038/nprot.2007.173
Khachigian LM(2006)胶原抗体诱导关节炎。Nat协议1(5):2512-2516。https://doi.org/10.1038/nprot.2006.393
Thornton S, Sowders D, Aronow B, Witte DP, Brunner HI, Giannini EH, Hirsch R (2002) DNA微阵列分析揭示了胶原诱导关节炎的新基因表达谱。临床免疫杂志105(2):155-168
Miyamae T, Marinov AD, Sowders D, Wilson DC, Devlin J, Boudreau R, Robbins P, Hirsch R (2006) Follistatin-like protein-1是一种新型促炎分子。中华免疫学杂志32 (6):369 - 369
杂波SD, Wilson DC, Marinov AD, Hirsch R (2009) folli他汀样蛋白1通过上调ifn - γ促进关节炎。中华免疫学杂志(1):34 - 34
村上K,田中M,臼井T,川崎D, Shiomi A, Iguchi-Hashimoto M, Shimizu M, Yukawa N, Yoshifuji H, Nojima T, Ohmura K, Fujii T, Umehara H, Mimori T (2012) folli他汀相关蛋白/ folli他汀样1通过CD14和toll样受体4引起先天免疫反应。FEBS学报586(4):319-324。https://doi.org/10.1016/j.febslet.2012.01.010
田中M,尾崎S,川端D,岸村M,大阪田F,大久保M,村上M,中尾K, Mimori T(2003)类风湿关节炎中follistatin相关蛋白/TSC-36对关节破坏及其自身抗体拮抗调节的潜在预防作用。国际免疫杂志15(1):71-77
Kawabata D, Tanaka M, Fujii T, Umehara H, Fujita Y, Yoshifuji H, Mimori T, Ozaki S (2004) folliostin相关蛋白/TSC-36/FSTL1对关节炎小鼠模型关节炎症的改善作用。风湿性关节炎50(2):660-668。https://doi.org/10.1002/art.20023
Dooley S, Herlitzka I, Hanselmann R, Ermis A, Henn W, Remberger K, Hopf T, Welter C(1996)类风湿关节炎中C -fos和C -jun的本构表达、ets-2的过表达和转移抑制基因nm23-H1的低表达。中国科学d辑(5):394 - 394
Kim HJ, Kang WY, sesj, Kim SY, Lim MS, Yoon YR (2016) Follistatin-like 1通过rankl介导的NF-kappaB激活和m - csf诱导的前体增殖促进破骨细胞形成。Cell Signal 28(9): 1137-1144。https://doi.org/10.1016/j.cellsig.2016.05.018
Kagari T, Doi H, Shimozato T (2002) IL-1 β和tnf - α的重要性,以及IL-6在单克隆抗体诱导关节炎发展中的不参与。中华免疫学杂志19 (3):359 - 366
Chaly Y, Fu Y, Marinov A, Hostager B, Yan W, Campfield B, Kellum JA, Bushnell D, Wang Y, Vockley J, Hirsch R (2014) follistatin样蛋白1增强单核细胞和巨噬细胞NLRP3炎性体介导的il -1 β分泌。中华医学会免疫学杂志32(5):369 - 369。https://doi.org/10.1002/eji.201344063
范宁,孙浩,王颖,王颖,张玲,夏铮,彭磊,侯颖,沈伟,刘锐,尹杰,彭颖(2013)Follistatin-like 1:肥胖中炎症的潜在调节因子。Mediat发炎2013:752519。https://doi.org/10.1155/2013/752519
Adams DC, Karolak MJ, Larman BW, lilaw L, Nolin JD, Oxburgh L (2010) Follistatin-like 1调节顺铂肾毒性中il -1 β的表达。Am J Physiol Renal Physiol 299(6): F1320-F1327
Hayakawa S, Ohashi K, Shibata R, Kataoka Y, Miyabe M, Enomoto T, Joki Y, Shimizu Y, Kambara T, Uemura Y, Yuasa D, Ogawa H, Matsuo K, Hiramatsu-Ito M, van den Hoff MJ, Walsh K, Murohara T, Ouchi N(2015)心肌细胞来源的follistatin-like 1在肾次全切除术模型中预防肾损伤。中华医学会细胞免疫学杂志26(3):636-646。https://doi.org/10.1681/ASN.2014020210
Le Luduec JB, Condamine T, Louvet C, Thebault P, Heslan JM, Heslan M, Chiffoleau E, Cuturi MC (2008) follistatin-like 1在同种异体心脏移植中的免疫调节作用。中国生物医学工程学报8(11):2297-2306。https://doi.org/10.1111/j.1600-6143.2008.02398.x
Pardo A, Gibson K, Cisneros J, Richards TJ, Yang Y, Becerril C, Yousem S, Herrera I, Ruiz V, Selman M, Kaminski N(2005)人特发性肺纤维化中骨桥蛋白的上调和促纤维化作用。公共科学图书馆2(9):e251。https://doi.org/10.1371/journal.pmed.0020251
董燕,耿莹,李丽,李欣,闫欣,方燕,李欣,董森,刘欣,李欣,杨欣,郑欣,谢婷,梁健,戴宏,刘欣,尹卓,Noble PW,江东,宁伟(2015)阻断follistin -like 1可减弱博莱霉素诱导的小鼠肺纤维化。中华临床医学杂志212(2):235-252。https://doi.org/10.1084/jem.20121878
Murphy N, Gaynor KU, Rowan SC, Walsh SM, Fabre A, Boylan J, Keane MP, McLoughlin P(2016)骨形态发生蛋白辅助蛋白在小鼠和人肺纤维化中的表达改变。中华寄生虫病杂志186(3):600-615。https://doi.org/10.1016/j.ajpath.2015.10.032
Vollmann EH, Cao L, Amatucci A, Reynolds T, Hamann S, Dalkilic-Liddle I, Cameron TO, Hossbach M, Kauffman KJ, Mir FF, Anderson DG, Novobrantseva T, Koteliansky V, Kisseleva T, Brenner D, Duffield J, Burkly LC(2017)通过体内siRNA沉默鉴定新型纤维化修饰物。摩尔Ther核酸:314 - 323。https://doi.org/10.1016/j.omtn.2017.04.014
Umezu T, Yamanouchi H, Iida Y, Miura M, Tomooka Y (2010) follistatin - like1,一种扩散间充质因子决定上皮细胞的命运。中国科学:地球科学27(4):461 - 461。https://doi.org/10.1073/pnas.0909501107
Miller M, Esnault S, Kurten RC, Kelly EA, Beppu A, Das S, Rosenthal P, Ramsdell J, Croft M, Zuraw B, Jarjour N, Hamid Q, Broide DH(2016)节段性过敏原挑战增加哮喘患者气道follistatin-like 1水平。中华过敏临床免疫学杂志38(2):596-599 e594。https://doi.org/10.1016/j.jaci.2016.01.019
Miller M, Beppu A, Rosenthal P, Pham A, Das S, Karta M, Song DJ, Vuong C, Doherty T, Croft M, Zuraw B, Zhang X, Gao X, Aceves S, Chouiali F, Hamid Q, Broide DH (2015) Fstl1通过诱导抑癌素M促进哮喘气道重塑。https://doi.org/10.4049/jimmunol.1501105
刘颖,刘婷,吴娟,李婷,焦曦,张慧,赵娟,王娟,刘玲,曹玲,李松,徐娟,徐娟,马霞,杨玲,董磊(2017)哮喘患者FSTL1表达与气道重塑的相关性。Mediat发炎杂志2017:7918472。https://doi.org/10.1155/2017/7918472
刘涛,刘颖,Miller M,曹玲,赵娟,吴娟,王娟,刘玲,李松,邹梅,徐娟,Broide DH,董磊(2017)自噬在fstl1诱导的上皮间质转化和哮喘气道重塑中的作用。肺细胞分子生理醇313(1):L27-L40。https://doi.org/10.1152/ajplung.00510.2016
Gugnoni M, Sancisi V, Manzotti G, Gandolfi G, Ciarrocchi A(2016)自噬和上皮-间质转变:癌症中复杂的相互作用。细胞死亡7(12):e2520。https://doi.org/10.1038/cddis.2016.415
Prieto-Echague V, Lodh S, Colman L, Bobba N, Santos L, Katsanis N, Escande C, Zaghloul NA, Badano JL (2017) BBS4调节FSTL1的表达和分泌,FSTL1是一种参与纤毛发生和3T3-L1分化的蛋白质。科学通报7(1):9765。https://doi.org/10.1038/s41598-017-10330-0
Ouchi N, Parker JL, Lugus JJ, Walsh K(2011)炎症和代谢性疾病中的脂肪因子。免疫应答11(2):85-97。https://doi.org/10.1038/nri2921
Iacomino G, Siani A (2017) microRNAs在肥胖和肥胖相关疾病中的作用。基因坚果12:23。https://doi.org/10.1186/s12263-017-0577-z
杨燕,刘杰,毛红,胡亚,闫燕,赵超(2009)Follistatin-like 1在小鼠中枢神经系统发育中的表达模式。基因Expr模式9(7):532-540。https://doi.org/10.1016/j.gep.2009.07.001
刘锐,杨勇,沈娟,陈浩,张强,巴锐,魏勇,李凯成,张旭,赵超(2015)Fstl1参与调节桡骨胶质支架的发育。摩尔大脑8:53。https://doi.org/10.1186/s13041-015-0144-8
李克春,张菲克斯,李春林,王芳,于爱梅,钟玉青,张海红,陆玉军,王强,马晓丽,姚建军,王继勇,林伯林,韩敏,张玉青,昆尔瑞,肖海红,鲍林,高翔,张霞(2011)Follistatin-like 1通过激活Na抑制感觉传入传递+K+腺苷三磷酸酶。神经元69(5):974 - 987。https://doi.org/10.1016/j.neuron.2011.01.022
Bartel DP (2004) MicroRNAs:基因组学、生物发生、机制和功能。细胞116 (2):281 - 297
Laurence J(2017)将MicroRNAs翻译到临床。Mica Haley,爱思唯尔,阿姆斯特丹
Hinske LC, Galante PA, Kuo WP, Ohno-Machado L(2010)基因内mirna在宿主互作组中的潜在作用。BMC Genom 11:533。https://doi.org/10.1186/1471-2164-11-533
Sundaram GM, Common JE, Gopal FE, Srikanta S, Lakshman K, Lunny DP, Lim TC, Tanavde V, Lane EB, Sampath P(2013)伤口愈合过程中单个转录本中microRNA-198和FSTL1的“See-saw”表达。自然495(7439):103 - 106。https://doi.org/10.1038/nature11890
王梅,王杰,孔欣,陈浩,王艳,秦梅,林艳,陈辉,徐静,洪杰,陈yx,邹伟,方建勇(2014)MiR-198通过靶向focusyl转移酶8抑制结直肠癌肿瘤生长和转移。Sci Rep 4:6145。https://doi.org/10.1038/srep06145
吴松,张刚,李鹏,陈松,张芳,李娟,蒋晨,陈曦,王莹,杜燕,孙强,赵刚(2016)miR-198靶向SHMT1抑制肺腺癌细胞增殖并增强细胞凋亡。肿瘤生物学杂志37(4):5193-5202。https://doi.org/10.1007/s13277-015-4369-z
McCarthy JJ (2008) MicroRNA-206:骨骼肌特异性myomiR。生物化学生物物理学报1779(11):682-691。https://doi.org/10.1016/j.bbagrm.2008.03.001
Amthor H, Connolly D, Patel K, brandon - saberi B, Wilkinson DG, Cooke J, Christ B(1996)卵泡抑素和卵泡抑素样基因在鸟类体区隔化和肌发生中的表达和调控。生物技术学报(2):343-362
Bergstrom DA, Penn BH, Strand A, Perry RL, Rudnicki MA, Tapscott SJ (2002) MyoD结合和信号转导启动子特异性调控协同模式基因表达。Mol Cell 9(3): 587-600
赖丽,宋颖,刘颖,陈强,韩强,陈伟,潘婷,张颖,曹旭,王强(2013)MicroRNA-92a通过靶向MKK4激酶负调控巨噬细胞toll样受体(TLR)引发的炎症反应。中国生物化学杂志28(11):7956-7967。https://doi.org/10.1074/jbc.M112.445429
Kozomara A, griffith - jones S (2014) miRBase:使用深度测序数据注释高置信度microRNAs。核酸Res 42(数据库问题):D68-D73。https://doi.org/10.1093/nar/gkt1181
确认
作者感谢Jan Ruijter博士对手稿的批判性阅读。Andrea Mattiotti和Stuti Prakash获得了欧盟FP7-Marie Curie-ITN行动ITN-GA-2011-289600赠款CardioNeT的财政支持。
作者信息
作者和隶属关系
相应的作者
电子补充材料
下面是电子补充材料的链接。
权利与权限
开放获取本文根据创作共用署名4.0国际许可协议发布(http://creativecommons.org/licenses/by/4.0/),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。
关于本文
引用本文
A.马提奥蒂,S.普拉卡什,P.巴奈特。et al。Follistatin-like 1在发育和人类疾病中的作用细胞。生命科学。75, 2339-2354(2018)。https://doi.org/10.1007/s00018-018-2805-0
收到了:
修改后的:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1007/s00018-018-2805-0
关键字
- 心血管病
- 癌症
- 免疫疾病
- 炎症
- 纤维化
- 肥胖
- 肺病
- 信号转导
- 糖基化
- microrna的