摘要
检讨的目的
这篇综述评估了短链脂肪酸(SCFA)与宿主代谢健康和心血管疾病(CVD)风险之间的最新证据,并提出了可能的生物学机制的最新证据。
最近发现
SCFA在肠道、内脏和外周组织中有一系列局部作用,这些作用共同诱导改善代谢调节,并对CVD风险标志物有直接和间接影响。
总结
主要由膳食纤维的微生物发酵产生的短链脂肪酸似乎是肠道微生物组诱导的有益作用的关键介质。膳食纤维发酵不仅调节肠道微生物活动,短链脂肪酸还通过一系列与肠道屏障功能、葡萄糖稳态、免疫调节、食欲调节和肥胖相关的组织特异性机制直接调节宿主健康。随着全球肥胖负担的增加,肠道微生物群产生的短链脂肪酸在保护人体免受能量密集饮食影响方面的作用,为调节代谢健康和心血管疾病风险提供了一个有趣的新途径。
介绍
心血管疾病(CVD)是全球死亡的主要原因,占美国死亡人数的三分之一[1]。尽管在20世纪后期,发达国家已观察到心血管疾病死亡率的显著下降[2,3.]由于公共卫生和医疗保健的改善,心血管疾病在低收入和中等收入国家的负担仍然很高,全球四分之三以上的心血管疾病死亡都发生在这些国家[4]。与心血管疾病相关的饮食和生活方式的危险因素包括吸烟、缺乏运动、肥胖、糖尿病、血脂异常和高血压。然而,最近心血管疾病死亡率的下降有被肥胖患病率的增加逆转的危险。自20世纪80年代以来,全世界的肥胖患病率翻了一番,最近的全球数据表明,目前全球范围内,除撒哈拉以南非洲和亚洲部分地区外,所有地区的超重人数都超过体重不足人数[5]。展望未来,仅在英国,预计到2050年,60%的男性和50%的女性将会肥胖。6]。发达国家目前和持续的肥胖负担以及低收入和中等收入国家的新负担对CVD死亡率的持续下降构成了重大挑战。
代谢健康及其与心血管疾病风险的联系的一个新兴兴趣领域是肠道微生物组。高通量宏基因组技术的出现促进了对肠道微生物组在CVD风险中的作用的新见解[7]。重要的是,对于微生物介导的代谢物产生的因果途径的机制见解正在出现,这些代谢物对代谢健康和心血管疾病风险既有有益的影响,也有有害的影响[8]。例如,微生物介导的三甲胺生产和随后的三甲胺n -氧化物(TMAO)的肝脏修饰已成为CVD的一个强有力的微生物介导的危险因素[9,10,11]。最近的粪便微生物移植工作表明,三甲氧化三甲胺的产生可以通过针对肠道微生物群进行修改[12•]强调了肠道微生物组作为可修改的治疗靶点的潜力。通过饮食、生物或异种生物方法调节肠道微生物组活性的可能性使这一“器官”成为一系列宿主健康结果的有吸引力的目标,具有具有成本效益的个人和人群规模干预的潜力。肠道微生物组的主要功能是处理从小肠排出的未消化物质,包括未消化的膳食成分和由宿主分泌到肠道(仍未消化)的物质,包括胰腺分泌物、胆汁酸、黏蛋白和通过正常肠道内容物通道从小肠脱落的物质。在代谢健康中具有重要生物学意义的是膳食纤维的作用及其被肠道微生物群分解的主要产物短链脂肪酸(SCFA)。
短链脂肪酸的形成及其在人体健康中的主要功能
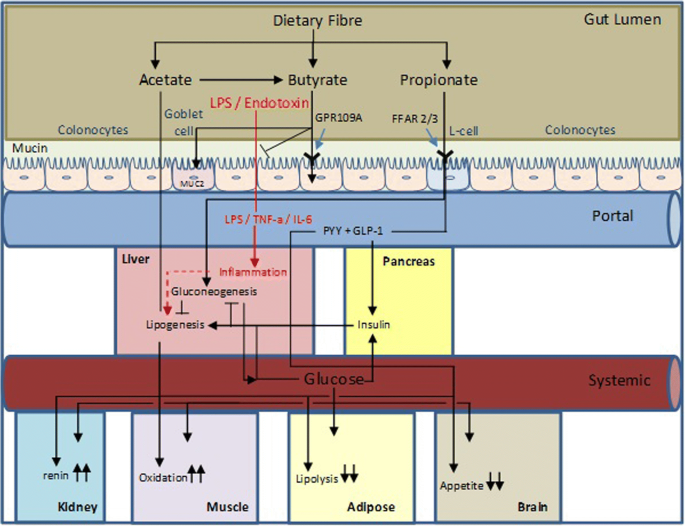
最近的一些流行病学研究强调了膳食纤维摄入量与心血管疾病危险因素之间的负相关[13,14,15,16,17,18]。不可消化碳水化合物(NDC)是膳食纤维的重要组成部分,短链脂肪酸(SCFA)是不可消化碳水化合物在大肠内糖解发酵的主要产物。乙酸、丙酸和丁酸是主要的短链脂肪酸产品,它们以大约60:20:20的摩尔比产生,在肠道内的总浓度超过100毫米,尽管循环浓度要低得多,尤其是丙酸和丁酸[19]。糖水解发酵和蛋白水解发酵之间的平衡主要与膳食摄入量和NDC对微生物群的可利用性有关。在精巧的工作中,饮食转换实验已经证明了与饮食中的蛋白质、脂肪和NDC(膳食纤维)含量相关的微生物代谢活性和多样性的快速变化[20.••,21]。因此,微生物组已成为一个有吸引力的目标,因为它易于通过饮食调节,目的是改变宿主的反应。SCFA在宿主健康中发挥着重要作用,除了从未消化的食物中恢复能量。丁酸盐在协调大肠和小肠屏障的完整性和为大肠上皮细胞提供能量方面发挥着重要作用[22]。最近的工作也证明了丁酸盐通过Treg细胞群的扩大调节免疫反应的作用[23,24]增加了早期关于SCFA在改善免疫细胞对抗原刺激的促炎反应中的作用的大量工作(在[25])。尽管最近的一项研究表明丙酸在肠道糖异生中起作用,但丙酸大部分通过肠腔[26],它几乎被定量地固定在肝脏中,在那里它可能作为糖异生底物或被氧化[27]。部分醋酸盐被腔内细菌转化为丁酸盐;然而,醋酸盐大部分逃脱内脏提取,可用于外周组织,在脂肪组织中用于脂肪生成或被肌肉氧化[28]。SCFA的作用,包括SCFA的组织特异性代谢,最近已在其他地方进行了综述[29]。SCFA作用和隔离的复杂腔内、内脏和外周细胞特异性性质如图所示。1。
SCFA在代谢健康和心血管疾病中的作用机制综述。肠道微生物发酵产生的醋酸盐在很大程度上逃过了肝脏的首次代谢。它在肝细胞和脂肪细胞的细胞液中为脂肪生成贡献乙酰基单位,但其主要氧化部位是周围肌肉。还能调节脂肪组织的脂解作用,对中枢食欲有调节作用。丙酸在肠道内局部作用于肠道内分泌l细胞,刺激厌食性肠道激素PYY和GLP-1的释放。丙酸大部分通过肠道被吸收,主要在肝脏中被氧化或用于糖异生。丁酸盐主要在肠道上皮被氧化,在协调紧密连接蛋白复合物以控制肠道屏障功能方面发挥核心作用。它还通过受体介导和组蛋白去乙酰化机制在调节炎症细胞群和功能中发挥作用。这三种SCFA都可能在血压调节中发挥作用;通过Olfr78介导的肾素产生和通过FFAR3和丁酸通过血管紧张素ii诱导的肾prorenin受体和肾素表达的衰减进行反调节的复杂相互作用,乙酸和丙酸
短链脂肪酸在代谢和心血管健康中的作用
SCFA通过直接和间接途径在调节代谢健康和CVD危险因素方面具有许多潜在作用。
血压调节
可能调节CVD风险最直接的途径是SCFA调节收缩压(SBP)和舒张压(DBP)。最近的一项人体对照试验已证明丁酸盐通过减少炎症在减少DPB方面具有潜在的辅助作用[30.],并且在怀孕早期,产生丁酸盐细菌的丰度与血压和纤溶酶原激活物抑制剂-1水平呈负相关[31]。膳食纤维研究的间接证据表明,膳食纤维与1型糖尿病患者血压降低有关(尽管纤维摄入量较高),但由于膳食纤维的多效作用,应谨慎对待SCFA的因果作用[32]。最近的一项荟萃分析得出结论,所有膳食纤维类型一起考虑时,可降低血压(收缩压和舒张压分别为−0.9和−0.7 mmHg),尽管β -葡聚糖(SDP和DBP分别为−2.9和−1.5 mmHg)型纤维的效应更大[33]。膳食纤维引起这些影响的机制仍有待完全阐明。
代谢调节
短链脂肪酸在肥胖和代谢调节(葡萄糖和脂质稳态)中的作用越来越引起人们的兴趣。流行病学和可靠的动物数据表明,膳食纤维摄入量与肥胖和体重增加呈反比关系。最近的研究开始深入了解SCFA的作用。醋酸盐在中央食欲调节中发挥作用[34],增加远端结肠的产量可能比近端结肠更有效,促进脂肪氧化,改善葡萄糖稳态和炎症状态[35•]。醋酸盐在能量稳态和底物代谢中的作用最近已在其他地方进行了综述[36]。我们最近的工作使用菊粉丙酸酯靶向递送到大肠,在对照人体试验中证明丙酸直接降低食欲和食物摄入量[37],影响食物选择[38],可改善胰脏功能[39]并调节肝脏脂质增加[40]。口服丙酸也被证明可增加人体的脂肪氧化[41]。急性口服丁酸盐,但不是静脉注射丁酸盐,已被证明可以通过动物的肠道-大脑神经回路减少食物摄入量,改善葡萄糖和血脂状况[42]。在超重/肥胖男性中,结肠输注SCFA可增加脂肪氧化、能量消耗和PYY释放,并减少脂肪组织脂肪分解[43]。菊粉是一种易发酵产生短链脂肪酸的低聚果糖益生元NDC,已证明对肥胖有有益作用[44]底物代谢[45],胰岛素敏感性[46]和食欲调节[47,48,49]尽管在人类身上看到的效果并不一致,可能与菊粉摄入量有关[50]。最近的一项荟萃分析初步得出结论,菊粉型果聚糖对血脂和葡萄糖代谢有有益的影响[51]。
肠道屏障功能
也许SCFA对宿主代谢健康影响最大的最有趣的作用是它们在协调上皮屏障以维持肠道完整性和防止细菌促炎分子在肠壁上易位方面的重要性。在结肠中产生的SCFA,目前的证据指向丁酸盐的关键调节作用。大量动物研究证实丁酸盐在维持上皮细胞完整性方面发挥了关键作用[52,53]以及在疾病挑战模型中恢复正常屏障功能[54,55,56,57]主要是通过调控肠细胞间通道内细胞旁渗透性和溶质运输的紧密连接蛋白的协调作用[58]。维持最佳肠道屏障的结果是防止微生物细胞壁成分的易位,如强烈促炎的脂多糖。丁酸盐的另一个关键作用是诱导粘液蛋白的产生,它在腔内细菌和上皮细胞之间建立了一个物理屏障[59]。有趣的是,在最近一项检查高血压患者肠道渗透性的人体研究中,高血压患者肠道渗透性增加和LPS的标记物升高,并且观察到肠道渗透性和收缩压之间存在很强的相关性[60•]。然而,这项研究只能在相关的小鼠模型实验中证明丁酸盐的保护作用。菊粉可迅速发酵成短链脂肪酸,改善小鼠的肠道功能[61]但在人类身上并没有观察到屏障功能的改善[62这给从动物到人类的研究结果的转化带来了不确定性。
肠道微生物功能
最近来自动物研究的证据表明,可溶性膳食纤维可使TMA和TMAO代谢分别降低40.6%和62.6%,这与SCFA生成增加、血脂和胆固醇降低有关[63]。相比之下,人类补充菊粉对禁食或餐后TMAO水平没有影响[64],表明了将研究结果从动物转化为人类的挑战,以及不同膳食纤维对微生物活动的作用的复杂性。
短链脂肪酸在代谢和心血管健康中的作用机制研究
短链脂肪酸是几种受体的配体
目前已鉴定出许多脱孤G蛋白偶联受体,其中SCFA作为天然配体[65,66]。游离脂肪酸受体(FFAR) 2和3对乙酸和丙酸具有较高的亲和力,在肠道、脂肪组织、胰腺和一些免疫细胞亚型中表达。GPR109A对丁酸盐具有较高的亲和力,并可能在肠道炎症通路中发挥作用[67]。嗅觉受体78 (Olfr78)受体对乙酸和丙酸具有较高的亲和力,位于心脏和肠道的自主神经、动脉平滑肌细胞和肾脏肾小球旁细胞[68•]。SCFA还具有组蛋白去乙酰化酶抑制剂(HDACs)的功能。组蛋白乙酰化是通过染色质结构调控转录因子活化和下游基因表达的关键调控因子。
血压
SCFA在调节血压中的作用已被研究,主要是在动物模型中。醋酸和丙酸似乎通过复杂的相互作用调节血压,包括通过Olfr78诱导肾素产生和通过FFAR3反调节。敲除模型的证据表明,丙酸可诱导肾肾素释放并通过Olfr78升高血压,但也可诱导出现FFAR3依赖性的血压降低[68•,69]。在大鼠中,丁酸盐已被证明通过减弱血管紧张素ii诱导的肾前肾素受体和肾素的表达来降低血压[70]。然而,鉴于丁酸盐在人体中的循环浓度较低[71],这一途径是否与生理相关,需要进一步研究来阐明。丙酸和丁酸在人体内循环浓度一般< 10 μmol/L [71]而在动物研究中,所检测的浓度从生理上< 10 μmol/L不等[700.1-10 mmol/L浓度[68•]。
肠道屏障功能
短链脂肪酸和丁酸盐长期以来一直被认为是维持肠道健康的重要基质。丁酸盐是结肠菌的首选底物。最近,SCFA通过协调调节紧密连接蛋白(调节管腔和肝门系统之间的细胞内分子公路)调节上皮完整性的作用已被假定。高血糖和肠道通透性增加与细菌和/或其细胞壁成分的易位有关,易位引发了与肥胖和胰岛素抵抗有关的炎症级联[72•]。在小鼠中,丁酸盐还可以作用于核苷酸结合寡聚结构域样受体(NLRs),这是炎症的关键调节剂,以FFAR2依赖的方式调节紧密连接复合物的关键成分[73]。细胞模型的工作揭示了p38 MAPK的可能作用[74], IL-10受体介导[75和AMPK/细胞内ATP [76丁酸盐对克劳丁蛋白的调节。有趣的是,FFAR2在这一途径中的参与也为其他SCFA在调节屏障功能中的作用打开了大门[77]。在高脂饮食诱导的脂肪性肝炎小鼠模型中,丁酸盐被观察到通过改善高脂饮食诱导的肠黏膜损伤、上调zonulin和降低内毒素水平来减轻脂肪性肝炎[78]。这些改善与肝脏内毒素相关基因(TLR4和Myd88)的下调和促炎基因(MCP-1, TNF-α, IL-1, IL-2, IL-6和IFN-γ)的表达有关。鉴于在肠腔细菌和宿主免疫系统之间维持一个有效的肠道物理屏障的重要作用,有必要进行精心设计的人体研究来阐明SCFA在肠道屏障功能中的作用。
食欲调节和能量摄入
短链脂肪酸被认为可以通过减少食欲和能量摄入来预防饮食引起的肥胖。然而,多项研究报告显示,在啮齿类动物的饮食中加入SCFA对食物摄入量没有影响[26,79]。同样,在人类中,直接在饮食中加入丙酸对随意试验餐或食用后24小时内的能量摄入没有影响[80]。口服SCFA可从上消化道迅速吸收,因此可能不会显著提高肠腔内的浓度。这似乎对SCFA促进食欲调节的作用很重要。
Li等人最近的一项研究报告了胃内给药丁酸盐后能量摄入减少,但静脉给药丁酸盐没有减少[42]。这种结果的差异可能是由于胃内给药允许丁酸盐到达其在肠腔内的自然生产位置,因此与肠道受体相互作用,这是外周给药无法实现的。通过有针对性地将丙酸输送到大肠,我们已经证明了丙酸可诱导食欲调节,减少食物摄入量并防止人类体重增加[37]。
因此,现有的啮齿动物和人类研究表明,口服补充SCFA不会调节食欲反应,而将SCFA输送到肠道更远处可能会减少能量摄入。短链脂肪酸受体FFAR2和FFAR3在胰高血糖素样肽1 (GLP-1)和肽YY (PYY)表达细胞中共表达[65],从而提出SCFAs可能通过刺激这些厌食激素的释放来减少能量摄入。一些使用肠内分泌细胞系体外模型的研究研究了SCFAs对肠道激素释放的影响[81]。这些报道强调,SCFAs可以通过FFAR2刺激厌食肠道激素释放。也有研究表明,下肠中高水平的SCFA可以通过肠-脑神经回路调节能量摄入。例如,De Vadder等人报道,结肠丙酸盐产量升高可通过FFAR3诱导肠道或门静脉中的迷走神经信号传递[26]。同样,Li等人发现小鼠胃内注射丁酸盐后食物摄入量的减少在迷走神经切断后被阻断[42]。
总之,针对SCFA向胃肠道输送的研究表明,能量摄入减少,这可能与厌食肠道激素释放和/或通过FFAR2和FFAR3受体直接神经肠道-大脑信号传递有关。短链脂肪酸还可能通过增加能量消耗来调节体重和肥胖。事实上,许多研究报告表明,急性和慢性给药SCFAs都能促进啮齿动物的能量消耗[42,82,83]。现有的人体研究也表明,结肠[43]及口头SCFA [41]补充剂会提高能量消耗的速度。一直有报道称,SCFA刺激的能量消耗增加与促进全身脂质氧化有关[41,43,79]。SCFA引起的能量消耗和脂质氧化的增加被认为是由于交感神经系统(SNS)活性的刺激,通过在交感神经节水平上表达的FFAR3 [84],棕色脂肪组织(BAT)活性增加[42]以及通过抑制外周组织中的PPARγ,从而上调脂质氧化[79]。
葡萄糖稳态
短链脂肪酸通过一系列机制对葡萄糖稳态有重要影响。如前所述,改善肠道屏障功能可减少炎症和氧化应激,促进改善胰岛素敏感性(综述于[85])。在人类膳食纤维补充研究中,血浆丙酸升高与餐后胰岛素降低有关[86]和改善葡萄糖稳态[37]通过改善胰腺β细胞功能[39]尽管补充抗性淀粉观察到葡萄糖稳态的改善似乎与循环SCFA无关,并通过减少游离脂肪酸输出来解释[87]。醋酸盐和丁酸盐也可能通过作用于细胞毒性T细胞(通过b细胞介导)和SCFA直接作用于调节性T细胞群而在维持β细胞功能方面发挥作用[88•]。
肥胖
短链脂肪酸通过多种机制防止饮食引起的肥胖。结肠中产生的短链脂肪酸刺激结肠中肠内分泌l细胞上的FFAR 2/3,导致厌食性肠道激素GLP-1和PYY的释放[81,89]。醋酸盐在食欲调节、肥胖和体重增加中的作用是有争议的。Frost等人证明醋酸盐可诱导中央食欲调节并减少小鼠的食物摄入量,从而防止饮食引起的体重增加[34]。最近,Perry等人证明醋酸盐具有相反的效果,导致葡萄糖刺激的胰岛素分泌增加,胃饥饿素分泌增加,小鼠嗜食和肥胖[90]。这些相互矛盾的结果需要进一步的工作来解释,但可能与代谢状态和醋酸盐给药部位有关[36]。
我们使用靶向方法将丙酸输送到大肠,已经证明丙酸可诱导食欲调节,减少食物摄入量并防止人类体重增加,这可能部分原因是GLP-1和PYY的增加[37]。在小鼠中,SCFA已被证明可以降低PPARγ的表达和活性,导致线粒体解偶联蛋白2的表达增加,AMP-to-ATP比值增加,通过AMPK刺激肝脏和脂肪组织中的氧化代谢[79]。丁酸盐还可能通过激活白色脂肪组织中β3肾上腺素能受体介导的脂肪分解来增加能量消耗,从而在预防饮食诱导的肥胖中发挥作用[82]以及通过激活脂联素介导的途径和刺激骨骼肌中的线粒体功能[91]。在2型糖尿病小鼠模型中,丁酸盐-一种有效的HDAC抑制剂-通过MKK3/p38/PRAK激活减弱心肌细胞凋亡,减少活性氧的产生并增加血管生成[92]。肝脏脂肪堆积与肝脏胰岛素敏感性受损有关,并与2型糖尿病有关[93]。在人类中[40]和老鼠[94],丙酸通过抑制参与脂肪酸合成的基因,并可能通过争夺细胞内辅酶A储存,与防止肝脏脂质积聚有关。
结论和未来展望
来自动物模型的令人信服的证据表明,SCFA可以在调节代谢健康和降低CVD风险方面发挥重要作用。然而,由于SCFA受体表达的组织特异性性质,特别是在使用全局基因敲除模型时,对证据的仔细解释是必要的。此外,必须认识到各种组织所接触到的与生理有关的浓度。虽然口服补充或灌胃SCFA对动物研究来说是实用和有吸引力的,但这通常不是SCFA在人类肠道中的出现方式。肠道中SCFA产生的位置和速率可能对生理后果至关重要,因此模拟人体生理对正确解释动物研究很重要。更好的是,如果研究和临床社区要确信SCFA在人类健康中发挥的有益作用,就需要进行控制良好的人类干预研究来建立强有力的证据基础。随着SCFA对调节屏障功能和炎症的重要性的影响不断显现,我们了解这些影响与疾病缓解的相关性至关重要,因为在人群水平上有相对廉价的干预选择。SCFA在控制肥胖和体重增加中的作用在动物中有很好的记录,SCFA在食欲调节和人类肥胖中的紧急作用也提供了一个令人兴奋的机会,在种群水平上干预,以解决我们这个时代可能最紧迫的健康问题——肥胖。
参考文献
最近发表的特别有趣的论文被列为:•重要的••非常重要的
Mozaffarian D, Benjamin EJ, Go AS, Arnett DK, Blaha MJ, Cushman M,等。心脏病和中风统计-2016更新:来自美国心脏协会的一份报告。循环。2016;133 (4):e38 - 360。https://doi.org/10.1161/CIR.0000000000000350。
Roth GA, Johnson CO, Abate KH, Abd-Allah F, Ahmed M, Alam K,等。1990-2016年美国各州心血管疾病负担中国心血管杂志,2018;3(5):375-89。https://doi.org/10.1001/jamacardio.2018.0385。
Bhatnagar P, Wickramasinghe K, Wilkins E, Townsend N.英国心血管疾病流行病学趋势。心。2016;102(24):1945 - 52。https://doi.org/10.1136/heartjnl-2016-309573。
世卫组织|心血管疾病预防和控制全球地图集。谁。2015.doi: /实体/ cardiovascular_diseases /出版/ atlas_cvd / en / index . html。
1975年至2014年200个国家成人体重指数的趋势:对1698项基于人口的测量研究进行汇总分析,共有1920万参与者。柳叶刀》。2016;387(10026):1377 - 96。doi:https://doi.org/10.1016/s0140 - 6736 (16) 30054 - x。
Butland B, Jebb S, Kopelman P, McPherson K, Thomas S, Mardell J.远见:解决肥胖:未来的选择。http://www.foresight.gov.uk。2009.
赵杰,陈志伟,陈志伟,等。肠道微生物组与Bogalusa心脏研究参与者终生心血管疾病风险相关Circ res 2016;119(8): 956-64。https://doi.org/10.1161/circresaha.116.309219。
王智,赵颖。肠道微生物代谢产物在心血管健康和疾病中的作用。蛋白质细胞。2018;9:416-31。https://doi.org/10.1007/s13238-018-0549-0。
heanza Y, Ma W, Manson JE, Rexrode KM, Qi L.肠道微生物代谢产物与主要不良心血管疾病事件和死亡风险:前瞻性研究的系统回顾和荟萃分析。中国心脏杂志。2017;6(7)。https://doi.org/10.1161/jaha.116.004947。
森通V,王震,李秀生,范勇,吴勇,唐文辉等。肠道微生物群生成的代谢物三甲胺- n -氧化物与稳定型冠状动脉疾病的5年死亡风险:肠道微生物群在courage样患者队列中的贡献作用美国心脏学会2016;5(6)。https://doi.org/10.1161/jaha.115.002816。
朱伟,王忠,唐文伟,黑森林生。肠道微生物产生的膳食胆碱三甲胺n -氧化物对血栓形成有促进作用。循环。17卷。曼联States2017。p . 1671 - 1673。
•Gregory JC, Buffa JA, Org E, Wang Z, Levison BS,朱伟,等。动脉粥样硬化易感性与肠道微生物移植的传播。中国生物医学工程杂志,2015;29(9):5647-60。https://doi.org/10.1074/jbc.M114.618249Gregory等人(2015)的研究表明,在抗生素处理的载脂蛋白缺失小鼠模型中,可以移植产生较高水平TMAO的肠道微生物组来复制动脉粥样硬化病变。
Hartley L, May MD, Loveman E, Colquitt JL, Rees K.膳食纤维对心血管疾病的一级预防。Cochrane数据库系统版本2016(1):Cd011472。https://doi.org/10.1002/14651858.CD011472.pub2。
膳食纤维摄入量与心血管疾病和所有癌症的死亡率:前瞻性队列研究的荟萃分析。中华心血管病杂志,2016;39(1):39-54。https://doi.org/10.1016/j.acvd.2015.09.005。
刘玲,王松,刘杰。纤维消耗与全因、心血管和癌症死亡率:队列研究的系统回顾和荟萃分析。中国生物医学工程学报,2015;29(1):379 - 379。https://doi.org/10.1002/mnfr.201400449。
Hajishafiee M, Saneei P, Benisi-Kohansal S, Esmaillzadeh a .谷物纤维摄入与各种原因、心血管疾病、癌症和炎症性疾病的死亡风险:前瞻性队列研究的系统回顾和荟萃分析中国生物医学工程学报,2016;26(2):343-52。https://doi.org/10.1017/s0007114516001938。
米夏·R, Shulkin ML, Penalvo JL, Khatibzadeh S, Singh GM, Rao M,等。心血管疾病和糖尿病风险的病因效应和食物和营养素的最佳摄入量:来自营养和慢性疾病专家组(NutriCoDE)的系统回顾和荟萃分析。公共科学学报,2017;12(4):e0175149。https://doi.org/10.1371/journal.pone.0175149。
麦克蕾MP。膳食纤维有益于心血管疾病的预防:荟萃分析的综合综述中华骨科杂志,2017;16(4):289-99。https://doi.org/10.1016/j.jcm.2017.05.005。
Boets E, Gomand SV, Deroover L, Preston T, Vermeulen K, De Preter V,等。健康受试者结肠衍生短链脂肪酸的系统可用性和代谢:稳定同位素研究。中国生物医学工程学报,2017;29(2):344 - 344。https://doi.org/10.1113/jp272613。
••David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE,等。饮食可以快速且重复地改变人体肠道微生物群。自然。2014;505(7484):559 - 63。https://doi.org/10.1038/nature12820David等人(2014)的研究优雅地展示了微生物发酵模式和细菌多样性的快速变化,这在很大程度上是由饮食输入驱动的,反映了肠道菌群碳水化合物和蛋白质发酵之间的平衡。
李建军,李建军,李建军,张晓明,等。非裔美国人和农村非洲人的脂肪,纤维和癌症风险Nat Commun. 2015;6:6342。https://doi.org/10.1038/ncomms7342。
马修森,李志强,李志强,等。肠道微生物代谢产物调节肠上皮细胞损伤和减轻移植物抗宿主病。中华免疫杂志,2016;17(5):505-13。https://doi.org/10.1038/ni.3400。
杨晓东,杨晓东,杨晓东,等。共生菌产生的代谢物促进外周调节性t细胞的生成。大自然。2013;504(7480):451。https://doi.org/10.1038/nature12726。
古泽勇,小田勇,田福寿,远藤田,中藤G,高桥D,等。共生微生物来源的丁酸盐诱导结肠调节性T细胞分化。大自然。2013;504(7480):446 - 50。https://doi.org/10.1038/nature12721。
孙敏,吴伟,刘震,丛云。微生物区系代谢物短链脂肪酸、GPCR与炎症性肠病。中华胃肠病杂志,2017;52(1):1 - 8。https://doi.org/10.1007/s00535-016-1242-9。
李文杰,李文杰,李文杰,等。微生物群产生的代谢物通过肠道-大脑神经回路促进代谢益处。细胞。2014;156(2):84 - 96。https://doi.org/10.1016/j.cell.2013.12.016。
张敏,韩勇,张敏,张伟,等。大鼠肝脏中3-羟基丙酸与丙酸代谢的相互关系:与丙酰辅酶a代谢紊乱相关。中华内分泌杂志,2017;29(4):344 - 344。https://doi.org/10.1152/ajpendo.00105.2017。
登贝斯滕G,兰格K,哈文加R,范戴克TH,葛丁A,范尤恩K,等。来自肠道的短链脂肪酸被宿主碳水化合物和脂类生动地同化。中华实用医学杂志。2013;30 (12):G900-10。https://doi.org/10.1152/ajpgi.00265.2013。
莫里森DJ,普雷斯顿T.短链脂肪酸的形成肠道微生物群及其对人体代谢的影响。肠道微生物,2016;7(3):189-200。https://doi.org/10.1080/19490976.2015.1134082。
Roshanravan N, Mahdavi R, Alizadeh E, Jafarabadi MA, Hedayati M, Ghavami A,等。丁酸盐和菊粉对2型糖尿病患者血糖状态、血脂和胰高血糖素样肽1水平的影响:一项随机双盲研究安慰剂对照试验Horm Metab res 2017;49(11): 886-91。https://doi.org/10.1055/s-0043-119089。
戈麦斯-阿兰戈LF,巴雷特HL,麦金太尔HD,卡拉威LK,莫里森M,德克尔NM。妊娠早期收缩压和舒张压升高与肠道菌群组成和丁酸盐产生的改变有关。高血压。2016;68(4):974 - 81。https://doi.org/10.1161/hypertensionaha.116.07910。
Beretta MV, Bernaud FR, Nascimento C, Steemburgo T, Rodrigues TC。高纤维摄入量与1型糖尿病患者较低的血压水平有关。《内分泌杂志》2018;62(1):47-54。https://doi.org/10.20945/2359-3997000000008。
Evans CE, Greenwood DC, Threapleton DE, Cleghorn CL, Nykjaer C, Woodhead CE,等。膳食纤维类型对血压的影响:对健康个体随机对照试验的系统回顾和荟萃分析中华外科杂志,2015;33(5):897-911。https://doi.org/10.1097/hjh.0000000000000515。
陈晓明,李志强,陈志强,等。短链脂肪酸醋酸酯通过中枢稳态机制降低食欲。Nat Commun. 2014;5:3611。https://doi.org/10.1038/ncomms4611。
•van der Beek CM, Canfora EE, Lenaerts K, Troost FJ, Olde Damink SWM, Holst JJ,等。远端,而不是近端,结肠醋酸盐输注促进脂肪氧化和改善超重/肥胖男性的代谢标志物。临床科学(伦敦)。2016; 130(22): 2073 - 82。https://doi.org/10.1042/cs20160263van der Beek(2016)的研究强调了区域SCFA在肠道中产生的重要性,并且由于SCFA生理的区域和组织特异性,使用口服和区域给药SCFA的研究需要谨慎解释。
Canfora EE, Blaak EE。醋酸盐:能量代谢中的一种饮食来源的关键代谢产物:在肥胖和葡萄糖稳态的背景下是好是坏?中国临床医学杂志。2017;20(6):477-83。https://doi.org/10.1097/mco.0000000000000408。
钱伯斯ES, Viardot A, Psichas A, Morrison DJ, Murphy KG, zack - varghese SEK,等。丙酸靶向递送对人结肠食欲调节、体重维持和超重成人肥胖的影响。肠道。2014;64:1744-54。https://doi.org/10.1136/gutjnl-2014-307913。
Byrne CS, Chambers ES, Alhabeeb H, china N, Morrison DJ, Preston T,等。结肠丙酸的增加减少了人类纹状体对高能量食物的预期奖励反应。中华临床杂志,2016;29(1):1 - 5。https://doi.org/10.3945/ajcn.115.126706。
陈志伟,陈志伟,陈志伟,等。膳食衍生的短链脂肪酸丙酸改善人体β细胞功能,并在体外刺激人体胰岛胰岛素分泌。中国糖尿病杂志,2017;19(2):257-65。https://doi.org/10.1111/dom.12811。
钱伯斯ES, Byrne CS, Rugyendo A, Morrison DJ, Preston T, Tedford MC,等。膳食补充菊粉和菊粉-丙酸酯对成人非酒精性脂肪性肝病肝脏脂肪变性的影响糖尿病Obes Metab, 2018。https://doi.org/10.1111/dom.13500。
钱伯斯,陈勇,陈志强,陈志强,等。急性口服丙酸钠补充剂增加了空腹人的静息能量消耗和脂质氧化。中国糖尿病杂志。2018;20(4):1034-9。https://doi.org/10.1111/dom.13159。
李震,易春霞,Katiraei S, Kooijman S,周娥,钟志强,等。丁酸盐降低食欲,并通过肠道-大脑神经回路激活棕色脂肪组织。肠道。2018;67(7):1269 - 79。https://doi.org/10.1136/gutjnl-2017-314050。
Canfora EE, van der Beek CM, Jocken JWE, Goossens GH, Holst JJ, Olde Damink SWM,等。短链脂肪酸混合物结肠输注促进超重/肥胖男性的能量代谢:一项随机交叉试验。科学通报2017;7(1):2360。https://doi.org/10.1038/s41598-017-02546-x。
尼科鲁奇AC,休谟MP,马丁内斯I,马英巴姆S,沃尔特J,雷默RA。在超重或肥胖的儿童中,益生元可减少体脂并改变肠道菌群。胃肠病学。2017;153(3):711 - 22所示。https://doi.org/10.1053/j.gastro.2017.05.055。
van der Beek CM, Canfora EE, Kip AM, Gorissen SHM, Olde Damink SWM, van Eijk HM,等。益生元菊粉改善底物代谢和促进短链脂肪酸的生产超重到肥胖男性。新陈代谢。2018;87:25-35。https://doi.org/10.1016/j.metabol.2018.06.009。
Weitkunat K, Stuhlmann C, Postel A, Rumberger S, Fankhanel M, Woting A,等。短链脂肪酸和菊粉,而不是瓜尔胶,可以通过小鼠的差异机制防止饮食诱导的肥胖和胰岛素抵抗。科学通报2017;7(1):6109。https://doi.org/10.1038/s41598-017-06447-x。
Singh A, Zapata RC, Pezeshki A, Reidelberger RD, Chelikani PK.菊粉纤维剂量依赖调节高脂喂养雄性大鼠的能量平衡、葡萄糖耐量、肠道微生物群、激素和饮食偏好。《生物化学学报》2018;59:142-52。https://doi.org/10.1016/j.jnutbio.2018.05.017。
Reimer RA, Willis HJ, Tunnicliffe JM, Park H, Madsen KL, Soto-Vaca a .菊粉型果聚糖和乳清蛋白都能调节食欲,但只有果聚糖能改变超重/肥胖成人的肠道菌群:一项随机对照试验。Mol Nutr Food res 2017;61(11)。https://doi.org/10.1002/mnfr.201700484。
休谟MP,尼科鲁奇AC,雷默RA。补充益生元改善超重和肥胖儿童的食欲控制:一项随机对照试验。中华临床医学杂志,2017;29(4):489 - 497。https://doi.org/10.3945/ajcn.116.140947。
猜猜ND,多恩霍斯特A,奥利弗N,弗罗斯特GS。一项随机交叉试验:菊粉对前驱糖尿病亚型葡萄糖稳态的影响。中国生物医学工程学报,2016;29(1):344 - 344。https://doi.org/10.1159/000441626。
刘峰,Prabhakar M,鞠军,龙海,周宏伟。菊粉型果聚糖对血脂和血糖水平的影响:随机对照试验的系统回顾和荟萃分析。中华临床医学杂志,2017;29(1):1 - 6。https://doi.org/10.1038/ejcn.2016.156。
Gonzalez A, Krieg R, Massey HD, Carl D, Ghosh S, Gehr TWB,等。丁酸钠通过调节肠通透性和黏蛋白表达改善CKD大鼠的胰岛素抵抗和肾功能衰竭。Nephrol Dial Transplant, 2018。https://doi.org/10.1093/ndt/gfy238。
冯伟,吴勇,陈刚,付松,李波,黄波,等。丁酸钠以gpr109a依赖的方式减轻断奶仔猪腹泻并促进结肠紧密连接蛋白的表达。中国生物化学杂志,2018;47(4):1617-29。https://doi.org/10.1159/000490981。
胡德德,陈大志,吴建林,卢斌斌,陈林,郑明明,等。高纤维膳食和丁酸钠通过调节免疫调节细胞和肠屏障来减弱实验性自身免疫性肝炎。细胞免疫,2018;328:24-32。https://doi.org/10.1016/j.cellimm.2018.03.003。
Matheus VA, Monteiro L, Oliveira RB, Maschio DA, collres - buzato CB。丁酸盐可降低糖尿病前期小鼠高脂饮食诱导的代谢改变、肝脏脂肪变性、胰腺β细胞和肠屏障功能障碍。Exp生物医学(梅伍德)。2017:1535370217708188。https://doi.org/10.1177/1535370217708188。
韩霞,宋辉,王勇,盛勇,陈杰。丁酸钠对腹膜炎小鼠肠屏障功能的保护作用。中华临床医学杂志,2015;8(3):4000-7。
杨峰,王丽玲,李霞,王丽文,韩晓青,龚志军。丁酸钠对大鼠毒性急性肝衰竭有保护作用。肝胆胰杂志2014;13(3):309-15。
莫克尔,拉克纳,梅尼策尔,曼格,李霍弗,Halwachs B,等。女性血清佐菌素反映的肠道菌群、饮食摄入量和肠道通透性。《Eur J Nutr》,2018。https://doi.org/10.1007/s00394-018-1784-0。
Cornick S, Tawiah A, Chadee K.肠道粘液屏障的作用和调节。组织屏障。2015;3(1-2):e982426。https://doi.org/10.4161/21688370.2014.982426。
•Kim S, Goel R, Kumar A, Qi Y, Lobaton G, Hosaka K,等。高血压患者肠道菌群失衡与肠上皮屏障功能障碍临床科学(伦敦)。132(6): 701 - 2018; 18。https://doi.org/10.1042/cs20180087Kim等人(2018)的研究值得注意,因为观察到肠道屏障功能的一系列标记物与血压之间的关联。虽然在人类中尚未建立因果关系,但动物模型数据表明,SCFA丁酸盐起着关键作用。
刘涛,Cephas KD, Holscher HD, Kerr KR, Mangian HF, Tappenden KA,等。不可消化的果聚糖改变了饮食诱导肥胖的C57BL/6J小鼠的胃肠屏障功能、基因表达、组织形态学和微生物群特征。中国生物医学工程学报,2016;26(5):344 - 344。https://doi.org/10.3945/jn.115.227504。
Ferolla SM, Couto CA, Costa-Silva L, Armiliato GN, Pereira CA, Martins FS等。在非酒精性脂肪性肝炎人群中,补充共生生物对肝脏脂肪变性和人体测量参数的有益影响,但对肠道渗透性没有影响。营养。2016;8(7)。https://doi.org/10.3390/nu8070397。
李强,吴涛,刘睿,张敏,王蓉。可溶性膳食纤维通过肠道微生物群降低三甲胺代谢,并共同调节宿主AMPK通路。Mol Nutr Food res 2017;61(12)。https://doi.org/10.1002/mnfr.201700473。
Baugh ME, Steele CN, Angiletta CJ, Mitchell CM, Neilson AP, Davy BM等。菊粉补充不能降低2型糖尿病高危人群血浆三甲胺n -氧化物浓度。营养。2018; 10(6)。https://doi.org/10.3390/nu10060793。
木村I, Inoue D, Hirano K, Tsujimoto G.短链脂肪酸受体GPR43与能量代谢。前内分泌(洛桑)。2014; 5:85。https://doi.org/10.3389/fendo.2014.00085。
Bolognini D, Tobin AB, Milligan G, Moss CE。短链脂肪酸受体的药理学和功能。中国药理学杂志,2016;89(3):388-98。https://doi.org/10.1124/mol.115.102301。
张志强,张志强,张志强,等。激活烟酸和共生代谢物丁酸的受体(Gpr109a)可抑制结肠炎症和癌变。免疫力。2014;40(1):128 - 39。https://doi.org/10.1016/j.immuni.2013.12.007。
•Pluznick JL, Protzko RJ, Gevorgyan H, Peterlin Z, Sipos A, Han J,等。嗅觉受体响应肠道微生物源信号在肾素分泌和血压调节中发挥作用。中国科学(d辑),2013;29(3):344 - 344。https://doi.org/10.1073/pnas.1215927110Pluznick等(2013)的研究通过SCFA对肾肾小球旁细胞和血管平滑肌细胞中表达的受体Olfr78和FFAR 3的拮抗作用,证明了SCFA对血压的复杂生物学调控作用。
Natarajan N, Hori D, Flavahan S, Steppan J, Flavahan NA, Berkowitz DE,等。微生物短链脂肪酸代谢产物通过内皮G蛋白偶联受体41降低血压。中国生物医学工程学报。2016;48(11):826-34。https://doi.org/10.1152/physiolgenomics.00089.2016。
王磊,朱强,陆安,刘旭,张磊,徐超,等。丁酸钠通过抑制肾(亲)肾素受体和肾内肾素-血管紧张素系统抑制血管紧张素ii诱导的高血压。中国生物医学工程学报,2017;35(9):1899-908。https://doi.org/10.1097/hjh.0000000000001378。
Boets E, Deroover L, Houben E, Vermeulen K, Gomand SV, Delcour JA,等。菊粉体内结肠短链脂肪酸生成的定量研究。第七营养素。2015;(11):8916 - 29。https://doi.org/10.3390/nu7115440。
•Thaiss CA, Levy M, Grosheva I,郑D, Soffer E, Blacher E,等。高血糖可导致肠屏障功能障碍和肠道感染风险。科学。2018;359(6382):1376 - 83。https://doi.org/10.1126/science.aar3318Thaiss等人(2018)的研究表明,肠道微生物活性、短链脂肪酸和葡萄糖稳态之间存在复杂的系统和互惠关系,进而影响肠道屏障功能。
程东,徐建华,李建勇,王淑云,吴廷峰,陈庆科,等。丁酸改善- nlrc3以gpr43依赖的方式保护肠屏障。Exp Cell res 2018;368(1): 101-10。https://doi.org/10.1016/j.yexcr.2018.04.018。
黄晓珍,李志荣,朱林龙,黄海燕,侯丽丽,林娟。p38丝裂原活化蛋白激酶抑制丁酸诱导的Caco-2细胞单层肠屏障损伤。中华儿科胃肠病学杂志,2014;59(2):264-9。https://doi.org/10.1097/mpg.0000000000000369。
郑玲,Kelly CJ, Battista KD, Schaefer R, Lanis JM, Alexeev EE,等。微生物来源的丁酸盐通过IL-10受体依赖的claudin-2抑制促进上皮屏障功能。中华免疫杂志,2017;19(8):2976-84。https://doi.org/10.4049/jimmunol.1700105。
H燕,KM阿朱旺。丁酸通过选择性上调紧密连接蛋白和激活Akt信号通路来修饰IPEC-J2细胞的肠屏障功能。公共科学学报,2017;12(6):e0179586。https://doi.org/10.1371/journal.pone.0179586。
童立龙,王勇,王志斌,刘文文,孙松,李林,等。丙酸通过改善肠屏障功能和减少炎症和氧化应激来改善右旋糖酐硫酸钠诱导的结肠炎。Front Pharmacol, 2016;7:253。https://doi.org/10.3389/fphar.2016.00253。
周东,潘强,辛富珍,张仁仁,何彩霞,陈光宇,等。丁酸钠通过改善肠道菌群和胃肠屏障来减轻高脂饮食引起的小鼠脂肪性肝炎。世界胃肠杂志,2017;23(1):60-75。https://doi.org/10.3748/wjg.v23.i1.60。
den Besten G, Bleeker A, Gerding A, van Eunen K, Havinga R, van Dijk TH,等。短链脂肪酸通过依赖pparγ从脂肪生成到脂肪氧化的转换来防止高脂肪饮食诱导的肥胖。糖尿病。2015;64(7):2398 - 408。https://doi.org/10.2337/db14-1213。
Darzi J, Frost GS, Robertson MD.一种新型富含丙酸的酵母面包对食欲和食物摄入量的影响。中华临床病学杂志,2012;26(7):349 - 349。https://doi.org/10.1038/ejcn.2012.1。
Psichas A, Sleeth ML, Murphy KG, Brooks L, Bewick GA, Hanyaloglu AC,等。短链脂肪酸丙酸通过游离脂肪酸受体2刺激啮齿动物GLP-1和PYY的分泌。中国生物医学工程学报。2015;39(3):424-9。https://doi.org/10.1038/ijo.2014.153。
贾勇,洪杰,李辉,胡勇,贾林,蔡东,等。丁酸通过组蛋白高乙酰化相关β 3 -肾上腺素能受体激活刺激高脂饮食诱导的肥胖小鼠的脂肪脂解和线粒体氧化磷酸化。中国生物医学工程学报,2017;32(2):344 - 344。https://doi.org/10.1113/ep086114。
张文杰,张文杰,张文杰,等。丁酸钠通过核小体定位表观遗传调节高脂饮食诱导的骨骼肌线粒体适应、肥胖和胰岛素抵抗。中国药物学杂志,2015;29(4):344 - 344。https://doi.org/10.1111/bph.13058。
木村I,小泽K,井上D,今村T,木村K,前田T,等。肠道菌群通过短链脂肪酸受体GPR43抑制胰岛素介导的脂肪积累。Nat Commun. 2013;4:1829。https://doi.org/10.1038/ncomms2852。
Kim YA, Keogh JB, Clifton PM。益生菌,益生元,合生素和胰岛素敏感性。生态学报,2018;31(1):35-51。https://doi.org/10.1017/s095442241700018x。
Vetrani C, Costabile G, Luongo D, Naviglio D, Rivellese AA, Riccardi G,等。全谷物谷物食品对代谢综合征患者血浆短链脂肪酸浓度的影响营养。2016;32(2):217 - 21所示。https://doi.org/10.1016/j.nut.2015.08.006。
李志强,王志强,王志强,王志强。菊粉和抗性淀粉对精瘦和超重人群餐后血清短链脂肪酸和第二餐血糖反应的急性影响。中华临床医学杂志,2017;29(2):344 - 344。https://doi.org/10.1038/ejcn.2016.248。
•Marino E, Richards JL, McLeod KH, Stanley D, Yap YA, Knight J,等。肠道微生物代谢产物限制自身免疫T细胞的频率,并预防1型糖尿病。中华免疫杂志,2017;18(5):552-62。https://doi.org/10.1038/ni.3713Marino等人(2017)的研究表明,在非肥胖糖尿病小鼠菌株中,局部调节肠道中SCFA的产生对调节免疫细胞反应以预防糖尿病的重要性。
李志强,李志强,李志强,等。短链脂肪酸通过g蛋白偶联受体FFAR2刺激胰高血糖素样肽-1的分泌。糖尿病。2012;61(2):364 - 71。https://doi.org/10.2337/db11-1019。
裴俊杰,彭林,巴瑞娜,克莱恩GW,张东,Cardone RL,等。醋酸盐介导微生物组-脑-细胞轴促进代谢综合征。大自然。2016;534(7606):213 - 7。https://doi.org/10.1038/nature18309。
洪杰,贾勇,潘松,贾林,李辉,韩忠,等。丁酸盐通过激活脂联素介导通路和刺激小鼠骨骼肌线粒体功能来缓解高脂饮食引起的肥胖。Oncotarget。2016;7(35):56071 - 82。https://doi.org/10.18632/oncotarget.11267。
张玲,杜娟,矢野宁,王华,赵宜东,Dubielecka PM,等。丁酸钠对高脂饮食引起的II型糖尿病小鼠心功能障碍和代谢紊乱有保护作用。中国生物医学工程学报,2017;18(8):2395-408。https://doi.org/10.1002/jcb.25902。
Tilg H, Moschen AR, Roden M. NAFLD与糖尿病。中华胃肠外科杂志,2017;14(1):32-42。https://doi.org/10.1038/nrgastro.2016.147。
魏昆特K,舒曼S,镍D, Kappo KA, Petzke KJ, Kipp AP,等。丙酸在高脂饮食诱导的肥胖中抑制肝脏脂肪生成和改善胰岛素敏感性的重要性。中国生物医学工程学报,2016;29(6):529 - 529。https://doi.org/10.1002/mnfr.201600305。
确认
本文得到了英国生物技术和生物科学研究委员会(BB/L004259/1, BB/H004815/1)的支持,并得到了帝国理工学院(IC)医疗保健NHS信托的NIHR CRF BRC的支持。所表达的观点是作者的观点,不一定是IC, NHS, NIHR或卫生部的观点。糖尿病、内分泌、代谢和研究医学学部由MRC、BBSRC、NIHR、综合哺乳动物生物学(IMB)能力建设奖、FP7- HEALTH- 2009- 241592 EuroCHIP赠款资助,并由NIHR生物医学研究中心资助计划支持。GF拥有NIHR高级研究员奖。
作者信息
作者及隶属关系
相应的作者
道德声明
利益冲突
爱德华·钱伯斯宣称他没有利益冲突。
Tom Preston是已发布专利#WO2014020344(“化合物及其对食欲控制和胰岛素敏感性的影响”)的联合发明人。
Gary Frost是已发布专利#WO2014020344(“化合物及其对食欲控制和胰岛素敏感性的影响”)的联合发明人。
Douglas J. Morrison是已发布专利#WO2014020344(“化合物及其对食欲控制和胰岛素敏感性的影响”)的联合发明人。
人权和动物权利以及知情同意
本文不包含任何作者对人类或动物进行的任何研究。
额外的信息
这篇文章是主题集合的一部分心血管病
权利和权限
开放获取本文根据创作共用署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)发布,该协议允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的署名,提供到创作共用许可协议的链接,并注明是否有更改。
关于本文
引用本文
钱伯斯,e.s.,普雷斯顿,T,弗罗斯特,G。et al。肠道微生物群生成的短链脂肪酸在代谢和心血管健康中的作用Curr Nutr代表7, 198-206(2018)。https://doi.org/10.1007/s13668-018-0248-8
发表:
发行日期:
DOI:https://doi.org/10.1007/s13668-018-0248-8
关键字
- 短链脂肪酸
- 肠道微生物组
- 发酵
- 葡萄糖稳态
- 血压
- 食欲调节
- 肥胖
- 炎症
- 代谢健康
- 心血管病