文摘gydF4y2Ba
缺乏一个小动物模型人类丙型肝炎病毒(HCV)的抗病毒治疗对这种流行病感染阻碍发展。普通人类的肝细胞移植到SCID小鼠携带纤溶酶原激活物转基因(gydF4y2BaAlb-uPAgydF4y2Ba),我们生成的老鼠与人类肝嵌合体。纯合性的gydF4y2BaAlb-uPAgydF4y2Ba与更高水平的人类肝细胞移植,和这些老鼠发达长期丙肝病毒感染病毒滴度高的人类血清与感染接种后。初始总病毒载量的增加1950倍,节段病毒RNA的复制检测证实移植肝脏。丙肝病毒蛋白质被本地化的人类肝细胞结节和感染是通过三代的老鼠连续通过确认感染性病毒颗粒的合成和释放。这些嵌合小鼠代表第一个小鼠模型适用于研究人类丙型肝炎病毒gydF4y2Ba在活的有机体内gydF4y2Ba。gydF4y2Ba
主要gydF4y2Ba
丙型肝炎病毒引起的人类肝脏疾病已成为医学界的重大挑战,影响全世界估计有1.75亿人gydF4y2Ba1gydF4y2Ba。说明1989年的病毒序列(ref。gydF4y2Ba2gydF4y2Ba丙肝病毒)共同发起的研究。抗病毒治疗联合干扰素和利巴韦林是在选定的病人有效,但许多不响应或容忍治疗不佳,强调需要改进。发展有效的治疗策略明显受到难以建立gydF4y2Ba在体外gydF4y2Ba和gydF4y2Ba在活的有机体内gydF4y2Ba病毒复制的模型。gydF4y2Ba
的gydF4y2BaAlb-uPAgydF4y2Ba转基因老鼠,1990年开发研究新生儿出血失调gydF4y2Ba3gydF4y2Ba,进行一系列串联的四个鼠尿激酶基因控制的白蛋白启动子。这种转基因目标尿激酶生产过剩到肝脏导致深刻hypofibrinogenemic状态,加速肝细胞死亡。通过随机体细胞突变,个别肝细胞自发的删除部分转基因数组,在周围的细胞提供一个重要的复制的优势,导致重新主要nontransgenic的肝细胞gydF4y2Ba4gydF4y2Ba。这种生存优势扩展到肝细胞移植的老鼠,老鼠gydF4y2Ba5gydF4y2Ba和土拨鼠捐助者gydF4y2Ba6gydF4y2Ba,最近在嗜肝病毒系统使用无限增殖gydF4y2Ba7gydF4y2Ba和nonimmortalizedgydF4y2Ba8gydF4y2Ba人类肝细胞。gydF4y2Ba
人类生存与移植gydF4y2BaAlb-uPAgydF4y2Ba接合性gydF4y2Ba
我们走过gydF4y2BaAlb-uPAgydF4y2Ba和C.b-17 / SCID /gydF4y2BabggydF4y2Ba鼠标线,通过选择性回交育种SCID的纯合性特征。在最初的实验中,纯合子SCID动物携带gydF4y2BaAlb-uPAgydF4y2Ba转基因以半合的方式交叉,窝与新鲜孤立的人类肝细胞移植。完全由人类肝细胞白蛋白是用作移植肾功能的指标gydF4y2Ba9gydF4y2Ba。gydF4y2Ba
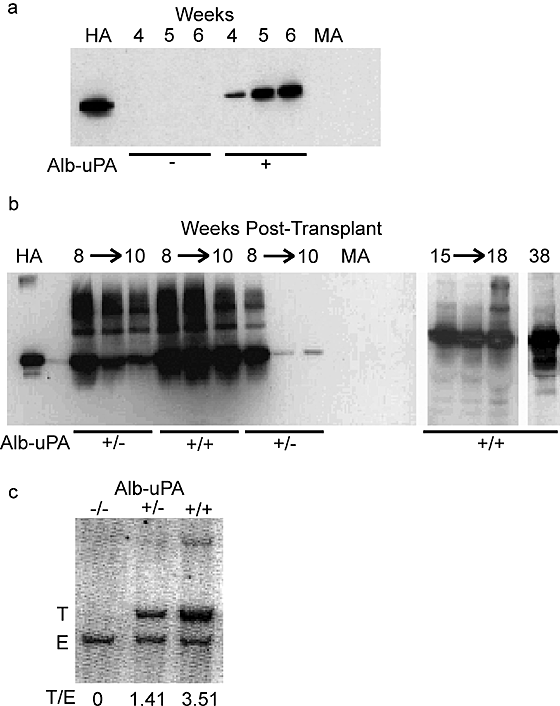
在试点研究36移植,强大的白蛋白信号在4 - 5周移植后的血清中演示了19人。我们检测白蛋白乐队在移植后2周增加强度在4-6-week时间点,表明移植物扩张(gydF4y2Ba图1gydF4y2Ba一个gydF4y2Ba)。盲法显示所有强烈human-albumin-positive动物进行基因型分析gydF4y2BaAlb-uPAgydF4y2Ba,而其余部分没有。gydF4y2Ba
一个gydF4y2Ba在野生型、免疫印迹分析显示早期公顷生产(−)或转基因(+)收件人;增量增加HA信号表明移植物扩张。gydF4y2BabgydF4y2Ba免疫印迹分析显示移植受者长期公顷生产半合(+ /−)或纯合子(+ / +)gydF4y2BaAlb-uPAgydF4y2Ba转基因。吸干了半合子衰减信号,与坚持在该信号。哈在左边的车道,哈标准;在最右边的马,nontransplanted小鼠血清(负控制)。gydF4y2BacgydF4y2Ba,印迹分析测定gydF4y2BaAlb-uPAgydF4y2Ba从基因组DNA接合性。转基因uPA:内生nuPA (T / E)的比率gydF4y2Ba∼gydF4y2Ba2是半合子的老鼠的特征,而该比率gydF4y2Ba∼gydF4y2Ba4所示。gydF4y2Ba
尽管最初白蛋白信号很强,一些收件人显示灭绝的信号14周左右,而第二个子集保持强劲的信号超出30周(gydF4y2Ba图1gydF4y2BabgydF4y2Ba)。随着这些移植受者是杂合的十字架的后代,我们假设这个分歧是接合性的结果gydF4y2BaAlb-uPAgydF4y2Ba。转基因和内生gydF4y2BauPAgydF4y2Ba区分了印迹分析,然后使用信号比确定的接合性转基因阵列(gydF4y2Ba图1gydF4y2BacgydF4y2Ba)。基因组DNA分析证实,动物展示持续人类移植是纯合的gydF4y2BaAlb-uPAgydF4y2Ba,而失败的移植肾功能的子集是半合。gydF4y2Ba
小鼠肝脏是人体肝细胞重新填充gydF4y2Ba
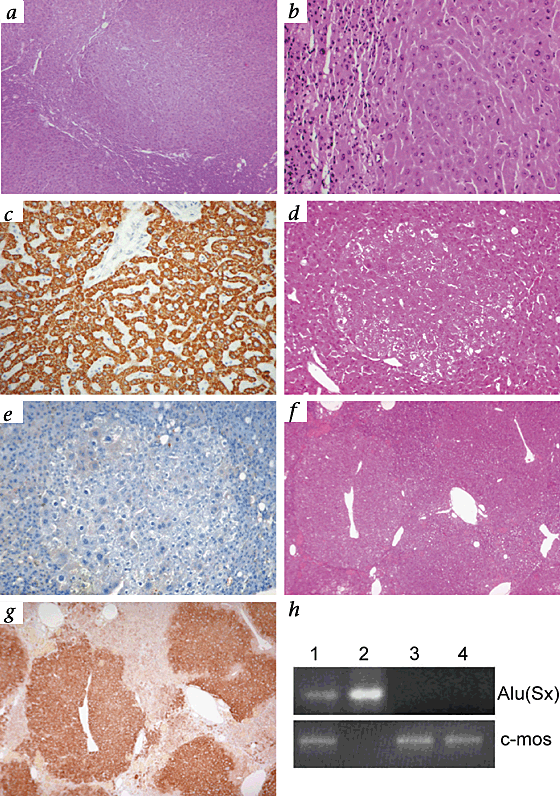
结合体移植肝脏的部分显示大结节的肝细胞排列在典型cord-like结构(gydF4y2Ba图2gydF4y2Ba一个gydF4y2Ba)。在结节,肝细胞胞浆和核出现组织学正常的与周围组织细胞明显较小,与有液泡的细胞质和细胞核固缩的(gydF4y2Ba图2gydF4y2BabgydF4y2Ba)。我们应用部分的单克隆抗体交叉反应强烈彩色控制人类的肝脏,但没有与非移植纯合子小鼠肝脏内或外的从内部产生再生结节(gydF4y2Ba图2gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba和gydF4y2BaegydF4y2Ba)。这显示结节显然是人类的起源,向外扩张和压缩murine-derived周围组织(gydF4y2Ba图2gydF4y2BafgydF4y2Ba和gydF4y2BaggydF4y2Ba)。胆道和门户结构似乎主要host-derived Rhim观察到gydF4y2Ba等gydF4y2Ba。gydF4y2Ba10gydF4y2Ba
一个gydF4y2Ba和gydF4y2BabgydF4y2Ba结合体,移植沾染了)。gydF4y2BacgydF4y2Ba,人工肝应用单克隆抗体对人类肝细胞。gydF4y2BadgydF4y2Ba,结合体Nontransplanted mouse-derived再生结节;他走时染色。gydF4y2BaegydF4y2Ba,连续切片gydF4y2BadgydF4y2Ba应用在gydF4y2BacgydF4y2Ba。gydF4y2BafgydF4y2Ba结合体,移植沾染了)。gydF4y2BaggydF4y2Ba,连续切片gydF4y2BafgydF4y2Ba应用与人类肝细胞单克隆抗体。的放大,×40 (gydF4y2Ba一个gydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba)和×200 (gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba和gydF4y2BaegydF4y2Ba)。gydF4y2BahgydF4y2Ba、基因组DNA提取肝移植的纯合子gydF4y2Ba铝青铜/ uPAgydF4y2Ba老鼠和人类特有的分析gydF4y2BaAluSxgydF4y2Ba共识序列或murine-specificgydF4y2Bac-mosgydF4y2Ba原癌基因。gydF4y2BaAluSxgydF4y2Ba从移植的共识是在基因组DNA中发现gydF4y2Ba铝青铜/ uPAgydF4y2Ba小鼠肝脏(巷1)和人类外周血(巷2)而不是从非移植控制gydF4y2Ba铝青铜/ uPAgydF4y2Ba小鼠肝脏(巷3)或鼠控制尾(巷4)。gydF4y2Ba
额外确认人类的嵌合现象,我们从肝脏移植和孤立的基因组DNA nontransplanted老鼠,我们杰出的小鼠和人类DNA使用pcr检测策略gydF4y2Ba运算器gydF4y2Ba元素,短的点缀元素只存在于灵长类动物基因组序列gydF4y2Ba11gydF4y2Ba(gydF4y2Ba图2gydF4y2BahgydF4y2Ba)。gydF4y2BaAluSxgydF4y2Ba是最丰富的亚科和被认为代表了一般人吗gydF4y2Ba运算器gydF4y2Ba共识。我们确认的小鼠的基因组DNA, PCR扩增序列映射到小鼠gydF4y2Bac-mosgydF4y2Ba原癌基因gydF4y2Ba12gydF4y2Ba。正如所料,nontransplanted老鼠肝脏DNA和老鼠尾巴活检DNA包含原癌基因,但没有gydF4y2Ba运算器gydF4y2Ba重复,而人类外周血中gydF4y2Ba运算器gydF4y2Ba重复而不是原癌基因。分析DNA的提取从一个移植小鼠肝脏明显显示两支乐队,建立肝内人类基因组DNA的存在。gydF4y2Ba
建立移植中感染丙型肝炎病毒的老鼠gydF4y2Ba
延长人类移植的证据,我们下一个感染小鼠的血清hcv感染人类的捐助者。我们将未受人类肝细胞移植到27个后代从杂合的十字架,在移植后6周所有小鼠静脉注射和/或腹腔内注射0.25毫升人类血清获得从1 2无关HCV-positive捐助者(病毒基因型1和6)。我们分析了选择血清样本接种后3至40周的存在正链HCV RNA逆转录酶聚合酶链反应(RT) (gydF4y2Ba表1gydF4y2Ba)。gydF4y2Ba
所有八个野生型控件显示不持续消极的初始移植肾功能和丙肝病毒RNA。半合动物最初白蛋白信号很强,但逐渐显示信号强度递减平均移植15.5周的持续时间;我们不能检测丙肝病毒正链RNA的这些动物在多个时间点。与此形成鲜明对比的是,所有四个动物的纯合子gydF4y2BaAlb-uPAgydF4y2Ba转基因证明持续人类嵌合现象(平均30.5周),丙肝病毒RNA阳性血清通过rt - pcr分析如图所示。定量丙肝病毒RNA分析显示,病毒水平,从1.4×10gydF4y2Ba3gydF4y2Ba1.4×10gydF4y2Ba6gydF4y2BaRNA拷贝/毫升,是感染人类的范围之内。成功的建立了感染两种基因型的病毒培养液,感染和持续时间范围从10 - 21周在这个初始群体。gydF4y2Ba
丙肝病毒感染是依赖gydF4y2BaAlb-uPAgydF4y2Ba纯合性gydF4y2Ba
而正链HCV RNA在纯合子小鼠持续可见的,我们无法检测半合子。我们假设半合子后未能支持检测丙肝病毒复制水平减少最初的嫁接和移植早些时候的损失。我们开发了一种蛋白质点状试验用化学发光和phosphoimaging更准确地量化白蛋白生产。在移植后1×10gydF4y2Ba6gydF4y2Ba低温贮藏人类肝细胞从一个人类捐献到21接受者(比如15日和6半合子),我们随机选择采样动物定量白蛋白分析和/或免疫组织化学分析。gydF4y2Ba
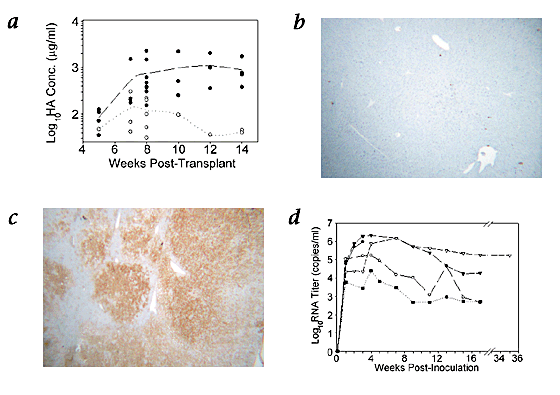
而半合和纯合子动物最初显示类似的白蛋白信号强度,通过5 - 6周明显的差异是明显的,10 - 12周白蛋白信号在纯合子小鼠超过一个数量级高于半合子(gydF4y2Ba图3gydF4y2Ba一个gydF4y2Ba)。估计百分比更换小鼠肝脏与人体组织,随机从接受者肝部分移植后死亡在指定时间点与肝细胞的单克隆抗体的具体应用。这些免疫组织化学数据证实了点状的蛋白质的发现,人类细胞占据可观的部分肝脏(> 50%)的横截面积纯合子小鼠(gydF4y2Ba图3gydF4y2BabgydF4y2Ba)。在鲜明的对比中,我们检查组织的多个部分杂合的接受者,发现只有很少的证据人类移植(gydF4y2Ba图3gydF4y2BacgydF4y2Ba)。综合来看,这些研究都表明相当优势的大小和持续时间为纯合子的人类肝细胞移植gydF4y2BaAlb-uPAgydF4y2Ba收件人与杂合的同行相比。gydF4y2Ba
一个gydF4y2Ba,Vertica-scatter块量化公顷生产从个体纯合子(gydF4y2Ba●gydF4y2Ba)或半合(gydF4y2Ba○gydF4y2Ba)受体鼠血清样本。两组的平均趋势线所示。gydF4y2BabgydF4y2Ba和gydF4y2BacgydF4y2Ba照片显示,代表部分取自杂合的(gydF4y2BabgydF4y2Ba)和纯合子(gydF4y2BacgydF4y2Ba)gydF4y2BaAlb-uPAgydF4y2Ba移植受者移植后12周应用与反人类肝细胞抗体。gydF4y2BadgydF4y2Ba,血清HCV RNA浓度随着时间的推移,在接种后纯合子转基因移植受者血清HCV感染人类。每个不同的线和符号代表连续滴度从一个人移植接受者。gydF4y2Ba
通过移植到后代的杂合的十字架,我们建立了成功的4/27感染小鼠,比如。这种模型的成功率会过于繁琐的日常使用。由于在移植物大小量化优势归结为纯合子小鼠,我们转移我们对独家生产纯合子的繁殖生长gydF4y2BaAlb-uPAgydF4y2Ba老鼠。使用我们的点状试验筛选早期进行高层肝细胞移植(白蛋白水平> 250μg /毫升),大约有75%的HCV-inoculated动物开发持续超过3×10的病毒滴度gydF4y2Ba4gydF4y2Ba拷贝/毫升,多达1×10gydF4y2Ba6gydF4y2Ba拷贝/毫升。病毒的其他研究也因此在纯合子。gydF4y2Ba
长期持久的丙肝病毒感染gydF4y2Ba
坚持人类的病毒滴度持续活跃增殖的结果。然而,在免疫功能不全的嵌合体动物,可能是HCV持久性是由于慢病毒消灭,而不是真正的感染和复制。五个纯合子的移植受者接种250μl感染人类血清(3基因型;2.95×10gydF4y2Ba6gydF4y2Ba病毒RNA拷贝/毫升);每只动物因此收到7.38×10的培养液gydF4y2Ba5gydF4y2BaRNA复制。病毒滴度,在3/5的患者增加了16 - 27 36-fold,分别在最初的培养液接种后5周(gydF4y2Ba图3gydF4y2BadgydF4y2Ba)。在剩下的2人,滴度温和增长超过5周(1.6 - 4.3倍,分别)。在这群老鼠,检测也证实了正链HCV RNA的15周后接种1动物和在17周2人(一个早死后血液采样)。在第五鼠标,高效感染丙肝病毒是在35周后接种病毒滴度为1.67×10gydF4y2Ba5gydF4y2Ba拷贝/毫升。初始浓度的上升加上居高不下的病毒水平在35周与病毒复制是一致的,并且不能归因于结转工件。gydF4y2Ba
3-log上升病毒滴度与丙肝病毒接种后gydF4y2Ba
病毒滴度检测初始上升可能掩饰了一个更高的病毒培养液,我们用一个小得多的病毒感染六分之一嵌合小鼠接种体(1.35×10gydF4y2Ba3gydF4y2BaRNA复制),然后每隔一周。这只老鼠迅速发达丙肝病毒感染,总在感染后10周血清病毒载量测定为1.33×10gydF4y2Ba6gydF4y2Ba册,增长了1000倍。在后续动物接种2 1.05×10gydF4y2Ba3gydF4y2Ba副本和1.75×10gydF4y2Ba3gydF4y2Ba册,滴度上升到9.5×10gydF4y2Ba5gydF4y2Ba拷贝/毫升10周和3.42×10gydF4y2Ba6gydF4y2Ba拷贝/毫升,分别在5周post-inoculation;上涨905倍和1954倍,这证实了最初的10周的结果。非生产性的交互不可能维持一个合理3-log病毒载量的增加,强烈支持病毒复制的发生。gydF4y2Ba
段在受体肝脏病毒RNAgydF4y2Ba
丙肝病毒是一种正链RNA病毒复制通过节段中间;检测肝脏内的节段HCV RNA是复制的证据。这个复制的中间被认为存在水平低10 - 100倍比它的正链模板gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,因此它的检测可以更困难。gydF4y2Ba
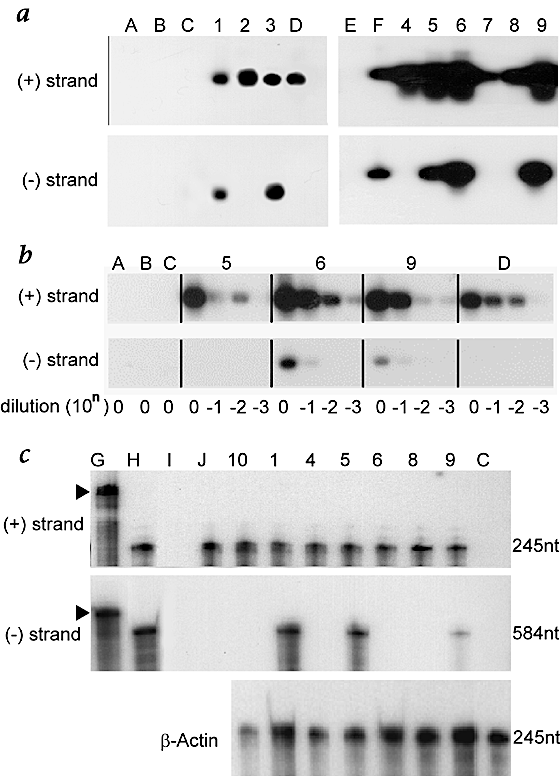
九纯合子的移植受者接种5×10gydF4y2Ba5gydF4y2Ba份刚获得人类血清病毒RNA显示正链HCV RNA在3 - 4周post-inoculation (gydF4y2Ba图4gydF4y2Ba一个gydF4y2Ba上)。肝组织的样本获得的50%部分肝切除术在2 - 5周post-inoculation 7小鼠和剩余12 - 13周2老鼠。分析节段丙肝病毒RNA进行盲评的一个独立的实验室(境)使用耐热性的rTth RT-RNA PCR (rTth PCR)协议和strand-specific引物(gydF4y2Ba图4gydF4y2Ba一个gydF4y2Ba较低的面板)。在5/9样品分析,节段RNA检测;这两个样本在12 - 13周post-inoculation没有显示节段RNA。减少假阳性结果的风险gydF4y2Ba15gydF4y2Ba,我们执行两组额外的验证性实验。gydF4y2Ba
字母名称(“A”通过“J”,指定以下和一致通过图)代表不同的RNA控制样品,数量和名称(1到10,图)和一致通过以下指定代表个人孤立的RNA样本10纯合子小鼠的肝脏移植,然后接种人类血清hcv感染。gydF4y2Ba一个gydF4y2Ba检测(+)链RNA(上)或(−)链RNA(低)耐热性的rTth逆转录酶RNA与strand-specific引物PCR协议。道:,野生型控制鼠标,nontransplanted,未感染;与丙肝病毒B,杂合的移植小鼠接种;C,纯合子不移植小鼠接种丙肝病毒;D,感染人类血清;E标准DNA梯;标记探针的F,绑定目标DNA序列生成的(+)链(上)或(−)病毒RNA链(低);G,老鼠肝RNA(10μg)与血清添加RNA从HCV-positive人类;H,老鼠肝RNA与1×10(10μg)补充道gydF4y2Ba6gydF4y2Ba副本radioinert反义(上)或意义(低)riboprobe;我,老鼠肝RNA与1×10(10μg)补充道gydF4y2Ba6gydF4y2Ba副本radio-inert意义(上)或反义riboprobe(低);J, riboprobes杂化10μg老鼠肝RNA,所有后续步骤相同,除了核糖核酸酶。gydF4y2BabgydF4y2Ba,Dilution-series分析选择动物使用耐热性的rTth逆转录酶RNA PCR协议。gydF4y2BacgydF4y2Ba、检测(+)链HCV RNA(上)、(−)链HCV RNA(中间)或β-actin RNA(低)核糖核酸酶保护试验。碎片在车道G代表未消化的riboprobe(箭头),与预期长度大于相应的片段杂交保护他们的目标。控制通道上面指定的;小鼠10只分析了雷达分析方法。gydF4y2Ba
使用rTth PCR,我们进行了稀释系列三种动物来确认稀释度的节段信号(gydF4y2Ba图4gydF4y2BabgydF4y2Ba)。正链信号检测在3-log稀释2/3的动物以及控制人类血清。正如所料,没有人类血清中发现段信号。在2/3的老鼠,节段信号显然是10倍稀释后可检测。第三只老鼠,我们没有检测节段;这个动物的减少正链信号表明相对较少的RNA是装上这些车道的凝胶。缺乏更多的样本材料防止重复分析该方法;然而,我们随后证实的存在节段使用核糖核酸酶保护方法。gydF4y2Ba
进一步验证实验,我们化验六个动物以前由上面的PCR检测方法(加上一个额外的动物)节段RNA使用一种核糖核酸酶保护试验在我们实验室开发的(gydF4y2Ba图4gydF4y2BacgydF4y2Ba)。结果从这个系统整合与以前的PCR结果在5/6老鼠,证实存在节段RNA 3/4老鼠和老鼠缺席剩下的2,最初由rTth PCR测试呈阴性反应。我们无法证实存在节段在一个鼠标;这种差异可能是由于RNase-protection试验的敏感性越少。gydF4y2Ba
显然这些单独和独立进行化验证明存在节段丙肝病毒RNA在2 - 5周post-inoculation嵌合肝内取样。我们先前的实验顺序每周定量rt - pcr分析显示出迅速崛起在丙肝病毒血清效价周接种后2 - 4,对应于最大的肝脏内的病毒复制。我们希望这是平行段病毒RNA的最大数量。经过这段时间的快速复制,病毒水平稳定,表明尽管正在进行复制时,减少速度等于病毒的损失。这也许可以解释为什么段RNA检测早期感染(5/6动物采样2 - 5周),而不是(0/2取样12 - 13周)。这些数据有力地支持活跃病毒复制小鼠模型。gydF4y2Ba
丙肝病毒感染可以连续通道gydF4y2Ba
我们从人类捐赠(腹腔内注入新鲜血清250μl;4.75×10gydF4y2Ba5gydF4y2Ba病毒RNA复制)到一个天真的嵌合小鼠;在接种后4周,病毒滴度分别为1.76×10gydF4y2Ba6gydF4y2Ba拷贝/毫升。血清来自这只老鼠(125μl;gydF4y2Ba∼gydF4y2Ba2.19×10gydF4y2Ba5gydF4y2BaRNA复制)腹腔内注入第二个天真的嵌合体小鼠,发达的滴度1.75×10gydF4y2Ba4gydF4y2Ba拷贝/毫升接种后4周。从100年首次通过收件人当时注射(血清μl;gydF4y2Ba∼gydF4y2Ba1.75×10gydF4y2Ba3gydF4y2Ba天真的嵌合小鼠RNA副本)到三分之一。在接种后5周,这第2通道接收3.42×10的病毒滴度gydF4y2Ba6gydF4y2Ba拷贝/毫升。血清从这个第2通道接收方(20μl)注入两个额外的天真的老鼠(第三段接受者),两人随后开发了丙肝病毒感染病毒滴度为1.6×10gydF4y2Ba5gydF4y2Ba和4.5×10gydF4y2Ba6gydF4y2Ba分别为9和11周post-inoculation,。如果一个假设零假设,复制不发生,而是最初的人类接种体持续下去,这些第三段收件人将收到约120份病毒从最初的培养液(4.75×10gydF4y2Ba5gydF4y2Ba病毒复制××1:8稀释1:10稀释×1:50稀释,如果老鼠血清体积gydF4y2Ba∼gydF4y2Ba1000μl)。在27周从人类最初的接种后鼠标,这些第三段接受者37500倍比会收到测量病毒RNA从原始人类的培养液。我们重复这个实验通过两个段落在另外两个系列的老鼠,并通过一个通道在第三个导致扩增病毒RNA从90 - 1057倍在最初的人类的培养液。这从人类传播→鼠标→鼠标→鼠标→鼠标代表的丙肝病毒基因组复制和生产完全传染性微粒。gydF4y2Ba
丙肝病毒感染人类肝细胞移植受者gydF4y2Ba
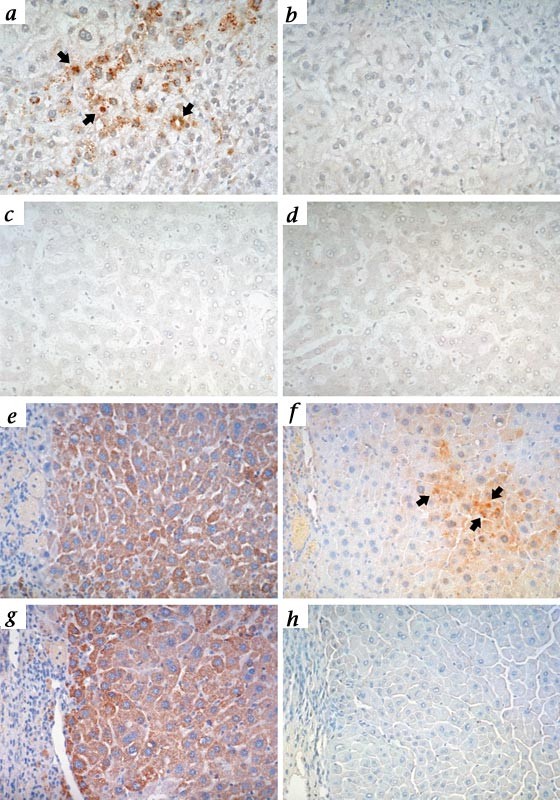
colocalize丙肝病毒感染在人类肝细胞嵌合体小鼠的肝脏内,我们应用部分肝移植来自纯合子小鼠生产丙肝病毒感染单克隆抗体对NS3 / NS4病毒多蛋白的一部分。控制部分被感染的人类肝脏肝细胞染色显示本地化,抽出的门户三位一体的结构和桥接纤维化领域(gydF4y2Ba图5gydF4y2Ba一个gydF4y2Ba)。使用严格的免疫组织化学标准定义的布罗迪gydF4y2Ba等gydF4y2Ba。gydF4y2Ba16gydF4y2Ba,感染细胞的特点是粗胞浆内颗粒(gydF4y2Ba图5gydF4y2Ba一个gydF4y2Ba箭头);弥漫性细颗粒胞质染色的部分被认为是特异性的。无关的isotype-specific控制抗体没有产生肝细胞内染色,和部分来自未感染人类的肝脏与抗体(无染色gydF4y2Ba图5gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba)。串行部分来自肝脏移植与多产的丙肝病毒感染小鼠的清楚地表明粗胞质颗粒局部特征在人类肝细胞结节,强度略有减弱与人工控制(gydF4y2Ba图5gydF4y2BaegydF4y2Ba和gydF4y2BafgydF4y2Ba)。我们只检测到HCV抗原在人类肝细胞,肝细胞周围没有染色的小鼠。尽管人类细胞显然是存在于移植纯合子小鼠感染丙肝病毒,丙肝病毒抗原(不存在gydF4y2Ba图5gydF4y2BaggydF4y2Ba和gydF4y2BahgydF4y2Ba)。这种免疫组织化学数据提供了令人信服的证据,丙肝病毒感染人类肝细胞结节内嵌合肝移植gydF4y2BaAlb-uPAgydF4y2Ba老鼠。gydF4y2Ba
一个gydF4y2Ba和gydF4y2BabgydF4y2Ba,串行部分的HCV感染人类的肝脏彩色丙肝病毒单克隆抗体对NS3 / NS4 (TORDJI-21) (gydF4y2Ba一个gydF4y2Ba)或一个无关isotype-specific单克隆抗体对黑色素瘤(HMB-45) (gydF4y2BabgydF4y2Ba)。gydF4y2BacgydF4y2Ba和gydF4y2BadgydF4y2Ba、串行部分未受人类肝脏沾TORDJI-21 (gydF4y2BacgydF4y2Ba)或HMB-45 (gydF4y2BadgydF4y2Ba)。gydF4y2BaegydF4y2Ba和gydF4y2BafgydF4y2Ba,串行部分移植的纯合子小鼠感染丙肝病毒,沾染了抗体人类肝细胞(gydF4y2BaegydF4y2Ba)和丙肝病毒抗体(TORDJI-21) (gydF4y2BafgydF4y2Ba)。箭头表示粗颗粒具体丙肝病毒感染。gydF4y2BaggydF4y2Ba和gydF4y2BahgydF4y2Ba从控制,串行部分未感染纯合子小鼠与人类肝细胞移植和沾染了反人类肝细胞抗体(gydF4y2BaggydF4y2Ba)或TORDJI 21 (gydF4y2BahgydF4y2Ba)。gydF4y2Ba
讨论gydF4y2Ba
这些实验证明纯合子SCID /gydF4y2BaAlb-uPAgydF4y2Ba与嵌合小鼠可以感染人类肝脏gydF4y2Ba新创gydF4y2BaHCV-positive人类血清;他们支持丙肝病毒复制人类一部分肝脏内临床相关的浓度;他们展示的能力传播感染其他嵌合体小鼠。成功的建立了感染病毒基因型1,1,3和6,快速增加病毒RNA浓度水平很容易检测到标准商业化验。我们成功地建立嵌合小鼠感染移植3 - 8周后,与大多数接种的移植后4 - 6周,受感染的人类血清的可用性。gydF4y2Ba
纯合性的gydF4y2BaAlb-uPAgydF4y2Ba病毒感染是至关重要的成功建立,通过使用该收件人,再加上由点状分析早期移植肾功能检查,丙肝病毒感染通常建立在大约75%的接种小鼠。先前的报告显示过高的围产期死亡率相关的纯合性gydF4y2BaAlb-uPAgydF4y2Ba转基因。纯合子Alb-uPA殖民地开始以来,我们经历了围产期死亡率为32.6%,这与提高种畜慢慢减少。使用8繁殖的雌性和4雄性繁殖提供了充足的潜在接受者老鼠可以在理想的接收方在任何时候年龄为5 - 14天。gydF4y2Ba
移植过程需要基本的显微外科设备和技术技能和需要5 - 6分钟的动物。而进入人类肝细胞可能会限制一些调查人员,收益率从肝细胞分解动作在我们实验室平均2 - 3×10gydF4y2Ba8gydF4y2Ba可行的人类细胞,类似于他人gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba。鉴于9至10天窗口最佳的移植和适度的调查人员之间的协作和肝胆的外科医生使用剩余组织,新鲜肝细胞几乎总是可以用于transplantation-we几乎没有任何未使用的老鼠在我们的殖民地。同行的能力过剩细胞可能允许运输中心没有人体组织访问,尽管我们的经验与冻存细胞是有限得多;我们已经成功地建立长期移植(尽管总体成功率较低)和生产丙肝病毒感染在这些动物。gydF4y2Ba
这个模型应该允许调查人员直接开始探索gydF4y2Ba在活的有机体内gydF4y2Ba策略由被动免疫抑制病毒复制或防止感染,它应该大大提前寻找新的丙型肝炎抗病毒治疗和疫苗开发。gydF4y2Ba
方法gydF4y2Ba
发展SCID /gydF4y2BaAlb-uPAgydF4y2Ba压力。gydF4y2Ba
后,动物被安置VAF加拿大动物保护委员会(1993年)的指导方针。实验批准来自阿尔伯塔大学的动物福利委员会。半合gydF4y2BaAlb-uPAgydF4y2Ba老鼠(应变TgN (gydF4y2BaAlb1PlaugydF4y2Ba)展望144年,杰克逊,缅因州巴尔港)与纯合子SCID /交叉gydF4y2BabggydF4y2Ba老鼠(应变C.b-17 / GbmsTac-SCID /gydF4y2BabggydF4y2BaN7, Taconic农场,日耳曼敦,纽约)。gydF4y2BaAlb-uPAgydF4y2Ba从基因组DNA, PCR放大(杰克逊)。SCID的纯合性特征证实了使用夹心ELISA总血清免疫球蛋白的量化。gydF4y2Ba
人类肝细胞的分离。gydF4y2Ba
伦理批准获得阿尔伯塔大学的医学院研究伦理委员会和知情同意肝细胞捐献者。人类肝组织(15 - 20厘米的段gydF4y2Ba3gydF4y2Ba)从切除标本通常被丢弃;大部分操作都表现为肝内恶性肿瘤。快速冷却后,肝细胞被collagenase-based灌注分离和纯化gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,使用0.38毫克/毫升Liberase CI (Boeringer)在灌流液,并存储在0°C Belzer-UW短期解决方案(杜邦、特拉华州的)。细胞计数(血细胞计数器)和可行性(台盼蓝)被证实使用前;生存能力总是> 80%。gydF4y2Ba
人类肝细胞的冷冻保存,解冻。gydF4y2Ba
孤立肝细胞(停牌1×10gydF4y2Ba7gydF4y2Ba肝细胞/毫升)在低温贮藏管在4°C冻结/解冻媒体(50 ml FCS, 2.5毫升笔/喉炎,447.5毫升M199媒体)。在冰上,2 m添加DMSO整除的0.5毫升,2毫升和4毫升0,分别为5和30分钟。在45分钟,管子被转移到一个可编程的乙醇冻结浴预设−7.4°C, liquid-N“有核”gydF4y2Ba2gydF4y2Ba冷却半导体杆,冷却1°C /分钟−40°C, N和无限期地存储在液体gydF4y2Ba2gydF4y2Ba。细胞被迅速加热到0°C 37°C水浴和旋转,和上层的丢弃。在冰上,1毫升0.75添加了蔗糖在0分钟。冻结/解冻媒体连续添加(1、1、2和4毫升30岁,35岁,40 - 45分钟)。在50分钟,上层清液分离,细胞在Belzer-UW resuspended解决方案(杜邦)在0°C。gydF4y2Ba
人类肝细胞的移植。gydF4y2Ba
收件人(5-14-day-old)与氟烷麻醉/ OgydF4y2Ba2gydF4y2Ba,通过左腰的小切口,1×10gydF4y2Ba6gydF4y2Ba可行的肝细胞被注入下脾杆;一个钛夹放置在注射部位止血,关闭切口。gydF4y2Ba
检测人血清蛋白在小鼠血清的免疫沉淀反应和免疫印迹分析。gydF4y2Ba
小鼠血清(20μl)孵化了单克隆抗体对白蛋白(克隆HSA-9;σ)和蛋白质复合物收集G-agarose珠子(勃林格公司)。在减少的情况下,免疫沉淀物分离通过sds - page和转移到硝基。西方的屁股准备使用生物素化的单克隆抗体对白蛋白(克隆HSA-11,σ),streptavidin-HRP共轭和化学发光底物(皮尔斯,罗克福德,伊利诺斯州)检测。gydF4y2Ba
决心的接合性gydF4y2BaAlb-uPAgydF4y2Ba转基因。gydF4y2Ba
老鼠的DNA(3μg)与PvuII消化,大小分级0.7%琼脂糖凝胶上,转移到Hybond-N +膜(Amersham)和杂化gydF4y2Ba32gydF4y2Ba从最后的基因内区P-labeled探针gydF4y2BauPAgydF4y2Ba基因(7312 - 7920年,加入基因库gydF4y2Ba# M17922gydF4y2Ba)。2.88 kb乐队是来自gydF4y2BauPAgydF4y2Ba转基因(T)和2.53 kb乐队从内生gydF4y2BauPAgydF4y2Ba基因(E);杂交与富士phosphoimager量化和图像测量软件(富士胶片,斯坦福,Connecticuit)。gydF4y2Ba
免疫组织化学。gydF4y2Ba
小鼠肝脏活检在10%福尔马林固定石蜡包埋。部分(5μm))以标准方式染色。检测人类肝细胞,部分预处理的亲和素、生物素阻断工具包(酶实验室、旧金山、加州)免疫——沾单克隆抗体对人类肝细胞(克隆OCH1E5 1:20稀释;DAKO Carpinteria,加州),结合抗体检测到超级敏感Immunodetection系统(BioGenex,旧金山,加州)。丙肝病毒蛋白质,部分是应用单克隆抗体对NS3 / NS4 (TORDJI-22;Biogenex)gydF4y2Ba16gydF4y2Ba;isotype-specific无关的单克隆抗体对人类黑色素瘤(克隆HMB 45;恩佐诊断、法明岱尔纽约)被用作控制。gydF4y2Ba
蛋白质点状的量化测定人血清蛋白的生产。gydF4y2Ba
小鼠血清样本(2μl)孵化100°C的5分钟40μl减少缓冲是一式三份涂抹到硝基。干膜浸泡在传输缓冲区,与3% PBS-Tween阻塞,准备在西方的屁股。化学发光是量化(风暴phosphoimager)从标准曲线上每一个污点。gydF4y2Ba
内的人类DNA检测移植小鼠肝脏。gydF4y2Ba
基因组DNA被phenol-chloroform孤立,和gydF4y2Ba运算器gydF4y2Ba聚合酶链反应使用重复放大gydF4y2BaAlu SxgydF4y2Ba特殊引物R16A / 6 (5′-GGCGCGGTGGCTCACG-3′)和L23A / 266 (5′-TTTTTTGAGACGGAGTCTCGCTC-3′)gydF4y2Ba21gydF4y2Ba。人类外周血作为积极的控制gydF4y2Ba铝青铜/ uPAgydF4y2Ba尾巴和非移植gydF4y2Ba铝青铜/ uPAgydF4y2Ba肝脏作为消极的控制。小鼠基因组DNA被放大的序列检测小鼠gydF4y2Bac-mosgydF4y2Ba原癌基因,使用MUSMOS (5′-GAATTCAGATTTGTGCATACACAGTGACT-3′)和MUSMOS B (5′-AACATTTTTCGGGAATAAAAGTTGAGT-3′)。gydF4y2Ba
定量分析的正链HCV RNA在小鼠血清。gydF4y2Ba
盲法分析是由阿尔伯塔省公共卫生实验室(埃德蒙顿,加拿大),或加拿大疾病控制中心(温尼伯,加拿大),使用Cobas Amplicor丙肝病毒监控系统(加拿大拉瓦尔罗氏诊断)。gydF4y2Ba
由rTth PCR检测段丙肝病毒RNA。gydF4y2Ba
总RNA分离小鼠肝脏活组织检查或被感染的人类血清使用试剂盒(GIBCO / BRL,伯灵顿,加拿大)。rt - PCR进行使用耐热性的rTth逆转录酶RNA PCR试剂盒(康涅狄格州诺沃克,优秀的)。与一个反义正链RNA检测(5′-CTCGCAAGCCCCTATCAGG-3′)底漆与节段(5′-GAAAGCGTCTAGCCATGGCGT-3′)逆转录引物gydF4y2Ba22gydF4y2Ba。Strand-specific cDNA放大通过添加其他引物的目标是240年英国石油公司区域的5′非编码区域,使用35周期为30年代在95°C, 66°C 45和70°C的90年代,紧随其后的是70°C 5分钟。反应产品装上2%的琼脂糖凝胶,转移到Hybond-N +尼龙膜(Amersham)和杂化α-gydF4y2Ba32gydF4y2BaP-labeled DNA探针丙肝病毒5′非编码区域在一夜之间在42°C。gydF4y2Ba
段检测丙肝病毒RNA核糖核酸酶保护试验。gydF4y2Ba
总RNA分离小鼠肝脏使用试剂盒试剂(GIBCO / BRL)和使用QIAamp从hcv感染人类血清病毒RNA迷你包(试剂盒,瓦伦西亚,加州)。提取RNA;探讨了gydF4y2Ba32gydF4y2BaP-labeled, gel-purified反义riboprobe(检测正链),感觉riboprobe(负链的检测)和/或β-actin反义riboprobe。质粒的合成和riboprobe建设的细节是可用的(gydF4y2Ba方法gydF4y2Ba,gydF4y2Ba网络的补充gydF4y2Ba)。变性核糖核酸样本杂交一夜之间在42°C,使用一个核糖核酸酶和核糖核酸酶消化了保护分析工具包(Ambion狙击枪三世工具包,奥斯汀,德克萨斯)。产品解决5%的页面包含8 M尿素和暴露于柯达X-Omat AR电影(柯达,温哥华,加拿大)。gydF4y2Ba
注意:补充信息可以在自然医学网站(gydF4y2Bahttp://www.nature.com/nm/supplementary_info/gydF4y2Ba)。gydF4y2Ba
加入代码gydF4y2Ba
引用gydF4y2Ba
Sarbah, s & Younossi z丙型肝炎:一个更新在沉默的流行病。gydF4y2Baj .中国。胃炎。gydF4y2Ba30.gydF4y2Ba,125 - 143 (2000)。gydF4y2Ba
Choo, Q.L. et al .隔离cDNA克隆来自血液承担许可non-B病毒性肝炎基因组。gydF4y2Ba科学gydF4y2Ba244年gydF4y2Ba,359 - 361 (1989)。gydF4y2Ba
黑格尔,J。,Sandgren, E., Degen, J., Palmiter, R. & Brinster, R. Neonatal bleeding in transgenic mice expressing urokinase-type plasminogen activator.细胞gydF4y2Ba62年gydF4y2Ba,447 - 456 (1990)。gydF4y2Ba
Sandgren、大肠等。完成后肝再生albumin-plasminogen活化剂转基因体细胞删除。gydF4y2Ba细胞gydF4y2Ba68年gydF4y2Ba,245 - 256 (1991)。gydF4y2Ba
Rhim, J。,Sandgren, E., Degen, J., Palmiter, R. & Brinster, R. Replacement of diseased mouse liver by hepatic cell transplantation.科学gydF4y2Ba263年gydF4y2Ba,1149 - 1152 (1994)。gydF4y2Ba
彼得森,J。Dandri, M。,Gupta, S. & Rogler, C. Liver repopulation with xenogeneic hepatocytes in B and T cell-deficient mice leads to chronic hepadnavirus infection and clonal growth of hepatocellular carcinoma.Proc。国家的。学会科学。美国gydF4y2Ba95年gydF4y2Ba,310 - 315 (1998)。gydF4y2Ba
布朗,j . et al。长期乙型肝炎病毒血症模型生成的移植nontumorigenic人类Rag-2缺陷小鼠肝细胞永生化。gydF4y2Ba肝脏病学gydF4y2Ba31日gydF4y2Ba,173 - 181 (2000)。gydF4y2Ba
彼得森,j . et al。肝细胞分离的成人肝可以重新填充uPA / Rag-2老鼠和支持乙型肝炎病毒感染和复制。gydF4y2Ba肝脏病学gydF4y2Ba30.gydF4y2Ba423 (1999)。gydF4y2Ba
克莱门特,et al。长期培养的成人肝细胞与大鼠肝上皮细胞:调制的白蛋白分泌和细胞外物质的积累。gydF4y2Ba肝脏病学gydF4y2Ba4gydF4y2Ba,373 - 380 (1984)。gydF4y2Ba
Rhim, J。,Sandgren, E., Palmiter, R. & Brinster, R. Complete reconstitution of mouse liver with xenogeneic hepatocytes.Proc。国家的。学会科学。美国gydF4y2Ba92年gydF4y2Ba,4942 - 4946 (1995)。gydF4y2Ba
施密德,漫画gydF4y2Ba运算器gydF4y2Ba:结构、起源、进化、意义和功能的人类DNA的十分之一。gydF4y2Ba掠夺。诊断。酸摩尔。》杂志。gydF4y2Ba53gydF4y2Ba,283 - 319 (1996)。gydF4y2Ba
范·比C。,van Straaten, F., Galleshaw, J. & Verma, I. Nucleotide sequence of the genome of a murine sarcoma virus.细胞gydF4y2Ba27gydF4y2Ba,97 - 108 (1981)。gydF4y2Ba
梅勒J。,Haydon, G., Blair, C., Livingstone, W. & Simmonds, P. Low level or absent在活的有机体内gydF4y2Ba丙型肝炎病毒的复制和G型肝炎病毒/ GB病毒C在外周血单核细胞。gydF4y2Baj .性研究。gydF4y2Ba79年gydF4y2Ba,705 - 714 (1998)。gydF4y2Ba
Lanford, R。,Chavez, D., Chisari, F.W. & Sureau C. Lack of detection of negative-strand hepatitis C virus RNA in peripheral blood mononuclear cells and other extrahepatic tissues by the highly-specific rTth reverse transcriptase PCR.j .性研究。gydF4y2Ba69年gydF4y2Ba,8079 - 8083 (1995)。gydF4y2Ba
Lanford, R。,Sureau, C., Jacob, J., White, R. & Fuerst, T. Demonstration of在体外gydF4y2Ba丙型肝炎病毒感染的黑猩猩肝细胞使用strand-specific RT / PCR。gydF4y2Ba病毒学gydF4y2Ba202年gydF4y2Ba,606 - 614 (1994)。gydF4y2Ba
布罗迪,r . et al .免疫组织化学检测丙型肝炎抗原的单克隆抗体TORDJI-22相比,PCR病毒检测。gydF4y2Ba点。j .中国。路径。gydF4y2Ba110年gydF4y2Ba32-37 (1998)。gydF4y2Ba
芭蕾、f . et al .隔离、文化和表征的成人肝细胞手术肝活检。gydF4y2Ba肝脏病学gydF4y2Ba4gydF4y2Ba,849 - 854 (1984)。gydF4y2Ba
Dorko, k . et al .分离新技术,从整个人类肝细胞培养或分割肝脏不用于移植。gydF4y2Ba细胞移植。gydF4y2Ba3gydF4y2Ba,387 - 395 (1994)。gydF4y2Ba
Seglen, p .制备分离大鼠肝细胞gydF4y2Ba冰毒。细胞。医学杂志。gydF4y2Ba13gydF4y2Ba29 - 83 (1976)。gydF4y2Ba
瑞安,C。,Carter, E., Jenkins, R. & Sterling, L. Isolation and long-term culture of human hepatocytes.手术gydF4y2Ba113年gydF4y2Ba48-54 (1993)。gydF4y2Ba
Zietkiewicz E。Labuda, M。,Sinnett, D., Glorieux, G. & Labuda, D. Linkage mapping by simultaneous screening of multiple polymorphic loci using运算器gydF4y2Baoligonucleotide-directed PCR。gydF4y2BaProc。国家的。学会科学。美国gydF4y2Ba89年gydF4y2Ba,8448 - 8451 (1997)。gydF4y2Ba
墨菲,D。,Willems, B. & Delage, G. Use of the 5′ noncoding region for genotyping hepatitis C virus.j . Inf。说。gydF4y2Ba169年gydF4y2Ba,473 - 475 (1994)。gydF4y2Ba
确认gydF4y2Ba
我们感谢c.a Compston宝贵的援助区域试验;t . Cavanagh提供酶;m·克雷格的援助与免疫印迹分析;型和p·迪基寻求帮助的后代。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
相应的作者gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
美世,D。,Schiller, D., Elliott, J.et al。gydF4y2Ba丙型肝炎病毒复制人类肝脏与嵌合体小鼠。gydF4y2BaNat地中海gydF4y2Ba7gydF4y2Ba,927 - 933 (2001)。https://doi.org/10.1038/90968gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/90968gydF4y2Ba
本文引用的gydF4y2Ba
描述相关的宿主因素的内部核糖体进入位点口蹄疫和古典猪瘟病毒gydF4y2Ba
科学报告gydF4y2Ba(2022)gydF4y2Ba
有效的人类肝细胞移植和病毒转导德意志联邦共和国鼠肝脏人性化模式gydF4y2Ba
科学报告gydF4y2Ba(2022)gydF4y2Ba
人源化小鼠感染和神经退行性疾病gydF4y2Ba
RetrovirologygydF4y2Ba(2021)gydF4y2Ba
表征和应用人性化的嵌合小鼠肝脏的临床前药物开发gydF4y2Ba
实验动物研究gydF4y2Ba(2020)gydF4y2Ba
丙型肝炎病毒的发现gydF4y2Ba
共振gydF4y2Ba(2020)gydF4y2Ba