文摘
背景:
BI 2536年小说Polo-like激酶1抑制剂,评估患者的先进不可切除的胰腺的外分泌腺癌。
方法:
研究采用两阶段设计。随机一线患者接受BI 2536 200毫克1天(n= 43)或60毫克1 - 3天(n每21天= 43)。招募患者二线计划第二阶段依赖于一个临时分析展示⩾2反应的18名可治疗12周后和/或肿瘤控制⩾12周5例/时间表。主要终点是客观缓解率(ORR)。
结果:
由独立的审查,或者是2.3%(部分)和24.4%稳定疾病证实了最好的回应。第二阶段没有启动。149年总体中位数和无进展生存(95%可信区间(CI), 91 - 307)和46天(95% CI, 44-56)。最常见的药物相关的不良事件是嗜中性白血球减少症(37.2%)、白血球减少症(29.1%)、疲劳(29.1%)和恶心(22.1%);最常见的年级3/4-related事件是嗜中性白血球减少症(36.0%)、白血球减少症(27.9%)和血小板减少症(8.1%)。
结论:
考虑到低奥尔和穷人的生存,进一步发展BI 2536年单一疗法并不保证在这个人口。
主要
在发达国家,胰腺癌是第四个癌症相关死亡的主要原因,占全球每年约有266 000人死亡和65在欧洲每年000人死亡(Cascinu et al, 2010年;Jemal et al, 2011年)。在德国,每年大约有14 693例新病例,大多数患者将死于这种疾病(Ferlay et al, 2011年)。在诊断,80 - 85%的患者不可切除的疾病(李等人,2004年);对这些病人预后差的5年存活率为1.8% (Howlader et al, 2011年)。
静脉注射吉西他滨单药治疗被认为是标准的照顾一线治疗晚期胰腺癌不可切除的基于第三期临床试验,显示出显著提高生存能力vs5 -氟尿嘧啶(5.65vs4.41个月,P= 0.0025)(伯等人,1997年)。第二个三期临床试验研究的结合与埃罗替尼吉西他滨在一线高级胰腺癌非常小,但显著改善生存vs吉西他滨单(6.24vs5.91个月,P= 0.038)(摩尔等人,2007年)。基于这些结果,埃罗替尼联合吉西他滨是通过美国食品和药物管理局和欧洲药品局的一线治疗晚期胰腺癌(特罗凯(包插入),2010;特罗凯(产品特征的总结),2011年)。5 -氟尿嘧啶、亚叶酸,铂+伊立替康(FOLFIRINOX)最近在欧洲进行三期临床试验的患者(协议/ PRODIGE)转移性胰腺癌。与吉西他滨相比,FOLFIRINOX导致显著改善生存(6.8vs11.1个月,P< 0.0001);然而,FOLFIRINOX与年级的发生率明显高于3/4嗜中性白血球减少症,发热性中性粒细胞减少、血小板减少症、腹泻和感觉神经病变(康罗伊等人,2011年)。
考虑到不良预后和可怕的晚期胰腺癌患者的治疗结果,新疗法是一个紧急医疗需要。一个潜在的有前途的新方法是针对快速分裂的细胞周期,通过抑制肿瘤细胞的有丝分裂检查点(Swanton 2004)。这样的一个目标是有丝分裂丝氨酸/苏氨酸激酶Polo-like激酶1 (Plk1),这是参与关键的细胞功能包括通过至关重要的有丝分裂检查点,有丝分裂纺锤体的组织,并通过后期进展和胞质分裂Strebhardt 2010;Komlodi-Pasztor et al, 2011年)。Plk1在几个人类癌症,包括非小细胞肺癌、前列腺癌、卵巢癌、乳腺癌和结直肠癌(狼等人,1997年;高桥et al, 2003年;Schoffski 2009)。此外,过度Plk1和放松管制的细胞循环控制是建立在胰腺癌细胞(灰色小et al, 2004年)。
BI Plk家族的2536是一个抑制剂的蛋白质,并演示了Plk1的有效抑制,导致细胞循环逮捕和独特的马球逮捕的表型(Schoffski 2009)。2536年BI鼠标异种移植模型,实现肿瘤回归到完全治愈,胰腺腺癌模型,BI 2536年显著降低增长在更大程度上比吉西他滨(Steegmaier et al, 2007年)。一期临床研究的BI 2536年晚期癌症患者决定的最大耐受剂量BI 2536在三个不同的时间表:200毫克每3周1天,100毫克每3周1和8天和60毫克1天,每3周(2和32008年的mro et al;Hofheinz et al, 2010年;霜等人,2012年)。这些研究还表明,BI 2536有初步的证据效力和在这个病人耐受良好。主要dose-limiting毒性(dlt)可逆嗜中性白血球减少症,发热性中性粒细胞减少和血小板减少症(2008年的mro et al;Hofheinz et al, 2010年;霜等人,2012年)。在这里,我们报告二期试验调查结果有效性、安全性和药代动力学(PK)的BI 2536作为一线治疗晚期胰腺的外分泌腺癌患者。
材料和方法
试验设计
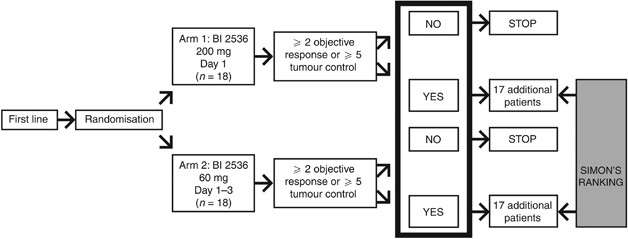
这是一个第二阶段非盲、随机、平行对照试验中2536 BI的患者从德国和奥地利先进不可切除的胰腺的外分泌腺癌,并进行符合赫尔辛基宣言。两阶段设计(修改国家),一线患者随机两个BI 2536年第一阶段治疗方案,使用(图1)。发展到第二阶段,这其中包括扩大一线二线患者的队列和招聘,依赖于一个临时的分析。病人招募了第二阶段的试验将得到最好的治疗方案从第一阶段。临时分析准则确定审判是否应该继续从第一阶段(一线)第二阶段(二线病人)。要实现这一标准的手臂,2头18名可,定义为患者完成⩾2周期,实现证实完全或部分响应(CR或公关)后12周的治疗和/或5个18肿瘤患者达到控制至少12周。如果这一标准是在审判的双臂,然后选择二线方案将基于探索性分析的响应率,tumour-control率,不良事件(AE)利率和严重程度,和实用性。
本研究的主要终点是客观缓解由独立审查的肿瘤成像根据固体肿瘤的反应评估标准(RECIST 1.0)。次要终点包括肿瘤控制(客观缓解或稳定的疾病(SD)第四疗程)后,无进展生存(PFS),总生存期(OS),安全和DLT CA19-9反应。
病人的选择
患者至少18岁的局部晚期或转移性,不可切除的胰腺的外分泌腺癌了。评估的病史,体格检查,Karnofsky得分和心电图进行基线包括血液学、生化和凝固参数。在这两级计划的第一阶段试验中,一线chemo-naive病人登记,在第二阶段,患者接受化疗前gemcitabine-based包括在内。入选标准包括Karnofsky地位⩾一线群和70%⩾50%二线群;至少一个可以衡量的肿瘤病变的存在,至少3个月的寿命。排除标准包括对一线病人辅助治疗之前,胰腺壶腹癌,过敏试验药物或赋形剂,临床上相关毒性坚持化疗之前,已知的第二恶性肿瘤需要治疗和脑转移症状或需要治疗。同时,患者器官功能不足(绝对中性粒细胞计数< 1500 mm3,血小板计数⩽每毫米100 0003血红蛋白< 9毫克dl−1、天冬氨酸转氨酶/丙氨酸转氨酶>正常上限的2.5倍(或> 5次在肝转移)的情况下,胆红素> 3.0毫克dl−1下足够的排水措施和血清肌酐> 2.0毫克dl−1)、伴随疾病(包括积极感染、充血性心力衰竭、不稳定心绞痛、心律失常)或接受荷尔蒙疗法,治疗与生物反应修饰符,或用一种试验性药物治疗在过去4周被排除在外。这项研究是按照道德原则进行来自赫尔辛基宣言和良好的临床实践所定义的国际协调会议。所有参与病人给书面知情同意。
治疗
两种剂量方案的BI 2536了(图1):BI 2536作为一个点静脉注射(IV)注入给开放标签的剂量200毫克每天一次1天每21天治疗周期和BI 2536作为一个开放点的静脉输液标签60毫克的剂量每天一次的天1 - 3每21天治疗周期。BI 2536年停产的DLT,定义为毒品等级⩾3明确非毒性(不包括摘要恶心、呕吐或腹泻),与毒品有关的4级中性粒细胞减少⩾7天内和/或复杂的感染,或与毒品有关的4级嗜中性白血球减少症以外的血液学的毒性。病人可以继续治疗,如果DLT决定成绩,允许进一步治疗,但只有在2536年减少剂量的BI(减少到50毫克200毫克组和10毫克60毫克组)约定的临床监测和研究人员。只有一个剂量减少每个病人被允许的审判。每个协议,BI 2536年停止如果第二个DLT发生或者DLT并没有解决治疗中断或减少剂量。患者持续治疗之外的第二个疗程可以接受剂量升级(不超过50毫克的步骤在200毫克组和10毫克步骤60毫克组)如果疾病非渐进式和治疗耐受良好。
调查
在筛选肿瘤反应是评估访问(或前21天内开始研究药物),每秒钟疗程结束时,在试验的结论。所有肿瘤图像被送往中央成像单元测试和评估蒙蔽独立审查根据RECIST 1.0。确认所需的客观反应,CRs和PRs证实6周后反应的初始条件是第一次见到。SD的评估作为最好的回应,后续测量必须符合SD的标准至少研究一次入口至少6周的间隔。最好的反应是评估取得的最好的回应从开始直到疾病进展或复发的治疗。
安全评估由监测和记录所有AEs,定期监测血液学和临床化学测量(实验室评估),定期测量生命体征和体格检查的性能。不良事件和实验室异常分级根据美国国家癌症研究所的常见术语标准的不良事件,3.0版。
药代动力学分析
药代动力学分析确定2536年BI的血浆浓度。之前、期间和之后血液样本被政府(重复第一个24小时和7天再次发布管理)。2536年BI的浓度是由高效液相chromatography-tandem质谱(HPLC-MS / MS)。
统计分析
试验旨在最初招募18一线患者每个治疗手臂在第一阶段临时分析响应计划一旦每安排18名可收到四个疗程的治疗(12周)。病人没有完成第二个疗程被认为可评价的最终分析,但没有考虑临时的分析。临时分析后,招聘是35一线完成病人每个治疗手臂在第一阶段共有70名患者。总共35二线患者招募到单臂第二阶段。
疗效和安全性分析的人口占所有病人至少一个剂量的BI 2536,包括病人退出或任何理由停止。然而,每协议人口没有违反协议被描述。
结果
患者人群
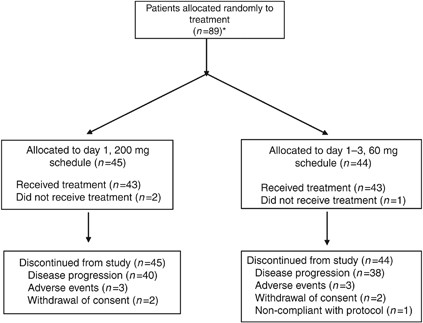
共有90名患者在9个研究中心在德国和奥地利的第一阶段试验。其中,89人随机接受BI 2536根据第一天200毫克时间表(n一天= 45)或1 - 3 60毫克计划(n= 44)。病人招聘的细节和中止的原因图2。第一阶段的研究是完全应计之前获得18名可临时分析由于大量的患者排除由于早期疾病进展之前完成两个周期的治疗。因此,预先计划好的临时没有进行分析和结果报告所基于完整的第一阶段研究人口。
共有86名患者在每个剂量臂(43)收到BI 2536,包括在分析中。基线人口统计学两臂之间的相似(表1)。平均年龄为64.5岁,68.6%的患者为男性。治疗武器也很匹配的胰腺癌的历史。大多数(87%)患者被诊断出患有胰腺导管腺癌和头部作为主要网站(58%),三分之一的患者知道分化等级低分化肿瘤,88%阶段4(转移)疾病筛查。每个协议,没有病人收到之前的化疗,1病人放疗前和28个病人做了手术。
治疗接触
BI 2536的平均数量的课程是相似的在两个治疗组,3.2在第一天(范围1 - 14)200毫克组1 - 3和3.2(1 - 16)天60毫克组。在两组中,大多数(> 65%)的患者完成< 3疗程的治疗和13 86名患者只有一个课程,最常见的是由于早期疾病进展。剂量减少所需的一个病人在200毫克组和两个病人由于发生dlt 60毫克组。每组六位病人剂量升级,三天的1 - 3 60毫克组随后剂量降级。
功效
时临时分析(基于调查员评估),5个18名可在每个治疗组PFS后3个月的治疗。然而,这些对患者进行评估,共有79名患者已经招募了41经历过进展在两个疗程的治疗。因此,尽管遇到了正式的标准过渡到第二阶段,这是决定招募患者二线的第二阶段试验不应继续进行。
基于独立审查,没有患者CR和两个患者治疗后证实PRs(反应率2.3%)。然而,没有观察到相应的PRs根据各自的调查评估,患者停止治疗后课程4由于临床或非目标病变疾病进展。SD是证实24.4%的患者最好的回应。肿瘤控制在3个月实现了12.8%的病人(七个病人在一天200毫克组和4名患者在1 - 3 60毫克组)。
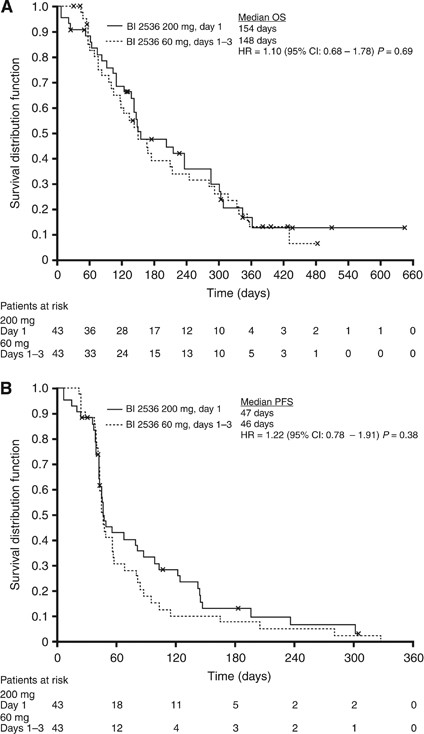
池操作系统中位数为149天(95%可信区间(CI), 91 - 307)和PFS 46天(95% CI, 44-56)作为评估由独立评估(图3)。1年期生存和3个月PFS率分别为17.2%和31.1%的第一天200毫克的胳膊,13.1%和15.4%的1 - 3天60毫克的手臂,分别。治疗手臂之间没有统计上的显著差异检测到任何结果。
安全
总体而言,98.8%的患者经历了AE的年级,最常见的胃肠道(82.6%)、血液学的(48.8%)或一般障碍(66.3%)。经历严重的AEs不管原因是52.3%的病人。26(30.2%)患者有一个AE,合格的DLT(200毫克组25.6%和34.9%在60毫克组);20这些26例(76.9%)有一个血液学的DLT,最常见的中性粒细胞减少(14例(研究人口的16.3%))。整体其他dlt血小板减少的发生率(4.7%)、贫血(3.5%)、发热性中性粒细胞减少疲劳(2.3%)和(2.3%)。腹泻、白血球减少症、恶心、肺炎、口腔炎和呕吐dlt,所有发生在单一的患者(1.2%)的频率。
整体的与毒品有关的AEs的年级第一天200毫克组69.8%和83.7%的1 - 3 60毫克组(表2)。最常见的与毒品有关的AEs是嗜中性白血球减少症(37.2%)、白血球减少症(29.1%)、疲劳(29.1%)和恶心(22.1%)。一般来说,两个剂量组之间的AE率相似;然而,恶心(27.9%vs16.3%)和脱发(25.6%vs14.0%)高于60毫克组和中性粒细胞减少(41.9%vs32.6%)和白血球减少症(34.9%vs23.3%)200毫克组高。百分之五十的患者至少有一个年级3/4 AE。最常见的3/4级毒品AEs总体是嗜中性白血球减少症(研究人口的36.0%),白血球减少症(27.9%)和血小板减少症(8.1%)。有18人死亡由于AEs,没有一个被调查者认为是毒品。
药代动力学分析
BI 2536证明multi-compartmental PK的行为。一般来说,等离子体浓度增加到0.5或1 h后注入的开始。输液后,血浆浓度迅速下降,表明快速分布阶段。邮寄24小时输液,平均血浆浓度为18.6 ng毫升−1并进一步下降到1.70 ng ml−1到120年200毫克剂量后h。
讨论
在这个随机、非盲、2536年Plk抑制剂BI探索性研究,没有迹象显示的临床疗效与剂量有关安排不可切除的晚期胰腺癌患者。生存是相对较短的OS 149天(相当于4.9个月),在较低的范围预计将与吉西他滨(4.9 - -8.2个月,根据历史数据)(2006年埃克尔et al;Heinemann et al, 2008年)。1年生存率为14.7%,仅略高于下限为吉西他滨(据11 - 28%2006年埃克尔et al;Heinemann et al, 2008年)。此外,这些功效数据比较不好与最近报道的第三阶段协议/ PRODIGE试验,一个操作系统的6.8个月,吉西他滨与FOLFIRINOX提高至11.1个月(康罗伊等人,2011年)。修改国家顺序设计是用来确保一定程度的抗肿瘤功效在这个试验允许完整的权责发生制,以避免接触病人可能不活跃的药物。使用这个设计,两个PRs或CRs和/或疾病控制⩾12周5 18可评价的患者(即。,治疗⩾2课程)的手臂被要求在进入第二阶段。在第二阶段的试验中,患者的数量每手臂计划35岁患者二线群发起后的两个时间表被选中。然而,因为大量的病人,没有可评价的疾病控制和后期宣读的疾病控制在12周后,两阶段设计没有限制病人招聘之前完整的患者数量已经进入了审判。回想起来,搬到第二阶段更严格的标准应该被使用。
作为第一阶段试验的报道,BI 2536治疗耐受良好,没有意想不到的AEs。血液学的毒性是最常见的副作用和可控的适当措施。2536 PK的BI媲美的是在第一阶段试验,与药物证明multi-compartmental PK行为没有重复注入后药物积累的证据。
尽管一个强大的基础原理和承诺基础和早期阶段的数据,2536年BI未能证明足够的功效在二期临床试验日期和发展已经停止。发达,许多这些试验的难治性肿瘤分子异构和这些因素可能是导致BI 2536未能证明其临床有效性。此外,BI 2536的半衰期相对较短在活的有机体内和未能实现临床疗效可能反映了曝光不足的肿瘤细胞活性抑制剂,而不是真正的抵抗行动的机制。作为临床前数据没有显示的优越性测试管理安排,四个不同的时间表已经进行第一阶段试验导致类似的暴露不相关的安全性和疗效的差异。虽然它仍然是有可能的,另一种安排2536年BI将导致一个更强大和更长期的抑制有丝分裂,一个有效的有丝分裂块可能难以实现没有显著myelosuppression固体肿瘤,患者约28%的骨髓中性粒细胞不断发生有丝分裂(Komlodi-Pasztor et al, 2011年)。
还有一个引人注目的理由Plk抑制剂的临床试验在癌症患者尽管整体负这个试验的结果。临床前研究表明Plk抑制剂可以把化疗药物抑制恶性细胞增殖在体外(Gleixner et al, 2010年)和肿瘤生长在活的有机体内在小鼠异种移植模型中没有添加剂的毒性(Baum et al, 2007年),这表明这些组合的潜在适用性在癌症患者。Plk抑制剂目前阶段I / II发展各种固体肿瘤和血液学的迹象。GSK461364 Plk1的ATP-competitive抑制剂,卫生计量系统网络- 214,对称二苯代乙烯衍生物干扰Plk1亚细胞定位,表明SD最佳响应在第一阶段试验的先进的固体肿瘤患者(加兰等人,2006年;张艺泷et al, 2011年)。在01910年。Na (rigosertib),声称与Plk交互途径,还显示在胰腺癌临床疗效(马等人,2011年),目前正在招聘这个指示II / III期临床试验。然而,真正的这种化合物对Plk1通路的影响目前还不清楚(Oussenko et al, 2011年)。在第一阶段研究先进的固体肿瘤,患者volasertib 6727 (BI),额外dihydropteridinone导数改进PK概要文件与BI 2536相比,提供了更强的功效比2536年BI信号和有利的安全配置文件(Schoffski et al, 2012年)。由于这些原因,临床开发BI 2536已经终止和volasertib选择进一步的临床开发。
针对有利安全性观察到目前为止,Plk抑制剂可能为未来使用结合其他代理,包括细胞毒性和靶向制剂。第一阶段试验的volasertib结合顺铂或卡铂是目前正在进行和已经证明晚期患者的疗效和耐受性的初步证据的实体肿瘤(Deleporte et al, 2011年)和一个第一阶段的审判volasertib结合afatinib,不可逆erbb家族拦截器,目前正在进行。这些mono -:试验的数据将有助于确定Plk作为目标的潜在治疗癌症Schoffski 2009)。此外,迫切需要生物标志物研究来帮助确定病人最有可能受益于Plk抑制。包括生物标志物评估正在进行临床试验。
改变历史
2012年7月03
本文首次出版后修改后的12个月内使用创作共用许可证条款,指出在出版
引用
Baum, Garin-Chesa P Gurtler U, Munzert G,鲁道夫·G(2007) 2536年BI功效,一个强有力的和有丝分裂激酶Plk1的选择性抑制剂,在人类非小细胞肺癌的模型。Thorac肿瘤学杂志2:s435-s436
伯哈,摩尔MJ,安徒生J,格林先生,Rothenberg M, Modiano先生,克里普斯MC, Portenoy RK, Storniolo, Tarassoff P,纳尔逊R,多尔FA,斯蒂芬斯CD,冯·霍夫DD(1997)改善生存和临床效益与吉西他滨作为一线治疗晚期胰腺癌患者:一项随机试验。中华肿瘤防治杂志15:2403 - 2413
Cascinu年代,尔孔尼。M, Valentini V, Jelic年代(2010)胰腺癌:ESMO临床实践指南的诊断、治疗和随访。安杂志21(5):v55-v58
康罗伊T, Desseigne F, Ychou M,钻孔O, Guimbaud R, Becouarn Y,亚丁的,拉乌尔杰,Gourgou-Bourgade年代,de la Fouchardiere C, Bennouna J, Bachet JB, Khemissa-Akouz F, Pere-Verge D, Delbaldo C, Assenat E, Chauffert B,米歇尔•P Montoto-Grillot C, Ducreux M (2011) FOLFIRINOXvs吉西他滨对转移性胰腺癌。N拉米夫地中海364年:1817 - 1825
Deleporte, Dumez H, Awada Costermans J, Meeus M, Berghmans T,阿Kaci M, Juhel N,河岸,Taube T, Schoffski P(2011)第一阶段试验volasertib 6727 (BI), polo-like激酶1 (Plk1)抑制剂,与顺铂或卡铂在晚期实体肿瘤患者。中华肿瘤防治杂志29日,3031年(抽象)
施奈德Eckel F, G,施密德RM(2006)胰腺癌:审查的最新进展。专家知道Investig药物15:1395 - 1410
Ferlay J,胫骨人力资源,布雷F,福尔曼D,拿到C,帕金DM (2011)GLOBOCAN 2008,全球癌症发病率和死亡率:IARC CancerBase 10号(互联网)国际癌症研究机构:里昂,法国,2010年
霜,mro K, Steinbild年代,Hedbom年代,昂格尔C, Kaiser R, Trommeshauser D, Munzert G(2012)第四阶段我研究Plk1的抑制剂BI 2536年连续3天在先进的固体肿瘤。咕咕叫杂志19:e28-e35
加你,泰勒C,皮尔金顿DL,科恩杰,冯·霍夫DD(2006)期药代动力学研究卫生计量系统网络- 214,一本小说口语对称二苯代乙烯导数polo-like kinase-1-interacting属性,在晚期实体肿瘤患者。中国癌症Res12:5182 - 5189
Gleixner KV,费伦茨V,彼得•B Gruze, Meyer RA, Hadzijusufovic E, Cerny-Reiterer年代,Mayerhofer M, Pickl WF, Sillaber C,化合价的P (2010) Polo-like激酶1 (Plk1)作为小说在慢性粒细胞白血病药物目标:覆盖Plk1的伊马替尼耐药抑制剂BI 2536。癌症Res70年:1513 - 1523
纳格尔灰色PJ,贝尔斯——DJ,汉族H, R,曹女士,院长N,冯·霍夫DD(2004)识别人类polo-like激酶1在胰腺癌作为一个潜在的治疗目标。摩尔癌症其他3:641 - 646
Heinemann V, Boeck年代,Hinke Labianca R, Louvet C(2008)随机试验的荟萃分析:评估受益gemcitabine-based结合化疗应用于先进的胰腺癌。BMC癌症8:82
Hofheinz RD, Al-Batran SE, Hochhaus Jager E, Reichardt六世,弗里奇H, Trommeshauser D, Munzert G(2010)非盲,第一阶段的研究polo-like激酶抑制剂,BI 2536年晚期实体肿瘤患者。中国癌症Res16:4666 - 4674
Howlader N,没有人点,Krapcho M, Neyman N, Aminou R,沃尔德伦W, Altekruse科幻,Kosary CL,鲁尔J, Tatalovich Z,曹H, Mariotto,艾斯纳议员刘易斯博士,陈HS封地EJ,克罗宁KA,爱德华兹BK (eds) (2011) SEER癌症统计审查,1975 - 2008。马里兰州贝塞斯达国家癌症研究所http://seer.cancer.gov/csr/1975_2008/根据2010年11月SEER数据提交,张贴SEER网站
Jemal,布雷F,中心MM, Ferlay J,病房E,福尔曼D(2011)全球癌症统计数据。CA癌症中国61年:69 - 90
威尔克森Sackett Komlodi-Pasztor E、D J, Fojo T(2011)有丝分裂并不是一个微管代理在病人肿瘤的关键目标。Nat牧师肿瘤防治杂志8:244 - 250
李D,谢K,沃尔夫R, Abbruzzese杰(2004)胰腺癌。《柳叶刀》363年:1049 - 1057
马WW,梅瑟史密斯对比佤邦、Dy GK Freas E,惠氏,威廉F,堪称" SG, Adjei AA,港务局(2011)最终结果的第一阶段研究的一种新的细胞周期抑制剂的组合在01910年。Na与吉西他滨在晚期胰腺癌患者和其他实体肿瘤。中华肿瘤防治杂志29日,3101年(抽象)
摩尔MJ, Goldstein D,哈姆J,孙亚红,赫克特小,难堪的年代,非盟HJ Murawa P, Walde D,沃尔夫RA,坎波斯D, Lim R,丁K,克拉克G, Voskoglou-Nomikos T, Ptasynski M, Parulekar W(2007)埃罗替尼+吉西他滨与吉西他滨在晚期胰腺癌患者:第三期临床试验的加拿大国家癌症研究所的临床试验。中华肿瘤防治杂志25:1960 - 1966
mro K,霜,Steinbild年代,Hedbom年代,性质J, Kaiser R, Rouyrre N, Trommeshauser D, Hoesl CE、Munzert G(2008)第一阶段2536年BI剂量升级和药代动力学研究,小说Polo-like激酶1抑制剂,在晚期实体肿瘤患者。中华肿瘤防治杂志26:5511 - 5517
巴克张艺泷D, D, Sharma R,布鲁内托,Yap助教,Taegtmeyer AB, Barriuso J, Medani H, Degenhardt YY,奥尔雷德AJ,史密斯哒,默里SC, Lampkin助教,Dar MM,威尔逊R, de Bono JS Blagden我研究GSK461364 SP(2011)阶段,一个特定的和竞争Polo-like激酶1抑制剂,在先进的固体恶性血液病患者。中国癌症Res17:3420 - 3430
Oussenko IA,荷兰摩根富林明,Reddy EP, Ohnuma T 01910年(2011年)的影响。抗癌有丝分裂抑制剂,Na,细胞循环过程与RanGAP1 hyperphosphorylation。癌症Res71年:4968 - 4976
Schoffski P (2009) Polo-like激酶(PLK)抑制剂在临床前和临床肿瘤学的发展。肿瘤学家14:559 - 570
Schoffski P, Awada Dumez H,吉尔T, Bartholomeus年代,沃尔特P, Taton M,弗里奇H, Glomb P, Munzert G(2012)第一阶段,剂量递增研究小说的Polo-like激酶抑制剂volasertib 6727 (BI)先进的固体肿瘤患者。欧元J癌症48:179 - 186
雷纳特Steegmaier M,霍夫曼M, Baum, P, Petronczki M, Krssak M, Gurtler U, Garin-Chesa P, Lieb年代,量化J, Grauert M,阿道夫GR,德国人N,彼得斯JM, Rettig WJ(2007) 2536年BI,有力和polo-like激酶1的选择性抑制剂,抑制肿瘤的生长在活的有机体内。咕咕叫杂志17:316 - 322
Strebhardt K(2010)多方面polo-like激酶:药物靶点和antitargets癌症治疗。Nat牧师药物越是加大9:643 - 660
Swanton C(2004)细胞循环靶向治疗。《柳叶刀》杂志5:27-36
加藤Sano高桥T, B,经营T H, Sugiyama Y, Kunieda K,木村M,冈Y, Saji S (2003) Polo-like激酶1 (PLK1)是主要在结肠直肠癌。癌症科学94年:148 - 152
特罗凯(包插入)(2010)OSI制药,Inc .):梅尔维尔,纽约;基因泰克公司:南旧金山
特罗凯(产品特征的总结)(2011)罗氏注册有限:韦林花园城,英国
狼G,邵,Doermer Holtrich U,阿克曼H, Stutte HJ, Altmannsberger嗯,Rubsamen-Waigmann H, Strebhardt K(1997)的预后意义polo-like激酶(PLK)表达在非小细胞肺癌。致癌基因14:543 - 549
确认
本研究支持勃林格殷格翰集团制药GmBH & Co KG。写作和编辑提供的援助是维多利亚几何学的罗伯,简约的勃林格殷格翰集团制药GmBH & Co KG。这个手稿的作者满足标准为作者推荐的国际医学期刊编辑委员会,完全负责所有内容和编辑决策和参与所有的手稿的发展阶段。作者没有收到相关补偿这个手稿的发展。
作者信息
作者和联系
相应的作者
额外的信息
这项工作发表在标准许可下发布协议。后12个月的工作将成为免费的许可条款将切换到Creative Commons Attribution-NonCommercial-Share都3.0 Unported许可证。
权利和权限
从原来的出版了12个月之后,这个工作是在Creative Commons许可Attribution-NonCommercial-Share都3.0 Unported许可证。查看本许可证的副本,请访问http://creativecommons.org/licenses/by-nc-sa/3.0/
关于这篇文章
引用这篇文章
mro, K。,Dittrich, C., Aulitzky, W.et al。Polo-like激酶抑制剂的随机二期试验2536年BI chemo-naive不可切除的患者胰腺的外分泌腺癌——在中欧社会研究抗癌药物研究(塞萨尔)协作网络。Br J癌症107年,280 - 286 (2012)。https://doi.org/10.1038/bjc.2012.257
收到了:
修改后的:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/bjc.2012.257
关键字
- 胰腺癌
- Plk1抑制剂
- 二期
- 2536年毕
本文引用的
针对PLK1-FOXO1通路作为小说治疗晚期前列腺癌的治疗方法
科学报告(2020)
新的打赌抑制剂,171年,通过细胞增殖抑制肿瘤生长抑制细胞凋亡诱导多
临床实验的新药(2020)
Polo-like激酶和急性白血病
致癌基因(2019)
PLK1抑制三阴性乳腺癌的治疗潜力
实验室调查(2019)
Polo-like激酶抑制剂的发现和发展volasertib在癌症治疗
白血病(2015)