文摘
背景:
代谢产物释放的肠道微生物群可能影响宿主代谢和免疫。我们已经测试了的假设inulin-type果聚糖(ITF),通过促进微生物生产的短链脂肪酸(SCFA),影响肠道外肿瘤细胞增殖。
方法:
小鼠移植Bcr-Abl-transfected BaF3细胞,收到ITF的饮用水。肠道微生物群是由16 s rDNA分析聚合酶链反应(PCR)变性梯度凝胶电泳(DGGE)和qPCR。血清短链脂肪酸被UHPLC-MS量化。细胞增殖是评估在活的有机体内、分子生物学、组织学和在体外。
结果:
Inulin-type果聚糖治疗减少肝BaF3细胞渗透,减少炎症和门户丙酸浓度增加。在体外丙酸,减少BaF3通过营地等级相关通路细胞生长。此外,游离脂肪酸的激活受体2 (FFA2), Gi / Gq-protein-coupled受体也称为GPR43丙酸结合,减少BaF3和其他人类癌症细胞系的增殖。
结论:
我们首次显示,丙酸发酵的营养如ITF可以抵消恶性细胞增殖在肝脏组织。我们的研究结果支持的利益FFA2激活作为癌症治疗的新策略。这项研究强调了研究关注的重要性肠道microbes-host交互管理系统和严重的疾病,如白血病。
主要
肠道微生物群的利润从高代谢生成自己的能源潜力,主要是通过发酵饮食non-digestible碳水化合物(Neish 2009)。碳水化合物发酵结束产品气体和有机酸,包括乳酸和短链脂肪酸(SCFA)如乙酸、丙酸和丁酸盐(Neish 2009)。在人类中,丁酸盐构成的主要能量来源colonocytes (Guarner Malagelada, 2003)。丙酸是主要由肝脏,而醋酸周组织(Guarner Malagelada, 2003)。短链脂肪酸被认为是关键的代谢和免疫细胞监管机构(Neish 2009)。乙酸和丙酸表现出人类单核细胞和抗炎作用在活的有机体内在结肠炎模型(考克斯等人,2009年;Maslowski et al, 2009年)。在人类癌症细胞,丁酸和其他SCFA影响细胞周期抑制增殖和诱导分化和细胞死亡(Siavoshian et al, 2000年;青山et al, 2010年;唐等人,2011年)。细胞内参与细胞增殖和细胞死亡机制(还存在激活3和7,减少组蛋白脱乙酰酶活动),被广泛使用评估在体外化验(青山et al, 2010年;唐等人,2011年)。最近,两个G-protein-coupled受体,游离脂肪酸受体3 (FFA3)和FFA2,也称为GPR41 GPR43,分别被确定为SCFA受体(布朗等人,2003年;Le Poul et al, 2003年)。丙酸被认为是最有效的内源性FFA3和FFA2受体激动剂(布朗等人,2003年;Le Poul et al, 2003年)。游离脂肪酸受体2表达主要发生在免疫细胞中,而且在脂肪细胞、肠上皮细胞和内分泌细胞(布朗等人,2003年;Le Poul et al, 2003年)。游离脂肪酸受体3展品普遍表达式模式(脾、淋巴结、骨髓、脂肪组织和结肠癌)(布朗等人,2003年;Le Poul et al, 2003年)。教训FFA2淘汰赛老鼠和携带RNA技术,显示丙酸和乙酸的性质归因于FFA2-binding活动,例如,解决炎症反应在结肠炎小鼠模型(Maslowski et al, 2009年)、中性粒细胞趋化性(Vinolo et al, 2011年),glucagon-like peptide-1分泌(Tolhurst et al, 2012年)和pre-adipocyte分化(2005年香港et al)。
基于这样的理论:丁酸盐增加核扩散和减少结肠癌细胞系的细胞凋亡(Siavoshian et al, 2000年;唐等人,2011年),营养方法,提出了管理可发酵non-digestible碳水化合物,作为辅助治疗结肠癌(Pool-Zobel萨奥尔,2007)。有趣的是,可发酵碳水化合物non-digestible也可能与胃肠道外控制肿瘤生长。我们和其他人所描述的口服inulin-type果聚糖(ITF),这些non-digestible碳水化合物,减少肿瘤的大小在肝脏或乳腺癌小鼠模型(锥形et al, 1997年;Kondegowda et al, 2011年)。Inulin-type果聚糖是由saccharolytic细菌发酵,导致增加生产小鼠盲肠的短链脂肪酸(Busserolles et al, 2003年)。生命起源以前的养分,ITF改变肠道微生物群的组成和活动(埃弗拉德等,2011年),和控制宿主代谢和免疫(主要在结肠炎,肥胖和糖尿病模型)(Cherbut et al, 2003年;Cani et al, 2006年;Cani et al, 2007年)。即便如此,没有机械的研究调查ITF系统性抗肿瘤作用到目前为止已经完成。
我们提出SCFA增产ITF政府可能会阻碍系统性癌症恶化后,通过FFA2激活,这可能发生。我们选择一个模型,小鼠概率ectopically BaF3细胞表达bcr - abl因为他们可以入侵并增殖的淋巴器官(2005年任;Fiskus et al, 2006年;Bindels et al, 2012年),比如肝组织,积极占用SCFA来源于肠道。在这里,我们证明在活的有机体内ITF减少BaF3细胞增殖,增加丙酸在门静脉和降低全身炎症,和在体外丙酸,减少BaF3通过营地等级相关细胞增殖途径,改变BaF3 FFA2激活细胞生长。
材料和方法
动物
雌性BALB / c小鼠(5-week-old,查尔斯河,法国)被安置在12 h每个笼子里的两只老鼠光/暗周期。生理盐水或BaF3细胞(1×106细胞在0.1毫升生理盐水),曝露的尾静脉注入老鼠。BaF3接种后一天,一半的老鼠与BaF3细胞移植收到每天0.2克ITF (Orafti p95, Beneo-Orafti, Oreye,比利时)的饮用水。食物和水的摄入量是每2天记录监控ITF消费。老鼠被杀死在疾病的晚期(BaF3接种后13天)与氯胺酮麻醉后/甲苯噻嗪i.p。,分别为100和10毫克/公斤。血液样本,肝脏,脾脏和盲肠内容收获进行进一步分析。实验经当地伦理委员会批准,和住房条件所指定的2010年4月6日比利时法律,保护实验动物(协议LA - 1230314)。
组织和细胞信使rna分析
从组织和细胞总RNA分离使用TriPure隔离试剂盒(罗氏诊断,潘茨堡,德国)。互补DNA是由反转录的1μg总RNA使用逆转录系统工具包(WI Promega,麦迪逊,美国)。定量聚合酶链反应(qPCR)进行(如前所述)(Bindels et al, 2012年)。目标基因的引物序列详细补充表1。
肠道微生物群分析
肠道微生物群组成由16 s rRNA基因分析评估使用变性梯度凝胶电泳(DGGE)和qPCR,如前所述(Bindels et al, 2012年)。基因组DNA提取的盲肠的内容使用QIAamp DNA凳子迷你包(试剂盒、希尔登,德国)根据制造商的指示。完整的在线协议是可用的补充的方法。
生化和组织学分析
等离子体l乳酸浓度确定spectrophotometrically通过测量在340 nm的增加NADH-mediated NAD +和吸光度l乳酸脱氢酶(罗氏,曼海姆,德国)的一个基本的缓冲区。光谱光度测量的工具是用来确定乳酸脱氢酶活性(动画、Sopachem、布鲁塞尔,比利时)。血浆细胞因子测定使用定制的多路复用设备(Bio-Rad,拿撒勒,比利时)和Luminex技术(Bio-Plex Bio-Rad)。肝甘油三酯含量用分光光度工具包(动画)在脂质提取chloroform-methanol(2: 1)根据Folch的方法。测定肝糖原含量、肝脏组织在碱性介质和消化,中和后,在没有孵化或淀粉转葡糖苷酶的存在。每个条件的葡萄糖浓度测定的光谱光度测量的工具(动画)和糖原含量计算不同葡萄糖浓度绘制标准曲线。肝脏组织学分析,formalin-conserved是嵌入在石蜡。
短链脂肪酸分析
短链脂肪酸量化使用ultraperformance液相色谱与质谱(UHPLC-MS)提取后血清和随后derivatisation。进行了提取和derivatisation协议如前所述丙戊酸(Alric et al, 1981年)。短暂,短链脂肪酸提取50μl门户的血清与盐酸、乙腈和氯化钾。离心后,上阶段与碳酸钾孵化。的执行derivatisation 2-bromo-2-acetonaphthone的1,4,7,10,13-pentaoxacyclopentadecane和K2有限公司3。结束时的反应,液相是恢复和干下氮流。由此产生的残渣溶解在甲醇。5 -μ分析了l整除UHPLC-MS使用LTQ-Orbitrap质谱仪(ThermoFisher科学,阿尔斯特,比利时)耦合到一个Accela UHPLC系统(ThermoFisher科学)。分析物的分离是通过使用一个海波西尔金aQ(50×2.1)列(热科学)。移动阶段A和B是acetonitrile-H组成2O-acetic酸10:90:0.1 (v / v / v)和acetonitrile-acetic酸100:0.1 (v / v),分别。梯度(0.5毫升分钟−1)设计如下:90%的8分钟;从90%到100% B线性/ 6分钟;其次是3分钟100% B和随后re-equilibration 90%我们女士分析积极执行模式APCI电离源。乙酸、丙酸和丁酸量化使用丙戊酸钠作为内标,和校准曲线是由纯标准稀释在水里。分析物的性质,证实了他们的质量,一份碎片和co-elution纯标准。此外,醋酸减少污染,超纯水(开曼化工、塔林、爱沙尼亚)和HPLC-grade乙腈(VWR,鲁汶,比利时)纯化SPE在平流层列(PL-HCO3 MP-resin,瓦里安,安捷伦科技,圣克拉拉,CA,美国)。
细胞培养和化学物质
bcr - abl的BaF3细胞系转染是K Bhalla)博士的礼物(MCG癌症中心、佐治亚医学院、奥古斯塔、乔治亚州,美国)。BaF3细胞维持1640年RPMI介质补充10%胎牛血清(PAA克隆、PAA、派斯克、奥地利),链霉素100μ克毫升−1青霉素100 IU毫升−1和1%的非必需氨基酸溶液(Gibco、Inchinnan、苏格兰)37°C湿润有限公司5%2。这些细胞的生成是其他地方的详细描述(Fiskus et al, 2006年)。人类组织细胞的淋巴瘤U937 (Sundstrom和尼尔森,1976年)和淋巴母细胞K562细胞保持在相同的条件下,除了非必需氨基酸的解决方案。
所有化学品都从Sigma-Aldrich购买,圣路易斯,密苏里州,美国,除了合成FFA2受体激动剂(4-chloro -α(1号乙)N2-thiazolyl-benzeneacetamide) (CMTB) (王等人,2010年)(Ambinter、巴黎、法国)。
细胞增殖(MTT、手动计数、BrdU)
新陈代谢细胞生长试验是基于活跃细胞裂开黄噻唑基蓝四唑溴化(MTT)形成紫色甲瓒晶体。甲瓒的吸光度测量在570海里,从一个背景值,测量在650海里,是减去。细胞增殖是表示为一个百分比的价值获得细胞孵化与车辆(中、PBS或DMSO,最终浓度0.2%和0.1之间)。手动计数、完整的细胞(赤藓红由排斥)在伯克细胞在显微镜下计数。溴脱氧尿苷公司化验后执行制造商的指令(细胞增殖ELISA, BrdU比色,罗氏,曼海姆,德国)。所有的化验进行介质中含10%胎牛血清。完整的在线协议是可用的补充的方法。
统计分析
结果表示为均值±s.e.m。学生的t以及,与图基单向方差分析事后测试并与Bonferroni双向方差分析事后测试被用于统计分析。P< 0.05被认为是统计学意义(Graph-Pad棱镜软件、圣地亚哥、钙、美国)。
结果
Inulin-type果聚糖政府减少肝BaF3细胞的渗透和系统性炎症小鼠
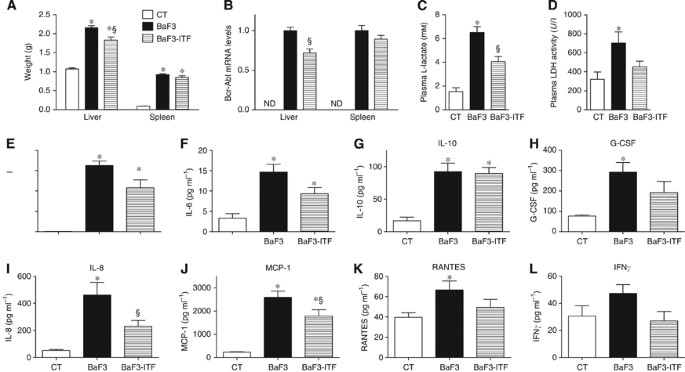
BaF3细胞移植到小鼠导致积极的模拟急性白血病和恶性肿瘤的特点是一个积累BaF3细胞在肝脏和脾脏。小鼠的肝脏和脾脏重量增加与BaF3细胞移植(BaF3老鼠),依照事实BaF3细胞渗透这些器官(图1一个)。有趣的是,ITF政府受损肝脏引起的体重增加BaF3细胞在脾脏重量无显著的影响。因为bcr - abl嵌合蛋白质,只和既定BaF3表达细胞,这是一个宝贵的BaF3标记细胞的存在。bcr - abl BaF3-ITF小鼠的肝脏表达与BaF3小鼠的肝实质反映了低渗透BaF3细胞(图1 b)所建议的组织学观察(补充图1)。肝糖原和甘油三酸酯含量不能占肝脏重量的差异,因为他们之间的相似BaF3和BaF3-ITF老鼠(补充图1 b和C)。认识提高脾脏重量,脾bcr - abl表达没有明显修改ITF管理局(图1 b,P= 0.21)。糖酵解途径成为主要恶性肿瘤细胞系和肿瘤生成lactacte作为最终产品,而血液中乳酸脱氢酶活性反映了一般细胞营业额和消极的进展(白血病预后因子Montillo et al, 2005年;Sonveaux et al, 2008年)。因此,等离子体l乳酸和血浆乳酸脱氢酶活性均增加BaF3肿瘤的存在,而ITF政府减少这些水平(图1 c和D)。值得注意的是,没有水或食物摄入量的变化由于ITF管理(数据未显示)。
鉴于癌细胞恶化和ITF治疗都能调节免疫,我们测量一组血浆细胞因子。血浆白介素4 (il - 4)、白细胞介素6 (il - 6)、白介素10 (il - 10)、粒细胞集落刺激因子(g - csf)、白介素8(引发)、单核细胞chemo-attractant蛋白1 (MCP-1)和咆哮在BaF3显著增加小鼠(图1 e-k)。Inulin-type果聚糖政府BaF3老鼠降低il - 4,引发和MCP-1水平(图1 e,我对il - 10)无显著影响,g - csf和咆哮的水平(图1 g, H)。白介素6是减少ITF治疗,这是由学生的重要t以及(P= 0.04)。干扰素(干扰素γ)倾向于减少了ITF喂养(P= 0.05,学生的t以及)(图1 l)。
Inulin-type果聚糖政府修改肠道微生物群组成和丙酸增加门静脉
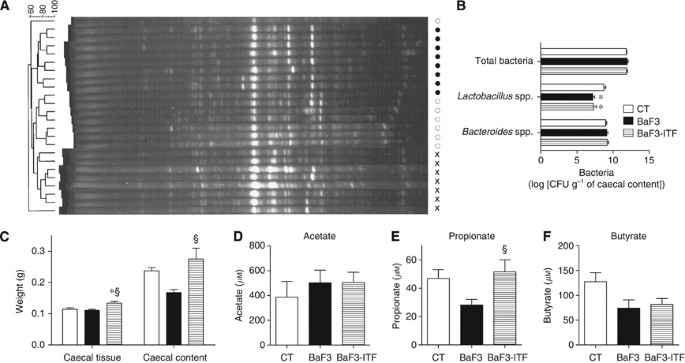
我们提出,ITF政府减少BaF3系统性炎症细胞浸润和降低通过肠道微生物群调制。肠道微生物组成的变化进行了评估使用DGGE和qPCR 16 s rRNA基因序列的总细菌、乳酸菌spp。双歧杆菌属spp。(两个革兰氏阳性属以消炎(路易et al, 2007年)),拟杆菌spp。(主要属革兰氏阴性)。总细菌的DGGE指纹显示三个集群,对应于每个治疗(图2一个)。DGGE指纹的系统树图表明,BaF3-ITF指纹鼠标从控制老鼠相比,更接近那些BaF3鼠标指纹。总细菌和革兰氏阴性拟杆菌被BaF3移植和修改ITF管理局(图2 b)。乳酸杆菌BaF3老鼠水平相对较低vs控制老鼠从ITF补充没有任何影响。值得注意的是,双歧杆菌的数量低于量化限制在本研究中使用的老鼠应变,即BALB / c小鼠。
盲肠的内容倾向于减少重量BaF3老鼠(单向方差分析不重要,但是P= 0.003的学生t以及)(图2 c)。我们可以合理地建议减少盲肠的内容BaF3小鼠体重减少食物摄入量的结果观察实验在过去2天(食物摄入量从11到13天:天CT: 9.62±0.51;BaF3: 7.02±0.37 g *;BaF3-ITF: 7.07±0.31 g *;n= 4 *P< 0.05vsCT)。然而,盲肠的内容BaF3-ITF小鼠体重增加,即使这些老鼠比BaF3老鼠吃同样数量的食物。盲肠的内容体重的增加反映了发生在ITF喂养的发酵。发酵还支持假说的盲肠的组织增加体重,只观察到BaF3-ITF老鼠(图2 c)。因为我们提出增加SCFA水平可以解释ITF治疗癌症恶化的影响,我们建立了一个方法来量化水平的乙酸,丙酸和丁酸门户血清。BaF3老鼠往往表现出减少血清丙酸和丁酸水平(P= 0.02和0.05,分别是学生的t以及)。ITF不补充修改乙酸和丁酸的水平,但丙酸诱导的双重提高水平(图2 d-f)。
短链脂肪酸减少BaF3细胞增殖在体外
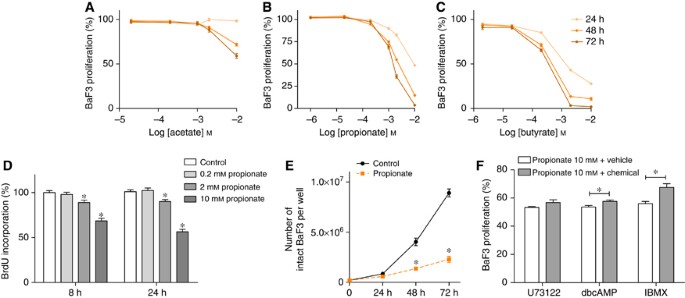
作为典型的ITF发酵代谢产物,SCFA可能合适的候选人可能占ITF在BaF3细胞生长的影响。事实上,BaF3细胞孵化的SCFA导致时间和剂量依赖性降低细胞增殖,通过MTT试验(如图所示图3 a - c)。值得注意的是,SCFA 10 m米没有修改介质的pH值。乙酸在SCFA,更强大的比丙酸和丁酸。0.2米米丙酸轻微但显著降低BaF3细胞生长(48 h后孵化,控制:100±1%;丙酸0,2 m米:95±1%的控制扩散;n= 3一式三份,P= 0.0032)。考虑到在活的有机体内ITF增加丙酸(但不是醋酸丁酸)和减少BaF3细胞增殖,我们集中在体外研究anti-proliferative丙酸的影响。因此,短期孵化项目,supra-physiological剂量,被用来研究丙酸的潜在机制。BrdU合并,反映出DNA合成,降低8和24小时后的孵化2和10 m的存在米丙酸(图3 d)。这些结果证实了计算生活BaF3细胞孵化2 m的存在米丙酸24、48或72 h (图3 e)。
短链脂肪酸减少BaF3细胞增殖在体外。(一个- - - - - -C)BaF3细胞没有孵化或乙酸,丙酸,丁酸24、48和72小时之前执行MTT试验。(D)BrdU公司8或24小时孵化后没有或丙酸的存在。(E)手动计数BaF3细胞后24、48和72 h在没有或2 m的存在米丙酸。(F)BaF3细胞pre-incubated没有或存在表示药物(U73122 2μ米,1 h;dbcAMP 1米米,30分钟;IBMX 316μ米1小时),然后在没有孵化或存在丙酸24 h。数据表示为一个百分比的控制执行每个丙酸药理条件缺乏。MTT试验。图表表示数据获得至少三个独立实验一式三份。*P< 0.05vs的控制。为F,每组与Bonferroni双向方差分析的数据进行了分析事后测试考虑控制的价值观。
丙酸减少BaF3通过营地等级相关通路细胞生长
丙酸是一种最有效的内源性FFA2配体和FFA2高度表达的BaF3细胞(Maslowski et al, 2009年)。因此,我们接下来要确定一个G-protein-coupled受体通路(可能FFA2)参与了anti-proliferative丙酸的影响。FFA2显示双耦合通过胃肠道和Gq蛋白家族(布朗等人,2003年;Le Poul et al, 2003年)。因此,与U73122 BaF3细胞被孵化,磷脂酶C (PLC)抑制剂。PLC封锁不钝propionate-induced细胞生长逮捕(图3 f;原始数据中补充图2)。胃肠道蛋白抑制腺苷酸环化酶,随后减少营地。因此,我们下一个调查如果营水平有一个角色在anti-proliferative丙酸的影响。DibutyrylcAMP、营地模拟或3-isobutyl-1-methylxanthine (IBMX),磷酸二酯酶的抑制剂,稍微减少了anti-proliferative行动丙酸(图3 f;原始数据中补充图2)。此外,异丙肾上腺素β肾上腺素能受体激动剂,其他属性,增加阵营,也稍微减少了anti-proliferative丙酸的影响(补充图2)。总的来说,这些数据表明,丙酸的anti-proliferative效果部分依赖于营水平。
游离脂肪酸受体2激活减少老鼠和人类细胞增殖在体外
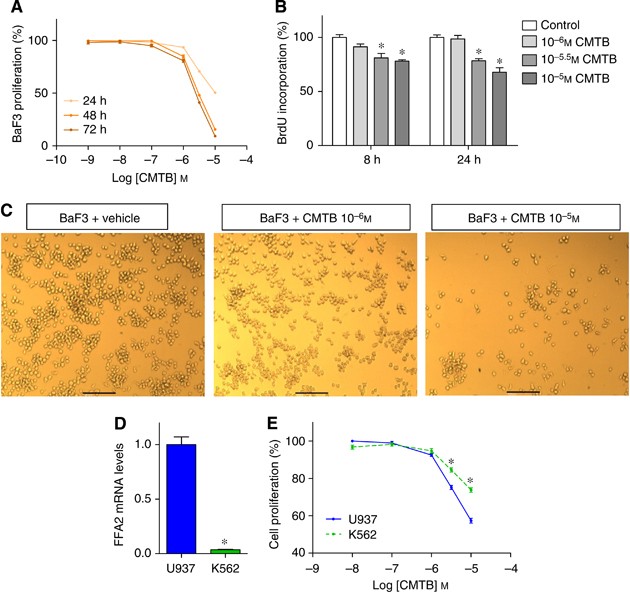
最后,我们想知道是否FFA2激活实际上是能够减少BaF3细胞生长。为此,我们使用CMTB,一个强有力的合成FFA2受体激动剂(王等人,2010年),发现它以时间和剂量依赖性的方式减少细胞增殖(MTT和BrdU化验)(图4 a和B)。这些结果证实了显微观察CMTB治疗后(图4 c)。此外,U73122 dibutyrylcAMP IBMX和异丙肾上腺素抑制CMTB-induced细胞生长停止,表明这两个阵营——和PLC-dependent通路参与CMTB anti-proliferative效应(补充图3)。
支持的角色FFA2 CMTB和丙酸的影响,我们测试了它们对Lewis肺癌的影响(LLC)细胞,低水平表达的细胞株FFA2 (补充图4)。BaF3细胞更敏感的anti-proliferative行动CMTB和丙酸比LLC的细胞几乎完全抵抗治疗,24小时后孵化(补充图4 b和C)。同样值得注意的是,LLC和BaF3细胞对阿霉素敏感,一个经典的化学治疗剂(补充图4 d)(2010年布雷et al)。我们可以拒绝假设LLC细胞通常都对任何anti-proliferative治疗。
进一步扩展FFA2的概念作为一个新的癌症治疗的目标,我们研究的影响CMTB两人类癌症细胞系U937细胞K562细胞。CMTB减少两个细胞系的生长。U937细胞,表达一个25倍FFA2成绩单的更高层次与K562细胞相比,CMTB治疗更敏感(图4 d和E)。
讨论
在这项研究中,我们将演示在急性白血病小鼠模型,膳食ITF政府减少癌细胞浸润到肝脏,减少了炎症与癌症恶化有关。在体外,我们证明了anti-proliferative丙酸的影响部分等级相关,而且FFA2激活改变癌症细胞增殖。这些结果支持这一观点的肠道微生物群作用的控制系统癌症。
饮食ITF的抗炎效应是在病理条件下,如肥胖、糖尿病或肠道炎症(Cherbut et al, 2003年;Cani et al, 2006年;Cani et al, 2007年),这种影响与微生物ITF喂养引起的变化,即增加双歧杆菌和乳酸杆菌(路易et al, 2007年)。ITF发酵,反映BaF3-ITF小鼠盲肠的内容和组织重量增加,伴随着变化总肠道微生物群组成,在不改变乳酸杆菌和双歧杆菌的水平。因此,在这个阶段,我们不能认为ITF的抗炎效果的变化程度的乳酸菌,建议在其他模型。
肠道微生物群可以通过改变其代谢物影响BaF3细胞进展。我们假定的肠道microbiota-derived代谢物,增加在ITF治疗和专门针对肝组织,可以调解的保护作用。丙酸满足所有这些需求,因为它是ITF-fed大鼠门静脉的增加(Daubioul et al, 2002年),主要是由肝脏(Guarner Malagelada, 2003)。在目前的在活的有机体内研究中,丙酸含量增加门户BaF3-ITF小鼠的血。值得注意的是,丙酸和丁酸水平往往是降低癌症。这可以解释为改变肠道微生物群组成或减少食物摄入量观察到治疗结束时,这可以减少衬底供应。
确凿的在活的有机体内研究中,在体外研究显示BaF3细胞anti-proliferative丙酸的影响。因此,我们表明,丙酸,在SCFA,最可能的中介ITF的抗肿瘤效应。我们可以推测,丙酸吸收由肝脏解释了为什么ITF影响BaF3细胞进展在肝脏和脾脏。
在人类结肠癌细胞和中性粒细胞,anti-proliferative能力SCFA一直与SCFA抑制组蛋白脱乙酰酶活性的能力(Hinnebusch et al, 2002年;青山et al, 2010年)。丙酸丁酸盐是最强有力的抑制剂,而展示了一个中间概要文件。乙酸不影响组蛋白脱乙酰酶活动(Hinnebusch et al, 2002年;青山et al, 2010年)。在我们的在体外实验中,乙酸和丙酸减少BaF3细胞增殖。这让我们假定目标非组蛋白去乙酰酶抑制剂可能参与在体外anti-proliferative SCFA效应,即FFA2和FFA3。定量实时PCR显示FFA3表达BaF3细胞大约是100倍低于FFA2表达式(数据未显示)。因此,我们关注FFA2的潜在含义。鉴于细胞系的比较不同水平的表达FFA2 (LLC)和BaF3细胞),我们假设FFA2可能参与anti-proliferative丙酸的作用。游离脂肪酸受体2可以与胃肠道夫妇和Gq通路(布朗等人,2003年;Le Poul et al, 2003年)。阻止通过PLC Gq-PLC通路抑制剂没有抵消anti-proliferative丙酸的影响。模仿营水平增加(通过dibutyrylcAMP)和间接修改营地显著水平(通过IBMX或异丙肾上腺素),但仅略,减少了anti-proliferative丙酸的影响。因此,我们认为,丙酸的anti-proliferative活动可PLC-independent和部分营地等级相关。苯乙酰胺衍生物,如CMTB,最近形容FFA2受体激动剂和不活跃的反对GPCRs小组(包括FFA3)浓度高达30μ米(李等人,2008年;王等人,2010年)。在这里,我们建立FFA2激活通过PLC CMTB减少BaF3细胞生长和营地等级相关通路。重要的是,从药理研究的证据表明,FFA2激活不同的信号通路下游合成和内源性配体(李等人,2008年)。事实上,分子模拟分析表明,CMTB和内源性配体不绑定到相同的网站,这可能与丙酸CMTB和不同激活胃肠道和Gq通路。事实上,CMTB类似物同样激活《Gq》和胃肠道途径,而丙酸更强比Gq胃肠道途径(李等人,2008年)。需要额外的工作来评估的分子特征FFA2 FFA2-expressing癌细胞蛋白质水平,真正评估之前绑定的贡献的丙酸FFA2 anti-proliferative活动。
最后,用人类的进展细胞系,我们扩展FFA2激活tumour-suppressive治疗的概念。唐et al (2011 b)最近报道,增加FFA2人类结肠癌细胞的表达质粒转染tslp丙酸的作用。我们的结果表明FFA2治疗对不同造血癌症的治疗。
总之,这两个在活的有机体内和在体外方法治疗潜在的营养支持针对肠道微生物群在进展期疾病的控制。我们建议生产丙酸可能是肠道微生物功能负责生命起源以前的营养成分的抗肿瘤效应。此外,我们的数据支持治疗的兴趣药理激活FFA2控制癌细胞扩散。
引用
Alric R, Cociglio M, Blayac JP, Puech R(1981)绩效评估的反相高效液相色谱测定丙戊酸涉及分层溶剂萃取过程和precolumn derivatisation。J Chromatogr224年:289 - 299
青山M, Kotani J, Usami M(2010)丁酸和丙酸诱导活性或非活性通过HDAC抑制剂活动但是没有激活中性粒细胞凋亡GPR-41 / GPR-43通路。营养26(6):653 - 661
Bindels磅,贝克R, Schakman O,马丁JC,德支持者FC Sohet调频,Dewulf EM, Pachikian BD, Neyrinck, Thissen JP, Verrax J,卡尔德龙铅、锅B, Grangette C, Cani PD, Delzenne海里(2012)恢复特定的乳酸杆菌水平减少炎症和肌肉萎缩标记在急性白血病小鼠模型。《公共科学图书馆•综合》7(6):e37971
布雷J, Sludden J,格里芬MJ,科尔M, Verrill M, Jamieson D, Boddy AV(2010)药物基因学对响应的影响和毒性与阿霉素和环磷酰胺治疗的乳腺癌患者。Br J癌症102年(6):1003 - 1009
布朗AJ。戈兹沃西SM,巴恩斯AA, Eilert MM, Tcheang L,丹尼尔斯D,缪尔AI,维格斯沃斯MJ, Kinghorn我,弗雷泽NJ派克NB,弹奏JC, Steplewski公里,默多克公关,持有人JC,马歇尔FH Szekeres PG,威尔逊,Ignar DM, Foord SM,明智,道尔SJ(2003)孤儿G protein-coupled受体GPR41 GPR43被激活,丙酸和其他短链羧酸。J临床生物化学278年(13):11312 - 11319
Busserolles J, Gueux E, E,岩石Demigne C, Mazur, Rayssiguier Y (2003) Oligofructose防止hypertriglyceridemic和pro-oxidative高果糖饮食大鼠的影响。J减轻133年(6):1903 - 1908
Cani PD,可耐福C·伊格莱西亚斯,德鲁克DJ, Delzenne NM, Burcelin R(2006)肝改善葡萄糖耐量和胰岛素敏感性的oligofructose需要功能性glucagon-like肽1受体。糖尿病55(5):1484 - 1490
Cani PD, Neyrinck,蚕豆F,可耐福C, Burcelin RG,爵公里,吉布森GR, Delzenne海里(2007)的选择性增加双歧杆菌在肠道微生物区系通过一种机制提高high-fat-diet-induced糖尿病小鼠与endotoxaemia有关。Diabetologia50(11):2374 - 2383
Cherbut C,米歇尔•C Lecannu G(2003)的生命起源以前的特点fructooligosaccharides对于减少TNBS-induced结肠炎大鼠是必要的。J减轻133年(1):-
考克斯马,杰克逊J,斯坦顿M, Rojas-Triana,鲍勃L, Laverty M,杨X,朱F,刘J,王年代,Monsma F, Vassileva G,马奎尔M, Gustafson E, Bayne M,周CC, Lundell D, Jenh CH(2009)短链脂肪酸作为抗炎介质通过调节前列腺素E(2)和细胞因子。世界杂志15(44):5549 - 5557
卢梭Daubioul C, N, Demeure R, Gallez B,锥形H, Declerck B, Delzenne N(2002)饮食果聚糖,但不是纤维素,降低甘油三酯堆积在肝脏的肥胖Zucker fa / fa老鼠。J减轻132年(5):967 - 973
埃弗拉德,Lazarevic V, Derrien M,吉拉德M, Muccioli通用,Neyrinck, Possemiers年代,范哈,弗朗索瓦•P•德•Vos WM Delzenne NM,群落J, Cani PD(2011)肠道微生物群和葡萄糖和脂质代谢的反应在小鼠遗传肥胖和食源性leptin-resistant益生元。糖尿病60(11):2775 - 2786
Fiskus W, Pranpat M,巴厘岛P, Balasis M, Kumaraswamy年代,Boyapalle年代,罗查K,吴J,贾尔斯F,曼雷PW, Atadja P,巴拉K(2006)小说的酪氨酸激酶抑制剂AMN107和组蛋白脱乙酰酶抑制剂LBH589 Bcr-Abl-expressing人类白血病细胞。血108年(2):645 - 652
Guarner F, Malagelada小(2003)肠道菌群在健康和疾病。《柳叶刀》361年(9356):512 - 519
Hinnebusch BF,孟年代,吴JT,阿切尔SY, Hodin说道:RA(2002)短链脂肪酸的影响对人类结肠癌细胞表型与组蛋白hyperacetylation相关联。J减轻132年(5):1012 - 1017
香港YH,西村Y, Hishikawa D, Tsuzuki H, Miyahara H,后藤C,崔KC,冯DD,陈C,李HG, Katoh K,卢武铉SG,佐佐木年代(2005)乙酸和丙酸短链脂肪酸通过GPCR43刺激脂肪形成。内分泌学146年(12):5092 - 5099
Meaney Kondegowda NG, MP,贝克C, Ju YH (2011) non-digestible碳水化合物对estrogen-dependent人类乳腺癌的增长(MCF-7)植入肿瘤切除卵巢的无胸腺的老鼠。减轻癌症63年(1):55 - 64
Le Poul E, Loison C, Struyf年代,Springael司法院,Lannoy V, Decobecq我,Brezillon年代,Dupriez V, Vassart G, Van DJ,有土豆的M, Detheux M(2003)功能描述人类受体的短链脂肪酸和多形核细胞的激活作用。J临床生物化学278年(28):25481 - 25489
李T, Schwandner R, Swaminath G, Weiszmann J,卡多佐M,格林伯格J, Jaeckel P,通用电气H,王Y,焦X,刘J,凯塞F,田H,李Y(2008)识别和功能特性的变构为G FFA2 protein-coupled受体受体激动剂。摩尔杂志74年(6):1599 - 1609
路易斯·P,斯科特KP,邓肯SH,弗林特HJ(2007)了解饮食的影响在大肠细菌的新陈代谢。J: Microbiol102年(5):1197 - 1208
Maslowski公里,维埃拉,Ng, Kranich J, Sierro F,余D, Schilter HC, Rolph女士,麦凯F,阿提斯动物园D,泽维尔RJ,特谢拉MM,麦凯CR(2009)炎症反应的调节肠道微生物群和化学引诱物受体GPR43。自然461年(7268):1282 - 1286
林Montillo M, T, Hallek M,蒙特塞拉特E, E猜拳(2005)慢性淋巴细胞白血病:小说预后因素及其相关性risk-adapted治疗策略。Haematologica90年(3):391 - 399
Neish(2009)微生物在胃肠健康和疾病。胃肠病学136年(1):65 - 80
Pool-Zobel提单,萨奥尔J(2007)概述实验数据减少结直肠癌风险inulin-type果聚糖。J减轻137年(11):2580 - 2584年代
任R(2005)机制的bcr - abl慢性粒细胞性白血病的发病机理。Nat牧师癌症5(3):172 - 183
Siavoshian年代,Segain JP, Kornprobst M,阀盖C, Cherbut C, Galmiche JP, Blottiere嗯(2000)丁酸和trichostatin影响人类肠道上皮细胞的增殖和分化,诱导细胞周期素D3和p21表达。肠道46(4):507 - 514
Sonveaux P, Vegran F,施罗德T, Wergin MC, Verrax J,拉巴尼锌、De Saedeleer CJ,肯尼迪公里,Diepart C,乔丹BF,凯利MJ, Gallez B, Wahl ML, Feron O, Dewhirst兆瓦(2008)针对lactate-fueled呼吸有选择地杀死了缺氧小鼠的肿瘤细胞。中国投资118年(12):3930 - 3942
Sundstrom C,尼尔森K(1976)建立和描述的人类组织细胞的淋巴瘤细胞株(u - 937)。Int J癌症17(5):565 - 577
陈唐Y, Y,江H,聂D(2011)短链脂肪酸诱导自噬作为一种自适应策略阻碍mitochondria-mediated凋亡细胞死亡。细胞死亡是不同的18(4):602 - 618
陈唐Y, Y,江H,罗宾斯GT,聂D (2011 b) G-protein-coupled短链脂肪酸受体抑制结肠癌。Int J癌症128年(4):847 - 856
锥形HS Delzenne NM, Roberfroid MB(1997)移植小鼠肿瘤的生长抑制non-digestible碳水化合物。Int J癌症71年(6):1109 - 1112
Tolhurst G, Heffron H, Lam y,帕克,哈比卜,Diakogiannaki E,卡梅伦J, Grosse J, Reimann F,蛀木水虱调频(2012)短链脂肪酸刺激glucagon-like peptide-1通过G-protein-coupled受体FFAR2分泌。糖尿病61年(2):364 - 371
Vinolo妈,弗格森GJ, Kulkarni年代,Damoulakis G,安德森K, Bohlooly Y,斯蒂芬L,霍金斯PT, Curi R(2011)通过GPR43受体SCFAs诱导小鼠中性粒细胞的趋化作用。《公共科学图书馆•综合》6(6):e21205
焦王Y, X,凯塞F,刘J,王Z, Wanska M,格林伯格J, Weiszmann J,通用电气H,田H,黄,Schwandner R,李,李Y(2010)的第一个合成受体激动剂FFA2:发现和SAR苯乙酰胺的变构调节器。地中海Bioorg化学列托人20.(2):493 - 498
确认
我们感谢调频Sohet, BP Pachikian和F德支持者为有用的讨论和技术支持。激光弯曲是一个研究员,合资企业是一个科研工作者和PS和PDC从FRS-FNRS研究协会(喜欢国家de la任职)在比利时。RINH,阿伯丁大学接收来自苏格兰政府支持(resa)。药物是感谢大学catholique de鲁汶和FRS-FNRS(喜欢de la任职)FSR和FRFC(2.4555.08)格兰特,分别。PDC和NMD接受者FRS-FNRS格兰特(1.5105.11和1. a420.09)。
作者信息
作者和联系
相应的作者
额外的信息
补充信息伴随着英国癌症杂志》的网站上
权利和权限
这项工作在Creative Commons许可Attribution-NonCommercial-Share都3.0 Unported许可证。查看本许可证的副本,请访问http://creativecommons.org/licenses/by-nc-sa/3.0/
关于这篇文章
引用这篇文章
Bindels, L。,Porporato, P., Dewulf, E.et al。肠道microbiota-derived丙酸降低癌症肝细胞增殖。Br J癌症107年,1337 - 1344 (2012)。https://doi.org/10.1038/bjc.2012.409
收到了:
修改后的:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/bjc.2012.409
关键字
- 肠道微生物群
- 丙酸
- 癌症细胞
- FFA2 / FFAR2 / GPR43
- inulin-type果聚糖
本文引用的
Propionate-producing韦永氏球菌属parvula调节OSCC的恶性肿瘤细胞的性质
医学肿瘤学(2023)
Methylmalonic酸:一种与年龄相关的代谢物驱动肿瘤侵犯
自然的新陈代谢(2022)
针对癌症的肠道微生物群和肿瘤
自然医学(2022)
抗生素的早期生活和童年pre-B-ALL。原因分析可能的新拼图的
发现肿瘤(2022)
肠道微生物在骨骼肌生理和病理生理学
目前骨质疏松症的报道(2022)