摘要gydF4y2Ba
背景和目的:gydF4y2Ba
肠道激素肽YY (PYY)和胰高血糖素样肽1 (GLP-1)可显著抑制食欲。短链脂肪酸(SCFA)受体和游离脂肪酸受体2 (FFA2)存在于结肠肠内分泌L细胞上,并被认为在食欲调节中发挥作用。这里,我们描述gydF4y2Ba在体外gydF4y2Ba而且gydF4y2Ba在活的有机体内gydF4y2Ba结肠丙酸酯对小鼠PYY和GLP-1释放的影响,并以FFA2敲除小鼠研究FFA2在其中的介导作用。gydF4y2Ba
方法:gydF4y2Ba
我们使用Wistar大鼠、C57BL6小鼠和游离脂肪酸受体2敲除(FFA)gydF4y2Ba−−/gydF4y2Ba),以C57BL6为背景的小鼠为研究对象,探讨SCFA丙酸对PYY和GLP-1释放的影响。采用离体结肠隐窝培养物,研究丙酸对肠道激素释放的影响gydF4y2Ba在体外gydF4y2Ba.我们随后开发了gydF4y2Ba在活的有机体内gydF4y2Ba结肠灌注丙酸后,评估肠激素释放进入门静脉的技术。gydF4y2Ba
结果:gydF4y2Ba
丙酸能刺激野生型小鼠结肠隐窝培养物中PYY和GLP-1的分泌。这种效应在FFA2培养基中显著减弱gydF4y2Ba−−/gydF4y2Ba老鼠。结肠内注射丙酸可提高大鼠颈静脉血浆及大鼠和小鼠门静脉血浆中PYY和GLP-1的水平。然而,丙酸并没有显著刺激FFA2中肠道激素的释放gydF4y2Ba−−/gydF4y2Ba老鼠。gydF4y2Ba
结论:gydF4y2Ba
结肠内给药丙酸刺激大鼠和小鼠同时释放GLP-1和PYY。这些数据表明,FFA2缺乏同时损害了scfa诱导的肠道激素分泌gydF4y2Ba在体外gydF4y2Ba而且gydF4y2Ba在活的有机体内gydF4y2Ba.gydF4y2Ba
简介gydF4y2Ba
产厌食症肠道激素肽YY (PYY)和肠促胰岛素胰高血糖素样肽1 (GLP-1)在肠内分泌L细胞共同释放后,会急性抑制食欲。gydF4y2Ba1gydF4y2Ba有证据表明,RYGB (roux-en-Y胃旁路术)等手术引起的肠道营养物质的转移可能介导这些手术对减肥和2型糖尿病的显著影响,至少部分通过释放PYY和GLP-1。gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba了解营养物质如何刺激PYY和GLP-1分泌,可以导致更有效的营养管理和/或预防肥胖。gydF4y2Ba
营养刺激的肠道激素释放L细胞是很好的文件。gydF4y2Ba4gydF4y2Ba然而,大多数摄入的营养物质在到达L细胞密度最高的大肠之前是在小肠被吸收的。gydF4y2Ba5gydF4y2Ba有趣的是,结肠是肠道细菌发酵的主要部位,产生高水平的短链脂肪酸(SCFAs, 70-130 mmol lgydF4y2Ba−1gydF4y2Ba).gydF4y2Ba6gydF4y2Ba结肠微生物产生短链脂肪酸的主要基质是未被小肠消化的膳食碳水化合物,统称为膳食纤维。有趣的是,在人类的进化过程中,植物消耗的数量已经大大减少;古人类(主要食用草和莎草)每天的膳食纤维摄入量估计超过100克,而现代西方饮食通常导致每天摄入量低于15克。因此,结肠中发酵的物质数量明显减少。gydF4y2Ba
短链脂肪酸介导了它们的一些生物学效应gydF4y2Ba通过gydF4y2BaG蛋白偶联受体FFA2和FFA3,最近人们对FFA2在胃肠道生理和免疫功能以及能量和葡萄糖稳态中的有益作用越来越感兴趣。gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba最近的研究表明,FFA2可以防止高脂肪饮食的小鼠产生暴饮暴食、肥胖和胰岛素抵抗。gydF4y2Ba7gydF4y2Ba此外,据报道,ffa2缺乏的小鼠在正常饮食下表现出糖耐量受损。gydF4y2Ba10gydF4y2Ba这些效应可能至少部分是由SCFA和ffa2介导的肠道激素释放刺激引起的。事实上,TolhurstgydF4y2Baet al。gydF4y2Ba10gydF4y2Ba最近的研究表明,与SCFAs反应相关的GLP-1活性分泌在初级FFA2中减弱gydF4y2Ba−−/gydF4y2Ba小鼠L细胞gydF4y2Ba在体外gydF4y2Ba.然而,短链脂肪酸对原代结肠培养物PYY分泌的影响此前尚未被研究,而且不清楚ffa2是否对肠道激素释放产生依赖影响gydF4y2Ba在体外gydF4y2Ba相关gydF4y2Ba在活的有机体内gydF4y2Ba.最近的证据表明,SCFA丙酸与FFA2有很高的亲和力,gydF4y2Ba11gydF4y2Ba可能在肥胖治疗后肠道激素释放增强中起作用。gydF4y2Ba12gydF4y2Ba此外,丙酸是发酵的最终产物,因此不像乙酸和丁酸那样被微生物交叉代谢。gydF4y2Ba13gydF4y2Ba
因此,我们的目的是在啮齿类动物中确定(1)结肠丙酸对PYY和GLP-1释放的影响,以及(2)FFA2在介导这些影响中的作用gydF4y2Ba在体外gydF4y2Ba而且gydF4y2Ba在活的有机体内gydF4y2Ba.gydF4y2Ba
材料和方法gydF4y2Ba
在体外gydF4y2Ba
结肠文化准备gydF4y2Ba
C57BL6雄性小鼠(gydF4y2Ba⩾gydF4y2Ba8周龄;哈伦实验室,比斯特,英国)被取出,清洗,并置于冰冷的L-15(莱博维茨)培养基(PAA, Yeovil,英国)中。用L-15培养液彻底清洗肠道组织,0.4 mg ml消化gydF4y2Ba−1gydF4y2BagydF4y2BaogydF4y2BaC,如前所述。gydF4y2Ba14gydF4y2Ba将得到的细胞悬液离心(5min, 300gydF4y2BaggydF4y2Ba),微丸在DMEM中重悬(添加10%胎牛血清和1%抗生素,100 U mlgydF4y2Ba−1gydF4y2Ba青霉素0.1 mg mlgydF4y2Ba−1gydF4y2Ba链霉素)。复合细胞悬浮液通过尼龙网(孔径为250 μm)过滤,并被镀在24孔、1%基质涂层板上。这些盘子在37岁时被孵育了一夜gydF4y2BaogydF4y2Ba在95%氧的大气中gydF4y2Ba2gydF4y2Ba和5%的公司gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
肠道激素分泌实验gydF4y2Ba
分泌实验在电镀后24小时内进行。用分泌缓冲液(4.5 m)冲洗细胞3次gydF4y2Ba米gydF4y2Ba氯化钾、138米gydF4y2Ba米gydF4y2Ba氯化钠,4.2gydF4y2Ba米gydF4y2BaNaHCOgydF4y2Ba3.gydF4y2Ba1.2米,gydF4y2Ba米gydF4y2Ba不gydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba2.6米,gydF4y2Ba米gydF4y2BaCaClgydF4y2Ba2gydF4y2Ba1.2米,gydF4y2Ba米gydF4y2BaMgClgydF4y2Ba2gydF4y2Ba,和10米gydF4y2Ba米gydF4y2Ba添加0.1%无脂肪酸牛白蛋白血清(BSA;σ)。然后细胞在含有测试试剂的分泌缓冲液中孵育2小时gydF4y2BaogydF4y2Ba在95%氧的大气中gydF4y2Ba2gydF4y2Ba和5%的公司gydF4y2Ba2gydF4y2Ba.腺苷基环化酶激活剂forskolin (Sigma)和磷酸二酯酶抑制剂3-异丁基-1-甲基黄嘌呤(IBMX;Sigma)制备为10 mmol lgydF4y2Ba−1gydF4y2Ba二甲亚砜原液,最终浓度为10 μmol lgydF4y2Ba−1gydF4y2Ba每一个。在分泌物实验当天配制测试溶液。通过乳酸脱氢酶细胞毒性试验测定,试验试剂不具有细胞毒性(G-Biosciences, Maryland Heights, MO, USA)。gydF4y2Ba
孵育后,收集细胞上清,离心(3min, 100gydF4y2BaggydF4y2Ba).得到的上清液保存在−20gydF4y2BaogydF4y2BaC等待分析。将电镀的细胞用细胞裂解缓冲液处理并刮拭,离心后将裂解液保存在−20gydF4y2BaogydF4y2BaC等待分析。gydF4y2Ba
肠道激素分泌量计算为从每个孔测量的总激素(分泌+提取)的一部分,并相对于同一实验中测量的基础分泌量进行表达。gydF4y2Ba
在活的有机体内gydF4y2Ba
动物和住房gydF4y2Ba
所有的动物程序都经过了当地道德委员会的批准,并符合内政部的规定。抵达后,雄性Wistar大鼠(Charles River, Margate, UK)或雄性C57BL6小鼠(Harlan Laboratories)被成对饲养,并保持在21-23岁gydF4y2BaogydF4y2BaC按12小时光照,12小时暗周期(光照周期0700-1900小时)。在72 h的适应期,给予所有啮齿动物gydF4y2Ba随意gydF4y2Ba获得水和RM1标准食物(RM1饮食;特餐服务有限公司,Witham, Essex, UK)。FFA2基因敲除小鼠取自加文研究所的麦凯教授。通过同源重组将FFA2外显子1的55bp替换为β-gal-neo盒,将下游氨基酸序列移出阅读框。gydF4y2Ba15gydF4y2Ba
大鼠结肠内注射丙酸gydF4y2Ba
雄性Wistar大鼠(200-250 g)整晚禁食gydF4y2Ba随意gydF4y2Ba获得水)和使用异氟烷麻醉(1.5-4%;每分钟2升gydF4y2Ba2gydF4y2Ba流)。行颈内静脉插管及腹腔镜手术。采集两组基线颈静脉血样于gydF4y2BatgydF4y2Ba=−15gydF4y2BatgydF4y2Ba= 0分钟。丙酸(180 mmol lgydF4y2Ba−1gydF4y2Ba在大鼠盲肠远端结肠近端注射2.5 ml (~0.45 mmol) pH 5.5 (NaOH)或生理盐水对照(与pH和钠含量相匹配)。在gydF4y2BatgydF4y2Ba=15分钟采集门静脉和颈内静脉各1例。进一步的颈静脉样本采集于gydF4y2BatgydF4y2Ba= 30,gydF4y2BatgydF4y2Ba= 60分钟。血样采集于含有DPPIV抑制剂的eppendorfs (Millipore, Abingdon, UK;1 μl每100 μl血液,100 μmol lgydF4y2Ba−1gydF4y2Ba最终浓度)和蛋白酶抑制剂鸡尾酒(Sigma;1 μl / 100 μl血液)。血液离心10 min分离血浆。分离出来的等离子体立即放在干冰上。样品保存在−20gydF4y2BaogydF4y2BaC等待肠道激素分析。gydF4y2Ba
野生型和FFA2采用丙酸结肠内给药gydF4y2Ba−−/gydF4y2Ba老鼠gydF4y2Ba
编号C57BL6或FFA2gydF4y2Ba−−/gydF4y2Ba小鼠在异氟醚麻醉(1.5 ~ 4%;每分钟2升gydF4y2Ba2gydF4y2Ba血流),行剖腹手术。小鼠结肠内注射生理盐水(300 μl)或丙酸(180 mmol l)gydF4y2Ba−1gydF4y2Ba,与pH和钠含量相匹配)。注射后5min采集门静脉血液,采用既定的采样技术。gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba血浆按上述方法分离储存。gydF4y2Ba
肠道激素分析gydF4y2Ba
如前所述,使用敏感和特异的内部放射免疫分析法测定细胞上清、裂解液和血浆中GLP-1和PYY的总水平。gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba
统计分析gydF4y2Ba
使用D'Agostino-Pearson综合测试确定正态性gydF4y2BangydF4y2Ba⩾gydF4y2Ba8每组。统计学意义以未配对计算gydF4y2BatgydF4y2Ba-测试,单向方差分析或双向方差分析,视情况而定。采用Bonferroni多重比较进行两两比较gydF4y2Ba事后gydF4y2Ba测试。统计显著性为gydF4y2BaPgydF4y2Ba< 0.05。数据以平均值±s.e.m.表示。使用Graph Pad Prism软件,5.0版本(La Jolla, CA, USA)进行分析。gydF4y2Ba
结果gydF4y2Ba
丙酸能刺激小鼠L细胞释放PYY和GLP-1gydF4y2Ba
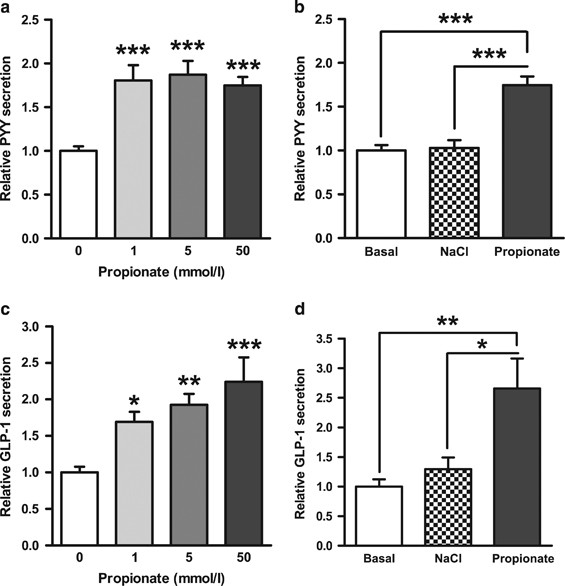
在小鼠原代结肠培养中,生理丙酸浓度(1-50 mmol lgydF4y2Ba−1gydF4y2Ba)gydF4y2Ba20.gydF4y2Ba显著刺激GLP-1和PYY分泌2小时(gydF4y2Ba图1a及cgydF4y2Ba).较高浓度的丙酸分别使PYY和GLP-1的释放量增加1.8倍和2.2倍。此外,50 mmol lgydF4y2Ba−1gydF4y2Ba与等渗NaCl对照相比,丙酸对肠道激素释放的影响仍极显著(gydF4y2Ba图1b和dgydF4y2Ba).gydF4y2Ba
丙酸对小鼠L细胞GLP-1和PYY分泌的影响。混合原代结肠培养加入1-50 mmol l的丙酸gydF4y2Ba−1gydF4y2Ba) (gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba).在50 mmol l的浓度下gydF4y2Ba−1gydF4y2Ba, NaCl对肠道激素释放无影响(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba).每个孔的GLP-1和PYY分泌量表示为孔内GLP-1或PYY总量的百分比,并归一化与同一实验中平行测量的基础分泌量。数据代表意味着±s.e.m。(gydF4y2BangydF4y2Ba= 6日到24日井)。与基础分泌(0 mmol lgydF4y2Ba−1gydF4y2Ba) (gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba)或同渗NaCl控制(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba)使用单因素方差分析(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaFgydF4y2Ba= 11.73,gydF4y2BaPgydF4y2Ba< 0.0001;gydF4y2BabgydF4y2Ba,gydF4y2BaFgydF4y2Ba= 7.931,gydF4y2BaPgydF4y2Ba= 0.0022;gydF4y2BacgydF4y2Ba,gydF4y2BaFgydF4y2Ba= 24.75,gydF4y2BaPgydF4y2Ba< 0.0001;gydF4y2BadgydF4y2Ba,gydF4y2BaFgydF4y2Ba= 25.99,gydF4y2BaPgydF4y2Ba<0.0001),使用BonferronigydF4y2Ba事后gydF4y2Ba测试(*gydF4y2BaPgydF4y2Ba< 0.05, * *gydF4y2BaPgydF4y2Ba< 0.01, * * *gydF4y2BaPgydF4y2Ba< 0.001)。gydF4y2Ba
结肠内注射丙酸可增加大鼠循环和门静脉血浆PYY和GLP-1浓度gydF4y2Ba
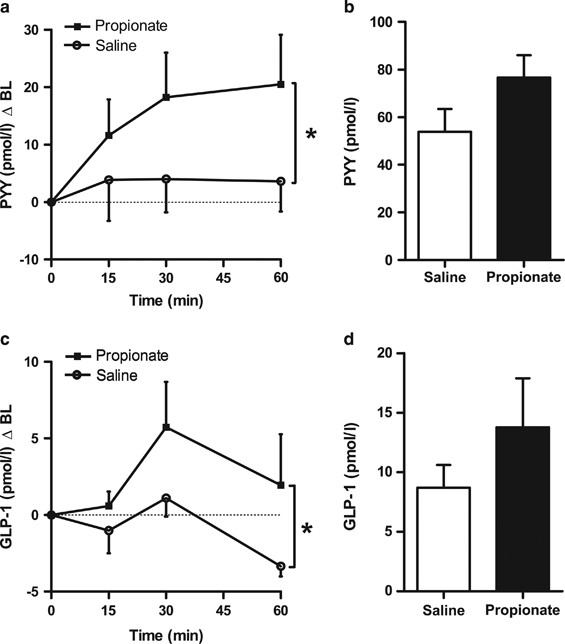
一个gydF4y2Ba在活的有机体内gydF4y2Ba通过结肠内单次注射丙酸,建立了能够评估血浆肠道激素谱的模型。结肠注射丙酸盐,60分钟后采集颈静脉血液样本,15分钟从门静脉单次采集血液样本。结肠内注射180 mmol lgydF4y2Ba−1gydF4y2Ba在麻醉大鼠中,丙酸(总剂量~0.45 mmol)与生理盐水对照(与钠含量和pH相匹配)导致循环血浆PYY和GLP-1水平显著升高(双向方差分析,治疗的影响)gydF4y2BaPgydF4y2Ba= 0.024,gydF4y2BaPgydF4y2Ba分别为= 0.023)。循环血浆GLP-1水平在30分钟达到峰值,而血浆PYY水平稳定上升,并在60分钟保持升高(gydF4y2Ba图2a及cgydF4y2Ba).此外,与生理盐水相比,15分钟时门静脉PYY和GLP-1水平升高(PYY, 76.5±9.4 vs 53.8±9.6 pmol lgydF4y2Ba−1gydF4y2BaGLP-1, 13.8±4.1 vs 8.7±1.9 pmol lgydF4y2Ba−1gydF4y2Ba),但这些差异在统计上并不显著(gydF4y2Ba图2b和dgydF4y2Ba).gydF4y2Ba
结肠内注射丙酸可增加雄性Wistar大鼠颈静脉和门静脉血浆肠激素浓度。在60分钟的时间内收集血液样本,gydF4y2Ba通过gydF4y2Ba颈静脉插管(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba),在gydF4y2BatgydF4y2Ba=离门静脉15分钟(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba),随后进行结肠内注射(2.5 ml) 180 mmol lgydF4y2Ba−1gydF4y2Ba异氟醚麻醉大鼠丙酸或生理盐水(与pH和钠含量相匹配)。数据代表意味着±s.e.m。(gydF4y2BangydF4y2Ba每组)= 10 - 14。显著性采用双向方差分析(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba)或未配对gydF4y2BatgydF4y2Ba以及(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba) (*gydF4y2BaPgydF4y2Ba< 0.05)。gydF4y2Ba
丙酸诱导的肠道激素释放在FFA2中减弱gydF4y2Ba−−/gydF4y2Ba原代小鼠L细胞gydF4y2Ba
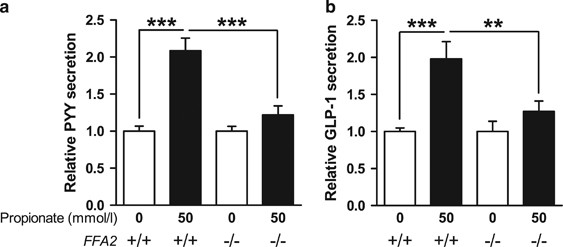
为了评估FFA2在丙酸诱导的PYY和GLP-1分泌中的作用,我们检测了丙酸对FFA2缺失小鼠(FFA2)原代结肠培养中肠道激素分泌的影响gydF4y2Ba−−/gydF4y2Ba).野生型小鼠结肠培养物50 mmol lgydF4y2Ba−1gydF4y2Ba丙酸强烈刺激原代L细胞PYY和GLP-1的分泌(~2倍,gydF4y2Ba图3a和bgydF4y2Ba).然而,FFA2对丙酸(相对于基础)的反应明显减弱gydF4y2Ba−−/gydF4y2Ba与野生型比较(PYY, 1.2- vs 2.1倍,GLP-1, 1.3- vs 2.0倍)(gydF4y2Ba图3a和bgydF4y2Ba).gydF4y2Ba
丙酸诱导的PYY和GLP-1分泌在FFA2中减弱gydF4y2Ba−−/gydF4y2Ba原代小鼠L细胞。从FFA2敲除的(−/−)和WT(+/+)同窝的原代结肠培养分别与丙酸(50 mmol l)孵育或不孵育gydF4y2Ba−1gydF4y2Ba).PYY组(gydF4y2Ba一个gydF4y2Ba)和GLP-1 (gydF4y2BabgydF4y2Ba)分泌量与孔内所含的总PYY或GLP-1的百分比表示,并归一化为基础分泌(0 mmol lgydF4y2Ba−1gydF4y2Ba)在同一实验中平行测量。数据代表意味着±s.e.m。(gydF4y2BangydF4y2Ba= 22-38威尔斯)。使用单向方差分析表明显著性相对于基础分泌(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaFgydF4y2Ba= 19.31,gydF4y2BaPgydF4y2Ba< 0.0001;gydF4y2BabgydF4y2Ba,gydF4y2BaFgydF4y2Ba= 8.816,gydF4y2BaPgydF4y2Ba<0.0001),使用BonferronigydF4y2Ba事后gydF4y2Ba测试(* *gydF4y2BaPgydF4y2Ba< 0.01;***gydF4y2BaPgydF4y2Ba< 0.001)。gydF4y2Ba
结肠内丙酸增加血浆肠道激素水平gydF4y2Ba通过gydF4y2Ba一种ffa2依赖的小鼠机制gydF4y2Ba
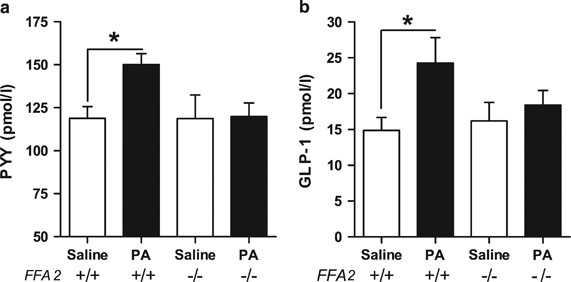
确定FFA2原代结肠培养中是否观察到减少的PYY和GLP-1分泌对丙酸的反应gydF4y2Ba−−/gydF4y2Ba老鼠gydF4y2Ba在体外gydF4y2Ba转化为这些小鼠的肠道激素分泌受损gydF4y2Ba在活的有机体内gydF4y2Ba单次结肠内注射丙酸(180 mmol l)对门静脉血浆PYY和GLP-1的反应gydF4y2Ba−1gydF4y2Ba)或生理盐水对照gydF4y2Ba−−/gydF4y2Ba与野生型同窝的小白鼠相比在野生型动物中,丙酸导致门静脉PYY和GLP-1水平分别比盐水显著增加1.3倍和1.6倍gydF4y2BaPgydF4y2Ba< 0.05) (gydF4y2Ba图4gydF4y2Ba).FFA2没有变化gydF4y2Ba−−/gydF4y2Ba组。两种基因型在结肠内给药5 min后门静脉血浆GLP-1和PYY水平无差异(gydF4y2Ba图4gydF4y2Ba).gydF4y2Ba
结肠内注射丙酸可提高门静脉血浆PYY和GLP-1水平gydF4y2Ba在活的有机体内gydF4y2Ba在老鼠身上gydF4y2Ba通过gydF4y2Ba一种FFA2-dependent机制。结肠内注射丙酸盐(180 mmol l) (300 μl) 5min后门静脉采血gydF4y2Ba−1gydF4y2Ba)或生理盐水(与pH和钠含量相匹配)在异氟醚麻醉的FFA2敲除小鼠(−/−)或WT同窝小鼠(+/+)中。数据代表意味着±s.e.m。(gydF4y2BangydF4y2Ba每组)= 5 - 7。显著性采用单因素方差分析(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaFgydF4y2Ba= 2.457,gydF4y2BaPgydF4y2Ba= 0.094;gydF4y2BabgydF4y2Ba,gydF4y2BaFgydF4y2Ba= 2.660,gydF4y2BaPgydF4y2Ba=0.076)与BonferronigydF4y2Ba事后gydF4y2Ba测试(*gydF4y2BaPgydF4y2Ba< 0.05)。gydF4y2Ba
讨论gydF4y2Ba
我们的研究表明,结肠内给药丙酸可以刺激小鼠同时释放GLP-1和PYY,并证明gydF4y2Ba在体外gydF4y2Ba,也是第一次gydF4y2Ba在活的有机体内gydF4y2BaFFA2缺乏会损害scfa诱导的肠道激素分泌。gydF4y2Ba
一段时间以来,人们一直假设短链脂肪酸起作用gydF4y2Ba通过gydF4y2Ba它们的受体FFA2和FFA3在结肠肠内分泌L细胞中富集,刺激产生厌食和肠促胰岛素的肠激素的释放。gydF4y2Ba10gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba托尔赫斯特最近的研究支持了这一假设gydF4y2Baet al。gydF4y2Ba10gydF4y2Ba证明FFA2gydF4y2Ba−−/gydF4y2Ba原代结肠培养对短链脂肪酸的GLP-1反应减弱。我们的工作证实了这一效应,也证明了scfa刺激的PYY释放在同一模型中衰减。gydF4y2Ba
即使在1 mmol l的低浓度下gydF4y2Ba−1gydF4y2Ba,丙酸能显著诱导小鼠原代L细胞释放GLP-1和PYY。这些结果与以往GLP-1的研究结果一致。gydF4y2Ba8gydF4y2Ba,gydF4y2Ba10gydF4y2Ba与肠腔中报道的高生理浓度的短链脂肪酸相反,1 mmol lgydF4y2Ba−1gydF4y2Ba更符合欧共体gydF4y2Ba50gydF4y2BaFFA2对SCFAs的作用。gydF4y2Ba11gydF4y2Ba,gydF4y2Ba23gydF4y2Ba为了解释这种差异,人们提出了几种假设。首先,L细胞有可能gydF4y2Ba在活的有机体内gydF4y2Ba暴露于较低浓度的短链脂肪酸,这是由于周围的结肠细胞吸收短链脂肪酸和/或由于粘膜层的存在。gydF4y2Ba10gydF4y2Ba因此,腔内浓度可能不能反映L细胞表面水平的浓度。其次,Nø人力资源gydF4y2Baet al。gydF4y2Ba8gydF4y2Ba提示结肠肠内分泌细胞可能在基底外侧表面发现了相当低浓度的短链脂肪酸。gydF4y2Ba8gydF4y2Ba另外,TolhurstgydF4y2Baet al。gydF4y2Ba10gydF4y2Ba还推测结肠短链脂肪酸可能在L细胞的慢性刺激张力中发挥作用gydF4y2Ba通过gydF4y2Ba顶部或基底外侧SCFA受体,这可能解释了在禁食状态下循环肠道激素的存在。在我们的研究中,我们无法检测到空腹GLP-1水平的差异(盐水注射后),但这可能是由于空腹时间的差异(4小时vs一夜)。较长的禁食期有望降低结肠SCFA水平,从而降低受体的刺激张力。gydF4y2Ba
证明这一发现至关重要gydF4y2Ba在体外gydF4y2Ba也可以翻译成gydF4y2Ba在活的有机体内gydF4y2Ba设置。在这种情况下,证明管腔丙酸能够刺激肠道激素释放是很重要的。此外,根据在一定条件下观察到的GLP-1和PYY在大鼠对SCFAs反应中的差异释放,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba同时测量两种肠道激素是必要的。结肠内注射丙酸可显著提高大鼠和小鼠血浆中两种肠道激素水平。gydF4y2Ba
我们建立了一个模型,在麻醉大鼠结肠内注射丙酸后,能够同时测量门脉和外周循环中肠道激素水平。观察到循环血浆在30和60分钟时PYY水平分别升高18.6和20.9 pmol/l,这与之前给予SCFAs混合物的研究一致。gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba与之前的研究不同的是,这些研究未能显示短链脂肪酸对GLP-1的影响,gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba这里提供的数据表明,结肠内给药丙酸后,PYY和GLP-1平行升高。然而,GLP-1的反应本质上是短暂的;GLP-1在30分钟达到峰值,但水平没有保持,并在60分钟降低。gydF4y2Ba
本研究记录的门静脉GLP-1浓度(8.7±1.9 pmol lgydF4y2Ba−1gydF4y2Ba)与文献报道的相似(7.8±0.7 pmol lgydF4y2Ba−1gydF4y2Ba(ref。gydF4y2Ba16gydF4y2Ba)和9.0±0.7 pmol lgydF4y2Ba−1gydF4y2Ba(ref。gydF4y2Ba28gydF4y2Ba))。与生理盐水相比,使用丙酸15分钟后门静脉血浆中PYY和GLP-1水平均升高(分别为1.4倍和1.6倍),但这些差异无统计学意义。然而,有可能选择的时间点太迟,以致于检测门脉肠激素水平的峰值;在小鼠实验中,门脉肠激素水平在5分钟时显著升高。gydF4y2Ba
在本论文中,我们选择了以超临界脂肪酸丙酸酯为研究对象。从FFA2提取的原代结肠培养物中,丙酸诱导的PYY和GLP-1释放显著降低gydF4y2Ba−−/gydF4y2Ba与WT培养的小鼠相比。然而,FFA2gydF4y2Ba−−/gydF4y2Ba结肠培养对细胞内cAMP浓度升高保持了强劲的肠道激素反应(gydF4y2Ba补充图1gydF4y2Ba),这表明肠道激素释放所需的细胞内机制是完整的。gydF4y2Ba
尽管事实上大多数gydF4y2Ba在体外gydF4y2Ba这项工作已经在原代小鼠L细胞和小鼠来源的细胞系中进行,结肠给药短链脂肪酸对小鼠血浆肠道激素水平的影响以前没有研究过。上文所述的大鼠门静脉采样程序被用于小鼠,以便在结肠内给药丙酸后测量门静脉血浆肠道激素水平。基础GLP-1值(13.1±8.5 pmol l)gydF4y2Ba−1gydF4y2Ba)与文献报道的相似(~16 pmol lgydF4y2Ba−1gydF4y2Ba,裁判。gydF4y2Ba17gydF4y2Ba).值得注意的是,小鼠门脉基础和刺激后的肠激素水平均高于大鼠(基础PYY为~2倍,GLP-1为~1.7倍)。然而,我们的结果表明,结肠丙酸盐增加小鼠和大鼠门静脉中PYY和GLP-1水平的幅度相似。gydF4y2Ba
有趣的是,在啮齿类动物中,RYGB后SCFA丙酸(FFA2的一种有效内源性激动剂)的水平升高。gydF4y2Ba12gydF4y2Ba,gydF4y2Ba29gydF4y2Ba此外,在接受人类双胞胎捐赠者粪便移植的无菌小鼠中,肥胖与盲肠丁酸和丙酸浓度之间也有显著的负相关。gydF4y2Ba30.gydF4y2Ba而发表的两项研究则研究了FFA2的能量内稳态gydF4y2Ba−−/gydF4y2Ba迄今为止,小鼠得出了不同的结论,两者都报告了与WT相比,高脂肪饮食的暴饮暴食。gydF4y2Ba7gydF4y2Ba,gydF4y2Ba31gydF4y2Ba在这两种情况下,高脂肪饮食也含有纤维;6.5%gydF4y2Ba7gydF4y2Ba和3.9%。gydF4y2Ba31gydF4y2Ba我们的研究结果表明,产生厌食症的肠道激素水平降低可能至少部分解释了这一观察结果。gydF4y2Ba
在我们的研究中,我们使用丙酸SCFA来研究FFA2激活在PYY和GLP-1释放中的作用。已知有多种营养物质能刺激L细胞分泌肠道激素。然而,这些营养物质并不能大量到达结肠L细胞。因此,短链脂肪酸可能是结肠L细胞刺激的重要来源。然而,当动物的饲料中含有高可发酵纤维时,短链脂肪酸也可能发挥更重要的作用。可发酵纤维和短链脂肪酸也被证明可以增加L细胞数量。gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba
我们已经证明,丙酸SCFA能够刺激原代小鼠结肠培养中GLP-1和PYY的释放gydF4y2Ba在活的有机体内gydF4y2Ba在啮齿类动物结肠内给药。本研究首次证明了丙酸刺激初级FFA2中PYY的释放gydF4y2Ba−−/gydF4y2Ba结肠培养也显著减弱,与野生型动物不同的是,FFA2gydF4y2Ba−−/gydF4y2Ba小鼠对丙酸没有反应。通过模拟营养置换过程中观察到的肠道激素水平升高,靶向营养传感通路(如短链脂肪酸激活的通路)可能具有转译潜力,从而有益地调节食欲。gydF4y2Ba
参考文献gydF4y2Ba
墨菲KG,布鲁姆SR。肠道激素与能量稳态的调节。gydF4y2Ba自然gydF4y2Ba2006;gydF4y2Ba444gydF4y2Ba: 854 - 859。gydF4y2Ba
le Roux CW, Aylwin SJ, Batterham RL, Borg CM, Coyle F, Prasad VgydF4y2Ba等gydF4y2Ba.减肥手术后的肠道激素水平有利于厌食状态,促进减肥,改善代谢参数。gydF4y2Ba安杂志gydF4y2Ba2006;gydF4y2Ba243gydF4y2Ba: 108 - 114。gydF4y2Ba
le Roux CW, Welbourn R, Werling M, Osborne A, Kokkinos A, Laurenius AgydF4y2Ba等gydF4y2Ba.Roux-en-Y胃旁路术后肠道激素对食欲和体重减轻的影响。gydF4y2Ba安杂志gydF4y2Ba2007;gydF4y2Ba246gydF4y2Ba: 780 - 785。gydF4y2Ba
Diakogiannaki E, Gribble FM, reiman F。肠促胰岛素激素分泌细胞检测营养素。gydF4y2Ba杂志BehavgydF4y2Ba2012;gydF4y2Ba106gydF4y2Ba: 387 - 393。gydF4y2Ba
艾塞勒·R、郭克·R、威勒默·S、哈瑟斯·惠普、维米尔·H、阿诺德·RgydF4y2Ba等gydF4y2Ba.胰高血糖素样肽-1细胞在大鼠、猪和人的胃肠道和胰腺。gydF4y2BaEur J Clin投资公司gydF4y2Ba1992;gydF4y2Ba22gydF4y2Ba: 283 - 291。gydF4y2Ba
Mortensen PB, Clausen MR。人结肠中的短链脂肪酸:与胃肠道健康和疾病的关系gydF4y2Ba胃肠素gydF4y2Ba1996;gydF4y2Ba216gydF4y2Ba: 132 - 148。gydF4y2Ba
木村I,小泽K,井上D,今村T,木村K,前田TgydF4y2Ba等gydF4y2Ba.肠道菌群抑制胰岛素介导的脂肪堆积gydF4y2Ba通过gydF4y2Ba短链脂肪酸受体GPR43。gydF4y2BaNat CommungydF4y2Ba2013;gydF4y2Ba4gydF4y2Ba: 1829。gydF4y2Ba
noø hr MK, Pedersen MH, Gille A, Egerod KL, Engelstoft MS, Husted ASgydF4y2Ba等gydF4y2Ba.GPR41/FFAR3和GPR43/FFAR2作为肠内分泌细胞短链脂肪酸的共传感器,而FFAR3在肠神经元和FFAR2在肠白细胞中。gydF4y2Ba内分泌学gydF4y2Ba2013;gydF4y2Ba154gydF4y2Ba: 3552 - 3564。gydF4y2Ba
史密斯总理,豪威特先生,潘尼科夫N,米肖M,加里尼CA, Bohlooly YMgydF4y2Ba等gydF4y2Ba.微生物代谢产物短链脂肪酸调节结肠Treg细胞的稳态。gydF4y2Ba科学gydF4y2Ba2013;gydF4y2Ba341gydF4y2Ba: 569 - 573。gydF4y2Ba
Tolhurst G, Heffron H, Lam YS, Parker HE, Habib AM, Diakogiannaki EgydF4y2Ba等gydF4y2Ba.短链脂肪酸刺激胰高血糖素样肽-1的分泌gydF4y2Ba通过gydF4y2Bag蛋白偶联受体FFAR2。gydF4y2Ba糖尿病gydF4y2Ba2012;gydF4y2Ba61gydF4y2Ba: 364 - 371。gydF4y2Ba
Le Poul E, Loison C, Struyf S, Springael JY, Lannoy V, Decobecq MEgydF4y2Ba等gydF4y2Ba.人短链脂肪酸受体的功能特征及其在多形核细胞活化中的作用。gydF4y2BaJ临床生物化学gydF4y2Ba2003;gydF4y2Ba278gydF4y2Ba: 25481 - 25489。gydF4y2Ba
刘安平,帕兹尤克M,吕瓦诺JM Jr., Machineni S, Turnbaugh PJ, Kaplan LM。由于胃旁路手术,肠道菌群的保守变化减少了宿主体重和肥胖。gydF4y2BaSci Transl地中海gydF4y2Ba2013;gydF4y2Ba5gydF4y2Ba: 178 ra41。gydF4y2Ba
Morrison DJ, Mackay WG, Edwards CA, Preston T, Dodson B, Weaver LT。人类粪便菌群低聚果糖发酵产生丁酸:细胞外乙酸和乳酸的贡献是什么?gydF4y2BaBr J减轻gydF4y2Ba2006;gydF4y2Ba96gydF4y2Ba: 570 - 577。gydF4y2Ba
Reimann F, Habib AM, Tolhurst G, Parker HE, Rogers GJ, Gribble FM。L细胞的葡萄糖感应:原代细胞研究。gydF4y2Ba细胞金属底座gydF4y2Ba2008;gydF4y2Ba8gydF4y2Ba: 532 - 539。gydF4y2Ba
马斯洛斯基,维埃拉,吴a,克兰尼奇,F西罗,于德gydF4y2Ba等gydF4y2Ba.肠道菌群和趋化剂受体GPR43对炎症反应的调节作用。gydF4y2Ba自然gydF4y2Ba2009;gydF4y2Ba461gydF4y2Ba: 1282 - 1286。gydF4y2Ba
卡尼警局,杜威C,德尔泽内警局。菊粉型果聚糖调节大鼠参与食欲调节的胃肠肽(胰高血糖素样肽-1和胃饥饿素)。gydF4y2BaBr J减轻gydF4y2Ba2004;gydF4y2Ba92gydF4y2Ba: 521 - 526。gydF4y2Ba
Delmée E, Cani PD, Gual G, Knauf C, Burcelin R, Maton NgydF4y2Ba等gydF4y2Ba.高脂饲料喂养小鼠结肠胰高血糖素原表达与低聚果糖代谢反应的关系。gydF4y2Ba生命科学gydF4y2Ba2006;gydF4y2Ba79gydF4y2Ba: 1007 - 1013。gydF4y2Ba
Adrian TE, Ferri GL, Bacarese-Hamilton AJ, Fuessl HS, Polak JM, Bloom SR。一种新的肠道激素肽YY在人体内的分布和释放。gydF4y2Ba胃肠病学gydF4y2Ba1985;gydF4y2Ba89gydF4y2Ba: 1070 - 1077。gydF4y2Ba
Kreymann B, Williams G, Ghatei MA, Bloom SR。胰高血糖素样肽-1 7-36:人体内的一种生理性肠促素。gydF4y2Ba《柳叶刀》gydF4y2Ba1987;gydF4y2Ba2gydF4y2Ba: 1300 - 1304。gydF4y2Ba
den Besten G, van Eunen K, Groen AK, Venema K, Reijngoud DJ, Bakker BM。短链脂肪酸在饲粮、肠道菌群与宿主能量代谢相互作用中的作用。gydF4y2BaJ脂质物gydF4y2Ba2013;gydF4y2Ba54gydF4y2Ba: 2325 - 2340。gydF4y2Ba
Karaki S, Mitsui R, Hayashi H, Kato I, Sugiya H, Iwanaga TgydF4y2Ba等gydF4y2Ba.短链脂肪酸受体GPR43在大鼠肠道内由肠内分泌细胞和黏膜肥大细胞表达。gydF4y2Ba细胞组织ResgydF4y2Ba2006;gydF4y2Ba324gydF4y2Ba: 353 - 360。gydF4y2Ba
Karaki S, Tazoe H, Hayashi H, Kashiwabara H, toyama K, Suzuki YgydF4y2Ba等gydF4y2Ba.短链脂肪酸受体GPR43在人结肠中的表达。gydF4y2BaJ摩尔HistolgydF4y2Ba2008;gydF4y2Ba39gydF4y2Ba: 135 - 142。gydF4y2Ba
Brown AJ, Goldsworthy SM, Barnes AA, Eilert MM, chang L, Daniels DgydF4y2Ba等gydF4y2Ba.孤株G蛋白偶联受体GPR41和GPR43由丙酸和其他短链羧酸激活。gydF4y2BaJ临床生物化学gydF4y2Ba2003;gydF4y2Ba278gydF4y2Ba: 11312 - 11319。gydF4y2Ba
徐福成,刘志强,刘志强,刘志强。大鼠餐后释放肽YY和胰高血糖素原衍生肽的比较。gydF4y2Ba弗鲁格拱gydF4y2Ba1999;gydF4y2Ba438gydF4y2Ba: 299 - 306。gydF4y2Ba
Plaisancié P, Dumoulin V, Chayvialle JA, Cuber JC。离体血管灌注大鼠结肠内胰高血糖素样肽-1(7-36)酰胺释放因子。gydF4y2BaJ性gydF4y2Ba1995;gydF4y2Ba145gydF4y2Ba: 521 - 526。gydF4y2Ba
Cherbut C, Ferrier L, Roze C, Anini Y, Blottiere H, Lecannu GgydF4y2Ba等gydF4y2Ba.短链脂肪酸通过神经和多肽YY释放改变大鼠结肠运动。gydF4y2Ba是杂志gydF4y2Ba1998;gydF4y2Ba275gydF4y2Ba: G1415-G1422。gydF4y2Ba
X付成,Y Anini,战车J, Voisin T, Galmiche JP, Rozé C。大鼠十二指肠内、肠内和结肠内给药后肽YY的释放。gydF4y2Ba弗鲁格拱gydF4y2Ba1995;gydF4y2Ba431gydF4y2Ba: 66 - 75。gydF4y2Ba
Cani PD, Montoya ML, Neyrinck AM, Delzenne NM, Lambert DM。由厌食大麻素化合物SR141716A(利莫那班)和油乙醇酰胺对血浆饥饿素和胰高血糖素样肽-1的潜在调节。gydF4y2BaBr J减轻gydF4y2Ba2004;gydF4y2Ba92gydF4y2Ba: 757 - 761。gydF4y2Ba
Saeidi N, Meoli L, Nestoridi E, Gupta NK, Kvas S, Kucharczyk JgydF4y2Ba等gydF4y2Ba.胃旁路术后大鼠肠道糖代谢重编程与血糖控制。gydF4y2Ba科学gydF4y2Ba2013;gydF4y2Ba341gydF4y2Ba: 406 - 410。gydF4y2Ba
Ridaura VK, Faith JJ, Rey FE, Cheng J, Duncan AE, Kau ALgydF4y2Ba等gydF4y2Ba.双胞胎肠道菌群不一致调节小鼠肥胖代谢。gydF4y2Ba科学gydF4y2Ba2013;gydF4y2Ba341gydF4y2Ba: 1241214。gydF4y2Ba
M, Admyre T, Goransson M, Marley AE, Smith DM, oscar JgydF4y2Ba等gydF4y2Ba.在喂食高脂肪食物的游离脂肪酸受体2缺乏小鼠中,改善葡萄糖控制和减少体脂质量。gydF4y2BaAm J Physiol Endocrinol MetabgydF4y2Ba2011;gydF4y2Ba300gydF4y2Ba: E211-E220。gydF4y2Ba
Cani PD, hosts, Guiot Y, Delzenne NM。膳食非消化碳水化合物促进大鼠近端结肠l细胞分化。gydF4y2BaBr J减轻gydF4y2Ba2007;gydF4y2Ba98gydF4y2Ba: 32-37。gydF4y2Ba
Petersen N, Reimann F, Bartfeld S, Farin HF, Ringnalda FC, Vries RGgydF4y2Ba等gydF4y2Ba.小鼠和人小肠类器官L细胞的生成。gydF4y2Ba糖尿病gydF4y2Ba2014;gydF4y2Ba63gydF4y2Ba: 410 - 420。gydF4y2Ba
确认gydF4y2Ba
本研究得到了MRC、BBSRC、NIHR、综合哺乳动物生物学(IMB)能力建设奖、FP7-HEALTH-2009-241592 EuroCHIP资助,并得到了NIHR帝国生物医学研究中心资助计划的支持。这项工作也得到了BBSRC DRINC BB/H014039/1的资助。AP是由英国科学与发展委员会的学生资助的。我们非常感谢Mackay教授(莫纳什大学)与FFA敲除小鼠的合作。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明不存在利益冲突。gydF4y2Ba
额外的信息gydF4y2Ba
补充信息gydF4y2Ba与这篇论文一起发表在《国际肥胖杂志》网站上gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
本作品采用知识共享署名4.0国际许可协议。本文中的图像或其他第三方材料均包含在本文的知识共享许可中,除非在授信额度中另有说明;如果材料不包括在创作共用许可下,用户将需要获得许可持有人的许可来复制材料。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
Psichas, A, Sleeth, M, Murphy, K。gydF4y2Baet al。gydF4y2Ba短链脂肪酸丙酸刺激GLP-1和PYY的分泌gydF4y2Ba通过gydF4y2Ba啮齿动物游离脂肪酸受体2。gydF4y2BaInt J obgydF4y2Ba39gydF4y2Ba, 424 - 429(2015)。https://doi.org/10.1038/ijo.2014.153gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
修改后的gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
发行日期gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/ijo.2014.153gydF4y2Ba
进一步的阅读gydF4y2Ba
低吸收减肥手术中一致的肠道细菌和短链脂肪酸特征与大鼠的代谢益处相关gydF4y2Ba
国际肥胖杂志gydF4y2Ba(2022)gydF4y2Ba
肠脑轴在能量和葡萄糖代谢中的作用gydF4y2Ba
实验与分子医学gydF4y2Ba(2022)gydF4y2Ba
健康和疾病中的微生物群gydF4y2Ba
信号传导与靶向治疗gydF4y2Ba(2022)gydF4y2Ba
代谢性疾病中的宿主-微生物相互作用:从饮食到免疫gydF4y2Ba
微生物学杂志gydF4y2Ba(2022)gydF4y2Ba
短链脂肪酸:可能调节胰岛素分泌gydF4y2Ba
分子与细胞生物化学gydF4y2Ba(2022)gydF4y2Ba