文摘
在结直肠癌描述体改变,我们公司进行了276个样本的分析,分析外显子组序列,DNA拷贝数,启动子甲基化和信使RNA, microRNA的表达。这些样本的一个子集(97)接受了low-depth-of-coverage全基因组测序。总共16%的大肠癌癌是hypermutated:四分之三的这些预期的高微卫星不稳定,通常与甲基化一种沉默,四分之一体细胞错配修复基因和聚合酶ε(极)突变。不包括hypermutated癌症,结肠和直肠癌症被发现也相当类似的基因改造的模式。24基因显著变异,除了预期APC,TP53,SMAD4,PIK3CA和喀斯特突变,我们发现频繁的突变ARID1A,SOX9和FAM123B。复发性人类基因组的改变包括潜在drug-targetable放大ERBB2和新发现的放大IGF2。复发性染色体易位的融合NAV2和WNT通路成员TCF7L1。综合分析表明,新的标记和激进的结直肠癌患者的一个重要的角色MYC直接转录激活和镇压。
主要
癌症基因组图谱项目计划分析基因组变化的20种不同的癌症类型和两个癌症迄今发表的结果1,2。我们现在的结果从多维分析人类结直肠癌(CRC)。
CRC是一个重要的贡献者癌症死亡率和发病率。结肠和直肠之间的区别主要是解剖,但外科和放射疗法的管理影响和可能影响预后。大部分调查者CRC生物划分为那些微卫星不稳定性(MSI);主要位于右结肠和经常与CpG岛methylator表型(CIMP)和多峰值)和微卫星稳定但染色体不稳定。
丰富的历史调查(审查看到裁判。3)发现了几个关键基因和通路的发生和发展重要的CRC (ref。3)。其中包括WNT, RAS−MAPK, PI3K, TGF-β、P53和DNA错配修复途径。大规模测序分析4,5,6已经确定了无数地突变基因和复发性染色体易位。尽管这一背景下,我们没有一个完整的集成视图的结直肠肿瘤发生的基因和基因组的变化及其意义。进一步了解这些变化可能使CRC的病理生理学的深入了解和识别潜在的治疗靶点。
结果
肿瘤和正常对被不同的平台进行了分析。样品分析每个平台的具体数字所示补充表1。
Exome-sequence分析
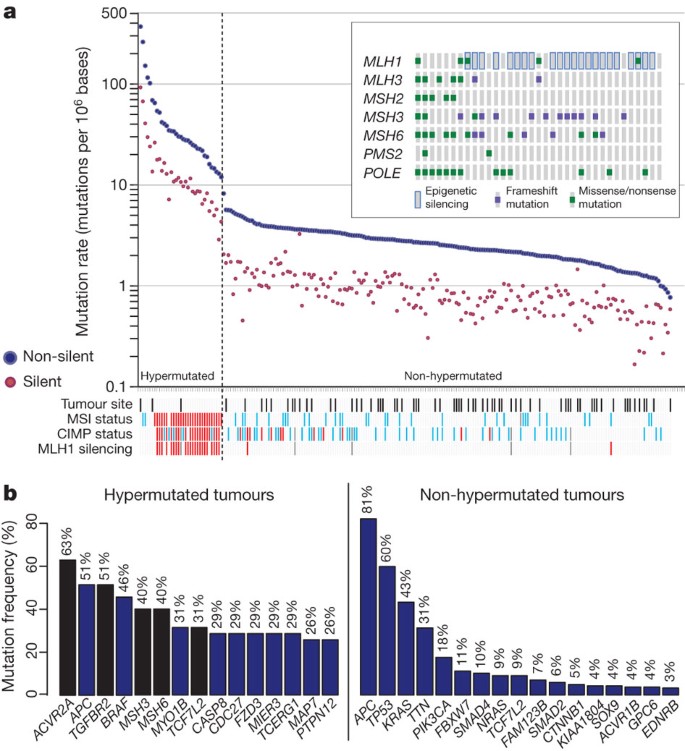
定义突变谱,我们进行外显子组捕获224肿瘤和正常对DNA测序(所有突变中列出补充表2)。测序完成> 20倍的报道至少有80%的有针对性的外显子。的体细胞变异率样本之间的差异很大。一些变异率< 1 / 106基地,而一些变异率> 100 / 106。我们分开例(84%)的突变率< 8.24每106(中位数non-silent突变的数量,58)和那些变异率> 12每106(中位数的变异数,728),我们指定为hypermutated (图1)。
一个、突变频率在每224名患者的肿瘤样本。注意明确hypermutated和non-hypermutated样品的分离。红色,MSI高,CIMP高或一种沉默;浅蓝色、MSI低或CIMP低;黑色,直肠;白色,结肠;灰色,没有数据。插图,错配修复基因和突变极在hypermutated样本。样品的顺序是一样的在主图。b,显著突变基因hypermutated non-hypermutated肿瘤。蓝色酒吧代表MutSig基因识别的算法和黑条代表基因序列数据的手工检查。
评估的基础相当不同的变异率,我们评估MSI7和突变的DNA错配修复途径8,9,10基因一种,MLH3,MSH2,MSH3,MSH6和PMS2。在30 hypermutated肿瘤与一个完整的数据集,23(77%)高水平的MSI (MSI-H)。包括在这组19肿瘤一种甲基化,其中17 CIMP。相比之下,其余七hypermutated肿瘤,包括六个变异率最高的,缺乏MSI-H, CIMP或一种甲基化,但通常在一个或多个体细胞突变或错配修复基因POLΕ畸变看到很少non-hypermutated肿瘤(图1)。
基因突变
总而言之,我们确定了32个循环体细胞突变基因(由MutSig定义11和人工管理)hypermutated和non-hypermutated癌症(图1 b)。后删除non-expressed基因,有15和17 hypermutated和non-hypermutated癌症,分别为(图1 b;对于一个完整的列表补充表3)。non-hypermutated肿瘤中,八个最常见的突变基因APC,TP53,喀斯特,PIK3CA,FBXW7,SMAD4,TCF7L2和国家管制当局方面。正如所料,突变喀斯特和国家管制当局方面通常有致癌基因密码子12和13或61密码子突变,而其余的基因灭活突变。CTNNB1,SMAD2,FAM123B(也称为WTX),SOX9也经常突变。FAM123B是一个x - WNT信号调节器吗12,几乎所有的突变损失函数。突变SOX9细胞分化的基因重要肠道干细胞利基13,14与人类癌症之前没有关联,但所有9个突变等位基因在non-hypermutated crc转移或无意义突变。肿瘤抑制基因自动取款机和ARID1A也有一个不成比例的大量的转移或无意义突变。ARID1A突变最近报告了CRC和许多其他癌症15,16。
hypermutated肿瘤,ACVR2A,APC,TGFBR2,MSH3,MSH6,SLC9A9和TCF7L2频繁的目标突变(图1 b),以及主要BRAF V600E ()突变。然而,经常被两个基因突变在non-hypermutated癌症更经常在hypermutated肿瘤突变:TP53(60 20%,P< 0.0001)和APC(分别为81%和51%,P= 0.0023;确切概率法)。其他基因,包括TGFBR2在hypermutated癌症突变地,但不是non-hypermutated样本。这些发现表明,hypermutated non-hypermutated肿瘤进展通过不同的基因序列事件。
正如所料,hypermutated肿瘤一种沉默和MSI-H显示额外的突变概要文件的差异。当我们专门研究了28基因单核苷酸重复的编码序列,我们发现移码突变的速率高出3.6倍的速度突变hypermutated肿瘤没有一种沉默和50倍高于non-hypermethylated肿瘤(补充表2)。
突变率和甲基化模式
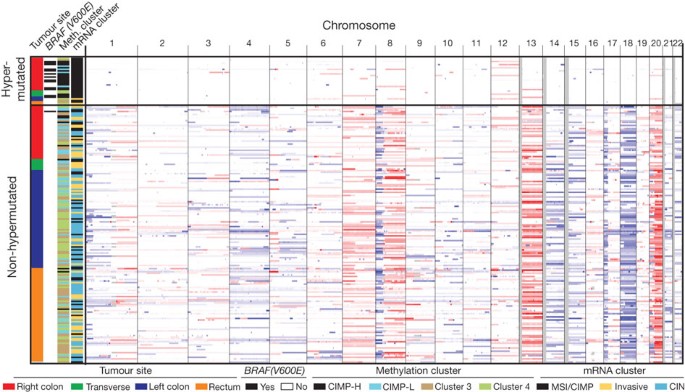
如前所述,结肠和直肠肿瘤患者管理不同17,流行病学也强调了两者间的差异17。最初的MSI状态,综合分析体细胞人类基因组改变(大会),CIMP地位和基因62 132结肠和直肠肿瘤使我们检查可能的肿瘤在两个地点之间生理上的差异。non-hypermutated肿瘤中,然而,整个模式拷贝数的变化,CIMP,信使rna和microrna的结肠和直肠之间是没有区别的癌(图2)。在这个结果的基础上,我们为所有后续分析合并这两个。
Hypermutated肿瘤near-diploid基因组和高纯度的甲基化,CIMP表型和表达BRAF V600E ()突变。Non-hypermutated肿瘤源自不同的网站几乎是相互区别的基础上,他们的人类基因组改造模式,DNA甲基化或基因表达模式。人类基因组变化的22个常染色体的深浅的红色所示人类收益和蓝色系的颜色对人类的损失。
无监督聚类236年启动子DNA甲基化概要文件的结直肠肿瘤识别四个亚组(补充图1和补充的方法)。的两个集群包含的甲基化率升高的肿瘤,被列为高CIMP低CIMP,如前所述18。这两个non-CIMP集群主要是来自肿瘤non-hypermutated和来自不同解剖位置。信使rna表达谱把结直肠肿瘤分成三个不同的集群(补充图2)。一个明显重叠CIMP-high肿瘤(P= 3×10−12)和富含hypermutated肿瘤,另外两个集群没有与任何组织甲基化数据。无监督聚类分析microrna的表达(补充图3)确定没有明确区分直肠癌和non-hypermethylated结肠癌。
染色体和sub-chromosomal变化
总共257名肿瘤被描述为大会做了Affymetrix SNP 6.0数组。这些肿瘤,97也分析了low-depth-of-coverage(低通)全基因组测序。正如所料,hypermutated肿瘤大会要少得多(图2)。没有发现差异microsatellite-stable和不稳定之间hypermutated肿瘤(补充图4)。我们使用了GISTIC算法19识别可能的基因焦点改变的目标。有几个以前定义的arm-level变化,包括收益1 q, 7 p和q, 8 p和q, 12问,13问,19问,和20 p和q (ref。6)。(补充图4和补充表4)。明显删除18 p和q(包括染色体武器SMAD4)在66%的肿瘤和17 p和q(包括TP53)的56%。其他明显删除染色体臂1 p, 4 q, 5 q, 8 p, q, 14 15 q, 20 p和22。
我们发现了28个反复删除峰(补充图4和补充表4),包括基因FHIT基因、RBFOX1和WWOX大基因组足迹位于潜在脆弱的网站的基因组,在near-diploid hypermutated肿瘤。等焦删除涉及肿瘤抑制基因SMAD4,APC,PTEN和SMAD3。一个重要焦点删除10 p25.2横跨四个基因,包括TCF7L2,也是经常突变基因融合在我们的数据集。相邻的基因VTI1A和TCF7L2通过一个间隙删除被发现在3%的CRC和生存需要的CRC细胞轴承易位4。
有17个地区重要的焦点放大(补充表4)。其中一些是染色体臂的叠加在广泛的收益,并包括一个峰值附近的13 q12.13 peptidase-coding基因USP12而在∼500 kb远CRC候选癌基因CDK8;在13 q12相邻峰;包含峰值KLF513岁q22.1;并在20 q13.12相邻峰值HNF4A。山峰8包括8号染色体上p12(包含组蛋白methyl-transferase-coding基因WHSC1L1,毗邻FGFR1)和8抓起(其中包含MYC)。17 q21.1的扩增子中发现肿瘤的4%,包含7个基因,包括酪氨酸激酶ERBB2。ERBB2放大被描述在结肠癌、乳腺癌和gastro-oesophageal肿瘤,乳腺和胃癌症轴承这些放大与anti-ERBB2抗体曲妥珠单抗治疗有效20.,21,22。
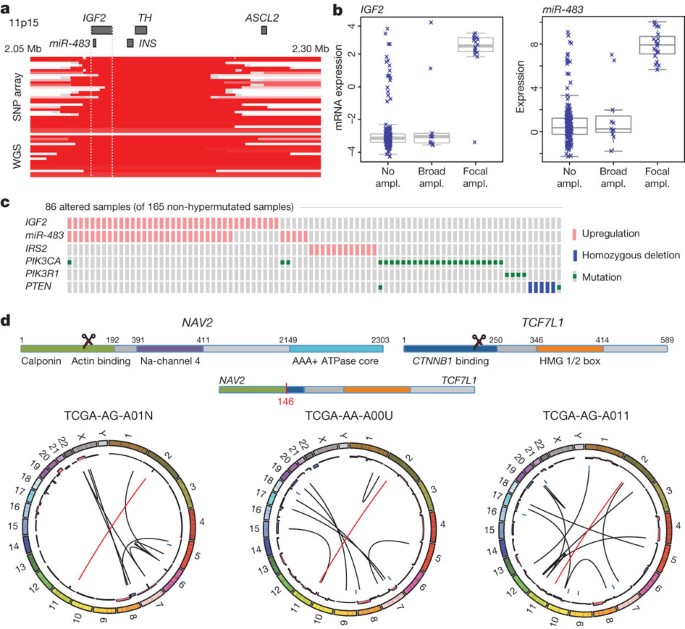
最常见的一种局部放大,发现在肿瘤的7%,是100 - 150 kb的获得11 p15.5染色体臂的区域。它包含胰岛素基因编码(INS)、胰岛素样生长因子2 (IGF2)和酪氨酸羟化酶(TH),以及mir - 483,这是嵌入IGF2(图3)。我们发现的表达升高IGF2和mir - 483但不是的INS和TH(图3 b, c)。立即毗邻放大区域ASCL2,一个转录因子活跃在指定肠道干细胞的命运23。虽然ASCL2被牵连的目标在CRC放大吗23,24,25,外面一直放大及其表达式的地区并不是与人类基因组的变化。这些观察表明,IGF2和mir - 483候选人11 p15.5放大的功能目标。IGF2超表达通过印迹的损失与CRC的推广26,27。mir - 483也可能有一个在CRC发病机制中的作用28。
一个11 p15.5焦点放大。分段DNA人类基因组单核苷酸多态性(SNP)的数据数组和低通全基因组测序(WGS)所示。每一行代表一个病人;放大所示红色区域。b与人类基因组的变化,表达水平的相关性IGF2和mir - 483。c,IGF2放大和PI3K signalling-related改变基因的超表达是互斥的。d,反复NAV2- - - - - -TCF7L2融合。这两个基因的结构,断点的位置导致的易位和圆形表示重组与融合显示肿瘤。红线代表NAV2- - - - - -TCF7L2融合和黑色线条代表其他重组。内圈代表了人类基因组的变化(蓝色表示损失,粉色代表获得)。
肿瘤的一个子集IGF2放大(15%)也有相当高的水平IGF2基因表达增加(高达100倍),不是由于甲基化变化产生影响IGF2启动子。评估的背景下IGF2放大/超表达,我们系统地寻找互斥使用备忘录基因组事件的方法29日。我们发现附近的一个模式的排他性(纠正P< 0.01)IGF2超表达与基因事件被激活的PI3K通路(突变PIK3CA和PIK3R1或删除/突变PTEN;图3 c和补充表5)。的IRS2连接IGF1R基因编码一种蛋白质(IGF2)的受体PI3K, 13号染色体上,在CRC频繁了。最高的情况下IRS2表达式是互斥的情况下IGF2超表达(P= 0.04),也缺乏PI3K通路中的基因突变(P= 0.0001;图3 c)。这些结果强烈表明IGF2-IGF1R-IRS2轴信号PI3K CRC和暗示治疗目标的途径可以阻止PI3K的活动在这个子集的病人。
易位
识别新的染色体易位,我们进行低通,paired-end,全基因组测序97肿瘤与正常样本。在每种情况下,我们实现了序列的报道∼3-4-fold和相应的物理覆盖7.5的10倍。尽管基因组覆盖率较低,我们发现250个候选染色体间易位(每个肿瘤范围、清廉)事件。在这些事件中,212年有一个或两个基因间区域断点,而其余的38个并列的两个基因编码区域的融合事件,其中18例将代码在坐标系事件(补充表6)。我们发现三个独立的情况下,前两个外显子的NAV2基因在染色体11日与3′编码部分TCF7L1染色体上2 (补充图5)。TCF7L1成员编码TCF3 TCF / LEF类的二聚化的转录因子核β-catenin启用β-catenin-mediated转录监管。有趣的是,在所有三个案例中,预测结构的NAV2-TCF7L1融合蛋白缺乏TCF3β-catenin-binding域。这种易位类似于另一个经常性的易位中确定CRC,融合的氨基酸VTI1A TCF4加入,编码的TCF7L2的同系物TCF7L1中删除或突变non-hypermutated肿瘤的12%4。我们还观察到21例易位涉及TTC28位于染色体22 (补充表6)。在所有情况下的融合预测失活TTC28,已被确定为一个目标P53和肿瘤细胞生长抑制剂30.。十一19(58%)的基因基因易位被获得PCR验证产品,或者在某些情况下,测序的结片段(补充图5)。
改变通路CRC
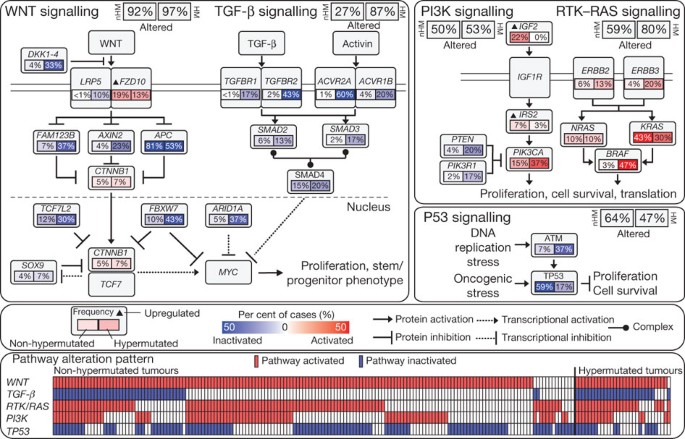
综合分析突变,拷贝数和mRNA表达变化195年肿瘤完整数据丰富我们理解如何解除一些定义良好的途径。我们分组样本hypermutation WNT地位和识别周期性变化,MAPK, PI3K TGF-β和p53通路(图4,补充图6和补充表1)。
Non-hypermutated (nHM;n= 165)和hypermutated (HM;n= 30)和样品完整的数据分别进行分析。改变是由体细胞突变,纯合子缺失,高层焦点放大,而且,在某些情况下,通过重大的差别,或者对这些基因表达(IGF2,FZD10,SMAD4)。改变频率表示为一个百分比的情况。红色表示激活基因和蓝色表示灭活基因。底部面板显示为每个样本如果至少一个基因在每个五通路中所描述的这个数字是改变。
我们发现WNT信号通路改变在所有肿瘤的93%,包括biallelic失活APC(补充表7)或激活的突变CTNNB1在∼80%的病例。也有突变SOX9突变和缺失TCF7L2,以及家庭成员和总价值AXIN2,FBXW7(补充图7),ARID1A和FAM123B(后者是消极WNT-β-catenin信号调节器12发现在霍奇金病突变的肿瘤31日)。一些突变FAM123B曾被描述在CRC32。SOX9一直认为癌症的作用,但是没有突变曾被描述。WNT受体卷曲的(FZD10)是在∼样本的17%,在某些情况下100×正常的水平。,我们发现16个不同的WNT通路的基因改变,证实这种途径在CRC的重要性。有趣的是,许多这些改变是肿瘤中发现港口APC突变,这表明多个病变影响WNT信号通路提供选择性的优势。
PI3K基因改变和RAS-MAPK通路在CRC很常见。除了IGF2和IRS2超表达,我们发现相互排斥的突变PIK3R1和PIK3CA以及删除PTENnon-hypermutated肿瘤在2%、15%和4%,分别。我们发现55%的non-hypermutated肿瘤已经改变喀斯特,国家管制当局方面或BRAF,一个重要的模式相互排他性(补充图6和补充表1)。我们也评估erythroblastic白血病病毒致癌基因的突变同族体(ERBB)受体家族,因为这种突变的转化关系。突变或放大的四个ERBB家族基因存在于22日165 (13%)non-hypermutated 30(53%)和16 hypermutated病例。宇宙中列出的一些突变数据库33,显示功能的作用。有趣的是,复发ERBB2 (V842I)和ERBB3 (V104M)突变被发现在四个和两个non-hypermutated情况下,分别。突变和焦的放大ERBB2(补充图6)应该评估预测目标这些受体的反应代理。我们观察到同现涉及RAS和PI3K通路的改变在三分之一的肿瘤(图4;P= 0.039,确切概率法)。这些结果表明,同时抑制RAS和PI3K通路可能需要达到治疗效果。
TGF-β信号通路是CRC和其他癌症的管制34。我们发现基因改变TGFBR1,TGFBR2,ACVR2A,ACVR1B,SMAD2,SMAD3和SMAD4hypermutated non-hypermutated的27%和87%的肿瘤。我们也评估了p53通路,寻找改变TP53在non-hypermutated病例的59%(主要是biallelic;补充表8在自动取款机)和改变,激酶磷酸化,激活P53 DNA损伤后,在7%。改变这两个基因显示趋势相互排他性(P= 0.016)(图4,补充图6和补充表1)。
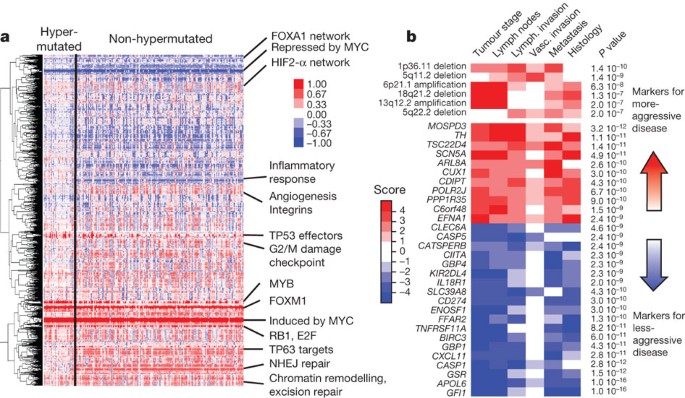
我们集成的拷贝数,基因表达,甲基化和路径数据使用模式的软件平台35。CRC的分析显示一些新特性(图5)。例如,尽管解剖多样性起源或突变水平,近100%的这些肿瘤MYC基因转录目标的变化,这两个被MYC和抑制。这些发现符合模式推导出从基因改变(图4)和建议的重要作用MYCCRC。分析还发现了几个基因网络改变所有肿瘤样本和微分改变hypermutated与non-hypermutated样本(补充表7癌症基因组图谱,补充数据发布网页)。
一个、聚类的基因和通路影响结肠和直肠肿瘤通过范例分析推导。蓝色表示under-expressed相对正常,红色表示过表达相对正常。的一些途径推导出用这种方法显示在右边。NHEJ,异源加入结束。b,基因表达与肿瘤相关签名和大会侵略。分子签名(行)显示统计学意义与肿瘤侵犯根据选定的临床化验(列)所示颜色,红色指示标记的肿瘤侵犯和蓝色表示不那么咄咄逼人的标记肿瘤。意义是基于的总和P价值加权费舍尔的方法,纠正多个测试。颜色的强度和分数是按照一个人的力量clinical-molecular协会和正比于日志10(P),P是P协会的价值。限制的深度图,基因表达特征限制相结合P的价值P< 10−9和大会P< 10−7,功能显示只有他们也显著的子集non-MSI-H样本(分别进行了完整的分析数据以及MSI-H non-MSI-H子组)。
因为在这项研究中使用的大多数肿瘤来源于前瞻性收集、生存数据不可用。然而,肿瘤可分为积极的或非侵略性的肿瘤分期的基础上,淋巴结状态、远处转移和血管侵犯的手术。我们发现了许多与肿瘤侵犯相关的分子特征,所示的一个子集图5 b。它们包括特定的焦点放大和删除和基因表达水平的改变,其中包括SCN5A(ref。36),一个监管机构结肠癌的入侵(见报告补充表10和11所示对于一个完整列表)。与肿瘤侵犯也观察到改变microrna的表达和特定的体细胞突变(APC,TP53,PIK3CA,BRAF和FBXW7;补充图8 b)。突变FBXW7(38例)和远处转移(32例)从来没有跟“(P= 0.0019)。有趣的是,大量的基因组区域有多个分子对肿瘤侵犯,表现为临床相关的基因组热点。这是该地区20 q13.12的例子,其中包括一个焦点放大和多个基因与肿瘤相关的侵略,和该地区22 q12.3,包含APOL6(ref。37)(补充图8和9)。
讨论
224年全面综合分析结直肠肿瘤和正常对提供了许多见解CRC的生物学和识别潜在的治疗靶点。识别可能的结肠和直肠肿瘤的生物学差异,我们发现,无论non-hypermutated肿瘤的解剖,相同类型的拷贝数,表达谱,DNA甲基化和microrna的变化。超过94%的变异在一个或多个成员WNT信号通路,主要在APC。然而,有一些区别肿瘤从右侧结肠癌和所有其他网站。更为常见的结肠癌、甲基化和四分之三的hypermutated样本来自同一网站,尽管并不是所有的MSI (图2)。为什么大多数的hypermutated样本来自正确的结肠和为什么有两种类型的肿瘤在这个网站是未知的。结肠从胚胎中肠和后肠的起源可能提供一个解释。作为高MSI-related癌症患者的存活率和这些癌症hypermutated要好,突变率可能是一个更好的预后指标。
Whole-exome测序和基因数据的综合分析提供了进一步洞察CRC特异表达的途径。我们发现93%的non-hypermutated和97%的hypermutated病例管制WNT信号通路。新发现包括复发性突变FAM123B,ARID1A和SOX9和高水平的WNT配体受体基因的超表达FZD10。据我们所知,SOX9没有以前经常被描述为在任何人类癌症突变。SOX9是转录抑制WNT信号,SOX9蛋白可以促进β-catenin退化38。ARID1A经常在妇科癌症突变,可以抑制MYC转录39。WNT信号激活和失活的TGF-β信号通路导致MYC的激活。我们的突变和综合分析强调MYC在CRC的至关重要的作用。我们也将我们的结果与其他大规模的分析6,发现很多相似之处,一些突变基因的差异(补充表3)。
我们综合分析显示一组不同的TCF / LEF-encoding基因的变化,表明额外角色TCF / LEF因素CRCβ-catenin除了被动的合作伙伴。
我们的数据显示一个号码CRC的治疗方法。包括wnt信号抑制剂小分子β-catenin抑制剂,显示最初的承诺40,41,42。我们发现几个蛋白质RTK-RAS和PI3K途径,包括IGF2 IGFR, ERBB2, ERBB3, MEK, AKT MTOR可以抑制的目标。
我们的分析表明,non-hypermutated腺癌的结肠和直肠不区分在基因组水平。然而,肿瘤从右边/升结肠hypermethylated和更有可能比其他的crc变异率升高。已经认识到以前,WNT信号通路的激活和失活TGF-β信号通路,导致增加MYC的活动,几乎是无处不在的CRC的事件。染色体畸变频率目标MAPK和PI3K通路,但频率较低目标受体酪氨酸激酶。总之,这里给出的数据提供一个有用的资源,为理解这种致命的疾病和识别可能有针对性的方式对待它。
方法总结
肿瘤和正常样本处理两种biospecimen核心资源,和整除的纯化核酸被运到基因组鉴定和测序中心(补充的方法)。biospecimen核心资源提供样本集在几个不同的批次。评估任何批影响我们对mRNA表达,microrna的表达和DNA甲基化数据集使用聚类分析的结合,增强了主成分分析和方差分析(补充的方法)。虽然有些差异被检测的批次,我们没有正确的计算,因为差异通常是温和的,因为他们中的一些人可能反映了生物现象(补充的方法)。
我们使用了Affymetrix SNP 6.0微阵列检测人类基因组的改变。样品受到低通的一个子集(2 - 5×)全基因组测序(Illumina公司HiSeq),在大会的检测部分和染色体易位43,44。使用安捷伦芯片和RNA-Seq基因生成。DNA甲基化数据得到使用Illumina公司英飞纳姆(HumanMethylation27)数组。DNA测序的编码区域是由外显子组捕获测序在固体或Illumina公司紧随其后HiSeq平台。描述的分析方法的细节补充的方法。
所有的主要序列文件存入dbGap和所有其他数据存入数据协调中心(DCC)公共访问(http://cancergenome.nih.gov/)。数据矩阵和支持数据可以发现http://tcga-data.nci.nih.gov/docs/publications/coadread_2012/。数据也可以探索通过印度商学院Regulome Explorer (http://explorer.cancerregulome.org/)、下一代集群热图(http://bioinformatics.mdanderson.org/main/TCGA/Supplements/NGCHM-CRC癌症基因组学)和cBio门户(http://cbioportal.org)。描述的数据可以发现https://wiki.nci.nih.gov/x/j5dXAg而在补充的方法。
加入代码
存款数据
dbGaP加入数字提供了补充表1。
引用
癌症基因组图谱的研究网络。全面的基因组特征定义了人类胶质母细胞瘤基因和核心通路。自然455年1061 - 1068 (2008)
癌症基因组图谱的研究网络。综合基因组分析卵巢癌。自然474年609 - 615 (2011)
费伦•e . r .结直肠癌的分子遗传学。为基础。启分册。6479 - 507 (2011)
鲈鱼,a . j . et al .基因组测序的结直肠腺癌标识一个轮回VTI1A- - - - - -TCF7L2融合。自然麝猫。43964 - 968 (2011)
Sjoblom, t . et al .共识编码序列的人类乳腺癌和结肠直肠癌。科学314年268 - 274 (2006)
木材、l . d . et al .人类基因组景观的乳腺癌和结肠直肠癌。科学318年1108 - 1113 (2007)
Umar, a . et al .修订后的贝塞斯达指南遗传性非息肉病性大肠癌(林奇综合症)和微卫星不稳定。本月j .国家的癌症。96年261 - 268 (2004)
Aaltonen,洛杉矶等。家族性结直肠癌的发病机制的线索260年,科学。812 - 816 (1993)
Ionov Y。,Peinado, M. A., Malkhosyan, S., Shibata, D. & Perucho, M. Ubiquitous somatic mutations in simple repeated sequences reveal a new mechanism for colonic carcinogenesis.自然363年558 - 561 (1993)
帕森斯r . et al . Hypermutability和r的错配修复缺陷+肿瘤细胞。细胞75年1227 - 1236 (1993)
杜利,a . l . et al .核因子I / B是一个在小细胞肺癌致癌基因。Dev的基因。251470 - 1475 (2011)
专业,m . b . et al .霍奇金病肿瘤抑制WNT /β-catenin mtx负调节信号。科学316年1043 - 1046 (2007)
需要Mori-Akiyama, y . et al . SOX9 paneth肠道上皮细胞的分化。胃肠病学133年539 - 546 (2007)
巴斯蒂德,p . et al . Sox9 Paneth需要调节细胞增殖和肠道上皮细胞分化。j .细胞杂志。178年635 - 648 (2007)
琼斯,s . et al,体细胞染色质重塑基因的突变ARID1A发生在几种肿瘤类型。嗡嗡声。Mutat。33100 - 103 (2012)
威尔逊,b . g . &罗伯茨,c W。瑞士/SNF核小体remodellers和癌症。Nat。启癌症11481 - 492 (2011)
明斯基,b . d .独特的直肠癌患者的注意事项。Semin。肿瘤防治杂志。38542 - 551 (2011)
Hinoue, t . et al .公司分析异常的DNA甲基化在结肠直肠癌。基因组Res。22271 - 282 (2012)
Beroukhim, r . et al .评估癌症的染色体畸变的意义:方法论和应用神经胶质瘤。Proc。《科学。美国104年20007 - 20012 (2007)
营地,j . et al .整合基因组学揭示了拷贝数改变机制负责转录放松管制在结肠直肠癌。Chromosom基因。癌症481002 - 1017 (2009)
瓦利,j . M。,Swallow, J. E., Brammar, W. J., Whittaker, J. L. & Walker, R. A. Alterations to eitherc-erbb - 2 (neu)或原癌基因原癌基因在乳腺癌癌与短期预后不佳。致癌基因1423 - 430 (1987)
横田,j . et al .放大的c-erbb - 2人类腺癌癌基因在活的有机体内。《柳叶刀》327年765 - 767 (1986)
van der传单,l . g . et al .转录因子achaete scute-like 2控制肠道干细胞的命运。细胞136年903 - 912 (2009)
Jubb, a . M。,Hoeflich, K. P., Haverty, P. M., Wang, J. & Koeppen, H. Ascl2 and 11p15.5 amplification in colorectal cancer.肠道601606 - 1607 (2011)
斯坦格,d . e . et al .表达的ASCL2相关的干细胞签名和IGF2在结直肠癌肝转移有11个p15.5收益。肠道591236 - 1244 (2010)
崔,h . et al .损失IGF2印记:一个潜在的标志结肠直肠癌的风险。科学299年1753 - 1755 (2003)
中川,h . et al .丧失印记biallelic的胰岛素样生长因子ⅱ基因发生甲基化的核心区域段H19在结直肠癌相关CTCF-binding网站。Proc。《科学。美国98年591 - 596 (2001)
委罗内塞,a . et al .致癌作用mir - 483 - 3 - p在IGF2/483轨迹。癌症Res。70年3140 - 3149 (2010)
Ciriello G。斯拉米E。,Sander, C. & Schultz, N. Mutual exclusivity analysis identifies oncogenic network modules.基因组Res。22398 - 406 (2012)
布雷迪,c . a . et al。不同的p53急性dna损伤反应和肿瘤抑制转录程序规定。细胞145年571 - 583 (2011)
里维拉,m . n . et al . X染色体基因,WTX,一般是在肿瘤灭活。科学315年642 - 645 (2007)
Scheel, s . k . et al .突变WTX基因被发现在一些高档微卫星不稳定(MSI-H)结肠直肠癌。BMC癌症10413 (2010)
福布斯,s . a . et al .体细胞突变在癌症的目录(宇宙)。咕咕叫。Protoc。嗡嗡声。麝猫。10.11 Ch。10、单位。(2008)
Massague, J。,Blain, S. W. & Lo, R. S. TGFβ signaling in growth control, cancer, and heritable disorders.细胞103年295 - 309 (2000)
Vaske, c . j . et al .推理的患者使用范式从多维癌症基因组学数据通路活动。生物信息学26i237-i245 (2010)
房子,c, d . et al .电压门控钠+通道SCN5A是一个关键的调节基因的转录网络控制结肠癌入侵。癌症Res。70年6957 - 6967 (2010)
刘,Z。,Lu, H., Jiang, Z., Pastuszyn, A. & Hu, C. A. Apolipoprotein l6, a novel proapoptotic Bcl-2 homology 3-only protein, induces mitochondria-mediated apoptosis in cancer cells.摩尔。癌症Res。321-31 (2005)
托波尔,L。,Chen, W., Song, H., Day, T. F. & Yang, Y. Sox9 inhibits Wnt signaling by promoting β-catenin phosphorylation in the nucleus.生物。化学。284年3323 - 3333 (2009)
纳格:G。,Jr, Zweitzig, D. R., Thimmapaya, B., Beck, G. R., Jr & Moran, E. The原癌基因基因是哺乳动物的直接目标瑞士/ SNF-related复合物在differentiation-associated细胞周期阻滞。癌症Res。66年1289 - 1293 (2006)
陈,et al。小molecule-mediated Wnt-dependent中断信号在组织再生和癌症。Nat,化学。医学杂志。5100 - 107 (2009)
伊万·k . et al。一个有用的方法来识别Wnt-dependent转录的新型小分子抑制剂。癌症Res。70年5963 - 5973 (2010)
袋,et al . S100A4-induced细胞运动性和转移受到Wnt /β-catenin通路抑制剂calcimycin结肠癌细胞。摩尔。杂志。细胞223344 - 3354 (2011)
陈,k . et al .霹雳舞:基因组结构变异的高分辨率的映射算法。自然方法6677 - 681 (2009)
习,r . et al .拷贝数变异检测全基因组测序数据中使用贝叶斯信息准则。Proc。《科学。美国108年E1128-E1136 (2011)
确认
这个工作是由以下来自美国国立卫生研究院资助:U24CA143799, U24CA143835, U24CA143840, U24CA143843, U24CA143845, U24CA143848, U24CA143858, U24CA143866, U24CA143867, U24CA143882, U24CA143883, U24CA144025, U54HG003067, U54HG003079 U54HG003273。
作者信息
作者和联系
财团
贡献
癌症基因组图谱研究网络贡献集体研究。Biospecimens组织源提供的网站和处理Biospecimen核心资源。数据生成和分析基因测序中心,癌症genome-characterization中心和基因组数据分析中心。所有数据通过数据协调中心被释放。项目活动协调的国家癌症研究所和国家人类基因组研究所的项目团队。项目领导人上面和D.A.W.写作团队,助教,A.J.B.,T.A.C.,清醒,A.H.,S.R.H., R.K., P.W.L., M.M., N.S., I.S., J.M.S., J.T., V.T. and D.A.W.; mutations, M.S.L., L.R.T., D.A.W. and G.G.; copy-number and structural aberrations, A.H.R., A.J.B., A.H. and P.-C.C.; DNA methylation, T.H.; expression, J.T.A.; miRNA, G.R., A.C.; pathways, C.J.C., L.D., T.G., S.N., J.D.R., C.S., N.S., J.M.S. and V.T.
相应的作者
道德声明
相互竞争的利益
作者声明没有竞争的经济利益。
额外的信息
(下面的区域安排的参与者的贡献和机构,上面)。
权利和权限
本文根据分布Creative Commons Attribution-Non-Commercial-Share都许可证(http://creativecommons.org/licenses/by-nc-sa/3.0/),它允许分布和繁殖在任何媒介,被认为提供了原作者和来源。这个许可证不允许商业开发,下许可的派生作品必须相同或相似的执照。
关于这篇文章
引用这篇文章
癌症基因组图谱网络。全面的分子表征人类结肠癌和直肠癌。自然487年,330 - 337 (2012)。https://doi.org/10.1038/nature11252
收到了:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/nature11252
本文引用的
APC基因突变与不良反应的免疫治疗结肠癌
BMC胃肠病学(2023)
主轴功能和Wnt通路抑制PBX1抑制肿瘤恶化通过下调DCDC2在结肠直肠癌
肿瘤形成(2023)
转录活动由β-CATENIN和TCF / LEF家庭成员完全是可有可无的生存和传播多种人类结肠癌细胞系
科学报告(2023)
SMARCA4R1157W突变促进染色质重塑和授予PRMT1 / SMARCA4抑制剂敏感性在结肠直肠癌
npj精密肿瘤学(2023)
通过抑制钠离子通道亚基SCNN1B抑制大肠癌的活跃c-Raf和MAPK信号级联
致癌基因(2023)