文摘
自噬维持细胞、组织和生物体通过降解体内平衡。复杂的翻译后调制Atg (autophagy-related)蛋白质增加了额外的入口点串扰与其他细胞类型特异的规定自噬细胞过程,帮助定义。超出了简单的流程专门致力于蜂窝组件的营业额,最近的数据发现了意想不到的自噬功能和autophagy-related基因,如调节代谢、膜运输和调制的宿主防御——表明小说前沿撒谎。
主要
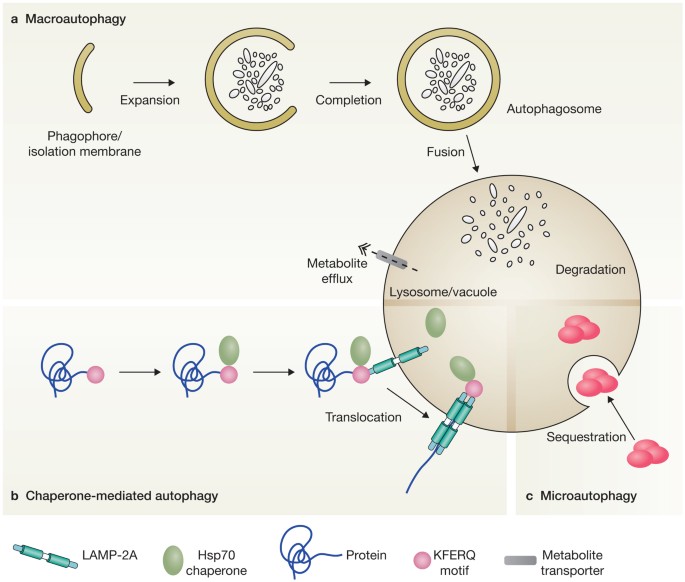
自噬,这个词来源于希腊语中“自食”,是指细胞的分解过程将在自己的选民1。蛋白酶体也参与细胞退化,但自噬仅指那些导致消除的途径通过交付成哺乳动物溶酶体或植物细胞质组件和酵母液泡。自噬是贴上趋向下降的,但它是更准确的描述它作为回收途径强调其细胞生理学的重要贡献。代谢物中产生自噬溶酶体、液泡结果的重用为能源或新大分子的合成的构建块。到目前为止,三个主要类型的描述了自噬:macroautophagy microautophagy,即使伴娘自噬(CMA) (图1)。本文将重点讨论macroautophagy,以下称为自噬。
自噬的特点是双层膜囊泡称为自噬小体的形成,隔离细胞质结构针对破坏(图1)。自噬诱导后,Atg蛋白(表1)组装在一个专门的网站,被评为phagophore大会网站或pre-autophagosomal结构(PAS)2。从这里,他们参与(可能与特定的陷阱和拘束因素)策划融合的高尔基体,核内体和plasma-membrane-derived phagophore膜形成3。不是已经证明摆脱地区的哺乳动物的内质网丰富phosphatidylinositol-3-phosphate (PtdIns3P)绑定蛋白DFCP1,已叫omegasomes4。可视化omegasomes之间的接触点和phagophores导致脂质是提供给新生的自噬小体的假设通过直接从内质网传输5,6,但其它脂质来源,如线粒体,在这个过程中也被牵连7。随后完成自噬体与溶酶体融合(或植物的液泡和酵母)其内容暴露在水解酶的内部细胞器。
自噬已被证明参与生理过程从适应饥饿、细胞分化和发展,异常结构的退化,多余的周转或受损的细胞器,肿瘤抑制,先天和适应性免疫,寿命扩展和细胞死亡8,9,10。Atg蛋白质的识别在自噬是一个里程碑的理解这个过程的重要性1,9。此外,Atg的转录后修饰蛋白质记录到目前为止带来巨大的可塑性集成Atg机械转导多种刺激。最近,附加功能已经分配给自噬结构超出了他们与溶酶体融合舱,以及大量的non-autophagic Atg蛋白质的角色。
选择性自噬类型
自噬长期以来被认为是一个大众化的过程大部分退化长寿蛋白质或胞质成分在营养不足。各种各样的选择性自噬最近发现11。在特定的条件下,自噬小体可以完全隔离,降低线粒体,过氧化物酶体、内质网、核内体、溶酶体、脂滴,分泌颗粒,胞质骨料、核糖体和入侵的病原体(图2一个)。等信号级联蛋白复合物inflammasome也通过选择性自噬调节12。在这种情况下,似乎他们退化并不总是需要刺激自噬本身的感应,而是针对基底形成的自噬小体自噬。
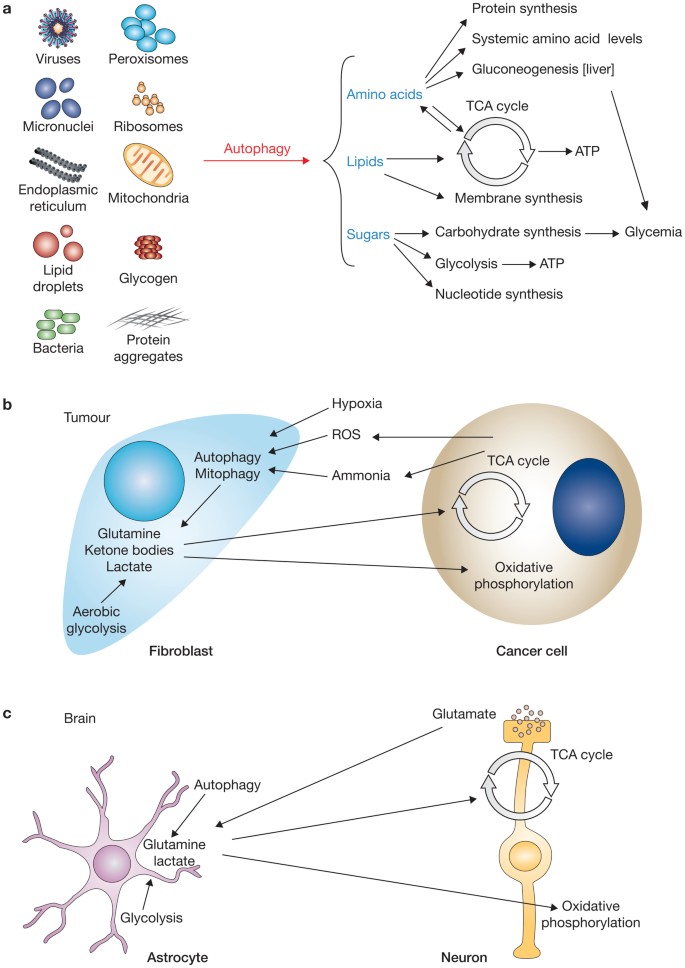
(一个)分解产品的细胞内结构的自噬小体的目标,如氨基酸、脂类和糖类,用于产生新的蛋白质合成代谢反应,部分聚糖、寡核苷酸和膜来维持细胞的功能。氨基酸也可以用来维持他们的系统性和水平新创肝脏中糖原的合成(糖质新生)。脂类和氨基酸可以进入三羧酸(TCA)周期和氧化磷酸化产生能量的形式ATP。糖也可以通过糖酵解代谢生成ATP和保持系统性的血糖水平。(b,c)代谢之间的区分不同的细胞类型。(b)在肿瘤、缺氧和氧化应激引发自噬和mitophagy基质成纤维细胞。这引发对有氧糖酵解代谢开关(称为Warburg效应),导致生产的乳酸和其他代谢物,解放到肿瘤细胞的胞内空间和重吸收。更在这些细胞产生氧化应激和氨氧化代谢(从glutaminolysis),进一步刺激自噬信号恢复成纤维细胞。(c)脑组织中,星形胶质细胞通过糖酵解产生乳酸葡萄糖和谷氨酰胺通过自噬。这些代谢产物是由神经元和氧化生成ATP。此外,神经递质谷氨酸释放的神经元,星形胶质细胞可以使变回原形为谷氨酰胺。
选择性自噬依赖cargo-specific自吞噬受体,促进货物封存到自噬小体。自吞噬受体直接交互的结构需要专门被自噬,以及池的Atg8(哺乳动物LC3的酵母同系物)蛋白家族成员出现在越来越多的自噬小体的内表面11,13。后者相互作用主要是通过介导的特定氨基酸序列中自噬受体和通常被称为LC3-interacting地区(LIR)或Atg8-interacting (AIM)的主题13,14。
研究存在于酵母生物合成的运输路线酿酒酵母cytosol-to-vacuole瞄准(Cvt)途径15,关键在理解在其他真核细胞选择性自噬。这个途径介导交付到液泡内腔的三种水解酶是一个大型的所有部分低聚物的结构。这个货物的招聘到自噬小体取决于Atg11和自噬受体Atg19 (Atg11和Atg19 starvation-induced自噬不是必需的)。表面Atg19货物的分布及其相互作用通过LIR Atg8主题允许密封形成双层膜的囊泡周围的目标结构。Atg32和Atg36酵母线粒体自噬的受体和过氧化物酶体,分别;他们发现这些细胞器和表面似乎在Atg19一样(参16,17,18)。
一个新兴主题在高等真核生物结构由自噬往往ubiquitinated,针对破坏和一系列的自噬受体ubiquitin-binding域和一个LIR主题(如p62 / SQSTM1 NBR1, NDP52或optineurin)促进吞没到自噬小体13,19。泛素化是一个关键监管元素在选择性自噬类型,E3连接和/或最终的适配器和监管机构在这些过程必须有中央的角色。然而,只有少数这些分子到目前为止已确定。这些包括Pink1激酶,帕金连接酶和线粒体外膜蛋白FUNDC(所有mitophagy有关20.,21,22),SMURF1连接酶和适配器,它参与清除病原体23,24。
在自噬调节转录后修饰
对于所有降解途径,明确监管是关键”打开“autopahgy有限的时间,它是必需的。一些信号分子和级联调节自噬在许多细胞和环境因素25,26。自噬是mTOR复杂1的最合适调节器(mTORC1)。这个激酶负调节自噬通过抑制Atg1的活动(ULK1)复杂的通过直接磷酸化。mTORC1的活动是由各种各样的刺激合成代谢输入,包括细胞的能量和养分状况以及氨基酸和生长因子的存在。相反,mTORC1抑制氨基酸稀缺时,生长因子信号降低和/或ATP浓度下降,这导致de-repression自噬26。
mTOR-dependent磷酸化的Atg1 (ULK1)复杂和ubiquitination-like反应是中央在自噬体生物起源的一代Atg12-Atg5和Atg8-phosphatidylethanolamine (PE)配合。虽然这些最初被认为是自噬,唯一的转录后修饰蛋白质与Atg机械目前已知为范围广泛的转录后修饰底物如磷酸化、泛素化和乙酰化作用27。
酵母蛋白激酶A (PKA)磷酸化Atg13的营养,防止其与PAS (ref。28)。在哺乳动物细胞中,ULK1直接磷酸化活化蛋白激酶(AMPK)为了应对能源限制29日,30.。因此,AMPK引发自噬的积极调节Atg1 / (ULK1)复杂和抑制mTOR (ref。25)。
phosphatidylinositol-3-OH激酶(π(3)K)复杂的我也是一个重要的调节点激酶调节自噬诱导。Beclin 1是一个亚基的π(3)K复杂我及其纳入这个复杂,这是至关重要的刺激PtdIns3P合成,通常是由其控制协会与其他蛋白质,如bcl - 2, 14-3-3或中间丝蛋白波形蛋白1 (VMP1)。死亡率beclin 1的磷酸化的蛋白激酶(DAPK)或磷酸化c-Jun bcl - 2的n端激酶(物)触发的离解beclin-1-Bcl-2复杂的不同刺激响应性,允许beclin 1与π(3)K复杂我(参考文献31日,32)。最近,它已被证明,beclin 1 phopshorylation Akt蛋白激酶B (PKB)支持的交互抑制自噬的beclin 1 14-3-3和波形蛋白中间丝蛋白1 (ref。33)。此外,AMPK刺激自噬通过磷酸化的beclin响应葡萄糖饥饿1在不同残渣的抑制激酶,促进其纳入修改π(3)K复杂的我(ref。34)。
下游ULK和π(3)K复合物,磷酸化可以调节LC3-II的活动。当PKA或磷酸化蛋白激酶C (PKC)、失效LC3在自噬小体的形成28,35。如何抑制磷酸化LC3功能还有待阐明。人类PKA网站是高度保守的,老鼠和老鼠LC3的亚型,但并不存在于酵母Atg8 (ref。28)。
自吞噬受体磷酸化也增加他们的亲和力结合基质和LC3在选择性自噬类型。磷酸化酪蛋白激酶2 p62的支持与ubiquitinated蛋白质的相互作用36,而磷酸化的optineurin TANK-binding激酶1增强其亲和力LC3促进消除胞质沙门氏菌37。
尽管泛素化起着重要的作用在毁灭的货物有针对性的选择选择性自噬类型,到目前为止,没有迹象表明,这种翻译修饰发生在Atg蛋白质。最近,组建Atg12-Atg3共轭虽然Atg7和催化的作用Atg3被描述在哺乳动物细胞的活动38。这个共轭扮演了一个角色在细胞死亡通路和控制线粒体扩张。
初步研究表明,一些Atg蛋白质乙酰化39和一个分析acetylome透露这一修改的重要性自噬的调节。Atg5、Atg7 LC3 p300乙酰转移酶和Atg12乙酰化的细胞保持在营养丰富的媒体和脱去乙酰基Sirt1在应对饥饿、一个事件需要诱导自噬40,41。最近,Atg3的乙酰化在酵母和Esa1 Esa1 orthologue TIP60 autophagy-inducing条件下在哺乳动物中被证明能促进Atg3之间的交互和Atg8,这需要Atg8 lipidation42。TIP60也乙醯化ULK1糖原合酶kinase-dependent的方式回应生长因子不足43。因此,ULK1被磷酸化或乙酰化反应活性氨基酸(或葡萄糖)和生长因子不足,分别44。
自噬和Atg蛋白质在膜运输和分泌
直到最近,Cvt途径一直是唯一的运输途径取决于Atg蛋白质并不与降解有关。Atg机械已经被证明参与货物到细胞外介质的释放,揭示了几种非常规蛋白质分泌机制45,46,47。这种机制似乎参与促炎细胞因子的分泌il - 1和地震在哺乳动物细胞47。这个过程取决于Atg5 inflammasome,外围高尔基蛋白GRASP55和小GTPase Rab8a。这autophagy-based非传统分泌机制可以被扩展,调节器等免疫反应的HMGB1 (ref。47)。autophagy-related细胞器的形态参与分泌和分子基础的形成,然而,仍有待确定。在酵母中,假定的运营商为这种类型的分泌建议来自一种目前为止无人舱非常规蛋白质分泌(名为杯)48。不一样,杯子还包含PtdIns3P以及Atg8 Atg9。然而,尽管这两个Atg所需蛋白质的生成,他们为杯形成似乎是不必要的。在哺乳动物系统中,这种模式的分泌可以解释non-lytic释放病毒,颠覆了外出的自噬机制49或驱逐细胞自噬小体材料的后期阶段,网织红细胞成熟红细胞50。
在oncogene-induced衰老细胞,一个专业室称为mTOR-autophagy特殊耦合腔室(TASCC)并列旁边的高尔基体和刺激细胞外的释放特定子集的蛋白质通过传统的分泌途径51。溶酶体,自噬体(溶酶体提供的蛋白质)两个毗邻TASCC积累。重要的是,mTOR位于溶酶体表面被氨基酸流出激活溶酶体和积极调节蛋白质合成和细胞生长52。TASCC之间的相互作用,溶酶体,自噬体可以通过耦合自噬关键在协调细胞代谢降解蛋白质的合成和分泌。TASCC-like结构也被观察到具有non-senescent细胞,这表明这种蛋白质分泌机制可能广泛使用51。
自噬和Atg蛋白质,包括Atg8共轭LC3-II,也调节分泌一些专业组织包括中耳、破骨细胞、肥大细胞、Paneth细胞和胰腺β-cells53。自噬体形成的独立,LC3-II介导融合包含蛋白酶的水泡运营商的组织蛋白酶K与破骨细胞的折边边界,在骨吸收是重要的一步54。这种情况反映了招聘的LC3-II时间以提高其吞噬细胞与溶酶体融合55。LC3-II的角色和Atg8蛋白质家族的其他成员在这些流程可能依靠他们的能力在中介拘束或多孔结构的融合56,57细胞骨架和/或绑定58。
自噬作为一个监管机构的组织微环境的新陈代谢
饥饿是经典的自噬刺激,诱发细胞内成分的降解产生代谢产物基本维持细胞生存能力图2一个),用于燃料线粒体呼吸和ATP生产59,60。在酵母中,氨基酸由自噬可以用来维持新蛋白质合成和维持线粒体功能营养不足61年。氨基酸在肝脏生成的自噬用于糖质新生保持系统性饥饿下血糖(图2一个)62年。此外,除了肝甘油三酯脂肪酶的活性,选择性降解肝脏的脂质滴自噬也会产生游离脂肪酸甘油三酯63年。
自噬的作用在癌症新陈代谢一直是紧张调查的主题。自噬防止癌细胞代谢压力(如减少养分有效性和缺氧条件)通过减少氧化应激和维持基因组的稳定性64年。现在清楚的是,癌症细胞重新编程新陈代谢来支持他们的扩散和快速增长。增加营养吸收,癌细胞也进行有氧糖酵解氧化葡萄糖乳酸产生ATP和中间代谢产物用于合成代谢反应,维持细胞生长65年。这代谢开关包括糖酵解酶的特定亚型的表达,以及表达的酶代谢氨基酸和脂质,与不同的酶的活动和衬底的偏好66年。在这种背景下,hypoxia-responsive因子的激活HIF-1调节许多糖酵解酶的表达和同样促进mitophagy67年。最近的代谢组学研究表明,细胞能维持最低级别的线粒体呼吸缺氧下产生ATP(1%氧气),这些细胞也显示增加水平的自噬活动及蛋白质和脂质分解代谢产生的中间体68年。自噬抑制在这些条件下减少细胞内ATP水平和导致细胞死亡,表明自噬能够燃料所带来的降解产物ATP合成的三羧酸循环来维持细胞生存能力甚至在低氧条件下68年。这个cyto-protective缺氧条件下自噬的作用可能是通过microRNA-dependent调节调制ATG7在肝肿瘤细胞系和表达式在活的有机体内xenographs69年。目前还不清楚是否autophagy-dependent线粒体退化是一个额外的机制负责代谢重编程,尽管在非致瘤性细胞的观察会支持这一观点70年。事实上,过度的RCAN1-1L蛋白质诱导mitophagy和从氧化转向在神经元细胞糖酵解代谢70年。
代谢耦合现象,两种不同的细胞类型不同协调他们的新陈代谢,已经与自噬和观察到的几个组织包括肿瘤和脑组织(图2 b, c)71年。肿瘤是由多种细胞类型,它被假定代谢耦合对肿瘤的发展是很重要的。特别是,成纤维细胞进行有氧糖酵解在肿瘤和显示糖酵解酶的表达增加,升高HIF-1活动,自噬和mitophagy71年。代谢物造成高架在这些成纤维细胞自噬和糖酵解,如乳酸、酮体和氨基酸释放到肿瘤微环境和隔离癌细胞燃料氧化磷酸化维持肿瘤生长所必需的71年。成纤维细胞的自噬刺激也导致增加衰老,促进生产酮体和线粒体代谢在邻近癌细胞转移72年。相比这些积极的自噬对肿瘤生长的影响,自噬upregulation癌细胞本身实际上抑制肿瘤生长72年。其他代谢物,如产生的氨glutaminolysis癌症细胞,刺激细胞自噬在邻国73年。
类似的代谢功能耦合已经观察到大脑中,星形胶质细胞和神经元交换代谢物来支持他们的细胞功能(图2 c)。损伤的溶酶体功能和自噬影响特定的细胞类型如星形胶质细胞,阻止他们支持和保护邻近的神经元,最终导致大脑皮层神经退化在活的有机体内74年。
在一起,这些数据表明,自噬在特定细胞类型可以在调节键周围组织的生存和发展(图2 c)。
的作用ATG基因在其他细胞过程
分析Atg蛋白质interactome建议他们可以独立功能的细胞通路在自噬的作用75年。这个新兴的话题最近研究进展76年,有些non-autophagic功能的ATG基因所示表2。一些模块参与自噬小体的形成,如两个共轭系统(ATG5-ATG12和LC3-PE)和π(3)K复杂的我,被雇来phagosomal膜促进融合时间和溶酶体吞噬作用引发的toll样受体的参与55。这些共轭系统也破骨细胞的生成所需折边边界,骨吸收的关键结构54。
ATG5-ATG12 / ATG16L1复杂,独立于LC3共轭体系,可以调节天生的病毒的免疫反应。ATG5-ATG12抑制了I型干扰素(IFN)生产与retinoic-acid-inducible基因通过直接联系我(rig - I)和IFN-β子刺激器(IPS-1)77年。这个复杂的也是II型IFN-mediated所需主机防御诺瓦克病毒通过抑制其膜复制复杂的形成78年。同样,需要ATG5寄生虫的间隙刚地弓形虫在巨噬细胞79年。
复合物结合系统的上游,如ULK1复杂和π(3)K复杂的我,对于细菌的胞内循环是必要的流产布鲁氏菌。他们是用来颠覆间隙通过参与液泡的形成包含促进感染的细菌80年。
除了传统ATG12-ATG5磁带,ATG12-ATG3共轭可以调节线粒体稳态和细胞死亡而不影响自噬小体的形成,以应对饥饿38。LC3和ATG12还可以独立运行的传统结合PE和ATG5,分别。LC3-I参与运营商来源于内质网的形成,称为EDEMosomes81年、通路被冠状病毒形成结构所需的病毒基因组的转录和复制82年。ATG12是一个积极的中介线粒体凋亡的灭活的成员pro-survival bcl - 2蛋白家族。的活动ATG12 ATG5或ATG3无关,和需要一个BH3-like主题ATG12 (ref。83年)。ATG蛋白质也autophagy-independent地后蛋白水解处理。例如,钙蛋白酶产生pro-apoptotic片段ATG5乳沟,干扰的抗凋亡活动Bcl-xL (ref。84年)。此外,beclin 1处理半胱天冬酶3生成两个片段,没有诱导自噬的能力85年,86年。c端片段产生的这个处理定位线粒体和糖分会让细胞凋亡86年。因此,类似于蛋白参与细胞凋亡也超出了细胞凋亡的作用87年,ATG组件,以及其他蛋白质参与自噬AMBRA1等VPS34和p62 (autophagy-independent角色这里不讨论),从事non-autophagic功能。这个概念必须考虑当我们实验探讨自噬的作用在活的有机体内的基础上单一的消融ATG基因。
结论和观点
尽管进展在我们对自噬的理解,许多关键方面的异化的途径仍是神秘的。例如,我们仍然知之甚少基底自噬的规定,在正常生长条件下运营。这一过程的调制进行肌动蛋白细丝和组蛋白脱乙酰酶HDAC6,这对自噬体都是可有可无的饥饿条件下成熟88年。
协调Atg蛋白质招聘不是来自不同膜的起源,以及他们在这个层次结构组装专业网站,是自噬小体的生物起源,将来应该仔细考虑。虽然Atg蛋白质的分级招聘已经提出了酵母遗传基础89年,他们的时间协会和功能层次结构的影响仍有待调查。考试的选择性线粒体或封存沙门氏菌通过自噬小体表示不同层次结构的假设,根据Atg或集群组蛋白可以独立关联形式不是(参考文献90年,91年)。同样,进一步分析不同形式的非规范自噬描述到目前为止,它只需要一个子集的Atg蛋白质,或Atg autophagy-independent功能的蛋白质,可以产生更好的理解功能的重要性,这些因素在自噬体的生成92年。
还有待观察为什么后生动物具有相同的几个亚型Atg蛋白质,这显然有相同的功能。例如,人类基因组包含6同系物单一酵母Atg8蛋白质,然而这些同行的作用仍有待阐明。这种蛋白质家族的一些成员,GABARAPL1 GABARAPL2,被证明参与自噬小体关闭57期间,而LC3C还充当一个特定受体选择性抗菌自噬93年。
自噬的重要性在许多方面的生理已经认可。毫不奇怪,缺陷在这个过程中与众多人类疾病密切相关。更好地了解自噬的分子基础和生理监管机构的控制,从细胞因子和激素限制饮食或锻炼身体,可以提供简单和非侵入性的方法来调节这个途径预防或治疗干预措施在未来25。
改变历史
2013年7月01
在本文的打印版本,表2是错误地省略。似乎正确的HTML和PDF版本。
引用
杨,z & Klionsky d . j .活活吞噬:macroautophagy的历史。Nat,细胞生物。12,814 - 822 (2010)。
水岛,N。,Yoshimori, T. & Ohsumi, Y. The role of Atg proteins in autophagosome formation.为基础。启细胞Dev。杂志。27,107 - 132 (2011)。
Rubinsztein博士,d . C。,Shpilka, T. & Elazar, Z. Mechanisms of autophagosome biogenesis.咕咕叫。医学杂志。22R29-34 (2012)。
斧,e . l . et al .自噬体形成膜隔间丰富的磷脂酰肌醇3 -磷酸和动态连接到内质网。j .细胞杂志。182年,685 - 701 (2008)。
Hayashi-Nishino, m . et al .内质网的子域形成自噬体形成的摇篮。Nat,细胞生物。11,1433 - 1437 (2009)。
Yla-Anttila, P。Vihinen, H。,Jokitalo, E. & Eskelinen, E. L. 3D tomography reveals connections between the phagophore and endoplasmic reticulum.自噬5,1180 - 1185 (2009)。
Hailey, d . w . et al .线粒体提供膜自噬小体生物起源在饥饿。细胞141年,656 - 667 (2010)。
Deretic诉&莱文,自噬,免疫和微生物适应性。细胞宿主细菌5,527 - 549 (2009)。
水岛,N。莱文,B。,Cuervo, A. M. & Klionsky, D. J. Autophagy fights disease through cellular self-digestion.自然451年,1069 - 1075 (2008)。
莱文,b &获得g .自噬在疾病的发病机理。细胞132年27-42 (2008)。
Reggiori F。,Komatsu, M., Finley, K. & Simonsen, A. Autophagy: more than a nonselective pathway.Int。j .细胞杂志。2012年219625 (2012)。
史,c . s . et al。自噬的激活炎症信号限制IL-1β生产目标ubiquitinated inflammasomes破坏。Immunol Nat。13,255 - 263 (2012)。
约翰森,t & Lamark t .选择性自噬由自噬适配器蛋白质。自噬7,279 - 296 (2011)。
野田佳彦:N。,Ohsumi, Y. & Inagaki, F. Atg8-family interacting motif crucial for selective autophagy.2月。584年,1379 - 1385 (2010)。
Lynch-Day, m . a . et al . Trs85指导Ypt1 GEF, TRAPPIII phagophore促进自噬。Proc。《科学。美国107年,7811 - 7816 (2010)。
马特里,a . M。,Nuttall, J. M. & Hettema, E. H. Pex3-anchored Atg36 tags peroxisomes for degradation in酿酒酵母。EMBO J。31日,2852 - 2868 (2012)。
Kanki, T。,Wang, K., Cao, Y., Baba, M. & Klionsky, D. J. Atg32 is a mitochondrial protein that confers selectivity during mitophagy.Dev细胞。17,98 - 109 (2009)。
冈本K。,Kondo-Okamoto, N. & Ohsumi, Y. Mitochondria-anchored receptor Atg32 mediates degradation of mitochondria via selective autophagy.Dev细胞。17,87 - 97 (2009)。
Shaid, S。,Brandts, C. H., Serve, H. & Dikic, I. Ubiquitination and selective autophagy.细胞死亡是不同的。20.21 - 30 (2013)。
Vives-Bauza, c . et al . PINK1-dependent招聘帕金在mitophagy线粒体。Proc。《科学。美国107年,378 - 383 (2010)。
•D。田中,。,Suen, D. F. & Youle, R. J. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy.j .细胞杂志。183年,795 - 803 (2008)。
刘,l . et al .线粒体外膜蛋白质FUNDC1调节低氧诱导mitophagy在哺乳动物细胞。Nat,细胞生物。14,177 - 185 (2012)。
华生,r . O。,Manzanillo, P. S. & Cox, J. S. Extracellular结核分枝杆菌目标细菌DNA自噬通过激活主机DNA-sensing通路。细胞150年,803 - 815 (2012)。
Orvedahl,等。基于图像的全基因组siRNA屏幕识别选择性自噬的因素。自然480年,113 - 117 (2011)。
Rubinsztein博士,d . C。,Codogno, P。&Levine, B. Autophagy modulation as a potential therapeutic target for diverse diseases.Nat。启药物。11,709 - 730 (2012)。
梅耶尔,a . j . & Codogno p .自噬:监管和在疾病中的作用。暴击。启中国。科学实验室。46,210 - 240 (2009)。
麦克尤恩,d . g . & Dikic,自噬的三个火枪手:磷酸化,ubiquitylation和乙酰化作用。细胞生物的趋势。21,195 - 201 (2011)。
斯蒂芬,j·S。叶,Y Y。,Ramachandran, V., Deminoff, S. J. & Herman, P. K. The Tor and PKA signaling pathways independently target the Atg1/Atg13 protein kinase complex to control autophagy.Proc。《科学。美国106年,17049 - 17054 (2009)。
伊根,d . f . et al .磷酸化ULK1 (hATG1)连接能量传感mitophagy活化蛋白激酶。科学331年,456 - 461 (2011)。
金,J。,Kundu, M., Viollet, B. & Guan, K. L. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1.Nat,细胞生物。13,132 - 141 (2011)。
魏、Y。,Pattingre, S., Sinha, S., Bassik, M. & Levine, B. JNK1-mediated phosphorylation of Bcl-2 regulates starvation-induced autophagy.摩尔。细胞30.,678 - 688 (2008)。
Zalckvar、大肠等。DAP-kinase-mediated磷酸化的BH3域beclin从Bcl-X 1促进离解beclin 1(左)和自噬的诱导。EMBO代表。30.,30 (2009)。
王,r . c . et al . Akt-mediated通过Beclin 1磷酸化调控自噬与肿瘤发生。科学338年,956 - 959 (2012)。
金,j . et al .微分调节不同的AMPK Vps34复合物的营养压力和自噬。细胞152年,290 - 303 (2013)。
Cherra, s . J。,3日。et al .调节自噬蛋白LC3的磷酸化。j .细胞杂志。190年,533 - 539 (2010)。
松本,G。和田,K。,Okuno, M., Kurosawa, M. & Nukina, N. Serine 403 phosphorylation of p62/SQSTM1 regulates selective autophagic clearance of ubiquitinated proteins.摩尔。细胞44,279 - 289 (2011)。
自噬的野外,p . et al .磷酸化受体optineurin限制沙门氏菌的生长。科学333年,228 - 233 (2011)。
Radoshevich, l . et al . ATG12接合ATG3调节线粒体稳态和细胞死亡。细胞142年,590 - 600 (2010)。
Morselli、大肠等。亚精胺和白藜芦醇诱导自噬通过不同的通路acetylproteome收敛。j .细胞杂志。192年,615 - 629 (2011)。
李,即h . et al . NAD-dependent脱乙酰酶的作用Sirt1在自噬的调节。Proc。《科学。美国105年,3374 - 3379 (2008)。
李,即h &芬克尔t调节自噬的p300乙酰转移酶。生物。化学。284年,6322 - 6328 (2009)。
咦,c . et al .乙酰化在自噬的作用和分子机制监管。科学336年,474 - 477 (2012)。
林,郑胜耀et al。GSK3-TIP60-ULK1生长因子不足,自噬信号通路链接。科学336年,477 - 481 (2012)。
Hamai, a & Codogno, p .乙酰化作用为目标的自噬。科学。信号。5pe29 (2012)。
杜兰,j . M。Anjard C。斯蒂芬,C。,Loomis, W. F. & Malhotra, V. Unconventional secretion of Acb1 is mediated by autophagosomes.j .细胞杂志。188年,527 - 536 (2010)。
Manjithaya, R。Anjard C。,Loomis, W. F. & Subramani, S. Unconventional secretion of毕赤酵母属pastorisAcb1取决于掌握蛋白质、过氧化物酶病函数和自噬小体的形成。j .细胞杂志。188年,537 - 546 (2010)。
杜邦、n . et al . Autophagy-based非传统分泌通路对细胞外IL-1β交付。Embo J30.,4701 - 4711 (2011)。
布鲁斯,C。,McCaffery, J. M., Curwin, A. J., Duran, J. M. & Malhotra, V. Biogenesis of a novel compartment for autophagosome-mediated unconventional protein secretion.j .细胞杂志。195年,979 - 992 (2011)。
杰克逊,w . t . et al . Subversion RNA病毒的细胞autophagosomal机械。公共科学图书馆杂志。3e156 (2005)。
格里菲斯,r . e . et al。成熟的网织红细胞血型糖蛋白中内化质膜包含囊泡与自噬小体在胞外分泌保险丝。血119年,6296 - 6306 (2012)。
成田机场,m . et al . mTOR的空间耦合和自噬增强分泌表型。科学332年,966 - 970 (2011)。
Zoncu, r .等人mTORC1感官溶酶体氨基酸通过一种由内到外的机制,需要空泡的H(+)腺苷三磷酸酶。科学334年,678 - 683 (2011)。
Deretic, V。,Jiang, S. & Dupont, N. Autophagy intersections with conventional and unconventional secretion in tissue development, remodeling and inflammation.细胞生物的趋势。22,397 - 406 (2012)。
DeSelm, c . j . et al .自噬蛋白调节的分泌成分监测骨吸收。Dev细胞。21,966 - 974 (2011)。
Sanjuan, m . a . et al . toll样受体信号在巨噬细胞吞噬作用的自噬途径的链接。自然450年,1253 - 1257 (2007)。
Nakatogawa, H。,Ichimura, Y. & Ohsumi, Y. Atg8, a ubiquitin-like protein required for autophagosome formation, mediates membrane tethering and hemifusion.细胞130年,165 - 178 (2007)。
Weidberg, h . et al . LC3 GATE-16 N末端调节自噬体膜融合过程需要生物转化。Dev细胞。20.,444 - 454 (2011)。
Monastyrska,我。立达E。,Klionsky, D. J. & Reggiori, F. Multiple roles of the cytoskeleton in autophagy.医学杂志。启剑桥市费罗斯。Soc。84年,431 - 448 (2009)。
Mellen, m·A。,de la Rosa, E. J. & Boya, P. The autophagic machinery is necessary for removal of cell corpses from the developing retinal neuroepithelium.细胞死亡是不同的。15,1279 - 1290 (2008)。
曲,x等。自噬gene-dependent清除凋亡细胞在胚胎发育阶段。细胞128年,931 - 946 (2007)。
铃木s W。,Onodera, J. & Ohsumi, Y. Starvation induced cell death in autophagy-defective yeast mutants is caused by mitochondria dysfunction.《公共科学图书馆•综合》6e17412 (2011)。
江崎,j . et al .肝脏自噬有助于维护血液葡萄糖和氨基酸水平。自噬7,727 - 736 (2011)。
辛格,r . et al .自噬调节脂类代谢。自然458年,1131 - 1135 (2009)。
白色,大肠Deconvoluting自噬在癌症的上下文相关的角色。Nat。启癌症12,401 - 410 (2012)。
水汽,s y &范德Heiden m . g .有氧糖酵解:细胞增殖的代谢需求。为基础。启细胞Dev。杂志。27,441 - 464 (2011)。
Porporato p E。、Dhup年代。,Dadhich, R. K., Copetti, T. & Sonveaux, P. Anticancer targets in the glycolytic metabolism of tumors: a comprehensive review.前面的杂志。2现年49岁(2011)。
西门·g·l·HIF-1:上游和下游的癌症新陈代谢。咕咕叫。当今。麝猫。Dev。20.51-56 (2010)。
Frezza, c . et al .缺氧细胞的代谢分析揭示异化的签名所需细胞的生存。《公共科学图书馆•综合》6e24411 (2011)。
Chang y等人mir - 375抑制自噬,降低肝癌细胞在缺氧条件下的生存能力。胃肠病学143年,177 - 187 (2012)。
Ermak, g . et al .慢性RCAN1-1L蛋白质的表达诱导线粒体自噬和代谢转变在神经细胞氧化磷酸化,糖酵解。生物。化学。287年,14088 - 14098 (2012)。
Pavlides et al。华宝满足自噬:癌症相关成纤维细胞通过氧化应激加速肿瘤的生长和转移,mitophagy,有氧糖酵解。Antioxid。氧化还原信号。16,1264 - 1284 (2012)。
Capparelli, c . et al。自噬和癌症相关的衰老成纤维细胞通过糖酵解代谢支持肿瘤的生长和转移,酮生产。细胞周期11,2285 - 2302 (2012)。
Eng, c, h &亚伯拉罕,r . t . Glutaminolysis收益率代谢副产品,刺激自噬。自噬6,968 - 970 (2010)。
Di马耳他、C。,Fryer, J. D., Settembre, C. & Ballabio, A. Astrocyte dysfunction triggers neurodegeneration in a lysosomal storage disorder.Proc。《科学。美国109年e2334 - 2342 (2012)。
Behrends C。,Sowa, M. E., Gygi, S. P. & Harper, J. W. Network organization of the human autophagy system.自然466年,68 - 76 (2010)。
Subramani, v . s . & Malhotra Non-autophagic autophagy-related蛋白质的角色。EMBO代表。14,143 - 151 (2013)。
Jounai: et al。Atg5 Atg12共轭associates和天生的抗病毒免疫反应。Proc。《科学。美国104年,14050 - 14055 (2007)。
黄,s . et al . Nondegradative角色Atg5-Atg12 / Atg16L1自噬蛋白复合物γ干扰素的抗病毒活性。细胞宿主细菌11,397 - 409 (2012)。
赵,z . et al . Autophagosome-independent基本函数的自噬蛋白Atg5细胞免疫细胞内病原体。细胞宿主细菌4,458 - 469 (2008)。
斯塔尔,t . et al。自噬的选择性subversion复合物有助于完成布鲁氏菌细胞内循环。细胞宿主细菌1133-45 (2012)。
卡利,T。,Galli, C., Olivari, S. & Molinari, M. Segregation and rapid turnover of EDEM1 by an autophagy-like mechanism modulates standard ERAD and folding activities.物化学。Biophys。Commun >,371年,405 - 410 (2008)。
Reggiori, f . et al .冠状病毒劫持LC3-I-positive EDEMosomes, ER-derived囊泡出口短暂ERAD监管机构、复制。细胞宿主细菌7,500 - 508 (2010)。
鲁宾斯坦,a D。艾森斯坦,M。方方面面,Y。,Bialik, S. & Kimchi, A. The autophagy protein Atg12 associates with anti-apoptotic Bcl-2 family members to promote mitochondrial apoptosis.摩尔。细胞44,698 - 709 (2011)。
Yousefi, s . et al . Calpain-mediated乳沟Atg5开关自噬细胞凋亡。Nat,细胞生物。8,1124 - 1132 (2006)。
罗,美国& Rubinsztein博士特区凋亡块Beclin 1-dependent自噬小体合成:被Bcl-xL拯救产生影响。细胞死亡是不同的。17,268 - 277 (2010)。
有威望、大肠等。Caspase-mediated乳沟Beclin-1 Beclin-1-induced自噬灭活和增强细胞凋亡促进从线粒体释放proapoptotic因素。细胞死亡说。1e18 (2010)。
Galluzzi, L。Kepp, O。,Trojel-Hansen, C. & Kroemer, G. Non-apoptotic functions of apoptosis-regulatory proteins.EMBO代表。13,322 - 330 (2012)。
李,j . y . et al . HDAC6控制自噬小体成熟必不可少的ubiquitin-selective质量控制自噬。Embo J。29日,969 - 980 (2010)。
铃木K。,Kubota, Y., Sekito, T. & Ohsumi, Y. Hierarchy of Atg proteins in pre-autophagosomal structure organization.基因的细胞12,209 - 218 (2007)。
Itakura E。,Kishi-Itakura, C., Koyama-Honda, I. & Mizushima, N. Structures containing Atg9A and the ULK1 complex independently target depolarized mitochondria at initial stages of Parkin-mediated mitophagy.j .细胞科学。125年,1488 - 1499 (2012)。
Kageyama, s . et al . LC3招聘机制是分开Atg9L1-dependent膜形成自噬的反应沙门氏菌。摩尔。杂志。细胞22,2290 - 2300 (2011)。
Codogno, P。,Mehrpour, M. & Proikas-Cezanne, T. Canonical and non-canonical autophagy: variations on a common theme of self-eating?Nat。启摩尔。细胞杂志。13广州(2011)。
冯·Muhlinen n . et al . LC3C选择性NDP52的经典之中LIR的主题,需要抗菌自噬。摩尔。细胞48,329 - 342 (2012)。
弗洛里,O。,Kim, S. E., Sandoval, C. P., Haynes, C. M. & Overholtzer, M. Autophagy machinery mediates macroendocytic processing and entotic cell death by targeting single membranes.Nat,细胞生物。13,1335 - 1343 (2011)。
马丁内斯,j . et al . Microtubule-associated蛋白质1轻链3α(LC3)相关的吞噬作用所需的高效清除死细胞。Proc。《科学。美国108年,17396 - 17401 (2011)。
确认
支持P.B. saf - 2009 - 08086和saf - 2012 - 36079的拨款。支持联储回波(700.59.003)ALW开放项目(821.02.017和822.02.014),DFG-NWO合作(dn82 - 303)和ZonMW VICI(016.130.606)资助。pc支持INSERM ANR赠款和印加。
作者信息
作者和联系
相应的作者
权利和权限
关于这篇文章
引用这篇文章
博雅,P。,Reggiori F。&Codogno, P。新兴自噬的调控和功能。Nat细胞生物15,713 - 720 (2013)。https://doi.org/10.1038/ncb2788
发表:
发行日期:
DOI:https://doi.org/10.1038/ncb2788
本文引用的
mTORC2:自噬的多方面的监管机构
细胞通讯和信号传导(2023)
吉西他滨促进自噬溶酶体功能通过ERK和TFEB-dependent机制
发现细胞死亡(2023)
通过阻断CMA-mediated C11orf54促进DNA修复HIF1A退化
通信生物学(2023)
发现rafoxanide作为小说剂用于治疗非小细胞肺癌
科学报告(2023)
CTB-targeted原始细胞增强能力lanthionine ketenamine类似物诱导自噬在电动机neuron-like细胞
科学报告(2023)