文摘gydF4y2Ba
肥胖是一种流行疾病与许多代谢改变有关,涉及到多个器官和系统。神经系统(ECS)似乎是一个能量体内平衡和代谢的主要监管机构。在这里,我们表明,具体删除的ECS合成酵素,NAPE-PLD,在脂肪细胞诱发肥胖,葡萄糖耐受不良,脂肪组织炎症和脂质代谢改变。我们的报告gydF4y2BaNapepldgydF4y2Ba删除老鼠出现褐变的改变计划,不太适应低温的反应可以褐变,强调NAPE-PLD的至关重要的作用在调节能量稳态和新陈代谢的生理状态。我们的结果表明,这些变化是由肠道微生物群组成的变化,可以部分转移表型无菌鼠。在一起,我们的研究发现脂肪组织的角色NAPE-PLD全身新陈代谢和提供支持针对NAPE-PLD-derived生物活性脂质治疗肥胖和代谢紊乱有关。gydF4y2Ba
介绍gydF4y2Ba
肥胖已经达到大流行的水平。除了与脂肪组织的大规模扩张,肥胖也与集群相关的代谢改变,如2型糖尿病和心血管和肝脏疾病。因此,它是至关重要的,解开底层机制,导致这些代谢变化来发现新的治疗策略。肥胖可以被认为是一个“多系统疾病”,因为多个器官和系统参与这个代谢状态。其中,神经系统(ECS)似乎是一个能量体内平衡和代谢的主要监管机构。gydF4y2Ba
ECS交互是一个复杂的系统由几个生物活性脂质膜结合和核受体,导致广泛的生理效应。ECS活动主要是由关键控制合成和降解酶gydF4y2Ba1gydF4y2Ba。叫花生四烯酸乙醇胺(gydF4y2BaNgydF4y2Ba-arachidonoylethanolamine AEA)是一个最好的特点内源性大麻素(央行),参与体内平衡调节食欲和能量gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3gydF4y2Ba。除了AEA外,其他相关gydF4y2BaNgydF4y2Ba-acylethanolamines (na),等gydF4y2BaNgydF4y2Ba-palmitoylethanolamine(豌豆),gydF4y2BaNgydF4y2Ba-stearoylethanolamine(海)gydF4y2BaNgydF4y2Ba-oleoylethanolamine (OEA)和AEA分享生物合成和降解途径。na一般合成的酶gydF4y2BaNgydF4y2Ba-acylphosphatidylethanolamine磷脂酶D (NAPE-PLD),尽管替代AEA生物合成途径存在gydF4y2Ba1gydF4y2Ba,gydF4y2Ba4gydF4y2Ba。欧洲央行从细胞膜磷脂合成和释放到细胞外室的目标受体。欧洲央行采取行动通过自分泌或旁分泌机制gydF4y2Ba5gydF4y2Ba。主要央行受体G-coupled受体CBgydF4y2Ba1gydF4y2Ba和CBgydF4y2Ba2gydF4y2Ba,主要的目标AEA 2-arachidonoylglycerol,两大央行。等na OEA或豌豆,激活non-cannabinoid受体,包括PPARα、GPR55或GPR119(参考文献gydF4y2Ba1gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba)。央行正密切的水平受合成和降解之间的平衡。释放后,欧洲央行和na迅速退化的集群如脂肪酸酰胺水解酶降解酶(FAAH)或美国水解酸酰胺酶(NAAA)gydF4y2Ba5gydF4y2Ba。因为他们主要是合成的需求,值得关注欧洲央行的生产。na调节食物摄入量和炎症反应gydF4y2Ba3gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba因此似乎作为重要的代谢体内平衡和炎症介质。研究总gydF4y2BaNapepldgydF4y2Ba敲除小鼠(KO)并没有发现明显的表型,突出替代合成途径等某些长链na AEA NAPE-PLD和暗示作用的调节脂质信号系统gydF4y2Ba4gydF4y2Ba,gydF4y2Ba11gydF4y2Ba。这些研究主要集中在中央ECS,但NAPE-PLD的确切作用gydF4y2Ba本身gydF4y2Ba在外围组织的新陈代谢还有待调查。gydF4y2Ba
在周组织参与肥胖,脂肪组织扮演着中心角色。除了存储过多的能量,脂肪组织是一个活跃的代谢器官,分泌许多介质,如激素和细胞因子(例如,发病)gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba。我们之前和其他人强调角色ECS的脂肪形成和脂肪组织功能gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,从而指定了ECS脂肪组织代谢的一个重要参与者。我们假设na由脂肪细胞是关键调解人体内平衡调节全身代谢和能量。gydF4y2Ba
评估na的具体作用产生的脂肪组织,我们生成一个adipocyte-specific缺失的小鼠模型gydF4y2BaNapepldgydF4y2Ba基因和研究脂肪组织的生理作用下NAPE-PLD基底(控制饮食(CT))和病理(食源性肥胖(戴奥))条件。我们在这项研究中发现gydF4y2BaNapepldgydF4y2Ba删除在脂肪组织会导致肥胖的发展,损害的葡萄糖和脂质稳态以及改变脂肪组织代谢和肠道微生物群组成的变化。gydF4y2Ba
结果gydF4y2Ba
NapepldgydF4y2Ba删除特定的脂肪组织gydF4y2Ba
评估脂肪组织NAPE-PLD在新陈代谢的作用,gydF4y2BaNapepldgydF4y2Ba液态氧/液态氧gydF4y2Ba老鼠(建设gydF4y2Ba补充图1gydF4y2Ba)越过了gydF4y2BaFabp4-CregydF4y2Ba小鼠产生小鼠NAPE-PLD条件adipocyte-specific KO (cKO)。gydF4y2BaFabp4-CregydF4y2Ba- - - - - -gydF4y2BaNapepld cgydF4y2BaKO小鼠出生后的正常发展,形成鲜明对比gydF4y2BaFabp4-CregydF4y2Ba老鼠菌株可以开发产后杀伤力gydF4y2Ba18gydF4y2Ba。确认的失效gydF4y2BaNapepldgydF4y2Ba基因在脂肪组织cKO的老鼠,我们评估的存在NAPE-PLD蛋白质免疫印迹分析的白色脂肪组织(窟)野生型小鼠(WT)和cKO (gydF4y2Ba图1一个gydF4y2Ba),发现没有检测到大量的NAPE-PLD cKO窟的老鼠。相比之下,我们没有观察到大脑中的NAPE-PLD水平降低,这表明我们的模型的特异性(gydF4y2Ba补充图2gydF4y2Ba)。此外,信使核糖核酸(mRNA)表达式的分析从多个组织确认删除特定不同仓库的窟(皮下,内脏和附睾的)和褐色脂肪组织(蝙蝠;gydF4y2Ba图1 bgydF4y2Ba),在不影响gydF4y2BaNapepldgydF4y2Ba表达在肝脏、结肠或肌肉,这表明重组并没有发生在其他组织gydF4y2Ba19gydF4y2Ba。在实验期间,WT和cKO老鼠CT (WT-CT和cKO-CT组)或高脂肪的饮食(HFD;WT-HFD cKO-HFD组)。删除的gydF4y2BaNapepldgydF4y2Ba基因验证cKO组在饮食(gydF4y2Ba图1 bgydF4y2Ba)。因为我们观察到剩余的表达gydF4y2BaNapepldgydF4y2Ba在脂肪组织中,我们进行了分离的间质血管分数(SVF)和脂肪细胞丰富分数窟。这表明,减少的表达gydF4y2BaNapepldgydF4y2Ba只发生在脂肪细胞分数而不是SVF (gydF4y2Ba补充图2gydF4y2Ba)。一些文献中建立了一个报告gydF4y2BaCregydF4y2Ba活动由gydF4y2BaFabp4gydF4y2Ba在其他细胞如巨噬细胞启动子gydF4y2Ba20.gydF4y2Ba。来验证gydF4y2BaNapepldgydF4y2Ba在巨噬细胞表达,我们孤立从WT腹膜巨噬细胞,cKO老鼠。我们发现巨噬细胞从基因型没有差别gydF4y2BaNapepldgydF4y2Ba表达式(gydF4y2Ba补充图2gydF4y2Ba)。最后,为了确保删除gydF4y2BaNapepldgydF4y2Ba确实是降低美国水平我们测量na由NAPE-PLD的水平。gydF4y2Ba图1 cgydF4y2Ba说明了~ 60%减少豌豆,OEA和海平面cKO老鼠的脂肪组织与WT老鼠。相比之下,我们没有发现大脑中na含量下降当比较两个基因型(gydF4y2Ba补充图2gydF4y2Ba)。缺乏显著的影响gydF4y2BaNapepldgydF4y2Ba删除在AEA证实存在的另一种合成途径美国gydF4y2Ba4gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba21gydF4y2Ba。重要的是,我们确定HFD-treated WT的老鼠表现出类似水平的na cKO老鼠,这表明HFD治疗本身有一个美国降低效应,仅略加剧cKO基因型。此外,我们发现gydF4y2BaNapepldgydF4y2Ba删除在脂肪组织会导致增加美国前体水平(午睡)在脂肪组织,确凿的结果中执行的先前的研究gydF4y2BaNapepldgydF4y2Ba−−/gydF4y2Ba老鼠gydF4y2Ba4gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba21gydF4y2Ba(gydF4y2Ba补充图2gydF4y2Ba)。gydF4y2Ba
(gydF4y2Ba一个gydF4y2Ba)代表脂肪组织免疫印迹NAPE-PLD和β-actin WT老鼠和cKO老鼠。(gydF4y2BabgydF4y2Ba)mRNA的相对表达gydF4y2BaNapepldgydF4y2Ba在不同的脂肪组织存款(皮下、内脏、附睾的和棕色脂肪tissue-SAT,增值税,吃和蝙蝠),以及肝脏、结肠和胫骨肌肉CT下饮食和HFD cKO老鼠和老鼠WT (gydF4y2BangydF4y2Ba= 20-27)。这些数据(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)对应于三个独立实验的结果。数据与‘*’显示显著差异(gydF4y2BaP
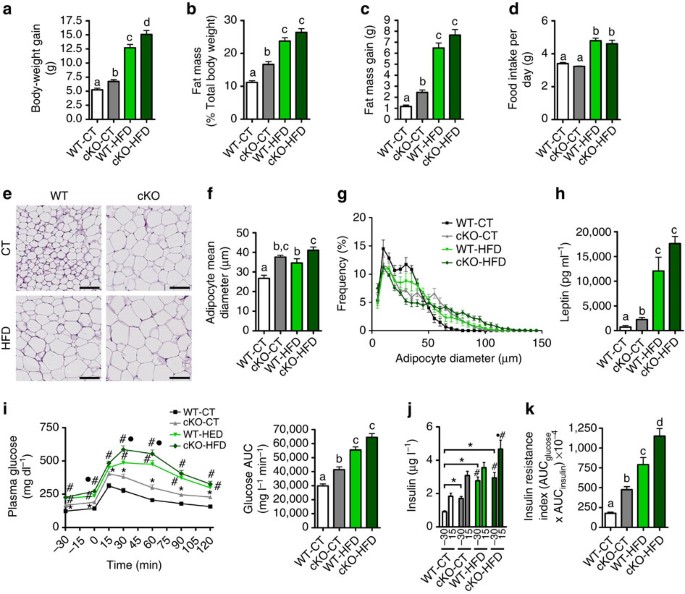
脂肪组织gydF4y2BaNapepldgydF4y2Ba删除老鼠开发一个肥胖表现型gydF4y2Ba
令人惊讶的是,根据CT饮食,cKO老鼠比WT小鼠体重增长的多。这一现象加剧了HFD(下gydF4y2Ba图2一个gydF4y2Ba)。身体成分测量通过核磁共振表明,cKO老鼠积累更多的脂肪质量,从而导致更高比例的总脂肪和脂肪量增加增益(gydF4y2Ba图2 b, cgydF4y2Ba)和较低的百分比精益质量与控制同行相比CT饮食(8周后gydF4y2Ba补充图3gydF4y2Ba)。食物摄入量不变WT与cKO老鼠但增加HFD-treated组与CT-treated组(gydF4y2Ba图2 dgydF4y2Ba)。脂肪量的增加在cKO获得观察小鼠与增加脂肪细胞大小老鼠CT饮食和HFD (gydF4y2Ba图2 e, fgydF4y2Ba)。增加反映在更高的频率更大的脂肪细胞相比,cKO老鼠和老鼠HFD WT-CT老鼠(gydF4y2Ba图2 ggydF4y2Ba)。此外,血浆瘦素的含量,生产比例脂肪量,在cKO-CT显著增加小鼠相比WT-CT老鼠和增加更多的cKO-HFD老鼠相比WT-HFD老鼠(gydF4y2Ba图2 hgydF4y2Ba)。我们下一个评估是否脂肪gydF4y2BaNapepldgydF4y2Ba删除对全身葡萄糖代谢的影响。我们观察到cKO-CT老鼠在禁食状态,这些小鼠高血糖的葡萄糖耐受不良发展,就是明证口服葡萄糖耐量试验(OGTT) (gydF4y2Ba图2我gydF4y2Ba)。重要的是,这在OGTT的持续时间都保持葡萄糖耐受不良。此外,脂肪gydF4y2BaNapepldgydF4y2Ba删除加剧HFD-induced葡萄糖耐受不良(gydF4y2Ba图2我gydF4y2Ba)。cKO-CT老鼠表现出双重的更高层次的血浆胰岛素在禁食状态以及口服葡萄糖负荷后,这一效应也出现在HFD喂养(无花果。gydF4y2Ba2 jgydF4y2Ba)。这些观测证实了增加胰岛素抵抗指数观察cKO-CT在CT和HFD饮食喂养,后者在cKO-HFD老鼠而恶化WT-HFD老鼠(gydF4y2Ba图2 kgydF4y2Ba)。gydF4y2Ba
(gydF4y2Ba一个gydF4y2Ba)总体重增加(g) (gydF4y2BangydF4y2Ba= 20-27)。(gydF4y2BabgydF4y2Ba身体总重量)总脂肪量(%)衡量TD-NMR (gydF4y2BangydF4y2Ba= 20-27)。(gydF4y2BacgydF4y2Ba)总脂肪量增加(g)衡量TD-NMR (gydF4y2BangydF4y2Ba= 20-27)。(gydF4y2BadgydF4y2Ba每只老鼠(g))的意思是每日食物摄入量(gydF4y2BangydF4y2Ba= 20-27)。(gydF4y2BaegydF4y2Ba)代表苏木精和eosin-stained坐存款的照片。μm酒吧,规模100人。(gydF4y2BangydF4y2Ba= 6 - 10)。(gydF4y2BafgydF4y2Ba)的意思是脂肪细胞直径(μm)由组织学分析(gydF4y2BangydF4y2Ba= 6 - 10)。(gydF4y2BaggydF4y2Ba)脂肪细胞的分布和频率对平均直径来衡量组织学分析(gydF4y2BangydF4y2Ba= 6 - 10)。(gydF4y2BahgydF4y2Ba)血浆瘦素水平测量腔静脉(μg毫升gydF4y2Ba−1gydF4y2Ba;gydF4y2BangydF4y2Ba= 6 - 10)。(gydF4y2Ba我gydF4y2Ba)血浆葡萄糖(mg dlgydF4y2Ba−1gydF4y2Ba)剖面和均值曲线下面积(AUC)测量葡萄糖负荷后0到120分钟(毫克dlgydF4y2Ba−1gydF4y2Ba最小值;gydF4y2BangydF4y2Ba= 20-27)。(gydF4y2BajgydF4y2Ba在30分钟)血浆胰岛素水平和葡萄糖负荷后15分钟(gydF4y2BangydF4y2Ba= 20-27)。(gydF4y2BakgydF4y2Ba)胰岛素抵抗指数由相乘的AUC AUC血糖的胰岛素。这些数据(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba和gydF4y2Ba我gydF4y2Ba- - - - - -gydF4y2BakgydF4y2Ba)对应于三个独立实验的结果。数据提出了均值±s.e.m。数据与不同的上标字母明显不同(gydF4y2BaP
脂肪组织gydF4y2BaNapepldgydF4y2Ba删除诱发胰岛素抵抗gydF4y2Ba
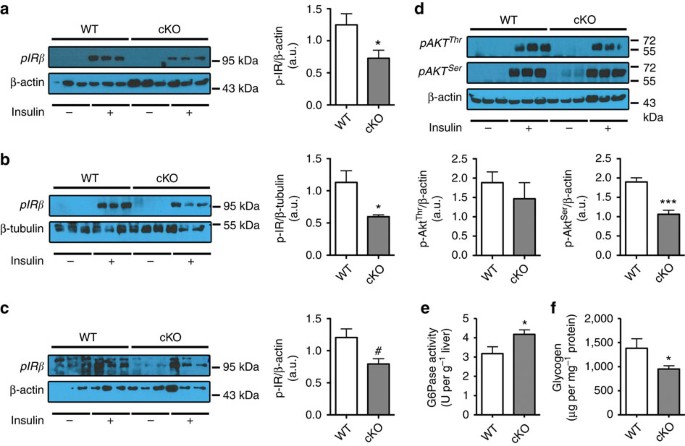
cKO小鼠胰岛素抵抗是禁食glycaemia建议的增加,葡萄糖耐受不良,禁食和美联储高胰岛素血症和胰岛素抵抗指数(gydF4y2Ba图2 i (kgydF4y2Ba)。探讨机关负责胰岛素抵抗,我们分析了insulin-induced磷酸化的胰岛素受体(p-IRβ)。我们发现,胰岛素刺激后,磷酸化的IRβ强烈降低肝脏和肌肉的cKO老鼠,而减少的磷酸化IRβ在脂肪组织没有统计学意义(gydF4y2Ba图3 a - cgydF4y2Ba)。进一步分析在肝脏胰岛素抵抗,我们接下来分析insulin-induced一种蛋白激酶的磷酸化(p-Akt),胰岛素信号通路下游中介。一种蛋白激酶的磷酸化丝氨酸网站减少胰岛素刺激后在肝脏(gydF4y2Ba图3 dgydF4y2Ba在这个器官),证实胰岛素抵抗,而p-Akt水平没有影响肌肉或脂肪组织(数据没有显示)。最后,我们发现glucose-6-phosphatase活动增加,肝脏中糖原含量减少,证实胰岛素抵抗在这个器官(gydF4y2Ba图3 e, fgydF4y2Ba)。gydF4y2Ba
(gydF4y2Ba一个gydF4y2Ba)代表肝脏免疫印迹p-IRβ和β-Actin WT, cKO老鼠有或没有胰岛素刺激。比刺激p-IRβ在肝脏的加载控制以微cKO和WT老鼠(gydF4y2BangydF4y2Ba= 6)。(gydF4y2BabgydF4y2Ba)代表骨骼肌免疫印迹p-IRβ和β-tubulin WT, cKO老鼠有或没有胰岛素刺激。在肌肉刺激比p-IRβ加载控制以微cKO和WT老鼠(gydF4y2BangydF4y2Ba= 3 - 6)。(gydF4y2BacgydF4y2Ba)代表脂肪组织免疫印迹,p-IRβ和β-Actin WT, cKO老鼠有或没有胰岛素刺激。比刺激p-IRβ在脂肪组织加载控制以微cKO和WT老鼠(gydF4y2BangydF4y2Ba= 3)。(gydF4y2BadgydF4y2Bap-Akt)代表肝脏免疫印迹gydF4y2BaThr308gydF4y2Ba,p-AktgydF4y2BaSer473gydF4y2Ba和β-Actin WT cKO老鼠有或没有胰岛素刺激。比刺激p-AktgydF4y2BaThr308gydF4y2Ba和p-AktgydF4y2BaSer473gydF4y2Ba在肝脏的加载控制以微cKO和WT老鼠(gydF4y2BangydF4y2Ba= 6)。(gydF4y2BaegydF4y2Ba每克肝)肝脏G6Pase活动(U) (gydF4y2BangydF4y2Ba= 6 - 10)。(gydF4y2BafgydF4y2Ba)肝糖原含量(每毫克μg蛋白质;gydF4y2BangydF4y2Ba= 6 - 10)。数据提出了均值±s.e.m。数据与‘*’明显不同(gydF4y2BaP
NapepldgydF4y2Ba删除影响脂肪和全身的血脂水平gydF4y2Ba
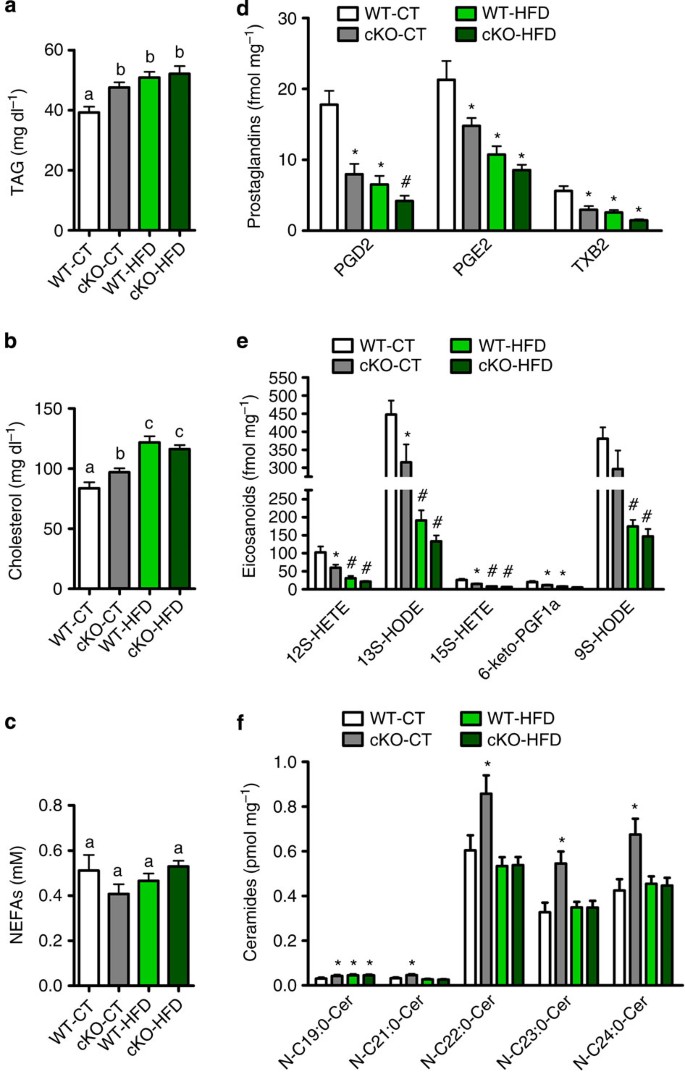
NapepldgydF4y2Ba删除会导致降低合成生物活性介质(即美国)可能参与调节脂肪组织的脂质合成和释放。研究这种可能性,我们执行一个循环脂质和脂肪组织lipidomics分析。我们观察到循环增加甘油三酯(标记)和胆固醇水平(gydF4y2Ba图4 a, bgydF4y2Ba)cKO老鼠,而循环non-esterified脂肪酸水平被删除(不受影响gydF4y2Ba图4摄氏度gydF4y2Ba)。此外,na分享类似的生物合成途径类花生酸及其衍生物(即前列腺素(PG)),也是重要的脂质代谢和炎症介质参与gydF4y2Ba22gydF4y2Ba。我们不能排除脂肪组织的可能性gydF4y2BaNapepldgydF4y2Ba删除也会影响这些脂质介质,这种互动可以额外的机制参与能源体内平衡和葡萄糖代谢的变化,我们量化的脂肪类花生酸的水平,PG,天然保湿因子,使用lipidomic磷脂的方法。我们观察到的删除gydF4y2BaNapepldgydF4y2Ba在脂肪组织减少PG在脂肪组织和类二十烷酸浓度相同的程度上HFD治疗(gydF4y2Ba图4 d, egydF4y2Ba)。我们发现在cKO-CT显著增加小鼠水平非常长链神经酰胺(gydF4y2Ba图4 fgydF4y2Ba)与WT-CT老鼠。有趣的是,我们观察到HFD治疗不影响长链神经酰胺水平,由于没有在HFD cKO状况的恶化。此外,cKO-CT老鼠表现出几窟中磷脂的含量下降而WT-CT老鼠(gydF4y2Ba补充表1gydF4y2Ba)。总之,这些数据证实的强烈影响gydF4y2BaNapepldgydF4y2Ba删除对脂质代谢的基本状态。gydF4y2Ba
(gydF4y2Ba一个gydF4y2Badl)血浆甘油三酸酯含量(毫克gydF4y2Ba−1gydF4y2Ba;gydF4y2BangydF4y2Ba= 20-27)。(gydF4y2BabgydF4y2Badl)血浆胆固醇含量(毫克gydF4y2Ba−1gydF4y2Ba;gydF4y2BangydF4y2Ba= 20-27)。(gydF4y2BacgydF4y2Ba)等离子体non-esterified脂肪酸(NEFA)水平(mM;gydF4y2BangydF4y2Ba= 20-27)。这些数据(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba)对应于三个独立实验的结果。(gydF4y2BadgydF4y2Ba)前列腺素含量测量质/女士坐在fmol每毫克组织(gydF4y2BangydF4y2Ba= 10)。(gydF4y2BaegydF4y2Ba)类二十烷酸内容以质/女士坐在fmol每毫克组织(gydF4y2BangydF4y2Ba= 10)。(gydF4y2BafgydF4y2Ba质/ MS)坐在神经酰胺含量来衡量pmol /毫克组织(gydF4y2BangydF4y2Ba= 10)。另请参阅gydF4y2Ba补充表1gydF4y2Ba。数据提出了均值±s.e.m。数据明显不同(不同的上标字母或符号gydF4y2BaP
NapepldgydF4y2Ba删除修改炎症和褐变过程gydF4y2Ba
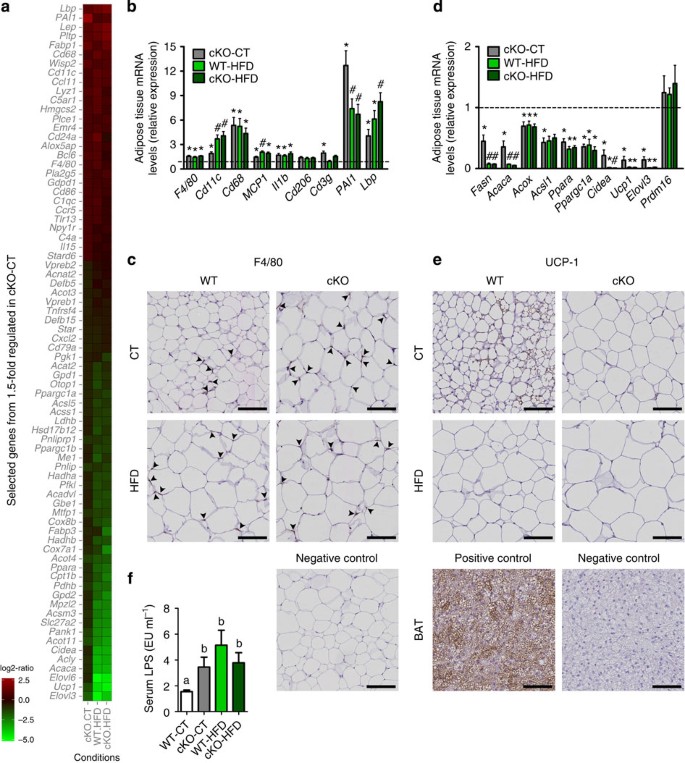
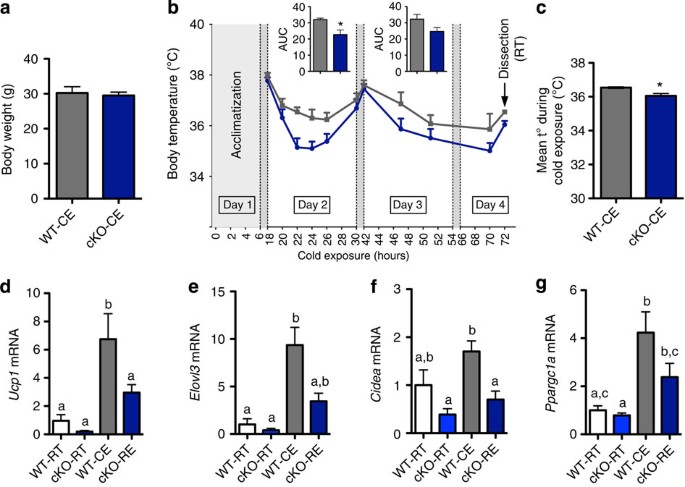
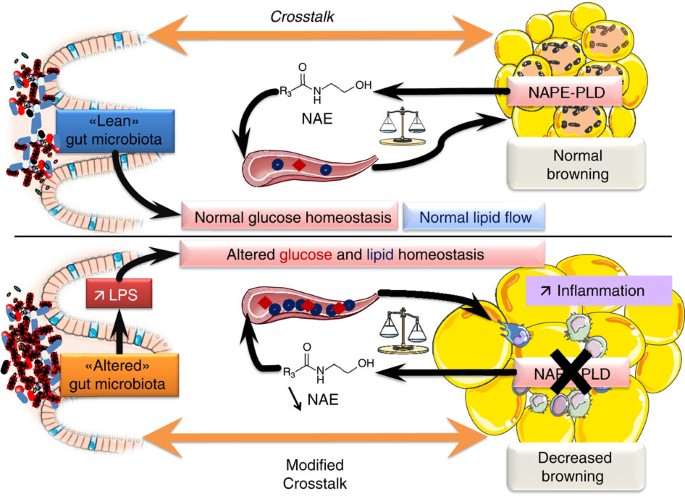
更好地解释脂肪量的增加和改变血脂观察后删除gydF4y2BaNapepldgydF4y2Ba在脂肪组织中,我们分析了在窟的微阵列基因表达谱。这些发现增加了大量的基因的表达参与炎症通路和减少大量的脂肪组织代谢基因的表达在cKO-CT WT-HFD和cKO-HFD老鼠相比WT-CT老鼠(gydF4y2Ba图5gydF4y2Ba)。基因被分配到相关通路通过分析基因本体使用生物信息学工具大卫(gydF4y2Ba补充图4gydF4y2Ba)。gydF4y2Ba图5一个gydF4y2Ba代表相对比率在我们实验小组的选择基因或调节至少1.5倍cKO-CT与WT-CT老鼠。基因的完整列表中可用gydF4y2Ba补充数据1gydF4y2Ba。从微阵列分析确认结果,我们进行了定量PCR (qPCR)测量关键炎症标记物以及脂质代谢和布朗宁标记。所有的qPCR结果支持微阵列的结果,证实cKO小鼠表现出明显增加脂肪组织炎症(gydF4y2Ba图5 bgydF4y2Ba)。值得注意的是,炎症标记物的水平在cKO-CT老鼠类似于WT-HFD cKO-HFD老鼠或比HFD条件下更加明显,强调的效果gydF4y2BaNapepldgydF4y2Ba删除在生理条件下脂肪组织炎症。我们已经证实的存在在cKO小鼠炎症组织学染色窟F4/80标记的部分(gydF4y2Ba图5度gydF4y2Ba,量化gydF4y2Ba补充图5gydF4y2Ba)。关于脂质代谢,我们观察到一些基因的表达减少脂肪生成(gydF4y2BaFasngydF4y2Ba和gydF4y2BaAcacagydF4y2Ba),β-oxidation (gydF4y2BaAcox1gydF4y2Ba和gydF4y2BaAcsl1gydF4y2Ba)或脂类代谢的关键调节因素(gydF4y2BaPparagydF4y2Ba和gydF4y2BaPpargc1agydF4y2Ba在cKO-CT老鼠)(gydF4y2Ba图5 dgydF4y2Ba)。寻求机械的解释增加脂肪堆积,我们确定了微阵列的关键差别明显对这些标记的褐变,即gydF4y2BaPpargc1agydF4y2Ba,gydF4y2BaUcp1gydF4y2Ba,gydF4y2BaCideagydF4y2Ba和gydF4y2BaElovl3gydF4y2Ba在cKO-CT老鼠(gydF4y2Ba图5gydF4y2Ba)。证实了差别这对这些qPCR (gydF4y2Ba图5 dgydF4y2BaUCP1)和免疫染色(gydF4y2Ba图5 egydF4y2Ba,量化gydF4y2Ba补充图5gydF4y2Ba)。因为我们观察到的脂肪量增加,但没有增加食物摄入量,这些结果表明脂肪的影响gydF4y2BaNapepldgydF4y2Ba删除对褐变过程。这些不同的标记之间的相似cKO-HFD和WT-HFD (gydF4y2Ba图5中gydF4y2Ba)。我们和其他人联系的增加表达脂多糖(LPS)结合蛋白(LBP)在脂肪组织炎症和血浆LPS水平gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba。作为gydF4y2Ba枸杞多糖gydF4y2Ba信使rna是大幅增加cKO老鼠的脂肪组织微阵列和qPCR数据显示,我们测量血浆LPS水平,发现增加gydF4y2Ba枸杞多糖gydF4y2BamRNA表达和更高的炎症cKO-CT老鼠与显著增加相关代谢内毒素(也就是说,增加血浆LPS水平gydF4y2Ba25gydF4y2Ba)(gydF4y2Ba图5 fgydF4y2Ba)。gydF4y2Ba
(gydF4y2Ba一个gydF4y2Ba)从微阵列分析热图代表选择的炎症或脂质代谢基因,根据基因的列表或调节1.5倍cKO-CT与WT-CT老鼠。另请参阅gydF4y2Ba补充图4gydF4y2Ba和gydF4y2Ba补充数据1gydF4y2Ba。(gydF4y2BabgydF4y2Ba)的mRNA表达脂肪组织炎症标记物来衡量RT-qPCR (gydF4y2BangydF4y2Ba= 20-27gydF4y2BaF4/80gydF4y2Ba,gydF4y2BaCd11cgydF4y2Ba,gydF4y2BaMCP1gydF4y2Ba和gydF4y2BaIl1bgydF4y2Ba和gydF4y2BangydF4y2Ba其他标记)= 6 - 10。black-dotted线代表WT-CT mRNA表达水平。数据gydF4y2BabgydF4y2Ba关于炎症标记物与三个独立实验的结果相对应。(gydF4y2BacgydF4y2Ba)代表F4/80染色的坐在照片。规模酒吧,100μm。(gydF4y2BangydF4y2Ba= 6 - 10)。另请参阅gydF4y2Ba补充图5gydF4y2Ba。(gydF4y2BadgydF4y2Ba)的mRNA表达脂肪组织代谢标记来衡量RT-qPCR (gydF4y2BangydF4y2Ba= 6 - 10)。black-dotted线代表WT-CT mRNA表达水平。(gydF4y2BaegydF4y2Ba)代表图像染色坐在UCP1。规模的酒吧,100μm。(gydF4y2BangydF4y2Ba= 6 - 10)。另请参阅gydF4y2Ba补充图5gydF4y2Ba。(gydF4y2BafgydF4y2Ba每毫升)血浆LPS水平(欧盟)测量门静脉(gydF4y2BangydF4y2Ba= 6 - 10)。数据提出了均值±s.e.m。数据与不同的上标字母明显不同(gydF4y2BaP
NapepldgydF4y2Ba删除会损害适应寒冷暴露gydF4y2Ba
调查是否减少窟褐变是一个因果因素,或代谢的结果,表型观察,我们提交身体weight-matched WT和cKO老鼠(gydF4y2Ba图6gydF4y2Ba)为72 h寒冷暴露。在正常情况下,这有效地移植gydF4y2BaUcp1gydF4y2Ba和顺向热产生(勃朗宁)WT老鼠,为了对抗环境温度的下降gydF4y2Ba26gydF4y2Ba。cKO老鼠维持较低的体温在寒冷暴露和72 h后的平均体温明显降低寒冷暴露(gydF4y2Ba图6 b, cgydF4y2Ba)。qPCR布朗宁计划窟的标记(gydF4y2BaUcp1、Elovl3 CideagydF4y2Ba和gydF4y2BaPpargc1agydF4y2Ba)表明,寒冷暴露导致正常布朗宁WT窟的老鼠,但这种感应受损cKO老鼠(gydF4y2Ba图6 dgydF4y2Ba)。gydF4y2Ba
(gydF4y2Ba一个gydF4y2Ba)身体总重量(g;gydF4y2BangydF4y2Ba= 7)。(gydF4y2BabgydF4y2Ba)体温进化(°C) 72 - h寒冷暴露(gydF4y2BangydF4y2Ba= 7)。插入表示曲线下的面积(AUC)的2和3,与基线组34°C。(gydF4y2BacgydF4y2Ba)是指体温(t°)以°C在寒冷暴露(gydF4y2BangydF4y2Ba= 7)。(gydF4y2BadgydF4y2Ba)gydF4y2BaUcp1gydF4y2Ba信使rna水平,(gydF4y2BaegydF4y2Ba)gydF4y2BaElovl3gydF4y2Ba信使rna水平,(gydF4y2BafgydF4y2Ba)gydF4y2BaCideagydF4y2Ba信使rna水平,(gydF4y2BaggydF4y2Ba)gydF4y2BaPpargc1agydF4y2Ba信使rna水平(相对表达式)在室温(RT)和cold-exposed坐(CE) WT, cKO老鼠(gydF4y2BangydF4y2Ba= 7)。数据提出了均值±s.e.m。双向重复测量方差分析(方差分析;基因型基因型×时间)发现了一个显著的影响(gydF4y2BaP =gydF4y2Ba时间(0.02),一个重要的效应gydF4y2BaP
布朗宁表型主要是守恒的gydF4y2Ba体外gydF4y2Ba外植体gydF4y2Ba
因为肾上腺素能刺激窟引起褐变过程中,这一现象gydF4y2Ba在活的有机体内gydF4y2Ba被认为是一个富有同情心的事件吗gydF4y2Ba27gydF4y2Ba。事实上,许多行为的所谓“布朗宁代理”可以追溯到间接机制,导致激活交感神经系统(SNS)和随后的诱导褐变gydF4y2Ba27gydF4y2Ba。然而,一些代理可能影响褐变直接和细胞自动的方式。进一步了解脂肪组织的影响gydF4y2BaNapepldgydF4y2Ba删除在褐变过程中,我们想知道这些表型是由细胞自动功能或与同情音调的变化gydF4y2Ba在活的有机体内gydF4y2Ba。为了解决这个问题,我们孤立的皮下脂肪垫(外植体)和培养他们gydF4y2Ba体外gydF4y2Ba24 h消除周边肾上腺素的刺激。有趣的是我们发现在培养基24小时孵化后,脂肪组织外植体从cKO老鼠倾向于复制gydF4y2Ba在活的有机体内gydF4y2Ba表现型布朗宁标记,尽管这种减少没有达到统计学意义(gydF4y2Ba补充图6gydF4y2Ba)。这些结果表明,的影响gydF4y2BaNapepldgydF4y2Ba删除在褐变不能完全归因于交感变化驱动。此外,我们没有发现任何β3的mRNA表达受体的变化gydF4y2Ba在活的有机体内gydF4y2Ba,这可能被预期为β3受体表达水平的密切监管由同情输入(gydF4y2Ba补充图6gydF4y2Ba)。gydF4y2Ba
脂肪组织gydF4y2BaNapepldgydF4y2Ba删除改变肠道微生物群gydF4y2Ba
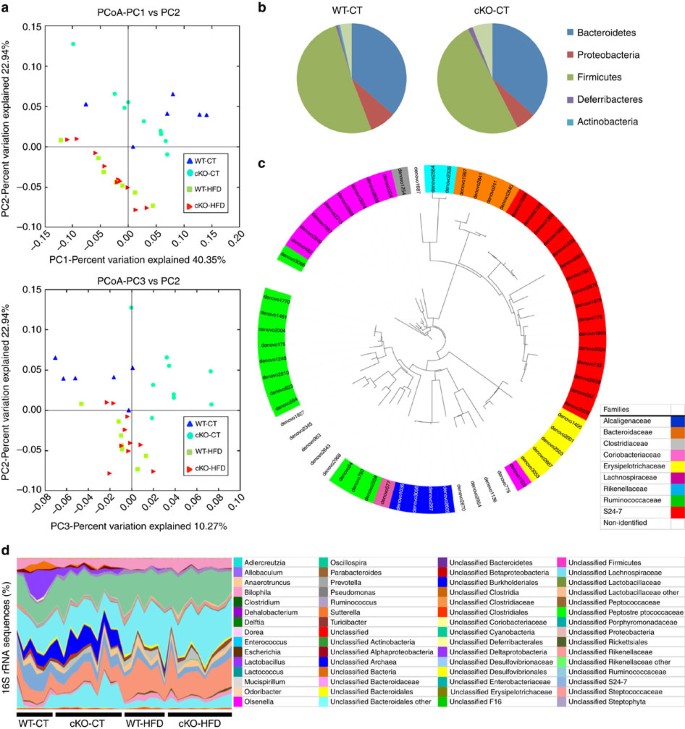
代谢内毒素在cKO-CT老鼠表示假定的肠道微生物群组成的变化。因为我们以前演示了一个强大的协会之间的脂肪组织,欧洲央行内容和肠道微生物群gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba使用高通量测序,我们分析了肠道微生物群。与以前的研究一致gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba28gydF4y2Ba,我们观察到一个明显的变化在肠道微生物群组成与CT相比HFD饮食。有趣的是,删除gydF4y2BaNapepldgydF4y2Ba深刻影响肠道微生物群在CT饮食的条件下,观察到在主坐标分析(gydF4y2Ba图7gydF4y2Ba)。更具体地说,64年的丰富业务分类单位cKO-CT老鼠与WT-CT老鼠相比明显不同(gydF4y2Ba图7 cgydF4y2Ba)。在分类级别,两个门,六科8属明显修改cKO-CT老鼠相比WT-CT老鼠(gydF4y2Ba图7罪犯gydF4y2Ba和gydF4y2Ba补充表3 - 5gydF4y2Ba)。有趣的是,从cKO-CT小鼠肠道微生物群的不同于WT-CT HFD-treated老鼠老鼠也从那(gydF4y2Ba图7 a, dgydF4y2Ba),建议的影响gydF4y2BaNapepldgydF4y2Ba删除引起的肠道微生物群可能不同于那些HFD治疗。这一发现强烈表明,删除gydF4y2BaNapepldgydF4y2Ba在脂肪组织中有深远的影响在生理条件下肠道微生物群组成,从而首次表明脂肪组织的存在肠道微生物群的轴。gydF4y2Ba
(gydF4y2Ba一个gydF4y2Ba基于加权)PCoA UniFrac分析操作分类单元(辣子鸡;gydF4y2BangydF4y2Ba= 6 - 10)。每个符号代表一个样本是彩色根据集团。(gydF4y2BabgydF4y2Ba)构成丰富的细菌类群中确定WT-CT和cKO-CT小鼠的肠道微生物群(gydF4y2BangydF4y2Ba= 6 - 10)。(gydF4y2BacgydF4y2Ba)不同的辣子鸡影响脂肪组织gydF4y2BaNapepldgydF4y2Ba删除在CT的饮食。代表16 s rRNA从64年的每一个差异表达基因辣子鸡cKO-CT与WT-CT老鼠是对齐的,用来推断系统发育树提出了数据(gydF4y2BangydF4y2Ba= 6 - 10)。前面的颜色OTU表示OTU的家庭。(gydF4y2BadgydF4y2Ba16 s rRNA序列的)的相对含量(百分比)的各种细菌属在每个样本中每组的老鼠(gydF4y2BangydF4y2Ba= 6 - 10)。在gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba不同的类群,家庭和属由不同的颜色代码。另请参阅gydF4y2Ba补充表3 - 5gydF4y2Ba。gydF4y2Ba
长期抗生素治疗改善葡萄糖体内平衡gydF4y2Ba
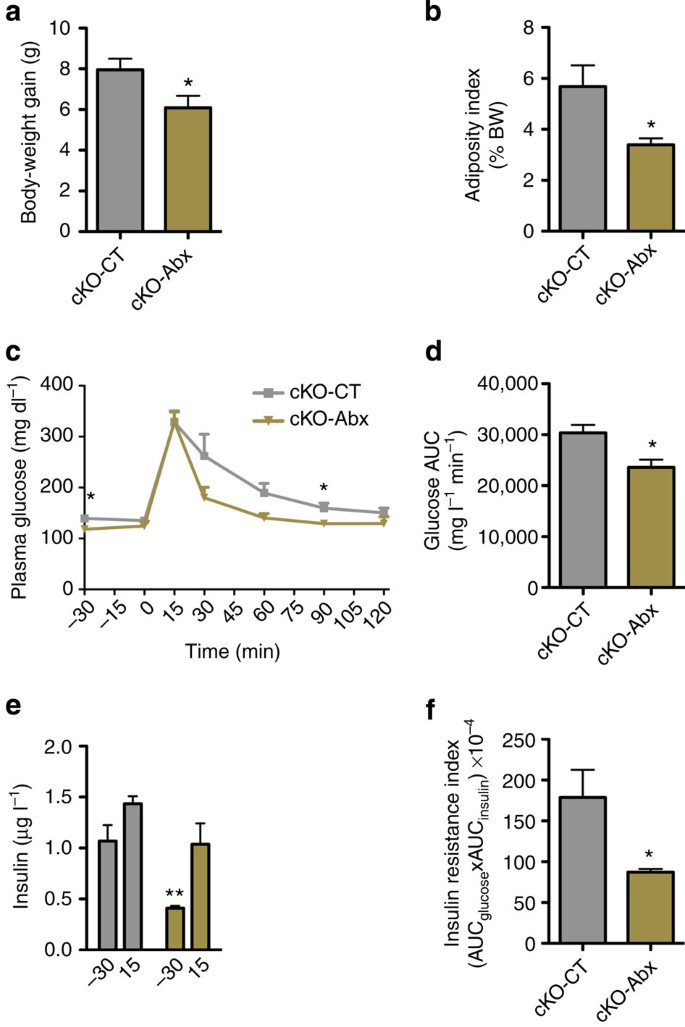
调查如果肠道微生物群可能影响表型的观察gydF4y2BaNapepldgydF4y2Ba删除,我们老鼠抗生素治疗12周。有趣的是我们发现,长期抗生素治疗在cKO老鼠CT (cKO-Abx)体重增加和减少脂肪量开发(gydF4y2Ba图8 a, bgydF4y2Ba)。抗生素也改善葡萄糖耐量和胰岛素抵抗指数(cKO老鼠gydF4y2Ba图8氟gydF4y2Ba),建议直接影响肠道微生物群在能源和葡萄糖体内平衡。gydF4y2Ba
(gydF4y2Ba一个gydF4y2Ba)总体重增加(g;gydF4y2BangydF4y2Ba= 5)。(gydF4y2BabgydF4y2Ba身体总重量)肥胖指数(%)长期抗生素治疗(gydF4y2BangydF4y2Ba= 5)。(gydF4y2BacgydF4y2Ba)血浆葡萄糖(mg dlgydF4y2Ba−1gydF4y2Ba)和(gydF4y2BadgydF4y2Ba)均值曲线下面积(AUC)测量葡萄糖负荷后0到120分钟(mg lgydF4y2Ba−1gydF4y2Ba最小值gydF4y2Ba−1gydF4y2Ba;gydF4y2BangydF4y2Ba= 5)。(gydF4y2BaegydF4y2Ba)血浆胰岛素水平在30分钟和15分钟后葡萄糖加载(μg lgydF4y2Ba−1gydF4y2Ba)(gydF4y2BangydF4y2Ba= 5)。(gydF4y2BafgydF4y2Ba)胰岛素抵抗指数由相乘的AUC AUC血糖的胰岛素。数据提出了均值±s.e.m。数据与‘*’明显不同(gydF4y2BaP
肠道微生物群转移部分复制表型gydF4y2Ba
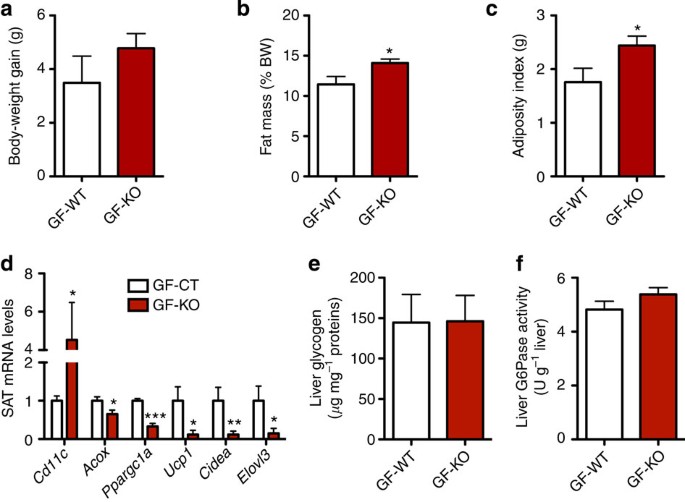
是否改变肠道微生物群组成cKO老鼠是一个因果因素,或代谢的结果,表型观察和进一步阐明肠道微生物群组成是否深刻的转变中观察到cKO老鼠可能导致表型,我们转移到肠道微生物群body-weight-matched WT或cKO老鼠到无菌(GF)受体小鼠。捐助者和接受者都保存在CT的饮食。4周后,我们发现肠道微生物群从cKO捐助者显著增加脂肪量增加和肥胖指数(笔的重量不同的脂肪组织仓库)(gydF4y2Ba图9 b, cgydF4y2Ba)。有一个趋势增加总体重增加但这并未达到统计学意义(gydF4y2Ba图9gydF4y2Ba)。我们发现从cKO小鼠肠道微生物增加脂肪组织炎症(增加gydF4y2BaCd11cgydF4y2Ba信使rna水平,gydF4y2Ba图9 dgydF4y2Ba)和显著减少标记β-oxidation和布朗宁(gydF4y2BaAcoxgydF4y2Ba,gydF4y2BaPpargc1agydF4y2Ba,gydF4y2BaCideagydF4y2Ba,gydF4y2BaElovl3gydF4y2Ba,gydF4y2BaUcp1gydF4y2Ba- - - - - -gydF4y2Ba图9 dgydF4y2Ba)。调查如果肠道微生物群的转移也可能影响胰岛素敏感性,我们分析gydF4y2BaSlc2a4gydF4y2Ba(GLUT4)表达在皮下脂肪组织(坐)和肌肉和glucose-6-Phosphatase (gydF4y2BaG6pcgydF4y2Ba)表达在肝脏和发现的微生物群转移cKO老鼠并不影响这些参数。此外,微生物群转移并没有改变肝糖原含量也G6Pase活动(gydF4y2Ba图9 e, fgydF4y2Ba)。因此,这些结果表明,肠道微生物群转移足以迅速繁殖的表型观察到脂肪组织gydF4y2BaNapepldgydF4y2Ba删除老鼠(即脂肪增益和褐变),而对葡萄糖代谢的影响尚未观察到。在一起,抗生素暴露和微生物群转移后的结果证实所发挥的关键作用肠道微生物群在塑造主持人表型和演示的关键影响脂肪组织NAPE-PLD肠道微生物群。gydF4y2Ba
(gydF4y2Ba一个gydF4y2Ba)体重增加(g)后肠道微生物群转移到无菌鼠(gydF4y2BangydF4y2Ba= 7)。(gydF4y2BabgydF4y2Ba)脂肪重量百分比的体重后肠道微生物群转移到无菌鼠(%;gydF4y2BangydF4y2Ba= 7)。(gydF4y2BacgydF4y2Ba)肥胖指数(g)后肠道微生物群转移到无菌鼠(gydF4y2BangydF4y2Ba= 7)。(gydF4y2BadgydF4y2Ba)mRNA的表达gydF4y2BaCd11cgydF4y2Ba,gydF4y2BaAcoxgydF4y2Ba,gydF4y2BaPpargc1agydF4y2Ba,gydF4y2BaUcp1gydF4y2Ba,gydF4y2BaCideagydF4y2Ba和gydF4y2BaElovl3gydF4y2Ba在坐gydF4y2BangydF4y2Ba= 7)。(gydF4y2BaegydF4y2Ba)肝糖原含量(每毫克μg蛋白质;gydF4y2BangydF4y2Ba= 7)。(gydF4y2BafgydF4y2Ba)肝脏G6Pase活动(U / g肝脏;gydF4y2BangydF4y2Ba= 7)。数据提出了均值±s.e.m。数据与*gydF4y2BaP
讨论gydF4y2Ba
ECS及其相关生物活性脂质如na能量稳态的调控中起着关键作用。在本文中,我们发现了欧洲央行的重要作用合成的酶NAPE-PLD在脂肪组织(总结gydF4y2Ba图10gydF4y2Ba)。老鼠缺乏gydF4y2BaNapepldgydF4y2Ba基因在脂肪组织容易肥胖和代谢紊乱有关。值得注意的是,cKO小鼠的表型发展生理状态(即CT饮食)。这表明NAPE-PLD基础代谢的调节中起着重要的作用,能量体内平衡和炎症。令人惊讶的是,gydF4y2BaNapepldgydF4y2Ba删除老鼠HFD下有更高的体重和胰岛素抵抗指数,而其他不加剧了这种病态条件下代谢参数。因为脂肪组织的水平na WT, cKO老鼠在HFD之间是相似的,这或许可以解释为什么我们不观察增加炎症和HFD下改变脂质代谢。尽管如此,gydF4y2BaNapepldgydF4y2Ba删除将脂肪组织分化时有效完成,因此之前HFD治疗的开始。因此增加体重增加,胰岛素抵抗可能直接归因于gydF4y2BaNapepldgydF4y2Ba删除而其他代谢的改变可能是由于长期减少na。gydF4y2Ba
使用不同的方法(微阵列,qPCR和组织学),我们认为cKO老鼠发展明显炎症。这种表型可能通过不同的机制来解释,包括这一事实gydF4y2BaNapepldgydF4y2Ba删除抗炎豌豆的水平下降。事实上,豌豆前面已被确认为抗炎作用的生物活性脂质gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba29日gydF4y2Ba。此外,改变监管的几个后卫,磷脂、磷脂质、二十烷类可能导致改变炎症通路的调控gydF4y2Ba30.gydF4y2Ba。有趣的是,它已经表明,炎症刺激如有限合伙人可以减少gydF4y2BaNapepldgydF4y2Ba在RAW264.7巨噬细胞表达和豌豆生产gydF4y2Ba31日gydF4y2Ba。这些gydF4y2Ba在体外gydF4y2Ba数据,我们一起gydF4y2Ba在活的有机体内gydF4y2Ba发现,支持NAPE-PLD的作用在调节正常的炎症反应。gydF4y2Ba
ECS起着重要的作用在调节葡萄糖体内平衡gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba。因此,我们的研究结果表明脂肪组织的影响gydF4y2BaNapepldgydF4y2Ba葡萄糖代谢。扰动的葡萄糖稳态与脂肪组织炎症gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba在我们的模型中,这表明炎症发展导致的观察葡萄糖和胰岛素抵抗。我们还发现,胰岛素抵抗主要发生在肝脏而不是骨骼肌和脂肪组织。然而,我们不能排除,胰岛素抵抗可能影响这些器官在稍后的时间自磷酸化IRβ也显著影响骨骼肌和有一个重要的趋势减少IRβinsulin-induced磷酸化的脂肪组织。因此,胰岛素抵抗的具体动力的发展需要进一步调查。gydF4y2Ba
此外,我们发现gydF4y2BaNapepldgydF4y2Ba删除在脂肪组织会导致循环标签和胆固醇水平,增加潜在干扰脂质代谢。进一步阐明NAPE-PLD产生的机制与生物活性脂质和其他脂质候选人在炎症和胰岛素抵抗中发挥重要作用,我们进行了彻底lipidomic分析,包括神经酰胺、二十烷类和动力。磷脂质炎症与胰岛素抵抗gydF4y2Ba37gydF4y2Ba。此外,最近的一项研究报告长链磷脂质间的直接联系,央行在肝脏和胰岛素的行动gydF4y2Ba38gydF4y2Ba。有趣的是我们发现cKO的老鼠表现出水平的提高长链脂肪组织磷脂质,建议改变美国生产脂肪组织可能会影响神经酰胺水平和随后导致其他代谢紊乱。欧洲央行和类二十烷酸代谢密切相关gydF4y2Ba17gydF4y2Ba,gydF4y2Ba39gydF4y2Ba。类花生酸和PG合成通过COX通路从花生四烯酸(AA),也可代谢央行gydF4y2Ba39gydF4y2Ba。此外,在cKO-CT老鼠,我们发现一个upregulation几个基因参与调节炎症和免疫以及生物活性脂质代谢(gydF4y2BaAlox5ap, Pla2g5gydF4y2Ba和gydF4y2BaPlce1gydF4y2Ba;gydF4y2Ba图5gydF4y2Ba)。相比之下,我们观察到减少二十烷类和PG cKO老鼠的脂肪组织以及HFD-treated老鼠的脂肪组织,增加这些炎性脂质介质是可以预料的gydF4y2Ba22gydF4y2Ba。然而,最近的数据表明,这些脂质可能出现赞成和消炎作用根据病理情况。另一方面,PG金融衍生品可以是合成了央行通过COX2通路的新陈代谢,导致PG-glycerol酯或PG-ethanolamides的形成,起到抗炎作用gydF4y2Ba40gydF4y2Ba,gydF4y2Ba41gydF4y2Ba。此外,这些生物活性脂质可能充当resolvin,从而导致了复杂的解决炎症gydF4y2Ba30.gydF4y2Ba。在PGD是否下降gydF4y2Ba2gydF4y2Ba和铂族元素gydF4y2Ba2gydF4y2Ba观察到的调制有助于这些复杂交互需要进一步调查。最后,AA水平不变cKO-CT老鼠和HFD下减少而WT-CT老鼠(gydF4y2Ba补充图7gydF4y2Ba)。全球改变血脂中观察到我们的模型表明,底物的减少水平(AA)或许可以解释为什么后卫并不增加。综上所述,这些数据的影响阐明NAPE-PLD在脂肪组织和生物活性脂质水平明显改变脂肪组织脂质代谢在我们的小鼠模型。此外,我们发现水平的提高午睡(na前体,gydF4y2Ba补充图2gydF4y2Ba)在cKO小鼠脂肪组织与WT老鼠相比,确认在以前的研究中获得的数据gydF4y2Ba4gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba21gydF4y2Ba。这些脂质也可以潜在贡献者所示的表型观察一些午睡一直以来存在代谢特性,即能源体内平衡gydF4y2Ba42gydF4y2Ba。然而,这句话在我们的模型需要进一步调查。gydF4y2Ba
cKO老鼠也会展出mRNA水平的下降gydF4y2BaUcp1gydF4y2Ba和其他富含棕色脂肪的基因,如gydF4y2BaCideagydF4y2Ba和gydF4y2BaPpargc1agydF4y2Ba,在他们窟,这表明他们的脂肪组织失去了产热的潜力。这一发现进一步支持的微阵列分析,这表明减少相关的几个基因的表达通常棕色/米色脂肪细胞,如Eva1(也称为髓鞘蛋白的0 2,gydF4y2BaMpzl2gydF4y2Ba)和线粒体基因gydF4y2BaCox7a1gydF4y2Ba和gydF4y2BaCox8bgydF4y2Ba。它最近建议一个子集坐存款可以激活脂肪细胞的产热的项目,即米色或闪亮细胞gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba。动物缺乏功能性米色细胞培养肥胖,结合大量增加存款gydF4y2Ba45gydF4y2Ba。值得注意的是,我们观察到10多个基因参与这些代谢过程的监管没有NAPE-PLD有显著影响。根据这些观察,我们建议增加脂肪量发展与脂肪组织的改变褐变过程和降低开发能力正常的产热的计划。有趣的是,微阵列的差别分析还揭示了对这些gydF4y2BaFabp3gydF4y2Ba和线粒体脂肪酸氧化基因,如gydF4y2BaAcss1gydF4y2Ba,gydF4y2BaAcsl5gydF4y2Ba和gydF4y2BaCpt1bgydF4y2Ba。这些酶被发现调节寒冷暴露或β-adrenergic刺激后,则联系窟的转换gydF4y2Ba46gydF4y2Ba。可能会进一步反映β-oxidation减少由于差别他们对这些损失的BAT-characteristics窟。这个缺陷在β-oxidation可能导致流通的脂质水平升高的。此外,药理CB的封锁gydF4y2Ba1gydF4y2Ba受体诱发蝙蝠生热作用的激活与增强葡萄糖和脂质利用率gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba最近,《奥亚报》现已涉及老鼠β-adrenergic-mediated生热作用的增强gydF4y2Ba49gydF4y2Ba,连接ECS和生热作用。在我们的模型中,观察到的改变脂质代谢改变有关褐变过程。例如,铂族元素gydF4y2Ba2gydF4y2Ba最近被认定为一个重要的监管机构的white-to-brown脂肪生成gydF4y2Ba50gydF4y2Ba和减少铂族元素gydF4y2Ba2gydF4y2Ba窟中观察到的水平可能会因此参与减少褐变。进一步探索的影响gydF4y2BaNapepldgydF4y2Ba删除在褐变过程中,我们接触cKO WT老鼠寒冷暴露和发现gydF4y2BaNapepldgydF4y2Ba删除老鼠显然存在诱导的改变诱使褐变过程。这个过程似乎是由于gydF4y2BaNapepldgydF4y2Ba删除独立以来同情驱动器的脂肪组织外植体从cKO捐助者往往开发相同的表型。总的来说,这些数据清楚地表明,脂肪组织NAPE-PLD是能量的一种关键酶参与调节体内平衡调节的褐变过程。然而,因果关系的影响gydF4y2BaNapepldgydF4y2Ba删除褐变过程的优点进一步调查以确定直接影响褐变,独立于一个热损失的机制或交感神经系统的激活gydF4y2Ba27gydF4y2Ba。gydF4y2Ba
使用454 -焦磷酸测序,我们发现,改变美国在脂肪组织合成深刻改变了肠道微生物群组成。例如,属gydF4y2Ba乳酸菌gydF4y2Ba和gydF4y2BaAllobaculumgydF4y2Ba减少在cKO-CT老鼠而WT-CT老鼠(gydF4y2Ba补充表5gydF4y2Ba)。我们以前报道,HFD喂养降低了大量的gydF4y2BaAllobaculumgydF4y2Ba这个属,而益生元增加;减少脂肪,代谢和炎症gydF4y2Ba枸杞多糖gydF4y2Ba信使rna表达;并增加胰岛素敏感性gydF4y2Ba24gydF4y2Ba。同样的,丰富的gydF4y2BaAllobaculumgydF4y2Ba增加与小檗碱喂养的老鼠,防止肥胖和胰岛素抵抗在HFD治疗gydF4y2Ba51gydF4y2Ba。几株gydF4y2BaLactobacillugydF4y2Bas是常用的益生菌gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba。因此,不是不能想像的的影响gydF4y2BaNapepldgydF4y2Ba删除在脂肪组织产生代谢变化与假定的肠道微生物的代谢功能。我们还观察到一个明显的影响HFD治疗肠道微生物群组成,证实了先前公布的数据gydF4y2Ba24gydF4y2Ba。此外,gydF4y2BaNapepldgydF4y2Ba删除会导致增加门户有限合伙人,暗示一种改变肠道屏障功能gydF4y2Ba54gydF4y2Ba。我们因此假定减少生产na的脂肪组织会影响肠道微生物群和肠道屏障功能gydF4y2Ba14gydF4y2Ba。gydF4y2Ba
用抗生素治疗cKO老鼠和肠道微生物从cKO转移和WT老鼠GF收件人,我们可以展示的贡献肠道微生物群的表型观察cKO老鼠。这些结果承认肠道微生物群的一个重要的角色,似乎是独立于体重,adipocyte-specificgydF4y2BaNapepldgydF4y2Ba删除导致HFD条件下获得不同的肠道微生物群组成,以及转移的肠道微生物群body-weight-matched捐助者能充分有效地转移表型的一部分。然而,我们可能不完全排除补充体重和协会的肠道微生物群调制以来长期抗生素治疗减少体重和改善葡萄糖稳态cKO老鼠。要注意,只有4周随访肠道微生物群的转移(相比之下,8周后gydF4y2Ba在活的有机体内gydF4y2Ba研究)足以重现表型的部分原因。相反,胰岛素敏感性和葡萄糖耐量或许尚未影响4周后肠道微生物群转移小鼠模型,而是观察长期调制后肠道微生物群(也就是说,抗生素治疗)。同时,是否一个或几个特定的肠道微生物造成这一表型需要进一步调查。gydF4y2Ba
总之,我们的研究强调了脂肪组织美国合成途径的重要贡献,全身能量代谢和生理机能。没有这个功能合成通路的基础状态,老鼠发展肥胖,脂肪组织炎症、胰岛素抵抗,葡萄糖耐受不良和扰动的脂质代谢。这种表型改变部分介导的肠道微生物群组成和褐变的改变计划(gydF4y2Ba图10gydF4y2Ba)。综上所述,这些数据背后的组织差异的重要性ECS的规定,特别强调脂肪组织。gydF4y2Ba
方法gydF4y2Ba
老鼠gydF4y2Ba
代的脂肪组织Napepld cKO老鼠gydF4y2Ba。脂肪组织gydF4y2BaNapepldgydF4y2Ba删除老鼠老鼠(cKO)生成的跨越老鼠轴承gydF4y2BaCregydF4y2Ba重组酶表达的控制下gydF4y2BaFabp4gydF4y2Ba启动子(gydF4y2BaFabp4-CregydF4y2Ba)(C57BL / 6背景,杰克逊实验室,巴尔港,我,美国)窝藏老鼠gydF4y2BaloxPgydF4y2Ba在gydF4y2BaNapepldgydF4y2Ba等位基因。gydF4y2BaNapepldgydF4y2Ba液态氧小鼠生成的如前所述gydF4y2Ba55gydF4y2Ba。删除是有效当脂肪组织达到成熟和老鼠出生在正常孟德尔比率。gydF4y2Ba
所有老鼠实验是批准和执行按照当地伦理委员会的指导方针为动物保健卫生部门的伦敦大学学院教授的监督下f . Lemaigre和JP Dehoux教授和特定数量2010 /伦敦/ MD / 022。住房条件是比利时法律规定2013年5月29日关于保护实验动物(协议号LA1230314)。gydF4y2Ba
cKO实验gydF4y2Ba。群8-week-old男性cKO老鼠和WT的同胞被安置在组每个笼子里的两只老鼠(filter-top笼子)免费的食物和水。老鼠采用CT (AIN93Mi,研究饮食)或HFD(60%的脂肪,D12492,研究饮食)。治疗持续了8周。这个实验是独立进行三次。控制老鼠WT同窝出生的庇护gydF4y2BaNapepld loxPgydF4y2Ba在等位基因而不是gydF4y2BaCregydF4y2Ba重组酶。体重、食物摄取和水消费记录一周一次。身体成分是评估每周使用7.5 mhz时域NMR (TD-NMR) (LF50 Minispec,力量,Rheinstetten,德国)。gydF4y2Ba
7周的治疗后,进行OGTT如前所述在自由移动的老鼠gydF4y2Ba25gydF4y2Ba,gydF4y2Ba32gydF4y2Ba。分析胰岛素信号通路,老鼠收到5 U胰岛素(Actrapid;丹麦诺和诺德公司A / S)麻醉(Queenborough Forene异氟烷,雅培,肯特郡英格兰),或同等体积的PBS进入门静脉分析信号响应胰岛素。注射三分钟后,老鼠死亡,肝脏,坐和腓肠肌骨骼肌快速切割。gydF4y2Ba
在治疗结束时,老鼠与异氟烷麻醉后6小时禁食时期。门户和静脉静脉血液采集样本进行进一步分析。放血后,老鼠被颈椎错位。组织是精确的解剖,称重和立即snap-frozen NgydF4y2Ba2gydF4y2Ba并存储在−80°C进行进一步分析。gydF4y2Ba
寒冷暴露实验gydF4y2Ba。群8-week-old男性cKO老鼠和WT同窝出生长大在室温下标准住房条件(filter-top笼子)10周的免费获取食物和水。老鼠CT的饮食(AIN93Mi研究饮食,新布伦瑞克,新泽西州,美国)。体重、食物摄取和水消费记录一周一次。身体成分是评估每周使用7.5 mhz TD-NMR。10周后随访,两组年龄和身体weight-matched cKO WT小鼠分离和单独住。一半的动物从每个基因型被转移到一个寒冷的房间在8°C,而另一半保持在室温下(gydF4y2BangydF4y2Ba= 7 - 9 /组)。老鼠在白天禁食期和美联储gydF4y2Ba随意gydF4y2Ba在夜间。老鼠在寒冷的房间为72 h和18 h后适应在寒冷的房间里,体温监测与直肠探头在不同间隔两天(RET-3,世界精密仪器,阿斯顿斯蒂夫尼奇,英国)。72 h后,所有老鼠都牺牲了如上所述。gydF4y2Ba
抗生素治疗实验gydF4y2Ba。群8-week-old C57 / Bl6女性cKO老鼠住在2或3组小鼠/笼(filter-top笼子)免费的食物和水。12周的老鼠CT的饮食。一半的老鼠(gydF4y2BangydF4y2Ba每组= 5)接受抗生素(1.0 g lgydF4y2Ba−1gydF4y2Ba氨苄青霉素(σ,圣路易斯,密苏里州)和0.5 g lgydF4y2Ba−1gydF4y2Ba新霉素(σ))在他们的饮用水在实验期间gydF4y2Ba14gydF4y2Ba。体重记录一周一次。身体成分是评估每周使用7.5 mhz TD-NMR。11周后,进行OGTT如上所述。随访12周后,小鼠死亡如上所述。gydF4y2Ba
肠道微生物群移植实验gydF4y2Ba。3 cKO老鼠和3 WT的盲肠的内容同窝出生(体重匹配)移植到老鼠14 GF (7-week-old Swiss-Webster男性,泰康利,哈德逊,纽约,美国)如前所述gydF4y2Ba56gydF4y2Ba。每个捐赠者被用来移植两个或三个女朋友。每个盲肠的样本(150毫克)在厌氧室取样,悬浮在PBS(1.5毫升/盲肠)。盲肠的内容然后立即接种(0.15毫升/鼠标)女朋友老鼠。GF老鼠单独住在通风的笼子里(Tecnilab-BMI,印度河流域文明AERO GM500 Someren、荷兰)和美联储CT饮食为4周。体重、食物摄取和水消费记录一周一次。身体成分是评估每周使用7.5 mhz TD-NMR。4周随访后,老鼠杀了如上所述。gydF4y2Ba
胰岛素抵抗指数gydF4y2Ba
血浆胰岛素浓度测定在等离子体从尾巴血液收集OGTT使用酶联免疫试剂盒(Mercodia,乌普萨拉,瑞典)根据制造商的指示。胰岛素抵抗指数由曲线下的面积相乘的血糖(−30到120分钟)和血浆胰岛素(−30到15分钟)从OGTT获得。gydF4y2Ba
RNA提取和实时qPCR分析gydF4y2Ba
从组织总RNA制备使用TriPure试剂(罗氏)。的量化和完整性分析总RNA进行了通过运行1μl每个样本的安捷伦2100生物分析仪(安捷伦RNA 6000纳米装备,安捷伦)。互补DNA是由逆转录和实时qPCR如前所述gydF4y2Ba24gydF4y2Ba。gydF4y2BaRPL19gydF4y2BaRNA被选为看家基因。引物序列中提供gydF4y2Ba补充表2gydF4y2Ba。gydF4y2Ba
微阵列分析gydF4y2Ba
等量的RNA从五个老鼠每组每组内汇集。微阵列进行如前所述gydF4y2Ba57gydF4y2Ba。老鼠基因圣微阵列芯片被用于杂交(MoGene第1.0,Affymetrix)。WT表达式工具包(Ambion)是用于补充总RNA的RNA制备。杂交、清洗和扫描是根据Affymetrix套件和程序特定于鼠标ST基因芯片。扫描后,杂交的质量控制检查使用Affymetrix基因表达控制台软件。使用Affymetrix APT套件工具,我们RMA-Sketch规范化数据的过程,计算信号检测gydF4y2BaPgydF4y2Ba值使用DABG算法。所有的探针集DABGgydF4y2BaPgydF4y2Ba值> 0.05的所有条件都丢弃的分析。其余的探针集都叠化分析。功能注释和路径分析是使用大卫web工具完成的gydF4y2Ba58gydF4y2Ba。工具都是美联储的列表选择官方基因名称作为输入,和意义是默认设置的阈值gydF4y2BaPgydF4y2Ba值< 0.05。gydF4y2Ba
DNA分离小鼠盲肠的样品和qPCR和测序gydF4y2Ba
盲肠的内容收集和保存冻结在−80°C到使用。宏基因组DNA从使用QIAamp盲肠的内容中提取DNA凳子mini-kit(试剂盒、希尔登,德国)根据制造商的指示。细菌的V1-V3地区16 s rRNA放大使用编码基因引物27 f - 534 r (ref。gydF4y2Ba59gydF4y2Ba)和高通量测序结果分析了纯化扩增子的罗氏FLX基因组定序器使用钛化学(DNAVision, Gosselies,比利时)。结果读取处理通过QIIME v1.7.0管道gydF4y2Ba60gydF4y2Ba。丰富的识别和未分类类群后改变了使用车辆疾驰的方法去除类群代表<总丰度的0.01%。主坐标分析使用加权UniFrac距离计算。操作分类单位被确定使用uclust共识分类法分类器阈值对绿色煤电0.97数据库。系统发育树生成使用QIIME 1.7.0和可视化使用iTOL v2.2.2。gydF4y2Ba
sds - page及免疫印迹gydF4y2Ba
总溶解产物,组织与TissueLyser II(试剂盒)均质里帕缓冲区gydF4y2Ba61年gydF4y2Ba补充鸡尾酒的蛋白酶抑制剂(σ)和磷酸酶抑制剂。等量的蛋白质被sds - page分离和转移到硝化纤维膜。检测蛋白质的胰岛素途径、组织均质在ERK缓冲区(Triton x - 100 0.1%,消息灵通的50 mM,氯化钠5 M,甘油10%,MgClgydF4y2Ba2gydF4y2Ba1.5毫米和德勤1毫米)补充了蛋白酶抑制剂和磷酸酶抑制剂的鸡尾酒。一夜之间,膜被孵化在4°C以下抗体稀释Tris-buffered盐水tween-20包含1%脱脂奶粉:NAPE-PLD (1:200;ab95397 Abcam,剑桥,妈,美国),p-IRβ(1:1,000;sc - 25103,圣克鲁斯、钙、美国),p-AktgydF4y2BaThr308gydF4y2Ba(1:1,000;# 2965 l,细胞信号,丹佛,美国马)和p-AktgydF4y2BaSer473gydF4y2Ba(1:1,000;# 4060 l,细胞信号)。量化的phospho-proteins进行每组六个动物胰岛素注射。加载控制β-actin (1:10,000;ab6276)或β-tubulin对于骨骼肌(1:800;sc - 9104)。完整的未编辑的墨迹中可用gydF4y2Ba补充图8gydF4y2Ba。gydF4y2Ba
组织学分析和免疫组织化学gydF4y2Ba
组织固定在4%的甲醛。苏木精和伊红染色使用标准协议执行5-μm脂肪组织部分。脂肪细胞大小(苏木精和eosin-stained部分)、巨噬细胞浸润(F4/80: ab6640 Abcam)和UCP1染色(ab23841, Abcam)测定使用ImageJ(版本1.48 r、美国国立卫生研究院的贝塞斯达,马里兰州,美国)。gydF4y2Ba
脂肪细胞和SVF分离gydF4y2Ba
约150 - 300毫克的坐存款被切割,切成小块,用胶原酶消化(罗氏)15分钟37°C。消化组织过滤和离心1分钟的400克。包含SVF infranatant和上层清液含脂肪细胞被洗了三次Krebs-BSA1%解决方案和存储在Tripure−80°C试剂(罗氏)进一步RNA的提取。gydF4y2Ba
原发性腹膜巨噬细胞隔离gydF4y2Ba
小鼠腹腔巨噬细胞是通过诱发急性腹腔注射thioglycolate周围炎症反应gydF4y2Ba62年gydF4y2Ba。孤立的主要巨噬细胞在37°C孵化4 h,用PBS洗净,然后冻结在Tripure试剂进一步RNA的提取。gydF4y2Ba
脂肪组织移植组织文化gydF4y2Ba
小鼠皮下脂肪仓库从20 (10 WT 10 cKO老鼠和老鼠)精确切割,和所有可见的血管,粒子和连接组织被移除。脂肪组织是然后切成小块(4毫米gydF4y2Ba3gydF4y2Ba),每个基因型和集中放入柠檬酸缓冲(pH值7.4)含有0.5% (w / v)脂肪无酸的BSA,青霉素和链霉素(1:10 0)和二性霉素b(1:10 0)(表达载体)。总共200毫克脂肪组织在PBS和孵化冲洗100毫米培养皿包含10毫升αMEM(表达载体)补充0.5% (w / v)脂肪无酸的BSA,青霉素和链霉素(1:10 0)和二性霉素b (1:10 0)。所有条件都重复在六个不同的菜。菜讲究的是24小时在37°C公司5%gydF4y2Ba2gydF4y2Ba的气氛。基葡萄糖浓度的新媒体是5更易与lgydF4y2Ba−1gydF4y2Ba。在实验的最后,脂肪物质收集并立即在液态氮冷冻,并存储在−80°C到随后的mRNA分析。gydF4y2Ba
生化分析gydF4y2Ba
循环瘦素决定使用多路复用免疫(默克密理博,布鲁塞尔,比利时)和测量使用Luminex技术(Bioplex, Bio-Rad,比利时)后,制造商的指示。gydF4y2Ba
对于肝脏G6Pase活动,肝组织均质在裂解缓冲(消息灵通的20毫米,蔗糖250 mM,氯化钾10 mM, MgClgydF4y2Ba2gydF4y2Ba1.5毫米,EDTA 1毫米和德勤1毫米),用释放膜结合G6Pase。匀浆分别被孵化与20毫米G6P(σ)或20毫米β-glycerophosphate(σ)来衡量非特异性磷酸酶活性。无机磷酸盐化验在每个条件在时间0和10分钟孵化37°C。G6Pase活动是由计算特定G6Pase-phosphate释放如前所述gydF4y2Ba63年gydF4y2Ba。gydF4y2Ba
肝糖原含量的测量,肝脏在氢氧化钠(1米)和消化消化停止了盐酸(1米)。消化肝脏被稀释在乙酸钠(1:4卷/期)unsupplemented或补充淀粉转葡糖苷酶(50 U mlgydF4y2Ba−1gydF4y2Ba;默克密理博)和孵化55°C 1 h将糖原转化为葡萄糖。释放葡萄糖是上帝量化使用葡萄糖FS(动画诊断和系统、Holzheim德国)根据制造商的指示。gydF4y2Ba
等离子体non-esterified脂肪酸,胆固醇和甘油三酯浓度测量使用工具包耦合与分光光度检测反应的一种酶反应产物(动画诊断和系统)根据制造商的指示。gydF4y2Ba
门户血浆LPS浓度测量使用Endosafe-MCS(查尔斯河实验室,里昂,法国)如前所述gydF4y2Ba64年gydF4y2Ba。gydF4y2Ba
Lipidomics分析gydF4y2Ba
Lipidomics进行合作Biocrates(奥地利因斯布鲁克)。生物种类最丰富的磷脂,磷脂质和类花生酸定量分析了大规模流动注射电喷射ionization-tandem质谱谱/ MS)检测方法或HPLC-MS /女士(质/ MS)。gydF4y2Ba
测量的央行和午睡的水平gydF4y2Ba
组织在CHCl均质gydF4y2Ba3gydF4y2Ba(10毫升),然后甲醇(5毫升),HgydF4y2Ba2gydF4y2BaO(2.5毫升)和盐酸2 N被剧烈的混合添加和脂质提取。有机层是恢复和干下NgydF4y2Ba2gydF4y2Ba。由此产生的脂质分数是由固相萃取pre-purified二氧化硅,并与CHCl午睡被筛选了gydF4y2Ba3gydF4y2Ba甲醇(6:4,v / v)。分析了由此产生的脂质分数HPLC-MS使用LTQ Orbitrap质谱仪(热费希尔科学、沃尔瑟姆,妈,美国)耦合Accela高效液相色谱系统(热费希尔科学)。分析物的分离是通过使用一个C-18 Kinetex C-18列(5μm, 4.6×150毫米;Phenomenex,荷兰乌得勒支)和C-18 pre-column。A和B是由MeOH-H移动阶段gydF4y2Ba2gydF4y2BaO-NHgydF4y2Ba4gydF4y2Ba哦(75:25:0.1,v / v / v)和MeOH-NHgydF4y2Ba4gydF4y2Ba哦(100:0.1,v / v),分别。梯度(0.5毫升分钟gydF4y2Ba−1gydF4y2Ba)如下:在15分钟从100%到100%,其次是10分钟100% B和后续re-equilibration A 100%在负模式进行质谱分析用ESI源。欧洲央行的测量产生的如前所述gydF4y2Ba32gydF4y2Ba,数据标准化组织样本的重量。gydF4y2Ba
统计分析gydF4y2Ba
数据表示为均值±s.e.m。组之间的差异评估使用单向方差分析(方差分析),其次是图基gydF4y2Ba因果gydF4y2Ba测试。双向方差分析分析与Bonferonni测试后的演变进行了重复测量体重,脂肪量和glycaemia OGTT。数据分析使用GraphPad Prism 5.00版本Windows (GraphPad软件、圣地亚哥、钙、美国)。数据用不同的上标字母或符号是明显不同的gydF4y2BaP
额外的信息gydF4y2Ba
加入代码:gydF4y2Ba微阵列数据存入GEO下加入代码gydF4y2BaGSE56852gydF4y2Ba。gydF4y2Ba
本文引用:gydF4y2Ba吉尔茨,L。gydF4y2Ba等gydF4y2Ba。脂肪组织NAPE-PLD控制脂肪量发展通过改变褐变过程中,肠道微生物群。gydF4y2BaCommun Nat。gydF4y2Ba6:6495 doi: 10.1038 / ncomms7495 (2015)。gydF4y2Ba
加入代码gydF4y2Ba
引用gydF4y2Ba
Muccioli, g . g .神经生物合成和失活,从简单到复杂。gydF4y2Ba药物。今天gydF4y2Ba15gydF4y2Ba,474 - 483 (2010)。gydF4y2Ba
卷:&泰勒,d . a . Anandamide政府在老鼠腹内侧下丘脑刺激食欲。gydF4y2BaBr。j .杂志。gydF4y2Ba134年gydF4y2Ba,1151 - 1154 (2001)。gydF4y2Ba
汉森h . s . & Diep t . a . N-acylethanolamines anandamide和食物摄入量。gydF4y2Ba物化学。杂志。gydF4y2Ba78年gydF4y2Ba,553 - 560 (2009)。gydF4y2Ba
梁,D。,Saghatelian, A., Simon, G. M. & Cravatt, B. F. Inactivation of N-acyl phosphatidylethanolamine phospholipase D reveals multiple mechanisms for the biosynthesis of endocannabinoids.生物化学gydF4y2Ba45gydF4y2Ba,4720 - 4726 (2006)。gydF4y2Ba
Di Marzo诉内源性大麻素:合成和降解。gydF4y2Ba启杂志。物化学。杂志。gydF4y2Ba160年gydF4y2Ba- 24 (2008)。gydF4y2Ba
Ryberg、大肠等。孤儿受体GPR55是一种新型的大麻素受体。gydF4y2BaBr。j .杂志。gydF4y2Ba152年gydF4y2Ba,1092 - 1101 (2007)。gydF4y2Ba
瞧Verme, j . et al .核受体的过氧物酶体proliferator-activated receptor-alpha介导palmitoylethanolamide的抗炎作用。gydF4y2Ba摩尔。杂志。gydF4y2Ba67年gydF4y2Ba15 - 19 (2005)。gydF4y2Ba
赛义德·s . k . et al。与endocannabinoid-like脂质GPR119受体活动的监管。gydF4y2Ba点。j .杂志。性。金属底座。gydF4y2Ba303年gydF4y2BaE1469-E1478 (2012)。gydF4y2Ba
Hoareau, l . et al . palmitoylethanolamide对人体脂肪细胞的抗炎作用。gydF4y2Ba肥胖(SilverSpring)gydF4y2Ba17gydF4y2Ba,431 - 438 (2009)。gydF4y2Ba
埃斯波西托,g . et al . Palmitoylethanolamide提高结肠炎症通过肠神经胶质/ toll样受体4-dependent PPAR-alpha激活。gydF4y2Ba肠道gydF4y2Ba63年gydF4y2Ba,1300 - 1312 (2014)。gydF4y2Ba
西蒙,通用汽车& Cravatt b.f.表征的老鼠缺乏候选人n -乙醇胺生物合成的酶提供了多个通路的证据,有助于神经的生产gydF4y2Ba在活的有机体内gydF4y2Ba。gydF4y2Ba摩尔。Biosyst。gydF4y2Ba6gydF4y2Ba,1411 - 1418 (2010)。gydF4y2Ba
冷冻,S。,Oakhill, J. S. & Steinberg, G. R. Adipose tissue as an endocrine organ.摩尔。细胞性。gydF4y2Ba316年gydF4y2Ba,129 - 139 (2010)。gydF4y2Ba
Lafontan, m .脂肪组织和脂肪细胞失调。gydF4y2Ba糖尿病金属底座。gydF4y2Ba40gydF4y2Ba16-28 (2014)。gydF4y2Ba
Muccioli, g . g . et al .神经系统链接肠道微生物群的脂肪形成。gydF4y2Ba摩尔。系统。医学杂志。gydF4y2Ba6gydF4y2Ba392 (2010)。gydF4y2Ba
吉尔茨,l . et al .改变肠道微生物群和神经系统在肥胖和糖尿病leptin-resistant老鼠:对组织apelin监管在脂肪组织的影响。gydF4y2Ba前面。Microbiol。gydF4y2Ba2gydF4y2Ba149 (2011)。gydF4y2Ba
D 'Eon, t . m . et al。脂肪细胞胰岛素抵抗的发病机制的作用与肥胖相关的内源性大麻素的海拔。gydF4y2Ba糖尿病gydF4y2Ba57gydF4y2Ba,1262 - 1268 (2008)。gydF4y2Ba
Silvestri, c . et al . Anandamide-derived prostamide F2alpha负调节脂肪形成。gydF4y2Ba生物。化学。gydF4y2Ba288年gydF4y2Ba,23307 - 23321 (2013)。gydF4y2Ba
森·m·a . et al .改变microrna的处理会破坏棕色/白色脂肪细胞与脂肪代谢障碍的决心和同事。gydF4y2Baj .中国。投资。gydF4y2Ba124年gydF4y2Ba,3339 - 3351 (2014)。gydF4y2Ba
李,刘贤美等。课程条件基因打靶小鼠脂肪组织。gydF4y2Ba糖尿病gydF4y2Ba62年gydF4y2Ba,864 - 874 (2013)。gydF4y2Ba
Mullican, s . e . et al。小说adipose-specific基因缺失模型演示了现有方法的潜在的缺陷。gydF4y2Ba摩尔。性。gydF4y2Ba27gydF4y2Ba,127 - 134 (2013)。gydF4y2Ba
Tsuboi, k . et al .酶形成N-acylethanolamines N-acylethanolamine缩醛磷脂通过N-acylphosphatidylethanolamine-hydrolyzing磷脂酶D-dependent和独立通路。gydF4y2BaBiochim。Biophys。学报gydF4y2Ba1811年gydF4y2Ba2011年,565 - 577。gydF4y2Ba
恐慌,c, d .前列腺素和白细胞三烯:类二十烷酸生物学的进步。gydF4y2Ba科学gydF4y2Ba294年gydF4y2Ba,1871 - 1875 (2001)。gydF4y2Ba
Moreno-Navarrete, j . m . et al .角色adipocyte-derived lipopolysaccharide-binding蛋白质在炎症和肥胖相关脂肪组织功能障碍。gydF4y2BaDiabetologiagydF4y2Ba56gydF4y2Ba,2524 - 2537 (2013)。gydF4y2Ba
埃弗拉德,a . et al .微生物prebiotic-treated老鼠揭示小说的目标参与宿主反应在肥胖。gydF4y2BaISME J。gydF4y2Ba8gydF4y2Ba,2116 - 2130 (2014)。gydF4y2Ba
Cani, p . d . et al .代谢内毒素发起肥胖和胰岛素抵抗。gydF4y2Ba糖尿病gydF4y2Ba56gydF4y2Ba,1761 - 1772 (2007)。gydF4y2Ba
罗森,大肠d & Spiegelman b . m .我们谈论当我们谈到脂肪。gydF4y2Ba细胞gydF4y2Ba156年gydF4y2Ba20-44 (2014)。gydF4y2Ba
奈德嘎德j . &大炮,b .白色脂肪组织的褐变:一些燃烧问题。gydF4y2Ba细胞金属底座。gydF4y2Ba20.gydF4y2Ba,396 - 407 (2014)。gydF4y2Ba
恩伯,p . J。Backhed F。,Fulton, L. & Gordon, J. I. Diet-induced obesity is linked to marked but reversible alterations in the mouse distal gut microbiome.细胞宿主细菌gydF4y2Ba3gydF4y2Ba,213 - 223 (2008)。gydF4y2Ba
Alhouayek, m . et al . N-Acylethanolamine-hydrolyzing酸酰胺酶抑制增加结肠N-palmitoylethanolamine水平和抵消小鼠结肠炎。gydF4y2Ba美国实验生物学学会联合会J。gydF4y2Ba29日gydF4y2Ba,650 - 661 (2015)。gydF4y2Ba
巴克利,c, D。,Gilroy, D. W. & Serhan, C. N. Proresolving lipid mediators and mechanisms in the resolution of acute inflammation.免疫力gydF4y2Ba40gydF4y2Ba,315 - 327 (2014)。gydF4y2Ba
朱,c . et al .炎性刺激控制N-acylphosphatidylethanolamine-specific磷脂酶D巨噬细胞中表达。gydF4y2Ba摩尔。杂志。gydF4y2Ba79年gydF4y2Ba,786 - 792 (2011)。gydF4y2Ba
吉尔茨,L。,Muccioli, G. G., Delzenne, N. M. & Cani, P. D. Chronic endocannabinoid system stimulation induces muscle macrophage and lipid accumulation in type 2 diabetic mice independently of metabolic endotoxaemia.《公共科学图书馆•综合》gydF4y2Ba8gydF4y2Bae55963 (2013)。gydF4y2Ba
李,Z。,Schmidt, S. F. & Friedman, J. M. Developmental role for endocannabinoid signaling in regulating glucose metabolism and growth.糖尿病gydF4y2Ba62年gydF4y2Ba,2359 - 2367 (2013)。gydF4y2Ba
Cani, p D。,吉尔茨,L。,Matamoros, S., Plovier, H. & Duparc, T. Glucose metabolism: Focus on gut microbiota, the endocannabinoid system and beyond.糖尿病金属底座。gydF4y2Ba40gydF4y2Ba,246 - 257 (2014)。gydF4y2Ba
韦伦医生,k . e . &格克汗。g . s .炎症、压力,和糖尿病。gydF4y2Baj .中国。投资。gydF4y2Ba115年gydF4y2Ba,1111 - 1119 (2005)。gydF4y2Ba
卖,H。,Habich, C. & Eckel, J. Adaptive immunity in obesity and insulin resistance.Nat,启性。gydF4y2Ba8gydF4y2Ba,709 - 716 (2012)。gydF4y2Ba
阿瑟,j . r . et al .抑制gydF4y2Ba新创gydF4y2Ba神经酰胺合成逆转食源性胰岛素抵抗及增强全身耗氧量。gydF4y2Ba糖尿病gydF4y2Ba59gydF4y2Ba,2453 - 2464 (2010)。gydF4y2Ba
Cinar, r . et al .肝cannabinoid-1受体调节食源性胰岛素抵抗增加长链神经酰胺的从头合成。gydF4y2Ba肝脏病学gydF4y2Ba59gydF4y2Ba,143 - 153 (2014)。gydF4y2Ba
Alhouayek, m & Muccioli g . g . COX-2-derived神经代谢物作为小说炎症介质。gydF4y2Ba趋势杂志。科学。gydF4y2Ba35gydF4y2Ba,284 - 292 (2014)。gydF4y2Ba
Alhouayek, M。,Masquelier, J., Cani, P. D., Lambert, D. M. & Muccioli, G. G. Implication of the anti-inflammatory bioactive lipid prostaglandin D2-glycerol ester in the control of macrophage activation and inflammation by ABHD6.Proc。《科学。美国gydF4y2Ba110年gydF4y2Ba,17558 - 17563 (2013)。gydF4y2Ba
布朗,k . L。,Davidson, J. & Rotondo, D. Characterisation of the prostaglandin E2-ethanolamide suppression of tumour necrosis factor-alpha production in human monocytic cells.Biochim。Biophys。学报gydF4y2Ba1831年gydF4y2Ba2013年,1098 - 1107。gydF4y2Ba
儿子Gillum,“m . p . et al . N-acylphosphatidylethanolamine肠道,导出循环因素引起的脂肪摄入,抑制食物摄取。gydF4y2Ba细胞gydF4y2Ba135年gydF4y2Ba,813 - 824 (2008)。gydF4y2Ba
吴,j . et al .米色脂肪细胞是不同类型的产热的脂肪细胞在老鼠和人类。gydF4y2Ba细胞gydF4y2Ba150年gydF4y2Ba,366 - 376 (2012)。gydF4y2Ba
你们l . et al .脂肪细胞直接感觉温度激活生热作用。gydF4y2BaProc。《科学。美国gydF4y2Ba110年gydF4y2Ba,12480 - 12485 (2013)。gydF4y2Ba
科恩,p . et al .消融PRDM16和米色脂肪会导致代谢障碍和内脏脂肪皮下开关。gydF4y2Ba细胞gydF4y2Ba156年gydF4y2Ba,304 - 316 (2014)。gydF4y2Ba
中村,Y。佐藤,T。,Shiimura, Y., Miura, Y. & Kojima, M. FABP3 and brown adipocyte-characteristic mitochondrial fatty acid oxidation enzymes are induced in beige cells in a different pathway from UCP1.物化学。Biophys。Commun >,gydF4y2Ba441年gydF4y2Ba42-46 (2013)。gydF4y2Ba
Bajzer, m . et al .大麻素受体1 (CB1)对抗增强葡萄糖利用率和激活棕色脂肪组织在食源性肥胖老鼠。gydF4y2BaDiabetologiagydF4y2Ba54gydF4y2Ba,3121 - 3131 (2011)。gydF4y2Ba
恩,m . r . et al .外围大麻素1受体封锁激活棕色脂肪组织和减少血脂异常和肥胖。gydF4y2Ba美国实验生物学学会联合会J。gydF4y2Ba28gydF4y2Ba,5361 - 5375 (2014)。gydF4y2Ba
苏亚雷斯,j . et al . Oleoylethanolamide提高beta-adrenergic-mediated生热作用和white-to-brown脂肪细胞表型在大鼠附睾的白色脂肪组织。gydF4y2Ba分离模型。动力机械。gydF4y2Ba7gydF4y2Ba,129 - 141 (2014)。gydF4y2Ba
Garcia-Alonso, v . et al .协调功能监管之间的微粒体前列腺素E synthase-1 (mPGES-1)和过氧物酶体proliferator-activated受体γ(PPARgamma) white-to-brown脂肪细胞的转换。gydF4y2Ba生物。化学。gydF4y2Ba288年gydF4y2Ba,28230 - 28242 (2013)。gydF4y2Ba
张x et al .结构性变化的肠道微生物群在berberine-mediated预防高脂饮食大鼠肥胖和胰岛素抵抗。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba7gydF4y2Bae42529 (2012)。gydF4y2Ba
吉尔茨,L。,Neyrinck, A. M., Delzenne, N. M., Knauf, C. & Cani, P. D. Gut microbiota controls adipose tissue expansion, gut barrier and glucose metabolism: novel insights into molecular targets and interventions using prebiotics.Benef。微生物gydF4y2Ba5gydF4y2Ba3 - 17 (2014)。gydF4y2Ba
Cani p d & Van Hul, m .小说下一代益生菌针对代谢综合症的机会。gydF4y2Ba咕咕叫。当今。Biotechnol。gydF4y2Ba32gydF4y2Ba- (2015)。gydF4y2Ba
Cani, p . d . et al .改变肠道微生物群控制炎症在肥胖老鼠的机制涉及GLP-2-driven改善肠道通透性。gydF4y2Ba肠道gydF4y2Ba58gydF4y2Ba,1091 - 1103 (2009)。gydF4y2Ba
刘,j . et al .多个通路参与叫花生四烯酸乙醇胺的生物合成。gydF4y2Ba神经药理学gydF4y2Ba54gydF4y2Ba1 - 7 (2008)。gydF4y2Ba
埃弗拉德,a . et al .肠道上皮MyD88传感器开关主机根据营养状况对肥胖新陈代谢。gydF4y2BaCommun Nat。gydF4y2Ba5gydF4y2Ba5648 (2014)。gydF4y2Ba
Essaghir,。Dif, N。,Marbehant, C. Y., Coffer, P. J. & Demoulin, J. B. The transcription of FOXO genes is stimulated by FOXO3 and repressed by growth factors.生物。化学。gydF4y2Ba284年gydF4y2Ba,10334 - 10342 (2009)。gydF4y2Ba
黄达,W。,Sherman, B. T. & Lempicki, R. A. Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources.Protoc Nat。gydF4y2Ba4gydF4y2Ba44-57 (2009)。gydF4y2Ba
吴,g . d . et al .采样和焦磷酸测序方法描述在人类肠道细菌社区使用16 s序列标签。gydF4y2BaBMC Microbiol。gydF4y2Ba10gydF4y2Ba206 (2010)。gydF4y2Ba
Caporaso, j·g . et al . QIIME允许社区高通量测序数据的分析。gydF4y2BaNat方法。gydF4y2Ba7gydF4y2Ba,335 - 336 (2010)。gydF4y2Ba
Pachikian, b . d . et al .肝n - 3多不饱和脂肪酸消耗促进脂肪变性和在小鼠胰岛素抵抗:细胞基因组分析的目标。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba6gydF4y2Bae23365 (2011)。gydF4y2Ba
张X。,Goncalves, R. & Mosser, D. M. The isolation and characterization of murine macrophages.咕咕叫。Protoc。Immunol。gydF4y2Ba第14章gydF4y2Ba、单位14 11 (2008)。gydF4y2Ba
之,F。,Bruni, N., Montano, S., Zitoun, C. & Mithieux, G. The glucose-6 phosphatase gene is expressed in human and rat small intestine: regulation of expression in fasted and diabetic rats.胃肠病学gydF4y2Ba117年gydF4y2Ba,132 - 139 (1999)。gydF4y2Ba
埃弗拉德,a . et al .肠道微生物群和葡萄糖和脂质代谢的反应在小鼠遗传肥胖和食源性leptin-resistant益生元。gydF4y2Ba糖尿病gydF4y2Ba60gydF4y2Ba,2775 - 2786 (2011)。gydF4y2Ba
确认gydF4y2Ba
我们要感谢a . Barrois a .毕弗Blave, h . Danthinne b . Es萨阿迪和r . Selleslagh优秀的技术援助。我们感谢.戈培尔组织学援助。我们感谢m . Osto繁殖老鼠的帮助。我们感谢参考书籍为厌氧室夹头。P.D.C.是一个研究员FRS-FNRS(昏聩de la任职),比利时。A.E. FRS-FNRS和硕士是博士后研究员,比利时。惠普是一个FRS-FNRS博士研究员。从FNRS P.D.C.是资助的接受者(J.0084.15公约,公约3.4579.11)和PDR(项目de矫揉造作的约定:T.0138.14)和弧(行动de矫揉造作的法国比利时Concertee-Communaute公约:12/17 - 047)。这项工作是支持的昏聩de la矫揉造作的Scientifique-FNRS FRFS-WELBIO格兰特没有下。welbio - cr - 2012 - 02 r。 P.D.C. is a recipient of ERC Starting Grant 2013 (European Research Council, Starting grant 336452-ENIGMO).
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
P.D.C.构思,监督项目和设计实验,进行实验和贡献的解释所有的结果。S.L.生成gydF4y2BaNapepldgydF4y2Ba液氧老鼠。低速齿轮导致了实验的设计,执行大部分的实验,分析和解释结果。低速齿轮,M.V.H., Ah.E. and S.M. contributed to generate figures and tables; A.E., M.V.H., Ah.E., T.D., S.M., H.P., J.C. and R.G.P.D. performed the experiments. M.B. contributed to the antibiotic treatment. C.D. contributed to isolate SVF. M.A. helped with the isolation of peritoneal macrophages. G.G.M. measured the endocannabinoids and NAPEs. N.M.D., J.-B.D. and S.L. provided reagents and participated in the discussions. L.G. and P.D.C. wrote the manuscript. All authors discussed the results, reviewed and approved the manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有竞争的经济利益。gydF4y2Ba
补充信息gydF4y2Ba
补充数据和补充表gydF4y2Ba
补充图1 - 8和补充表1 - 5 (PDF 1002 kb)gydF4y2Ba
补充数据1gydF4y2Ba
总列表1.5倍上调或下降的监管cKO-CT老鼠相比WT-CT老鼠。(XLSX 62 kb)gydF4y2Ba
权利和权限gydF4y2Ba
这项工作是基于知识共享署名4.0国际许可证。本文中的图片或其他第三方材料都包含在本文的创作共用许可,除非另有说明在信贷额度;如果材料不包括在Creative Commons许可下,用户需要获得许可证持有人的许可复制的材料。查看本许可证的副本,访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
吉尔茨,L。,Everard, A., Van Hul, M.et al。gydF4y2Ba脂肪组织NAPE-PLD控制脂肪量发展通过改变褐变过程中,肠道微生物群。gydF4y2BaNat CommungydF4y2Ba6gydF4y2Ba6495 (2015)。https://doi.org/10.1038/ncomms7495gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/ncomms7495gydF4y2Ba
进一步的阅读gydF4y2Ba
(Wh) olistic (E)通过(N) utrition ndocannabinoidome-Microbiome-Axis调制(当)抑制肥胖和相关疾病gydF4y2Ba
脂质在健康和疾病gydF4y2Ba(2022)gydF4y2Ba
提议的神经系统的调节作用对脂肪组织代谢和硒在抗奶牛乳房炎的胃口gydF4y2Ba
动物科学和生物技术杂志》上gydF4y2Ba(2021)gydF4y2Ba
下丘脑内源性大麻素在肥胖:一个古老的故事与新的挑战gydF4y2Ba
细胞和分子生命科学gydF4y2Ba(2021)gydF4y2Ba
大麻类和扩大神经系统神经障碍gydF4y2Ba
自然神经学评论》gydF4y2Ba(2020)gydF4y2Ba
膳食脂肪酸的摄入量和肠道微生物群确定循环endocannabinoidome信号超出身体脂肪的影响gydF4y2Ba
科学报告gydF4y2Ba(2020)gydF4y2Ba
评论gydF4y2Ba
通过提交评论你同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果你发现一些滥用或不符合我们的条件或准则请国旗是不合适的。gydF4y2Ba