文摘
的定义acute-on-chronic肝功能衰竭(ACLF)仍然是有争议的。在欧洲和北美,这个术语通常应用根据欧洲研究协会Liver-Chronic肝衰竭(EASL-CLIF)协会的指导方针,它定义了这个条件的综合征,在肝硬化患者和发展特点是急性呼吸困难,器官衰竭,短期死亡率高。三分之一的患者住院急性呼吸困难表现为ACLF在入学或发展综合症住院治疗。ACLF经常发生在一个封闭的时间关系诱发事件,如细菌感染或急性酒精,药物或病毒性肝炎。但是,没有沉淀大约有40%的患者的事件可以被识别。ACLF涉及系统性炎症的机制由于感染、急性肝损伤,可能在没有突发事件情况下,肠道细菌易位或细菌的产品。ACLF是分为三个阶段(ACLF等级1 - 3)器官失败的数量的基础上,以更高的成绩与死亡率增加有关。肝脏和肾脏故障是最常见的器官故障、其次是凝固、大脑、循环和呼吸衰竭。28天ACLF死亡率是30%。根据不同的年级,可以扭转ACLF只有16 - 51%的病人使用标准治疗,留下了相当比例的患者ACLF保持稳定或进展。 Liver transplantation in selected patients with ACLF grade 2 and ACLF grade 3 increases the 6-month survival from 10% to 80%.
介绍
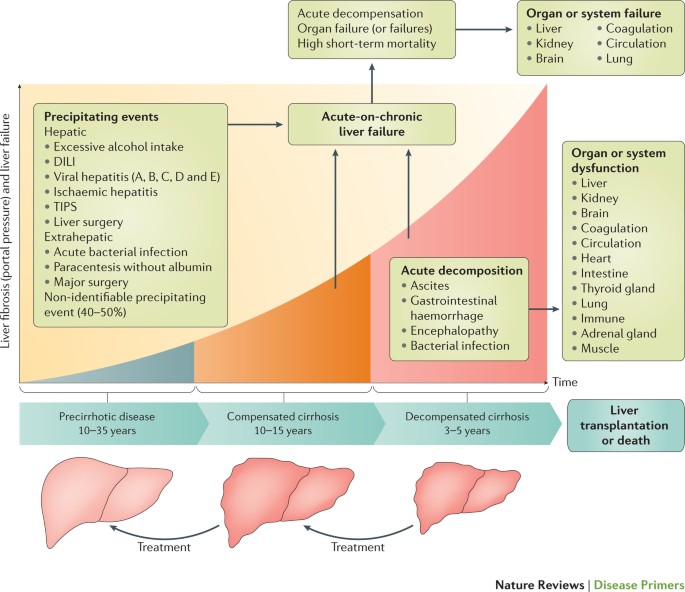
肝硬化是一种进步的慢性肝脏疾病的特点是弥漫性纤维化,严重破坏肝内静脉流、门脉高压和肝功能衰竭。肝硬化的过程分为两个阶段1(图1)。补偿肝硬化定义了肝硬化的发病之间的时期和第一个主要并发症。在此期间,在大多数病人相对较长(> 10年),症状是缺失或微不足道,但肝脏病变和门户压力稳步进展。失代偿肝硬化这个词定义后的时期发展腹水(也就是说,积累大量的腹膜腔内的液体),静脉曲张的出血和/或肝性脑病2- - - - - -4。这一时期与短期生存(3 - 5年)。
Acute-on-chronic肝功能衰竭(ACLF)可以在任何阶段开发补偿失代偿肝硬化,涉及肝或肝外诱发事件。相当比例的患者没有可识别的触发事件。在这个图中,穿刺术意味着大量穿刺术的(> 5升)。急性失代偿肝硬化的定义临床明显的急性发展腹水,肝性脑病,这些患者的胃肠道出血或任何组合或未经这些并发症的历史。尽管细菌感染并不具体的肝硬化并发症,他们被认为是在患者腹水的历史之前,出血或脑病,因为他们的高患病率和与异常相关的肝硬化,包括细菌易位和白细胞功能受损1- - - - - -8。帝力,药物引起的肝损伤;提示,transjugular肝内门体静脉的分流。图是改编自一个图像提供的乔迪皇马,Avinguda de la Generalitat,西班牙巴塞罗那。
肝硬化是快速变化的概念。首先,肝硬化是不再被认为是一个不可逆转的进步的疾病。事实上,肝硬化失代偿肝硬化可以补偿甚至precirrhotic阶段是否移除疾病的原因5。第二,肝硬化的器官或系统障碍列表(肝、肾、脑和循环)已经扩大到包括免疫系统,肠、心脏、肺、肾上腺、肌肉和甲状腺腺体。第三,新的机制参与了肝硬化并发症的发病机理,如微生物群的失调6和系统性炎症7已经认可。最后,越来越明显的是,病人很少死亡结果的终末期肝脏的不可逆转的破坏。相反,在大多数患者中,死因是一种急性临床状况恶化的被诱发事件——一个综合征称为acute-on-chronic肝功能衰竭(ACLF)8。
超过13个不同的定义ACLF已经提出。这些定义通常是基于个人经验或共识协议9- - - - - -15(箱1)。
亚太研究协会的肝脏(APASL)定义了主要的关注11,12(箱1)。这个定义是基于积极的和消极的标准。积极的标准主要有:之前的诊断慢性肝病(肝硬化或non-cirrhotic,孤立的脂肪变性除外);诱发事件,对肝脏有直接影响;导致急性肝衰竭和急性肝侮辱。APASL定义的主要负面的标准是:没有之前的历史患者急性失代偿肝硬化(失代偿肝硬化会代表进行性肝病终末期的存在);和肝外诱发事件,如细菌感染。APASL定义是基于共识会议。
APASL提案没有达到广泛扩散在欧洲和北美有几个原因。首先,最常见的ACLF在这些领域发生在失代偿肝硬化患者在一个封闭的时间与细菌感染或活跃的酗酒8,13(图1),这些病人并不包含在APASL定义。第二,失代偿肝硬化代表一个终端的概念阶段的疾病不是欧洲中心的经验。第三,肝外器官衰竭是最特征之间的微分特性ACLF和急性呼吸困难患者在欧洲的病人。最后,ACLF non-cirrhotic慢性肝病患者特别在欧洲和北美由于低流行的甲型肝炎病毒,乙型肝炎病毒(HBV)和E型肝炎病毒感染。
由于这些原因,在2009年,欧洲研究协会Liver-Chronic肝功能衰竭(EASL-CLIF)财团开始预期,1343年欧洲多中心观察研究患者住院的急性失代偿肝硬化(轮唱的研究)。本研究旨在定义ACLF肝硬化,评估综合症的患病率和临床过程和改善预后的准确性分数目前可用的8,16- - - - - -20.通过一个以证据为基础的实用方法。本研究的分析导致新的定义与三大特征(箱1):急性失代偿肝硬化;器官衰竭的存在(或失败,可肝或肝外);和一个高概率的短期死亡率(28天)。后发表的主要文章来源于轮唱的研究的定义、分级ACLF严重程度和预后评分提出广泛应用于欧洲、亚洲和北美的评估和治疗失代偿肝硬化患者21- - - - - -32。
有人建议APASL和EASL-CLIF财团之间的差异定义逻辑后果不同的肝脏疾病流行病学的东部和西部28,33。然而,更有可能的差异与不同的定义都是设计的目标。ACLF定义APASL共识集团旨在确定一个条件,预测肝外的发展或多个器官衰竭和死亡11,12。相比之下,轮唱的研究的目的是描述一个综合症器官衰竭(或失败)和高短期死亡率至关重要的功能8。
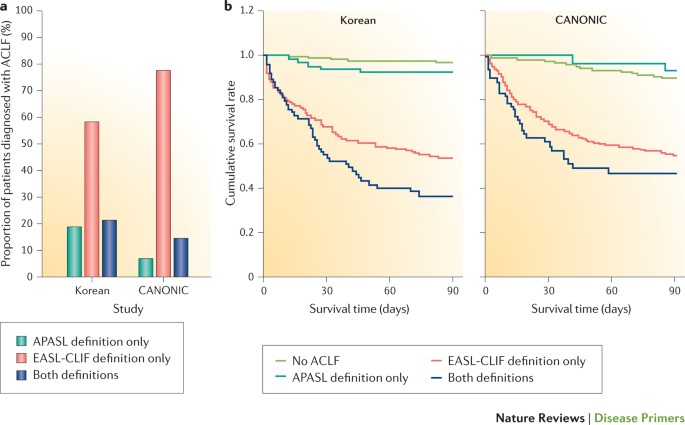
试图统一定义都没有成功34。最近来自亚洲的调查比较了两个定义在一个大的一系列的肝硬化患者23,26,35。图2亚洲最大的系列的比较结果35与标准的研究8。一致的诊断APASL和EASL-CLIF财团定义在两个系列只有少数的病人中,表明所选择的两个ACLF定义不同的患者群体(图2一个)。EASL-CLIF财团的定义是准确预测预后明显多于APASL定义在东部和西部人口(图2 b)。死亡率显著差异取决于诊断标准也观察到另外两个组的患者来自中国23和印度26。这个引物在肝硬化ACLF使用EASL-CLIF财团的定义。读者被称为沙林和Choudhury审查36的讨论ACLF基于APASL标准。
流行病学
全球发病率和死亡率
ACLF全球是一个主要的医学问题,在该地区高危人群患病率的20 - 35% (表1)。全球死亡率的报道ACLF根据EASL-CLIF财团定义范围在30%至50%之间,与器官的数量密切相关的失败。在欧洲,平均28天死亡率没有肝移植轮唱的报告的研究是在失代偿肝硬化患者中1.9%没有ACLF ACLF患者和32.8% (23% ACLF患者1级,31%患者ACLF 2级患者和74% ACLF三年级;看到框2详情)8。
在美国,一项研究使用北美联盟结束阶段研究肝脏疾病(NACSELD)标准(箱1)报道,30天死亡率与感染有关失代偿肝硬化没有ACLF是8%,这个速度增加到27%的患者,49%的患者中,64%患者的三,四个器官衰竭患者为77%13。此外,在亚洲,没有显著降低患者死亡率ACLF已经观察到在过去的二十年里,全国样本与死亡率接近50%36。
在中国,平均28天transplant-free死亡率报告等。24在失代偿肝硬化患者由于慢性乙型肝炎病毒感染是2.6%的病人没有ACLF ACLF患者的44%。本研究使用EASL-CLIF财团ACLF的定义,发现患者死亡率23.6% ACLF 1级,40.8%患者ACLF 2级患者和60.2% ACLF三年级(Ref。24)。张等。23失代偿肝硬化患者报告了类似的结果在中国不同的目的。90天没有ACLF的病人的死亡率为2.1%,患者ACLF 1级为39.9%,ACLF二年级为54.1%,ACLF三年级是84.7%(使用EASL-CLIF联盟定义)23。
诱发事件
沉淀的事件ACLF根据地理区域和不同可分为肝原产地或肝外取决于他们的网站14,34,37- - - - - -39(图1)。慢性乙肝病毒复活,急性肝炎病毒或E型肝炎病毒感染38急性酒精性肝炎、急性细菌感染是最常见的诱发事件ACLF在亚洲23。在西方,最常见的诱因是活跃的酗酒和细菌感染,尽管在相当比例的患者没有可识别的诱发事件8。药物引起的肝损伤的潜在作用(帝力)诱发事件ACLF已经不够了东方和西方。
器官的失败
依教规的研究8,在ACLF不同的器官和系统故障中,最常受影响的器官或系统被肾脏(55.8%的患者),其次是肝脏(43.6%的患者),凝固(27.7%的患者),大脑(24.1%的患者),循环(16.8%的患者)和肺(9.2%的患者)。乍一看,这可能是令人惊讶的,不是所有ACLF患者肝功能衰竭,但有两个重要的应该考虑的问题。首先,胆红素水平用于定义肝衰竭非常高(≥12毫克/分升)和大多数(如果不是全部的话)患者肝功能衰竭也异常胆红素值,这意味着一个变量在这些患者肝功能的损害程度。其次,重要的是要注意,ACLF超越的经典概念的定义失代偿肝硬化的后果,包括肝硬化的其他器官的功能7。
/病理生理学机制
过程中ACLF肝硬化
表示,肝硬化是一种进行性的疾病必然会导致死亡,除非病原学的机制是抑制由适当的治疗或进行肝移植。事实上,有充分的证据表明,中止的酒精摄入酒精性肝硬变,抗病毒治疗在慢性与乙型肝炎病毒有关的和丙型肝炎病毒相关肝硬化和免疫抑制治疗自身免疫性肝硬化失代偿肝硬化可能变换补偿肝硬化甚至precirrhotic阶段5。相比之下,如果患者病原学的机制坚持补偿肝硬化,肝纤维化由于连续递增肝细胞坏死和炎症,引起肝脏体系结构的渐进变形,减少肝实质细胞,肝内门户静脉流动阻力增加,门静脉高压、肝衰竭和急性呼吸困难的疾病(图1)。
主要并发症的发展,腹水,次数少,静脉曲张的出血或肝性脑病,是失代偿肝硬化的发病。失代偿肝硬化的特征是损害肝脏和肝外器官和系统的功能,包括:大脑(影响认知障碍,精神和运动功能从亚临床改变严重昏迷,昏迷);肾脏(损伤肾钠和自由水排泄,intrarenal血液动力学,肾灌注和肾小球滤过率);循环(内脏动脉血管舒张导致全身血管阻力和减少高心输出量);肺部(通气/灌注损伤率导致缺氧和低碳酸血);心脏(变时性的障碍和左心室收缩和舒张功能);凝固(由于损伤的肝脏合成凝血剂,抗凝因子和增加纤维蛋白溶解);肾上腺皮质醇释放(能力受损提供足够的对压力的反应);肠道(减少运动性、细菌过度生长,增加黏膜的渗透性屏障导致增加的细菌易位和/或细菌产品从肠道流明到体循环);免疫系统(系统性炎症和多形核白细胞和单核细胞功能受损); the thyroid glands (impaired hormonal secretion); and muscles (sarcopaenia) (图1)。
ACLF可能出现在任何阶段的疾病早期或晚期失代偿肝硬化(补偿图1)。因此,它不是一个长期存在的失代偿肝硬化的终端事件。如上所示(框2),器官衰竭被定义为一个强烈的障碍在六个特定的器官或系统的功能是重要的在确定预后(肝脏、肾脏和大脑和凝固,循环和呼吸系统)8。器官衰竭的特性区别ACLF从没有ACLF失代偿肝硬化。相比之下,器官功能障碍,它定义了一个不太严重的损害这些(和其他)的功能器官和系统,是肝硬化失代偿肝硬化的微分特性和补偿。例如,根据标准的研究8失败,大脑由肝性脑病定义3级或4级的西汉文分类,而大脑功能障碍定义为肝性脑病1级或2级。同样,肾功能障碍定义为血清肌酐水平的1.5 - -1.9 mg / dl,而肾功能衰竭定义的血清肌酐水平≥2 mg / dl。
炎症ACLF
ACLF与系统性炎症的特点相关联。例如,白血球计数和血浆c反应蛋白水平和促炎细胞因子和趋化因子,il - 6等IL-1β和引发ACLF患者高于没有ACLF肝硬化患者8,22。此外,ACLF患者当中,ACLF严重程度越高,器官的数量估计的故障、血浆促炎症细胞因子和趋化因子水平越高(m .轮唱的实验,未发表的观察)。促炎细胞因子和趋化因子的过度生产系统——或“细胞因子风暴”的病人的免疫系统可能会导致担保组织损伤40,这一过程称为免疫病理反应41。因此,细胞因子风暴也可能成为一个杰出的贡献者器官衰竭患者肝硬化的发展。值得注意的是,患者ACLF, CD14的子集+单核细胞显示超表达酪氨酸受体激酶MER(编码MERTK),导致抑制这些细胞的炎性细胞因子的产生22,表明一种补偿性免疫抑制并行发展的系统性炎症反应。
有两类ACLF:那些在诱导物(或诱发)炎症(例如,细菌感染或过度饮酒)识别和那些没有临床可识别的触发(或触发)8。在这个引物,后者被称为“ACLF没有临床识别触发”。诱导的炎症是外生或内生42。在外源诱导物,我们只讨论细菌诱导物,因为其他人都超出了这篇文章的范围和其它地方均有描述42。虽然大部分的分子细节的炎症触发ACLF还有待阐明,可能下面的一般过程扮演一个关键的部分。“细菌诱导的炎症”和“内生诱发炎症的ACLF潜在的炎症机制。
细菌诱导的炎症。细菌病原体可以通过两个不同类型的分子诱导炎症:其分子模式(pamp)42- - - - - -44和毒力因素42,45。pamp被主机通过专用的受体被称为模式识别受体(PRRs)以及PRRs细菌性配体详细的例子图342- - - - - -44。订婚的PRRs结果信号级联的刺激,激活转录因子43。PRR-activated转录因子可以引起一系列基因编码分子参与炎症,包括促炎细胞因子43,45,46(图3 b)。
一个|模式识别受体的例子(PRRs),其为病原体检测细菌独特的分子结构的分子模式(pamp)及其亚细胞本地化。通常PRRs细菌配体包括的toll样受体),nucleotide-binding寡聚化域(点头)同受体(NLRs),视黄acid-inducible基因1 (rig - i;RIG-I-like受体家族的成员)和胞质DNA传感器(包括interferon-γ(IFNγ)诱导蛋白质16 (IFI16),没有在黑色素瘤2 (AIM2)和循环GMP-AMP合成酶(cga))43- - - - - -48,167年。b| PRR-mediated炎症的一个例子是炎症信号通路的激活细胞外和细胞内脂多糖(LPS)。检测TLR4的细胞外有限合伙人参与两个胞内信号管道:骨髓分化主要响应蛋白88 (MYD88)通路(灰色),包括适配器Toll-IL-1受体(行动)domain-containing适配器蛋白质(TIRAP);和TIR domain-containing适配器protein-inducing IFNβ(TRIF)通路(浅绿色),包括适配器行动domain-containing衔接分子2 (TICAM2)43。MYD88通路通过肿瘤坏死因子(TNF) receptor-associated因子6 (TRAF6)刺激不同的激酶(深绿色),包括核factor-κB激酶抑制剂(IKK)和增殖蛋白激酶(MAPKs),激活转录因子(橙色)大师,NF-κB和激活蛋白1 (AP-1),分别。MYD88通路也激活转录因子干扰素调节因子5 (IRF5)。这些激活转录因子诱导的炎症基因(红色),包括如炎性基因肿瘤坏死因子和白细胞介素6和抗炎等基因IL10和IL1RN。TRIF通路包括TRAF3 IRF3转录因子的激活,然后与其他转录因子有助于I型干扰素的诱导43。还存在细胞内有限合伙人是公认的炎症(半胱天冬酶4和半胱天冬酶5在人类和小鼠的半胱天冬酶11)刺激非规范点头,远程雷达,pyrin domain-containing 3 (NLRP3) inflammasome167年,168年。这导致激活半胱天冬酶1(没有显示),促进乳沟IL-1β和地震(参考文献167年,168年)。激活细胞内的半胱天冬酶4和半胱天冬酶5有限合伙人可以触发一个叫做pyroptosis程序性细胞死亡169年。dsDNA,双链DNA;NAIP5,神经元细胞凋亡抑制蛋白5;ssRNA单链RNA。
第二类的细菌诱导的炎症包括大量的毒性因子42,44。与pamp不同,这些因素一般不被大多数人专用的受体,但可以感觉到他们的活动的影响(这一过程被称为功能特性识别)38,46- - - - - -48。
内源性诱导的炎症。内源性诱导释放的坏死细胞或细胞外基质(ECM)产生的分解在一个受伤的组织(如肝脏病变的ACLF)42,43和被称为有关分子模式(抑制)49。可以被抑制宿主的某些受体,识别导致的无菌炎症。例如,高机动组框1蛋白质(HMGB1)从事高级糖基化终端产品特定的受体(愤怒),合作和toll样受体(通常;一个类的PRRs)诱导炎症反应42,43,49。其他因素也可能参与ACLF包括坏死细胞,这可能释放il - 1的家人如IL-1α和IL-33触发炎症通过各自的骨髓分化主要响应蛋白88 (MYD88)耦合的同源受体50。
炎症反应的结果。细菌感染的炎症反应的目的是促进宿主抗性,减少细菌的负担,而无菌炎症是促进组织修复51- - - - - -54。然而,当这两个类别的炎症反应过度,他们可能引起组织损伤52。在细菌感染,急性期炎症反应的过度,会导致免疫病理反应。例如,效应物的免疫反应,如招募中性粒细胞炎症单核细胞,激活T辅助1 (TH1)和TH17细胞和细胞毒性T细胞,已知与免疫病理的高风险有关44。也有一些例子DAMP-induced过度炎症反应导致主要的组织损伤。老鼠缺乏receptor-interacting丝氨酸/苏氨酸激酶1 (Ripk1)开发RIPK3-mixed家族激酶域蛋白(MLKL)介导necroptosis导致全身炎症,多器官损伤和死亡在出生3天50。在这个模型中,IL-33(潮湿)驱动器系统性炎症和严重性。因此,最初的组织损伤所致necroptosis可能导致进一步的组织损伤。在严重的细菌感染,细胞坏死可能发生(免疫病理的功能)和潮湿会导致释放。在这种情况下,释放抑制可以延续或加重炎症最初由细菌诱导物(pamp和毒力因素)51。
ACLF确定诱发的炎症
这些炎症过程的相对贡献ACLF可能根据不同触发,和相当大的研究仍然需要充分阐明这种综合征的病原学的途径。ACLF所有公认的诱发事件,机制两个——脓毒症和严重的酒精性肝炎——最好的特征,详细如下。
Sepsis-induced ACLF。器官功能障碍不正常的宿主免疫反应引起的细菌感染定义sepsis-induced ACLF。30%的肝硬化患者和ACLF细菌性败血症的可识别的触发综合症8。然而,ACLF也可以使细菌感染;事实上,患者的比例ACLF开发过程中细菌感染综合症8。在细菌感染,自发性细菌性腹膜炎(SBP),脓毒症和肺炎更经常比其他感染与ACLF轮唱的研究8。在肝硬化和腹水患者,可行的肠道细菌可以穿过肠道屏障和迁移到大气环流和殖民腹水55,56。
在第一个小时的细菌感染,肝硬化患者血浆促炎细胞因子水平高于没有肝硬化患者。这一发现表明过度炎症肝硬化的存在57,58。背后的机制这过度的炎症反应细菌感染是不完全理解59。事实上,我们的大部分知识是基于实验研究先天免疫反应脂多糖(LPS), PAMP时被TLR4(参考文献59- - - - - -61年)(图3)。有限合伙人的响应进行了研究体外研究在新鲜分离的单核细胞或外周血单核细胞(PBMCs)和肝硬化患者。LPS-stimulated生产促炎细胞因子和趋化因子是细胞从肝硬化患者高于控制细胞62年- - - - - -66年。LPS-induced细胞因子风暴与肝硬化相关的机制知之甚少。体外实验表明,PBMCs或肝硬化患者单核细胞显示缺陷TLR4信号:在接下来的负反馈机制的激活磷酸肌醇3-kinase (PI3K) akt通路61年,65年;抑制糖原合成酶激酶3活动66年;和il - 1的感应receptor-associated激酶(IRAKM;也称为IRKA3)62年和抗炎细胞因子il - 10(参考文献61年,65年)。然而,其他几个关键的机制被下调TLR-mediated non-cirrhotic条件下炎症反应(特别是,诱导肿瘤坏死factor-α-induced蛋白3 (A20;也称为TNFAIP3))的上下文中尚未调查肝硬化。
后在活的有机体内有限合伙人的挑战,血浆肿瘤坏死因子(TNF)水平显著高于肝硬化比non-cirrhotic动物67年- - - - - -71年。此外,在此设置,动物,但不是没有,肝硬化发展肝细胞凋亡和坏死70年。此外,与正常肝脏相比,在肝硬化肝脏、有限合伙人抒发长期内质网应激和随后展开的蛋白质反应,负责持续的磷酸化真核翻译起始因子2 subunit-α(eIF2α)70年。eIF2α磷酸化减弱大多数rna的翻译72年。在这种情况下,肝细胞TNF-mediated肝硬化肝脏细胞死亡可能发生,因为缺乏核factor-κB翻译(NF-κB)端依赖生存mrna成蛋白质。支持这一假说,正常肝细胞暴露于高水平的肿瘤坏死因子是防止细胞死亡的感应NF-κB-dependent prosurvival蛋白质73年。在一起,这些发现导致的理论,在肝硬化,LPS识别可能导致严重的肝损伤,不仅是由于过度先天免疫反应的损伤也参与肝细胞内质网内稳态机制。
未来的研究应该调查引起的炎症反应和组织损伤的识别pamp有限合伙人。还应该注意,诱发炎症的作用,除了pamp,如毒性因子和抑制,尚未研究的上下文中sepsis-induced ACLF。
严重的酒精性肝炎。轮唱的研究的结果8表明,20%的病例的ACLF是由严重的酒精性肝炎引起的。在酒精性肝炎,肝细胞死亡和炎症的显示特性74年,75年。然而,解释这些特性的潜在机制仍知之甚少75年最下面的机制需要确认。
过度饮酒会改变肠道微生物群,增加肠道通透性75年。此外,慢性系统性炎症和过度造成损害肠道屏障。这些改变可能有利于细菌进入血液的易位76年- - - - - -78年(图4)。不管这些细菌引起感染,它们释放pamp(如有限合伙人),可以到达肝脏,在那里它们被通常表现在常驻巨噬细胞(称为枯氏细胞)。这个识别刺激炎性科学家趋化因子的分泌,如引发(Ref。79年),吸引和激活中性粒细胞80年。嗜中性粒细胞浸润是酒精性肝炎的一个特点75年。肝细胞坏死,这已经被记载在严重的酒精性肝炎81年,可能导致释放的抑制被不同的受体介导炎症反应,如上所述。
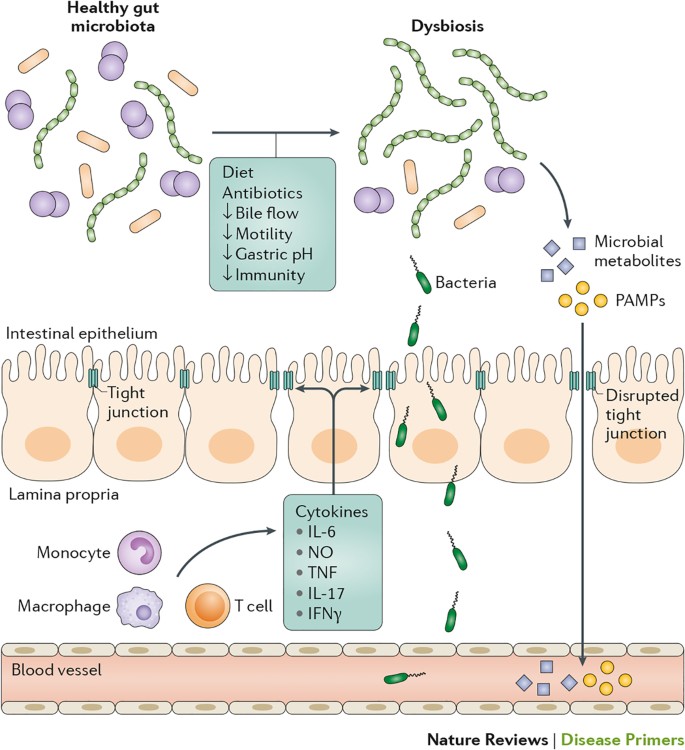
肝硬化与定量差异(细菌过度生长)和肠道微生物群的成分变化,所谓的失调。几个因素可能导致失调的肠道微生物群在肝硬化,包括饮食,使用抗生素,减少胆汁流和肠道蠕动,胃pH值的变化和粘膜免疫受损。肝硬化患者的另一个重要特性是细菌的易位。紧密连接的破坏使其分子模式(pamp)和可能的其他微生物代谢物之间使用paracellular路线相邻易位肠上皮细胞。肠道通透性已经增加precirrhotic阶段,而可行的细菌易位是肝硬化的特征,尤其是在代谢失调。细菌可能使用transcellular路线通过上皮细胞(transcytosis)。pamp也可能激活免疫细胞,包括单核细胞、巨噬细胞和T细胞,肠道固有层的,导致分泌炎症介质。细胞因子,如肿瘤坏死因子(TNF)、il - 6, IL-17,一氧化氮(NO)和interferon-γ(IFNγ),增加患者的肠道或与肝硬化动物模型76年- - - - - -78年。这些介质的几个为紧密连接的功能障碍。相反,肠道免疫监测反应可能将改变细菌固有层受损。
线粒体DNA (mtDNA)是一种潮湿,和mtDNA压力也可能导致炎症在酒精性肝炎的上下文中。乙醛代谢导致肝细胞活性氧(ROS)的生产68年。ROS还受到肿瘤坏死因子刺激生产65年。在慢性酒精消费82年有限合伙人或之后的挑战83年,ROS生产过剩引发mtDNA压力。小鼠模型的温和mtDNA压力,mtDNA了逃避细胞溶质,参与细胞内在反应涉及先天胞质DNA传感器循环GMP-AMP合成酶(cga) (图3)。反过来,注册会计师参与mtDNA介导I型干扰素(IFN)生产和随后的自分泌和旁分泌干扰素诱导目标基因84年。因此,细胞内在反应mtDNA压力可能成为炎症反应在组织层面,从而可能导致肝功能衰竭。
最近的研究结果表明,肝脏再生的抑制可能参与肝衰竭伴有严重的酒精性肝炎85年。虽然肝祖细胞被激活与严重的酒精性肝炎肝脏,这些细胞将分化成cholangiocytes(胆管上皮细胞衬)代替肝细胞85年。因此,它是可能的,没有替换的肝细胞死亡的结果发生酒精性肝炎。在一起,这些发现表明,严重的酒精性肝炎可能造成免疫病理和受损的肝细胞再生。
ACLF没有可识别的触发
的触发ACLF在大约40%的情况下是未知的8。尽管这些患者全身炎症的显示特性8,一个人不能清楚地解释如何系统性炎症刺激。三个假设可以解释背后的机制在ACLF没有临床识别引发炎症。
第一个假设是基于生态失调的存在在肝硬化患者肠道微生物群(图4)。失调与肝硬化通常表现为多样性减少,减少Lachnospiraceae, Ruminococcaceae、类杆菌和家庭十四incertae基准在家庭层面和减少拟杆菌种虫害在属水平6,86年- - - - - -89年。此外,生态失调与肝硬化包括革兰氏阴性肠杆菌科的增加,在革兰氏阳性链球菌科Fusobacteriaceae Porphyromonadaceae和家庭的水平6,86年- - - - - -89年。失代偿肝硬化导致额外的不同成分变化的微生物群与补偿的肝脏疾病阶段87年。有一个健壮的某些细菌的丰度之间的正相关家庭成员和血浆炎性细胞因子水平(包括il - 6和TNF ACLF患者)90年。这些发现表明,肠道微生物群产生的代谢物可能导致全身炎症(图4)。
第二个假设是,一些患者可能有肠道pamp的易位,如有限合伙人或细菌CpG DNA91年(图3)。这些配体可能达到肝脏和体循环然后被通常公认的。因此,TLR识别一般不依赖于微生物生存能力或侵袭性。ACLF在高峰阶段,系统性的LPS水平高于ACLF发作之前和期间的幸存者87年,91年,这表明较高的系统性LPS水平与疾病严重程度。有趣的是,小肠细菌过度生长的一个危险因素增加系统性LPS水平在肝硬化患者92年。增加系统水平的CpG DNA在失代偿肝硬化患者没有明显的细菌感染,并与死亡率相关93年,这表明CpG DNA水平的升高可能参与ACLF的发展严重失代偿肝硬化患者。
第三机制解释临床上ACLF没有可识别的触发炎症可能是抑制的释放,例如,通过坏死的肝细胞。在急性肝衰竭患者和动物,各种抑制,如HMGB1可能导致炎症被释放83年,但不知道抑制ACLF患者。
最后,另一个可能的解释未能识别ACLF诱发事件可能与当前诊断测试或测试协议未能识别感染或帝力。
诊断、筛查和预防
定义器官衰竭和ACLF
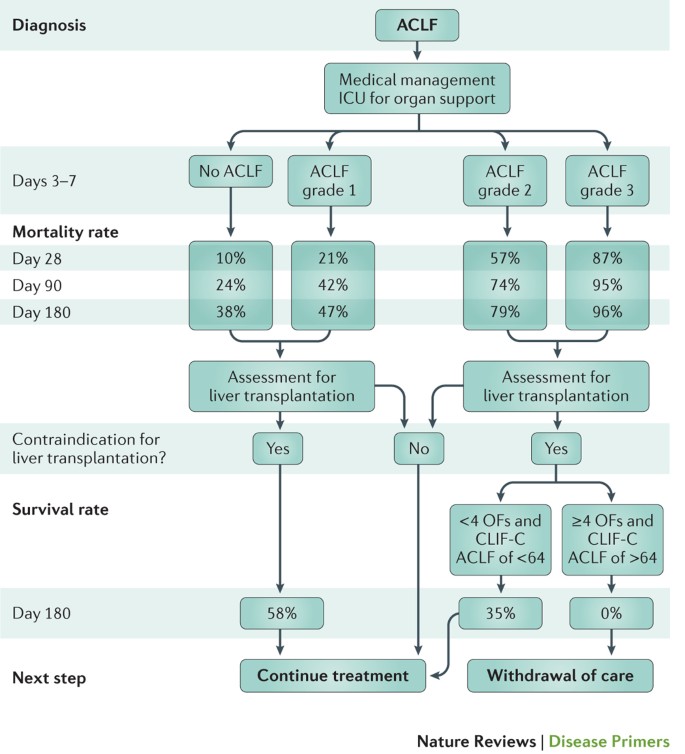
器官衰竭的诊断标准。做出的假设定义EASL-CLIF标准之一是肝外器官衰竭(或失败)是一个主要ACLF的微分特性。CLIF-Sequential器官衰竭评估(CLIF-SOFA)得分是最初的规模用于定义器官衰竭的轮唱的研究8。来自沙发上得分,规模广泛用于重症监护16- - - - - -19,适应慢性肝病患者的基础上发表的研究。截止值建立了评估后28天的风险增加死亡率在过去四CLIF-SOFA得分的类别与前一个相比轮唱的病人的研究。一个简化版的CLIF-SOFA得分,克利夫财团器官衰竭(CLIF-C)评分(表2)与相同的器官衰竭诊断标准和类似的预测准确性,已经发达20.。
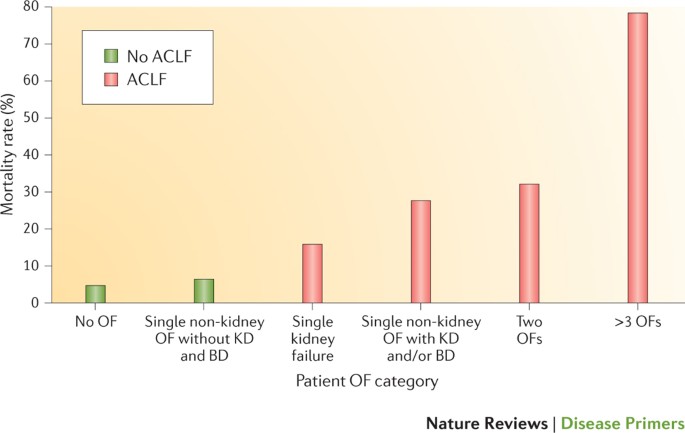
死亡的标准。另一个预定义的标准诊断ACLF EASL-CLIF标准的发展是一个预期的28天≥15%的死亡率。依教规的系列8,这一标准是存在于两个或两个以上的器官衰竭患者,但不是在一个器官衰竭患者(28天死亡率为14.6%)。额外的风险因素被用来进一步分类的病人在这种低风险的子群。分析产生子组的患者,实现了三个预定义的标准ACLF (图5):两个或两个以上的器官衰竭患者;一个器官衰竭患者(特别是肾功能衰竭);non-renal单一器官衰竭患者如果这些失败与肾相关和/或大脑功能障碍。
等级的ACLF的严重性
失代偿肝硬化患者可以分层分成四组的严重性——没有ACLF或ACLF等级1 - 3的类型和数量的基础上器官失败他们(框2)。肾衰竭是最常见的器官衰竭ACLF 1级。ACLF等级2,肝衰竭的器官衰竭是最普遍其次是肾脏、大脑和凝固失败。ACLF 3年级,所有器官衰竭的发病率很高。
依教规的研究8,23%的病人住院ACLF入学。此外,11%的在录取了没有ACLF综合症患者在住院期间,使ACLF的总患病率为31%。在ACLF患者中,51%有ACLF 1级,35%有ACLF ACLF年级3年级2和13%。除了提供综合征的诊断,这些标准也为快速预后提供数据信息,与ACLF年级与不同的死亡率(表3)。这些分类标准的实用性以及CLIF-SOFA和CLIF-C分数评估预后的独立系列的患者进行验证26,29日- - - - - -31日,94年,95年。
自然历史的ACLF
潜在的可逆性ACLF是一种综合征96年。然而,数据标准的研究清楚地表明,尽管这一特性,ACLF患者死亡率增加累计即使这些病人从医院出院。具体来说,从大约20%死亡率增加28天> 35%,90天患者ACLF 1级,从30%到大约50%患者在90天ACLF 2级(Ref。8)。尽管病人之间有相当大的变化20.,21,一些大原则就可以提出的条件。一般来说,在天3 - 7和表示,大约50%的患者没有ACLF ACLF 1级将会改善,顺向28天死亡率约为7%。此外,25%的患者ACLF 1级将保持不变(即ACLF成绩不会改变)的28天死亡率24%。相比之下,约25%的患者ACLF 1级进展ACLF 2级或2级ACLF三年级;他们的28天的死亡率是53%和88%,分别。在患者呈现ACLF 2级,只有35%改善没有ACLF或者ACLF 1级天3 - 7表示。患者改善有28天死亡率低大约5%。此外,约有50%的患者ACLF二年级恶化到ACLF三年级(28天死亡率90%)或保持不变(28天死亡率为26%)。患者呈现ACLF年级3,死亡率仍然很高,只有大约13%的改善没有ACLF或ACLF 1级。的因素是独立与发展更先进的成绩是CLIF-C ACLF得分(下面讨论)和肝衰竭的存在。 These data indicate that the syndrome is indeed very dynamic and that early intervention is crucial to minimize the risk of death.
临床危险因素
有证据表明,上述临床ACLF过程适用于所有ACLF的目的。来自中国的回顾性研究中主要有与乙型肝炎病毒有关的肝硬化的患者,短期的结果,这是最与ACLF密切相关,没有受到诱发疾病的性质的影响97年。肝患者沉淀剂,如乙型肝炎病毒复活,有短期(28天及90天)患者死亡率类似于肝外沉淀剂,如感染。这种模式也被观察到在第二个中国研究24在肝硬化患者由于发达ACLF慢性乙型肝炎病毒感染的人。28天,90天的死亡率为任何给定的等级ACLF在这项研究中24类似报道的轮唱的研究8并与沉淀的存在和类型无关的事件(表4)。因此,这些研究表明,它是失败和器官的数量不是肝硬化的病因学或诱发事件死亡的主要危险因素。
先前的历史事件的急性呼吸困难没有23%的患者ACLF轮唱的研究,表明ACLF的发展作为初始失代偿肝硬化的表现是一种相对常见的功能。这些患者未经代谢失调是年轻的历史,更频繁地酗酒者,已经严重系统性炎症和ACLF年级,短期死亡率(42%和30%)高于之前ACLF患者急性呼吸困难的历史。
预测预后
ACLF是一个动态的综合症,预后评分需要是动态的,这样他们可以按顺序每天更新,这将允许评估干预反应,升级需要紧急肝移植和决心的徒劳的持续治疗。轮唱的研究表明,后续数据诊断后的前3 - 7天内ACLF极其重要的决议以来预测的临床过程;改善或恶化ACLF标准药物治疗后发生在这个时期大多数早期患者96年。
患者的预后模型开发和验证ACLF,称为CLIF-C ACLF分数,对于急性呼吸困难患者没有履行ACLF的诊断标准,称为CLIF-C急性呼吸困难(CLIF-C广告;www.clifconsortium.com)得分。这两个分数设计因为单一的分数不足以令人满意地描述与急性呼吸困难和ACLF预后相关8。
的CLIF-C ACLF得分由分数的CLIF-C,年龄和白细胞计数20.,98年。分数是一个数字从0到100;数越高,死亡的风险就越大。比分是验证利用一系列的患者的前瞻性收集的数据没有包含在标准的研究。的CLIF-C ACLF分数提供了一个更好的估计死亡的风险在28天,90天,6个月和12个月post-presentation与终末期肝病模型(MELD)评分,MELD-Sodium分数和儿童得分24,32,95年,99年- - - - - -101年。相比CLIF-C ACLF得分,MELD评分低估了死亡风险的患者20 - 30%,这意味着对移植器官分配使用MELD评分严重缺点ACLF患者20.。的性能CLIF-C ACLF分数改善后续的时期,这表明它应该每天更新20.。
公元CLIF-C得分是在急性呼吸困难患者没有ACLF开发的98年。独立变量被发现是年龄与生存相关,血清钠水平,血清肌酐水平,白细胞计数与国际标准化比率。这些生成的一个分数在0和100之间,也显著比融合更准确的预测预后,MELD-Sodium和儿童24,98年。患者CLIF-C广告得分< 45有28天死亡率< 3%,这一类可能识别一群病人早期从医院出院。相反,CLIF-C广告> 60分的患者发展为成熟的高危ACLF 28天死亡率约为20%,表明这可能是一个“pre-ACLF”组。公元CLIF-C得分也验证了连续使用。
预防
早期诊断和治疗潜在的突发事件预防ACLF至关重要,和一些预防措施已被证明是有效的5,55,102年- - - - - -105年。这些都涉及治疗感染才能继续触发ACLF和包括:抗生素的促使政府根据当地的流行病学模式疑似感染患者的阻力;根除长期抑制乙型肝炎病毒感染或持续的丙型肝炎病毒感染患者的补偿或失代偿肝硬化;和静脉注射感染诊断SBP患者的白蛋白。SBP患者的白蛋白是高度有效预防1型肝肾综合征的发展(小时),这是一种特殊形式的ACLF快速进行性肾功能衰竭的特征。这种效应可能是由于等离子体体积膨胀和白蛋白的调节效应与pamp相关的系统性炎症(如有限合伙人)104年,105年。没有证据表明静脉注射白蛋白在其他细菌感染是有效的106年,107年。
也有间接证据支持ACLF其他潜在的预防措施。例如,长期口服诺氟沙星政府减少SBP的速度(和其他细菌感染)和类型1小时在失代偿肝硬化患者55,102年,108年- - - - - -110年。诺氟沙星徒通过有选择地减少革兰氏阴性微生物群,通过刺激肠道屏障的通透性降低il - 10释放和调节免疫应答、细菌易位111年- - - - - -113年。另外,治疗严重急性酒精性肝炎患者pentoxifylline,巨噬细胞产生肿瘤坏死因子抑制剂,或强的松和静脉N乙酰半胱氨酸已经被证明可以减少发生率1小时在某些类型的研究114年,115年,可能是通过调节肝脏炎症,但这还没有得到证实在最近的一次调查116年。最后,短期管理相结合的粒细胞集落刺激因子(g - csf)加上darbepoetin(促红细胞生成素)的合成类似物已被证明改善肝功能,降低严重脓毒症的发病率,增加1年存活率相比安慰剂在失代偿肝硬化患者117年。
管理
医疗管理
医疗管理ACLF由早期识别、治疗诱发的事件和支持性护理8,14,118年,119年。触发器被证明是减少死亡率的早期治疗,例如,在处理重新激活与类固醇乙型肝炎病毒感染与替诺福韦或酒精性肝炎75年,117年,119年- - - - - -121年。然而,大多数ACLF管理重点是支持性护理118年。
抗菌治疗。正如上面所讨论的,细菌感染的诱发事件ACLF在大约35%的患者14(表4)。因此,应该有一个低门槛的早期启蒙抗生素在肝硬化患者细菌感染。脓毒性休克患者,每小时延迟以外的陈述与整体死亡的一个调整后的优势比为1.1(参考文献122年,123年)。应该使用广谱抗生素,尤其是在医院或卫生保健相关感染患者或脓毒性休克患者,是不恰当的初始抗菌治疗增加了调整后的优势比死亡的十倍122年,123年。同样重要的是抗生素的早期启蒙是促使降级的抗生素病人一旦发现有机体和/或显示临床改善。如果没有识别和生物有持久的临床恶化的广谱抗生素,应考虑抗真菌123年。措施,防止重复感染(继发感染发生的主要感染)应该实现ACLF患者,包括包与机械通气相关肺炎的预防和控制、导管相关性菌血症和尿路感染,手部卫生,障碍的预防措施,避免不必要的仪器124年。
受感染和非受感染的患者承认ACLF高度倾向于开发新的细菌感染住院期间(m .轮唱的实验,未发表的观察)。这些感染作为“第二次打击”综合症。因此,预防、早期诊断和治疗这些ACLF继发感染是主要问题。
HBV-specific疗法。重新激活ACLF乙肝病毒是一个频繁的诱发事件的肝硬化患者在亚洲。抗病毒治疗肝炎患者B-related ACLF改善肝脏功能,增加短期和长期生存119年- - - - - -121年,125年,126年。因此,早期抗病毒治疗药物(如拉米夫定、替诺福韦,恩替卡韦或telbuvidine)应该尽快开始121年,127年。
免疫调节。ACLF患者可能受益于治疗旨在恢复免疫功能,如白蛋白、N乙酰半胱氨酸和g - csf117年,128年。事实上,最近的一项随机对照试验的结果表明,g - csf可防止败血症的发展管理,提高短期生存患者没有严重形式的ACLF,那些没有脓毒症、脑衰竭或多器官功能衰竭128年。g - csf被认为行为由骨髓干细胞动员的外围国家,包括肝脏,从而提高肝脏再生。
肾脏功能障碍和失败。急性肾损伤)是最常见的在ACLF器官衰竭8,129年。阿基的常见原因包括pre-renal,内在原因和小时129年。阿基不同取决于潜在的病因学,管理和尿液标志物有助于识别阿基的原因129年,130年。成交量复苏与晶体和/或白蛋白pre-renal AKI患者应使用(也就是说,损害肾功能相关hypovolaemia造成过度利尿治疗)。Terlipressin或去甲肾上腺素的首选治疗小时与白蛋白结合体积膨胀129年。给出Terlipressin或去甲肾上腺素减少内脏动脉血管舒张导致小时系统性循环功能障碍和肾血管收缩。白蛋白的影响最初认为是由于等离子体体积膨胀。然而,白蛋白的潜在影响调节患者的全身炎症ACLF最近被提出7,105年。肾脏替代治疗作为桥肝移植或肝肾移植患者严重的阿基,尽管透析的剂量和时间尚未完全研究129年。
心血管衰竭。在脓毒症的管理,积极卷复苏和血管收缩剂的起始剂(去甲肾上腺素)保持一个适当的血压器官灌注是至关重要的对抗与ACLF常状态发生14,131年。平均动脉压的目标是> 60毫米汞柱,应该关注与晶体体积政府鉴于容量超负荷的倾向在肝硬化患者118年。胶体,包括白蛋白,也可能引发容量超负荷。Terlipressin或加压素可以作为辅助剂。也有越来越多的证据表明,肾上腺机能不全在ACLF可以进一步妥协血液动力学132年。虽然存在争议,但评价肾上腺机能不全可以通过测量随机早上的皮质醇水平。如果这些水平是不确定的、肾上腺机能不全的可以证实的促肾上腺皮质激素(ACTH)测试(亦称cosyntropin tetracosactide或Synacthen测试),估计肾上腺对压力的反应。
大脑功能障碍和失败。与自来水灌肠治疗脑病,乳果糖和口头non-absorbable抗生素(rifaximin、新霉素等),通过改进的意识水平,可以防止支气管愿望,吸入性肺炎和呼吸衰竭14。重要的是滴定乳果糖适当剂量和灌肠,以防止hypovolaemia所导致的腹泻,并防止hypernatraemia(血清钠水平上升),结果从乳果糖。目标凳子上输出一天应该3 - 4排便133年。降低粪便输出不足减少肠道的生产从血氨和氨增加间隙。高凳子上输出可能诱发hypernatraemic脱水。iii iv级脑病患者应该插管,因为他们有一个高的风险经历支气管愿望(唾液或胃液体)。颅内压监测和使用甘露醇不推荐在这些患者脑水肿和肝性脑病患者的颅内高血压是例外与ACLF有关12。
凝血障碍。凝血障碍患者ACLF往往是难以管理的设置凝血和一个无效的止血剂之间的波动状态134年,135年。活动设置的出血和严重的凝血障碍,血小板输血,沉淀物(冰冻血液产品准备从等离子体用于增加纤维蛋白原水平)和血液应该考虑。然而,患者不应预防性输血等离子增加国际标准化比率。门静脉血栓形成的患者可能需要抗凝治疗预防复发性静脉曲张的出血。
重症监护和肝脏支持设备
进入重症监护单位是强制性的在血管的情况下,呼吸或脑衰竭和肾功能衰竭患者的建议。肝脏和凝固衰竭患者仍然可以在普通病房接受治疗,但需要严格的临床监测。依教规的研究8,50%的患者ACLF获准进入重症监护病房(86%的ACLF年级3)。由于ACLF患者死亡率高,治疗能够桥之间的时间承认严重疾病患者(ACLF二年级或三年级入学后3 - 7天),肝移植显然是必要的。
体外肝支持系统是ACLF潜在的治疗方法136年,137年。生物人工肝支持系统使用中空纤维生物反应器含有肝细胞病变的肝脏的代谢和合成功能支持。目前,只有肿瘤肝细胞或猪肝细胞行(兰德的重要疗法和Alliqua HepatAssist 2000系统)是可用的。最近的一项随机试验比较兰德与标准治疗并没有发现任何显著影响生存136年。非生物系统包括白蛋白透析技术和基于这个分子的能力将水不溶性物质和炎性分子(如pamp和ROS)保留在等离子体由于肝功能衰竭和系统性炎症105年。此外,白蛋白的生理学功能显著受损在失代偿肝硬化患者因为严重的氧化内源性活性氧分子,改变其分子结构和其他绑定网站的饱和水不溶性物质生产和/或保留由于肝功能衰竭(如胆红素、胆盐和药物)。三个不同的白蛋白透析系统是目前:Gambro分子吸附再循环系统(MARS),普罗米修斯分离血浆分离和吸收(FPSA)系统和费森尤斯医疗账本单程白蛋白透析(SPAD)。火星,在ACLF最广泛的系统评估,改善全身血液动力学和严重肝性脑病136年,137年。然而,两个大的随机、多中心的研究也没能证明使用火星和FPSA改善生存138年,139年。最后,一个人工肝装置(大学学院London-Liver透析设备),旨在删除和替换的功能失调的白蛋白肝硬化患者,减少循环endotoxaemia目前正在评估140年。血浆置换,一个解毒系统,增加急性肝衰竭患者的生存期141年非随机研究,改善肝性脑病和肝功能ACLF患者。
肝移植
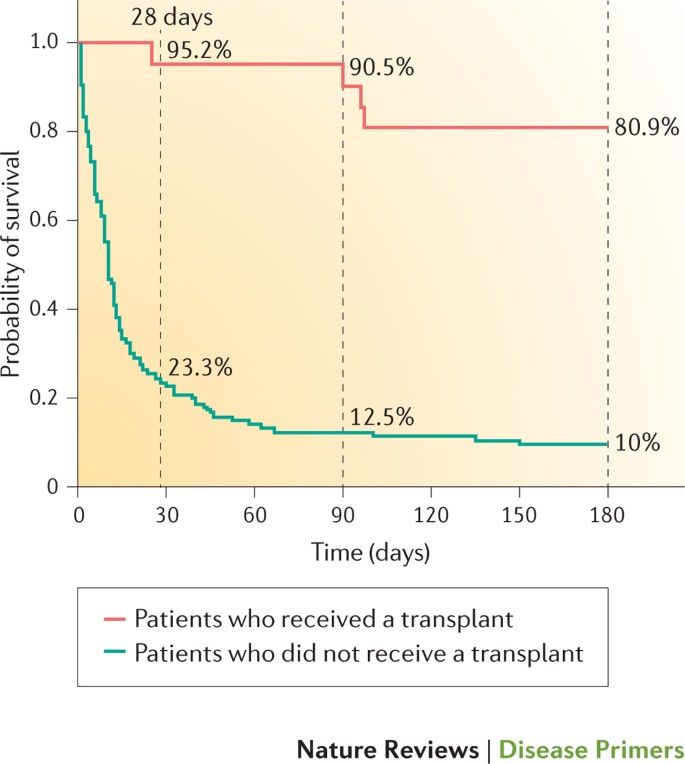
肝移植是唯一的治疗选择ACLF患者。然而,很少有研究评估它的可行性,选择标准(适应症和禁忌症),时机和有效性96年,142年- - - - - -148年。急性肝衰竭患者相比,患者ACLF目前不能包括在high-urgency移植名单。此外,正如ACLF发展迅速的临床过程,评价和清单的时间框架是经常很短。先进的年龄,活跃的酗酒,不受控制的感染和多器官功能衰竭的主要原因是禁忌移植或摘牌。有一个普遍共识,考虑到移植患者必须避免严重的循环或呼吸衰竭和持续的脓毒症。相比之下,对于大多数有经验的中心,支持器官(肾脏替代治疗和机械通风)不禁忌ACLF移植。目前的数据表明,只有不到一半的患者ACLF列出,过程是可行的只有10 - 25%的病人,> 50 - 70%的病人死在等候名单上列出147年。在美国最近的一项研究表明,肝硬化患者,ACLF MELD评分(> 40)和高死亡率有更高的候补名单)(几乎两倍高于状态1候选人(即急性肝衰竭患者)145年。定义标准选择和按优先级排序ACLF患者在等待名单将有助于改善结果通过提供及时的肝移植。几项研究表明,活体供肝移植和死者供体移植提供类似的结果在此设置146年- - - - - -148年。肝移植患者的报道结果ACLF好(图6),介于74%和90%在5年,很多类似的其他指标,观察肝移植的病人96年,144年- - - - - -148年。
管理算法
三个新的计分系统来源于轮唱的研究——CLIF-C分数(或CLIF-SOFA分数),该CLIF-C ACLF得分和CLIF-C广告得分——可以用来区分有危险的肝硬化病人和急性呼吸困难,表明早期肝移植和评估重症监护室治疗无效20.,98年(图7)。ACLF的预后不仅取决于数量的器官故障或CLIF-C ACLF得分在早期诊断而且对治疗的反应96年。近20%的患者ACLF三年级改善治疗后,三个或三个以上器官衰竭患者应该住进了重症监护室,应该得到无限制的器官支持短时间内(3 - 7天)。持久性三个或三个以上器官故障后干预可能导致需要考虑限制在一个致命的结果是维持生命的治疗几乎不变在缺乏“打捞”肝移植19。高CLIF-C ACLF初始干预后得分(> 64分)(在3 - 7天),也被认为是一个潜在的无用规则的病人没有早期肝移植的可能性96年。然而,这些标准需要进一步验证。早期肝移植患者潜在的候选人,包括活体供肝移植,不能限制他们的治疗。在那些没有选择移植,分数和务实的个案评估应该用于决策。
再生疗法
很少有研究评估小组的g - csf的治疗效果ACLF患者128年,149年,150年。这来源于干细胞的细胞因子动员骨,恢复中性粒细胞功能和促进肝再生。在不重的g - csf政府形式的ACLF减少发展中器官衰竭的风险(或失败)和脓毒症,改善生存。g - csf治疗似乎是无效的在脓毒症患者和那些有严重的ACLF形式。肝细胞和干细胞移植在ACLF也被建议作为潜在的治疗方法151年。
前景
ACLF定义
获得一个通用的挑战ACLF的定义是一个重要的问题。然而,APASL和西方之间的差异的定义太重要了不能单靠共识协议解决。不仅这些定义不同的病人的特点,诊断标准及临床课程,而且最重要的是,在疾病的概念视图。APASL会议定义假设的事件顺序与肝ACLF开始侮辱导致急性肝衰竭,因此,肝外器官衰竭(或失败)。相比之下,西方的定义依赖于概念的急性损伤肝功能(,如果强烈,被定义为肝衰竭)发展同时在其他器官的功能障碍(,如果强烈,也定义为器官衰竭)由于肝内或肝外的机制。这些机制可能包括强烈的系统性炎症相关的大量释放的抑制肝脏病(急性酒精性肝炎,病毒性肝炎或帝力)或pamp(通过入侵的细菌在脓毒症或从患者的肠道微生物群没有明确的诱发事件)。这样的争议只能通过促进研究解决在这个引人注目的新的综合症。
临床的挑战
调查ACLF一般都进行诊断后综合症。因此,很少有数据ACLF开发前的关键时期。前瞻性观察性研究在这一时期,因此,必要的,尤其是那些评估生物标志物或面板的系统性炎症的生物标记物,可以作为预测治疗反应和生存的价值。肝脏病理学ACLF还不够调查。在肝硬化患者由于乙型肝炎病毒感染,ACLF发生在设置submassive肝坏死27。在酒精性肝硬变患者和活跃的酗酒,严重肝硬化酒精性肝炎重叠的可能是主要的肝组织学。最后,最近的两项研究报道严重ductular bilirubinostasis和胆汁淤积,脓毒症患者的病变,也见过那些没有肝硬化,ACLF特定的病变156年,157年。
洞察病理生理学
顺序的研究先天和适应性免疫系统功能之前和之后ACLF缺乏。这样的研究理解ACLF机制至关重要。此外,免疫系统的功能可能会改变在综合症的临床过程。因为它发生在脓毒症158年、初始ACLF免疫系统的激活可能是紧随其后的是免疫抑制,这将有利于进一步的细菌易位和器官衰竭的进展(或失败)。
ACLF器官或系统故障的机理是主要的兴趣。肾衰竭在肝硬化被认为是次要的系统性循环功能障碍和受损的肾灌注。研究脓毒症的然而,最近的证据显示,肾功能衰竭也可能的结果直接影响肾脏炎症,损害肾微循环和细胞的功能159年。事实上,有证据表明,炎症可能参与心脏功能障碍的发病机制、脑病、相对肾上腺机能不全在肝硬化和肺功能障碍7。
ACLF研究的主要困难是缺乏合适的动物模型。碳tetrachloride-induced肝硬化大鼠肝硬化的是一个很好的模型,但动物死亡前肝外器官衰竭的发展160年。胆汁duct-ligated老鼠代表急性肝衰竭模型和腹水,结合急性腹腔内的有限合伙人,已被用来作为ACLF模型161年。然而,这种模式明显不同于人类肝硬化和肝外器官衰竭已记录。
治疗
系统性炎症为主要的识别机制ACLF开辟了新的领域新的治疗程序的设计。这些知识将促进新的人工肝支持系统的开发不仅能够消除潜在的有害分子保留器官功能衰竭的结果也导致ACLF炎性分子。总血浆置换141年显然是另一种方法来消除pamp,抑制自由基。
然而,一个主要问题在ACLF是预防的管理。有三个潜在的有效的治疗方法,应探索。第一个由细菌易位的预防长期口服不吸收性抗生素107年,110年,162年。长期每周管理静脉注射白蛋白是第二种方法。初步数据表明,这种技术预防细菌感染,安琪和肝性脑病和改善生存在一个大的意大利在失代偿肝硬化患者随机对照试验163年。最后,最近的调查显示缺陷的核心作用胆汁酸受体(也称为farnesoid X-activated受体)信号在肝脏炎症和肠道细菌易位,ACLF因素已知形状164年- - - - - -166年。Obeticholic酸是一种有效的胆汁酸受体激动剂。最近的动物研究表明,obeticholic酸降低门脉高压,改善细菌易位165年,166年,这表明它可能是潜在的ACLF患者受益。
引用
希内斯,P。等。补偿肝硬化:自然历史和预后因素。肝脏病学7,122 - 128 (1987)。
Schrier, r·W。等。外周动脉血管舒张的假设:一个建议的起始肾钠和水的潴留在肝硬化。肝脏病学8,1151 - 1157 (1998)。
弗雷泽,c . l . & Arieff a . i .肝性脑病。心血管病。j .地中海。313年,865 - 873 (1985)。
小儿麻痹症,j . & Groszmann r . j .血流动力学因素参与开发和食管静脉曲张破裂:病理生理的方法治疗。Semin。肝脏说。6,318 - 331 (1986)。
拉玛钱德朗P。,Iredale, J. P. & Fallowfield, J. A. Resolution of liver fibrosis: basic mechanisms and clinical relevance.Semin。肝脏说。35,119 - 131 (2015)。
秦,N。等。改变人类肠道微生物组的肝硬化。自然513年59 - 64 (2014)。
贝尔纳迪,M。男人味儿,R。天使,P。,Schnabl, B. & Arroyo, V. Mechanisms of decompensation and organ failure in cirrhosis: from peripheral arterial vasodilation to systemic inflammation hypothesis.j .乙醇。63年,1272 - 1284 (2015)。
男人味儿,R。等。Acute-on-chronic肝衰竭是一个截然不同的综合征,急性呼吸困难患者的肝硬化。胃肠病学144年,1426 - 1437。e9 (2013)。本文描述了第一个前瞻性调查评估诊断标准(EASL-CLIF财团ACLF)的定义,流行,诱发事件,分级ACLF严重程度和预后的一系列大型的欧洲失代偿肝硬化住院治疗的病人用务实的态度。
Wlodzimirow, k。伊斯拉米S。,Abu-Hanna, A., Nieuwoudt, M. & Chamuleau, R. A. F. M. A systematic review on prognostic indicators of acute on chronic liver failure and their predictive value for mortality.肝脏Int。3340-52 (2013)。
道路,r &威廉姆斯,r . Acute-on-chronic肝衰竭:病理生理基础的治疗选择。血液Purif。20.,252 - 261 (2002)。
萨林,美国K。等。Acute-on-chronic肝衰竭:共识建议亚洲太平洋肝脏研究协会(APASL)。乙醇。Int。3,269 - 282 (2009)。本文描述的结果APASL会议推广的共识旨在评估诊断ACLF的定义。
萨林,美国K。等。Acute-on-chronic肝衰竭:共识建议亚洲太平洋研究协会的肝脏(APASL) 2014。乙醇。Int。8,453 - 471 (2014)。
巴贾杰,j·S。等。在感染相关性生存acute-on-chronic肝衰竭是由extra-hepatic器官定义失败。肝脏病学60,250 - 256 (2014)。这项研究显示了ACLF患病率和相关的死亡率在一个大的一系列肝硬化患者和细菌感染来自美国。
道路,R。等。Acute-on慢性肝衰竭。j .乙醇。57,1336 - 1348 (2012)。
肝功能衰竭和人工肝组织,中国社会的传染病,中国医学协会;严重肝脏疾病和人工肝组肝脏病学的中国社会,中国医学协会。(肝衰竭诊断和治疗指南(2012年版)]。中华甘藏必应21,177 - 183(中文)(2013)。
文森特,j·L。等。沙发(Sepsis-related器官衰竭评估)得分来描述器官功能障碍或衰竭。代表工作组Sepsis-Related重症监护医学的欧洲社会的问题。重症监护医学。22,707 - 710 (1996)。
威尔,M。,Kokoska, J., Reulbach, U., Hahn, E. G. & Strauss, R. Short-term prognosis in critically ill patients with cirrhosis assessed by prognostic scoring systems.肝脏病学34,255 - 261 (2001)。
Das, V。等。肝硬化患者在医疗重症监护室:早期预后和长期生存。暴击。保健医疗。38,2108 - 2116 (2010)。
几何,E。等。前瞻性评估肝硬化病人预后评分的重症监护室。j .乙醇。56,95 - 102 (2012)。
道路,R。等。开发和验证预后评分系统预测死亡率在患有急性慢性肝衰竭。j .乙醇。61年,1038 - 1047 (2014)。本研究描述了ACLF患者的预后评分系统专门设计。这个分数的准确性(CLIF-C ACLF分数)是所有得分显著高于目前用于临床实践。
伯纳尔,W。等。Acute-on-chronic肝功能衰竭。《柳叶刀》386年,1576 - 1587 (2015)。
Bernsmeier C。等。acute-on-chronic肝衰竭患者增加了监管的免疫细胞的数量表达受体酪氨酸激酶MERTK。胃肠病学148年,603 - 615。e14灯头(2015)。
张,问。等。比较当前acute-on-chronic肝衰竭的诊断标准。《公共科学图书馆•综合》10e0122158 (2015)。
李,H。等。特点,acute-on-chronic肝硬化肝功能衰竭的诊断和预后相关乙肝。科学。代表。625487 (2016)。这项研究表明,EASL-CLIF财团ACLF专为欧洲病人的定义也可以用于中国肝硬化患者由于乙肝病毒感染流行中没有重大分歧,严重程度和预后。
Dirchwolf, M。等。免疫功能紊乱在肝硬化:根据肝硬化严重程度不同的细胞表型。细胞因子77年14-25 (2015)。
Amarapurkar D。等。Acute-on-chronic肝衰竭:前瞻性研究来确定临床资料,结果,和因素预测死亡率。印度j .杂志。34,216 - 224 (2015)。
李,H。等。Submassive肝坏死区分HBV-associated急性慢性肝衰竭的肝硬化患者急性呼吸困难。j .乙醇。63年50,59 (2015)。
辛格,h & Pai c . g .定义acute-on-chronic肝衰竭:东、西方或中间地带?世界j .乙醇。7,2571 - 2577 (2015)。
Agrawal, S。,Duseja, A., Gupta, T., Dhiman, R. K. & Chawla, Y. Simple organ failure count versus CANONIC grading system for predicting mortality in acute-on-chronic liver failure.j .杂志。乙醇。30.,575 - 581 (2015)。
李,M。等。CLIF-SOFA评分系统准确地预测短期死亡率严重失代偿性的酒精性肝硬变患者:回顾性分析。肝脏Int。3546-57 (2015)。
Dhiman, r·K。、Agrawal年代。古普塔,T。,Duseja, A. & Chawla, Y. Chronic Liver Failure-Sequential Organ Failure Assessment is better than the Asia-Pacific Association for the Study of Liver criteria for defining acute-on-chronic liver failure and predicting outcome.世界j .杂志。20.,14934 - 14941 (2014)。
金,h . Y。等。表征acute-on-chronic肝衰竭患者死亡率的预测亚洲活跃酗酒。j .杂志。乙醇。31日,427 - 433 (2016)。
d . j . Kim t y & Kim Acute-on-chronic肝功能衰竭。中国。摩尔。乙醇。19,349 - 359 (2013)。
道路,R。等。对一种改进的定义acute-on-chronic肝功能衰竭。胃肠病学147年4到10 (2014)。
金,t Y。等。acute-on-chronic肝衰竭的特征和差异:需要一个统一的定义。《公共科学图书馆•综合》11e0146745 (2016)。这项研究首次表明,EASL-CLIF财团定义和ACLF的APASL定义包括不同人群的患者。
萨林,s . k . & Choudhury Acute-on-chronic肝衰竭:术语、机制和管理。Nat,启杂志。乙醇。13,131 - 149 (2016)。
奥尔森Kamath j . c . & p s Acute-on-chronic肝衰竭:概念、自然历史和预后。咕咕叫。当今。暴击。护理17,165 - 169 (2011)。
辛格,K . K。,Panda, S. K., & Shalimar Acharya, S. K. Patients with diabetes mellitus are prone to develop severe hepatitis and liver failure due to hepatitis virus infection.j .中国。Exp。乙醇。3,275 - 280 (2013)。
韦贝克(L。,Nevens, F. & Laleman, W. Bench-to-beside review: acute-on-chronic liver failure — linking the gut, liver and systemic circulation.暴击。护理15233 (2011)。
Suntharalingam G。等。细胞因子风暴的第一阶段试验anti-CD28单克隆抗体比。心血管病。j .地中海。355年,1018 - 1028 (2006)。
Medzhitov, R。,Schneider, D. S. & Soares, M. P. Disease tolerance as a defense strategy.科学335年,936 - 941 (2012)。
Medzhitov, r .起源和生理角色的炎症。自然454年,428 - 435 (2008)。
竹内,o . &彰,s .模式识别受体和炎症。细胞140年,805 - 820 (2010)。
Iwasaki, a & Medzhitov r控制适应性免疫的先天免疫系统。Immunol Nat。16,343 - 353 (2015)。
吴,j .陈& z . j .胞质核酸的先天免疫传感和信号。为基础。启Immunol。32,461 - 488 (2014)。
徐,H。等。先天免疫传感的细菌修改的ρgtpase pyrin inflammasome。自然513年,237 - 241 (2014)。
赵,Y。等。的NLRC4 inflammasome受体细菌鞭毛蛋白和III型分泌器。自然477年,596 - 600 (2011)。
玛蒂农,F。,Mayor, A. & Tschopp, J. The inflammasomes: guardians of the body.为基础。启Immunol。27,229 - 265 (2009)。
河野,h &岩石,k . l .死亡细胞如何提醒免疫系统危险。启Immunol Nat。8,279 - 289 (2008)。
理查德,j . A。等。RIPK1调节RIPK3-MLKL-driven系统性炎症和紧急造血作用。细胞157年,1175 - 1188 (2014)。
安格斯特区& van der民调显示,t .严重脓毒症和脓毒性休克。心血管病。j .地中海。369年,840 - 851 (2013)。
2010年Medzhitov, r .炎症:旧情人的新冒险。细胞140年,771 - 776 (2010)。
Iwasaki, a & Medzhitov r调节适应性免疫的先天免疫系统。科学327年,291 - 295 (2010)。
Chovatiya, r & Medzhitov, r .压力,炎症,和国防的体内平衡。摩尔。细胞54,281 - 288 (2014)。
道路,R。等。在肝硬化的细菌感染。立场声明基于EASL 2013特别会议。j .乙醇。60,1310 - 1324 (2014)。
王寅,R。,Lawson, M. & Geuking, M. Pathological bacterial translocation in liver cirrhosis.j .乙醇。60,197 - 209 (2014)。
Byl B。,Roucloux, I., Crusiaux, A., Dupont, E. & Devière, J. Tumor necrosis factor alpha and interleukin 6 plasma levels in infected cirrhotic patients.胃肠病学104年,1492 - 1497 (1993)。
Navasa, M。等。肿瘤坏死因子和白细胞介素- 6在肝硬化自发性细菌性腹膜炎:与肾功能损害的发展和死亡率之间的关系。肝脏病学27,1227 - 1232 (1998)。首次引用57和58显示体内过剩的促炎细胞因子在肝硬化患者。
Gustot, T。,Durand, F., Lebrec, D., Vincent, J.-L. & Moreau, R. Severe sepsis in cirrhosis.肝脏病学50,2022 - 2033 (2009)。
Deviere, J。等。过度在体外细菌lipopolysaccharide-induced生产monokines肝硬化。肝脏病学11,628 - 634 (1990)。本文第一次表明,来自体内的先天免疫反应有限合伙人在酒精性肝硬变患者单核细胞从管制。
Le Moine O。等。的角色中有缺陷的单核细胞白细胞介素- 10”释放肿瘤坏死因子-α在酗酒者肝硬化生产过剩。肝脏病学22,1436 - 1439 (1995)。
塔子,k。等。Upregulation tnf的生产从晚期肝硬化患者单核细胞信号通路:Akt和IRAK-M可能的作用。j .乙醇。45,280 - 289 (2006)。本文描述了过度的细胞内机制参与先天免疫反应在失代偿肝硬化患者单核细胞从有限合伙人。
塔子,k。等。蛋白质芯片技术研究细胞因子生产由先进的酒精性肝硬变患者单核细胞:一个体外试点研究。乙醇。Res。39,706 - 715 (2009)。
Galbois,。等。体外高密度脂蛋白的影响暴露在lipopolysaccharide-induced严重肝硬化患者的炎症反应。肝脏病学49,175 - 184 (2009)。
Coant, N。等。糖原合成酶激酶3参与过度促炎反应有限合伙人在失代偿肝硬化患者。j .乙醇。55,784 - 793 (2011)。
Gandoura, S。等。基因和exon-expression分析揭示了一个广泛的LPS-induced响应在肝硬化患者的免疫细胞。j .乙醇。58,936 - 948 (2013)。
海勒,J。等。脂多糖对TNFα生产的影响,肝NOS2活动,并在与肝硬化大鼠肝毒性。j .乙醇。33,376 - 381 (2000)。
男人味儿,R。等。Terlipressin抑制在活的有机体内主动脉伊诺表达脂多糖诱导的大鼠胆汁性肝硬化。肝脏病学36,1070 - 1078 (2002)。
Urbanowicz, W。等。Tezosentan,内皮素受体拮抗剂,限制在内毒素挑战肝硬化大鼠肝损伤。肠道53,1844 - 1849 (2004)。
塔子,k。等。在活的有机体内改变的蛋白质反应和细胞凋亡在肝脏lipopolysaccharide-challenged肝硬化大鼠。j .乙醇。46,1075 - 1088 (2007)。本文第一次表明,LPS-induced肝脏内质网应激抑制NF-κB-dependent抗凋亡蛋白的积累与肝硬化大鼠的肝脏。
Thabut D。等。高密度脂蛋白政府减弱肝脏炎性反应,恢复肝脏内皮一氧化氮合酶活性,降低门户在肝硬化大鼠压力。肝脏病学46,1893 - 1906 (2007)。
考夫曼Malhi, h & r . j .内质网应激在肝脏疾病。j .乙醇。54,795 - 809 (2011)。
Chaisson m . L。,Brooling, J. T., Ladiges, W., Tsai, S. & Fausto, N. Hepatocyte-specific inhibition of NF-κB leads to apoptosis after TNF treatment, but not after partial hepatectomy.j .中国。投资。110年,193 - 202 (2002)。
Louvet,。等。感染严重的酒精性肝炎患者治疗类固醇:早期反应治疗是关键因素。胃肠病学137年,541 - 548 (2009)。
使用清洁,m R。,Mathurin, P. & Morgan, T. R. Alcoholic hepatitis.心血管病。j .地中海。360年,2758 - 2769 (2009)。
Ubeda, M。等。Obeticholic酸减少,抑制肠道细菌易位在肝硬化大鼠肠道炎症。j .乙醇。64年,1049 - 1057 (2015)。
Du Plessis), J。等。激活在肝硬化患者肠巨噬细胞释放il - 6,不得扰乱肠道屏障功能。j .乙醇。58,1125 - 1132 (2013)。
弗朗西丝,R。等。细菌易位是由anti-TNFα单克隆抗体表达下调政府在大鼠肝硬化和腹水。j .乙醇。46,797 - 803 (2007)。
Dominguez, M。等。科学家的肝脏表达趋化因子预测门户高血压和酒精性肝炎患者的生存期。胃肠病学136年,1639 - 1650 (2009)。本文表明neutrophil-attracting趋化因子在肝脏严重酒精性肝硬变患者。
限制,即f &凯蒂,r . m .许多在炎症趋化因子和趋化因子受体的角色。心血管病。j .地中海。354年,610 - 621 (2006)。
Kubes, p . & Mehal w z无菌炎症在肝脏。胃肠病学143年,1158 - 1172 (2012)。
Larosche,我。等。长期乙醇政府耗尽MnSOD-overexpressing转基因小鼠线粒体DNA,但不是在野生型的同胞。Toxicol。达成。杂志。234年,326 - 338 (2009)。
Choumar,。等。Lipopolysaccharide-induced线粒体DNA损耗。Antioxid。氧化还原信号。15,2837 - 2854 (2011)。
西方,a P。等。线粒体DNA压力启动抗病毒先天免疫反应。自然520年,553 - 557 (2015)。
Dubuquoy, L。等。祖细胞扩张和受损肝细胞再生移植肝脏从酒精性肝炎。肠道64年,1949 - 1960 (2015)。
布伦纳,d . A。沉重的一击,中州。& Schnabl肠道微生物群在肝脏疾病中的作用。j .中国。杂志。49S25-S27 (2015)。
巴贾杰,j·S。等。改变的人类肠道微生物组与肝硬化及其并发症有关。j .乙醇。60,940 - 947 (2014)。
巴贾杰,j·S。等。连杆的肠道微生物组肝性脑病的认知。点。j .杂志。Gastrointest。肝脏杂志。302年G168-G175 (2012)。
陈,Y。等。肝硬化患者的粪便微生物群落的特征。肝脏病学54,562 - 572 (2011)。
陈,Y。等。肠道失调acute-on-chronic肝功能衰竭,死亡率的预测价值。j .杂志。乙醇。30.,1429 - 1437 (2015)。
锅,C。等。脂多糖含量的动态变化的不同阶段在慢性乙型肝炎急性肝功能衰竭。《公共科学图书馆•综合》7e49460 (2012)。
鲍尔,t . M。等。小肠细菌过度生长在人类肝硬化与系统性的内毒素。点。j .杂志。97年,2364 - 2370 (2002)。本文展示了一个协会之间的微生物群改变和系统性endotoxaemia肝硬化患者。
Zapater, P。等。血清和腹水细菌的DNA:一个新的未感染肝硬化患者的独立预后因素。肝脏病学48,1924 - 1931 (2008)。
麦克菲尔,m·j·W。等。增加了肝硬化患者生存和器官衰竭肝脏重症监护和验证的慢性肝脏Failure-Sequential器官衰竭评分系统。中国。杂志。乙醇。13,1353 - 1360。e8 (2015)。
席尔瓦,p . E . s . E。等。只有验证acute-on-chronic EASL-CLIF联盟定义的肝功能衰竭和CLIF-SOFA死亡率的预测肝硬化。肝脏Int。35,1516 - 1523 (2015)。
Gustot, T。等。acute-on-chronic肝衰竭综合症的临床过程和对预后的影响。肝脏病学62年,243 - 252 (2015)。这项研究是第一个调查的临床过程定义ACLF后28天内诊断。这表明ACLF是一个极其动态的综合症,可能改善,恶化或遵循一个稳定的过程。预后是高度依赖于临床诊断后第一周内。
施,Y。等。Acute-on-chronic肝衰竭沉淀,沉淀的肝脏损伤明显不同于肝外的侮辱。肝脏病学62年,232 - 242 (2015)。本研究证实轮唱的研究在欧洲病人的结果,表明短期(28天及90天)患者死亡率在亚洲ACLF取决于数量的器官的失败,而不是病因学(突发事件类型)的综合症。
道路,R。等。克利夫财团急性呼吸困难评分(CLIF-C广告)的预后没有acute-on-chronic住院肝硬化患者肝功能衰竭。j .乙醇。62年,831 - 840 (2015)。
Kamath p s &金,w . r .终末期肝病模型(MELD)。肝脏病学45,797 - 805 (2007)。
勾勒出f &眉毛,d .肝硬化的预后评估:儿童与融合。j .乙醇。42S100-S107 (2005)。
Biggins, s . w .使用血清钠肝移植移植分配:十年了,现在是准备黄金时段吗?肝脏Transpl。21,279 - 281 (2015)。
费尔南德斯j . &阿罗约诉细菌感染肝硬化:一个日益严重的问题产生了重大影响。中国。肝脏说。2,102 - 105 (2013)。
萨林,美国K。等。亚太管理乙肝临床实践指南:2015更新。乙醇。Int。101 - 98 (2016)。
排序,P。等。静脉注射白蛋白对肾功能损害和死亡率的影响患者的肝硬化并自发性细菌性腹膜炎。心血管病。j .地中海。341年,403 - 409 (1999)。这个随机对照试验是第一个表明,静脉注射白蛋白(1.5克/公斤体重的感染诊断和每公斤体重1克在第三天)是高度有效预防1型小时和死亡率在肝硬化患者和自发性细菌性腹膜炎。
阿罗约,V。,García-Martinez, R. & Salvatella, X. Human serum albumin, systemic inflammation, and cirrhosis.j .乙醇。61年,396 - 407 (2014)。
格瓦拉,M。等。白蛋白对其他细菌感染肝硬化自发性细菌性腹膜炎。一项随机、对照研究。j .乙醇。57,759 - 765 (2012)。
Thevenot, T。等。白蛋白的影响在肝硬化患者感染自发性细菌性腹膜炎。一个随机试验。j .乙醇。62年,822 - 830 (2015)。
希内斯,P。等。诺氟沙星防止肝硬化自发性细菌性腹膜炎复发:结果的双盲、安慰剂对照试验。肝脏病学12,716 - 724 (1990)。
索里亚诺,G。等。诺氟沙星可以防止细菌感染在侦测与胃肠道出血。胃肠病学103年,1267 - 1272 (1992)。
费尔南德斯,J。等。自发性细菌性腹膜炎的主要预防延迟肝肾综合征在肝硬化和改善生存。胃肠病学133年,818 - 824 (2007)。这个随机对照试验是第一个表明诺氟沙星的长期口服预防自发性细菌性腹膜炎的发展,类型1小时,改善肝硬化患者的生存期和严重的肝脏和肾脏功能障碍。
Zapater, P。等。诺氟沙星调节炎症反应和直接影响中性粒细胞在失代偿肝硬化患者。胃肠病学137年,1669 - 1679。e1 (2009)。
Gomez-Hurtado,我。等。Interleukin-10-mediated血红素加氧酶1-induced底层机制炎症下调诺氟沙星的肝硬化。肝脏病学53,935 - 944 (2011)。
Gomez-Hurtado,我。等。白介素10在诺氟沙星预防腔的自由与肝硬化小鼠内毒素易位。j .乙醇。61年,799 - 808 (2014)。
Akriviadis E。等。Pentoxifylline改善短期生存严重急性酒精性肝炎:双盲,安慰剂对照试验。胃肠病学119年,1637 - 1648 (2000)。
Nguyen-Khac E。等。糖皮质激素+N乙酰半胱氨酸在严重的酒精性肝炎。心血管病。j .地中海。365年,1781 - 1789 (2011)。
Thursz认为,m R。等。强的松或pentoxifylline酒精性肝炎。心血管病。j .地中海。372年,1619 - 1628 (2015)。
Kedarisetty c K。等。粒细胞集落刺激因子和促红细胞生成素失代偿肝硬化患者的改善结果。胃肠病学148年,1362 - 1370。e7 (2015)。
阿罗约,V。,男人味儿,R。,道路,R。&Ginès, P. Acute-on-chronic liver failure: a new syndrome that will re-classify cirrhosis.j .乙醇。62年S131-S143 (2015)。
濑户,W.-K。,Lai, C.-L. & Yuen, M.-F. Acute-on-chronic liver failure in chronic hepatitis B.j .杂志。乙醇。27,662 - 669 (2012)。
加戈,H。等。替诺福韦改善结果在自发活化的乙肝患者呈现acute-on-chronic肝功能衰竭。肝脏病学53,774 - 780 (2011)。
飞利浦,c . a &沙林,s . k .强有力的抗病毒疗法改善生存在急性慢性肝衰竭由于乙型肝炎病毒再活化。世界j .杂志。20.,16037 - 16052 (2014)。这项研究的结果清楚地表明,强有力的抗病毒治疗显著改善患者的临床过程和生存ACLF由于乙肝病毒再活化。
而,y . M。等。抗菌治疗结果的决定因素从脓毒性休克患者肝硬化。肝脏病学56,2305 - 2315 (2012)。
经脉,p & Garcia-Tsao g .细菌感染,败血症,multiorgan失败在肝硬化。Semin。肝脏说。2826-42 (2008)。
费尔南德斯,J。,经脉,P。,Mensa, J. & Garcia-Tsao, G. Antibiotic prophylaxis in cirrhosis: good and bad.肝脏病学63年,2019 - 2031 (2016)。
陈,T。等。核苷类似物的短期和长期预后改善患者乙型肝炎病毒相关acute-on-chronic肝功能衰竭。中国。Exp。地中海。12,159 - 164 (2012)。
谢,F。等。核苷类似物对慢性肝炎患者的影响B-associated肝衰竭:荟萃分析。《公共科学图书馆•综合》8e54773 (2013)。
杨,J。等。初始联合抗病毒治疗拉米夫定、阿德福伟减少短期死亡率hepatitis-B-virus-related acute-on-chronic肝功能衰竭。性研究。J。1297 (2015)。
加戈,V。等。粒细胞集落刺激因子动员CD34+细胞和提高acute-on-chronic肝衰竭患者的生存。胃肠病学142年,505 - 512。e1 (2012)。
天使,P。等。急性肾损伤的诊断和管理在肝硬化患者:修订后的共识建议国际俱乐部的腹水。j .乙醇。62年,968 - 974 (2015)。本文提供了最现代的临床诊断和治疗的指南在肝硬化。
贝尔彻,j . M。等。尿液标志物和安琪在肝硬化患者的进展。中国。j。Soc。Nephrol。9,1857 - 1867 (2014)。
河流,E。等。早期目标导向治疗治疗严重脓毒症和脓毒性休克。心血管病。j .地中海。345年,1368 - 1377 (2001)。
忠贞G。等。肾上腺皮质功能障碍在肝脏疾病:一项系统回顾。肝脏病学55,1282 - 1291 (2012)。
Vilstrup, H。等。在慢性肝病肝性脑病:2014年实践指南由美国肝病研究协会和欧洲肝脏研究协会。肝脏病学60,715 - 735 (2014)。
Bianchini, M。,De Pietri, L. & Villa, E. Coagulopathy in liver diseases: complication or therapy?挖。说。32,609 - 614 (2014)。
德·弗兰,r &斜坡VI晶教员。在门静脉高压扩大共识:斜坡VI晶共识研讨会的报告:门脉高压分层风险和个性化医疗。j .乙醇。63年,743 - 752 (2015)。本文提供了最现代的临床诊断指南管理在肝硬化门脉高压和胃肠道出血。有详细描述的管理门户静脉血栓形成患者的凝血障碍。
李,美国Y。,Kim, H. J. & Choi, D. Cell sources, liver support systems and liver tissue engineering: alternatives to liver transplantation.Int。j .干细胞836-47 (2015)。
Struecker B。,Raschzok, N. & Sauer, I. M. Liver support strategies: cutting-edge technologies.Nat,启杂志。乙醇。11,166 - 176 (2014)。本文包含一个全面审查的人工肝支持策略在急性肝衰竭患者和ACLF。
Banares, R。等。与分子吸附再循环系统体外白蛋白透析acute-on-chronic肝衰竭:减压试验。肝脏病学57,1153 - 1162 (2013)。
Kribben,。等。影响分离血浆分离和吸附acute-on-chronic肝衰竭患者的生存期。胃肠病学142年,782 - 789。e3 (2012)。
李,k . c . L。等。体外肝协助设备交换白蛋白和去除内毒素急性肝衰竭:一个关键的临床前研究的结果。j .乙醇。63年,634 - 642 (2015)。
拉森,f·S。等。大容量在急性肝衰竭患者血浆置换:一个开放的随机对照试验。j .乙醇。64年,69 - 78 (2016)。
Bahirwani, R。动了一下,O。Bewtra, M。,Forde, K. & Reddy, K. R. Acute-on-chronic liver failure before liver transplantation: impact on posttransplant outcomes.移植92年,952 - 957 (2011)。
段,B.-W。等。肝移植在acute-on-chronic肝衰竭患者高终末期肝病模型(MELD)评分:一个中心连续100例的经验。j . Surg. Res。183年,936 - 943 (2013)。
Finkenstedt,。等。Acute-on-chronic肝衰竭:优秀的结果肝移植术后高死亡率在等待名单上。肝脏Transpl。19,879 - 886 (2013)。
沙玛,P。,Schaubel, D. E., Gong, Q., Guidinger, M. & Merion, R. M. End-stage liver disease candidates at the highest model for end-stage liver disease scores have higher wait-list mortality than status-1A candidates.肝脏病学55,192 - 198 (2012)。
陈,a . C。等。acute-on-chronic肝衰竭肝移植。乙醇。Int。3,571 - 581 (2009)。
Chan a . c . y &粉丝,s . t . ACLF肝移植标准和结果。乙醇。Int。9,355 - 359 (2015)。
Reddy, m . S。,Rajalingam, R. & Rela, M. Liver transplantation in acute-on-chronic liver failure: lessons learnt from acute liver failure setting.乙醇。Int。9,508 - 513 (2015)。
Khanam,。等。改变频率的树突细胞IFN-γ-secreting T细胞和粒细胞集落刺激因子(g - csf)治疗acute-on -慢性肝衰竭。肝脏Int。34,505 - 513 (2014)。
段,X.-Z。等。粒细胞集落刺激因子治疗提高了患者的生存乙型肝炎病毒相关acute-on-chronic肝功能衰竭。世界j .杂志。19,1104 - 1110 (2013)。
妈,X.-R。等。自体间充质干细胞移植的终末期肝硬化:一个荟萃分析基于七个对照试验。杂志。Pract >,2015年908275 (2015)。
Volk, m . L。,Tocco, R. S., Bazick, J., Rakoski, M. O. & Lok, A. S. Hospital readmissions among patients with decompensated cirrhosis.点。j .杂志。107年,247 - 252 (2012)。
Reddy, k . R。等。高退市的风险或死亡在肝脏移植候选人后感染:北美财团的结果终末期肝脏疾病的研究。肝脏Transpl。21,881 - 888 (2015)。
奥利里,j·G。等。长期使用抗生素和质子泵抑制剂预测肝硬化患者感染的发展。中国。杂志。乙醇。13,753 - 759。e2 (2015)。
战斗中,c, E。,Davies, G. & Evans, P. A. Long term health-related quality of life in survivors of sepsis in south west Wales: an epidemiological study.《公共科学图书馆•综合》9e116304 (2014)。
Vanwijngaerden Y.-M。等。相关重要疾病引起循环胆汁酸升高改变肝脏转运蛋白和核受体表达。肝脏病学54,1741 - 1752 (2011)。
Katoonizadeh,。等。acute-on-chronic酒精肝衰竭的早期特征:前瞻性队列研究。肠道59,1561 - 1569 (2010)。
霍奇,r S。,Monneret, G. & Payen, D. Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy.启Immunol Nat。13,862 - 874 (2013)。
戈麦斯,H。等。sepsis-induced急性肾损伤的统一理论:炎症,microcirculatory功能障碍,生物能学,管状细胞适应损伤。冲击413-11 (2014)。本文包含一个全面审查机制的阿基与系统性炎症脓毒症有关。阿奇和其他类型的概念可能会扩展到ACLF器官衰竭。
吉梅内斯,W。,Clária, J., Arroyo, V. & Rodés, J. Carbon tetrachloride induced cirrhosis in rats: a useful tool for investigating the pathogenesis of ascites in chronic liver disease.j .杂志。乙醇。7,90 - 97 (1992)。
哈利,D。等。内毒素敏感性增加胆汁duct-ligated肝硬化大鼠。肝脏病学30.,1198 - 1205 (1999)。
巴斯:M。等。Rifaximin治疗肝性脑病。心血管病。j .地中海。362年,1071 - 1081 (2010)。本文报告一个随机对照试验表明,口服rifaximin高度有效预防复发的肝性脑病的肝硬化。
贝尔纳迪,M。等。长期使用白蛋白治疗腹水的肝硬化患者:临时答案的分析研究。挖。丽芙·。说。47(5。1)e6 (2015)。
Neuschwander-Tetri, b。等。Farnesoid X核受体配体obeticholic non-cirrhotic酸,非酒精性脂肪肝(FLINT):多中心,随机,安慰剂对照试验。《柳叶刀》385年,956 - 965 (2015)。
韦贝克(L。等。Obeticholic酸,farnesoid X受体激动剂,改善了由两种不同的途径在肝硬化门脉高压大鼠。肝脏病学59,2286 - 2298 (2014)。
韦贝克(L。等。FXR受体激动剂obeticholic酸可以防止肠道屏障功能障碍和在淤胆型大鼠肠道细菌易位。点。j .分册。185年,409 - 419 (2015)。本文报道实验性肝硬化的一项研究表明,口服obeticholic酸改善肠道通透性,肠道炎症和细菌易位。
Kayagaki, N。等。经典之中inflammasome TLR4的激活细胞内的有限合伙人独立。科学341年,1246 - 1249 (2013)。
施,J。等。炎症还存在先天免疫受体胞内有限合伙人。自然514年,187 - 192 (2014)。
被,p .免疫学:目标驱动pyroptosis半胱天冬酶。自然526年,642 - 643 (2015)。
Sargenti, K。Prytz, H。,Nilsson, E. & Kalaitzakis, E. Predictors of mortality among patients with compensated and decompensated liver cirrhosis: the role of bacterial infections and infection-related acute-on-chronic liver failure.Scand。j .杂志。50,875 - 883 (2015)。
布莱,a t &科尔多瓦,j .肝性脑病。点。j .杂志。96年,1968 - 1976 (2001)。
确认
欧洲研究协会Liver-Chronic肝功能衰竭(EASL-CLIF)财团支持欧洲肝脏研究协会,从Grifols支持一种无限制的补助金。作者感谢d·j·金的供应韩国出版的数据和数据管理中心的EASL-CLIF财团提供欧洲未发表的数据中使用图2。
作者信息
作者和联系
贡献
介绍(使得);流行病学(P.S.K.);/病理生理学机制(m .并胡说八道);诊断、筛查和预防(P.G.,退役军人和参考书籍);管理(R.J.,G.G.-T。,U.T. and J.F.); Quality of life (P.S.K.); Outlook (F.N. and V.A.); Overview of Primer (V.A.). V.A. and R.M. contributed equally to this work.
相应的作者
道德声明
相互竞争的利益
退役军人收到Grifols研究经费,武田的科学顾问委员会。从Grifols P.G.获得研究经费,显示出的科学顾问委员会和Squana医疗和收到Sequana医学研究经费。R.J.获得研究经费的重要疗法,曾企图制药公司的科学顾问委员会和武田,Gambro和Grifiols研究合作的一个行业赞助研究的首席研究员(Sequana医学)。F.N.曾科学顾问委员会的中心部分,克罗伊胭脂比利时,拦截,戈尔,百时美施贵宝,AbbVie,诺华,默沙东,Janssen-Cilag, Promethera生物科学和基列,从罗氏公司和获得资助,阿斯特拉,显示出,诺华,Janssen-Cilag和AbbVie。所有其他作者声明没有利益冲突。
权利和权限
关于这篇文章
引用这篇文章
阿罗约,V。,男人味儿,R。,Kamath, P.et al。Acute-on-chronic肝硬化肝功能衰竭。Nat牧师说引物216041 (2016)。https://doi.org/10.1038/nrdp.2016.41
发表:
DOI:https://doi.org/10.1038/nrdp.2016.41
本文引用的
细胞治疗终末期肝脏疾病:取代和改造
干细胞研究与治疗(2023)
部分脾栓塞作为救援和紧急治疗门静脉高压和胃食管静脉曲张的出血
BMC胃肠病学(2023)
全球肝硬化病因学,流行病学趋势和预测
自然评论胃肠病学和肝脏病学(2023)
肠道乳酸菌和益生菌乳酸菌lactis / rhamnosis改善肝纤维化的预防和治疗
微生物学杂志(2023)
acute-on-chronic肝衰竭患者细胞因子吸附(CYTOHEP)——单中心、非盲、三臂,随机对照干预试验
试用(2022)