文摘gydF4y2Ba
成纤维细胞调节组织内稳态、协调炎症反应和调解组织损伤。在类风湿性关节炎(RA)滑膜成纤维细胞维持慢性炎症导致关节破坏。对成纤维细胞异质性或如果在成纤维细胞畸变子集与病理相关。在这里,我们显示功能和纤维母细胞转录差异子集使用批量从人体滑膜组织转录组的有针对性的亚种群和单细胞转录组。我们确定了七个成纤维细胞有着截然不同的表面蛋白表型的子集,和折叠成三个子集通过整合转录组数据。纤维母细胞一个子集,其特点是蛋白质的表达podoplanin, THY1膜糖蛋白和cadherin-11,但缺乏CD34,三倍扩大在RA患者相对于骨关节炎患者。这些成纤维细胞定位血管周的区域在滑膜发炎,分泌促炎细胞因子,增殖,有体外入侵细胞的表型特征。我们的策略可能会被用作模板来确定致病性基质细胞在其他复杂疾病子集。gydF4y2Ba
介绍gydF4y2Ba
成纤维细胞是终末器官病理学的重要介质在慢性炎症和纤维化疾病和炎症。虽然这些细胞调节正常基质沉积和伤口愈合的炎症,慢性激活成纤维细胞可以分化成myofibroblasts生产所需的胶原蛋白,在肺纤维化,肝、肠道、皮肤和其他组织gydF4y2Ba1gydF4y2Ba。相反,长期激活成纤维细胞负责过度矩阵退化软骨破坏,造成永久性的关节损伤在类风湿性关节炎(RA)gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3gydF4y2Ba,gydF4y2Ba4gydF4y2Ba。此外,研究强调了成纤维细胞的作用的基质细胞,调节免疫反应在淋巴结和肿瘤基质gydF4y2Ba5克ydF4y2Ba,gydF4y2Ba6gydF4y2Ba。与造血细胞类型是由多种功能不同的细胞类型和子集,成纤维细胞通常被认为是没有异质性;功能不同的亚种群尚未明确。gydF4y2Ba
高通量技术的进步使调查人员能够以新的方式查询复杂的人类疾病。例如,全球转录组分析显示不同的激活状态和细胞免疫细胞的子集gydF4y2Ba7gydF4y2Ba。这些方法提供了一个机会来检查基质细胞如何调节各种类型的局部组织病理变化。转录组的小数量的细胞,甚至单个细胞,从人类病理学样本可以在疾病提前组织动力学的理解。例如,单细胞RNA-sequencing (RNA-seq)识别肿瘤细胞的异质性在癌症和耐药机制gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba。gydF4y2Ba
风湿性关节炎是一种复杂的自身免疫性疾病影响高达1%的世界人口gydF4y2Ba10gydF4y2Ba。在风湿性关节炎,滑膜急剧变化随着薄膜封装联合成为发炎,增生性,入侵组织质量导致关节破坏gydF4y2Ba4gydF4y2Ba。滑膜成纤维细胞分泌炎性细胞因子和趋化因子,入侵并降低软骨,并刺激破骨细胞,骨侵蚀gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4gydF4y2Ba。gydF4y2Ba
在这里,我们表明,这些不同的功能可能由不同的成纤维细胞细胞子集,类似于白细胞的功能不同的子集。我们建议改变比例的纤维母细胞可能子集构成联合组织的病理变化gydF4y2Ba11gydF4y2Ba。我们用流式细胞术分析大量的成纤维细胞子集新鲜人体组织从关节成形术手术患者的晚期或早期疾病。我们使用转录组来定义基因签名,区分成纤维细胞各亚群和预测正常和病理活动。我们用免疫荧光染色组织学图像可视化滑膜组织和本地化纤维母细胞的组织学子集的衬里层,副线层,和血管周的地区。最后,我们执行功能实验,以确定哪些纤维母细胞更容易执行不同的分子功能子集osteoclastogenesis和单核细胞等招聘。gydF4y2Ba
结果gydF4y2Ba
成纤维细胞在滑膜组织中具有不同的表面标记gydF4y2Ba
检查成纤维细胞在关节组织的异质性,滑膜细胞分离得到组织收集的RA患者关节置换手术或骨关节炎(OA)和类风湿性关节炎患者滑膜切除术。骨关节炎的变化可以在RA患者在疾病的晚期关节置换手术的时候。要仔细考虑,我们认为与OA患者滑膜组织将揭示特定的自体免疫变化RA,不同于那些比较器OA样本。gydF4y2Ba
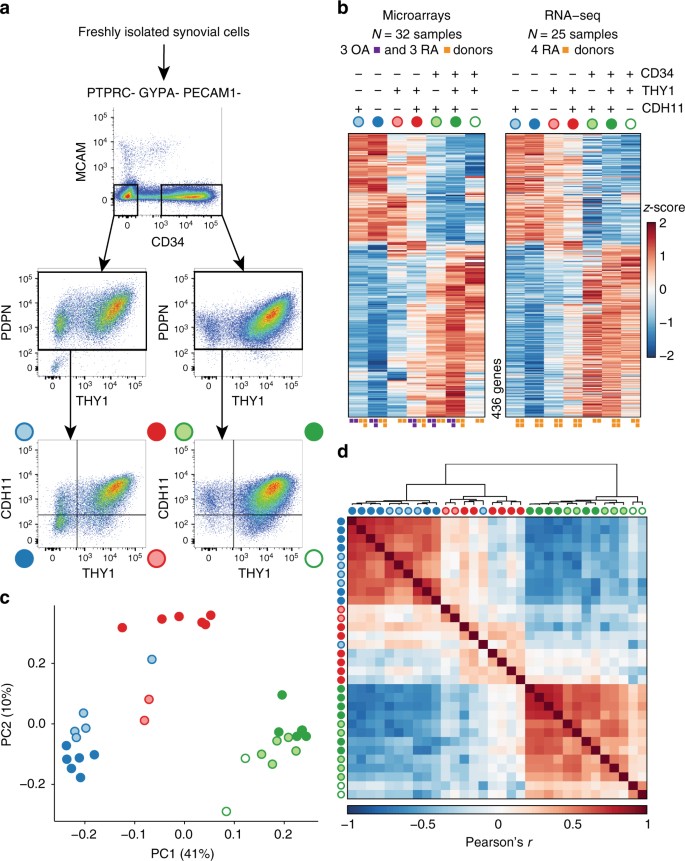
我们首先检查新鲜分离滑膜成纤维细胞对蛋白质表达的各种各样的表面标记已报告在成纤维细胞表达gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba。许多表面蛋白筛选之后,我们选择了podoplanin (PDPN)和cadherin-11 (CDH11),因为他们的特征表达对成纤维细胞和THY1(也称为CD90)和CD34的能力区分纤维母细胞亚群(图。gydF4y2Ba1gydF4y2Ba)。我们通过排除其他细胞分离滑膜成纤维细胞gydF4y2Ba17gydF4y2Ba。我们排除了造血细胞蛋白质酪氨酸磷酸酶阳性受体类型C (PTPRC,也称为CD45)。我们排除了红细胞血型糖蛋白阳性(也称为CD235a GYPA)。我们排除了内皮细胞阳性血小板和内皮细胞粘附分子1 (PECAM1,也称为CD31)。最后,我们排除了对阳性细胞表面糖蛋白MUC18 (MCAM,也称为CD146)。剩下的基质细胞表现出高蛋白PDPN表达式,与在滑膜成纤维细胞(图一致。gydF4y2Ba1gydF4y2Ba)。两个主要的成纤维细胞的数量被确定基于表面蛋白CD34的表达。在42个捐助者(26 OA和16个RA),我们观察到CD34的中位数为34.7%gydF4y2Ba+gydF4y2Ba和54.7% CD34gydF4y2Ba- - - - - -gydF4y2Ba细胞(图。gydF4y2Ba1gydF4y2Ba补充表gydF4y2Ba1gydF4y2Ba)。CD34gydF4y2Ba- - - - - -gydF4y2Ba和CD34gydF4y2Ba+gydF4y2Ba成纤维细胞可能会进一步被分为四个和三个种群,分别基于THY1和CDH11表达式。gydF4y2Ba
不同的蛋白质和纤维母细胞子集之间的信使rna表达。gydF4y2Ba一个gydF4y2Ba与异构控制策略滑膜成纤维细胞表面蛋白的表达。gydF4y2BabgydF4y2Ba方差分析(方差分析)显示有重大罗斯福(1%)的436个基因变异在七个封闭的人群,测量并统计上显著的微阵列和RNA-seq数据集。热图中的每一列对应于多个细胞样品的平均排序门。每平方在一列表示一个捐赠这个示例。gydF4y2BacgydF4y2Ba主成分分析(PCA)和2986个基因(1%罗斯福,方差分析)在微阵列数据分离的32微阵列的样品分为三个子集:CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba,CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba,CD34gydF4y2Ba+gydF4y2Ba。gydF4y2BadgydF4y2Ba成对皮尔逊相关的微阵列也提出了三个主要的成纤维细胞的子集gydF4y2Ba
纤维母细胞亚群具有不同的mRNA签名gydF4y2Ba
测试是否这些子集代表不同的纤维母细胞的数量,我们应用两种互补策略组织崩溃后调查获得的滑膜成纤维细胞的数量。第一个策略利用荧光排序使用一组候选蛋白标记之后,转录组分析的封闭的人群。第二种策略使用无偏单细胞转录组没有门。gydF4y2Ba
首先,我们化验前的七个封闭的人群从三个OA和三个RA捐助者Affymetrix HuGene 2.0芯片,使用健壮的多片平均53617 probesets正常化和20452个基因。正如预期的那样,我们发现所有的样品表达基因通常表现在成纤维细胞和缺乏其他lineage-specific基因的表达(补充图。gydF4y2Ba1gydF4y2Ba)。然而,控制供体之间的差异后,我们观察到有重大变化的2986个基因在七个不同的人群的基于表面蛋白标记表达式(错误发现率(罗斯福)< 1%,方差分析(方差分析),提出值得注意的转录差异在这些假定的子集。来验证这些微阵列的发现,我们应用RNA-seq相同的七个子集从四个独立的RA捐助者。我们准备好的库Smart-Seq2,平均深度为5.6 m片段测序/样本,量化表达,19532个基因。这些样本也富含纤维母细胞谱系基因(补充图。gydF4y2Ba1 bgydF4y2Ba)。这些显著差异表达的基因微阵列实验和重叠的RNA-seq实验(gydF4y2BangydF4y2Ba= 2659个基因)也有类似的表达谱的七大子集(补充图。gydF4y2Ba2gydF4y2Ba)。总共436个基因测试平台和有重大变化的七大公认的亚种群在两个实验(1%罗斯福,方差分析)(无花果。gydF4y2Ba1 bgydF4y2Ba)。这些结果的一致性表明,基因表达差异反映了生物变异而不是技术或随机工件。我们推断,这些分子表达谱可以作为代理功能与不同的生物细胞子集定义假定的角色。gydF4y2Ba
微阵列数据的主成分分析(PCA)显示,七个表型人口主要分为三个不同的子集:CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba,CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba,CD34gydF4y2Ba+gydF4y2Ba。主成分1 CD34清晰地分离开gydF4y2Ba- - - - - -gydF4y2Ba和CD34gydF4y2Ba+gydF4y2Ba样品和CD34 PC2分离gydF4y2Ba- - - - - -gydF4y2Ba样品是THY1gydF4y2Ba+gydF4y2Ba和CDH11gydF4y2Ba+gydF4y2Ba(无花果。gydF4y2Ba1 cgydF4y2Ba)。我们观察到同样的模式在RNA-seq数据(补充图。gydF4y2Ba3gydF4y2Ba)。三个子集也清楚明显的分层聚类在成对皮尔逊相关性的基因表达谱(无花果。gydF4y2Ba1 dgydF4y2Ba)。CD34gydF4y2Ba- - - - - -gydF4y2Ba样品相互呈正相关,CD34gydF4y2Ba+gydF4y2Ba样品也相互呈正相关,但CD34gydF4y2Ba- - - - - -gydF4y2Ba和CD34gydF4y2Ba+gydF4y2Ba样品是负相关的。CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba样本的相关性与其他样本不一致,表明这个子集可能更比CD34异构gydF4y2Ba- - - - - -gydF4y2Ba或CD34子集gydF4y2Ba+gydF4y2Ba(图子集。gydF4y2Ba1 dgydF4y2Ba)。我们决定组CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2BaCDH11gydF4y2Ba- - - - - -gydF4y2Ba和CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2BaCDH11gydF4y2Ba+gydF4y2Ba样品在一起,因为他们有相似的基因表达谱。gydF4y2Ba
单细胞RNA-seq识别三大纤维母细胞的子集gydF4y2Ba
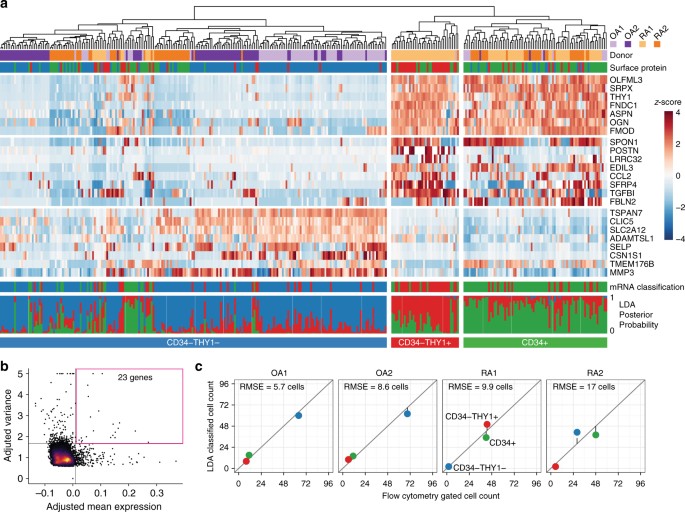
接下来,因为我们观察从封闭的成纤维细胞的数量可能是潜在的偏见通过我们的先验选择表面标记,我们进行单细胞mRNA测序获得的无偏特性在滑膜成纤维细胞转录异质性。单纤维母细胞从四个额外的捐助者(两个RA和两个OA)被孤立的流式细胞术(PTPRCgydF4y2Ba- - - - - -gydF4y2BaGYPAgydF4y2Ba- - - - - -gydF4y2BaPECAM1gydF4y2Ba- - - - - -gydF4y2BaPDPNgydF4y2Ba+gydF4y2Ba),其次是单细胞库代(Illumina公司Smart-Seq2)(补充图。gydF4y2Ba1 cgydF4y2Ba)。序列的平均深度是5.4米每细胞碎片,导致检测平均8842个基因细胞至少有1每百万(TPM)成绩单(补充图。gydF4y2Ba4gydF4y2Ba)。三百三十七个细胞至少有5000检测到基因用于单细胞微分表达式估计误差模型为每个细胞,规范化表达值,消除由于库的复杂性方面的变化,在捐助者和正确的批处理的效果gydF4y2Ba18gydF4y2Ba。同时在每一个细胞表面蛋白标记了流式细胞术在单细胞排序。值得注意的是,公正的子集(定义为层次聚类的单个细胞23基因显示高跨细胞均值和方差)整合了三个子集定义CD34和THY1表面标记的蛋白质含量(gydF4y2BaPgydF4y2Ba< 10gydF4y2Ba−4gydF4y2Ba;排列测试)(图gydF4y2Ba2 a, bgydF4y2Ba)。gydF4y2Ba
无偏集群单细胞RNA-seq的成纤维细胞。gydF4y2Ba一个gydF4y2Ba层次聚类与我们的表面蛋白控制整合。第一个跟踪表明供体细胞来源。第二个跟踪显示细胞排序门细胞分为表面蛋白表达。热图显示mRNA表达,扩展跨细胞变异细胞之间。以下的热图,第一跟踪显示线性判别分析(LDA)分类968个基因的mRNA的表达。最后跟踪显示了LDA分类的后验概率。gydF4y2BabgydF4y2Ba的热图,我们选择23个基因表达最大的1%的均值和方差最大的1%的水平。gydF4y2BacgydF4y2Ba细胞的数量在每个子集由表面蛋白水平(gydF4y2BaxgydF4y2Ba设在)和通过LDA分类(gydF4y2BaygydF4y2Ba设在)是一致的。RMSE,根均方误差gydF4y2Ba
接下来,我们评估是否批量和单细胞RNA-seq概要文件被标记类似的细胞亚群。我们训练一个线性判别分析(LDA)分类器在968个基因大部分RNA-seq数据和预测单个细胞的类(见方法)。LDA分类器产生了属于每个类(CD34的概率gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba,CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba,CD34gydF4y2Ba+gydF4y2Ba)。分类有信心(概率为0.8)和符合三个子集(无花果。gydF4y2Ba2gydF4y2Ba)。我们将信使rna分类与流仪记录蛋白质标记数据的无偏单细胞排序,发现整合细胞身份和比例(图。gydF4y2Ba2摄氏度gydF4y2Ba补充图。gydF4y2Ba5克ydF4y2Ba)。这些单细胞RNA-seq结果提供一个公正和独立验证三大子集的定义与散装转录组样本的蛋白质表面标记。gydF4y2Ba
滑膜成纤维细胞定位到特定子集的地区gydF4y2Ba
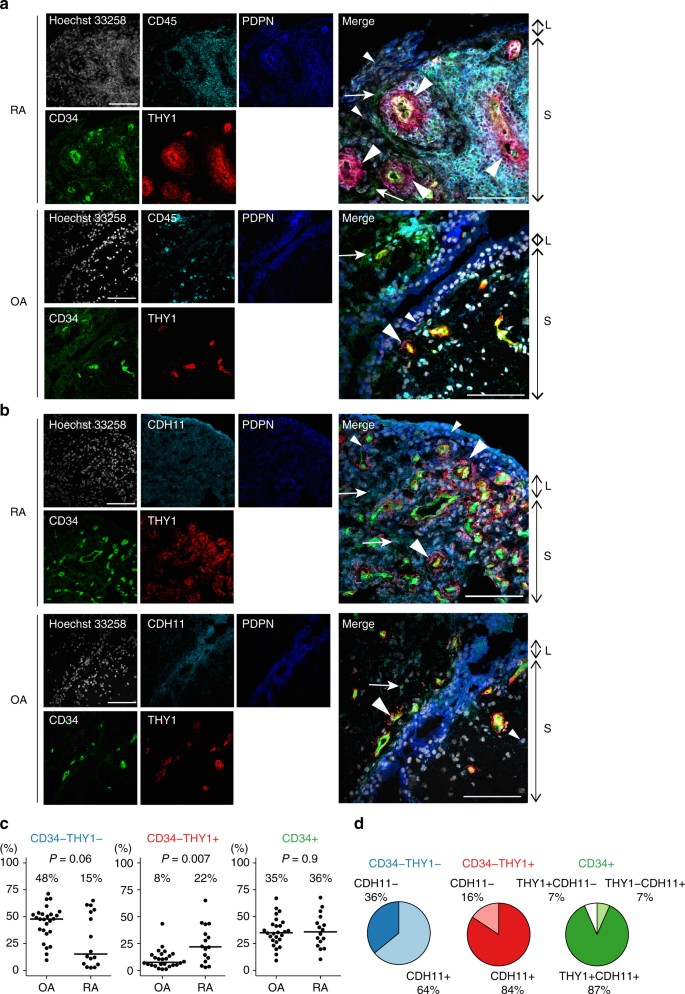
由于纤维母细胞的身份是高度依赖于微环境,我们试图确定纤维母细胞的解剖定位子集可能导致办公自动化(OA)和RA滑膜组织中转录组异质性(无花果。gydF4y2Ba3 a, bgydF4y2Ba,补充图。gydF4y2Ba6gydF4y2Ba)。有趣的是,CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞在类风湿性关节炎形成离散血管周的区域周围的毛细结构的深亚系层滑膜,尤其是附近的淋巴细胞的积累。相比之下,CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞组成一个薄层细胞围绕血管较少OA(无花果。gydF4y2Ba3gydF4y2Ba)。CD34gydF4y2Ba+gydF4y2Ba观察成纤维细胞表面的衬里和更深的滑膜的副线区域。CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba成纤维细胞衬里地区主要是观察。CDH11的表达在大多数的成纤维细胞,观察与表达衬层(图中观察到最高。gydF4y2Ba3 bgydF4y2Ba补充图。gydF4y2Ba7gydF4y2Ba)。gydF4y2Ba
解剖定位和比例的纤维母细胞的子集。gydF4y2Ba一个gydF4y2Ba纤维母细胞的解剖定位子集和白细胞在RA和OA滑膜组织。赫斯特33258年:白色、CD45:青色,PDPN:蓝色、CD34:绿色、THY1:红色。小箭头:CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba成纤维细胞。大箭头:CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞。箭头:CD34gydF4y2Ba+gydF4y2Ba成纤维细胞。= 100µm规模。gydF4y2BabgydF4y2Ba表达成纤维细胞标记RA和OA滑膜组织子集。赫斯特33258年:白色,CDH11:青色,PDPN:蓝色、CD34:绿色、THY1:红色。gydF4y2BacgydF4y2Ba纤维母细胞的比例子集在OA滑膜组织(gydF4y2BangydF4y2Ba= 26)和RA (gydF4y2BangydF4y2Ba通过流式细胞术= 16)评估。gydF4y2BaPgydF4y2Ba从Wilcoxon rank-sum测试值。gydF4y2BadgydF4y2Ba的比例CDH11gydF4y2Ba+gydF4y2BaCD34细胞gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba成纤维细胞CD34,gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞,CD34gydF4y2Ba+gydF4y2Ba成纤维细胞。L衬里,年代亚系区域gydF4y2Ba
纤维母细胞比例改变在RA子集gydF4y2Ba
我们假设如果病理纤维母细胞存在子集,那么一些子集可能或多或少地丰富RA相对于OA滑膜组织。的确,纤维母细胞的比例子集定义为与蛋白质表面标记流式细胞术不同RA滑膜组织(gydF4y2BangydF4y2Ba= 16)和OA (gydF4y2BangydF4y2Ba=(图26)。gydF4y2Ba3 cgydF4y2Ba补充表gydF4y2Ba1gydF4y2Ba)。成纤维细胞占测试三个子集,我们考虑一个gydF4y2BaPgydF4y2Ba0.05 / 3 = 0.017的价值是重要的。CD34的比例gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞组成的中值相比,RA成纤维细胞总数的22%到8% OA(比值比(或)= 3(95%可信区间(CI): 1.33 - -6.48),gydF4y2BaPgydF4y2Ba= 0.007 (Wilcoxon rank-sum测试))。相比之下,CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba细胞不太丰富的RA在OA的15%到48%(或= 0.48(95%置信区间:0.23—-1.03),gydF4y2BaPgydF4y2Ba= 0.06 (Wilcoxon rank-sum测试))。7在12 RA样本,样本取自根据风湿病关节肿胀的评估,和5样本从non-swollen关节(补充图。gydF4y2Ba8gydF4y2Ba)。虽然我们承认肿胀的存在与否不是一个健壮的参数来反映关节炎症,我们发现肿胀关节CD34较少gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba(gydF4y2BaPgydF4y2Ba= 0.02),更多的CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba(gydF4y2BaPgydF4y2Ba= 0.09),和更多的CD34gydF4y2Ba+gydF4y2Ba成纤维细胞(gydF4y2BaPgydF4y2Ba= 0.01 (Wilcoxon rank-sum测试))。值得注意的是,大多数细胞CD34在扩大gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba人口在RA的表面蛋白水平也积极CDH11(平均84%),和CDH11也表达了纤维母细胞包括CD34子集gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba(平均64%)和CD34gydF4y2Ba+gydF4y2Ba(平均94%)细胞(图。gydF4y2Ba3 dgydF4y2Ba)。这些结果表明,滑膜成纤维细胞亚群比例密切相关疾病类型和活动。gydF4y2Ba
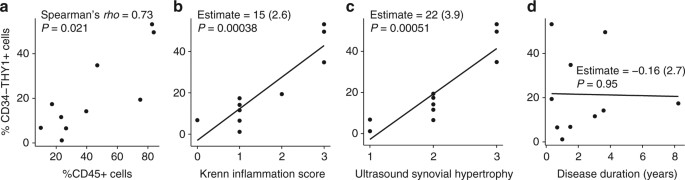
我们注意所有从膝OA采集标本,而RA样本包括那些从膝盖(gydF4y2BangydF4y2Ba= 8)以及其他小关节(gydF4y2BangydF4y2Ba= 8)(补充表gydF4y2Ba1gydF4y2Ba)。确认改变比例的纤维母细胞子集在RA反映组织炎症的程度,而不是共同起源的位置,我们只收集了10独立RA滑膜组织切片的膝盖关节和检查的比例纤维母细胞和白细胞渗透子集流式细胞术(补充表gydF4y2Ba2gydF4y2Ba)。我们只选择样本与滑膜肥大超声图像。尽管样本容量(gydF4y2BangydF4y2Ba= 10)是有限的,我们看到CD34的比例gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞与白细胞渗透的比例呈正相关,流式细胞术(无花果。gydF4y2Ba4gydF4y2Ba)。此外,CD34的比例gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞与组织学滑膜炎和滑膜肥大评估超声波(图。gydF4y2Ba4 b, cgydF4y2Ba)。这些结果表明,纤维母细胞的比例改变子集在RA反映组织炎症分子和临床水平。相比之下,CD34的比例之间的关系gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞和疾病持续时间没有被观察到,这表明改变比例的纤维母细胞子集不是慢性组织损伤(图的继发效应。gydF4y2Ba4 dgydF4y2Ba)。gydF4y2Ba
比例的纤维母细胞和滑膜炎症子集之间的相关性。gydF4y2Ba一个gydF4y2Ba斯皮尔曼的CD34的比例之间的相关性gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba在成纤维细胞和成纤维细胞CD45的比例gydF4y2Ba+gydF4y2Ba细胞总活细胞从RA膝关节滑膜组织切片。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2BaCD34的比例之间的线性相关系数gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞和Krenn炎症评分(gydF4y2BabgydF4y2Ba)、超声波滑膜肥大的分数(gydF4y2BacgydF4y2Ba),和疾病持续时间(年)gydF4y2BadgydF4y2Ba)。流式细胞仪细胞的比例进行评估。情节gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba显示系数估计和线性模型gydF4y2BatgydF4y2Ba测试gydF4y2BaPgydF4y2Ba值gydF4y2Ba
转录组预测不同的纤维母细胞的功能gydF4y2Ba
我们假设几个关键效应分子由纤维母细胞差异表达子集可能代表关键转录模块,可以预测不同的纤维母细胞中细胞功能子集(无花果。gydF4y2Ba5gydF4y2Ba)。测试是否这些转录模块与体外细胞功能,被孤立和维护主细胞和纤维母细胞子集与每个模块相关的预测功能检查。gydF4y2Ba
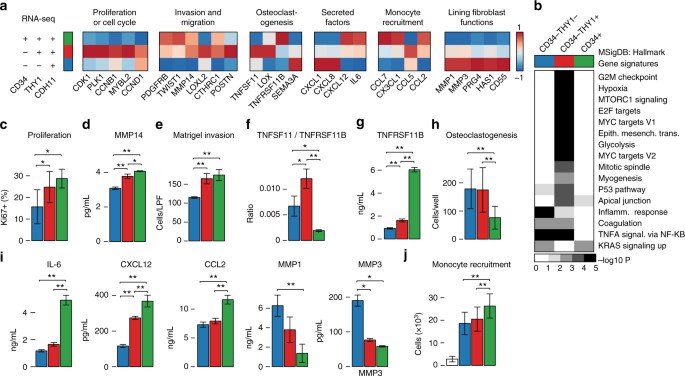
功能性纤维母细胞子集之间的区别。gydF4y2Ba一个gydF4y2Ba基因表达模式的主要效应分子预测纤维母细胞的功能子集。gydF4y2BabgydF4y2Ba基因集富集分析RNA-seq样品和MSigDB标志基因签名。与罗斯福显示< 5%。gydF4y2BacgydF4y2BaKi67-positive细胞的比例在新鲜分离滑膜成纤维细胞的子集。gydF4y2BadgydF4y2Ba蛋白质的表达MMP14扩大成纤维细胞的细胞溶解产物的子集1 ng / mL TNF-α。gydF4y2BaegydF4y2Ba迁移和入侵细胞的数量transwell矩阵入侵检测。50毫微克每毫升PDGFBB被用来促进迁移和入侵。gydF4y2BafgydF4y2BaTNFSF11的比率(RANKL)和TNFRSF11B(功能)的mRNA水平扩展成纤维细胞的子集。gydF4y2BaggydF4y2Ba上层清液的蛋白质的表达TNFRSF11B扩大纤维母细胞的子集。gydF4y2BahgydF4y2Ba破骨细胞数量开发破骨细胞祖细胞与成纤维细胞共培养的子集的20 ng / mL - csf和5 ng / mL RANKL。gydF4y2Ba我gydF4y2Ba蛋白表达的细胞因子和基质金属蛋白酶的上层清液中扩大纤维母细胞的子集1 ng / mL TNF-α。gydF4y2BajgydF4y2Ba单核细胞中的单核细胞迁移数量招聘分析使用上层清液培养的成纤维细胞的子集。在酒吧图,蓝色、红色和绿色颜色编码对应于所示的纤维母细胞的子集gydF4y2Ba一个gydF4y2Ba。白色的酒吧里gydF4y2BajgydF4y2Ba表明没有成纤维细胞培养基。酒吧展示手段和误差标准差。单向方差分析,图基的事后:*gydF4y2BaPgydF4y2Ba< 0.05;* *gydF4y2BaPgydF4y2Ba< 0.005gydF4y2Ba
首先,基因集富集分析显示显著富集CD34的有丝分裂和增殖的基因gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba(图子集。gydF4y2Ba5 bgydF4y2Ba)。与一个积极增殖状态一致,CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba和CD34gydF4y2Ba+gydF4y2Ba种群表现出显著更高比例的Ki67-positive细胞CD34相比gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba成纤维细胞(图gydF4y2Ba5度gydF4y2Ba)。接下来,我们发现基因在成纤维细胞迁移反应,包括gydF4y2BaCTHRC1gydF4y2Ba,gydF4y2BaTWIST1gydF4y2Ba,gydF4y2BaPOSTNgydF4y2Ba,gydF4y2BaLOXL2gydF4y2Ba,gydF4y2BaPDGFRBgydF4y2Ba,gydF4y2BaMMP14gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,在CD34升高gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba和CD34gydF4y2Ba+gydF4y2Ba成纤维细胞(图gydF4y2Ba5 a, dgydF4y2Ba),建议提高迁移和入侵行为。事实上,CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba和CD34gydF4y2Ba+gydF4y2Ba成纤维细胞表现出增强体外入侵和迁移对血小板衍生生长因子BB (PDGFBB) transwell矩阵入侵检测(图。gydF4y2Ba5 egydF4y2Ba)。gydF4y2Ba
在RA滑膜成纤维细胞的一个重要致病效应函数是osteoclastogenesis的调制,这一过程主要是由TNFSF11(也称为核factor-κΒ配体受体激活剂(RANKL))和反对TNFRSF11B(也称为osteoprotegerin(功能)),这是一个为TNFSF11诱饵受体gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba。分析osteoclastogenesis透露相关的基因的高表达gydF4y2BaTNFSF11gydF4y2Ba和低表达的gydF4y2BaTNFRSF11BgydF4y2Ba在CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞(图gydF4y2Ba5 fgydF4y2Ba)。低表达的gydF4y2BaTNFRSF11BgydF4y2Ba在CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba成纤维细胞CD34和gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba证实了成纤维细胞直接从上层清液的成纤维细胞蛋白质测量子集(无花果。gydF4y2Ba5克gydF4y2Ba)。支持他们的角色在促进破骨细胞的分化、CD34的培养gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba或CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba成纤维细胞和外周血单核细胞导致数量的增加tartrate-resistant酸性磷酸酶(陷阱)艾滋病监测细胞体外(图。gydF4y2Ba5 hgydF4y2Ba)。gydF4y2Ba
白细胞的趋化因子的分泌和招聘发炎组织是滑膜成纤维细胞的主要功能gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4gydF4y2Ba。CD34gydF4y2Ba+gydF4y2Ba成纤维细胞有一个转录组剖面表现为炎性细胞因子基因的表达gydF4y2Ba白细胞介素6gydF4y2Ba,gydF4y2BaCXCL12gydF4y2Ba,gydF4y2BaCCL2gydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Ba)。我们还证实,CD34 +成纤维细胞il - 6分泌大量的蛋白质,CXCL12和CCL2当刺激与肿瘤坏死因子(TNF)在体外(无花果。gydF4y2Ba5我gydF4y2Ba)。此外,他们增强分泌表型也反映出了他们的招聘能力明显高于外周血单核细胞的数量在一个transwell白细胞招聘分析(图。gydF4y2Ba5 jgydF4y2Ba)。总的来说,这些结果说明对CD34发挥更大作用gydF4y2Ba+gydF4y2Ba成纤维细胞在单核细胞发炎滑膜组织招聘。gydF4y2Ba
最后,我们研究了基因的表达,内衬纤维母细胞中高度表达。我们发现CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba成纤维细胞表达高水平的基因gydF4y2BaMMP1gydF4y2Ba,gydF4y2BaMMP3gydF4y2Ba,gydF4y2BaPRG4gydF4y2Ba,gydF4y2BaHAS1gydF4y2Ba,gydF4y2BaCD55gydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Ba)。高表达CD34的蛋白质可以和MMP3水平gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba成纤维细胞也被证实(图。gydF4y2Ba5我gydF4y2Ba)。这些结果表明,CD34的至少一部分gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba成纤维细胞是成纤维细胞。gydF4y2Ba
讨论gydF4y2Ba
本研究确定了新鲜人体滑膜成纤维细胞的子集,包括PDPN的不同子集gydF4y2Ba+gydF4y2BaCD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞在RA和扩大可能致病。这些细胞在RA滑膜周围丰富的血管,和他们的表达谱揭示潜在的致病作用矩阵入侵,免疫细胞的招募,osteoclastogenesis。我们注意到,几乎所有这些细胞阳性蛋白CDH11,以前我们有显示与病理行为有关的成纤维细胞在体外研究和RA小鼠模型gydF4y2Ba3gydF4y2Ba。gydF4y2Ba
成纤维细胞的扩张RA滑膜炎是一个动态的组成部分。增加滑膜衬里成纤维细胞是前所述与疾病活动得分在28个关节(DAS28),疾病持续时间和巨噬细胞浸润的程度gydF4y2Ba28gydF4y2Ba。RA滑膜亚系成纤维细胞也观察到的扩张,但没有以前的文献报道亚系之间显著相关成纤维细胞和其他临床或病理结果,除了与DAS28负相关研究gydF4y2Ba28gydF4y2Ba。在这里,通过分离成纤维细胞成子集多个标记的表达模式的基础上,我们发现CD34的增加gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞亚系的血管周围区域是一个占主导地位的改变在RA滑膜成纤维细胞。此外,这种扩张RA有别于OA,反映RA疾病活动,并且与免疫细胞浸润在滑膜。之前的研究表明,间充质CDH11决定了成纤维细胞之间的粘附,增加他们的迁移和入侵,并加强生产成纤维细胞基质金属蛋白酶的激活,细胞因子和趋化因子gydF4y2Ba3gydF4y2Ba,gydF4y2Ba29日gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba。因为绝大多数人口扩大成纤维细胞表达这个钙粘蛋白,它也可能导致他们在RA病理行为(无花果。gydF4y2Ba3 dgydF4y2Ba)。gydF4y2Ba
高gydF4y2BaTNFSF11gydF4y2Ba和低gydF4y2BaTNFRSF11BgydF4y2Ba基因表达在新鲜CD34孤立gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞表明CD34数量的增加gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞在类风湿性关节炎是参与了RA的增加骨质破坏。然而,CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba和CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞没有的能力,促进不同osteoclastogenesis体外。我们相信体内滑膜CD34的环境可能需要gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba成纤维细胞完全函数作为基质细胞,促进osteoclastogenesis。这个子集也负责在RA滑膜组织中淋巴细胞的积累,因为TNFSF11参与T细胞贩卖自身免疫性炎症gydF4y2Ba31日gydF4y2Ba。此外,CD34的比例减少gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba成纤维细胞可以解释在RA骨形成减少活动,因为他们也表达gydF4y2BaBMP-6gydF4y2Ba,促进成骨细胞的骨形成gydF4y2Ba32gydF4y2Ba。综上所述,RA的纤维母细胞的比例改变子集可能导致异常的联合支持联合破坏体内平衡。gydF4y2Ba
我们注意到差异表达的基因在新鲜分离成纤维细胞没有子集保留体外体外或没有翻译功能差异。这些鲜活的细胞,培养细胞之间的差异可能是由于当地的文化条件和损失的影响因素在微环境。识别的关键信号通路相关维护身份在体外文化将极大地促进纤维母细胞子集深入功能分析,进一步阐明纤维母细胞异质性的生物学意义。gydF4y2Ba
我们也认识到,应对酶消化纤维母细胞子集之间可能有所不同,这可能会导致基因表达谱的差异。然而,所有样本相同的消化过程中,我们观察到类似的三种类型的基因表达的差异表达数据,包括微阵列和RNA-seq化验排序成纤维细胞以及单细胞RNA-seq刚孤立的单个细胞。进一步扩大了细胞在体外实验中显示功能差异与基因表达数据一致。在以前的研究中,他人已经表明细胞与器官组织保留截然不同的转录概况gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba。因此,新鲜的分析分离细胞的影响器官疾病是有用的识别病原的细胞亚群发病机理及其功能。gydF4y2Ba
我们的基因表达数据仅限于滑膜标本RA的最新阶段,因此代表慢性晚期RA的变化。基因表达分析,从早期RA滑膜活检标本需要了解更多关于发病机制在疾病的早期阶段。gydF4y2Ba
有一个真正的策略需要定义成纤维细胞异质性和致病性纤维母细胞人口为了理解的复杂性质组织病理学和组织居民细胞终末器官损害的作用。我们的方法包括细胞表面标记的综合分析,大部分转录组,单细胞转录组,组织学成像发现疾病相关的人体组织成纤维细胞亚群,最终可能作为治疗的具体目标。还没有批准的药物,成纤维细胞直接目标,确定致病纤维母细胞子集可能揭示广泛适用的一系列疾病的治疗目标。在RA,针对纤维母细胞子集可能补充抗炎疗法这一目标白细胞及其细胞因子gydF4y2Ba4gydF4y2Ba。gydF4y2Ba
需要额外的临床研究来了解这些子集的改变参与各种RA临床环境中包括的严重性疾病活动,关节破坏,预后和对治疗的反应。我们预计,这项研究将作为这些研究路线图,并可能为未来的研究作为一个模板来确定致病的子集在其他人类疾病的组织细胞。gydF4y2Ba
方法gydF4y2Ba
患者滑膜细胞的招募和隔离gydF4y2Ba
我们从关节置换手术获得滑膜组织,滑膜切除手术,或OA滑膜活检或根据需要适当RA患者知情同意。研究协议合作医疗制度审查委员会批准,特种外科医院,伯明翰大学的当地伦理审查委员会。我们收集所有可用的RA为研究样本。OA从关节置换手术随机收集的样本没有任何偏见。我们修改前所述协议分离滑膜细胞gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba。简单地说,我们组织在手术后立即获得。我们用剪刀去除骨骼和脂肪组织。我们滑膜组织切成小块,然后使这些作品酶消化。微阵列分析、低输入批量RNA-seq和在体外实验中,我们用4毫克/毫升胶原酶消化组织类型4(美国新泽西州沃辛顿),0.8毫克/毫升dispase II, 0.1毫克/毫升DNaseI(罗氏)杜尔贝科修改鹰的介质(DMEM) 37°C。15分钟后,我们收集了上层清液,取而代之的是新的酶混合。我们重复这些过程每15分钟总1 h。分析滑膜活检样本,我们消化组织0.05毫克/毫升Liberase TM(罗氏)和0.04毫克/毫升DNaseI 30分钟的37°C。对于单细胞RNA-seq,我们消化组织为0.2毫克/毫升Liberase TL(罗氏),0.1毫克/毫升DNaseI RPMI 37°C的20分钟的乳沟降到最低的淋巴细胞表面标记酶消化。红细胞溶解后ACK-lysing缓冲区,我们染色细胞和抗体,按FACSAria融合(BD) 100μm喷嘴在20 psi。 For the analysis with microarray and low input RNA-seq, the cells were sorted into 2% fetal bovine serum (FBS) HBS+ buffer, spun down, and lysed with TRIzol (Invitrogen). We extracted RNA and cleaned up by RNeasy micro kit (Qiagen) with DNaseI treatment. For single-cell RNA-seq, the cells were stained with antibodies and directly sorted into 5 μl of TCL buffer (Qiagen) with 1% β-mercaptoethanol (Sigma) in 96-well plates.
抗体和试剂gydF4y2Ba
下面的抗体和试剂用于分析滑膜细胞流式细胞术和细胞分类:anti-CD45-APC-H7 (2 d1, BD Pharmingen) anti-CD235a-APC-Alexa Fluor750 (11 e4b-7-6 (KC16),贝克曼库尔特),anti-CD31-PE-Cyanine7 (WM-59 eBioscience) anti-CD146-BV450 (P1H12, BD地平线)anti-CD34-PE (4 h11, eBioscience) anti-PDPN-PerCP-eFluor710(新西兰- 1.3,eBioscience) anti-THY1-FITC (5 e10, BD Pharmingen) anti-cadherin-11-biotin (23 c6),人类TruStain FcX (BioLegend) streptavidin-APC(杰克逊ImmunoResearch),生活/死可以解决的aqua死细胞染色板(分子探针)。免疫荧光染色的滑膜组织,抗体和试剂:anti-CD45 (135 - 4 - c5, AbD Serotec), anti-CD34 (EP373Y Abcam) anti-PDPN(新西兰- 1.3,eBioscience) anti-THY1 (F15-42-1、默克密理博和克隆Thy-1A1,研发系统),anti-cadherin-11-Biotin (23 c6), anti-Ki67 (16 a8, BioLegend) anti-mouse IgG1-FITC(生物技术)南部,anti-mouse IgG2a FITC(生物技术)南部,anti-mouse IgG2b-Alexa萤石647(生命技术),anti-rat IgG-Alexa萤石594(生命技术),anti-rat IgG-Alexa萤石647年anti-rabbit IgG-Alexa萤石546(生命技术),赫斯特33258(生命技术),anti-FITC Alexa萤石488(生命技术)。gydF4y2Ba
基因表达微阵列gydF4y2Ba
我们评估的完整性RNA生物分析仪或Tapestation(安捷伦)。我们只用RNA RNA完整性多得分为7。我们准备好的互补DNA(互补)从38.1 g总RNA使用鼓掌Pico WTA (NuGEN),其次是使用生物素标记5μg cDNA模块(NuGEN)。我们检测基因表达人类使用GeneChip 2.0微阵列(Affymetrix)。我们通过强劲的规范化表达Multiarray平均(RMA)。我们通过PCA识别和移除两个离群值数组。我们分配探测Entrez基因IDs使用运用BioMart 2015年3月17日。实例中有多个probesets分配给单个基因,我们平均获得单个基因的值。gydF4y2Ba
RNA-seq图书馆准备和测序gydF4y2Ba
我们使用1250细胞/样本库的准备。我们准备好的序列库使用Smart-Seq2协议。我们汇集和测序库池和测序Illumina公司HiSeq 2500深度8-14M读取/库。gydF4y2Ba
单细胞RNA-seqgydF4y2Ba
384年我们检测成纤维细胞从四个捐助者、两个与OA和两个RA。对于每个捐赠者,我们收集新鲜的滑膜组织,孤立的滑膜细胞酶的消化,并与抗体染色CD45, CD235a, CD31, CD146, PDPN, CD34, THY1, CDH11。我们96单CD45排序gydF4y2Ba- - - - - -gydF4y2BaCD235agydF4y2Ba- - - - - -gydF4y2BaCD31gydF4y2Ba- - - - - -gydF4y2BaPDPNgydF4y2Ba+gydF4y2Ba细胞通过FACSAria融合(BD),化验mRNA表达Smart-Seq2协议gydF4y2Ba37gydF4y2Ba。单细胞库也准备使用相同的协议,我们旨在序列的深度200 k-12m读取/库gydF4y2Ba38gydF4y2Ba。平均而言,我们5.4片段测序,检测到8153个基因每个细胞至少有1 TPM。我们丢弃的47个细胞(12%)只有不到5000个基因检测的进一步分析。gydF4y2Ba
RNA-seq基因表达量化gydF4y2Ba
我们在规范量化的互补染色体在运用释放83 Kallisto v0.42.4gydF4y2Ba39gydF4y2Ba在TPM和总结能够表达式的值。我们以同样的方式量化基因表达和单细胞RNA-seq样本。微分表达分析、层次聚类和主成分分析,我们日志(基础2)改变了TPM值。gydF4y2Ba
谱系标记分析gydF4y2Ba
我们选择的谱系标记成纤维细胞、内皮细胞和造血细胞gydF4y2Ba12gydF4y2Ba,并检查他们的表达水平来确认我们的样品从纤维母细胞谱系(补充图。gydF4y2Ba1gydF4y2Ba)。gydF4y2Ba
微分表达式分析微阵列gydF4y2Ba
我们用R包limma RMA规范化评估微分表达式分析表达式的值gydF4y2Ba40gydF4y2Ba。在执行微分表达式分析之前,供体特异性变异退化获得残差的线性模型。为了回归效应,我们建模的每个基因供体特异性效应的线性组合。在使用普通最小二乘法以适应供体特异性效应,我们计算残差为每一个基因。这些残差被用于微分表达式分析、层次聚类和主成分分析。我们预期之间的基因表达差异RA和OA。然而,我们没有权利看到这些差异纤维母细胞的子集。gydF4y2Ba
与RNA-seq差异表达分析gydF4y2Ba
RNA-seq数据分析了微阵列数据一样,从日志2-transformed TPM表达式的值。供体特异性变化同样退化了微分表达式分析之前,层次聚类和主成分分析。gydF4y2Ba
基因集富集分析gydF4y2Ba
从MSigDB标志基因签名gydF4y2Ba41gydF4y2Ba用于富集分析与狮虎吗gydF4y2Ba42gydF4y2Ba。我们测试了基因集富集之间的微分表达式三大子集为了评估他们可能不同于彼此的分子途径。MSigDB标志通路富集CD34的微分表达式信号gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2Ba人口,扩大在RA关节,包括“epithelial-to-mesenchymal过渡,”“缺氧”和“糖酵解。”gydF4y2Ba42gydF4y2Ba
主成分分析gydF4y2Ba
后基因选择方差分析(方差分析)或微分表达式的分析,我们按比例缩小的每个样本,然后按比例缩小的每个基因在样品获得特异性的基因样本。接下来,我们使用了prcomp R的函数执行PCA与集中和扩展日志2表达式的值。gydF4y2Ba
线性判别分析gydF4y2Ba
我们检查如果转录概况的单个细胞类似于配置文件定义的三个子集我们批量转录组。首先,我们选择了1171个基因显著(5%罗斯福)微分表达式之间的任何两三个子集散装RNA-seq数据。我们选择一个子集的968个基因高表达在单个细胞(平均日志2 (TPM) >日志2 (10))。我们使用了大部分RNA-seq数据来训练一个LDA模型与这些基因,然后分类每个细胞的表达谱预测每一个细胞的身份。每个分类的信心表示后验概率。gydF4y2Ba
组织学分析gydF4y2Ba
RA滑膜组织活检获得的来自RA患者在伯明翰灯塔早期关节炎人群中,这是一个早期关节炎队列之前招募新发病患者关节炎疾病修饰治疗风湿病的治疗药物。滑膜组织染色是冻结在10月。部分是在6μm厚度,用丙酮固定,冷冻前使用。幻灯片在phosphate-bufferred水化盐(PBS),阻止10%正常羊或马血清在PBS 10分钟,然后孵化主要抗体,紧随其后的是二次抗体。幻灯片是安装使用延长钻石(生命技术),并使用蔡司成像LSM 780年或800年共焦显微镜。图像处理用禅宗黑色和禅宗lite(蔡司)。代表图像显示。滑膜组织的组织学分析和苏木精和伊红染色在甲醛固定,然后安装在石蜡,由医院病理切片,染色服务。gydF4y2Ba
组织学评估炎性浸润gydF4y2Ba
Hematoxylin-stained和eosin-stained部分的膝盖滑膜活检样本进行组织学上的严重性炎性浸润的炎症组件Krenn滑膜炎得分gydF4y2Ba43gydF4y2Ba。炎性浸润被划分等级从0到3(0 =没有炎性浸润,1 =几主要血管周围淋巴细胞和浆细胞,2 =大量淋巴细胞和浆细胞有时形成follicle-like总量,和3 =密集band-like炎性浸润或众多大型follicle-like总量)。组织被蒙蔽的方式评分两个训练有素的人,然后提供共识。gydF4y2Ba
滑膜炎的临床评估超声波gydF4y2Ba
联合使用超声波检查评估立即手术前使用西门子Acuson Antares扫描仪(西门子PLC,布拉克内尔,英国)和多频第5 - 13 (MHz)线性阵列传感器。滑膜炎和能量多普勒(PD)积极使用共识定义OMERACT定义gydF4y2Ba44gydF4y2Ba。灰度滑膜肥大和PD超声波变量评分在0 - 3半定量尺度如前所报道gydF4y2Ba45gydF4y2Ba。gydF4y2Ba
细胞培养gydF4y2Ba
我们分类CD34gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba- - - - - -gydF4y2Ba成纤维细胞CD34,gydF4y2Ba- - - - - -gydF4y2BaTHY1gydF4y2Ba+gydF4y2BaCDH11gydF4y2Ba+gydF4y2Ba成纤维细胞,CD34gydF4y2Ba+gydF4y2BaTHY1gydF4y2Ba+gydF4y2BaCDH11gydF4y2Ba+gydF4y2Ba成纤维细胞,培养他们在DMEM补充10%的边后卫(双子)、2毫米gydF4y2BalgydF4y2Ba谷氨酰胺、抗生素(青霉素和链霉素)和必要的和不必要的氨基酸(生命技术)。这些细胞被化验体外扩大为3天。细胞与一个或两个段落。细胞培养在1 ng / mL的存在与否TNF-α(R和D) 24小时的酶联免疫吸附试验(ELISA) il - 6, CXCL12, MMP1、MMP3, MMP14,或者72 h为定量实时PCR (qPCR) TNFSF11 TNFRSF11B。gydF4y2Ba
ELISAgydF4y2Ba
il - 6的水平,CXCL12 MMP1、MMP3 TNFRSF11B上层清液或细胞溶解产物的MMP-14水平进行评估的酶联免疫试剂盒制造商的指示所述(两集,R和D)。gydF4y2Ba
定量实时聚合酶链反应gydF4y2Ba
互补脱氧核糖核酸合成与QuantiTect逆转录工具包(试剂盒)。qPCR执行与杰出的三世超高速SYBR绿色qPCR大师混合(安捷伦科技)Mx3000 (Stratagene)。以下引物被使用:TNFSF11转发:5′gga GAG棉酚ATC AGC ATC呕吐和反向:5′cca AAC ATC CAG棉酚ATA猫AAC交流;TNFRSF11B转发:5′CAA CAC AGC柠檬酸CAA棉酚CAG和反向:5′棉酚GGT GAG GTT AGC ATG移行细胞癌;GAPDH转发:5′aat CCC ATC ACC ATC TTC CAG和反向;5′aaa TGA GCC CCA GCC TTC。gydF4y2Ba
Osteoclastogenesis化验gydF4y2Ba
破骨细胞祖细胞是由培养外周血单核细胞在20 ng / mL的巨噬细胞集落刺激因子(csf) (PeproTech)在DMEM补充10%的边后卫(通用电气医疗集团),2毫米gydF4y2BalgydF4y2Ba谷氨酰胺,抗生素5 - 6天。扩大成纤维细胞被播种在5000细胞/ 96 -孔板。第二天,破骨细胞祖细胞被添加在每口井的5000个细胞,并与成纤维细胞共培养20 ng / mL - csf和5 - 20 ng / mL RANKL (PeproTech)。媒体是每2天更换一次。6天培养后,细胞被4%多聚甲醛固定。陷阱染色后,TRAP-positive多核细胞被算作破骨细胞。gydF4y2Ba
Ki67染色gydF4y2Ba
分解滑膜细胞被洗,沾extraceullar面板,其次是固定和透化作用(eBioscience Foxp3 /转录因子染色缓冲区设置)。Ki67-positive细胞的比例量化通过流式细胞术和通过FlowJo Ki67-positive细胞进行了分析和计算。gydF4y2Ba
单核细胞招聘分析gydF4y2Ba
修改transwell迁移试验被用来评估由滑膜成纤维细胞单核细胞招聘。上层清液从TNF-α-stimulated滑膜成纤维细胞收集子集,RPMI 1:1稀释,放置在底部商会24-well盘子。总共5×10gydF4y2Ba5克ydF4y2Ba净化人类外周血单核细胞健康的捐赠者在RPMI resuspended和放置在顶部商会Transwell插入(康宁)。3 h后,细胞迁移到室底部收集和单核细胞通过流仪量化分析。gydF4y2Ba
Transwell矩阵入侵检测gydF4y2Ba
Transwell入侵矩阵进行了分析使用康宁基底膜基质入侵室8.0μm孔隙按制造商的协议。扩大成纤维细胞是resuspended 0.5%牛血清白蛋白(BSA) / DMEM和播种在上院15000细胞/好。50毫微克每毫升PDGFBB 0.5% BSA / DMEM被用来促进成纤维细胞的入侵和迁移。孵化后48 h, non-invading细胞被膜的上表面。细胞的下表面膜与Diff-Quick染色。入侵细胞的数量与显微镜计数。gydF4y2Ba
代码的可用性gydF4y2Ba
作者宣称R源代码可从相应的作者。gydF4y2Ba
数据可用性gydF4y2Ba
微阵列和RNA-seq表达数据,支持本研究的发现已经存入地理与主GSE109450加入代码。gydF4y2Ba
引用gydF4y2Ba
有效地,d . C。,Bell, P. D. & Hill, J. A. Fibrosis—a common pathway to organ injury and failure.心血管病。j .地中海。gydF4y2Ba372年gydF4y2Ba,1138 - 1149 (2015)。gydF4y2Ba
Bottini: & Firestein g s的二元性呈synoviocytes RA:被动反应者和压印的侵略者。gydF4y2Ba启Rheumatol Nat。gydF4y2Ba9gydF4y2Ba33 (2013)。gydF4y2Ba
李,d . m . et al . Cadherin-11在关节炎滑膜衬里形成和病理学。gydF4y2Ba科学gydF4y2Ba315年gydF4y2Ba,1006 - 1010 (2007)。gydF4y2Ba
特纳,j . d . &档人员,a .滑膜成纤维细胞在类风湿性关节炎发病机理中的作用。gydF4y2Ba咕咕叫。当今。Rheumatol。gydF4y2Ba27gydF4y2Ba,175 - 182 (2015)。gydF4y2Ba
弗莱彻,a . L。,Acton, S. E. & Knoblich, K. Lymph node fibroblastic reticular cells in health and disease.启Immunol Nat。gydF4y2Ba15gydF4y2Ba,350 - 361 (2015)。gydF4y2Ba
特尔,美国J。,Cremasco, V. & Astarita, J. L. Immunological hallmarks of stromal cells in the tumour microenvironment.启Immunol Nat。gydF4y2Ba15gydF4y2Ba,669 - 682 (2015)。gydF4y2Ba
天雪,j . et al . Transcriptome-based网络分析揭示了人类巨噬细胞激活的谱模型。gydF4y2Ba免疫力gydF4y2Ba40gydF4y2Ba,274 - 288 (2014)。gydF4y2Ba
帕特尔,a . p . et al .单细胞RNA-seq强调在原发性胶质母细胞瘤瘤内异质性。gydF4y2Ba科学gydF4y2Ba344年gydF4y2Ba,1396 - 1401 (2014)。gydF4y2Ba
宫本茂,d . t . et al . RNA-Seq单抗雄激素抵抗前列腺ctc牵连到经典之中Wnt信号。gydF4y2Ba科学gydF4y2Ba349年gydF4y2Ba,1351 - 1356 (2015)。gydF4y2Ba
Gibofsky, a .流行病学、病理生理学和类风湿性关节炎的诊断:剧情简介。gydF4y2Ba点。j .等内容。护理gydF4y2Ba20.gydF4y2BaS128-S135 (2014)。gydF4y2Ba
Firestein g . s .风湿性关节炎的发展概念。gydF4y2Ba自然gydF4y2Ba423年gydF4y2Ba,356 - 361 (2003)。gydF4y2Ba
Malhotra d . et al .转录分析基质的淋巴结发炎和休息定义免疫学特征。gydF4y2BaImmunol Nat。gydF4y2Ba13gydF4y2Ba,499 - 510 (2012)。gydF4y2Ba
Ekwall A.-K。h . et al。肿瘤相关糖蛋白podoplanin表达呈增生性的synoviocytes在类风湿性关节炎滑膜衬里层。gydF4y2Ba关节炎研究》。gydF4y2Ba13gydF4y2BaR40 (2011)。gydF4y2Ba
瓦伦西亚,x et al . Cadherin-11纤维母synoviocytes之间提供了特定的细胞粘附。gydF4y2Baj . Exp。地中海。gydF4y2Ba200年gydF4y2Ba,1673 - 1679 (2004)。gydF4y2Ba
鲍尔,s . et al .成纤维细胞激活蛋白表达由风湿性myofibroblast-like synoviocytes。gydF4y2Ba关节炎研究》。gydF4y2Ba8gydF4y2BaR171 (2006)。gydF4y2Ba
宅一生,k . et al .炎性细胞因子的表达vasohibin-1类风湿性滑膜成纤维细胞。gydF4y2BaActa地中海。日本冈山gydF4y2Ba63年gydF4y2Ba,349 - 358 (2009)。gydF4y2Ba
米德尔顿j . et al .内皮细胞标记物表达的比较研究人类组织慢性炎症:台面式晶体管- 79,达菲抗原趋化因子受体,血管性血友病因子、CD31、CD34、CD105和CD146。gydF4y2Baj .分册。gydF4y2Ba206年gydF4y2Ba,260 - 268 (2005)。gydF4y2Ba
Kharchenko, p V。,Silberstein, L. & Scadden, D. T. Bayesian approach to single-cell differential expression analysis.Nat方法。gydF4y2Ba11gydF4y2Ba,740 - 742 (2014)。gydF4y2Ba
Shekhani, m . t . et al .胶原蛋白三螺旋重复包含1是一个新的promigratory关节炎血管翳的标志。gydF4y2Ba关节炎研究》。gydF4y2Ba18gydF4y2Ba171 (2016)。gydF4y2Ba
你,s . et al。识别关键监管者风湿性synoviocytes通过系统的迁移和入侵的方法。gydF4y2BaProc。国家的。学会科学。美国gydF4y2Ba111年gydF4y2Ba,550 - 555 (2014)。gydF4y2Ba
米勒,m . c . et al .膜1型基质金属蛋白酶是一种重要的启动子在人类风湿性关节炎滑膜入侵。gydF4y2Ba关节炎感冒。gydF4y2Ba60gydF4y2Ba,686 - 697 (2009)。gydF4y2Ba
Sabeh F。,Li, X. Y., Saunders, T. L., Rowe, R. G. & Weiss, S. J. Secreted versus membrane-anchored collagenases: relative roles in fibroblast-dependent collagenolysis and invasion.生物。化学。gydF4y2Ba284年gydF4y2Ba,23001 - 23011 (2009)。gydF4y2Ba
Brekhman诉& Neufeld医生g .小说不对称三维体外试验研究肿瘤细胞入侵。gydF4y2BaBMC癌症gydF4y2Ba9gydF4y2Ba415 (2009)。gydF4y2Ba
考克斯·t·r . et al .检查参与组成分泌腺缺氧癌症诱发pre-metastatic通过赖氨酰化氧骨骼病变。gydF4y2Ba自然gydF4y2Ba522年gydF4y2Ba,106 - 110 (2015)。gydF4y2Ba
Tsukasaki, m . et al . LOX失败在osteoclastogenesis RANKL的替代品。gydF4y2Baj .骨矿商。Res。gydF4y2Ba32gydF4y2Ba,434 - 439 (2017)。gydF4y2Ba
Hayashi, m . et al . Osteoprotection semaphorin 3。gydF4y2Ba自然gydF4y2Ba485年gydF4y2Ba,69 - 74 (2012)。gydF4y2Ba
煤页岩,l . et al . RANKL表达在滑膜成纤维细胞主要负责骨侵蚀关节炎症。gydF4y2Ba安。感冒。说。gydF4y2Ba75年gydF4y2Ba,1187 - 1195 (2016)。gydF4y2Ba
Izquierdo、大肠等。类风湿性关节炎滑膜成纤维细胞增生:临床病理的相关性和局部抗肿瘤坏死因子治疗逆转。gydF4y2Ba关节炎感冒。gydF4y2Ba63年gydF4y2Ba,2575 - 2583 (2011)。gydF4y2Ba
Chang s . k . et al . Cadherin-11调节成纤维细胞炎症。gydF4y2BaProc。国家的。学会科学。美国gydF4y2Ba108年gydF4y2Ba,8402 - 8407 (2011)。gydF4y2Ba
诺,e . H。,Chang, S. K., Watts, G. F. M. & Brenner, M. B. Modulation of matrix metalloproteinase production by rheumatoid arthritis synovial fibroblasts after cadherin 11 engagement.关节炎感冒。gydF4y2Ba63年gydF4y2Ba,3768 - 3778 (2011)。gydF4y2Ba
Guerrini, m . m . et al .抑制TNF家族细胞因子RANKL防止自身免疫性炎症在中枢神经系统。gydF4y2Ba免疫力gydF4y2Ba43gydF4y2Ba,1174 - 1185 (2015)。gydF4y2Ba
Vukicevic, s & Grgurevic l . BMP-6和间充质干细胞分化。gydF4y2Ba细胞因子生长因子。牧师。gydF4y2Ba20.gydF4y2Ba,441 - 448 (2009)。gydF4y2Ba
Der、大肠等。单个细胞RNA序列在狼疮肾炎解剖分子异质性。gydF4y2Ba江森自控的洞察力gydF4y2Ba2gydF4y2Ba93009 (2017)。gydF4y2Ba
饶,d . a . et al .病理扩展外围辅助T细胞子集驱动B细胞在类风湿性关节炎。gydF4y2Ba自然gydF4y2Ba542年gydF4y2Ba,110 - 114 (2017)。gydF4y2Ba
齐纳尔,h P。李,d . M。,Agarwal, S. K. & Brenner, M. B. Cadherin-11 induces rheumatoid arthritis fibroblast-like synoviocytes to form lining layers in vitro.点。j .分册。gydF4y2Ba168年gydF4y2Ba,1486 - 1499 (2006)。gydF4y2Ba
弗莱彻,a . l . et al .可再生的孤立淋巴结的基质细胞显示site-dependent成纤维细胞的网状细胞的差异。gydF4y2Ba前面。Immunol。gydF4y2Ba2gydF4y2Ba35 (2011)。gydF4y2Ba
Picelli, s . et al .全身使用Smart-seq2 RNA-seq从单个细胞。gydF4y2BaProtoc Nat。gydF4y2Ba9gydF4y2Ba,171 - 181 (2014)。gydF4y2Ba
Trombetta, j。j。单细胞RNA-Seq库的准备下一代测序。gydF4y2Ba咕咕叫。Protoc。摩尔。杂志。gydF4y2Ba107年gydF4y2Ba1卷(2014)。4所示。22 . .gydF4y2Ba
布雷:L。,P我mentel, H., Melsted, P. & Pachter, L. Near-optimal probabilistic RNA-seq quantification.生物科技Nat。》。gydF4y2Ba34gydF4y2Ba,525 - 527 (2016)。gydF4y2Ba
里奇,m . e .等人limma权力分析RNA-sequencing与微阵列研究微分表达式。gydF4y2Ba核酸Res。gydF4y2Ba43gydF4y2Bae47 (2015)。gydF4y2Ba
Liberzon, a . et al .分子签名数据库特征基因集集合。gydF4y2Ba细胞系统。gydF4y2Ba1gydF4y2Ba,417 - 425 (2015)。爱思唯尔。gydF4y2Ba
风扇J。gydF4y2BaJEFworks /狮虎:1.0版本gydF4y2Ba(互联网)。gydF4y2Bahttps://doi.org/10.5281/zenodo.887386gydF4y2Ba(2017)。gydF4y2Ba
Krenn诉et al。滑膜炎得分:慢性低级和高级滑膜炎之间的歧视。gydF4y2Ba组织病理学gydF4y2Ba49gydF4y2Ba,358 - 364 (2006)。gydF4y2Ba
韦克菲尔德,r . j . et al .肌肉骨骼超声包括超声病理学的定义。gydF4y2Baj . Rheumatol。gydF4y2Ba32gydF4y2Ba,2485 - 2487 (2005)。gydF4y2Ba
档人员,等。超声联合计算的实用预测早期类风湿性关节炎患者滑膜炎。gydF4y2Ba安。感冒。说。gydF4y2Ba70年gydF4y2Ba,500 - 507 (2011)。gydF4y2Ba
确认gydF4y2Ba
我们感谢BWH人类免疫学中心细胞分类援助,流式细胞术的核心合作伙伴个性化医学转化为微阵列分析基因组学的核心。RNA-seq和广泛的技术实验室。这项研究得到了露丝l . Kirschstein国家研究服务奖(F31AR070582)国家关节炎和肌肉骨骼和皮肤疾病研究所(K.S.),创新研究从风湿病研究基金会的资助和NIH关节炎和肌肉骨骼和皮肤疾病(RO1 AR063709) (M.B.B.),一个来自日本的奖学金风湿病基金会和战略年轻研究员从日本海外访问程序加速人才环流促进社会科学(F.M.)的Fundacion Bechara (P.A.N.),和NIH P30 AR070253 (P.A.N.),和其他资金从其他国家卫生研究院(R01AR063759, U01GM092691 U19AI111224,狭义相对论)。这份报告是一个独立的研究支持的国家健康研究所/临床研究机构Wellcome Trust伯明翰大学医院NHS信托基金会。我们感激地承认资金从英国关节炎研究类风湿性关节炎卓越中心(比赛,裁判。20298)和临床科学家18547年奖学金,和欧洲共同体的合作项目fp7 -健康- f2 - 2012 - 305549之下“Euro-TEAM”。gydF4y2Ba
作者信息gydF4y2Ba
作者和联系gydF4y2Ba
贡献gydF4y2Ba
F.M.构思的项目,执行实验,分析数据,并写了手稿。K.S.分析微阵列和RNA-seq数据,写的手稿。J.L.M.和自动跟踪进行组织学分析。K.W.进行实验和写的手稿。* *,S.K.C., H.N.N., E.H.N., and J.D.T performed experiments. B.E.E., P.E.B., J.W., B.P.S., G.D.K., S.M.G., V.P.B., L.B.I., and P.A.N. participated in patient recruitment and sample acquisition. A.F. and C.D.B. participated in patient recruitment and sample acquisition, and contributed to the review and interpretation of the data. L.T.D. participated in patient recruitment, sample acquisition, and review of the data. J.A.L. developed reagents and assisted with analysis. N.H. assisted with RNA-seq. S.R. co-supervised the project, analyzed data, and co-wrote the manuscript. M.B.B. conceived the project, supervised the work, analyzed data, and co-wrote the manuscript.
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
M.B.B.共和国,,C.D.B. declare that they received research funding from Roche, and M.B.B. is a consultant to Roche. The remaining authors declare no competing financial interests.
额外的信息gydF4y2Ba
出版商的注意:gydF4y2Ba施普林格自然保持中立在发表关于司法主权地图和所属机构。gydF4y2Ba
电子辅料gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到Creative Commons许可,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
沟口健二,F。,Slowikowski, K., Wei, K.et al。gydF4y2Ba功能不同的疾病有关的纤维母细胞在类风湿性关节炎子集。gydF4y2BaNat CommungydF4y2Ba9gydF4y2Ba789 (2018)。https://doi.org/10.1038/s41467 - 018 - 02892 - ygydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467 - 018 - 02892 - ygydF4y2Ba
本文引用的gydF4y2Ba
单细胞分析揭示了青少年特发性关节炎呈异质性synoviocytes疾病亚型的影响gydF4y2Ba
关节炎研究和治疗gydF4y2Ba(2022)gydF4y2Ba
单细胞分析多通道识别常见的风湿性关节炎患者滑膜成纤维细胞的监管项目和建模TNF-driven关节炎gydF4y2Ba
基因组医学gydF4y2Ba(2022)gydF4y2Ba
清除衰老细胞与abt - 263改善骨关节炎患者滑膜间充质干细胞的生物学功能gydF4y2Ba
干细胞研究与治疗gydF4y2Ba(2022)gydF4y2Ba
CD34 + THY1 +关节炎关节滑膜成纤维细胞子集体外成骨细胞的和chondrogenic潜力高gydF4y2Ba
关节炎研究和治疗gydF4y2Ba(2022)gydF4y2Ba
识别HBEGF +成纤维细胞的缓解类风湿性关节炎通过整合单细胞RNA序列数据集和批量RNA序列数据集gydF4y2Ba
关节炎研究和治疗gydF4y2Ba(2022)gydF4y2Ba
评论gydF4y2Ba
通过提交评论你同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果你发现一些滥用或不符合我们的条件或准则请国旗是不合适的。gydF4y2Ba