摘要gydF4y2Ba
的变化gydF4y2BaNgydF4y2Ba-酰基乙醇胺(NAE)水平与肥胖和代谢合并症有关。它们在肠道中的作用尚不清楚。因此,我们建立了诱导性肠上皮细胞(IEC)特异性缺失小鼠模型gydF4y2BaNgydF4y2Ba-酰基磷脂酰乙醇胺磷脂酶D (NAPE-PLD)是NAE生物合成的关键酶(gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba)。我们发现gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠在第一次接触高脂肪饮食(HFD)时出现过度吞噬,并发展为加剧的肥胖和脂肪变性。这些小鼠展示下丘脑gydF4y2BaPomcgydF4y2Ba神经元功能障碍和肠和血浆NAE和2-酰基甘油的改变。经过长期的高热量饮食,gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠的能量消耗减少。脂肪变性的增加与较高的肠道和肝脏脂质吸收有关。gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠显示肠道菌群发生改变。gydF4y2BaAkkermansia muciniphilagydF4y2Ba给药部分抵消了IEC NAPE-PLD缺失效应。综上所述,肠道NAPE-PLD是脂肪摄入的营养适应、肠-脑轴和能量稳态的关键传感器,因此构成了解决肥胖和相关疾病的新靶点。gydF4y2Ba
介绍gydF4y2Ba
肥胖是影响全球10%以上人口的流行病gydF4y2Ba1gydF4y2Ba。除了脂肪组织质量增加,肥胖还与慢性炎症和几乎所有代谢相关组织的改变有关。这使肥胖者容易出现代谢综合征的表现,如胰岛素抵抗、肝脏脂肪变性和心血管疾病。然而,肥胖和这种代谢改变之间的联系机制仍然知之甚少。重要的是要加深我们对肥胖的病理生理学及其合并症的理解。gydF4y2Ba
内源性大麻素系统(ECS)由普遍存在的生物活性脂质组成,通过各种受体调节葡萄糖和脂质代谢、食物摄入和炎症gydF4y2Ba2gydF4y2Ba。内源性大麻素是最有特色的一种gydF4y2BaNgydF4y2Ba-酰基乙醇胺(NAE)gydF4y2BaNgydF4y2Ba-花生四烯酮酰乙醇胺(AEA)刺激大麻素受体CB1和CB2gydF4y2Ba3 gydF4y2Ba。其他NAE如油酰乙醇酰胺(OEA)、硬脂酰乙醇酰胺(SEA)、亚麻酰乙醇酰胺(LEA)和棕榈酰乙醇酰胺(PEA)在结构上接近并与AEA共享生物合成途径,但不激活CB1或CB2。它们被认为是内源性大麻素类分子,作用于其他受体,如PPARα或GPR119gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba5克ydF4y2Ba。内源性大麻素及其相关介质的水平直接由它们的合成和降解酶的活性调节。NAE主要是用NAPE-PLD合成的gydF4y2BaNapepldgydF4y2Ba-敲除(KO)小鼠描述了AEA合成的替代途径gydF4y2Ba6克ydF4y2Ba。NAE降解是由脂肪酸酰胺水解酶(FAAH)和NAE水解酸酰胺酶(NAAA)活性介导的。gydF4y2Ba3 gydF4y2Ba。gydF4y2Ba
肥胖与NAE水平改变和CB1过度激活相关,导致肝脏、肌肉和脂肪组织中的脂质堆积和炎症,以及糖耐量受损gydF4y2Ba2gydF4y2Ba。一致地,gydF4y2BaCnr1gydF4y2Ba(编码CB1)-KO小鼠对饮食诱导的肥胖有保护作用。ECS的酶也在代谢综合征的发展中发挥作用,如gydF4y2BaFaahgydF4y2Ba-即使在控制饮食的情况下,ko小鼠也会变得肥胖和胰岛素抵抗gydF4y2Ba7gydF4y2Ba。有趣的是,单核苷酸多态性gydF4y2BaNapepldgydF4y2Ba与人类肥胖有关吗gydF4y2Ba8gydF4y2Ba。然而,这种酶的影响不如全身那么明显gydF4y2BaNapepldgydF4y2Ba-KO小鼠没有表现出身体成分或葡萄糖代谢的变化gydF4y2Ba9gydF4y2Ba。值得注意的是,外周NAE水平在全身不受影响gydF4y2BaNapepldgydF4y2Bako小鼠gydF4y2Ba10gydF4y2Ba。相反,我们最近表明脂肪细胞特异性gydF4y2BaNapepldgydF4y2Ba缺失会降低脂肪组织NAE水平,有利于对照组小鼠肥胖的发展gydF4y2Ba11gydF4y2Ba。因此,研究NAPE-PLD在肥胖相关特定组织中的作用很有意义。gydF4y2Ba
肠上皮通过其在营养吸收中的作用和肠内分泌细胞(EEC)分泌的各种激素调节能量代谢。gydF4y2Ba12gydF4y2Ba。它也是内源性大麻素和调节食物摄入量的相关化合物的主要来源gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba。胃内短期脂肪暴露诱导空肠AEA动员,而十二指肠脂肪暴露导致OEA合成,有助于膳食脂肪摄入的微调gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba。此外,最近的数据强调了肠道ECS在调节脂质吸收、肠道内分泌分泌和肠道屏障功能方面的重要性gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba5克ydF4y2Ba。在饮食引起的肥胖中,肠道NAE水平降低gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba。这些变化是否在代谢综合征的发展中起作用仍有待研究。gydF4y2Ba
为了评估肠道NAE在肥胖中的重要性,我们建立了一个诱导模型gydF4y2BaNapepldgydF4y2Ba肠上皮细胞特异性缺失(gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠),并研究其在生理条件下和饮食诱导肥胖期间对代谢的影响。HFD-fedgydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠对肥胖和脂肪变性以及食物摄入量的改变、下丘脑能量稳态调节的改变、能量消耗的降低和肠道菌群的改变更加敏感。正如我们之前演示的那样gydF4y2BaAkkermansia muciniphilagydF4y2Ba作为一种在肥胖过程中具有有益作用的肠道微生物,NAPE-PLD可以通过调节与ECS相关的肠道生物活性脂质来发挥其作用,我们测试了肠道NAPE-PLD是否介导了这些作用。gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠对维生素d的保护作用仍然敏感gydF4y2Ba答:muciniphilagydF4y2Ba这表明肠道NAPE-PLD并不是这种细菌对抗代谢综合征的有益效果所必需的。我们的研究结果强调了肠内源性大麻素和相关介质在通过肠-脑轴调节食物摄入中的其他作用,并支持它们在肠-肝轴中的重要性。他们还强调了相互作用的新机制gydF4y2Ba答:muciniphilagydF4y2Ba它的宿主在肥胖的背景下。gydF4y2Ba
结果gydF4y2Ba
验证gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠模型gydF4y2Ba
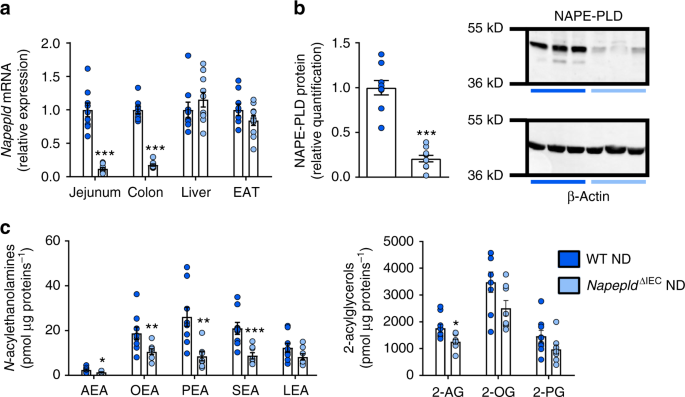
Villin-CregydF4y2BaERT2gydF4y2Ba老鼠gydF4y2Ba22gydF4y2Ba被与gydF4y2BaNapepldgydF4y2BalgydF4y2Ba牛/液态氧gydF4y2Ba老鼠gydF4y2Ba11gydF4y2Ba生成gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠。为了验证模型,我们进行了量化gydF4y2BaNapepldgydF4y2Ba对照组(ND)小鼠多个组织的基因表达。空肠和结肠基因表达降低gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠(图。gydF4y2Ba1gydF4y2Ba)。在肝脏或附睾脂肪组织(EAT)中未观察到减少,支持肠段缺失的特异性(图。gydF4y2Ba1gydF4y2Ba)。western blot分析证实缺失;gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠的NAPE-PLD蛋白水平比野生型(WT)小鼠低5倍(图2)。gydF4y2Ba1 bgydF4y2Ba)。gydF4y2Ba
IEC的验证gydF4y2BaNapepldgydF4y2Ba删除。gydF4y2Ba一个gydF4y2BaNapepldgydF4y2BaWT和nd喂养的WT空肠、结肠、肝脏和附睾脂肪组织(EAT) mRNA表达gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠(gydF4y2BangydF4y2Ba= 8 - 10)。gydF4y2BabgydF4y2Ba结肠中的NAPE-PLD蛋白水平。NAPE-PLD和β-Actin的代表性western-blot (gydF4y2BangydF4y2Ba= 9)。gydF4y2BacgydF4y2Ba水平的gydF4y2BaNgydF4y2Ba-酰基乙醇胺和2-酰基甘油在nd喂养的WT小肠上皮细胞和gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠(gydF4y2BangydF4y2Ba= 7-9)采用高效液相色谱-质谱联用LTQ Orbitrap质谱仪测定。深蓝色:WT ND小鼠,浅蓝色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba和老鼠。数据以均数±s.e.m表示。*, **和***分别表示与WT ND有显著差异gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2BaPgydF4y2Ba< 0.01,gydF4y2BaPgydF4y2Ba< 0.001),符合Mann-Whitney检验gydF4y2Ba
最后,我们定量了从WT和小肠分离的肠上皮细胞中的内源性大麻素(eCB)和eCB样化合物(即NAE和单酰甘油)gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠。所有NAE水平均受缺失影响,AEA(42%)、OEA(44%)、PEA(68%)、SEA(58%)显著下降,LEA(33%)呈趋势下降。相反,只有2-花生四烯醛甘油降低,而其他酰甘油没有明显影响(图。gydF4y2Ba1 cgydF4y2Ba)。gydF4y2Ba
NapepldgydF4y2Ba∆IEC老鼠gydF4y2Ba第一次接触HFD会出现过度吞噬gydF4y2Ba
十二指肠脂质注入刺激肠道OEA的产生,导致脂肪暴露后的饱腹感增加gydF4y2Ba17gydF4y2Ba而小肠OEA的产生在慢性脂肪喂养过程中会中断gydF4y2Ba21gydF4y2Ba。然而,这个缺陷的起源还没有被确定。作为gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠表现出较低的肠道NAE水平,我们推断它们的食物摄入量可以在第一次高脂肪饮食(HFD)暴露后直接改变,从而提供了NAPE-PLD概念的第一个证据gydF4y2Ba本身gydF4y2Ba可以在这种情况下发挥重要作用。gydF4y2Ba
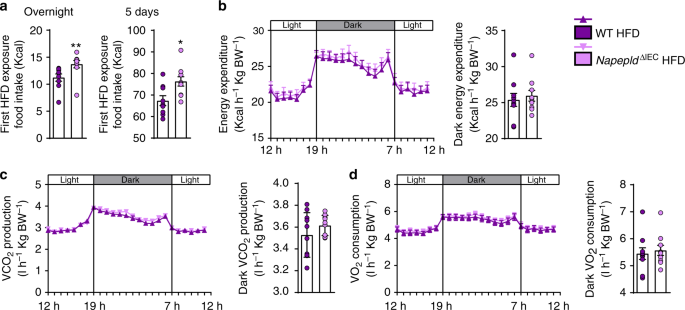
因此,我们记录了个体的高热量膳食摄入量gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠第一次接触饮食后使用代谢笼。与我们的假设一致,gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba在第一夜接触HFD期间,小鼠明显吃得更多,5天后这种差异仍保持不变(图2)。gydF4y2Ba2gydF4y2Ba)。由于肠道NAE也会影响能量代谢,我们测量了同期的能量消耗。能源消耗,COgydF4y2Ba2gydF4y2Ba生产,OgydF4y2Ba2gydF4y2Ba两组的消耗相似(图。gydF4y2Ba两个罪犯gydF4y2Ba)。gydF4y2Ba
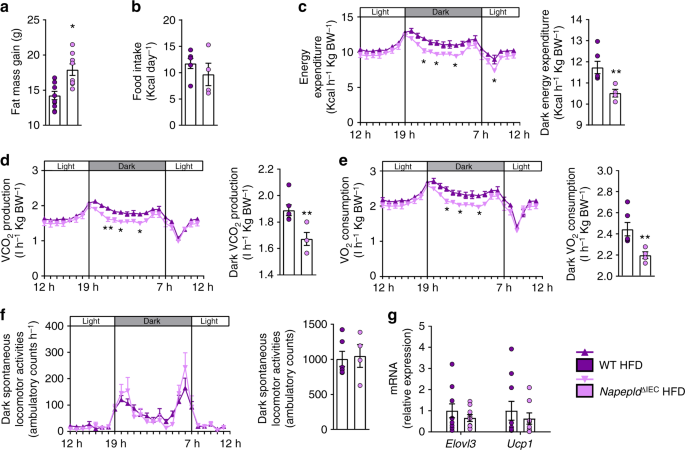
NapepldgydF4y2Ba∆IECgydF4y2Ba在早期接触高热量膳食后出现过度吞噬,而能量消耗没有变化。gydF4y2Ba一个gydF4y2Ba饲喂24小时及5天后的高热量膳食摄入量(千卡)(gydF4y2BangydF4y2Ba= 9)。gydF4y2BabgydF4y2Ba光和暗循环能量消耗(千卡小时gydF4y2Ba−1gydF4y2Ba体重gydF4y2Ba−1gydF4y2Ba)在间接量热研究中在代谢室中测量。gydF4y2BacgydF4y2BaCO的明暗循环gydF4y2Ba2gydF4y2Ba生产(l h)gydF4y2Ba−1gydF4y2Ba体重gydF4y2Ba−1gydF4y2Ba)。gydF4y2BadgydF4y2BaO的明暗循环gydF4y2Ba2gydF4y2Ba消耗量(l h)gydF4y2Ba−1gydF4y2Ba体重gydF4y2Ba−1gydF4y2Ba)。紫色:WT HFD小鼠,粉色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD老鼠。数据以均数±s.e.m表示。*和**表示与WT HFD有显著差异(分别gydF4y2BaPgydF4y2Ba< 0.05和gydF4y2BaPgydF4y2BaMann-Whitney检验< 0.01)gydF4y2Ba
肠道NAE可通过肠-脑轴作用,影响肠道激素,同时也通过首先作用于弓状核(ARC),最终作用于室旁核(PVN),影响食物摄入的中央调节。gydF4y2Ba
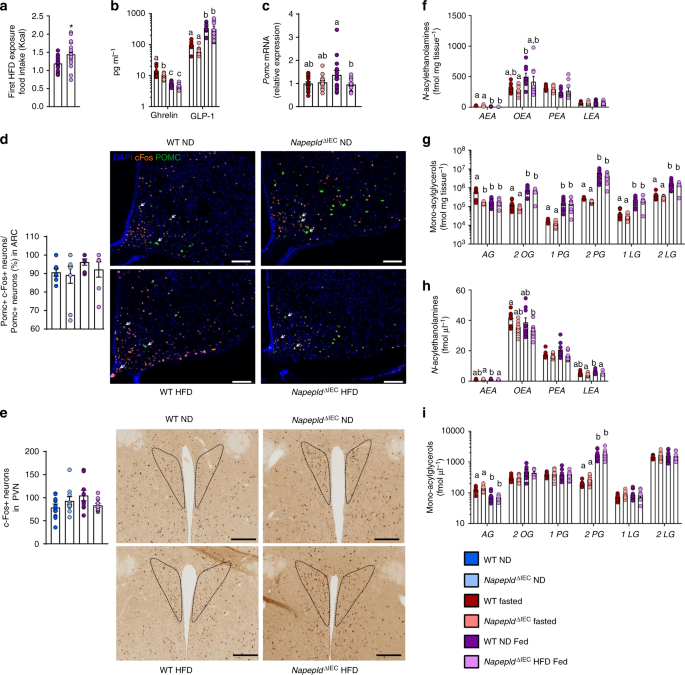
NapepldgydF4y2Ba∆IECgydF4y2Ba与WT小鼠相比,小鼠在第一次接触HFD的4小时内摄入了明显更多的食物(图2)。gydF4y2Ba3gydF4y2Ba)。因此,我们量化了调节食物摄入的关键肠道激素水平。与禁食小鼠相比,HFD暴露显著降低了门脉ghrelin,增加了门脉GLP-1水平(图2)。gydF4y2Ba3 bgydF4y2Ba)。然而,gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba和WT小鼠在HFD下表现出相似的特征。这些结果表明,这些肠道激素并不有助于观察到的表型gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠。gydF4y2Ba
嗜食症gydF4y2Ba∆IECgydF4y2Ba与Pomc神经元、NAE和单酰甘油的改变有关。gydF4y2Ba一个gydF4y2Ba高热量膳食摄入量(千卡)(gydF4y2BangydF4y2Ba= 17)。gydF4y2BabgydF4y2BaGhrelin和GLP-1水平(pg mlgydF4y2Ba1gydF4y2Ba)注入门静脉(gydF4y2BangydF4y2Ba= 7 - 9)。gydF4y2BacgydF4y2Ba相对mRNA表达gydF4y2BaPomcgydF4y2Ba在下丘脑(gydF4y2BangydF4y2Ba= 15 - 17)。gydF4y2BadgydF4y2BaARC中Pomc阳性神经元与c-Fos阳性神经元的比例(gydF4y2BangydF4y2Ba= 7-10)和ARC (bregma−1,70 mm) IF-TSA双重染色的代表性图像(比例尺= 100 μm),放大20倍。白色箭头表示表达POMC(绿色)的激活神经元(橙色为c-Fos阳性)。gydF4y2BaegydF4y2BaPVN中c-Fos阳性神经元(gydF4y2BangydF4y2Ba= 9-10)和代表性的PVN内c-Fos免疫组化亮场图像(bregma−0,58 mm)(比例尺= 200µm),放大倍率10×,黑色虚线为定界PVN。gydF4y2BafgydF4y2BaNgydF4y2Ba-酰基乙醇胺(fmol mggydF4y2Ba−1gydF4y2Ba)测量于空肠(gydF4y2BangydF4y2Ba= 7-9)使用岛津8050三重四极质谱仪。gydF4y2BaggydF4y2Ba单酰甘油(AG = 1AG + 2AG) (fmol mggydF4y2Ba−1gydF4y2Ba)测量于空肠(gydF4y2BangydF4y2Ba= 7 - 9)。gydF4y2BahgydF4y2BaNgydF4y2Ba-酰基乙醇胺(fmol μlgydF4y2Ba−1gydF4y2Ba)测量门静脉(gydF4y2BangydF4y2Ba= 7 - 9)。gydF4y2Ba我gydF4y2Ba单酰甘油(AG = 1AG + 2AG) (fmol μlgydF4y2Ba−1gydF4y2Ba)测量门静脉(gydF4y2BangydF4y2Ba= 7-9)使用岛津8050三重四极质谱仪。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba和gydF4y2BaggydF4y2Ba- - - - - -gydF4y2BajgydF4y2Ba以WT和gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba要么禁食,要么摄入高热量食物4小时后,gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba以WT和gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠在ND或HFD摄入1小时后。数据gydF4y2Ba一个gydF4y2Ba和gydF4y2BacgydF4y2Ba对应于两个独立实验的结果。深蓝色:WT ND小鼠,浅蓝色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaND小鼠,红色:WT空腹小鼠,三文鱼:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba禁食小鼠,紫色:野生型高热量饮食小鼠,粉色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD老鼠。数据以均数±s.e.m表示。星号(*)表示与WT HFD有显著差异(gydF4y2BaPgydF4y2BaMann-Whitney检验< 0.05)。不同上标字母的数据有显著差异(gydF4y2BaPgydF4y2Ba< 0.05),根据常规的双因素方差分析,然后进行Tukey的事后检验gydF4y2Ba
调节食物摄入的信号的最后整合发生在下丘脑。为了解剖解释能量摄入改变的潜在机制,我们研究了厌食症(即gydF4y2BaPomcgydF4y2Ba,编码前阿皮黑色素皮质蛋白和gydF4y2Ba车gydF4y2Ba编码可卡因相关和安非他明相关转录本)和促食性转录本(即gydF4y2BaNpygydF4y2Ba,编码神经肽Y和gydF4y2BaAgrpgydF4y2Ba(编码agouti相关肽),已知在高热量饲喂后早期被调节的肽gydF4y2Ba23gydF4y2Ba。gydF4y2Ba
有趣的是,HFD喂养足以诱导显著增加gydF4y2BaPomcgydF4y2BaWT动物与禁食动物的mRNA表达gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠表现出与禁食小鼠相似的表达水平。gydF4y2Ba3 cgydF4y2Ba)。肠道AEA和OEA可通过肠-脑轴作用,主要通过调节下丘脑来影响食物摄入的中枢调节gydF4y2Ba催产素gydF4y2Ba表达式gydF4y2Ba4 gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba24gydF4y2Ba。值得注意的是,两者都没有表达gydF4y2Ba催产素gydF4y2Ba,也不是gydF4y2Ba车gydF4y2Ba,gydF4y2BaNpygydF4y2Ba,gydF4y2BaAgrpgydF4y2Ba均受到影响(补充数字gydF4y2Ba2gydF4y2Ba)。gydF4y2Ba
此外,我们量化了c-Fos阳性神经元,这是神经元激活的典型标记。禁食一晚后,我们暴露了WT和gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba对小鼠进行ND或HFD,并定量大脑中的c-Fos。与nd喂养的WT小鼠相比,hfd喂养的WT小鼠下丘脑POMC神经元的激活倾向于更高。gydF4y2Ba3 dgydF4y2Ba),而在gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD小鼠,从而显示出在调节食物摄入方面的第一个缺陷。PVN接收来自ARC的投影,并作为下丘脑控制厌食症信号的最终调节器gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba。有趣的是,虽然HFD喂养倾向于增加PVN中c-Fos的表达(gydF4y2BaPgydF4y2Ba= 0.06,gydF4y2BaTgydF4y2Ba以及),gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Bahfd喂养的小鼠对饮食诱导的PVN中c-Fos的表达没有反应(图2)。gydF4y2Ba3 egydF4y2Ba)。总的来说,我们的数据显示了hfd喂养的下丘脑中厌食症信号整合的潜在缺陷gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠。gydF4y2Ba
在基础条件下gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠表现出较低的空肠NAE水平,我们测量了暴露于HFD 4小时后空肠和门脉血中不同的NAE水平。有趣的是,在肠道NAE中,我们发现在WT和HFD暴露后AEA水平显著降低gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠(图。gydF4y2Ba3 fgydF4y2Ba),而OEA的浓度仅在WT型HFD小鼠中显著增加(gydF4y2BaPgydF4y2Ba= 0.02,gydF4y2BaTgydF4y2Ba以及(图)。gydF4y2Ba3 fgydF4y2Ba)。值得注意的是,2-AG,被描述为一种促食欲的单酰基甘油,在HFD暴露后显著降低(图。gydF4y2Ba3 ggydF4y2Ba)。相反,其他单酰基甘油,包括那些表现出厌食性影响,在HFD暴露期间增加,而不受影响gydF4y2BaNapepldgydF4y2Ba删除(图。gydF4y2Ba3 ggydF4y2Ba),从而排除了这些中介在目前情况下的潜在作用。gydF4y2Ba
有趣的是,在高热量膳食暴露期间,gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠的AEA、LEA和PEA水平显著降低(gydF4y2BaPgydF4y2Ba= 0.04,gydF4y2BaTgydF4y2Ba-test)在门脉血(图;gydF4y2Ba3 hgydF4y2Ba)。不同单酰基甘油的门静脉水平仅受HFD暴露的影响,而不受gydF4y2BaNapepldgydF4y2Ba删除(图。gydF4y2Ba3我gydF4y2Ba)。因此,这些结果强烈表明,增加的食物摄入量不是通过调节肠道激素介导的,而可能是通过NAPE-PLD产生的肠道生物活性脂质介导的。gydF4y2Ba
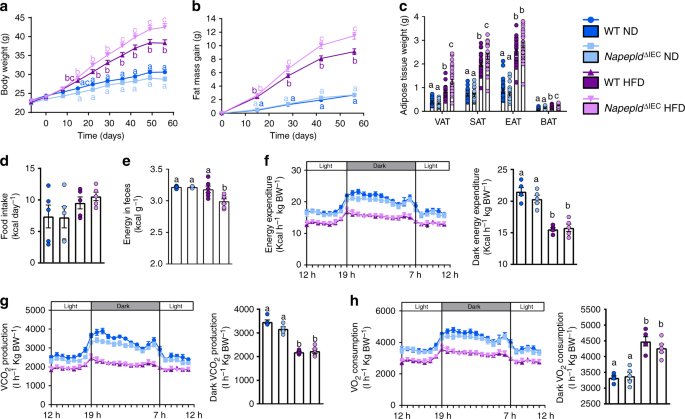
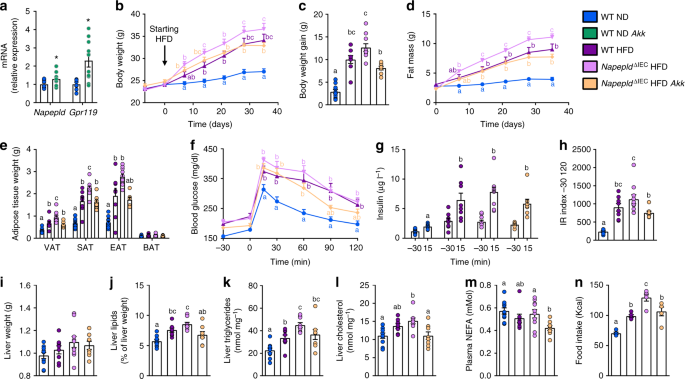
NapepldgydF4y2Ba∆IECgydF4y2Ba加重肥胖,减少能量消耗gydF4y2Ba
探讨的影响gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba在长期脂肪摄入后,我们将小鼠暴露在高热量饮食中8周。HFD-fedgydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠的体重明显升高(图;gydF4y2Ba4gydF4y2Ba)和脂肪量增加(图;gydF4y2Ba4 bgydF4y2Ba),而在ND条件下没有观察到差异。内脏(VAT)、皮下(SAT)和棕色脂肪组织(BAT)重量在hfd喂养组中均显著升高gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba附睾脂肪库(EAT)有类似趋势的小鼠(图。gydF4y2Ba4摄氏度gydF4y2Ba)。在ND上观察到(图。gydF4y2Ba1gydF4y2Ba),gydF4y2BaNapepldgydF4y2Ba空肠和结肠基因表达降低gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD小鼠(补充图gydF4y2Ba1gydF4y2Ba)。在蛋白水平上证实了缺失(补充图)gydF4y2Ba1 bgydF4y2Ba)。gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠没有表现出其他关键ECS参与者的肠道表达的任何变化,如gydF4y2BaNaaagydF4y2Ba,gydF4y2Ba球型gydF4y2Ba,gydF4y2BaFaahgydF4y2Ba或gydF4y2BaCnr1gydF4y2Ba。的适度增长gydF4y2BaNaaagydF4y2Ba和gydF4y2Ba球型gydF4y2Ba仅在hfd喂养的小鼠中观察到表达(补充图gydF4y2Ba1 cgydF4y2Ba)。gydF4y2Ba
hfd引起的肥胖的恶化gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠。gydF4y2Ba一个gydF4y2Ba体重(g)超过8周。gydF4y2BabgydF4y2Ba8周内脂肪量增加(g)。gydF4y2BacgydF4y2Ba不同白色脂肪组织库的重量与BAT (g)。gydF4y2BadgydF4y2Ba在高热量饮食喂养的第8周,通过间接量热法研究,在代谢室中测量每日食物摄入量(千卡/天)。gydF4y2BaegydF4y2Ba在高热量饲粮第8周时测定粪便能量(Kcal g粪便gydF4y2Ba−1gydF4y2Ba)。gydF4y2BafgydF4y2Ba光和暗循环能量消耗(千卡小时gydF4y2Ba−1gydF4y2Ba体重gydF4y2Ba−1gydF4y2Ba)在代谢室中测量。gydF4y2BaggydF4y2BaCO的明暗循环gydF4y2Ba2gydF4y2Ba生产(l h)gydF4y2Ba−1gydF4y2Ba体重gydF4y2Ba−1gydF4y2Ba)。gydF4y2BahgydF4y2BaO的明暗循环gydF4y2Ba2gydF4y2Ba消耗量(l h)gydF4y2Ba−1gydF4y2Ba体重gydF4y2Ba−1gydF4y2Ba)。数据gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba对应于三个独立实验的结果。为gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba,gydF4y2BangydF4y2Ba=代谢途径。为gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba- - - - - -gydF4y2BahgydF4y2Ba,gydF4y2BangydF4y2Ba= 5。为gydF4y2BaegydF4y2Ba,gydF4y2BangydF4y2Ba= 4 - 6。深蓝色:WT ND小鼠,浅蓝色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaND小鼠,紫色:WT HFD小鼠,粉色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD老鼠。数据以均数±s.e.m表示。不同上标字母的数据有显著差异(gydF4y2BaPgydF4y2Ba< 0.05),采用重复测量双因素方差分析,然后进行Tukey事后检验(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba)或常规的双向方差分析,然后是Tukey的事后检验(gydF4y2BacgydF4y2Ba,gydF4y2BahgydF4y2Ba)gydF4y2Ba
观察到的高脂肪量增加gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠的部分原因可能是它们的能量摄入增加了10% (gydF4y2BaPgydF4y2Ba> 0.05,gydF4y2BaTgydF4y2Ba以及(图)。gydF4y2Ba4 dgydF4y2Ba)和显著降低粪便中的能量排泄(图。gydF4y2Ba4 egydF4y2Ba),而不是通过改变整个身体的能量消耗(图。gydF4y2Ba4 fgydF4y2Ba)有限公司gydF4y2Ba2gydF4y2Ba生产(图。gydF4y2Ba4 ggydF4y2Ba)或OgydF4y2Ba2gydF4y2Ba消费(图。gydF4y2Ba4 hgydF4y2Ba)。gydF4y2Ba
人们可以预期,经过较长时间的高热量饮食,脂肪量的差异将会减少。因此,我们评估了表型gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba长时间的高热量膳食暴露(16周)后的小鼠。尽管空肠(2-PG除外)和门脉血中NAE和单酰甘油水平无明显差异(补充图)gydF4y2Ba3中gydF4y2Ba),我们发现,在gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Bahfd喂养的小鼠与WT hfd喂养的小鼠相比(图2)。gydF4y2Ba5gydF4y2Ba)。为了评估这种持续脂肪量差异的原因,我们调查了高热量膳食暴露的最后一周的能量代谢。那时,gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠并不比WT小鼠吃得更多(图;gydF4y2Ba5 bgydF4y2Ba)。然而,在黑暗期,gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠消耗的能量明显低于WT小鼠(图2)。gydF4y2Ba5度gydF4y2Ba),连同较低的COgydF4y2Ba2gydF4y2Ba生产(图。gydF4y2Ba5 dgydF4y2Ba)和OgydF4y2Ba2gydF4y2Ba消费(图。gydF4y2Ba5 egydF4y2Ba)。值得注意的是,这不是由于任何身体活动的改变(图。gydF4y2Ba5 fgydF4y2Ba)。最后,呼吸交换比(RER)未受影响(补充图)gydF4y2Ba3gydF4y2Ba)。为了进一步破译解释更高能量储存的机制,我们研究了高温的影响gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba脂肪组织褐变过程缺失。我们之前已经证明了脂肪细胞特异性gydF4y2BaNapepldgydF4y2Ba缺失与能量消耗减少和褐变有关gydF4y2Ba11gydF4y2Ba。在这里,我们发现了一个下调的关键褐变标记即gydF4y2BaUcp1gydF4y2Ba和gydF4y2BaElovl3gydF4y2Ba在白色脂肪组织中gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba与WT hfd喂养的小鼠相比,这种效应没有达到显著性(图2)。gydF4y2Ba5克gydF4y2Ba)。然而,由于这一测量是在实验结束时获得的,我们可能不排除由于这些小鼠的整体脂肪量较高,在这里观察到的趋势可能部分地有助于减少能量消耗,但这一假设值得进一步研究。总之,这些结果表明gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba导致高热量饮食开始时食物摄入量增加,导致体重和脂肪量增加,并由于能量消耗的变化而长期维持。gydF4y2Ba
Napepld表型gydF4y2Ba∆IECgydF4y2Ba16周后的小鼠能量消耗较低。gydF4y2Ba一个gydF4y2Ba16周后脂肪量增加(g)。gydF4y2BabgydF4y2Ba在高热量饮食的第16周进行间接量热研究时,在代谢室中测量每日高热量饮食摄入量(千卡/天)。gydF4y2BacgydF4y2Ba光和暗循环能量消耗(千卡小时gydF4y2Ba−1gydF4y2Ba体重gydF4y2Ba−1gydF4y2Ba)在代谢室中测量。gydF4y2BadgydF4y2BaCO的明暗循环gydF4y2Ba2gydF4y2Ba生产(l h)gydF4y2Ba−1gydF4y2Ba体重gydF4y2Ba−1gydF4y2Ba)。gydF4y2BaegydF4y2BaO的明暗循环gydF4y2Ba2gydF4y2Ba消耗量(l h)gydF4y2Ba−1gydF4y2Ba体重gydF4y2Ba−1gydF4y2Ba)。gydF4y2BafgydF4y2Ba光周期和暗周期自发运动活动(活动计数hgydF4y2Ba−1gydF4y2Ba)。gydF4y2BaggydF4y2BamRNA表达gydF4y2BaElovl3gydF4y2Ba和gydF4y2BaUcp1gydF4y2Ba在皮下脂肪组织中。为gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba,gydF4y2BangydF4y2Ba= 8 - 10。为gydF4y2BaggydF4y2Ba,gydF4y2BangydF4y2Ba= 8 - 10。紫色:WT HFD小鼠,粉色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD老鼠。数据以均数±s.e.m表示。星号(*和**)表示与WT HFD有显著差异(分别为gydF4y2BaPgydF4y2Ba< 0.05和gydF4y2BaPgydF4y2Ba< 0.01)根据Mann-Whitney检验或重复测量双因素方差分析,然后进行Bonferroni事后检验gydF4y2Ba
NapepldgydF4y2Ba∆IECgydF4y2Ba加剧饮食引起的脂肪变性gydF4y2Ba
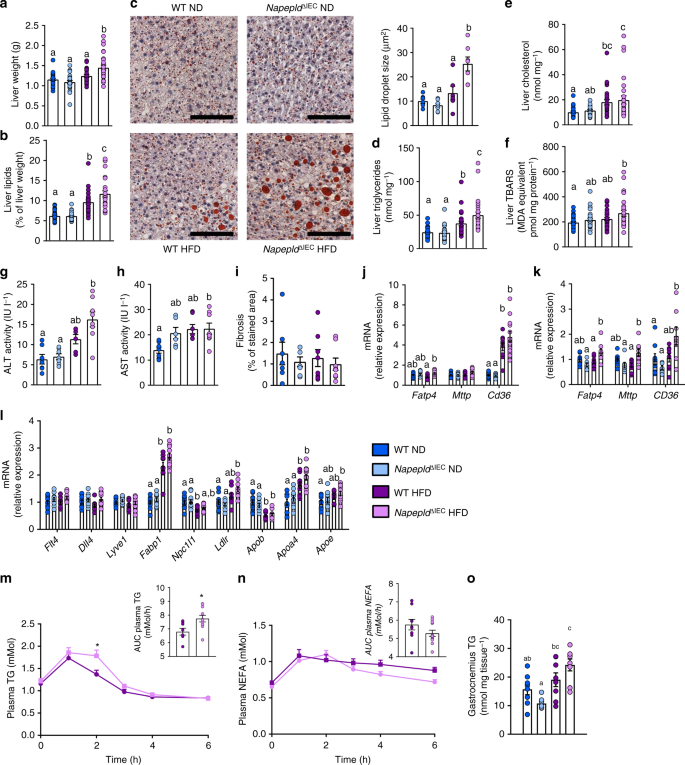
除了脂肪库,hfd喂养组的肝脏重量也明显更高gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba在高热量饮食8周后,小鼠的免疫功能明显高于其他各组。gydF4y2Ba6gydF4y2Ba)。这与hfd诱导的脂肪变性恶化有关,因为肝脏总脂质含量、肝脏甘油三酯和脂滴大小在hfd中显著升高gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba与WT小鼠相比(图;gydF4y2Ba6罪犯gydF4y2Ba)。这是由高基因表达的脂质合成基因的趋势,包括gydF4y2BaFasngydF4y2Ba,gydF4y2BaAcacagydF4y2Ba,gydF4y2BaScd1, Srebf1, Me1, GpamgydF4y2Ba和gydF4y2BaDgat2gydF4y2Ba(补充图gydF4y2Ba4gydF4y2Ba),而与脂质氧化有关的基因如gydF4y2BaPpargc1a, Ppara, Cpt1a, Acox和AcadmgydF4y2Ba(补充图gydF4y2Ba4 bgydF4y2Ba)。根据基因表达谱,ThrgydF4y2Ba172gydF4y2Bap-AMPK在各组间相似(补充图gydF4y2Ba4 hgydF4y2Ba)。肝脏胆固醇仅受HFD影响(图。gydF4y2Ba6 egydF4y2Ba),以及血浆胆固醇水平(补充图gydF4y2Ba4摄氏度gydF4y2Ba)。血浆甘油三酯和非酯化脂肪酸(NEFA)在所有组中均无变化(补充图)gydF4y2Ba4 dgydF4y2BaE).脂质过氧化显著增加gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba与nd喂养的动物相比(图;gydF4y2Ba6 fgydF4y2Ba)。与WT ND相比,WT HFD小鼠血浆丙氨酸转氨酶有升高的趋势,HFD喂养小鼠血浆丙氨酸转氨酶显著升高gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba(无花果。gydF4y2Ba6克gydF4y2Ba)。hfd喂养的两组血浆天冬氨酸转氨酶均增加一倍gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠(gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2BaTgydF4y2Ba-test)和WT型HFD (gydF4y2BaPgydF4y2Ba> 0.05,gydF4y2BaTgydF4y2Ba以及(图)。gydF4y2Ba6小时gydF4y2Ba)。最后,HFD-fedgydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠还显示出与脂肪性肝炎发展相关的胶原纤维编码基因表达增加的趋势gydF4y2Ba27gydF4y2Ba(补充图gydF4y2Ba4 fgydF4y2Ba),但这种效应与更高的纤维化无关(图。gydF4y2Ba6我gydF4y2Ba)。这些数据表明gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠对饮食引起的肥胖、肝脏脂肪变性和氧化应激更敏感。接下来,我们通过将注意力集中在几个因素上,研究了涉及脂肪变性发展的机制。肝脂肪变性可通过AEA水平升高而发生gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba28gydF4y2Ba以及高热量饮食时肝脏CB1过度活跃gydF4y2Ba28gydF4y2Ba。然而,肝脏gydF4y2BaCnr1gydF4y2BamRNA表达在所有条件下均未受影响(补充图gydF4y2Ba4 ggydF4y2Ba)。鉴于脂肪变性表型不能通过脂质合成或氧化的特定修饰来解释,我们研究了肠道和肝脏脂质吸收的几个标记物。我们发现了明显较高的表达gydF4y2BaFatp4gydF4y2Ba在肠道的近端gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba暴露于高热量食物的小鼠与WT高热量食物喂养的小鼠(图;gydF4y2Ba6 jgydF4y2Ba)。观察到类似的趋势gydF4y2BaCd36gydF4y2Ba和gydF4y2BaMttpgydF4y2Ba增加了25%gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba(图;gydF4y2Ba6 jgydF4y2Ba)。一致地,gydF4y2BaFatp4gydF4y2Ba和gydF4y2BaCd36gydF4y2Ba在肝脏中显著增加gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠(图。gydF4y2Ba6 kgydF4y2Ba)。为了扩展这一发现,我们分析了十二指肠脂肪代谢的其他标记物。由于肠道脂质吸收主要通过乳腺进行gydF4y2Ba29gydF4y2Ba,我们测量了乳酸标记物(gydF4y2BaFlt4gydF4y2Ba编码Vegfr3gydF4y2Ba, Dll4gydF4y2Ba,gydF4y2BaLyve1gydF4y2Ba),但在任何情况下都没有受到影响(图。gydF4y2Ba6 lgydF4y2Ba)。除了gydF4y2BaFatp4gydF4y2Ba和gydF4y2BaCd36gydF4y2Ba,我们还测量了十二指肠脂肪吸收和脂蛋白代谢的其他标志物。在这其中,gydF4y2BaFabp1, Ldlr, Apoa4gydF4y2Ba和gydF4y2BaApoegydF4y2BamRNA表达明显增加gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba与WT ND相比,HFD喂养小鼠,而与WT HFD相比,观察到一种趋势(图2)。gydF4y2Ba6 lgydF4y2Ba)。gydF4y2Ba
iec特异性Napepld加重饮食诱导的肝脏脂肪变性。gydF4y2Ba一个gydF4y2Ba肝脏重量(g)。gydF4y2BabgydF4y2Ba用重量法测定肝脏脂质含量(占肝脏重量的百分比)。gydF4y2BacgydF4y2Ba代表性肝油红O染色(比例尺:100µm)和平均脂滴大小(µm²,gydF4y2BangydF4y2Ba= 5 - 7)。gydF4y2BadgydF4y2Ba肝脏甘油三酯(nmol mggydF4y2Ba−1gydF4y2Ba)。gydF4y2BaegydF4y2Ba肝脏胆固醇(nmol mggydF4y2Ba−1gydF4y2Ba)。gydF4y2BafgydF4y2Ba肝脏硫代巴比妥酸反应物种(TBARS, pmol mg蛋白gydF4y2Ba−1gydF4y2Ba)。gydF4y2BaggydF4y2Ba测定腔静脉血浆丙氨酸转氨酶(ALT)活性(IU lgydF4y2Ba−1gydF4y2Ba) (gydF4y2BangydF4y2Ba= 6 - 8)。gydF4y2BahgydF4y2Ba测定腔静脉血浆天冬氨酸转氨酶(AST)活性gydF4y2Ba−1gydF4y2Ba) (gydF4y2BangydF4y2Ba= 6 - 8)。gydF4y2Ba我gydF4y2Ba用天狼星红染色进行组织纤维化分析,百分率为染色面积(gydF4y2BangydF4y2Ba= 7 - 8)。gydF4y2BajgydF4y2BamRNA表达gydF4y2BaFatp4gydF4y2Ba,gydF4y2BaMttpgydF4y2Ba,gydF4y2BaCd36gydF4y2Ba在十二指肠内(gydF4y2BangydF4y2Ba= 9 - 12)。gydF4y2BakgydF4y2BamRNA表达gydF4y2BaFatp4gydF4y2Ba,gydF4y2BaCd36gydF4y2Ba,gydF4y2BaMttpgydF4y2Ba在肝脏中(gydF4y2BangydF4y2Ba= 7 - 8)。gydF4y2BalgydF4y2BamRNA表达gydF4y2BaFlt4gydF4y2Ba,gydF4y2BaDll4gydF4y2Ba,gydF4y2BaLyve1, Fabp1gydF4y2Ba,gydF4y2BaNpc1l1gydF4y2Ba,gydF4y2BaLdlrgydF4y2Ba,gydF4y2Ba飞机观测gydF4y2Ba,gydF4y2BaApoa4gydF4y2Ba和gydF4y2BaApoegydF4y2Ba在十二指肠内(gydF4y2BangydF4y2Ba= 9 - 12)。gydF4y2Ba米gydF4y2Ba脂质负荷刺激后尾静脉血浆TG(脂质内20%乳剂300 μl) (mMol),插入:脂质负荷试验时TG水平演变曲线下面积(AUC) (gydF4y2BangydF4y2Ba= 7)。gydF4y2BangydF4y2Ba脂质负荷刺激(脂质内20%乳剂300 μl)后尾静脉血浆NEFA (mMol),插入:脂质负荷试验时NEFA水平演变曲线下面积(AUC) (gydF4y2BangydF4y2Ba= 7)。gydF4y2BaogydF4y2Ba腓肠肌TG含量(nmol mg组织gydF4y2Ba−1gydF4y2Ba) (gydF4y2BangydF4y2Ba= 7 - 8)。gydF4y2BangydF4y2Ba= 26-28gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba。数据gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba对应于三个独立实验的结果。深蓝色:WT ND小鼠,浅蓝色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaND小鼠,紫色:WT HFD小鼠,粉色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD老鼠。数据以均数±s.e.m表示。不同上标字母的数据有显著差异(gydF4y2BaPgydF4y2Ba< 0.05),根据常规的双因素方差分析,然后进行Tukey的事后检验。星号(*)表示与WT HFD有显著差异(gydF4y2BaPgydF4y2Ba< 0.05),采用双因素方差分析,然后进行Bonferroni事后检验gydF4y2Ba
证明…的假定含义gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba在脂质吸收方面,我们研究了急性口腔脂质负荷的影响。正如预期的那样,口服脂类药物增加了WT HFD和HFD的血浆甘油三酯水平gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba高热量膳食喂养小鼠。然而,gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠表现出明显更高的甘油三酯水平,这体现在脂质剖面(2小时后更高水平)和曲线下面积上(图。gydF4y2Ba6米gydF4y2Ba)。此外,NEFA的水平在土壤中呈快速下降趋势gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba高热量饮食小鼠比野生型高热量饮食小鼠(图。gydF4y2Ba6 ngydF4y2Ba),表明脂肪储存较多。除了较高的肝脏和脂肪组织脂肪储存外,我们还注意到肌肉中的甘油三酯异位沉积gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD喂养的小鼠,其脂肪含量比WT ND小鼠高2倍,脂肪含量比WT HFD小鼠高27%(图2)。gydF4y2Ba6 ogydF4y2Ba)。gydF4y2Ba
总之,我们的数据强烈表明,在肝脏和其他组织(即脂肪组织和肌肉)中观察到的脂质储存的增加可能是由这些器官吸收脂肪酸的能力增加所解释的。这些结果也与粪便中较低的能量排泄相一致gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD喂养的小鼠(图;gydF4y2Ba4 egydF4y2Ba)。gydF4y2Ba
NapepldgydF4y2Ba∆IECgydF4y2Ba不会影响hfd引起的脂肪炎症gydF4y2Ba
VAT质量的增加与促炎信号相关,这些信号将肥胖与胰岛素抵抗等代谢损伤联系起来gydF4y2Ba30.gydF4y2Ba。正如预期的那样,高热量饮食显著增加了所有炎症标志物的表达,如gydF4y2BaCd11cgydF4y2Ba(M1巨噬细胞标记),gydF4y2BaMcp1gydF4y2Ba(编码单核细胞趋化蛋白1),gydF4y2BaSerpin1gydF4y2Ba(编码纤溶酶原激活物抑制物-1,PAI-1)和gydF4y2Ba枸杞多糖gydF4y2Ba(编码脂多糖结合蛋白,LBPgydF4y2Ba5克ydF4y2Ba)。hfd组所有这些指标进一步提高了约25%gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba但该效应未达到显著性(补充图gydF4y2Ba5克ydF4y2Ba)。gydF4y2BaMcp1gydF4y2Ba在ND-fedgydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠的促炎作用增强gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba即使在没有HFD的情况下。gydF4y2Ba
NapepldgydF4y2Ba∆IECgydF4y2Ba不影响葡萄糖代谢gydF4y2Ba
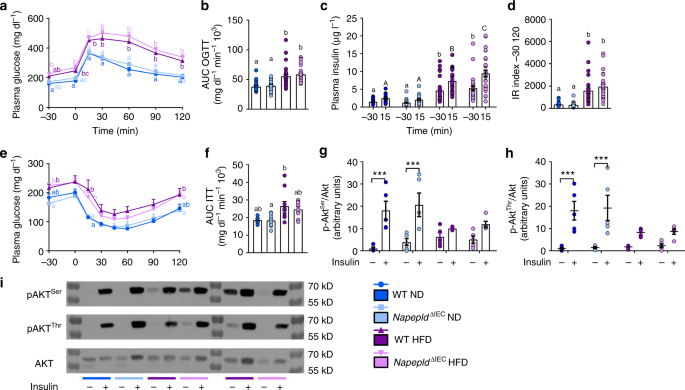
糖代谢主要受HFD影响,在口服糖耐量试验的所有时间点导致显著的高血糖和高胰岛素血症(图。gydF4y2Ba7得了gydF4y2Ba)。hfd喂养的葡萄糖挑战后15分钟,可以观察到胰岛素血症显著增加gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠(图。gydF4y2Ba7 cgydF4y2Ba)。胰岛素抵抗指数以高脂高脂喂养为主,高脂高脂喂养有升高的趋势gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba与WT型HFD小鼠相比(图;gydF4y2Ba7 dgydF4y2Ba)。观察到葡萄糖诱导的高胰岛素血症增加gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠促使我们用胰岛素耐量试验来验证胰岛素敏感性。正如预期的那样,HFD导致了显著的胰岛素抵抗,但这并没有加剧gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠(图。gydF4y2Ba7 e, fgydF4y2Ba)。最后,我们研究了门静脉注射胰岛素后肝脏胰岛素信号通路的激活情况。HFD强烈钝化肝脏p-Akt磷酸化gydF4y2Bathr308gydF4y2Ba和p-AktgydF4y2Baser473gydF4y2Ba显示肝脏存在大量胰岛素抵抗。然而,这一缺陷在gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠(图。gydF4y2Ba7胃肠道gydF4y2Ba)。gydF4y2Ba
iec特异性Napepld缺失不影响葡萄糖稳态。gydF4y2Ba一个gydF4y2Ba血糖谱(mg dlgydF4y2Ba−1gydF4y2Ba)在葡萄糖负荷前30分钟至后120分钟测量(gydF4y2BangydF4y2Ba= 26 - 28日期间)。gydF4y2BabgydF4y2Ba曲线下平均面积(AUC, mg dlgydF4y2Ba−1gydF4y2Ba最小值gydF4y2Ba−1gydF4y2Ba10gydF4y2Ba3 gydF4y2Ba)在葡萄糖负荷前30分钟至后120分钟测量(gydF4y2BangydF4y2Ba= 26 - 28日期间)。gydF4y2BacgydF4y2Ba血浆胰岛素水平(µg lgydF4y2Ba−1gydF4y2Ba)在葡萄糖负荷前30分钟及葡萄糖负荷后15分钟(gydF4y2BangydF4y2Ba= 26 - 28日期间)。gydF4y2BadgydF4y2Ba胰岛素抵抗指数由血糖的AUC乘以胰岛素的AUC (gydF4y2BangydF4y2Ba= 26 - 28日期间)。gydF4y2BaegydF4y2Ba血糖谱(mg dlgydF4y2Ba−1gydF4y2Ba)在注射胰岛素前30分钟至注射胰岛素后120分钟测量。gydF4y2BafgydF4y2Ba曲线下平均面积(AUC, mg dlgydF4y2Ba−1gydF4y2Ba最小值gydF4y2Ba−1gydF4y2Ba10gydF4y2Ba3 gydF4y2Ba)在注射胰岛素前30分钟至注射胰岛素后120分钟测量(gydF4y2BangydF4y2Ba第5 - 11 =)。gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba车体和胰岛素刺激的比例gydF4y2BaggydF4y2Bap-AktgydF4y2Baser473gydF4y2Ba和gydF4y2BahgydF4y2Bap-AktgydF4y2Bathr308gydF4y2Ba通过密度法测定总Akt。gydF4y2Ba我gydF4y2Ba代表性的western-blot检测肝脏p-AktgydF4y2Bathr308gydF4y2Ba, p-AktgydF4y2Baser473gydF4y2Ba,以及胰岛素刺激或不刺激时的Akt (gydF4y2BangydF4y2Ba= 9 - 11)。深蓝色:WT ND小鼠,浅蓝色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaND小鼠,紫色:WT HFD小鼠,粉色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD老鼠。数据gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba对应于三个独立实验的结果。数据以均数±s.e.m表示。不同上标字母的数据有显著差异(gydF4y2BaPgydF4y2Ba重复测量< 0.05),采用Tukey事后检验(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba)或常规的双向方差分析,然后是Tukey的事后检验(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba)。***表示与车辆注射组差异显著(gydF4y2BaPgydF4y2Ba< 0.001),根据双向方差分析,然后进行Sidak事后检验(gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba)gydF4y2Ba
上述结果均证实了肥胖表型的加重gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba在HFD条件下的小鼠不太可能与葡萄糖代谢的改变有关。然而,口服葡萄糖挑战后观察到的高胰岛素血症是一种现象,它本身至少部分地导致了较高的脂质储存gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba。gydF4y2Ba
NapepldgydF4y2Ba∆IECgydF4y2Ba改变肠道菌群gydF4y2Ba
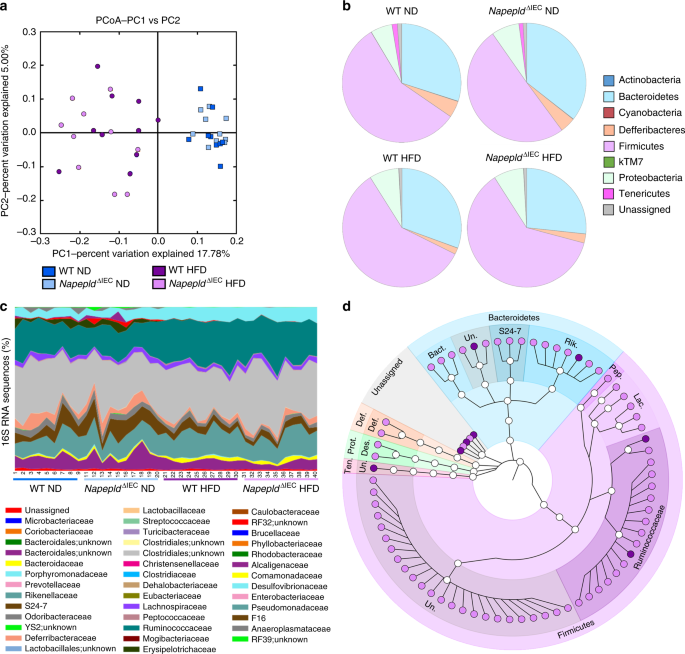
肠道ECS可以通过调节肠道菌群来调节能量稳态gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba33gydF4y2Ba。我们之前发现肠道菌群与ECS相互作用,并改变蛋白的表达gydF4y2BaCnr1gydF4y2Ba,gydF4y2BaCnr2gydF4y2Ba(编码CB2)和酶,包括gydF4y2BaNapepldgydF4y2Ba3 gydF4y2Ba在肠道里。相反,脂肪细胞特异性介导的ECS破坏gydF4y2BaNapepldgydF4y2Ba缺失改变肠道菌群组成,导致nd喂养小鼠肥胖gydF4y2Ba11gydF4y2Ba。因此,我们通过宏基因组学分析了小鼠的微生物群。正如预期的那样,主坐标分析(PCoA)显示,HFD极大地改变了肠道微生物群的组成,如图1轴上的移位所示(图2)。gydF4y2Ba8gydF4y2Ba)。与以往研究一致,HFD显著影响不同门的比例gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba。hfd喂养的小鼠Proteobacteria增加,Deferribacteres、Tenericutes和kTM7减少(图2)。gydF4y2Ba8 bgydF4y2Ba及补充表gydF4y2Ba1gydF4y2Ba)。15个细菌家族受到HFD的显著影响(图2)。gydF4y2Ba8 cgydF4y2Ba及补充表gydF4y2Ba2gydF4y2Ba)。在属水平上,HFD对19个细菌属进行了显著修饰gydF4y2Ba1gydF4y2Ba),根据Benjamini-Hochberg程序进行错误发现率(FDR)测试校正后,仍有11个细菌属受到显著影响。gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba在nd喂养的小鼠中,肠道菌群组成受到轻微影响(图。gydF4y2Ba8 cgydF4y2Ba及补充表格gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba及补充资料gydF4y2Ba1gydF4y2Ba)。我们没有发现hfd喂养的WT和gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba在门,类或属水平的小鼠(图;gydF4y2Ba8 cgydF4y2Ba及补充表格gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba及补充资料gydF4y2Ba1gydF4y2Ba)。然而,75个操作分类单位(OTUs)的相对丰度在hfd饲养之间存在显著差异gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠和WT小鼠,从而表明微生物群组成的强烈而具体的改变是由于gydF4y2BaNapepldgydF4y2Ba而不是由于高热量膳食本身(图。gydF4y2Ba8 dgydF4y2Ba)。gydF4y2Ba
IEC的影响gydF4y2BaNapepldgydF4y2Ba肠道菌群的缺失。gydF4y2Ba一个gydF4y2Ba基于UniFrac操作分类单元(OTUs)未加权分析的主坐标分析(PcoA)。代表单个样本的每个符号都根据其组进行着色。gydF4y2BabgydF4y2Ba在肠道菌群中发现的丰富细菌门的组成。gydF4y2BacgydF4y2Ba每个样品中不同细菌家族的相对丰度(16S rRNA基因序列的百分比)。gydF4y2BadgydF4y2BaHFD-fed的OTUs显著受影响gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠vs WT小鼠。从75个差异表达的OTUs中选取一个具有代表性的16S rRNA基因进行比对,并用于推断图中所示的系统发育树(gydF4y2BangydF4y2Ba=gydF4y2Ba9 - 10)。紫色:WT HFD小鼠,粉色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD老鼠。十个,Tenericutes; Prot., Proteobacteria; Def., Deferribacteres; Bact., Bacteroidaceae; Rik., Rikenellaceae; Pep., Peptococcaceae; Lac., Lachnospiraceae; Des., Desulfovibrionaceae; Def., Deferribacteraceae; Un., Unknown
NapepldgydF4y2Ba∆IECgydF4y2Ba不改变利益gydF4y2Ba答:muciniphilagydF4y2Ba
hfd喂养的代谢改变gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠与肠道菌群组成的变化有关。我们想知道是否针对肠道菌群gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠可以纠正它们的表型。我们和其他人之前已经证明了这一点gydF4y2Ba答:muciniphilagydF4y2Ba保护小鼠免受饮食引起的肥胖,甚至可以减少控制饮食喂养的小鼠的体重增加gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba。此外,gydF4y2Ba答:muciniphilagydF4y2Ba能在hfd喂养的小鼠中调节eCB和相关介质的肠道水平gydF4y2Ba36gydF4y2Ba。有趣的是,gydF4y2Ba答:muciniphilagydF4y2Ba治疗后回肠表达增加gydF4y2BaNapepldgydF4y2Ba和gydF4y2BaGpr119gydF4y2Ba编码一种由oea刺激的控制食欲的肠道肽激活的受体gydF4y2Ba5克ydF4y2Ba(无花果。gydF4y2Ba9gydF4y2Ba)。这表明NAPE-PLD及其产品可能参与了两者之间的对话gydF4y2Ba答:muciniphilagydF4y2Ba以及它的宿主。我们通过给hfd喂食细菌来验证这一假设gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba5周的小鼠。选择这个时间点是因为它足以观察到WT和gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠(图。gydF4y2Ba4 a、bgydF4y2Ba),以及的重大影响gydF4y2Ba答:muciniphilagydF4y2Ba在hfd喂养的小鼠中gydF4y2Ba34gydF4y2Ba。正如所料,gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba高热量膳食喂养5周后,小鼠的体重和脂肪量均高于野生型动物(图2)。gydF4y2Ba9罪犯gydF4y2Ba)。白色脂肪组织的重量也较高gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba尽管在所有条件下BAT的重量相似(图。gydF4y2Ba9 egydF4y2Ba)。gydF4y2Ba
的影响gydF4y2Ba答:muciniphilagydF4y2Ba在HFD-fedgydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠。gydF4y2Ba一个gydF4y2BamRNA表达gydF4y2BaNapepldgydF4y2Ba和gydF4y2BaGpr119gydF4y2Ba在nd喂养小鼠的回肠中gydF4y2Ba答:muciniphilagydF4y2Ba。gydF4y2BabgydF4y2Ba体重(g)超过5周。gydF4y2BacgydF4y2Ba5周后体重增加(g)。gydF4y2BadgydF4y2Ba脂肪量(g)超过5周。gydF4y2BaegydF4y2Ba不同白色脂肪组织库的重量与BAT (g)。gydF4y2BafgydF4y2Ba血糖谱(mg dlgydF4y2Ba−1gydF4y2Ba)在葡萄糖负荷前30分钟至后120分钟之间进行测量。gydF4y2BaggydF4y2Ba血浆胰岛素水平(µg lgydF4y2Ba−1gydF4y2Ba)在葡萄糖加载前30分钟和后15分钟。gydF4y2BahgydF4y2Ba胰岛素抵抗指数由血糖的AUC乘以胰岛素的AUC确定。gydF4y2Ba我gydF4y2Ba肝脏重量(g)。gydF4y2BajgydF4y2Ba用重量法测定肝脂含量(占肝脏重量的百分比)。gydF4y2BakgydF4y2Ba)肝脏甘油三酯(nmol mggydF4y2Ba−1gydF4y2Ba)。gydF4y2BalgydF4y2Ba肝脏胆固醇(nmol mggydF4y2Ba−1gydF4y2Ba)。gydF4y2Ba米gydF4y2Ba血浆非酯化脂肪酸(NEFA, mMol)为gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2Ba米gydF4y2Ba,gydF4y2BangydF4y2Ba= 8 - 10。gydF4y2BangydF4y2Ba第一周的食物摄入量(千卡,gydF4y2BangydF4y2Ba= 5)。另见附图gydF4y2Ba4 gydF4y2Ba。深蓝色:WT ND小鼠,绿色:WT ND小鼠gydF4y2Ba的样子gydF4y2Ba小鼠,紫色:野生型高热量小鼠,粉色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD小鼠和橙子:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFDgydF4y2Ba的样子gydF4y2Ba老鼠。数据以均数+ s.e.m表示。星号(*)表示与WT和ND (gydF4y2BaPgydF4y2Ba< 0.05)gydF4y2BatgydF4y2Ba以及。不同上标字母的数据有显著差异(gydF4y2BaPgydF4y2Ba< 0.05)根据单因素方差分析,然后进行Tukey事后检验(gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BahgydF4y2Ba- - - - - -gydF4y2BangydF4y2Ba)或重复测量双因素方差分析,然后进行Tukey事后检验(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba)gydF4y2Ba
答:muciniphilagydF4y2Ba治疗后体重和脂肪量显著降低gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠(图。gydF4y2Ba9中gydF4y2Ba)。在OGTT期间,它也倾向于降低高血糖和高胰岛素血症,导致胰岛素抵抗指数显著降低(图。gydF4y2Ba9 f-hgydF4y2Ba及补充数字gydF4y2Ba6gydF4y2Ba)。5周的治疗不足以引起肝脏重量的变化(图。gydF4y2Ba9我gydF4y2Ba),尽管hfd诱导的脂肪变性已经存在,并且在gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠(图。gydF4y2Ba9 jgydF4y2Ba)。这与甘油三酯含量显著升高有关,胆固醇也有类似的趋势。gydF4y2Ba9 k, lgydF4y2Ba)。gydF4y2Ba答:muciniphilagydF4y2Ba处理减少了hfd喂养的脂肪变性gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba肝脏脂质和胆固醇含量显著降低,甘油三酯也有类似趋势(图2)。gydF4y2Ba9 j-lgydF4y2Ba)。gydF4y2Ba答:muciniphilagydF4y2Ba管理也显著降低NEFA水平的HFD-fedgydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba与所有其他组相比(图;gydF4y2Ba9米gydF4y2Ba)。gydF4y2Ba答:muciniphilagydF4y2Ba纠正了在gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba在高热量膳食暴露的第一周内(图;gydF4y2Ba9 ngydF4y2Ba)。最后,gydF4y2Ba答:muciniphilagydF4y2Ba有没有影响回肠的表达gydF4y2BaNapepldgydF4y2Ba,gydF4y2BaGpr119gydF4y2Ba,gydF4y2BaCnr1gydF4y2Ba,gydF4y2BaPparagydF4y2Ba在gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Bahfd喂养的小鼠(补充图gydF4y2Ba6 bgydF4y2Ba)。总之,这些数据表明肠道NAE - pld,可能是其NAE产物,是不需要的保护作用gydF4y2Ba答:muciniphilagydF4y2Ba对抗肥胖和代谢综合症。gydF4y2Ba
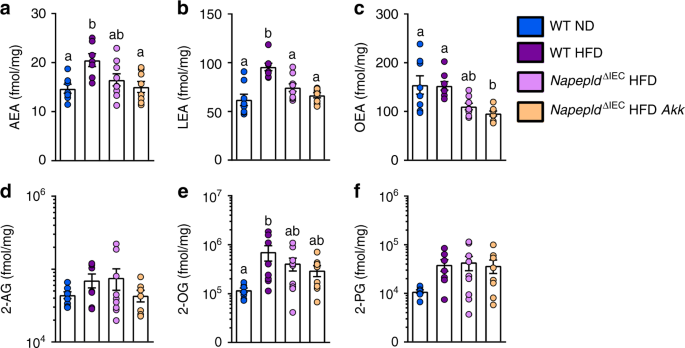
我们之前观察到gydF4y2Ba答:muciniphilagydF4y2Ba给药影响hfd喂养小鼠远端小肠中2-AG及其单酰甘油同源物2-OG和2-PG的水平gydF4y2Ba36gydF4y2Ba;然而,其对近端小肠的影响尚不清楚。在这里,我们发现5周的HFD,与上面4小时的HFD不同,显著增加了AEA和LEA,并倾向于增加空肠中的2-AG。与4小时HFD观察到的情况类似,2-OG和2-PG水平也增加了(图2-PG)。gydF4y2Ba10gydF4y2Ba)。相反,不出所料,gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD小鼠表现出某些NAE水平的降低(即LEA显著降低,OEA和AEA也有类似的趋势),而这种效果没有受到HFD治疗的显著影响gydF4y2Ba答:muciniphilagydF4y2Ba(无花果。gydF4y2Ba10gydF4y2Ba)。这一发现支持了肠道NAPE-PLD在高热量饮食期间肠道上部这些介质产生中的作用。有趣的是,用gydF4y2Ba答:muciniphilagydF4y2Ba的gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠gydF4y2Ba对2-AG和其他2-酰基甘油的水平没有显著影响,这与之前在WT HFD小鼠下呼吸道中观察到的情况不同(33)。gydF4y2Ba
的影响gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba和gydF4y2Ba答:muciniphilagydF4y2Ba空肠中生物活性脂质的水平。gydF4y2Ba一个gydF4y2Ba阿肯色州教育协会gydF4y2BabgydF4y2BaLEAgydF4y2BacgydF4y2BaOEA,gydF4y2BadgydF4y2Ba2-AG,gydF4y2BaegydF4y2Ba2-OG,gydF4y2BafgydF4y2Ba用岛津8050三重四极杆质谱计测定空肠中2-PG (fmol/mg)。gydF4y2BangydF4y2Ba= 7 - 9。深蓝色:WT ND小鼠,紫色:WT HFD小鼠,粉色:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD小鼠和橙子:gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFDgydF4y2Ba的样子gydF4y2Ba老鼠。数据以均数+ s.e.m表示。不同上标字母的数据有显著差异(gydF4y2BaPgydF4y2Ba根据单因素方差分析(one-way ANOVA)进行Tukey事后检验(post-hoc test)gydF4y2Ba
讨论gydF4y2Ba
我们的研究结果表明肠道gydF4y2BaNapepldgydF4y2Ba作为肠道-大脑轴中膳食脂肪的主传感器,导致hfd诱导的代谢障碍的发生。先前的报道表明,特定的NAE,如OEA或AEA,受到胃肠道中膳食脂类的影响gydF4y2Ba17gydF4y2Ba,gydF4y2Ba21gydF4y2Ba并将其水平的变化与食欲和饱腹感的调节联系起来。然而,这种变化的来源以及长期高热量膳食暴露的影响尚不清楚。gydF4y2Ba
这里显示的是肠上皮细胞gydF4y2BaNapepldgydF4y2Ba在第一次接触HFD时的食物摄入调节和最终能量稳态的长期调节中起着重要作用。此外,我们发现除了对食物摄入和脂肪量增加的影响,肠道gydF4y2BaNapepldgydF4y2Ba是预防hfd诱导的肝脏脂肪变性的关键酶。我们的数据表明,通过NAPE-PLD产生的肠道NAE调节能量的吸收、储存和消耗,而这一信号系统的破坏会导致肥胖和肝脏脂肪变性的发展。gydF4y2Ba
肠上皮细胞gydF4y2BaNapepldgydF4y2Ba这种缺失不会影响喂食标准饮食的小鼠。相反,as soon asgydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba当小鼠接触高能量密度的食物,如高热量食物时,它们调节食物摄入和长期能量稳态的能力下降。这一观察结果有力地表明,在控制食物摄入方面,肠道NAPE-PLD至少与特定的肠道激素一样重要。gydF4y2Ba
欧洲央行、AEA和其他非欧洲央行NAE的水平,部分取决于NAPE-PLD的活动gydF4y2Ba38gydF4y2Ba。相应地,我们发现AEA、OEA、PEA、SEA、LEA均有所下降,而与其他eCB相关的单酰基甘油没有变化,除了2-AG在Napepld空肠中也有所下降gydF4y2Ba∆IECgydF4y2Ba老鼠。这一发现令人惊讶,因为这种化合物不是由NAPE-PLD生物合成的。这种下降可能是由PEA的减少来解释的,在各种实验条件下,PEA被证明可以提高2-AG的水平gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba。为了调查其他生物活性脂质或前体是否受到影响gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠,我们进行了广泛的脂质组分析(补充表gydF4y2Ba5克ydF4y2Ba- - - - - -gydF4y2Ba10gydF4y2Ba)通过测量溶血磷脂酰乙醇胺、磷脂酰乙醇胺、溶血磷脂酰胆碱、溶血磷脂酰甘油、磷脂酰甘油、磷脂酰丝氨酸、磷脂酰胆碱、神经酰胺和鞘磷脂来测定。引人注目的是,除了高热量脂肪酸的特定影响外,这些脂类都没有受到高热量脂肪酸的影响gydF4y2BaNapepldgydF4y2Ba缺失,从而表明表型gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba由NAE水平的变化引起。此外,没有潜在的补偿机制涉及gydF4y2BaNaaa Faah MglgydF4y2Ba,或gydF4y2BaCnr1gydF4y2Ba在肠道中观察到gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠。gydF4y2Ba
已知高热量膳食暴露可诱导多种调节食物摄入和能量稳态的因素,如肠道激素(如胃饥饿素和GLP-1)和下丘脑神经递质(如gydF4y2BaPomc, Cart, Npy, AgrpgydF4y2Ba)gydF4y2Ba41gydF4y2Ba。在本研究中,我们排除了肠道肽的作用,因为ghrelin和GLP-1只受高热量膳食喂养的影响。然而,在gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠,gydF4y2BaPomcgydF4y2BaHFD暴露不诱导表达。此外,我们发现HFD喂养往往不会增加POMC的激活gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠。有趣的是,我们还发现gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠对hfd诱导的PVN神经元激活没有反应。这些数据表明gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠显示出肠道- arc - pvn神经元信号的改变。最后,HFD暴露也影响空肠和门脉血中的NAE水平gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba这表明肠道NAE参与了控制饮食脂肪摄入和调节下丘脑神经元。这一发现也表明,肠道NAE可以在短时间内调节下丘脑厌食神经元的活动。缺陷之间的联系gydF4y2BaPomcgydF4y2Ba调节和加剧了饮食诱发的肥胖gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠的结果与在近亲繁殖小鼠中得到的结果一致,其中调节异常gydF4y2BaPomcgydF4y2Ba表达是最早区分高热量膳食喂养易肥胖动物和抗肥胖动物的因素gydF4y2Ba23gydF4y2Ba。只在hfd喂养中观察到嗜食gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba第一周喂食的小鼠。尽管能源消耗没有变化,gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠已经显示出较低的粪便能量排泄和较高的脂肪吸收。总之,这些数据表明,脂肪量、肌肉脂肪含量和肝脏脂肪变性的增加可能至少部分是由脂肪酸潴留的增加所解释的。相反,尽管肠道和门脉血NAE都没有显著改变,但脂肪量和最终体重的持续增加可能是由于第二种机制,即能量消耗降低,这在高热量fd暴露16周后仍然观察到,以及褐变过程受损的趋势。这些数据与在小鼠中观察到的效果一致gydF4y2BaNapepldgydF4y2Ba在脂肪组织中,其特点是低能量消耗和脂肪组织的褐变gydF4y2Ba11gydF4y2Ba。gydF4y2Ba
根据我们的观察,补肠起着关键作用gydF4y2BaNapepldgydF4y2Ba之前的数据表明,脂肪摄入及其通过胃和近端小肠导致NAE的合成,从而调节两餐之间的食物摄入gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba。NAE的合成在gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠的这种微调被打乱了,这可能是它们嗜食症的原因。在长时间喂食高热量膳食后,观察到高热量膳食引起的能量消耗减少加剧gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠,可以解释随着时间的推移表型的维持。gydF4y2Ba
NapepldgydF4y2Ba在ND和hfd喂养的小鼠中,发现缺失会降低所有NAE的水平。然而,很容易推测HFD-fed观察到的表型gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠的死亡是由于PEA, LEA, SEA和/或OEA的变化,而不是AEA水平的变化,因为大多数这些NAE的肠道丰度高于AEA水平。此外,LEA和OEA可以激活抑制食物摄入和脂肪积累的靶点,而AEA则刺激相反的效果。这将与小肠中非ecb NAE水平降低而非升高与啮齿动物的贪食和肥胖相关的事实相一致gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba。gydF4y2Ba
除了体重和脂肪量增加,gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba会加剧hfd喂养小鼠的肝脏脂肪变性。短暂性的贪食gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠可能还不足以解释这种较高的脂质储存,而其他因素也在影响gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠很可能会参与其中。更具体地说,gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠在肠道和肝脏中吸收更多的脂质,而在粪便中排泄较少的能量。小鼠还会出现高胰岛素血症,这也会导致肝脏脂质储存gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba。脂肪生成酶的表达(gydF4y2BaFasn, Acaca, Scd1, Srebf1, Me1gydF4y2Ba)只在hfd喂养的情况下倾向于更高gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠,AMPK的磷酸化状态没有改变,而gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠肝脏和肠道脂质转运蛋白表达增加。这些结果进一步证实了口服脂质负荷,从而表明肠道gydF4y2BaNapepldgydF4y2Ba调节脂质吸收。肠道缺失gydF4y2BaNapepldgydF4y2Ba因此,不仅会导致肝脏脂肪变性,还会导致其他异位脂肪沉积(如肌肉)。尽管在脂肪变性过程中AEA和CB1表达水平升高gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba28gydF4y2Ba这表明肝脏CB1过度活跃在这一过程中发挥了作用gydF4y2Ba28gydF4y2Ba,我们没有发现任何变化gydF4y2BaCnr1gydF4y2Ba表达式,从而排除了这种潜在的作用机制。gydF4y2Ba
肠道菌群直接调节肠道ECSgydF4y2Ba11gydF4y2Ba,gydF4y2Ba44gydF4y2Ba。虽然所有的老鼠都是同窝的gydF4y2BaNapepldgydF4y2Ba在成年小鼠中诱导缺失,它仍然导致肠道菌群的特定变化gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠。在hfd喂养的WT和WT之间,一些OTUs有显著差异gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba这表明肠道NAE和肠道微生物之间存在潜在的串扰。这些变化是否有助于HFD-fed的表型gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba目前尚不清楚,应进一步研究。然而,肠道菌群的调节和特定细菌作为有益微生物的使用代表了代谢综合征管理的一种令人兴奋的策略gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba。gydF4y2Ba答:muciniphilagydF4y2Ba可以保护hfd喂养的小鼠免受肥胖和2型糖尿病的发展,并刺激2-酰基甘油的肠道生产gydF4y2Ba36gydF4y2Ba。虽然基因表达数据支持肠NAE - pld和NAE之间的相互作用gydF4y2Ba答:muciniphilagydF4y2Ba和它的宿主,我们在这里表明,这种细菌仍然部分地纠正了hfd诱导的嗜食症和肥胖gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠。这表明细菌的作用不依赖于IEC NAPE-PLD。我们之前说过gydF4y2Ba答:muciniphilagydF4y2Ba通过提高肠道内2-AG和2-酰基甘油水平(2OG和2PG),对代谢产生有益影响gydF4y2Ba36gydF4y2Ba益生菌的类似有益作用可能是由于NAE肠道水平的变化gydF4y2Ba3 gydF4y2Ba。因此,我们测量了用HFD和/或处理的小鼠空肠中的NAE和酰基甘油醇gydF4y2Ba答:muciniphilagydF4y2Ba(无花果。gydF4y2Ba10gydF4y2Ba)。我们的数据证实NAPE-PLD对几种NAE的合成是必需的,但不是近端肠内2-酰基甘油的合成。然而,2-酰基甘油不受该细菌的影响。后一项发现表明gydF4y2Ba答:muciniphilagydF4y2Ba对2-酰基甘油或局限于远端小肠gydF4y2Ba36gydF4y2Ba或者需要NAPE-PLD发生。在任何情况下,NAPE-PLD的事实似乎都不是必要的gydF4y2Ba答:muciniphilagydF4y2Ba我们的发现也证实了这种细菌的使用可以钝化hfd诱导的肝脏脂肪变性以及循环的NEFAgydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba小鼠,揭示了细菌对宿主代谢的新机制。可能有兴趣测量肝脏中的eCB和eCB样介质,以验证细菌或NAPE-PLD的存在是否会改变肝脏生物活性脂类化合物的特征。gydF4y2Ba
总之,我们的研究强调了肠道NAPE-PLD作为能量稳态的主要调节因子和膳食脂肪的代谢传感器。此外,我们的数据显示肠道NAE在代谢适应高脂饮食中的重要性。在缺乏NAPE-PLD的情况下,饮食引起的肥胖的严重程度随着脂肪组织和肝脏中脂肪积累的增加而更加明显。这与下丘脑调节食物摄入机制的改变有关,以应对膳食脂类和肠道菌群的变化。我们还展示了细菌gydF4y2Ba答:muciniphilagydF4y2Ba即使在没有iecnape - pld的情况下,也能有效对抗饮食引起的肥胖,这表明gydF4y2Ba答:muciniphilagydF4y2Ba在NAPE-PLD表达改变的肥胖患者中是否仍然是一种有趣的治疗工具gydF4y2Ba8gydF4y2Ba。最后,我们的研究结果揭示了肠道NAPE-PLD是调节肠道脂肪吸收、肝脏脂质沉积并最终控制下丘脑能量稳态的关键分子靶点。gydF4y2Ba
方法gydF4y2Ba
老鼠gydF4y2Ba
所有小鼠实验均由鲁文天主教大学卫生部门动物护理伦理委员会批准,由F Lemaigre教授和JP Dehoux教授监督,具体编号为2010/UCL/MD/022, 2014/UCL/MD/010, 2017/UCL/MD/005,根据当地伦理委员会的指导方针和2013年5月29日比利时关于保护实验动物的法律(协议编号为LA1230314)进行。小鼠数据以均数±s.e.m表示。每组分配的小鼠数量是基于之前的实验调查gydF4y2BaNapepldgydF4y2Ba饮食诱导肥胖的脂肪组织缺失gydF4y2Ba11gydF4y2Ba。在每次实验开始时,笼子被随机分配到实验组,以确保每组在体重和脂肪量方面是匹配的。没有进行盲法。gydF4y2Ba
排除标准预先定义如下:在随访期间表现出异常行为(例如,攻击性增加导致食物摄入量改变和/或体重减轻)的小鼠被排除在分析之外。在尸检和取样时仔细检查所有组织。任何显示病变的小鼠(例如,颗粒状肝脏)也被排除在外。最后,对于所有分析和每个组,任何排除决策都使用Grubbs检验来支持离群值检测。gydF4y2Ba
一代的gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba老鼠gydF4y2Ba
诱导性肠上皮gydF4y2BaNapepldgydF4y2Ba删除(gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba) C57Bl6/J小鼠是通过携带在绒毛启动子(villin Cre- ert2)控制下表达的依赖于他莫西芬的Cre重组酶的小鼠与携带agydF4y2BaloxPgydF4y2Ba在gydF4y2BaNapepldgydF4y2Ba等位基因gydF4y2Ba6克ydF4y2Ba,gydF4y2Ba22gydF4y2Ba。本研究中使用的所有小鼠都是在无特定病原体(SPF)动物设施中饲养的同窝小鼠。8周龄时腹腔内注射100 μ l他莫昔芬(10 mg ml)诱导缺失gydF4y2Ba−1gydF4y2Ba)连续五天。对照组小鼠(WT)在8周龄时腹腔内注射100 μ l载体(过滤葵花籽油加乙醇),连续注射5天。他莫昔芬是通过向100 mg他莫昔芬(他莫昔芬无碱,MP Biomedicals)中加入乙醇制备的,以获得100 mg mlgydF4y2Ba−1gydF4y2Ba他莫西芬悬浮液。A 10 mg mlgydF4y2Ba−1gydF4y2Ba加入过滤过的葵花籽油制备他莫昔芬溶液,超声处理30 min。10毫克毫升gydF4y2Ba−1gydF4y2Ba他莫昔芬溶液在4℃保存1周。使用前5分钟超声检查他莫西芬溶液。gydF4y2Ba
功能验证gydF4y2BaNapepldgydF4y2Ba删除gydF4y2Ba
9周大的WT或gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba雄性小鼠(17只,gydF4y2BangydF4y2Ba= 9 wt, 8gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba)成对地安置在特定的无病原体条件和受控环境(室温23±2℃,日光循环12小时)中,并自由获得无菌食品(辐照)和无菌水。给小鼠喂食ND (AIN93Mi;研究饮食)2周。gydF4y2Ba
ND和HFD条件下的表型gydF4y2Ba
三组独立的9周大WT或gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba雄性小鼠(第一组:40只小鼠,gydF4y2BangydF4y2Ba=每组10人;第二组:32只老鼠,gydF4y2BangydF4y2Ba= 8 /组;第三组:50只老鼠,gydF4y2BangydF4y2Ba=每组12人,除gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD与gydF4y2BangydF4y2Ba= 14)被成对地安置在特定的无病原体条件和受控环境(室温23±2°C,日光循环12小时)中,自由获得无菌食品(辐照)和无菌水。给小鼠喂食ND (AIN93Mi;研究饮食)或HFD(60%脂肪和20%碳水化合物(每100克千卡),D12492i,研究饮食)。每周记录体重、食物和水的摄入量。每周使用7.5 MHz时域-核磁共振(TD-NMR;LF50 minipec, Bruker)。治疗持续8周。每个队列在治疗7周后进行口服葡萄糖耐量试验。gydF4y2Ba
另一组9周大的WT或gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba雄性小鼠(42只,gydF4y2BangydF4y2Ba= 10 / nd -喂养组和gydF4y2BangydF4y2Ba在特定的无病原体条件下,在受控环境(室温23±2°C,日光循环12小时)中,每组为11只)被关在成对或三只笼子中,并自由获得无菌食物(辐照)和无菌水。该队列与上述队列随访8周。治疗7周后进行胰岛素耐量试验。gydF4y2Ba
在早期高热量膳食暴露期间的食物摄入量的个体测量gydF4y2Ba
一组9周大的WT或gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba雄性小鼠(40只,gydF4y2BangydF4y2Ba如上所述,每组= 10只)随访8周,并进行了以下修改:删除诱导后,20只小鼠(10只WT和10只gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba)被单独安置,并免费获得ND消毒食品(辐照)和无菌水。在10周大时,小鼠被放置在代谢室(Labmaster, TSE Systems GmbH, Bad Homburg, Germany)中,以单独测量食物摄入量。在接下来的8周,小鼠被喂食HFD(60%脂肪和20%碳水化合物(每100克千卡),D12492(研究饮食)。在最后一周的随访中,一组小鼠再次被放置在代谢室中,以监测个体的食物摄入量。gydF4y2Ba
短期HFD暴露gydF4y2Ba
两组10周大的小波或gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba雄性小鼠(共67只,gydF4y2BangydF4y2Ba每组= 16-17只)在特定的无病原体条件下和受控环境(室温23±2℃,日光循环12小时)中单独安置一周,并免费获得ND无菌食品(辐照)和无菌水。然后,他们被分成四个体重匹配的组,在组织采集之前,要么禁食20小时(禁食),要么禁食16小时,然后暴露于高热量饮食4小时(高热量饮食)。gydF4y2Ba
断食与复食实验gydF4y2Ba
另一组WT和gydF4y2BaNapepldgydF4y2BaΔIECgydF4y2Ba雄性小鼠(42只,gydF4y2BangydF4y2BaWT组= 10只,KO组为11只)被成对地安置在特定的无病原体条件和受控环境(室温23±2℃,日光循环12小时)中,免费获得无菌ND(辐照)和无菌水,直到试验结束的那一天。动物在黑暗期禁食一晚(ON),第二天早上再次喂食ND或HFD 1小时。动物分别用氯胺酮-木lazine IP注射(分别为100 mg/ml和20 mg/ml)麻醉,然后先用冷磷酸盐缓冲盐水(PBS)溶液经心灌注,冷后用4% (w/v)多聚甲醛(PFA)灌注。仔细收集整个大脑,在4°C的4% PFA ON中固定,在4°C的30%蔗糖(w/v)溶液中冷冻保护ON,随后在冷异戊烷中冷冻,并在−80°C保存。gydF4y2Ba
脂质负荷实验gydF4y2Ba
一组新的小鼠(42只小鼠,gydF4y2BangydF4y2Ba= 10 WT ND,gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaND和WT HFD组和gydF4y2BangydF4y2Ba= 12gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2BaHFD)用于研究口服脂质挑战后的脂质吸收情况。HFD暴露7周后进行口服脂质动态测试。夜间禁食动物灌胃脂内20%乳剂(Sigma) 300 μl;在给药前及给药后1、2、3、4、6 h从尾静脉抽取外周血。使用肝化管进行采样。血浆储存在−80°C。gydF4y2Ba
能量消耗的长期表型和评估gydF4y2Ba
一组10周大的WT或gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba雄性小鼠(40只,gydF4y2BangydF4y2Ba=每组10只)成对地安置在特定的无病原体条件下,并在受控环境(室温23±2℃,日光循环12小时)中,自由获得食物和水。给小鼠喂食ND (AIN93Mi;研究饮食)或HFD(60%脂肪和20%碳水化合物(每100克千卡),D12492i,研究饮食)。治疗持续16周。每周记录体重、食物和水的摄入量。每周使用7.5 MHz时域-核磁共振(TD-NMR;LF50 minipec, Bruker)。在15周的随访后,一组小鼠被置于代谢室进行间接量热测量。gydF4y2Ba
粪便能量含量gydF4y2Ba
在治疗的最后一周,使用炸弹量热计(Staufen, Germany)对24小时后收集的粪便样本进行粪便能量测量。gydF4y2Ba
Napepld的治疗gydF4y2Ba∆IECgydF4y2Ba老鼠gydF4y2BaAkkermansia muciniphilagydF4y2Ba
数据详见补充图gydF4y2Ba3 gydF4y2Ba来自Everard等人研究的一组代谢特征小鼠。gydF4y2Ba36gydF4y2Ba。一组10周大的WT或gydF4y2BaNapepldgydF4y2Ba∆IECgydF4y2Ba雄性小鼠(40只,gydF4y2BangydF4y2Ba=每组10只)成对地安置在特定的无病原体条件下和受控环境(室温23±2℃,日光循环12小时)中,自由获得食物和水。给小鼠喂食ND (AIN93Mi;研究饮食)或HFD(60%脂肪和20%碳水化合物(每100克千卡),D12492i,研究饮食),并每天口服2.10gydF4y2Ba8gydF4y2BaCFU的gydF4y2BaAkkermansia muciniphilagydF4y2Ba在150µl含2.5%甘油的无菌PBS(培养条件如下所述)或150µl载液(含2.5%甘油的PBS)中。每周记录体重、食物和水的摄入量。每周使用7.5 MHz时域-核磁共振(TD-NMR;LF50 minipec, Bruker)。治疗持续5周。治疗4周后进行口服葡萄糖耐量试验。gydF4y2Ba
口服糖耐量试验gydF4y2Ba
治疗7周后,6只禁食h的小鼠给予口服葡萄糖负荷(每公斤体重2克葡萄糖),并在口服葡萄糖负荷前和15、30、60、90和120分钟后测量血糖水平。在尾静脉尖端用标准血糖仪(Accu Check, Roche, Basel, Switzerland)测量血糖。分别于口服葡萄糖负荷前30min和口服葡萄糖负荷后15min在肝素化管中采集尾静脉尖部血浆,测定胰岛素浓度。gydF4y2Ba
胰岛素抵抗指数gydF4y2Ba
根据制造商说明,使用超灵敏小鼠胰岛素ELISA试剂盒(Mercodia, Uppsala, Sweden)测定样品的血浆胰岛素浓度。胰岛素抵抗指数通过乘以口服糖耐量试验后获得的血糖(- 30 ~ 120 min)和血浆胰岛素(- 30和15 min)曲线下的面积来确定。gydF4y2Ba
胰岛素耐量试验gydF4y2Ba
治疗7周后,6只空腹小鼠腹腔注射胰岛素(每公斤体重0.5 U)。在胰岛素注射前和注射后15、30、45、60、90和120分钟,用标准血糖仪(Accu Check, Roche, Basel, Switzerland)测量血糖水平。gydF4y2Ba
组织抽样gydF4y2Ba
在治疗期结束时,小鼠在禁食6小时后用异氟醚(forrene, Abbott, Queenborough, Kent, England)麻醉。从门静脉和腔静脉中抽取血液。放血后采用颈椎脱位法处死小鼠。精确地解剖组织,称重,立即浸入液氮中,然后在−80°C保存,以便进一步分析。gydF4y2Ba
为了分析接受胰岛素耐量试验的队列中的胰岛素信号通路,小鼠被分配到盐水注射亚组或胰岛素注射亚组,以便两个亚组在体重和脂肪量方面匹配。然后给予1 mU胰岛素/g体重(Actrapid;Novo Nordisk A/S,丹麦)在异氟醚(forrene, Abbott,英国)麻醉下,或等量生理盐水溶液注入门静脉。注射3分钟后,处死小鼠,取肝。gydF4y2Ba
的文化gydF4y2BaAkkermansia muciniphilagydF4y2Ba
答:muciniphilagydF4y2BaMucT (ATTC BAA-835)在基础粘蛋白培养基中厌氧培养gydF4y2Ba47gydF4y2Ba用16克/升大豆蛋白胨、4克/升苏氨酸和葡萄糖和gydF4y2BaNgydF4y2Ba-乙酰氨基葡萄糖(每个25毫米)gydF4y2Ba37gydF4y2Ba。在严格的厌氧条件下,在含25% (vol/vol)甘油的厌氧PBS中清洗和浓缩培养物。培养物立即冷冻并在- 80°C保存。有代表性的甘油在厌氧条件下解冻,使用含有1%琼脂糖(琼脂贵族,Difco)的粘蛋白补充BHI培养基进行平板计数,以确定CFU/ml。在口服灌胃给药前,甘油储存在厌氧条件下解冻,并用厌氧PBS稀释至2 × 10gydF4y2Ba8gydF4y2BaCFU/150 μ l和2.5%甘油。gydF4y2Ba
RNA制备及实时qPCR分析gydF4y2Ba
使用TriPure试剂(Roche)从组织中制备总RNA。通过Agilent 2100生物分析仪(Agilent RNA 6000 Nano Kit, Agilent, Santa Clara, California, USA)对每个样品1 μl进行总RNA的定量和完整性分析。cDNA通过逆转录系统试剂盒(Promega, Madison, Wisconsin, USA)对1 μg总RNA进行逆转录制备。采用CFX96实时PCR系统和CFX Manager 3.1软件(Bio-Rad, Hercules, California, USA)进行实时PCR,采用Mesa Fast qPCR (Eurogentec, Liège, Belgium),按照制造商说明书进行检测。gydF4y2BaRpl19gydF4y2BaRNA被选为管家基因。所有样品一式两份,数据按2gydF4y2Ba−ΔΔCTgydF4y2Ba方法。扩增结束时通过熔点曲线分析,鉴定扩增产物的纯度。目标小鼠基因引物序列见补充表gydF4y2Ba3 gydF4y2Ba。gydF4y2Ba
免疫印迹分析gydF4y2Ba
为了检测NAPE-PLD,组织用TissueLyser II (Qiagen)在RIPA缓冲液中均质,并辅以蛋白酶抑制剂和磷酸酶抑制剂(Sigma)。等量的蛋白质通过SDS-PAGE分离并转移到硝化纤维膜上。膜在4°C下孵育过夜,抗NAPE-PLD和β-肌动蛋白的抗体在含有1%脱脂干牛奶的tris缓冲盐水tween-20中稀释。gydF4y2Ba
为了检测Akt, AMPK及其磷酸化形式,组织在ERK缓冲液(Triton X-100 0.1%, HEPES 50 mM, NaCl 5 M, Glycerol 10%, MgCl)中均质gydF4y2Ba2gydF4y2Ba1.5 mM和DTT 1 mM)补充了蛋白酶抑制剂和磷酸酶抑制剂的鸡尾酒。等量的蛋白质通过SDS-PAGE分离并转移到硝化纤维膜上。膜与抗总Akt, p-Akt抗体在4°C孵育过夜gydF4y2BaThr308gydF4y2Ba和p-AktgydF4y2BaSer473gydF4y2Ba或AMPK和p-AMPKgydF4y2BaThr172gydF4y2Ba稀释于含有1%脱脂干牛奶或1%牛血清白蛋白的tris缓冲盐水tween-20中。gydF4y2Ba
揭示是使用化学发光衬底(SuperSignalgydF4y2Ba®gydF4y2BaWest Pico (ThermoScientific)和Amersham Image600 (GE Healthcare)。采用ImageQuanTL软件进行密度分析。gydF4y2Ba
有关所有抗体的信息可在补充表中找到gydF4y2Ba4 gydF4y2Ba。gydF4y2Ba
未裁剪的印迹图可作为补充图gydF4y2Ba7gydF4y2Ba- - - - - -gydF4y2Ba9gydF4y2Ba。gydF4y2Ba
脑组织学gydF4y2Ba
20微米厚的连续冠状冷冻切片安装在SuperFrost Plus载玻片上(Menzel Gläser),并保持在−20°C。对于弓状核,我们根据小鼠大脑的立体定向坐标(Paxinos, Franklin),从- 1.22 mm到- 2.54 mm,每只动物采集了大约10个连续切片;对于室旁核,每只动物6个节段,从- 0.58 mm到- 1.22 mm。gydF4y2Ba
对于PVN中的c-Fos免疫组化,加热抗原(Dako S1699)后(2100 antigen Retriever,来自AptumgydF4y2Ba)gydF4y2Ba在含H的MeOH溶液中,内源性过氧化物酶被抑制gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba0.1% (v / v)gydF4y2Ba。gydF4y2Ba切片在封闭溶液(TBS, BSA 5%, Tween20 0.1%)中RT孵育45分钟,然后在RT中与一级抗-c- fos (1/2000, ab190289来自Abcam)孵育ON。清洗后,切片在RT下用二抗(Envision Kit, Dako K4010)孵育1小时;二氨基联苯胺介导的显色检测是按照制造商的说明开发的(Envision试剂盒,Dako K4010)。玻片被脱水并覆盖。gydF4y2Ba
使用徕卡扫描仪(Leica SCN400)获得PVN的亮场图像。盲后程序,使用斐济软件gydF4y2Ba48gydF4y2Ba感兴趣区域(ROI)对应于PVN在每个部分上以立体定向坐标下的小鼠大脑(Paxinos, Franklin)作为参考。人工计数每个ROI内的c- fos阳性神经元,并获得每只动物的平均值(考虑每只动物至少有三个脑区)。gydF4y2Ba
采用tyramide信号放大(TSA)技术对ARC进行双免疫荧光c-Fos/POMC检测。在抗原提取、内源性过氧化物酶抑制和阻断(如上所述)后,将切片与兔抗c- fos (1/10,000, ab190289来自Abcam)孵育ON。切片用酶标二抗(DAKO K4003)在RT下孵育1小时。荧光信号根据制造商的协议使用TSA Cyanine 5系统(TSA Plus Fluorescence Kit, PerkinElmer)进行扩增。根据TSA程序,在抗原回收液中热处理去除一抗和二抗。该步骤不影响荧光信号gydF4y2Ba49gydF4y2Ba。阻断后切片用兔抗pomc一抗(1/1000,ab94446来自Abcam)孵育,再用酶标二抗(DAKO K4003)孵育。根据制造商的说明,用FITC-tyramide (TSA荧光系统,PerkinElmer)进行染色。最后,所有切片用Hoechst33342反染色,使用TrueBlack(来自Biotium)抑制自荧光。考虑到两种一抗都是在家兔体内产生的,为验证无交叉反应性,进行了所有适当的对照。更详细地说,在脑切片与初级兔抗c- fos孵卵后,荧光信号是根据上述方案使用5-氰胺产生的。热处理后切片用抗兔二抗和FITC-tyramide孵育。切片上未观察到FITC信号。gydF4y2Ba
采用Pannoramic P250滑动扫描仪对ARC中c-Fos和POMC进行定量。c-Fos和pomc表达神经元在多重染色冷冻切片上使用软件应用程序(APP)进行量化,使用图像分析工具Author version 2017.2 (Visiopharm, Hørsholm,丹麦)。Brightfield扫描(组织蓝色反染)和荧光扫描(c-Fos/POMC/Hoechst33342)首先使用Visiopharm公司的Tissuealign插件进行对齐。感兴趣的区域(ROI)然后在明场扫描上手动描绘,并自动应用于对齐的荧光扫描。在这些roi中,根据Hoechst核染色将细胞核分割,并根据其c-Fos和POMC的表达分为四类(阴性、每个标记物单染、双染)。最后使用计数帧对检测到的细胞进行量化,以避免重复计数。相同的APP应用于所有的部分。结果用ROI内双染色神经元c-Fos/POMC的数量除以总c-Fos阳性神经元的数量来表示。每只动物都有一个平均值。gydF4y2Ba
定量肠道eCB和eCB样水平gydF4y2Ba
数据见图。gydF4y2Ba1gydF4y2Ba得到与肠上皮细胞相对应的肠上皮细胞如下:文献中所述的分离肠上皮细胞。gydF4y2Ba35gydF4y2Ba并在CHCl中均质gydF4y2Ba3 gydF4y2Ba(10 ml),加入氘标准品(200 pmol)。甲醇(5ml)和HgydF4y2Ba2gydF4y2Ba加入O (2.5 ml),然后通过剧烈混合提取脂质。离心后,有机层被回收,在氮流下干燥gydF4y2Ba2gydF4y2Ba并用二氧化硅固相萃取纯化,然后用乙酸乙酯-丙酮(1:1)溶液洗脱。使用LTQ Orbitrap质谱仪(ThermoFisher Scientific)耦合Accela HPLC系统(ThermoFisher Scientific)对所得的脂质部分进行高效液相色谱-质谱分析。分析物分离使用C-18 Kinetex C-18色谱柱(5 mm, 4.6 × 150 mm;Phenomenex)和C18预柱。流动相A和B由MeOH/H组成gydF4y2Ba2gydF4y2BaO/乙酸75:25:10 .1 (v/v/v)和MeOH/乙酸100:0.1 (v/v)。梯度(0.5 ml mingydF4y2Ba−1gydF4y2Ba)设计如下:在15分钟内从100% A线性过渡到100% B,然后在100% B处线性过渡10分钟,然后在100% A处重新平衡。我们用APCI电离源在正模式下进行质谱分析。毛细管和APCI蒸发器温度分别设置为250°C和400°C。使用各自的氘化标准(显示相同的保留时间)用同位素稀释对eCBs进行定量。按照描述生成校准曲线,数据归一化至WT组的平均eCB含量/组织重量gydF4y2Ba3 gydF4y2Ba。gydF4y2Ba
内源性大麻素的LC-MS/MS分析gydF4y2Ba
数据如图所示。gydF4y2Ba3 gydF4y2Ba,gydF4y2Ba10gydF4y2Ba及补充数字gydF4y2Ba3 gydF4y2Ba冷冻(−196℃)空肠样品(~10 mg)用一次性组织研磨机粉碎,用500µl PBS收集,立即与500µl甲醇含5ng氘化标准液混合(见表),旋涡60 s,然后在室温下搅拌90 min,使蛋白质完全变性。样品离心(20000 ×gydF4y2BaggydF4y2Ba;10分钟,室温)。收集上清液,用酸化水(0.05醋酸)将其甲醇含量调整至10%。然后使用固相萃取墨盒(Strata-X Polymeric inverse phase, 60 mg/1 ml, Phenomenex)从样品中提取脂类。简单地说,墨盒用2毫升酸化甲醇(0.05%乙酸)清洗,然后用2毫升酸化水(0.05%乙酸)清洗。样品装入药筒,用2 ml酸化水冲洗药筒,用1 ml酸化甲醇洗脱脂质。洗脱液在氮气流下干燥,在50µl的流动相(50% B)中重建。不同化合物的回收率平均为50%±7%(平均值±sem), 2-棕榈酰甘油最低(35.2±4.9),epa -2-甘油最高(71.5±4.5)40µl样品注入高效液相色谱柱(Kinetex C8, 150 × 2.1 mm, 2.6 μm,以流速为400 μl/min的溶剂a (1mm醋酸铵+ 0.05%乙酸)和溶剂B(乙腈/水;95/5 + 1mm醋酸铵+ 0.05醋酸)。梯度为:0 ~ 2min为15 ~ 35% B, 2 ~ 12min为35 ~ 75% B, 12 ~ 12.1 min为75 ~ 95% B,直至17min为95% B。 The HPLC system was interfaced with the electrospray source of a Shimadzu 8050 triple quadrupole mass spectrometer and mass spectrometric analysis was done in the positive ion mode using multiple reaction monitoring using the specific mass transitions shown in Supplementary Table11gydF4y2Ba。gydF4y2Ba
空肠脂质组学分析gydF4y2Ba
数据详见补充表格gydF4y2Ba5克ydF4y2Ba- - - - - -gydF4y2Ba10gydF4y2Ba通过与Biocrates(奥地利因斯布鲁克)合作使用脂质组学获得。采用高通量流动注射ESI-MS/MS筛选方法定量分析了(溶索-)甘油磷脂生物学上最丰富的成员,即(溶索-)甘油-磷胆碱、甘油-乙醇胺、甘油-丝氨酸、甘油-甘油,以及鞘磷脂,即鞘磷脂、神经酰胺、二氢神经酰胺和2-羟酰神经酰胺。采用AB SCIEX 4000 QTrap®串联质谱仪(AB SCIEX,达姆施塔特,德国)在阳性和阴性模式下进行MRM检测。样品体积为20 μl,样品制备遵循MeOH/ chcl3 -液体/液体萃取工艺。5个内部标准用于补偿基质效应,43个外部标准用于多点校准。定量数据分析使用Biocrates内部软件MetIDQ™进行,可以进行同位素校正。gydF4y2Ba
提取肝脂gydF4y2Ba
用CHCl3:MeOH提取后测定肝组织总脂质gydF4y2Ba50gydF4y2Ba并适应如下:简单地说,100毫克肝组织均质于2毫升CHClgydF4y2Ba3 gydF4y2Ba:MeOH(2:1),使用组织裂解器,然后使用超声波均质器。加入400微升0.9%的NaCl溶液,然后通过剧烈摇晃提取脂质。离心后,氯仿相在玻璃管中回收,在N流下干燥gydF4y2Ba2gydF4y2Ba。在脂质提取前后称重玻璃管,定量总脂质含量。根据脂质含量,将干燥残渣溶于1.5 - 3ml异丙醇中。gydF4y2Ba
生化分析gydF4y2Ba
血浆非酯化脂肪酸(NEFA)、肝脏、血浆胆固醇和甘油三酯浓度根据制造商说明书使用酶促反应耦合分光光度法检测反应最终产物(Diasys diagnostics and Systems, Holzheim, Germany)的试剂盒进行测量。gydF4y2Ba
血浆丙氨酸-氨基转移酶(ALT)和天冬氨酸-氨基转移酶(AST)活性根据制造商说明书使用偶联酶活性与NADH+H+依赖的酶反应和NADH+H+转化为NAD+的分光光度检测试剂盒进行测量(Diasys诊断系统,Holzheim, Germany)。gydF4y2Ba
使用Bio-Plex Pro Assays试剂盒(Bio-Rad, Nazareth, Belgium)测定Portal GLP-1和ghrelin,并使用Luminex (Bio-Rad Bioplex;Bio-Rad)根据制造商的说明。通过测量脂质过氧化和活性化合物如丙二醛(MDA)和4-羟基壬烯醛(脂质过氧化的天然副产物)来评估肝脏氧化应激水平。简单地说,50 mg组织在0.9%的低温NaCl中均质,浓度为100 mg组织/ml。使用100 μ l匀浆的三等份进行测量。每个匀浆中加入750微升1% H3PO4。将250微升TBA 0.6%添加到三种匀浆中的两种中,而将250微升水添加到第三种空白测量中。样品和空白在95°C下孵育1小时,然后放入冰中。12.5 μ l HCl 1 N和1 mlgydF4y2BaNgydF4y2Ba在每个试管中加入-丁醇,然后通过剧烈混合提取脂质,然后在3000 ×下离心20分钟gydF4y2BaggydF4y2Ba4°C。样品中由于丙二醛与硫代巴比妥酸反应而形成的加合物,根据制造商的说明,使用Spectramax M2仪器(分子装置)分光光度法测量。TBARS水平由MDA当量标准测定。以牛血清白蛋白为标准,用Bradford法测定蛋白质浓度。gydF4y2Ba
从小鼠盲肠样本中提取DNA进行测序gydF4y2Ba
收集盲肠内容物并在−80°C冷冻保存直到使用。根据制造商的说明书进行修改,使用QIAamp DNA Stool Mini Kit (Qiagen, Hilden, Germany)从盲肠内容物中提取宏基因组DNAgydF4y2Ba34gydF4y2Ba。gydF4y2Ba
细菌DNA测序gydF4y2Ba
使用条形码引物27f (5 ' - cctatcccctgtgccttggcagtctag -3 ')和534r (5 ' -ATTACCGCGGCTGCTGG-3 ')扩增了细菌16S rRNA基因的V1-V3区域,并在Roche FLX基因组测序仪上使用钛化学(DNAVision)分析了纯化扩增物的高通量测序。读取结果通过QIIME v1.9.0管道进行处理。使用uclust共识分类器识别OTUs,阈值为0.97,对照Greengenes数据库(图2)。gydF4y2Ba5氟gydF4y2Ba)或使用mother(补充表格gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba2gydF4y2Ba及补充资料gydF4y2Ba1gydF4y2Ba)。主坐标分析采用非加权UniFrac距离计算。系统发育树用QIIME 1.9.0软件生成,用GraPhIAn软件可视化gydF4y2Ba51gydF4y2Ba。支持本研究结果的序列数据已存入序列阅读档案(SRA)数据库,登录代码为PRJNA508476 (gydF4y2Bahttp://www.ncbi.nlm.nih.gov/sra/PRJNA508476gydF4y2Ba)。gydF4y2Ba
油红O染色法分析肝脏脂质含量gydF4y2Ba
将肝组织嵌入tissue - tek最佳切割温度化合物(Sakura Europe, Leiden, Netherlands)中,并在冷异戊烷中快速冷冻。5个微米蜱组织切片用油红O染色进行脂质含量分析。每只小鼠分析5个高倍场(20倍)。使用ImageJ软件(Version 1.50a,美国国立卫生研究院,Bethesda, Maryland, USA)对平均液滴面积进行量化。gydF4y2Ba
天狼星红染色分析纤维化gydF4y2Ba
用0.1%天狼星红(Sigma-Aldrich)染色石蜡切片,观察肝脏胶原蛋白含量。为每只小鼠随机选择至少5个高倍放大场。图像使用SCN400滑动扫描仪和数字图像中心软件(徕卡生物系统公司,Wetzlar,德国)获得。所有分析均由研究者以盲法进行,并使用ImageJ软件中的半自动脚本进行量化(版本1.50a,美国马里兰州贝塞斯达国立卫生研究院)。胶原蛋白含量以染色面积占组织总切片面积的百分比进行量化。gydF4y2Ba
统计分析gydF4y2Ba
除上述微生物区系分析外,使用GraphPad Prism version 7.00 for Windows (GraphPad Software, San Diego, CA, USA)进行统计分析。如果组间方差有显著差异,则在进行分析之前对值进行对数变换归一化。在归一化后两组间方差仍有显著差异的情况下,进行非参数检验。不同与gydF4y2BaPgydF4y2Ba值< 0.05为显著。gydF4y2Ba
报告总结gydF4y2Ba
实验设计的进一步信息可在gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到本文。gydF4y2Ba
数据可用性gydF4y2Ba
所有脂质组数据作为补充资料(补充表)包含在本文中gydF4y2Ba5克ydF4y2Ba- - - - - -gydF4y2Ba10gydF4y2Ba)。所有剩余数据将由通讯作者在合理要求下提供。gydF4y2Ba
参考文献gydF4y2Ba
NCD-RisC。1975年至2014年200个国家成人体重指数的趋势:对1698项基于人口的测量研究进行汇总分析,共有1920万参与者。gydF4y2Ba《柳叶刀》gydF4y2Ba387gydF4y2Ba, 1377-1396(2016)。gydF4y2Ba
Gatta-Cherifi, B. & Cota, D.关于内源性大麻素系统在调节能量平衡中的作用的新见解。gydF4y2BaInt。j . ob。gydF4y2Ba40gydF4y2Ba, 210-219(2016)。gydF4y2Ba
穆奇奥利,G. G.等。内源性大麻素系统将肠道微生物群与脂肪形成联系起来。gydF4y2Ba摩尔。系统。医学杂志。gydF4y2Ba6克ydF4y2Ba, 392(2010)。gydF4y2Ba
傅,J.等。油乙醇酰胺通过激活核受体ppar - α调节摄食和体重。gydF4y2Ba自然gydF4y2Ba425gydF4y2Ba, 90-93(2003)。gydF4y2Ba
Lauffer, L. M., Iakoubov, R. & Brubaker, P. L. GPR119对于油乙醇酰胺诱导的肠内分泌l细胞分泌胰高血糖素样肽-1至关重要。gydF4y2Ba糖尿病gydF4y2Ba58gydF4y2Ba, 1058-1066(2009)。gydF4y2Ba
刘,J.等。涉及anandamide生物合成的多种途径。gydF4y2Ba神经药理学gydF4y2Ba54gydF4y2Ba, 1-7(2008)。gydF4y2Ba
Tourino, C., Oveisi, F., Lockney, J., Piomelli, D. & Maldonado, R. FAAH缺乏促进能量储存并增强对食物的动力。gydF4y2BaInt。j . ob。gydF4y2Ba34gydF4y2Ba, 557-568(2010)。gydF4y2Ba
Wangensteen, T., Akselsen, H., Holmen, J., Undlien, D. & Retterstol, L.在挪威人群队列研究(HUNT研究)中,NAPEPLD常见单倍型与严重肥胖相关。gydF4y2Ba肥胖gydF4y2Ba19gydF4y2Ba, 612-617(2011)。gydF4y2Ba
鲍威尔,d.r.等人。二酰基甘油脂肪酶α敲除小鼠表现出与大麻素受体1敲除小鼠相似的代谢和行为表型。gydF4y2Ba前面。性。gydF4y2Ba6克ydF4y2Ba, 86(2015)。gydF4y2Ba
井上,等人。外周组织水平和分子种类组成gydF4y2BaNgydF4y2Ba小鼠体内缺乏-酰基磷脂酰乙醇胺及其代谢产物gydF4y2BaNgydF4y2Ba-酰基磷脂酰乙醇胺特异性磷脂酶D。gydF4y2Ba学生物化学j。gydF4y2Ba162gydF4y2Ba, 449-458(2017)。gydF4y2Ba
Geurts, L.等。脂肪组织NAPE-PLD通过改变褐变过程和肠道菌群来控制脂肪质量的发展。gydF4y2BaCommun Nat。gydF4y2Ba6克ydF4y2Ba, 6495(2015)。gydF4y2Ba
Cani, P. D., Everard, A. & Duparc, T.肠道微生物群,肠道内分泌功能和代谢。gydF4y2Ba咕咕叫。当今。杂志。gydF4y2Ba13gydF4y2Ba, 935-940(2013)。gydF4y2Ba
傅,J.等。食物摄入调节油乙醇酰胺在近端小肠的形成和降解。gydF4y2Ba生物。化学。gydF4y2Ba282gydF4y2Ba, 1518-1528(2007)。gydF4y2Ba
Hao, S., Avraham, Y., Mechoulam, R. & Berry, E. M.低剂量anandamide影响饮食限制小鼠的食物摄入、认知功能、神经递质和皮质酮水平。gydF4y2Ba欧元。j .杂志。gydF4y2Ba392gydF4y2Ba, 147-156(2000)。gydF4y2Ba
罗德里格斯·德·冯塞卡,F.等。一种由进食调节的厌食症脂质中介物。gydF4y2Ba自然gydF4y2Ba414gydF4y2Ba, 209-212(2001)。gydF4y2Ba
Tellez, l.a等人。一种肠道脂质信使将过量的膳食脂肪与多巴胺缺乏联系起来。gydF4y2Ba科学gydF4y2Ba341gydF4y2Ba, 800-802(2013)。gydF4y2Ba
施瓦茨,G. J.等。脂质信使OEA将饮食中的脂肪摄入与饱腹感联系起来。gydF4y2Ba细胞金属底座。gydF4y2Ba8gydF4y2Ba, 281-288(2008)。gydF4y2Ba
DiPatrizio, n.v., Astarita, G., Schwartz, G., Li, X. & Piomelli, D.肠道内源性大麻素信号控制膳食脂肪摄入。gydF4y2Ba国家科学院学报美国gydF4y2Ba108gydF4y2Ba, 12904-12908(2011)。gydF4y2Ba
Diep, t.a.等。膳食脂肪通过脂肪传感器降低肠道厌食脂类的水平。gydF4y2Ba美国实验生物学学会联合会J。gydF4y2Ba25gydF4y2Ba, 765-774(2011)。gydF4y2Ba
阿尔特曼,A.等。膳食脂肪酸对内源性大麻素和gydF4y2BaNgydF4y2Ba大鼠大脑、肝脏和小肠中-酰基乙醇胺的含量。gydF4y2BaBiochim。Biophys等。学报gydF4y2Ba1781gydF4y2Ba, 200-212(2008)。gydF4y2Ba
Igarashi, M., DiPatrizio, n.v., Narayanaswami, V. & Piomelli, D.喂食诱导的油乙醇酰胺动员在饮食诱导的肥胖啮齿动物的肠道中被破坏。gydF4y2BaBiochim。Biophys等。学报gydF4y2Ba1851gydF4y2Ba, 1218-1226(2015)。gydF4y2Ba
el Marjou, F.等人。肠上皮组织特异性和诱导性cre介导的重组。gydF4y2Ba《创世纪》gydF4y2Ba39gydF4y2Ba, 186-193(2004)。gydF4y2Ba
Souza, g.f.等。饮食性肥胖中POMC调节缺陷先于下丘脑炎症。gydF4y2Ba科学。代表。gydF4y2Ba6克ydF4y2Ba, 29290(2016)。gydF4y2Ba
Gaetani, S.等人。脂肪诱导的饱腹因子油乙醇酰胺通过中枢释放催产素抑制进食。gydF4y2Baj . >。gydF4y2Ba30.gydF4y2Ba, 8096-8101(2010)。gydF4y2Ba
施瓦茨,M. W.,伍兹,S. C., Porte, D. Jr., Seeley, R. J. & Baskin, D. G.食物摄入的中枢神经系统控制。gydF4y2Ba自然gydF4y2Ba404gydF4y2Ba, 661-671(2000)。gydF4y2Ba
控制食欲的下丘脑神经元网络。gydF4y2BaBMB代表。gydF4y2Ba48gydF4y2Ba, 229-233(2015)。gydF4y2Ba
Kristiansen, m.n.等人。肥胖饮食诱导的非酒精性脂肪性肝炎小鼠模型-肝活检追踪疾病gydF4y2Ba世界J.肝。gydF4y2Ba8gydF4y2Ba, 673-684(2016)。gydF4y2Ba
Osei-Hyiaman, D.等。内源性大麻素在肝脏CB1受体的激活刺激脂肪酸合成,并有助于饮食诱导的肥胖。gydF4y2Baj .中国。投资。gydF4y2Ba115gydF4y2Ba, 1298-1305(2005)。gydF4y2Ba
Davis, r.b., Kechele, d.o., Blakeney, e.s., Pawlak, j.b. & Caron, k.m.降钙素受体样受体的淋巴缺失加剧肠道炎症。gydF4y2Ba江森自控的洞察力gydF4y2Ba2gydF4y2Ba, e92465(2017)。gydF4y2Ba
O 'Rourke, R. W.等人。人体脂肪组织炎症介质的仓库特异性差异以及NK细胞和ifn - γ在炎症中的作用gydF4y2BaInt。j . ob。gydF4y2Ba33gydF4y2Ba, 978-990(2009)。gydF4y2Ba
佩里,R. J.,塞缪尔,V. T.,彼得森,K. F. &舒尔曼,g.i.肝脏脂质在肝脏胰岛素抵抗和2型糖尿病中的作用。gydF4y2Ba自然gydF4y2Ba510gydF4y2Ba, 84-91(2014)。gydF4y2Ba
蒂切内尔,P. M.,拉扎尔,M. A. &伯恩鲍姆,M. J.揭示胰岛素对肝脏代谢的调节。gydF4y2Ba性趋势。金属底座。gydF4y2Ba28gydF4y2Ba, 497-505(2017)。gydF4y2Ba
Cani, P. D.等。内源性大麻素——在肠道菌群和宿主代谢之间的十字路口。gydF4y2Ba内分泌。gydF4y2Ba12gydF4y2Ba, 133-143(2016)。gydF4y2Ba
Everard, A.等人。益生元治疗小鼠的微生物组揭示了肥胖期间涉及宿主反应的新靶点。gydF4y2BaISME J。gydF4y2Ba8gydF4y2Ba, 2116-2130(2014)。gydF4y2Ba
Everard, A.等人。肠上皮MyD88是一种根据营养状况将宿主代谢转向肥胖的传感器。gydF4y2BaCommun Nat。gydF4y2Ba5克ydF4y2Ba, 5648(2014)。gydF4y2Ba
Everard, A.等人。粘液嗜阿克曼氏菌与肠上皮细胞的交叉对话控制饮食诱导的肥胖。gydF4y2Ba国家科学院学报美国gydF4y2Ba110gydF4y2Ba, 9066-9071(2013)。gydF4y2Ba
Plovier, H.等人。纯化的膜蛋白gydF4y2BaAkkermansia muciniphilagydF4y2Ba或者巴氏杀菌细菌可以改善肥胖和糖尿病小鼠的新陈代谢。gydF4y2BaNat,地中海。gydF4y2Ba23gydF4y2Ba, 107-113(2017)。gydF4y2Ba
王,J.等。作为金属- β -内酰胺酶家族成员的纯化的产生anandamide的磷脂酶D的功能分析。gydF4y2Ba生物。化学。gydF4y2Ba281gydF4y2Ba, 12325-12335(2006)。gydF4y2Ba
Petrosino, S.等人。抗炎介质棕榈酰乙醇酰胺提高了2-花生四烯酰甘油的水平,增强了其在TRPV1阳离子通道上的作用。gydF4y2BaBr。j .杂志。gydF4y2Ba173gydF4y2Ba, 1154-1162(2016)。gydF4y2Ba
Musella, A.等。内源性大麻素系统内的一种新型串扰控制GABA在纹状体中的传输。gydF4y2Ba科学。代表。gydF4y2Ba7gydF4y2Ba, 7363(2017)。gydF4y2Ba
莫瑟,A. J.等人。营养状态的时间变化对成年雄性小鼠下丘脑POMC肽水平的影响独立于瘦素。gydF4y2Ba点。j .杂志。性。金属底座。gydF4y2Ba306gydF4y2Ba, e904-e915(2014)。gydF4y2Ba
伊佐,a.a.等人。肥胖中的外周内源性大麻素失调:与食物剥夺和再喂食引起的肠道运动和能量处理有关。gydF4y2BaBr。j .杂志。gydF4y2Ba158gydF4y2Ba, 451-461(2009)。gydF4y2Ba
伊佐,a.a.等人。Zucker大鼠中内源性ppar - α配体的基础和空腹/再喂食调节组织水平。gydF4y2Ba肥胖gydF4y2Ba18gydF4y2Ba, 55-62(2010)。gydF4y2Ba
卢梭等人。gydF4y2Ba嗜酸乳杆菌gydF4y2Ba调节肠道疼痛,诱导阿片和大麻素受体。gydF4y2BaNat,地中海。gydF4y2Ba13gydF4y2Ba, 35-37(2007)。gydF4y2Ba
Cani, P. D. & Van Hul, M.针对代谢综合征的新一代益生菌的新机会。gydF4y2Ba咕咕叫。当今。Biotechnol。gydF4y2Ba32 cgydF4y2Ba, 21-27(2014)。gydF4y2Ba
Cani, P. D. & de Vos, W. M.下一代有益微生物:以gydF4y2BaAkkermansia muciniphilagydF4y2Ba。gydF4y2Ba前面。Microbiol。gydF4y2Ba8gydF4y2Ba, 1765(2017)。gydF4y2Ba
德莲,M.,沃恩,E. E.,普拉格,C. M.和德沃斯,W. M.。gydF4y2BaAkkermansia muciniphilagydF4y2Bagen nov., sp. nov.,一种人肠道黏液降解细菌。gydF4y2BaInt。j .系统。Evolut。Microbiol。gydF4y2Ba54gydF4y2Ba, 1469-1476(2004)。gydF4y2Ba
Schindelin, J.等。斐济:生物图像分析的开源平台。gydF4y2BaNat方法。gydF4y2Ba9gydF4y2Ba, 676-682(2012)。gydF4y2Ba
Toth, Z. E. & Mezey, E.使用来自同一物种的抗体,用酪胺信号放大同时显示多种抗原。gydF4y2Baj . Histochem。Cytochem。gydF4y2Ba55gydF4y2Ba, 545-554(2007)。gydF4y2Ba
Folch, J., Lees, M. & Sloane Stanley, g.h.一种从动物组织中分离和纯化总脂质的简单方法。gydF4y2Ba生物。化学。gydF4y2Ba226gydF4y2Ba497-509(1957)。gydF4y2Ba
Asnicar, F., Weingart, G., Tickle, T. L., Huttenhower, C. & Segata, N.系统发育数据和元数据的紧凑图形表示。gydF4y2BaPeerJgydF4y2Ba3 gydF4y2Ba, e1029(2015)。gydF4y2Ba
确认gydF4y2Ba
我们感谢A. Barrois, A. Bever, H. Danthinne, T. Duparc, B. Es Saadi, R. M. Goebbels, S. Matamoros, T. Pringels, V. Allaeys (UCLouvain, Université catholic olique de Louvain)和C. Martin (Université Laval)的大力支持和帮助。我们感谢来自IREC图像平台(2IP)的C. Bouzin和A. Daumerie,来自Institut de Recherche Expérimentale et Clinique (IREC),感谢他们的出色帮助,感谢N. Van Baren使用de Duve研究所(DDUV, UCL,布鲁塞尔)的全景图像系统。A.E.是比利时FRS-FNRS(科学研究基金会)的副研究员。M.R.和A.d.W.是FRS-FNRS的研究员,P.D.C.是比利时FRS-FNRS的高级副研究员。P.D.C.接受了来自FNRS和FRSM(科学研究基金会médicale,比利时)(公约J.0084.15和公约3.4579.11)、研究项目(公约:T.0138.14)和研究行动Concertée (Communauté française de Belgique公约12/17-047)的资助。V.D.M.是微生物组-内源性大麻素组代谢健康轴的加拿大卓越研究主席,Université Laval,由社会科学和人文科学研究委员会(SSHRC),自然科学和工程研究委员会(NSERC)和加拿大卫生研究所(CIHR)支持。这项工作由FRFS-WELBIO在WELBIO-CGR-2017C-02拨款下支持。P.D.C.是2015年医学研究基金(Baillet Latour)和2013年ERC启动基金(欧洲研究理事会,启动基金336452-ENIGMO)的获得者。gydF4y2Ba
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
概念化,P.D.C.;方法学,p.d.c., a.e.和H.P.;格式分析,p.d.c., a.e.,惠普;调查,P.D.C。乙醯,惠普,M.V.H, L.G, A.d.W,跨距,M.R, V.D.M, N.F。G.G.M.;资源,P.D.C。,S.L S.R, W.M.d.V, N.M.D.;写作-初稿,P.D.C, a.e.,惠普;监督;P.D.C.;资金收购,P.D.C.gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
a.e., h.p., c.d., p.d.c.和W.M.d.V.是专利申请的发明人,涉及使用gydF4y2Ba答:muciniphilagydF4y2Ba以及它在治疗肥胖和相关疾病中的作用。P.D.C.和wm.d.v是A-Mansia Biotech SA的联合创始人。其余作者声明没有竞争利益。gydF4y2Ba
额外的信息gydF4y2Ba
同行评议信息:gydF4y2Ba自然通讯gydF4y2Ba感谢匿名审稿人对本工作的同行评议所作的贡献。gydF4y2Ba
出版商的注意:gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
埃弗拉德,A.,普罗维尔,H.,拉斯泰利,M.。gydF4y2Baet al。gydF4y2Ba肠上皮细胞gydF4y2BaNgydF4y2Ba-酰基磷脂酰乙醇胺磷脂酶D将膳食脂肪与肥胖和脂肪变性的代谢适应联系起来。gydF4y2BaNat CommungydF4y2Ba10gydF4y2Ba, 457(2019)。https://doi.org/10.1038/s41467-018-08051-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-018-08051-7gydF4y2Ba
进一步的阅读gydF4y2Ba
(Wh)olistic (E)ndocannabinoidome-Microbiome-Axis通过(N)营养(WHEN)抑制肥胖和相关疾病gydF4y2Ba
《健康与疾病中的脂类gydF4y2Ba(2022)gydF4y2Ba
Akkermansia muciniphila:下一代有益微生物的范例gydF4y2Ba
自然评论胃肠病学和肝病学gydF4y2Ba(2022)gydF4y2Ba
针对内源性大麻素系统治疗肠易激综合征腹痛gydF4y2Ba
自然评论胃肠病学和肝病学gydF4y2Ba(2022)gydF4y2Ba
对遗传肥胖(ob/ob)和糖尿病(db/db)小鼠的新见解:同一枚硬币的两面gydF4y2Ba
微生物组gydF4y2Ba(2021)gydF4y2Ba
来自Akkermansia muciniphila的细胞外囊泡和巴氏杀菌细胞可防止小鼠高脂肪诱导的肥胖gydF4y2Ba
微生物细胞工厂gydF4y2Ba(2021)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba和gydF4y2Ba社区指导原则gydF4y2Ba。如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba