摘要gydF4y2Ba
早期人类肠道微生物群对宿主产生终生的健康影响,但支撑其组装的机制仍然难以捉摸。特别是梭状芽孢杆菌的早期殖民gydF4y2BaRoseburiagydF4y2Ba-gydF4y2Ba真细菌gydF4y2Ba与预防结直肠癌、免疫和代谢紊乱有关的群体是一个谜。在这里,我们描述了支持生长的分解代谢途径gydF4y2BaRoseburiagydF4y2Ba而且gydF4y2Ba真细菌gydF4y2Ba不同的人乳寡糖(HMOs)的成员。HMO途径包括以前未知的结构折叠和特异性的酶,在选定的HMO和与之共培养的过程中,与额外的聚糖利用位点一起上调gydF4y2BaAkkermansia muciniphilagydF4y2Ba关于粘蛋白,这表明粘蛋白在交叉喂食和接触粘蛋白方面有额外的作用gydF4y2BaOgydF4y2Ba聚糖。4599的分析gydF4y2BaRoseburiagydF4y2Ba基因组分析表明,该属植物HMO利用位点具有优势和多样性。产丁酸梭菌对HMOs的分解代谢可能有助于该组在断奶触发的微生物群成熟期间的竞争力。gydF4y2Ba
简介gydF4y2Ba
人体肠道菌群(HGM)是健康的关键决定因素gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba.在出生后不久,来自母亲的正交转移对该群落的建立有显著的贡献gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba.HGM在婴儿期动态发育,直到2-3年后形成一个具有弹性的成人社区gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba.早期生命微生物群在宿主内分泌、代谢和免疫系统的成熟中起着重要作用gydF4y2Ba9gydF4y2Ba该联盟的组成与终身健康影响有关gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.因此,了解在婴儿期定义HGM结构的因素对于最大限度地降低一系列代谢、炎症和神经退行性疾病的风险至关重要,这些疾病都与特定的HGM特征相关gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba.gydF4y2Ba
饮食中的糖抵抗人类酶的消化是形成发育中的HGM的主要驱动因素gydF4y2Ba6gydF4y2Ba,gydF4y2Ba15gydF4y2Ba.的支配地位强调了这一点gydF4y2Ba双歧杆菌属gydF4y2Ba在母乳喂养的婴儿中gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,这是由于该属的不同成员在利用人乳寡糖(HMOs)方面的竞争力。gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba.事实上,婴儿微生物群最显著的变化发生在断奶和固体食物的引入期间gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,即双歧杆菌门被厚壁菌门取代,成为成熟HGM最丰富的门。这种成分的变化伴随着短链脂肪酸(SCFAs)丙酸和丁酸(来自碳水化合物发酵)在断奶期间和断奶后浓度的显著纵向增加gydF4y2Ba18gydF4y2Ba.gydF4y2Ba
丁酸盐具有免疫调节活性gydF4y2Ba19gydF4y2Ba而且还能降低结肠癌、动脉粥样硬化和肠结肠炎的风险gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba.丁酸盐的产生主要归因于厚壁菌门gydF4y2Ba梭状芽胞杆菌gydF4y2Ba第四组及gydF4y2Ba梭状芽胞杆菌gydF4y2Ba对象的群集XIVagydF4y2BaRoseburiagydF4y2Ba-gydF4y2Ba真细菌gydF4y2Ba组(苦螺科,梭状藻目),在成年HGM中大量存在gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba.丰富的gydF4y2BaRoseburiagydF4y2Ba代谢性疾病、炎症性疾病和心血管疾病患者sp降低gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba.虽然丁酸盐生产者是建立在生命的第一年gydF4y2Ba27gydF4y2Ba在美国,它们早期出现(和流行)的机制仍然未知。gydF4y2Ba
支持竞争性生长的吸收和酶系统的进化gydF4y2Ba双歧杆菌属gydF4y2Basp . on HMOsgydF4y2Ba17gydF4y2Ba反映了母乳喂养的婴儿对肠道的成功适应。我们假设,其他具有以HMOs为目标的代谢能力的分类组可能在婴儿期婴儿肠道的定殖中具有早期优势。gydF4y2Ba
早期出现的gydF4y2BaRoseburiagydF4y2Ba-gydF4y2Ba真细菌gydF4y2Ba在人类肠道中提供了一个合适的模型组来评估这一假设。在这里,我们进行基因组分析,提示假定的HMO利用位点的存在gydF4y2BaRoseburiagydF4y2Ba而且gydF4y2Ba真细菌gydF4y2Ba菌株。在选择的HMO或来自母乳的复杂混合物上的生长结合差异蛋白质组学揭示了这些位点编码的蛋白质装置的高度上调,与它们在调节HMO利用中的作用一致。gydF4y2Ba
此外,我们描述了由HMO位点编码的酶和转运蛋白,以阐明该蛋白质装置捕获和降解HMO的分子细节。这些分析揭示了酶活性和结构折叠,这是以前没有报道过的。HMO分解代谢途径在模型粘蛋白降解物的作用下在生长过程中上调gydF4y2BaAkkermansia muciniphilagydF4y2Ba,表明这些途径可能支持对粘蛋白低聚糖的交叉喂养gydF4y2Ba答:muciniphilagydF4y2Ba.的宏基因组分析gydF4y2BaRoseburiagydF4y2Ba显示了HMO利用途径在整个属中显著的守恒和广泛存在,强调了它们对适应人类肠道的重要性。这项研究通过调节不同HMOs和宿主的分解代谢,为早期定殖和关键丁酸生成梭状芽孢杆菌的恢复能力提供了可能赋予竞争优势的途径gydF4y2BaOgydF4y2Ba聚糖。gydF4y2Ba
结果gydF4y2Ba
HMO基因座gydF4y2BaRoseburiagydF4y2Ba而且gydF4y2Ba真细菌gydF4y2Ba
我们的目的是研究产丁酸梭菌的HMO利用潜力,这可能会在断奶期间婴儿HGM的成熟过程中带来优势。通过对Lachnospiraceae中丁酸产生者的基因组分析,发现其与碳水化合物活性酶(CAZyme)数据库中最近发现的糖苷水解酶家族136 (GH136)具有遥远同源性(gydF4y2Bawww.cazy.orggydF4y2Ba)(补充图gydF4y2Ba1gydF4y2Ba).这个科是根据乳酸菌划分的gydF4y2BaNgydF4y2Ba-生物苷酶LnbX从gydF4y2Ba双歧杆菌longumgydF4y2Ba无性系种群。gydF4y2BalongumgydF4y2BaJCM 1217gydF4y2Ba28gydF4y2Ba,其裂解关键HMO乳酸gydF4y2BaNgydF4y2Ba-四糖(LNT)到乳酸gydF4y2BaNgydF4y2Ba-二糖(LNB)和乳糖(EC 3.2.1.140;补充表gydF4y2Ba1gydF4y2Ba).双歧杆菌LnbX的活性依赖于相邻基因的共表达,提出编码分子伴侣(LnbY)。GH136的正交物gydF4y2BaRoseburiagydF4y2Ba而且gydF4y2Ba真细菌gydF4y2Ba是有组织的,不像来自gydF4y2Ba双歧杆菌属gydF4y2Ba,在含有额外CAZyme基因的位点(补充图。gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
我们选了两个gydF4y2BaRoseburiagydF4y2Ba菌株和一个来自gydF4y2Ba真细菌gydF4y2Ba,都具有gh136样基因,以检测它们对HMO的利用能力。gydF4y2Ba
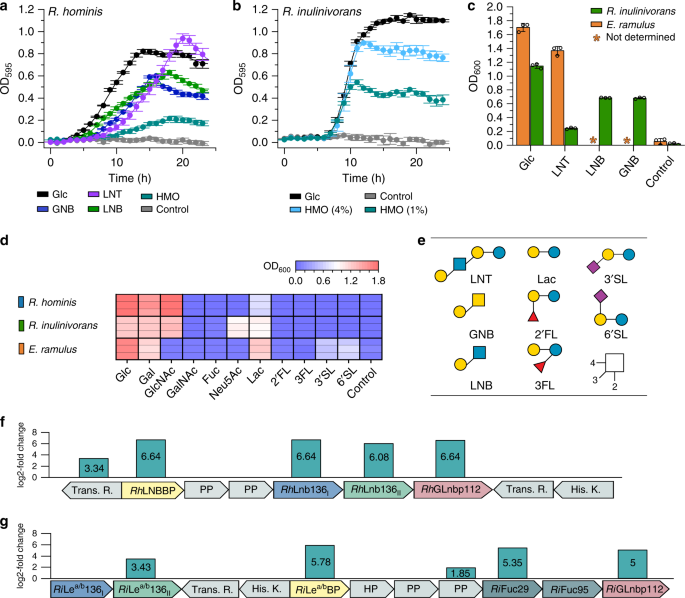
的显著增长gydF4y2BaRoseburia hominisgydF4y2BaDSM 16839 (gydF4y2BapgydF4y2Ba< 4.0 × 10gydF4y2Ba−4gydF4y2Ba),gydF4y2BaRoseburia inulinivoransgydF4y2BaDSM 16841 (gydF4y2BapgydF4y2Ba< 1.3 × 10gydF4y2Ba−4gydF4y2Ba) 24 h后用HMOs从母乳中提取,但生长gydF4y2Bar . inulinivoransgydF4y2Ba效率更高(gydF4y2BaµgydF4y2Ba马克斯gydF4y2Ba= 0.30±0.01 hgydF4y2Ba−1gydF4y2Ba)(图。gydF4y2Ba1 a, bgydF4y2Ba).接下来,我们从HMOs和相关的寡聚物中进行了构建块的生长gydF4y2BaOgydF4y2Ba-glycoconjugates(无花果。gydF4y2Ba1模拟gydF4y2Ba).尽管在乳糖上生长良好,但没有一株菌株能在富含聚酰基乳糖(FL)的HMOs上生长。gydF4y2Ba1 dgydF4y2Ba).gydF4y2BaRoseburiagydF4y2Ba菌株不能在唾液酸乳糖(SL)上生长(图;gydF4y2Ba1 dgydF4y2Ba),与编码唾液酸酶的缺乏相一致。gydF4y2Bar . hominisgydF4y2Ba在HMO LNT上高效生长(gydF4y2BaµgydF4y2Ba马克斯gydF4y2Ba= 0.22±0.02小时gydF4y2Ba−1gydF4y2Ba),其LNB单元(gydF4y2BaµgydF4y2Ba马克斯gydF4y2Ba= 0.16±0.01 hgydF4y2Ba−1gydF4y2Ba)和黏液衍生的半乳糖gydF4y2BaNgydF4y2Ba-生物糖(GNB) (gydF4y2BaµgydF4y2Ba马克斯gydF4y2Ba= 0.21±0.02 hgydF4y2Ba−1gydF4y2Ba)(图。gydF4y2Ba1gydF4y2Ba).LNT上的生长也与分类相关gydF4y2Ba真细菌小枝gydF4y2Ba真菌科的DSM 15684。相比之下,gydF4y2Bar . inulinivoransgydF4y2Ba只有LNB和GNB生长良好,而LNT生长不佳(图2)。gydF4y2Ba1 cgydF4y2Ba).gydF4y2Bar . inulinivoransgydF4y2Ba通过唾液酸(Neu5Ac)上的生长进一步区分,唾液酸富含HMOs和糖缀合物(图5)。gydF4y2Ba1 dgydF4y2Ba).gydF4y2Ba
生长曲线gydF4y2Bar . hominisgydF4y2Ba(gydF4y2Ba一个gydF4y2Ba),gydF4y2Bar . inulinivoransgydF4y2Ba(gydF4y2BabgydF4y2Ba)对葡萄糖、LNT、GNB、LNB和/或来自母乳的纯化HMOs的影响,与24小时内无碳源对照相比。gydF4y2BacgydF4y2Ba增长水平gydF4y2Bar . inulinivoransgydF4y2Ba在LNT, LNB, GNB和的gydF4y2Bae .小枝gydF4y2Ba包括葡萄糖和无碳源控制gydF4y2BadgydF4y2Ba,增长gydF4y2Bar . hominisgydF4y2Ba,gydF4y2Bar . inulinivoransgydF4y2Ba而且gydF4y2Bae .小枝gydF4y2Ba对乳糖,2'FL, 3FL, 3 ' l和6' l,以及来自HMOs和粘蛋白的单糖进行了24小时后,包括无碳源控制。增长分析(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba)在添加0.5% (w/v)碳水化合物(用于gydF4y2Bar . inulinivoransgydF4y2Ba分别在1% (w/v)和4% (w/v)从母乳中纯化的HMOs上进行独立的生物三重复试验。增长数据以平均值表示,误差条表示的标准偏差(SD)gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba.gydF4y2BaegydF4y2BaHMO和粘蛋白寡聚物的生长底物gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba.HMO利用位点gydF4y2Bar . hominisgydF4y2Ba(gydF4y2BafgydF4y2Ba),gydF4y2Bar . inulinivoransgydF4y2Ba(gydF4y2BaggydF4y2Ba)从蛋白质组学分析中鉴定出来,细胞分别生长在来自母乳的LNT和HMOs上,相对于葡萄糖。基因由它们的蛋白质产物表示:转录调节因子(Trans。r .);ABC转运蛋白溶质结合蛋白(gydF4y2BaRhgydF4y2BaLNBBP (gydF4y2BafgydF4y2Ba),gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba英国石油公司(gydF4y2BaggydF4y2Ba));ABC转运蛋白渗透酶(PP);假设蛋白(HP);糖苷水解酶136 (gydF4y2BaRhgydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba,gydF4y2BaRhgydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba(gydF4y2BafgydF4y2Ba),gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba136gydF4y2Ba我gydF4y2Ba,gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba136gydF4y2Ba2gydF4y2Ba(gydF4y2BaggydF4y2Ba));糖苷水解酶112 (gydF4y2BaRhgydF4y2BaGLnbp112 (gydF4y2BafgydF4y2Ba),gydF4y2Ba国际扶轮gydF4y2BaGLnbp112 (gydF4y2BaggydF4y2Ba));糖苷水解酶29 (gydF4y2Ba国际扶轮gydF4y2BaFuc29 (gydF4y2BaggydF4y2Ba));糖苷水解酶95 (gydF4y2Ba国际扶轮gydF4y2BaFuc95 (gydF4y2BaggydF4y2Ba)和组氨酸激酶感觉蛋白(His。k)蛋白质组学分析(gydF4y2BafgydF4y2Ba- - - - - -gydF4y2BaggydF4y2Ba)的生物副本和日志gydF4y2Ba2gydF4y2Ba显示了基因上调产物的无标记定量的-倍变化。根据聚糖符号命名法(SNFG)的聚糖结构表示(gydF4y2Bahttps://www.ncbi.nlm.nih.gov/glycans/snfg.htmlgydF4y2Ba).源数据以源数据文件的形式提供,并标有相应的图形编号和面板定义。gydF4y2Ba
通常情况下,细菌在存在最喜欢的碳源时抑制不太喜欢的基质的途径。来自丰富的膳食植物纤维木聚糖的木糖四糖已被证明是一种优选的生长底物和摄取配体的低聚木糖进口保存在gydF4y2BaRoseburiagydF4y2Ba29gydF4y2Ba.在断奶期间,婴儿的HGM可能同时接触HMOs和膳食植物纤维,例如谷物和水果中的木聚糖。我们测试了生长gydF4y2Bar . hominigydF4y2Bas在等摩尔浓度的LNT和相似大小的木糖四糖的存在下,以评估HMO与植物纤维的利用层次。引人注目的是,观察到单相生长与同时从培养上清中摄取这两种tetraoses一致(补充图)。gydF4y2Ba2 a - cgydF4y2Ba).gydF4y2Ba
揭示hmo增长的基础,重点是gydF4y2BaRoseburiagydF4y2Ba属,我们分析了蛋白质组gydF4y2Bar . hominisgydF4y2Ba而且gydF4y2Bar . inulinivoransgydF4y2Ba分别对LNT和HMO混合物,相对于葡萄糖。为gydF4y2Bar . hominisgydF4y2Ba而且gydF4y2Bar . inulinivoransgydF4y2Ba、15、62个蛋白表达显著上调(loggydF4y2Ba2gydF4y2Ba这些差异蛋白组以碳水化合物代谢蛋白为主,特别是两个基因座(以下称为HMO利用基因座)的产物,它们都编码一个atp结合盒(ABC)转运体,GH112和GH136酶,推定具有HMO活性,以及感觉和转录调节因子(图2)。gydF4y2Ba1 f, ggydF4y2Ba).的HMO轨迹gydF4y2Bar . inulinivoransgydF4y2Ba用GH29和GH95两个聚焦酶进行扩增。ABC转运体的特异性决定溶质结合蛋白(sps)gydF4y2Bar . hominisgydF4y2Ba(gydF4y2BaRhgydF4y2BaLNBBP)和gydF4y2Bar . inulinivoransgydF4y2Ba(gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2BaBP)分别是HMO蛋白组中第1个和第5个上调蛋白。此外,GH112 LNB/GNB磷酸化酶在蛋白表达上调前3位和前12位gydF4y2Bar . hominisgydF4y2Ba而且gydF4y2Bar . inulinivoransgydF4y2Ba,分别。在gydF4y2Bar . inulinivoransgydF4y2Ba另外两个编码唾液酸和重点分解代谢蛋白的位点也被上调(补充图。gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
不同的GH136酶介导HMO的初始降解gydF4y2Ba
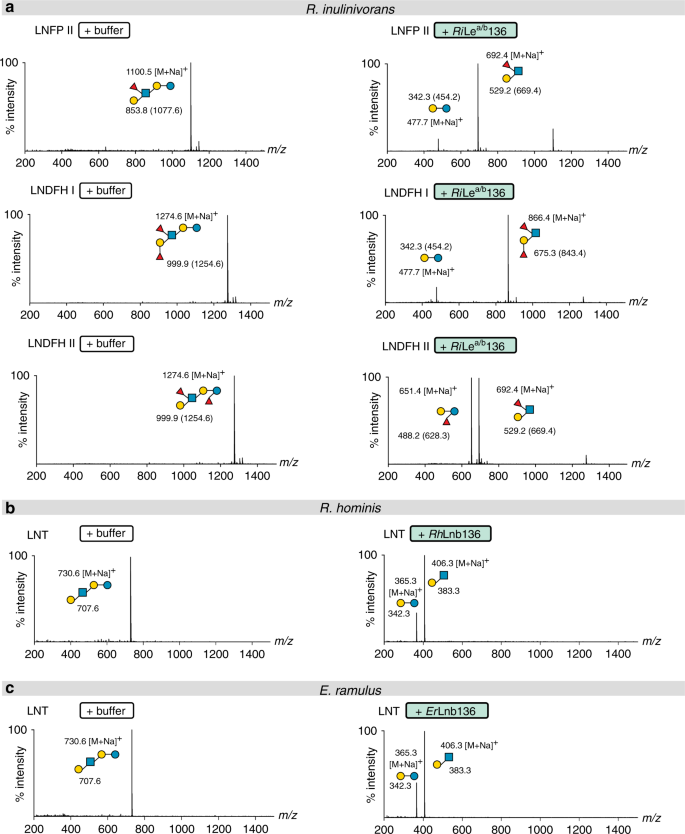
的同系物gydF4y2BaRhgydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba(LnbYgydF4y2Bab . longumgydF4y2Ba),gydF4y2BaRhgydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba(含有催化残基的LnbXgydF4y2Bab . longumgydF4y2Ba)在的LNT蛋白组中高度共上调gydF4y2Bar . hominisgydF4y2Ba(无花果。gydF4y2Ba1 fgydF4y2Ba).这两个,gydF4y2BaRhgydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba而且gydF4y2BaRhgydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba缺乏预测的跨膜结构域和信号肽的对比gydF4y2Bab . longumgydF4y2Ba(补充图。gydF4y2Ba4gydF4y2Ba),表明LNT在细胞内降解gydF4y2Bar . hominisgydF4y2Ba.只有共表达和共纯化gydF4y2BaRhgydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba而且gydF4y2BaRhgydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba产生一种活跃的乳酸gydF4y2BaNgydF4y2Ba-biosidase(从今以后gydF4y2BaRhgydF4y2BaLnb136)(无花果。gydF4y2Ba2 bgydF4y2Ba,补充表gydF4y2Ba4gydF4y2Ba).这些发现和观察到的共上调,表明一种异质二聚体(或寡聚体)gydF4y2BaRhgydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba而且gydF4y2BaRhgydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba聚合催化活性gydF4y2BaRhgydF4y2BaLnb136。接下来,我们证明了LNB和GNB磷酸化生成α-gydF4y2BadgydF4y2Ba-半乳糖-1-磷酸和相应的gydF4y2BaNgydF4y2Ba-acetylhexosamines GlcNAc和GalNAc。gydF4y2Ba5 fgydF4y2Ba),通过GH112 GNB/LNB磷酸化酶(gydF4y2BaRhgydF4y2BaGLnbp112)位于同一位点(图;gydF4y2Ba1 fgydF4y2Ba和补充图。gydF4y2Ba1gydF4y2Ba).该酶对LNB和GNB具有相当的特异性活性(补充表gydF4y2Ba5gydF4y2Ba)与这些双糖的生长相一致。功能性乳酸gydF4y2BaNgydF4y2Ba-生物苷酶和GNB/LNB磷酸化酶进一步支持该位点的HMO分解代谢作用。gydF4y2Ba
一个gydF4y2Ba的活动gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba聚焦hmo的136条。gydF4y2BabgydF4y2Ba的活动gydF4y2BaRhgydF4y2BaLNT上的Lnb136。gydF4y2BacgydF4y2Ba的活动gydF4y2Ba呃gydF4y2BaLNT上的Lnb136。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba采用MALDI-ToF质谱分析水解产物,不含(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)或与gydF4y2Ba一个gydF4y2Bapermethylation。gydF4y2Ba一个gydF4y2Ba括号中是甲基化糖的质量,离子峰对应NagydF4y2Ba+gydF4y2Ba甲基化糖的加合物。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba所示为相对强度(百分比强度)。MALDI-ToF质谱分析(gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba)是从独立的三次重复(每个生物酶反应重复一次分析)中进行的,所有分析都得出了相似的结果。gydF4y2Ba
国际扶轮gydF4y2BaGH136,来自hmo上调位点的GH136同源物gydF4y2Bar . inulinivoransgydF4y2Ba被预测为细胞外,与信号肽在gydF4y2Ba国际扶轮gydF4y2BaGH136gydF4y2Ba2gydF4y2Ba也具有两个c端碳水化合物结合模块(补充图。gydF4y2Ba8gydF4y2Ba)和预测的n端跨膜结构域gydF4y2Ba国际扶轮gydF4y2BaGH136gydF4y2Ba我gydF4y2Ba.Co-expression的gydF4y2Ba国际扶轮gydF4y2BaGH136gydF4y2Ba我gydF4y2Ba而且gydF4y2Ba国际扶轮gydF4y2BaGH136gydF4y2Ba2gydF4y2Ba,分别缺乏跨膜结构域和信号肽,导致了一种具有前所未有的特异性的活性酶。这种酶(gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba136)从集中化的HMOs(包括乳酸-)中释放Lewis a三糖或Lewis b四糖gydF4y2BaNgydF4y2Ba-岩藻五糖苷II (LNFP II),乳酸-gydF4y2BaNgydF4y2Ba-difucohexaose I (LNDFH I)和乳酸-gydF4y2BaNgydF4y2Ba-difucohexaose II (LNDFH II)gydF4y2Ba2gydF4y2Ba和补充图。gydF4y2Ba5gydF4y2Ba).据我们所知,到目前为止还没有关于聚焦化- glcnac还原端键断裂的报道。接下来,我们描述了由该位点编码的其他CAZymes,它们都缺乏信号肽或跨膜结构域,提示它们的细胞内定位。我们的一致行动表明gydF4y2Ba国际扶轮gydF4y2BaFuc29和gydF4y2Ba国际扶轮gydF4y2Ba作用于α-(1→4)键和α-(1→2)键的Fuc95gydF4y2BalgydF4y2Ba- focusyl,分别介导的假定产物的完全去聚焦化gydF4y2Ba国际扶轮gydF4y2BaGH136,勒gydF4y2BabgydF4y2Batetraose,勒gydF4y2Ba一个gydF4y2Ba三糖和H三糖I型(补充图。gydF4y2Ba5罪犯gydF4y2Ba).由gydF4y2Ba国际扶轮gydF4y2Ba释放1→2链接需要Fuc29gydF4y2BalgydF4y2Ba- focusyl在LegydF4y2BabgydF4y2Batetraose由gydF4y2Ba国际扶轮gydF4y2BaFuc95。最后,我们展示了GH112gydF4y2Bar . inulinivoransgydF4y2Ba(gydF4y2Ba国际扶轮gydF4y2BaGLnbp112同样有效地磷酸化LNB和GNB(补充图。gydF4y2Ba5 egydF4y2Ba,补充表gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
GH136活性需要一个具有新折叠的结构域gydF4y2Ba
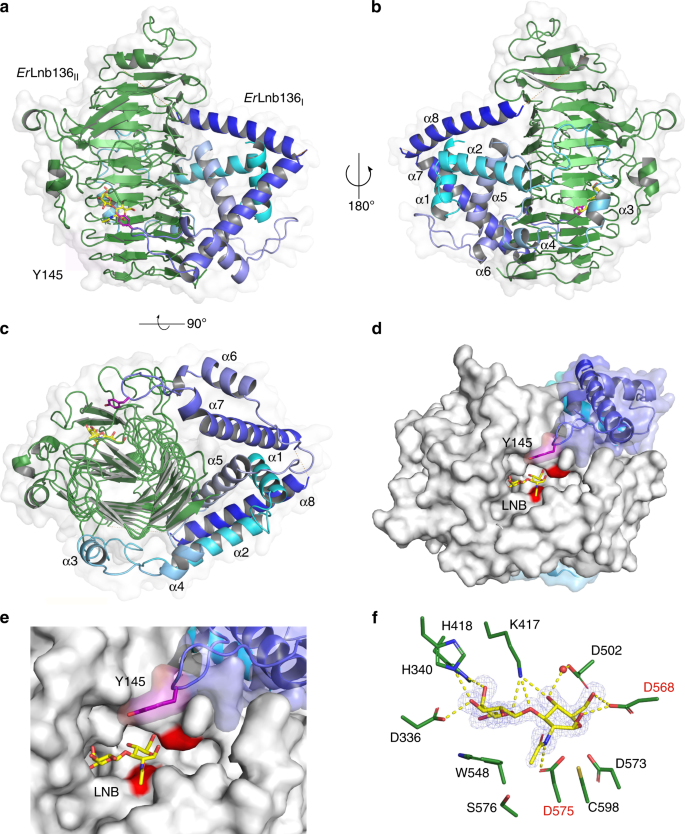
为了识别GH136酶的分子结构并解释这两个亚基对活性的要求,我们努力将它们结晶gydF4y2BaRhgydF4y2BaLnb136和gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba没有成功。因此,我们将注意力转向分类学相关gydF4y2Bae .小枝gydF4y2Ba,其GH136位点与中相似gydF4y2Bar . hominisgydF4y2Ba除了GH112磷酸化酶与GH42 β-半乳糖苷酶基因的替代(补充图。gydF4y2BaS1gydF4y2Ba),可能导致LNB/GNB单元的水解gydF4y2Ba30.gydF4y2Ba.gydF4y2Bae .小枝gydF4y2Ba而且gydF4y2Bar . hominisgydF4y2BaLNT也有相似的生长特征(图。gydF4y2Ba1gydF4y2Ba),这与功能性GH136的存在相一致。n端(gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba)和c端(gydF4y2Ba呃gydF4y2Ba的Lnb136II)区域gydF4y2Bae .小枝gydF4y2BaGH136同源于gydF4y2BaRhgydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba而且gydF4y2BaRhgydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba(补充图。gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba),分别暗示的融合gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba而且gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba形成一种活性酶(gydF4y2Ba呃gydF4y2BaLnb136)。这是由相同的特异性和相似的催化效率gydF4y2Ba呃gydF4y2BaLnb136和gydF4y2BaRhgydF4y2BaLnb136(补充表gydF4y2Ba4gydF4y2Ba).此外,两者的亲密互动gydF4y2Ba呃gydF4y2BaLnb136结构域与酶的协同展开图谱一致(补充图)。gydF4y2Ba4 bgydF4y2Ba).这些数据证明了这种使用是正确的gydF4y2Ba呃gydF4y2Ba研究GH136内活性必需的两个亚基/结构域的结构。硒代蛋氨酸(SeMet)的晶体结构标记和天然gydF4y2Ba呃gydF4y2BaLnb136分别在1.4和2.0 Å分辨率下测定(补充表gydF4y2Ba6gydF4y2Ba).c端催化结构域(gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba,来自AA 242-663)假设β螺旋折叠(图。gydF4y2Ba3.gydF4y2Ba)类似于双歧杆菌同源物LnbX(补充表gydF4y2Ba7gydF4y2Ba).结合在活性位点上的LNB分子被10个潜在的氢键和Gal单位在W548上的芳香层所识别(图548)。gydF4y2Ba3 fgydF4y2Ba和补充图。gydF4y2Ba6gydF4y2Ba).有趣的是,LNB的GlcNAc糖环gydF4y2Ba呃gydF4y2BaLnb136采用angydF4y2Ba4gydF4y2BaEgydF4y2Ba构象(gydF4y2BaφgydF4y2Ba= 232°和gydF4y2BaψgydF4y2Ba= 68°),使O1-OH处于伪轴向位置,与酸碱催化剂形成直接氢键(D568)(补充图。gydF4y2Ba6gydF4y2Ba).此外,D575 OgydF4y2Baδ2gydF4y2Ba在3.2的位置上,亲核试剂的亲核分子对GlcNAc的异构碳进行亲核攻击(Å)。gydF4y2Ba3 fgydF4y2Ba).gydF4y2Ba
一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba整体结构和半透明的表面gydF4y2Ba呃gydF4y2BaLnb136由n端结构域(gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba,蓝绿色)和c端β-螺旋结构域(gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba、绿色)。酶显示在gydF4y2Ba一个gydF4y2Ba与c端β螺旋结构域正交的视图,gydF4y2BabgydF4y2Ba观点gydF4y2Ba一个gydF4y2Ba旋转180°gydF4y2BacgydF4y2Ba沿c -末端看β螺旋畴轴,突出相互作用gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba而且gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba.gydF4y2BadgydF4y2Ba活性部位的分子表面俯视图和近距离视图gydF4y2BaegydF4y2Ba为了说明的贡献gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba结构域对活性位点结构的影响,特别是酪氨酸(Y145,品红)有助于底物亲和力。gydF4y2BafgydF4y2Ba加权gydF4y2Ba曼氏金融gydF4y2BaogydF4y2Ba-gydF4y2BaDFgydF4y2BacgydF4y2Ba省略了活性部位LNB单元(黄色棒)的电子密度图(等高线为4.0 σ)。水(红色球体)介导的和识别LNB的直接氢键是黄色虚线。gydF4y2BadgydF4y2Ba- - - - - -gydF4y2BafgydF4y2Ba催化亲核试剂(D575)和催化酸碱残基(D568)用红色标记。gydF4y2Ba一个gydF4y2Ba- - - - - -gydF4y2BacgydF4y2Ba无序区域(残基180-199和225-241)显示为橙色虚线。gydF4y2Ba
n端域(gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba(AA 7-224)由8个α-螺旋(α1-α8)组成。gydF4y2Ba3得了gydF4y2Ba),并假设一个以前未知的褶皱,由中心螺旋α1稳定。结构上最相关的蛋白质gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba,一种具有伴侣活性的肽酰脯氨酸顺反异构酶gydF4y2Ba幽门螺杆菌gydF4y2Ba(5EZ1)的结构相似性较弱,仅局限于α6和α7螺旋结构。gydF4y2Ba6 bgydF4y2Ba,补充表gydF4y2Ba7gydF4y2Ba).的gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba结构域包括β螺旋结构域的侧面和背面(图2)。gydF4y2Ba3得了gydF4y2Ba).这些广泛的域间相互作用(溶剂不可达接口≈1618 ÅgydF4y2Ba2gydF4y2Ba),用Δ稳定蛋白质结构gydF4y2BaGgydF4y2Ba=−17千卡摩尔gydF4y2Ba−1gydF4y2Ba.值得注意的是,α6-α7环gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba形成部分活性位点,Y145的溶剂可及侧链位于活性位点附近(5.7 Å到LNB的GlcNAc O1原子)(图。gydF4y2Ba3 d, egydF4y2Ba).Y145A突变体显示出4.9倍的高gydF4y2BaKgydF4y2Ba米gydF4y2Ba(补充表gydF4y2Ba4gydF4y2Ba,补充图。gydF4y2Ba4摄氏度gydF4y2Ba),表明该残基有助于底物相互作用,可能在+1子位点。gydF4y2Ba
捕获和吸收hmogydF4y2BaRoseburiagydF4y2Ba
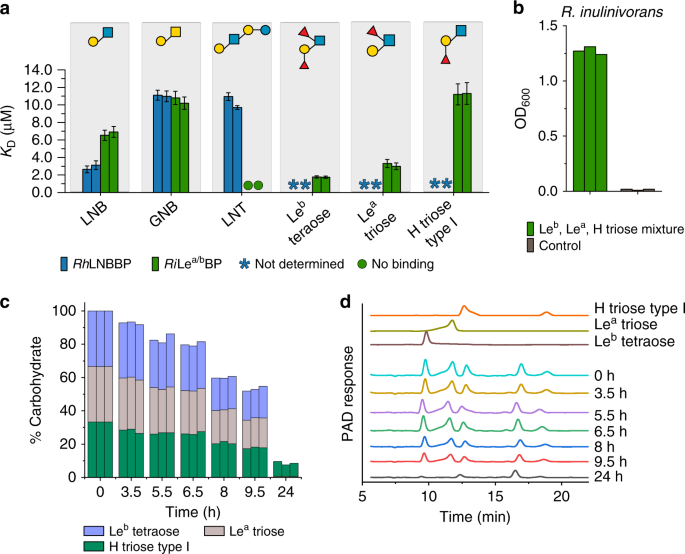
蛋白质组学分析强调了在hmo上生长所需的假定蛋白质装置。两种ABC转运蛋白的溶质结合蛋白(sps)gydF4y2Bar . hominisgydF4y2Ba而且gydF4y2Bar . inulinivoransgydF4y2Ba都在前8%的上调蛋白中,这表明它们参与了HMOs的摄取。两种sps都能从宿主聚糖中识别出不同的HMOs和配体(图。gydF4y2Ba4gydF4y2Ba、补充表格gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba3.gydF4y2Ba,补充图。gydF4y2Ba7gydF4y2Ba).的gydF4y2Bar . hominisgydF4y2BaSBP (lnb结合蛋白gydF4y2BaRhgydF4y2BaLNBBP)优先于LNB,其次是GNB和LNT,提示这些配体的摄取和细胞内降解通过gydF4y2BaRhgydF4y2BaGLnbp112和gydF4y2BaRhgydF4y2Ba如上所述的Lnb136。相比之下,focusyl装饰的Lewis b (LegydF4y2BabgydF4y2Ba)四聚糖和路易斯a (LegydF4y2Ba一个gydF4y2Ba)三糖是Le的首选配体gydF4y2Baa / bgydF4y2Ba结合蛋白(gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba英国石油公司)gydF4y2Bar . inulinivoransgydF4y2Ba,其次是LNB和GNB,而未检测到与LNT结合(图。gydF4y2Ba4gydF4y2Ba,补充表gydF4y2Ba3.gydF4y2Ba).在还原GlcNAc的末端丢失聚焦酰基降低了亲和力gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2BaH型血抗原三糖型(H三糖型I)的血压约为Le的5倍gydF4y2BabgydF4y2Batetraose。的特殊性gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2BaBP的特点是对乳酸缺乏亲和性gydF4y2BaNgydF4y2Ba-neotetroase (LNgydF4y2BangydF4y2BaT), A血型抗原三糖(A三糖),乳糖和2 ' -焦酰基乳糖(2 ' - fl)。这些发现表明,产品gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba136是首选配体gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2BaBP,与聚焦的五糖和六糖HMOs的胞外降解以及ABC转运体对其产物的摄取一致。Le的等摩尔混合物gydF4y2BabgydF4y2Ba,勒gydF4y2Ba一个gydF4y2Bah -三糖I型寡聚物促进了其生长gydF4y2Bar . inulinivoransgydF4y2Ba在类似的决赛中gydF4y2BaODgydF4y2Ba600gydF4y2Ba作为葡萄糖(图;gydF4y2Ba1 b, cgydF4y2Ba和无花果。gydF4y2Ba4gydF4y2Ba).这些配体的摄取情况反映了偏好gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2BaBP,与相关转运蛋白摄取一致(图。gydF4y2Ba4gydF4y2Ba).这也与从母乳中纯化的HMO生长过程中观察到的更大聚焦HMO结构的利用相一致(补充图)。gydF4y2Ba2 a - cgydF4y2Ba).值得注意的是,没有观察到LNT的摄取,这与生长不良非常一致(图2)。gydF4y2Ba1 cgydF4y2Ba),且与LNT缺乏可检测的结合gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba英国石油公司(图。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
一个gydF4y2BaHMOs与宿主寡糖的结合分析gydF4y2BaRhgydF4y2BaLNBBP和gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba英国石油公司。gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba生长和摄取偏好gydF4y2Bar . inulinivoransgydF4y2Ba在等摩尔的Le混合物上gydF4y2BabgydF4y2Batetraose,勒gydF4y2Ba一个gydF4y2Ba三糖和H三糖I型。gydF4y2BabgydF4y2Ba增长水平gydF4y2Bar . inulinivoransgydF4y2Ba在等摩尔的Le混合物上gydF4y2BabgydF4y2Batetraose,勒gydF4y2Ba一个gydF4y2Ba三糖和H三糖I型在24小时内,包括无碳对照。gydF4y2BacgydF4y2Ba时间进程的相对百分比的LegydF4y2BabgydF4y2Batetraose,勒gydF4y2Ba一个gydF4y2Ba三糖和H型三糖的培养上清gydF4y2BabgydF4y2Ba中提出的HPAEC-PAD分析gydF4y2BadgydF4y2Ba.gydF4y2BadgydF4y2Ba具有代表性的HPAEC-PAD色谱图,显示培养上清液的时间过程分析gydF4y2Bar . inulinivoransgydF4y2Ba在YCFA培养基上添加1.5 mM Leb四糖,1.5 mM LegydF4y2Ba一个gydF4y2Ba三糖和1.5 mM H三糖i型结合亲和力gydF4y2Ba一个gydF4y2Ba的gydF4y2BaRhgydF4y2Ba采用等温滴定量热法(ITC)测定LNBBP的结合亲和力gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba由于配体的低可用性,BP由表面等离子体共振(SPR)确定,并由这些技术的结合常数的可比性来证明gydF4y2Ba17gydF4y2Ba,gydF4y2Ba31gydF4y2Ba.两项分析均为独立重复(gydF4y2BangydF4y2Ba2)和gydF4y2BaKgydF4y2BaDgydF4y2Ba数值报告与误差条表示的误差适合绑定等温线。生长实验gydF4y2BabgydF4y2Ba作为独立的生物三副本进行(gydF4y2BangydF4y2Ba= 3)和3份HPAEC-PAD分析gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba进行了(一个分析/每个生物重复),其中所有HPAEC-PAD分析得出了相似的结果。gydF4y2Ba
这些结果证实了上述sbp对特定HMOs和相关配体的捕获以及它们的特异性的分化,如偏好gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2BaBP到末端聚焦的配体还原GlcNAc。gydF4y2Ba
RoseburiagydF4y2Ba粘蛋白交叉饲喂gydF4y2Ba
hmo和gydF4y2BaOgydF4y2Ba-来自糖脂和包括黏蛋白在内的糖蛋白的聚糖共享结构基序。高亲和力的sbp来自gydF4y2BaRoseburiagydF4y2Ba提示该底物(和/或糖缀合物中的低聚物)可能的觅食,因此代谢相互作用gydF4y2BaRoseburiagydF4y2Ba与粘液溶解的HGM成员。为了评估可能的交叉喂养机制,我们进行了比较gydF4y2BaRoseburiagydF4y2Ba使用或不使用模型粘蛋白降解剂对粘蛋白的生长gydF4y2BaAkkermansia muciniphilagydF4y2BaDSM 22959gydF4y2Ba32gydF4y2Ba.gydF4y2Ba
共同文化gydF4y2Bar . hominisgydF4y2Ba而且gydF4y2Bar . inulinivoransgydF4y2Ba24小时内黏蛋白混合物没有生长,48小时后生长缓慢(补充图)。gydF4y2Ba8 a、bgydF4y2Ba),与之相反gydF4y2Ba答:muciniphilagydF4y2Ba在24小时内生长良好。两者的共同文化gydF4y2BaRoseburiagydF4y2Ba物种和gydF4y2Ba答:muciniphilagydF4y2Ba增长到明显更高gydF4y2BaODgydF4y2Ba600gydF4y2Ba比gydF4y2Ba答:muciniphilagydF4y2Ba独自一人(gydF4y2BapgydF4y2Ba< 3.7 × 10gydF4y2Ba−6gydF4y2Ba24小时,gydF4y2BapgydF4y2Ba< 1.3 × 10gydF4y2Ba−3gydF4y2Ba48小时)(补充图。gydF4y2Ba8gydF4y2Ba).的成长gydF4y2BaRoseburiagydF4y2Ba在共培养上清液中丁酸盐水平比gydF4y2BaRoseburiagydF4y2Ba单独(24小时)。48小时后,丁酸盐浓度也在仅含有丁酸盐的培养物中略有增加gydF4y2BaRoseburiagydF4y2Ba与增长数据一致(补充图。gydF4y2Ba8 cgydF4y2Ba).gydF4y2Ba
来揭开基础gydF4y2BaRoseburiagydF4y2Ba生长,蛋白质组gydF4y2Bar . hominisgydF4y2Ba而且gydF4y2Bar . inulinivoransgydF4y2Ba与葡萄糖共培养的gydF4y2BaRoseburiagydF4y2Ba而且gydF4y2Ba答:muciniphilagydF4y2Ba生长在黏液上。为gydF4y2Bar . hominisgydF4y2Ba而且gydF4y2Bar . inulinivoransgydF4y2Ba, 31和93个蛋白,包括几个CAZymes显著上调(loggydF4y2Ba2gydF4y2Ba相对于葡萄糖共培养的> 2)的折叠变化。转运蛋白gydF4y2BaRhgydF4y2BaLNBBP和gydF4y2BaRhgydF4y2BaGLnbp112从gydF4y2Bar . hominisgydF4y2BaHMO位点(图;gydF4y2Ba1 fgydF4y2Ba)是前6名gydF4y2BathgydF4y2Ba和10gydF4y2BathgydF4y2Ba在粘蛋白组中的大多数上调蛋白gydF4y2Bar . hominisgydF4y2Ba,分别表明该位点在对宿主聚糖的交叉取食中的作用(补充图。gydF4y2Ba8 egydF4y2Ba).在gydF4y2Bar . inulinivoransgydF4y2Ba,相应的酶gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba英国石油公司和gydF4y2Ba国际扶轮gydF4y2BaGLnbp112也随log显著上调gydF4y2Ba2gydF4y2Ba折叠变化分别为2.77和4.71。gydF4y2Ba8 egydF4y2Ba).然而,顶部蛋白上调gydF4y2Bar . inulinivoransgydF4y2Ba蛋白质组是ABC转运体的SBP,与编码a -和B-血型裂解内do-β-(1→4)-半乳糖苷酶(gydF4y2Ba国际扶轮gydF4y2BaGH98),推测为GH36的α-半乳糖苷酶和α-半乳糖苷酶gydF4y2BalgydF4y2Ba- focusidase (GH29),这是粘蛋白蛋白质组中第四个上调的蛋白质(补充图。gydF4y2Ba8 fgydF4y2Ba).该位点的上调提示gydF4y2Bar . inulinivoransgydF4y2Ba具有直接接触某些粘蛋白低聚物的功能性机械。我们表达了预测的细胞外gydF4y2Ba国际扶轮gydF4y2BaGH98和证明释放A和B型血低聚物粘蛋白和相关gydF4y2BaOgydF4y2Ba-聚糖(补充图。gydF4y2Ba8 g-hgydF4y2Ba、补充数据gydF4y2Ba1gydF4y2Ba).编码焦点利用途径的基因座的共同上调(补充图。gydF4y2Ba3gydF4y2Ba)是按照聚在一起的寡聚物由gydF4y2Ba国际扶轮gydF4y2BaGH98。另一种觅食途径是唾液酸分解代谢途径的高度上调(补充图)。gydF4y2Ba3 bgydF4y2Ba),这可能会使gydF4y2Bar . inulinivoransgydF4y2Ba在该基底上(图;gydF4y2Ba1 dgydF4y2Ba).的不良生长gydF4y2Bar . inulinivoransgydF4y2Ba对粘蛋白的缺失gydF4y2Ba答:muciniphilagydF4y2Ba提示后一种细菌通过释放唾液酸来实现交叉摄食gydF4y2Bar . inulinivoransgydF4y2Ba缺乏唾液酸酶,这与能力一起gydF4y2Ba国际扶轮gydF4y2BaGH98能够在粘蛋白底物中获得A型血和B型血低聚物,可能在共培养中支持更好的共生长。这些发现与HMO利用机制和额外的功能性操纵子在支持与的共同生长中的作用一致gydF4y2Ba答:muciniphilagydF4y2Ba粘蛋白。gydF4y2Ba
HMO利用位点普遍存在于gydF4y2BaRoseburiagydF4y2Ba
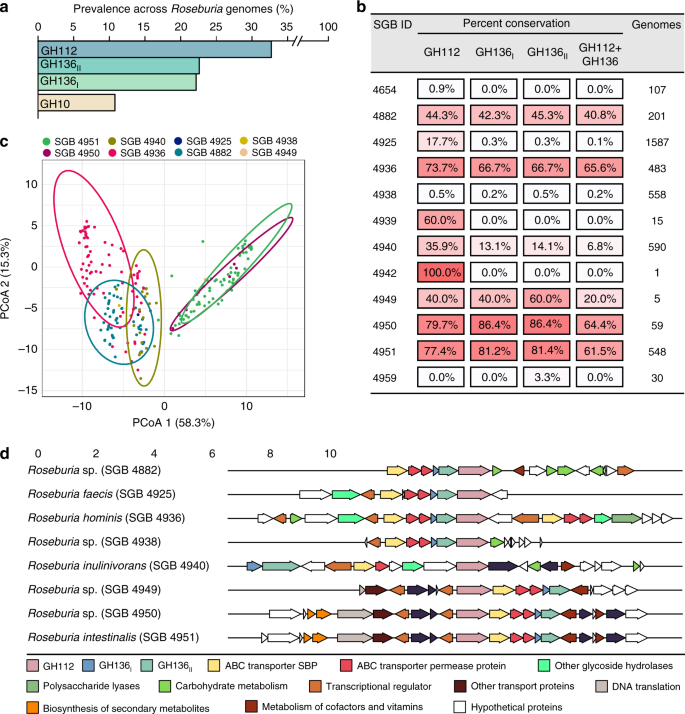
HMO基因座由GH136和GH112基因共同出现定义,在5个位点保守gydF4y2BaRoseburiagydF4y2Ba参考基因组(补充图;gydF4y2Ba1gydF4y2Ba).为了更广泛地研究这些位点的结构和保守性,上述基因的同源物在4599个先前重建的基因中被绘制出来gydF4y2BaRoseburiagydF4y2Ba基因组gydF4y2Ba33gydF4y2Ba.GH10木聚糖酶基因作为中枢分解代谢途径的参考信号,对于木聚糖的利用是必不可少的gydF4y2Bar . intestinalisgydF4y2Ba29gydF4y2Ba,也进行了分析。引人注目的是,GH112和GH136 HMO利用基因比GH10同类基因普遍约2-3倍。gydF4y2Ba5gydF4y2Ba),表明HMO基因座分布较广泛,而木聚糖酶基因座主要保守gydF4y2Bar . intestinalisgydF4y2Ba.的GH136gydF4y2Ba我gydF4y2Ba和GH136gydF4y2Ba2gydF4y2Ba基因的流行率与GH112相似,比GH112低30%左右。当我们分析单个物种水平的基因组仓(SGBs)时,这一总体趋势得到了重申,GH136和GH112基因的共现模式存在一些差异(图5b)。例如,GH112和GH136在gydF4y2Bar . hominisgydF4y2Ba(SGB 4936)中,GH112的流行率是GH136的2.6倍gydF4y2Bar . inulinivoransgydF4y2Ba(SGB 4940)。我们分析了818个位点的组织,这些位点由一个GH112基因和至少一个编码的GH136亚基的存在来定义,具有更严格的阈值(在5个位点中任何一个位点中存在70%的GH112和GH136序列的同一性)gydF4y2BaRoseburiagydF4y2Ba参考基因组,见补充图。gydF4y2Ba1gydF4y2Ba).围绕GH112的基因簇似乎是sgbs特异性的(图。gydF4y2Ba5度gydF4y2Ba),显示该属内基因座的多样性。每个SGB最具代表性的基因上下文分析(图。gydF4y2Ba5 dgydF4y2Ba)显示ABC转运体、GH136和转录调节基因最常与GH112基因同时出现,这提供了一个强有力的信号gydF4y2BaRoseburiagydF4y2BaHMO利用位点(图;gydF4y2Ba5 dgydF4y2Ba),并证实了它们的广泛分布。另外CAZymes和碳水化合物代谢基因也经常同时出现在GH112基因附近,这表明额外的糖基利用能力集中在HMO位点周围。gydF4y2Ba
一个gydF4y2Ba全球大量GH112, GH136gydF4y2Ba我gydF4y2Ba, GH136gydF4y2Ba2gydF4y2Ba4599的GH10木聚糖酶基因gydF4y2BaRoseburiagydF4y2Ba基因组说明了HMO利用装置的广泛存在和保存。gydF4y2BabgydF4y2Ba显示含有gh112的基因组分离的热图gydF4y2Ba一个gydF4y2Ba进入不同的种级基因组仓(SGB),以及每个SGB中HMO利用基因的相对丰度模式。这一数据表明GH136和GH112基因经常同时出现,尽管有些gydF4y2BaRoseburiagydF4y2Ba菌株只编码GNB/LNB降解GH112。gydF4y2BacgydF4y2Ba818的主坐标分析gydF4y2BaRoseburiagydF4y2Ba基因景观严格定义为与GH112和GH136的同源性≥70%gydF4y2BaRoseburiagydF4y2Ba基因组显示在补充图中。gydF4y2Ba1gydF4y2Ba包括GH112上游和下游的10种蛋白质。gydF4y2BadgydF4y2Ba最常出现的基因景观gydF4y2BaRoseburiagydF4y2BaSGB,通过在GH112基因的3 '端对齐来锚定。基因图谱分析提供了至少由一个GH112、一个GH136、一个abc转运体和一个转录调控因子定义的HMO利用位点的签名。gydF4y2Ba
讨论gydF4y2Ba
早期生命HGM组装的扰动与宿主免疫和代谢稳态的终身影响有关gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba.母乳喂养是婴儿期微生物群动态的一个关键影响因素。断奶标志着HGM向成人结构的戏剧性转变,HGM在2-3岁时成熟,并在整个成年期表现出高度的弹性gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba22gydF4y2Ba.gydF4y2Ba
在微生物群成熟之前的关键窗口为治疗干预提供了一个独特的机会,以解决异常的HGM状态,从而预防与生态失调相关的慢性疾病。到目前为止,深入了解婴儿时期微生物群组装的组成转变gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba是可用的,但基础机制,特别是在断奶期间,仍然难以捉摸。在这里,我们描述了以前未知的途径,赋予丁酸生产梭状芽孢杆菌生长在不同的HMO基序和相关的寡聚物从宿主糖缀合物。这些途径可能促进梭状芽孢杆菌的早期竞争性适应优势,这与健康的HGM有关,并与代谢和炎症疾病以及结直肠癌的保护有关gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba34gydF4y2Ba.gydF4y2Ba
我们独特地证明了关键丁酸盐的产生gydF4y2BaRoseburiagydF4y2Ba而且gydF4y2Ba真细菌gydF4y2Basp .生长在从母乳纯化的复杂HMO和定义的HMO基序上(图2)。gydF4y2Ba1模拟gydF4y2Ba).蛋白质组学分析揭示了两个高度上调的遗传位点,编码遥远的同源乳蛋白gydF4y2BaNgydF4y2Ba-biosidase从gydF4y2Bab . longumgydF4y2Ba28gydF4y2Ba,gydF4y2Ba35gydF4y2Ba, GNB/LNB磷酸化酶和ABC转运蛋白gydF4y2Bar . hominisgydF4y2Ba而且gydF4y2Bar . inulinivoransgydF4y2Ba(无花果。gydF4y2Ba1做减法gydF4y2Ba和补充图。gydF4y2Ba1gydF4y2Ba).的gydF4y2Bar . hominisgydF4y2Ba轨迹(无花果。gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba,补充图。gydF4y2Ba5 egydF4y2Ba、补充表格gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4gydF4y2Ba而且gydF4y2Ba5gydF4y2Ba)支持HMO基序LNT和LNB的生长,而gydF4y2Bar . inulinivoransgydF4y2Ba位点使更复杂的hmo生长,例如单聚焦和双聚焦版本的LNT(图2)。gydF4y2Ba2gydF4y2Ba一个和gydF4y2Ba4gydF4y2Ba,补充图。gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba5gydF4y2Ba).专业化的不同,但部分重叠,HMOs和相关刘易斯gydF4y2Baa / bgydF4y2Ba来自糖脂或糖蛋白的抗原低聚物产生差异化竞争性分解代谢生态位。这种专门化从GH136特异性的差异中很明显。因此,gydF4y2BaRhgydF4y2BaLnb136和gydF4y2Ba呃gydF4y2BaLnb136是乳酸gydF4y2BaNgydF4y2Ba-biosidases,而gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba136显示出前所未有的特异性,需要Fuc-α-(1→4)- glcnac在子位点−1,并在−2和+2子位点进行额外的聚焦修饰(图2)。gydF4y2Ba2gydF4y2Ba,补充图。gydF4y2Ba5gydF4y2Ba及补充表gydF4y2Ba4gydF4y2Ba).对聚焦化的偏好与循环缩短导致的开放活性位点一致,(gydF4y2Ba呃gydF4y2BaLnb136:回路1 AA 330-341,回路2 AA 520-543,补充图gydF4y2Ba6摄氏度gydF4y2Ba),允许容纳笨重的聚焦基板。值得注意的是GH136gydF4y2Ba我gydF4y2Ba子单位(或域)gydF4y2Ba呃gydF4y2BaGH136样酶)与GH136共同进化gydF4y2Ba2gydF4y2Ba具有催化残基的对应物(补充图。gydF4y2Ba6 dgydF4y2Ba).gydF4y2Ba
我们的稳定性(补充图gydF4y2Ba4摄氏度gydF4y2Ba),结构(图;gydF4y2Ba3.gydF4y2Ba和补充图。gydF4y2Ba6gydF4y2Ba)、生化(补充图gydF4y2Ba4gydF4y2Ba,补充表gydF4y2Ba4gydF4y2Ba)和系统发育分析(补充图。gydF4y2Ba6 dgydF4y2Ba)肯定了GH136的关键作用gydF4y2Ba我gydF4y2Ba研究人员发现了GH136酶功能的结构域,并为两个GH136结构域的关联提供了有力的证据。GH136序列守恒gydF4y2Ba我gydF4y2Ba和GH136gydF4y2Ba2gydF4y2Ba映射到的结构上gydF4y2Ba呃gydF4y2BaLnb136。引人注目的是,在这两个区域都发现了高度保守的斑块(补充图。gydF4y2Ba6 egydF4y2Ba).特别是α4-α5环和α5螺旋的部分gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba大量地堆积在gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba的互补共守恒区域显示全局守恒残馀gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba(补充图。gydF4y2Ba6 egydF4y2Ba).此外,表面的gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba是带正电和极性的gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba,这与酶的其余部分表面的负电位明显不同(补充图。gydF4y2Ba6 fgydF4y2Ba的界面表面相辅相成gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba.这些结果强调了GH136亚基或结构域的共同进化。gydF4y2Ba
ABC转运蛋白在两种双歧杆菌中都是摄取选择性和竞争力的决定因素gydF4y2Ba17gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba36gydF4y2Ba而且gydF4y2Bar . intestinalisgydF4y2Ba29gydF4y2Ba.ABC进口商的两个sbp位于HMO位点gydF4y2Bar . hominisgydF4y2Ba而且gydF4y2Bar . inulinivoransgydF4y2Ba均位于每个蛋白质组中响应HMO利用的前5个上调蛋白之列(图。gydF4y2Ba1gydF4y2Ba),强调了寡糖转运在竞争性肠道生态位中的关键作用。由这些基因座编码的sps和GHs的偏好似乎是一致的,以实现对首选底物的有效摄取和随后的分解代谢(图2)。gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba,补充图。gydF4y2Ba5gydF4y2Ba、补充表格gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba而且gydF4y2Ba5gydF4y2Ba).GH112的LNB/GNB磷酸化酶也保存在HMO位点中(补充图。gydF4y2Ba1gydF4y2Ba).gydF4y2Bar . inulinivoransgydF4y2Ba具有额外的CAZymes,特别是不同的聚焦酶降解内化聚焦寡聚物(补充图。gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba5罪犯gydF4y2Ba).基于蛋白质组学分析和生物化学数据,我们提出了HMOs在体内摄取和解聚的两种不同途径的模型gydF4y2BaRoseburiagydF4y2Ba而且gydF4y2Ba真细菌gydF4y2Ba(无花果。gydF4y2Ba6gydF4y2Ba和补充图。gydF4y2Ba9gydF4y2Ba).gydF4y2Ba
在gydF4y2Bar . hominisgydF4y2Ba, LNT, LNB和黏蛋白衍生的GNB被捕获gydF4y2BaRhgydF4y2BaLNBBP被吸收到细胞质中,随后LNT被水解为LNB。LNB和GNB都被gydF4y2BaRhgydF4y2BaGLnbp112变成α-gydF4y2BadgydF4y2Ba-半乳糖-1-磷酸和相应的gydF4y2BaNgydF4y2Ba-乙酰己糖胺GlcNAc和GalNAc。乳糖可能被典型的β-半乳糖苷酶水解。在gydF4y2Bar . inulinivoransgydF4y2Ba, HMOs的初始水解或gydF4y2BaOgydF4y2Ba来自糖脂/蛋白质的-聚糖在细胞外表面通过gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba136,它有两个c端半乳糖结合域。退化产品的进口是由gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Babp相关ABC转运蛋白。的协同活动移除Focusyl装饰gydF4y2Ba国际扶轮gydF4y2BaFuc95和gydF4y2Ba国际扶轮gydF4y2BaFuc29之前gydF4y2BaRhgydF4y2BaGLnbp112将产生的LNB或输入的GNB磷酸化成单糖,如中所述gydF4y2Bar . hominisgydF4y2Ba.半乳糖和半乳糖-1-磷酸产物通过Leloir途径转化为葡萄糖-6-磷酸和gydF4y2BaNgydF4y2Ba-乙酰己糖胺糖在进入糖酵解之前转化为glcacc -6-磷酸。糖酵解产生的丙酮酸部分转化为丁酸gydF4y2Ba46gydF4y2Ba.gydF4y2BaRoseburiagydF4y2Ba寄居在粘液的外层gydF4y2Ba47gydF4y2Ba在一起gydF4y2Ba答:muciniphiliagydF4y2Ba.gydF4y2Bar . inulinivoransgydF4y2Ba它以唾液酸为交叉饲料,并从粘蛋白和糖脂/蛋白质中获得β-(1→4)-连接血型A和B低聚糖gydF4y2Ba国际扶轮gydF4y2BaGH98。黑色实心箭头表示在本研究中建立或确认的酶促步骤。黑色虚线箭头表示基于文献的步骤。灰色虚线箭头表示丁酸盐的生产gydF4y2Bar . hominisgydF4y2Ba而且gydF4y2Bar . inulinivoransgydF4y2Ba与粘蛋白共培养gydF4y2Ba答:muciniphiliagydF4y2Ba.聚糖结构键如图所示。gydF4y2Ba1gydF4y2Ba.gydF4y2Ba
产生丁酸盐的细菌gydF4y2BaRoseburia-EubacteriumgydF4y2Ba梭状芽孢杆菌属(梭状芽孢杆菌目)是婴儿肠道的早期殖民者gydF4y2Ba6gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba37gydF4y2Ba并且是成人HGM的普遍成员gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba.gydF4y2Ba
这个分类组的起源是谜,但他们的存在在母乳微生物组已被报道gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba.从母本正交转移的基础上鉴定相同gydF4y2BaRoseburiagydF4y2Ba母亲粪便、乳汁和婴儿肠道中的菌株gydF4y2Ba40gydF4y2Ba也被提议。gydF4y2Bar . intestinalisgydF4y2Ba型菌株已从婴儿粪便中分离出来gydF4y2Ba41gydF4y2Ba,暗示了这个分类单元在完全过渡到固体食物之前的存在。gydF4y2Ba
我们先前的研究表明,母乳喂养婴儿肠道中不同双歧杆菌的丰度与高效ABC转运体密切相关,该转运体以高亲和力捕获2 ' -和3 ' -聚焦酰基乳糖hmo (gydF4y2BaKgydF4y2BaDgydF4y2Ba≈5µm)gydF4y2Ba17gydF4y2Ba.具有这些基因的菌株,如来自gydF4y2Ba双歧杆菌longumgydF4y2Ba亚种gydF4y2Ba对象的gydF4y2Ba与擅长利用植物来源的聚糖的对应物相反,在断奶后不被检测到。相比之下,也是一样的gydF4y2Ba梭状芽胞杆菌gydF4y2BaXIVa组具有植物聚糖利用途径的菌株gydF4y2Ba29gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba43gydF4y2Ba保留HMO分解代谢途径。的同时生长gydF4y2Bar . hominisgydF4y2Ba对LNT和谷物衍生的木糖四糖(补充图。gydF4y2Ba2 a - cgydF4y2Ba)证明了这种分解代谢的可塑性,这可能会在断奶期间带来额外的竞争优势,此时主要的焦酰基乳糖专一化gydF4y2Ba双歧杆菌属gydF4y2Ba社区因零星供应健康护理人员而崩溃。gydF4y2Ba
靶向HMOs的位点也介导粘蛋白或其他糖缀合寡聚物的交叉摄食,例如来自粘蛋白和血液抗原结构的GNB,两者都被高效捕获gydF4y2BaRoseburiagydF4y2Ba转运蛋白(图;gydF4y2Ba4gydF4y2Ba、补充表格gydF4y2Ba2gydF4y2Ba而且gydF4y2Ba3.gydF4y2Ba).这与在共培养中测量的显著丁酸盐生产是一致的gydF4y2BaRoseburiagydF4y2Ba而且gydF4y2Ba答:muciniphilagydF4y2Ba32gydF4y2Ba(补充图。gydF4y2Ba8 cgydF4y2Ba)以及粘蛋白共培养和HMO单培养中含有gh136位点的上调(图。gydF4y2Ba1gydF4y2Ba和补充图。gydF4y2Ba8 egydF4y2Ba).gydF4y2Bar . inulinivoransgydF4y2Ba具有广泛的粘液溶解机制,通过上调焦点和唾液酸分解代谢位点(补充图。gydF4y2Ba3.gydF4y2Ba)以及a型血和B型血的基因座(补充图。gydF4y2Ba8做减法gydF4y2Ba、补充数据gydF4y2Ba1gydF4y2Ba),从而释放肠细胞表面粘蛋白和糖脂中发现的β-(1→4)-连接血型低聚物gydF4y2Ba44gydF4y2Ba,gydF4y2Ba45gydF4y2Ba.这种从粘蛋白和宿主糖缀合物中获取碳水化合物的能力支持了营养紊乱期间的生长,这可能会增加这个分类组的恢复力。gydF4y2Ba
我们的生物信息分析gydF4y2BaRoseburiagydF4y2Ba基因组表明HMO的利用似乎是一个核心特征gydF4y2BaRoseburiagydF4y2Ba基于GH112和GH136基因位点的普遍存在(图。gydF4y2Ba5gydF4y2Ba).仅拥有GH112基因的SGB的发生(例如SGB 4939,图。gydF4y2Ba5 bgydF4y2Ba)表明不同的菌株是二级降解者,它们以释放的简单底物(如LNB和GNB)为交叉食源。相比之下,GH112和GH136基因的同时出现(图。gydF4y2Ba5 bgydF4y2Ba)提供了能够从HMOs或宿主糖缀合物中获得更复杂聚糖的主要降解物的特征。gydF4y2Ba
综上所述,本研究为理解早期生命微生物群中生理重要核心群的组装机制奠定了基础,并揭示了HMOs在梭状芽孢杆菌选择中的未知作用。需要更多的研究来进一步解决最重要的,但对早期生命微生物群的成熟知之甚少。gydF4y2Ba
方法gydF4y2Ba
化学物质和碳水化合物gydF4y2Ba
表中描述了本研究中使用的人乳和血液抗原寡糖gydF4y2BaS1gydF4y2Ba.gydF4y2BaNgydF4y2Ba-乙酰神经氨酸(Neu5Ac) α-gydF4y2BadgydF4y2Ba-半乳糖-1-磷酸(Gal1P)和α-gydF4y2BalgydF4y2Ba- focal (Fuc)来自Carbosynth, xylotetraose来自Megazyme。半乳糖,葡萄糖,gydF4y2BaNgydF4y2Ba乙酰氨基葡萄糖(GlcNAc),gydF4y2BaNgydF4y2Ba-乙酰半乳糖胺(GalNAc)和猪胃黏蛋白III型(PGM)来自Sigma Aldrich。牛颌下黏蛋白(BSM)来源于VWR。2-氨基邻氨基苯甲酸(2-AA)来自Nacalai Tesque,汇集的人乳样本来自Hvidøvre医院(丹麦Hvidøvre)。除非另有说明,所有化学品均为分析级。gydF4y2Ba
LNB和GNB的酶促生产gydF4y2Ba
用GH112半乳糖酶促生长LNB和GNBgydF4y2BaNgydF4y2Ba乙糖/奶-gydF4y2BaNgydF4y2Ba-biose磷酸化酶(EC 2.4.1.211)gydF4y2Bar . hominisgydF4y2Ba(gydF4y2BaRhgydF4y2BaGLnbp112)。具体来说,100mm的Gal1P与300mm对应gydF4y2BaNgydF4y2Ba-乙酰己糖胺(GlcNAc或GalNac)在50 mM MES, 150 mM NaCl, pH 6.5中与10µM孵育gydF4y2BaRhgydF4y2BaGLnbp112在30°C下加热36小时。孵育后,加入2.5体积(99%)冰水乙醇,-20℃孵育2 h,离心(10000 ×gydF4y2BaggydF4y2Ba, 30分钟,在4°C),以去除酶。通过旋转蒸发对上清液进行浓缩,双糖在超纯水(milliQ)中使用HiPrep脱盐柱(GE Healthcare,丹麦)在Äkta avant色谱仪上脱盐(GE Healthcare)。通过测量监测洗脱gydF4y2Ba一个gydF4y2Ba235海里gydF4y2Ba然后将混合的部分冷冻干燥。进一步纯化通过高效液相色谱(HPLC) (UltiMate 3000, Dionex)完成,使用TSKgel®Amide 80柱(4.6 × 250 mm)和TSKgel®Amide 80保护柱(4.6 × 10 mm) (VWR),装载溶解在流动相(75% (v/v)乙腈,ACN)中的LNB或GNB,并在1ml min等容洗脱gydF4y2Ba−1gydF4y2Ba.采用5 mM标准的GalNAc、GlcNAc、Gal1P和LNB/GNB薄层色谱法(TLC)分析收集部分(2 mL)的纯度。将含有纯LNB/GNB的馏分混合,通过快速真空蒸发去除ACN,并将样品冻干,直到进一步使用。gydF4y2Ba
人乳低聚糖的纯化gydF4y2Ba
hmo是从汇集的人乳样本中纯化出来的gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba.乳脂分离采用离心(10000 ×gydF4y2BaggydF4y2Ba在4°C下,30 min),通过乙醇沉淀去除蛋白质(如上)。用旋转蒸发法上清液浓缩,用2体积100 mM MES、300 mM NaCl、pH 6.5进行缓冲,用ß-半乳糖苷酶消化乳糖gydF4y2BaKluyvermomyces lactisgydF4y2Ba(Sigma Aldrich) (20 U mLgydF4y2Ba−1gydF4y2Ba, 37°C下3 h)。酶用乙醇沉淀(与之前一样),上清液用旋转蒸发浓缩。使用12 mL石墨化Supelclean™env - carb™柱(Supelco),床重为1 g,固相萃取(SPE)去除残留的乳糖和单糖。对于固相萃取,柱用含有0.05% (w/v)甲酸(FA)的80% (v/v) ACN激活,用缓冲液A (4% (v/v) ACN, 0.05% (w/v) FA)平衡,在加载前也用缓冲液稀释样品。样品加载后,洗涤柱(缓冲液A的6柱体积)以去除乳糖和单糖,然后用40% (v/v) ACN和0.05% (w/v) FA洗脱低聚糖。洗脱后的寡糖在快速真空浓缩器中浓缩,冷冻干燥,使用前用milliQ溶解。gydF4y2Ba
HMOs纯度在ICS-5000 (Dionex)系统上通过高性能阴离子交换色谱法与脉冲安培检测(HPAEC-PAD)验证,该系统具有3 × 250 mm CarboPac PA200柱(Theromofisher), 3 × 50 mm CarboPac保护柱(Theromofisher)和10µL注射。HMOs用醋酸钠逐级线性梯度洗脱:0-50 mM为0-7.5 min, 50-150 mM为7.5-25 min, 150-400 mM为25-35 min,流速为0.35 mL mingydF4y2Ba−1gydF4y2Ba流动相为恒定0.1 mM NaOH。使用标准(0.01-0.5 mM)的乳糖,半乳糖和葡萄糖(milliQ)来定量这些残留糖如上所述。进行了三次重复分析,这些糖的残留含量<纯化HMO混合物的2% (w/w)。gydF4y2Ba
猪粘蛋白的分离纯化gydF4y2Ba
进一步纯化了市售猪胃黏蛋白(PGM)gydF4y2Ba50gydF4y2Ba.简而言之,20 g PGM在25°C下在20 mM磷酸盐缓冲液中搅拌20小时,100 mM NaCl, pH 7.8(在前2小时后使用2 M NaOH调整为pH 7.2)。离心去除不溶性残留(10000 ×gydF4y2BaggydF4y2Ba可溶性粘蛋白加入3体积的冰冷乙醇(99%),在4℃孵育18 h后沉淀。用分子量为50 kDa的切断膜(Spectra, VWR)在4°C下以200体积milliQ透析5次16小时,然后冷冻干燥。gydF4y2Ba
猪结肠粘蛋白是从丹麦皇冠(Horsens,丹麦)屠宰场的五只新鲜猪结肠中分离出来的。猪结肠在现场处理,并立即放置在干冰上,以确保在运输过程中快速冷却。纵向打开结肠,机械去除内容物,用0.9% (w/v) NaCl冰水洗涤,直到看不到食糜。用吸收纸迅速擦干清洗后的腔表面,用钝的金属刮刀刮去粘膜,随后转移到预冷的玻璃烧杯中,去除可见脂肪并丢弃。然后如前所述纯化粘蛋白gydF4y2Ba51gydF4y2Ba.分离出的粘蛋白浸于10体积萃取缓冲液(10mm磷酸钠缓冲液、6m盐酸胍(GuHCl)、5mm乙二胺四乙酸(EDTA)、5mmgydF4y2BaNgydF4y2Ba-乙基马来酰亚胺,pH值6.5),在4°C中轻轻搅拌过夜。可溶性杂质与漂浮脂肪经离心(10000 ×gydF4y2BaggydF4y2Ba(4℃,30 min),将粘蛋白颗粒溶解于10体积萃取缓冲液中,再次室温孵育3 h。如前所述,通过离心去除可溶性杂质。短孵育(3小时)提取步骤重复7次,直到上清液清晰,至少重复提取两次。随后,通过0.1 M Tris、6 M GuHCl、5 mM EDTA、25 mM二硫三糖醇(DTT) pH 8在37℃下还原5小时,然后通过加入65 mM碘乙酰胺进行烷基化,并在黑暗中在4℃下孵育18小时,使不溶性黏蛋白溶解。可溶性黏蛋白用50 kDa MWCO透析袋在4°C下透析6小时,每次透析量为200体积milliQ。gydF4y2Ba
蛋白的克隆、表达及纯化gydF4y2Ba
编码蛋白质的开放阅读帧gydF4y2Bar . hominisgydF4y2BaDSM 16839,gydF4y2Bar . inulinivoransgydF4y2BaDSM 16841和gydF4y2Bae .小枝gydF4y2Ba采用Takara in - fusion克隆技术和表中引物从基因组DNA中克隆DSM 15684,不含信号肽和跨膜结构域gydF4y2BaS8gydF4y2Ba进入相应质粒的EcoRI和Ncol限制位点,编码具有可切割的N-或C-末端His的蛋白质gydF4y2Ba6gydF4y2Ba标签。使用petm11质粒(来自G. Stier, EMBL,生物化学中心,德国海德堡)gydF4y2Ba52gydF4y2Ba,除了gydF4y2BaRHOM_04110gydF4y2Ba(gydF4y2BaRhgydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba),gydF4y2BaROSEINA2194_01899gydF4y2Ba(gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba136gydF4y2Ba我gydF4y2Ba)克隆到pET15b (Novagen)中。重组蛋白在gydF4y2Ba大肠杆菌gydF4y2BaBL21ΔgydF4y2BalacZgydF4y2Ba(DE3)/pRARE2,并使用his亲和层析和尺寸排除层析按照标准方案纯化。突变体的gydF4y2BaE. ramulus HMPREF0373_02965gydF4y2Ba(gydF4y2Ba呃gydF4y2BaLnb136)使用QuickChange II Site-Directed Mutagenesis (Agilent)和pETM11_构建gydF4y2BaHMPREF0373_02965gydF4y2Ba作为模板。用于位点定向突变的引物列于表中gydF4y2BaS8gydF4y2Ba突变体的产生如上所述。gydF4y2BalgydF4y2Ba-硒代蛋氨酸(ʟ-SeMet)标记蛋白的表达gydF4y2Ba呃gydF4y2Ba将相应质粒导入Lnb136gydF4y2Ba大肠杆菌gydF4y2BaB834 (DE3),并将转化细胞培养在SelenoMet标记试剂盒(Molecular Dimensions)的合成M9培养基中gydF4y2BalgydF4y2Ba蛋氨酸或gydF4y2BalgydF4y2Ba-SeMet(均为50µg mLgydF4y2Ba−1gydF4y2Ba).的gydF4y2BalgydF4y2Ba-SeMet标记蛋白如上所述纯化。gydF4y2Ba
生长实验及单品系蛋白质组学分析gydF4y2Ba
r . hominisgydF4y2BaDSM 16839,gydF4y2Bar . inulinivoransgydF4y2BaDSM 16841,gydF4y2Bae .小枝gydF4y2BaDSM 15684和gydF4y2Bae .小枝gydF4y2BaDSM 16296使用Whitley DG250厌氧工作站(Don Whitley Scientific)在37°C厌氧生长。gydF4y2Bar . hominisgydF4y2Ba而且gydF4y2Bar . inulinivoransgydF4y2Ba在YCFA培养基上繁殖gydF4y2Ba41gydF4y2Ba而对于gydF4y2Bae .小枝gydF4y2Ba菌株CFA培养基(改良的YCFA培养基缺乏酵母提取物,以尽量减少gydF4y2Bae .小枝gydF4y2Ba酵母提取物生长)。生长培养基中添加0.5% (w/v)碳水化合物,经过滤(可溶性碳水化合物,0.45 μ m过滤器)或高压灭菌(黏蛋白,在121°C下15分钟)灭菌,除非另有说明,否则至少进行生物三重复培养。通过测量监测细菌生长情况gydF4y2BaODgydF4y2Ba600海里gydF4y2BapH值(用于共培养实验)。对于在微量滴定板中进行的生长实验,使用位于厌氧工作站的Tecan Infinite F50微板读取器(Tecan Group Ltd),生长后进行测量gydF4y2BaODgydF4y2Ba595海里gydF4y2Ba.没有配对的双尾学生gydF4y2BatgydF4y2Ba-检验检验不同培养条件与非碳水化合物对照之间达到的生长水平是否有统计学意义。gydF4y2Ba
对于差异蛋白质组分析,gydF4y2Bar . hominisgydF4y2Ba而且gydF4y2Bar . inulinivoransgydF4y2Ba在200 μ L YCFA (1.5 mL Eppendorf管)中培养至指数期中后期(gydF4y2BaODgydF4y2Ba600gydF4y2Ba~0.5 ~ 0.8), 4个生物重复。为gydF4y2Bar . hominisgydF4y2BaYCFA中添加0.5% (w/v) LNT或葡萄糖gydF4y2Bar . inulinivoransgydF4y2Ba采用1% (w/v) HMOs或葡萄糖作为碳源。采用离心分离法(5000×gydF4y2BaggydF4y2Ba, 4℃下5分钟),用0.9% (w/v) NaCl冰水洗涤两次,重悬在20µL裂解缓冲液中(50 mM HEPES, 6 M GuHCl, 10 mM Tris(2-羧乙基)磷化氢盐酸盐(TCEP), 40 mM 2-氯乙酰胺(CAA) pH 8.5),并保存在−80℃下用于蛋白质组学分析。gydF4y2Ba
共培养实验与蛋白质组学分析gydF4y2Ba
r . hominisgydF4y2Ba,gydF4y2Bar . inulinivoransgydF4y2Ba而且gydF4y2Ba答:muciniphilagydF4y2BaDSM 22959在10 mL YCFA中生长至指数期中后期(gydF4y2BaODgydF4y2Ba600gydF4y2Ba-0.7 ~ 0.6)。从这些预培养中,等量的细胞(gydF4y2BaODgydF4y2Ba600gydF4y2Ba)接种30 mL新鲜YCFA培养基,加入1% (w/v)的黏蛋白混合物(0.6% (w/w) PGM, 0.2% (w/w) PCM, 0.2% (w/w) BSM或1% (w/v)葡萄糖作为起始gydF4y2BaODgydF4y2Ba600gydF4y2Ba~ 0.01。所有培养在4个生物重复中进行,然后进行生长(gydF4y2BaODgydF4y2Ba600gydF4y2Ba和pH)在0、6、8、12、16、24和48 h。16 h后收集样品(2 mL)进行蛋白质组学分析,24和48 h后进行SCFA定量。样品立即在冰上冷却,细胞通过离心(5000 ×gydF4y2BaggydF4y2Ba, 10分钟,在4°C)。对于蛋白质组学,细胞球用0.9% (w/v) NaCl冷洗两次,重悬在60µL裂解缓冲液中,并在−80°C保存,直到蛋白质组学分析。收集的用于SCFA定量的培养上清无菌过滤(0.45 μ m过滤器),并保存在−80°C下供进一步分析。gydF4y2Ba
质谱样品制备gydF4y2Ba
样品使用预先建立的规程进行处理gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba.细胞通过煮沸(5分钟95°C),然后进行珠子敲打(3毫米珠子,30 Hz, 1分钟)(TissueLyser II, Qiagen)和超声浴(3 × 10秒,4°C) (Bioruptor, Diagenode)。裂解液离心(14000 ×gydF4y2BaggydF4y2Ba,在4°C下10分钟)和可溶性蛋白浓度通过Bradford法测定(赛默飞世尔科学公司)。为了消化,20µg蛋白质用50 mM HEPES, 10% (v/v) ACN, pH 8.5 1:3稀释,并与LysC (MS级,Wako)以1:50的比例(LysC:蛋白质)在37℃下孵卵4小时。随后,用50 mM HEPES、10% (v/v) ACN、pH 8.5将样品稀释至1:10,并进一步用胰蛋白酶(MS级,Promega)以1:100的比例在37℃下消化18小时。接下来,用2% (w/v)三氟乙酸(TFA)将样品1:1稀释,以淬灭酶活性,并对多肽进行质谱处理,用于室内包装阶段尖端gydF4y2Ba55gydF4y2Ba如下所述。gydF4y2Ba
从单个菌株培养物中提取的肽用三个C18树脂圆盘包装成200 μ L的尖端进行脱盐,并通过在1800×离心下连续加载40 μ L MeOH和40 μ L 80% (v/v) ACN, 0.1% (w/v) FA来激活gydF4y2BaggydF4y2Ba用40µL 3% (v/v) ACN, 1% (w/v) FA平衡两次,然后按50µL的步骤加载样品。加载后,尖端用100µL 0.1% (w/v) TFA洗涤三次,缩氨酸用40µL 40% (v/v) ACN和0.1% (w/v) FA分两步洗脱到0.5 mL Eppendorf LoBind管中。通过强阳离子交换(SCX)层析过滤塞(3m Empore)对共培养的肽进行脱盐和分离。每个样品,6个SCX圆盘装入200µL尖端,尖端通过加载80µL (v/v) ACN和80µL 0.2% (w/v) TFA来激活和平衡。样品在50µL的步骤中涂抹,尖端用600µL 0.2% (w/v) TFA洗涤两次。随后,用60 μ L 125 mM nhh分3份逐步洗脱多肽gydF4y2Ba4gydF4y2BaOAc, 20% (v/v) ACN, 0.5% (w/v) FA,然后加入60 μ L 225 mM NHgydF4y2Ba4gydF4y2BaOAc, 20% (v/v) ACN, 0.5% (w/v) FA,最后5% (v/v) NHgydF4y2Ba4gydF4y2BaOH, 80% (v/v) ACN注入0.5 mL Eppendorf LoBind管。洗脱肽在Eppendorf Speedvac中干燥(60°C下3小时),在质谱(MS)分析前用2% (v/v) ACN和1% (w/v) TFA重组。gydF4y2Ba
质/女士gydF4y2Ba
通过反相色谱法将每种培养条件下生物三倍体的多肽加载到质谱仪上,通过内联50 cm C18柱(Thermo EasySpray ES803)连接到2 cm长的C18陷阱柱(Thermo Fisher 164705),使用Thermo EasyLc 1000 HPLC系统。在250 nL min下,用4.8-48% (v/v) ACN和0.1% (w/v) FA梯度洗脱肽段gydF4y2Ba−1gydF4y2Ba超过260分钟(来自单一菌株培养的样品)或140分钟(来自共培养的SCX分离样品),并在Q-Exactive仪器(赛默飞世尔科学公司)上以数据依赖的方式使用Top 10方法进行分析。在70000分辨率下采集完整的质谱,AGC目标设置为3 × 10gydF4y2Ba6gydF4y2Ba离子或最大注入时间为20ms。多肽通过高能量碰撞解离(归一化碰撞能= 25)进行裂解。强度阈值设置为1.7 × 10gydF4y2Ba6gydF4y2Ba动态排除60s,排除荷态<2或未知离子。MS/MS谱分辨率为17500,AGC目标值为1 × 10gydF4y2Ba6gydF4y2Ba离子或最大注入时间为60毫秒。扫描范围限制在300-1750 m/z。gydF4y2Ba
细菌共培养中蛋白质无标记定量gydF4y2Ba
Proteome Discoverer 2.2和2.3版本用于处理和分析原始MS数据文件,并在处理和共识步骤中启用无标签量化。单株蛋白质组谱与蛋白质组数据库进行比对gydF4y2Bar . hominisgydF4y2BaDSM 16839 (ID: UP000008178)或gydF4y2Bar . inulinivoransgydF4y2BaDSM 16841 (ID: UP000003561),从Uniprot获得。对共培养实验的光谱进行搜索,以建立一个由两者的参考蛋白组组成的数据库gydF4y2BaRoseburia菌株gydF4y2Ba(如上)和gydF4y2Ba答:muciniphilagydF4y2BaDSM 22959 (id: up000001031)。在光谱搜索中,氧化(M)、脱酰胺(N, Q)和N端乙酰化被指定为动态修饰,半胱氨酸氨基甲基化被设置为静态修饰。得到的结果被过滤到1%的FDR,蛋白质定量是通过使用内置的Minora特征检测器完成的。对于无标签定量数据的分析,如果至少有两个独特的肽(定义在蛋白质组发现者)被识别,蛋白质被认为存在,并且在每个培养条件下分析的三个样本中至少有两个具有高置信度。gydF4y2Ba
共培养的相对细菌丰度是根据Unipept 4.0版本鉴定的菌株独特肽来估计的gydF4y2Ba56gydF4y2Ba.为了从分析中排除密切相关菌株之间共享的肽,所有通过Proteome Discoverer量化的肽序列都被导入到Unipept web服务器中,并根据设置进行分析gydF4y2Ba使I和L相等gydF4y2Ba而且gydF4y2Ba先进的遗漏乳沟处理gydF4y2Ba激活。由此产生的分类学上独特的多肽强度的归一化和然后用于评估每个菌株的相对丰度。gydF4y2Ba
丁酸量化gydF4y2Ba
在Agilent HP 1100系统上,用高效液相色谱法(HPLC)耦合折射率检测器(RID)和二极管阵列检测器(DAD)定量培养上清中的丁酸盐。标准丁酸(0.09-50 mM)在5 mM H中制备gydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba用于峰识别和定量。将20 μ L标准或过滤(0.45 μ M过滤器)培养上清注入7.8 × 300 mm Aminex HPX-87H柱(Biorad),并结合4.6 × 30 mm Cation H保护柱(Biorad),对来自4个生物重复的样品进行分析。在恒定流速0.6 mL min下进行洗脱gydF4y2Ba−1gydF4y2Ba流动相为5mm HgydF4y2Ba2gydF4y2Ba所以gydF4y2Ba4gydF4y2Ba.上述技术标准一式三份进行分析。gydF4y2Ba
低聚糖摄取偏好gydF4y2BaRoseburiagydF4y2Ba仕达屋优先计划gydF4y2Ba
r . hominisgydF4y2Ba在250 μ L的YCFA培养基中,加入0.5% (w/v)等量的木糖和LNT,厌氧培养生物三复制体。分别于0、3.5、5.5、6.5、8、9.5和24 h后取样品(20µL),用100 mM NaOH冰稀释10倍,在5000×离心10 mingydF4y2BaggydF4y2Ba上清液保存于−20℃,直至HPAEC-PAD分析。在100 mM NaOH中制备0.5 mM木糖四糖和LNT标准品,用于色谱图中相应峰的识别。将样品或标准品(2 μ L注射)注射到4 × 250 mm CarboPac PA10色谱柱上,并带4 × 50 mm CarboPac保护柱,并等距洗脱(0.750 mL min)gydF4y2Ba−1gydF4y2Ba, 100mm NaOH, 10mm NaOAc)。分析从生物副本中进行,标准分析在技术副本中进行。gydF4y2Ba
用于确定Le的摄取偏好gydF4y2BabgydF4y2Batetraose,勒gydF4y2Ba一个gydF4y2Ba三糖和H型三糖gydF4y2Bar . inulinivoransgydF4y2Ba在200 μ L YCFA培养基中厌氧生长,并加入等量的1.5 mM LegydF4y2BabgydF4y2Ba四糖,1.5 mM LegydF4y2Ba一个gydF4y2Ba三糖和1.5 mM血型H型三糖I型生物三副本。分别于0、3.5、5.5、6.5、8、9.5、24 h后取样品(10 μ L),用20 mM NaOH冰稀释10倍,在5000×离心10 mingydF4y2BaggydF4y2Ba上清液保存于−20℃,直至HPAEC-PAD分析。标准为0.1 mM LegydF4y2BabgydF4y2Batetraose,勒gydF4y2Ba一个gydF4y2Ba在20mm NaOH中制备I型血三糖和H型血三糖,并在色谱图中识别相应的峰。将样品或标准品(10 μ L注射)注射到4 × 250 mm CarboPac PA10色谱柱上,并带4 × 50 mm CarboPac保护柱,并等距洗脱(0.750 mL min)gydF4y2Ba−1gydF4y2Ba, 50 mM NaOH)。分析从生物副本中进行,标准分析在技术副本中进行。gydF4y2Ba
为了研究混合HMO摄取,gydF4y2Bar . inulinivoransgydF4y2Ba在300 μ L YCFA培养基中厌氧生长,其中0.5% (w/v)从母乳中纯化的混合HMOs或0.5% (w/v)从母乳中纯化的混合HMOs,但之前用gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba136(0.5µmgydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba136, 18h),生物三拷贝。0、24 h后取样品(10µL),用20 mM NaOH冰水稀释10倍,5000×离心10 mingydF4y2BaggydF4y2Ba上清液保存于−20℃,直至HPAEC-PAD分析。标准为0.1 mM LegydF4y2BabgydF4y2Batetraose,勒gydF4y2Ba一个gydF4y2Ba在20 mM NaOH中制备三糖、血H型三糖、LNDFH I、乳糖、2'FL和LNT,并在色谱图中鉴定相应的峰。将样品或标准品(10 μ L注射)注射到4 × 250 mm CarboPac PA200色谱柱上,并带4 × 50 mm CarboPac保护柱,并以等距洗脱(0.350 mL min)gydF4y2Ba−1gydF4y2Ba, 50 mM NaOH)。分析从生物副本中进行,标准分析在技术副本中进行。gydF4y2Ba
酶活性测定gydF4y2Ba
酶活性测定在50 mM MES, 150 mM NaCl, 0.005% (v/v) Triton X-100, pH 6.5标准测定缓冲液中进行,除非另有说明,否则分三次进行。gydF4y2Ba
GH136乳酸水解动力学和比活性的研究gydF4y2BaNgydF4y2Ba-生物苷酶用偶联酶法测定以监测乳糖释放。乳糖水解与ß-半乳糖苷酶(上面使用)和产生的葡萄糖氧化与葡萄糖氧化酶(Sigma Aldrich)伴随HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba通过偶联辣根过氧化物酶(Sigma Aldrich)对4-氨基安替比林和3,5-二氯-2-羟基苯磺酸的氧化来测量。在96孔微量滴定板中制备反应,最终体积为150µL,含底物,乳酸gydF4y2BaNgydF4y2Baß-半乳糖苷酶(150u mLgydF4y2Ba−1gydF4y2Ba),葡萄糖氧化酶(150u mLgydF4y2Ba−1gydF4y2Ba),辣根过氧化物酶(150u mLgydF4y2Ba−1gydF4y2Ba), 10 mM 3,5-二氯-2-羟基苯磺酸,1 mM 4-氨基安替比林在标准测定缓冲液中。反应在37°C和gydF4y2Ba一个gydF4y2Ba515海里gydF4y2Ba测量间隔为5秒,持续30分钟。以乳酸为代用品,制备了空白料gydF4y2BaNgydF4y2Ba-生物苷酶与标准测定缓冲液在反应混合物和乳糖标准(3-500 μ M)用于定量。gydF4y2Ba
水解动力学gydF4y2BaRhgydF4y2BaLnb136 (40 nM)和gydF4y2Ba呃gydF4y2BaLnb136 (10 nM)向LNT (0.2-5 mM)偏移gydF4y2BaRhgydF4y2BaLnb136和0.1-2.5 mMgydF4y2Ba呃gydF4y2BaLnb136)的测定如上所述。动力学参数gydF4y2BaKgydF4y2Ba米gydF4y2Ba而且gydF4y2BakgydF4y2Ba猫gydF4y2Ba,通过使用OriginPro 2018b和OriginPro 2019b (OriginLab)将Michaelis-Menten方程拟合到初始速率数据进行计算。乳gydF4y2BaNgydF4y2Ba-生物苷酶比活性gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba136(1.2µM)用3.5 mM LNT测量,如上所述。比活性以单位(U) mg表示gydF4y2Ba−1gydF4y2Ba酶,单位定义为释放1 μ mol乳糖的酶的量gydF4y2Ba−1gydF4y2Ba如上量化。gydF4y2Ba
具体活动gydF4y2BaRhgydF4y2BaGLnbp112和gydF4y2Ba国际扶轮gydF4y2Ba用50 mM磷酸钠缓冲液,150 mM NaCl, 0.005% (v/v) Triton X-100, pH 6.5对LNB和GNB的GLnbp112进行测定。用20 nM酶和2 mM底物在37℃下反应(150µL) 10 min。每分钟取出15µL的等分液,在135µL 0.2 M NaOH中淬灭。在0.2 M NaOH中制备Gal1P标准品(5 mM─0.02 mM),用于定量测定淬灭反应样品中释放的Gal1P浓度。用3 × 250 mm CarboPac PA200柱(Theromofisher)结合3 × 50 mm CarboPac保护柱(Theromofisher)和10µL注射,用HPAEC-PAD检测淬灭反应和标准物。以0.350 mL min的流速进行洗脱gydF4y2Ba−1gydF4y2Ba流动相为150 mM NaOH和60 mM醋酸钠。比活性以U mg表达gydF4y2Ba−1gydF4y2Ba其中U被定义为释放1 μ moL Gal1P min的酶的量gydF4y2Ba−1gydF4y2Ba.分析在技术上进行了三份。gydF4y2Ba
酶产品简介gydF4y2Ba
酶测定在37°C的标准测定缓冲液中进行16小时,或在磷酸盐版本(而不是MES)中进行GH112酶的独立生物三重复。降解产物通过薄层色谱(TLC)和或基质辅助激光解吸/飞行电离时间质谱(MALDI-TOF/MS)分析如下所示。gydF4y2Ba
薄层色谱法gydF4y2Ba
TLC是通过在硅胶60 F454板(Merck)上标记2µL的酶催化反应进行的,以丁醇:乙醇:毫q水(5:3:2)(v/v)为流动相进行分离,糖用5-甲基间苯二酚:乙醇:硫酸(2:80:10)(v/v)进行观察,热处理除gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba136.后者的薄层色谱在丁醇:乙酸:毫q (2:1:1)(v/v)中进行,用二苯胺-磷酸试剂显影gydF4y2Ba57gydF4y2Ba.TLC分析从两个独立的生物重复进行(每个生物酶反应重复进行一次分析)gydF4y2Ba
MALDI-TOF /女士gydF4y2Ba
的MALDI-TOF/MS分析gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba136 .根据gydF4y2Ba58gydF4y2Ba,在低聚糖过甲基化后gydF4y2Ba59gydF4y2Ba.对于过甲基化,将冻干的低聚糖在200µL无水二甲基亚砜(DMSO)中重建,并与250µL NaOH在DMSO中和150µL碘乙烷混合5分钟。接下来,加入2 mL 5% (w/v)醋酸,然后加入2 mL CHgydF4y2Ba2gydF4y2BaClgydF4y2Ba2gydF4y2Ba.随后,在有机相中提取过甲基化低聚糖,在40°C的氮气流下干燥,然后装载到预平衡的Sep-pak C18粉盒上,用水清洗,85% (v/v)乙腈洗脱。洗脱馏分像以前一样在氮气下干燥,并在−20°C保存,直到进一步使用。酶解反应后,将过甲基化产物干燥,与2,5-二羟基苯甲酸混合,并在MALDI板上斑点。MALFI-TOF/MS分析使用正离子模式下的Bruker Autoflex III智能束流。降解产物gydF4y2BaRhgydF4y2BaLnb136和gydF4y2Ba呃gydF4y2Ba以2,5-二羟基苯甲酸为基质,在正离子线性模式下使用Ultraflex II TOF/TOF (Bruker Daltonics)仪器对Lnb136进行了无初始低聚糖过甲基化分析。质谱峰分析采用Flexanalysis Version 3.3 (Bruker Daltonics)。MALDI-TOF/MS分析从独立的三次重复中进行(每个生物酶反应重复一次分析)。gydF4y2Ba
质gydF4y2Ba2gydF4y2Ba的gydF4y2BaOgydF4y2Ba-聚糖衍生的低聚糖gydF4y2Ba
携带A型血的猪胃黏液的均质制剂PGM (Sigma)被用于分析。每个点总共0.1 mg粘蛋白通过点印迹固定在Immobilon -P PVDF膜上(Immobilon P膜,0.45微米,Millipore, Billerica, MA)。gydF4y2Ba国际扶轮gydF4y2Ba在50µL中将GH98添加到1.5µM的一个dot上,在37°C下孵育1 h和4 h。反应上清液中含有释放的游离寡糖,通过多孔石墨化碳(PGC)颗粒(Thermo Scientific)收集和纯化,颗粒被包装在C18拉链尖(Millipore)上。样品用65% (v/v) ACN在0.5%三氟乙酸(TFA, v/v)中洗脱,干燥,10 μL milliQ重悬,- 20°C冷冻保存,待进一步分析。剩余gydF4y2BaOgydF4y2Ba在30 μL 0.5 M NaBH中孵育后,可还原β-消除dot上的-链接聚糖gydF4y2Ba4gydF4y2Ba在50°C的50 mM NaOH中浸泡16 h,加入1.5 μL冰醋酸淬灭反应。发布的gydF4y2BaOgydF4y2Ba-聚糖脱盐和干燥如上所述gydF4y2Ba60gydF4y2Ba.纯化后的多糖在10 μL milliQ中重悬,并在−20°C保存以供进一步分析。从糖鞘脂中释放低聚糖作为携带B型血(B5-2和B6-2)的模型底物gydF4y2Ba61gydF4y2Ba除单个孵育时间为2小时外,均按上述方法制备。gydF4y2Ba
纯化样品采用10 cm × 250µm I.D.色谱柱进行LC-MS/MS分析,室内填充5µm PGC颗粒。用0-40% ACN线性梯度在10 mM NH中洗脱聚糖gydF4y2Ba4gydF4y2BaHCOgydF4y2Ba3.gydF4y2Ba在10 μ l min超过40分钟gydF4y2Ba−1gydF4y2Ba.的筛选了gydF4y2BaOgydF4y2Ba-聚糖在LTQ质谱仪(Thermo Scientific)负离子模式下进行分析,电喷雾电压为3.5 kV,毛细管电压为−33.0 V,毛细管温度为300℃。空气被用作护套气体,质量范围根据要分析的具体结构来确定。数据处理使用Xcalibur软件(版本2.0.7,Thermo Scientific)。gydF4y2Ba
寡糖结合分析gydF4y2Ba
结合LNT, LNB, GNB, H型I三糖,LegydF4y2Ba一个gydF4y2Ba三糖和勒gydF4y2BabgydF4y2Batetraose来gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba采用表面等离子体共振(SPR;Biacore T100, GE医疗保健)。gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2BaBP,稀释于10 mM NaOAc缓冲液pH 3.75至50µg mLgydF4y2Ba−1gydF4y2Ba使用随机胺偶联试剂盒(GE Healthcare)固定在CM5芯片上,最终芯片密度为3214和4559响应单位(RU)。在流速为30 μ L min的条件下,分析包括90 s的结合阶段和240 s的解离阶段gydF4y2Ba−1gydF4y2Ba.传感图在25°C、20 mM磷酸钠缓冲液、150 mM NaCl、0.005% (v/v) P20 (GE Healthcare)、pH 6.5的条件下记录。实验在LNB 0.3-50µM, GNB 0.78-200µM, Le 0.97-250µM的范围内进行(每个包含一个技术副本)gydF4y2Ba一个gydF4y2Ba, 0.097-100 μ M为LegydF4y2BabgydF4y2BaH型血三糖为1.5 ~ 250µM。的配体指定gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2BaBP,结合进一步测试0.5 mM LNT, LNgydF4y2BangydF4y2BaT,乳糖,血A三糖,2'FL和3'FL。平衡解离常数(gydF4y2BaKgydF4y2BaDgydF4y2Ba),利用Biacore T100数据评估软件,将一个结合位点模型拟合到稳态传感器图中进行计算。gydF4y2Ba
结合LNT, LNB, GNB, LNnT,乳糖和2'FLgydF4y2BaRhgydF4y2BaLNBBP使用Microcal ITC测量gydF4y2Ba200gydF4y2Ba量热计(GE医疗保健)。在25°C下,用gydF4y2BaRhgydF4y2BaLNBBP (0.1 mM)在样品细胞中,1.5 mM配体在10mm磷酸钠缓冲液中,注射器中pH为6.5。第一次注射0.4 μ L,随后注射19次2 μ L配体,间隔180秒。稀释热由缓冲液滴定确定,校正数据使用MicroCal Origin软件v7.0进行分析。为了确定结合热力学,对归一化积分结合等温线拟合了非线性单结合模型。gydF4y2Ba
差示扫描量热法gydF4y2Ba
差示扫描量热法(DSC)分析在蛋白质浓度为1 mg mL时进行gydF4y2Ba−1gydF4y2Ba在20mm磷酸钠缓冲液中,150 mM NaCl, pH 6.5,使用Nano DSC (TA仪器)。在扫描速度为1°C min的情况下,记录从10°C到90°C的热图gydF4y2Ba−1gydF4y2Ba使用缓冲区作为参考。使用NanoAnalyze软件(TA仪器)分析基线校正数据。除非另有说明,DSC分析重复进行。gydF4y2Ba
结晶gydF4y2Ba
晶体的gydF4y2Ba呃gydF4y2BaLnb136蛋白在20°C下使用静滴蒸汽扩散法生长,混合0.5 μ L的10 mg mLgydF4y2Ba−1gydF4y2Ba蛋白质溶液和等体积的贮藏液。天然晶体在20% (w/v) PEG4000、0.1 M柠檬酸钠(pH 5.6)和20%异丙醇储液中生长。semet标记的晶体使用含有20% (w/v) PEG6000、0.1 M Tris-HCl pH 8.5和1m氯化锂的储层溶液生长。晶体在添加20% (v/v)甘油和25 mM LNB的储层溶液中冷冻保护。晶体在100k(- 173.15°C)的氮气流中快速冷却。衍射数据是在SLS X06DA(瑞士光源,瑞士)和高能加速器研究组织(KEK,筑波,日本)的光子工厂在100 K的光束线上收集的。数据采用HKL2000进行处理gydF4y2Ba62gydF4y2Ba和XDSgydF4y2Ba63gydF4y2Ba.使用PHENIX进行初始相位计算、相位改进和自动化模型构建gydF4y2Ba64gydF4y2Ba.利用Coot实现了模型的人工重建和优化gydF4y2Ba65gydF4y2Ba和REFMAC5gydF4y2Ba66gydF4y2Ba.由于semet标记的蛋白质和天然蛋白质的晶体结构几乎相同(Cα原子的均方根偏差= 0.14 Å),我们在结果和讨论中使用了semet标记的蛋白质结构。分子图形使用PyMOL (Schrödinger, LLC,纽约)或UCSF Chimera(加州大学旧金山分校)制备。gydF4y2Ba
生物信息学gydF4y2Ba
SignalP v.4.1gydF4y2Ba67gydF4y2Ba, PSORTb v3.0gydF4y2Ba68gydF4y2Ba, TMHMM v.2.0gydF4y2Ba69gydF4y2Ba用于信号肽和跨膜结构域的预测。InterProgydF4y2Ba70gydF4y2Ba和dbCAN2gydF4y2Ba71gydF4y2Ba被用来分析使用默认设置的革兰氏阳性细菌的模块化组织。使用CD-HIT服务器减少生物序列数据集的冗余(序列标识截断= 0.95)gydF4y2Ba72gydF4y2Ba.使用MAFFT (BLOSUM62)进行蛋白序列比对gydF4y2Ba73gydF4y2Ba.基于邻居连接算法,使用MAFFT服务器构建了系统进化树,并进行了1000次重复的自举。系统发生树被可视化,并使用树镜构建缠结图gydF4y2Ba74gydF4y2Ba.基于PROMALS3D服务器的蛋白质多重(基于结构的)比对,根据氨基酸序列守恒在UCSF Chimera中完成了蛋白质结构的着色gydF4y2Ba75gydF4y2Ba并利用UCSF中的Chimera实现了AL2CO算法gydF4y2Ba76gydF4y2Ba.利用MEME套件web服务器进行氨基酸序列motif的发现和评价gydF4y2Ba77gydF4y2Ba.蛋白质结构比较使用Dali服务器(gydF4y2Bahttp://ekhidna2.biocenter.helsinki.fi/dali/gydF4y2Ba) (midd: 27131377)和分子界面之间gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba我gydF4y2Ba而且gydF4y2Ba呃gydF4y2BaLnb136gydF4y2Ba2gydF4y2Ba通过PDBePISA服务器(gydF4y2Bahttps://www.ebi.ac.uk/pdbe/pisa/gydF4y2Ba).gydF4y2Ba
HMO利用基因编码GH112、GH136的丰度和分布gydF4y2Ba我gydF4y2Ba和GH136gydF4y2Ba2gydF4y2Ba在gydF4y2BaRoseburiagydF4y2Ba通过BLAST搜索从gydF4y2Bar . intestinalisgydF4y2Bal1 - 82,gydF4y2Bar . hominisgydF4y2Baa2 - 183和gydF4y2Bar . inulinivoransgydF4y2BaA2-194对比4599个重建的gydF4y2BaRoseburiagydF4y2Ba基因组,被Pasolli等人归类为42个物种级基因组箱(sbs)。gydF4y2Ba33gydF4y2Ba.的可变性gydF4y2BaRoseburiagydF4y2Ba核木聚糖酶(GH10)的测定也采用相同的方法gydF4y2Bar . intestinalisgydF4y2BaL1-82 (ROSINTL182_06494)。gydF4y2Ba
为了进一步分析,最初的爆炸命中根据与5个保守中的任何一个70%的一致性进行了过滤gydF4y2BaRoseburiagydF4y2Ba参考基因组。此外,gydF4y2BaRoseburiagydF4y2Ba只有当基因组与GH112基因命中并且至少有一个GH136基因亚基时,才会被认为是基因组。由此产生的818个基因组被分配到各自的gydF4y2BaRoseburiagydF4y2Ba基于Pasolli等人的分配。gydF4y2Ba33gydF4y2Ba.检索到的基因组用于分析GH112基因周围的基因格局。RAST服务器gydF4y2Ba78gydF4y2Ba用于基因注释。根据基因的标注和坐标,选取GH112上下游的11个基因进行基因景观分析。沿着每个SGB选择最保守的基因邻域作为每个SGB的代表。主成分分析基于GH112-GH136邻域的结构,考虑基因在基因图谱上的存在或缺失,以及其在基因座上的位置。我们用这个函数gydF4y2BastringdistmatrixgydF4y2Ba用“osa”方法从R开始计算距离矩阵。gydF4y2Ba
量化和统计分析gydF4y2Ba
使用未配对的双尾学生的方法确定统计学上的显著差异gydF4y2BatgydF4y2Ba以及。统计参数,包括n和gydF4y2BapgydF4y2Ba-values,在图形、图例和结果部分中报告或指示。除非另有说明,数据以算术平均值和标准差(SD)表示。gydF4y2Ba
报告总结gydF4y2Ba
有关研究设计的进一步资料,请参阅gydF4y2Ba自然研究报告摘要gydF4y2Ba链接到这篇文章。gydF4y2Ba
数据可用性gydF4y2Ba
质谱蛋白质组学数据已通过PRIDE合作伙伴存储库保存到ProteomeXchange Consortium,数据集标识符为PXD015045。本文报道的原子坐标接入号为PDB: 6KQS (Se-Met) (gydF4y2Bahttps://doi.org/10.2210/pdb6KQS/pdbgydF4y2Ba)和6KQT(本机),参见表gydF4y2BaS6gydF4y2Ba.黏蛋白聚糖谱MS/MS数据汇总见表gydF4y2BaS9gydF4y2Ba原始数据文件可根据要求提供。克隆基因的登录号见补充表gydF4y2Ba8gydF4y2Ba.图中数据gydF4y2Ba1模拟gydF4y2Ba,补充图。gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4摄氏度gydF4y2Ba,gydF4y2Ba5gydF4y2Ba- f和gydF4y2Ba8 a - cgydF4y2Ba作为源数据文件提供,代表性实验的再现性在相应的图例中表示。所有其他数据可根据要求从相应作者处获得。gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
代码的可用性gydF4y2Ba
的gydF4y2BastringdistmatrixgydF4y2Ba功能是r项目的一部分gydF4y2BastringdistgydF4y2Ba软件包,可在GitHub (gydF4y2Bahttps://github.com/markvanderloo/stringdistgydF4y2Ba)gydF4y2Ba源数据gydF4y2Ba提供了这篇论文。gydF4y2Ba
参考文献gydF4y2Ba
克莱门特,J. C.,乌尔塞尔,L. K.,帕弗雷,L. W.和奈特,R.肠道微生物群对人类健康的影响:综合观点。gydF4y2Ba细胞gydF4y2Ba148gydF4y2Ba, 1258-1270(2012)。gydF4y2Ba
Sonnenburg, J. L. & Bäckhed, F.饮食-微生物群相互作用作为人体代谢的调节因子。gydF4y2Ba自然gydF4y2Ba535gydF4y2Ba, 56-64(2016)。gydF4y2Ba
贝尔凯德,Y.和汉德,T. W.微生物群在免疫和炎症中的作用。gydF4y2Ba细胞gydF4y2Ba157gydF4y2Ba, 121-141(2014)。gydF4y2Ba
Bokulich, n.a.等人。抗生素、出生方式和饮食决定了生命早期微生物群的成熟。gydF4y2Ba科学。Transl。地中海。gydF4y2Ba8gydF4y2Ba, 343ra82(2016)。gydF4y2Ba
Yassour, M.等。生命最初几个月母婴细菌传播的菌株水平分析。gydF4y2Ba细胞宿主微生物gydF4y2Ba24gydF4y2Ba, 146 - 154。e4(2018)。gydF4y2Ba
Bäckhed, F.等。生命第一年人类肠道微生物群的动态和稳定。gydF4y2Ba细胞宿主微生物gydF4y2Ba17gydF4y2Ba, 690-703(2015)。gydF4y2Ba
斯图尔特,C. J.等。TEDDY研究中儿童早期肠道微生物群的时间发展。gydF4y2Ba自然gydF4y2Ba562gydF4y2Ba, 583-588(2018)。gydF4y2Ba
Yatsunenko, T.等。不同年龄和地理位置的人类肠道微生物组。gydF4y2Ba自然gydF4y2Ba486gydF4y2Ba, 222-227(2012)。gydF4y2Ba
罗伯逊,R. C., Manges, A. R., Finlay, B. B. & Prendergast, A. J.人类微生物群和儿童生长-最初1000天及以后。gydF4y2BaMicrobiol趋势。gydF4y2Ba27gydF4y2Ba, 131-147(2019)。gydF4y2Ba
考克斯,L. M.等。在关键的发育窗口期改变肠道菌群会产生持久的代谢后果。gydF4y2Ba细胞gydF4y2Ba158gydF4y2Ba, 705-721(2014)。gydF4y2Ba
考克斯,L. M. &布拉泽,M. J.抗生素在生命早期与肥胖。gydF4y2Ba内分泌。gydF4y2Ba11gydF4y2Ba, 182-190(2015)。gydF4y2Ba
Tamburini, S., Shen, N., Wu, H. C. & Clemente, J. C.早期生命中的微生物群:对健康结果的影响。gydF4y2BaNat,地中海。gydF4y2Ba22gydF4y2Ba, 713-722(2016)。gydF4y2Ba
Marchesi, J. R.等。肠道菌群和宿主健康:一个新的临床前沿。gydF4y2Ba肠道gydF4y2Ba65gydF4y2Ba, 330-339(2016)。gydF4y2Ba
沃格特,n.m.等人。阿尔茨海默病中肠道微生物组的改变。gydF4y2Ba科学。代表。gydF4y2Ba7gydF4y2Ba, 13537(2017)。gydF4y2Ba
Koropatkin, n.m., Cameron, E. A. & Martens, E. C.糖代谢如何塑造人体肠道菌群。gydF4y2BaNat. Rev.微生物。gydF4y2Ba10gydF4y2Ba, 323-335(2012)。gydF4y2Ba
Gotoh, A, Ojima, M. N. & Katayama, T.少数物种影响微生物群的形成:双歧杆菌与细胞外糖苷酶在母乳喂养婴儿肠道双歧杆菌菌群形成中的作用。gydF4y2Ba活细胞。Biotechnol。gydF4y2Ba12gydF4y2Ba, 259-264(2019)。gydF4y2Ba
Sakanaka, M.等。聚焦乳糖摄取系统的进化适应支持双歧杆菌-婴儿共生。gydF4y2Ba科学。睡觉。gydF4y2Ba5gydF4y2Ba, eaaw7696(2019)。gydF4y2Ba
Norin, E., Midtvedt, T. & Björkstén, B.爱沙尼亚和瑞典婴儿出生第一年粪便短链脂肪酸模式的发展。gydF4y2Ba活细胞。生态。健康说。gydF4y2Ba16gydF4y2Ba, 8-12(2004)。gydF4y2Ba
Furusawa, Y.等人。共生微生物来源的丁酸盐诱导结肠调节性T细胞分化。gydF4y2Ba自然gydF4y2Ba504gydF4y2Ba, 446-450(2013)。gydF4y2Ba
细菌丁酸盐可以预防动脉粥样硬化。gydF4y2BaMicrobiol Nat。gydF4y2Ba3.gydF4y2Ba, 1332-1333(2018)。gydF4y2Ba
卡纳尼,R. B.等。丁酸盐在肠道和肠外疾病中的潜在有益作用。gydF4y2Ba世界J.胃肠醇。gydF4y2Ba17gydF4y2Ba, 1519-1528(2011)。gydF4y2Ba
Arumugam等人。人类肠道微生物群的肠型。gydF4y2Ba自然gydF4y2Ba473gydF4y2Ba, 174-180(2011)。gydF4y2Ba
路易斯,P. &弗林特,H. J.多样性,代谢和微生物生态从人类大肠产生丁酸盐细菌。gydF4y2Ba《。列托人。gydF4y2Ba294gydF4y2Ba, 1-8(2009)。gydF4y2Ba
卡尔森,F. H.等。症状性动脉粥样硬化与肠道宏基因组改变有关。gydF4y2BaCommun Nat。gydF4y2Ba3.gydF4y2Ba, 1245(2012)。gydF4y2Ba
勒夏特列,等人。人体肠道微生物丰富度与代谢标志物相关。gydF4y2Ba自然gydF4y2Ba500gydF4y2Ba, 541-546(2013)。gydF4y2Ba
王,J.等。2型糖尿病患者肠道菌群宏基因组范围的关联研究。gydF4y2Ba自然gydF4y2Ba490gydF4y2Ba, 55-60(2012)。gydF4y2Ba
Vital, M. Karch, A. & Pieper, D. H.人类结肠丁酸盐产生群落:使用组学数据的概述。gydF4y2BamSystems。gydF4y2Ba2gydF4y2Ba, e00130-17,(2017)。gydF4y2Ba
山田,C.等。母乳喂养的婴儿与人类肠道微生物组长双歧杆菌共生进化的分子洞察。gydF4y2Ba细胞化学。医学杂志。gydF4y2Ba24gydF4y2Ba, 515 - 524。e5(2017)。gydF4y2Ba
Leth, M. L.等。不同的细菌捕获和运输偏好促进了膳食木聚糖在人类肠道中的共同生长。gydF4y2BaMicrobiol Nat。gydF4y2Ba3.gydF4y2Ba, 570-580(2018)。gydF4y2Ba
维博格,A. H.等人。长双歧杆菌3个糖苷水解酶家族42 β-半乳糖苷酶的底物特异性。婴儿ATCC 15697。gydF4y2Ba糖生物学gydF4y2Ba24gydF4y2Ba, 208-216(2014)。gydF4y2Ba
Theilmann, m.c, Fredslund, F., Svensson, B., Lo Leggio, L. & Abou Hachem, M. ABC输入物的基质偏好对应于动物双歧杆菌β-(1,6)-半乳糖苷的选择性生长。lactis。gydF4y2Ba生物。化学。gydF4y2Ba294gydF4y2Ba, 11701-11711(2019)。gydF4y2Ba
Derrien, M., Vaughan, E. E., Plugge, C. M. & de Vos, W. M. Akkermansia phila gen. nov., sp. nov.,一种人类肠道黏液降解细菌。gydF4y2BaInt。j .系统。另一个星球。Microbiol。gydF4y2Ba54gydF4y2Ba, 1469-1476(2004)。gydF4y2Ba
Pasolli, E.等人。从跨越年龄、地理和生活方式的宏基因组中,超过150,000个基因组揭示了广泛的未开发的人类微生物组多样性。gydF4y2Ba细胞gydF4y2Ba176gydF4y2Ba, 649 - 662。e20.(2019).
王,T.等。结直肠癌患者与健康志愿者肠道菌群的结构分离gydF4y2BaISME J。gydF4y2Ba6gydF4y2Ba, 320-329(2012)。gydF4y2Ba
樱山,H.等。长双歧杆菌亚种长双歧杆菌基因编码的乳酸- n -生物苷酶具有独特的底物特异性,其活性表达需要特定的伴侣。gydF4y2Ba生物。化学。gydF4y2Ba288gydF4y2Ba, 25194-25206(2013)。gydF4y2Ba
埃比,M.等。动物双歧杆菌亚种ABC转运体的两个结合蛋白。乳酸ATCC27673对β-甘露聚糖具有明显的甘露寡糖结合特征。gydF4y2Ba摩尔。Microbiol。gydF4y2Ba112gydF4y2Ba, 114-130(2019)。gydF4y2Ba
Kostic, a.d.等人。人类婴儿肠道微生物群在1型糖尿病发展和进展中的动态。gydF4y2Ba细胞宿主微生物gydF4y2Ba17gydF4y2Ba, 260-273(2015)。gydF4y2Ba
Jost, T., Lacroix, C., Braegger, C. & Chassard, C.使用培养依赖和培养独立方法评估母乳中的细菌多样性。gydF4y2BaBr。j .减轻。gydF4y2Ba110gydF4y2Ba, 1253-1262(2013)。gydF4y2Ba
Collado, m.c, Delgado, S., Maldonado, A. & Rodríguez, J. M.健康女性母乳细菌多样性的实时定量PCR评估。gydF4y2Ba列托人。达成。Microbiol。gydF4y2Ba48gydF4y2Ba, 523-528(2009)。gydF4y2Ba
Jost, T., Lacroix, C., Braegger, C. P., Rochat, F. & Chassard, C.通过母乳喂养母体肠道细菌的垂直母婴转移。gydF4y2Ba环绕。Microbiol。gydF4y2Ba16gydF4y2Ba, 2891-2904(2014)。gydF4y2Ba
Duncan, S. H., Hold, G. L., Barcenilla, A., Stewart, C. S. & Flint, H. J. Roseburia nestiinalis sp. nov.,一种从人类粪便中提取的新型糖化、产生丁酸盐的细菌。gydF4y2BaInt。j .系统。另一个星球。Microbiol。gydF4y2Ba52gydF4y2Ba, 1615-1620(2002)。gydF4y2Ba
La Rosa, s.l.等。人肠道Roseburia厚壁菌是膳食β-甘露聚糖的主要降解物。gydF4y2BaCommun Nat。gydF4y2Ba10gydF4y2Ba, 905(2019)。gydF4y2Ba
斯科特,K. P.,马丁,J. C.,邓肯,S. H.和弗林特,H. J.益生元刺激人类结肠产生丁酸盐的细菌和双歧杆菌,在体外。gydF4y2Ba《。生态。gydF4y2Ba87gydF4y2Ba, 30-40(2014)。gydF4y2Ba
Rossez, Y.等。几乎所有的人胃粘液蛋白o -聚糖都含有A、B或H血型抗原,是幽门螺杆菌的潜在结合位点。gydF4y2Ba糖生物学gydF4y2Ba22gydF4y2Ba, 1193-1206(2012)。gydF4y2Ba
霍格松,约瓦尔,Å。人大肠的糖鞘脂:详细的结构表征,特别参考血型化合物和细菌受体结构。gydF4y2Ba学生物化学j。gydF4y2Ba110gydF4y2Ba, 120-131(1991)。gydF4y2Ba
Anand, S., Kaur, H. & Mande, s.s .肠道共生生物和病原体丁酸盐生产途径的硅分析比较。gydF4y2Ba前面。Microbiol。gydF4y2Ba7gydF4y2Ba, 1945(2016)。gydF4y2Ba
Van Den Abbeele, P.等人。产丁酸梭菌簇XIVa物种在体外肠道模型中特异性定植粘蛋白。gydF4y2BaISME J。gydF4y2Ba7gydF4y2Ba, 949-961(2013)。gydF4y2Ba
王志强,王志强,王志强,等。固相萃取分离牛奶低聚糖的研究。gydF4y2Ba方法gydF4y2Ba2gydF4y2Ba, 9-15(2009)。gydF4y2Ba
Robinson R. C., Colet, E., Tian, T., Poulsen, N. A. & Barile, D.一种通过石墨化碳固相萃取纯化牛奶低聚糖的改进方法。gydF4y2BaInt。乳制品J。gydF4y2Ba80gydF4y2Ba, 62-68(2018)。gydF4y2Ba
米勒,R. S.和霍斯金斯,L. C.人类结肠生态系统中的粘蛋白降解:通过“最可能数”方法估计粘蛋白降解细菌的粪便种群密度。gydF4y2Ba胃肠病学gydF4y2Ba81gydF4y2Ba, 759-765(1981)。gydF4y2Ba
斯库格,e.c.等。人胃粘蛋白对幽门螺杆菌增殖、基因表达和与宿主细胞的相互作用有不同的调节作用。gydF4y2Ba《公共科学图书馆•综合》gydF4y2Ba7gydF4y2Ba, e36378(2012)。gydF4y2Ba
Dümmler, A.,劳伦斯,a.m.。使用模组化载体检测大肠杆菌中表达的可溶性融合结构的简化筛选。gydF4y2Ba活细胞。细胞的事实。gydF4y2Ba4gydF4y2Ba, 34(2005)。gydF4y2Ba
Kulak, N. A., Pichler, G., Paron, I., Nagaraj, N. & Mann, M.最小,封装蛋白质组学样本处理应用于真核细胞拷贝数估计。gydF4y2BaNat方法。gydF4y2Ba11gydF4y2Ba, 319-324(2014)。gydF4y2Ba
埃比,M.等。ATP结合盒转运蛋白介导双歧杆菌对α-(1,6)连接的膳食寡糖的摄取,并与这些底物上的竞争性生长相关。gydF4y2Ba生物。化学。gydF4y2Ba291gydF4y2Ba, 20220-20231(2016)。gydF4y2Ba
Rappsilber, J., Mann, M. & Ishihama, Y.使用StageTips进行蛋白质组学肽的微纯化、富集、预分离和存储的协议。gydF4y2BaProtoc Nat。gydF4y2Ba2gydF4y2Ba, 1896-1906(2007)。gydF4y2Ba
Gurdeep Singh, R.等人。Unipept 4.0:元蛋白组数据的功能分析。gydF4y2BaJ.蛋白质组。gydF4y2Ba18gydF4y2Ba, 606-615(2019)。gydF4y2Ba
安德森,K.,李,s . c。&李,Y.-T。二苯胺-苯胺-磷酸试剂,用于在薄层色谱板上显示糖缀合物的通用喷雾试剂。gydF4y2Ba分析的物化学。gydF4y2Ba287gydF4y2Ba, 337-339(2000)。gydF4y2Ba
Sugiyama, Y.等。利用高效的1,2-α- l -集中合成酶将h抗原引入糖蛋白的低聚糖和糖链。gydF4y2Ba糖生物学gydF4y2Ba26gydF4y2Ba, 1235-1247(2016)。gydF4y2Ba
Anumula, K. R. & Taylor, P. B.从糖蛋白碳水化合物制备部分甲基化糖糖醇乙酸酯的综合程序。gydF4y2Ba分析的物化学。gydF4y2Ba203gydF4y2Ba, 101-108(1992)。gydF4y2Ba
Karlsson N. G., Schulz, B. L. & Packer, N. H.用负离子lc -电喷雾- msn测定中性o -链寡糖糖醇的结构。gydF4y2Baj。Soc。质量范围。gydF4y2Ba15gydF4y2Ba, 659-672(2004)。gydF4y2Ba
Ångström, J.等。在霍乱毒素和大肠杆菌不热肠毒素B亚基的杂交中识别A和B血型决定因素的新碳水化合物结合位点。gydF4y2Ba生物。化学。gydF4y2Ba275gydF4y2Ba, 3231-3238(2000)。gydF4y2Ba
Otwinowski, Z. & Minor, W.振荡模式下x射线衍射数据的处理。gydF4y2BaEnzymol方法。gydF4y2Ba276gydF4y2Ba, 307-326(1997)。gydF4y2Ba
Kabsch, W. XDS。gydF4y2BaActa Crystallogr。D.生物学。Crystallogr。gydF4y2Ba66gydF4y2Ba, 125-132(2010)。gydF4y2Ba
亚当斯,P. D.等。PHENIX:构建自动化晶体结构测定的新软件。《晶体学报D节:生物晶体学》,第58卷,1948-1954(国际晶体学联合会,2002)。gydF4y2Ba
Emsley, P., Lohkamp, B., Scott, W. G. & Cowtan, K.白骨顶的特征与发育。gydF4y2BaActa Crystallogr。D.生物学。Crystallogr。gydF4y2Ba66gydF4y2Ba, 486-501(2010)。gydF4y2Ba
穆舒多夫,G. N., Vagin, A. A. & Dodson, E. J.用最大似然方法优化大分子结构。gydF4y2BaActa Crystallogr。教派D:生物学。Crystallogr。gydF4y2Ba53gydF4y2Ba, 240-255(1997)。gydF4y2Ba
用signaIP预测分泌蛋白。在gydF4y2Ba分子生物学方法gydF4y2Ba,卷1611,59-73 (Humana出版社,纽约,2017)。gydF4y2Ba
Yu, n.y.等人。PSORTb 3.0:改进了蛋白质亚细胞定位预测,改进了定位子类别和所有原核生物的预测能力。gydF4y2Ba生物信息学gydF4y2Ba26gydF4y2Ba, 1608-1615 (2010)gydF4y2Ba
Krogh, A., Larsson, B., Von Heijne, G. & Sonnhammer, E. L.用隐马尔可夫模型预测跨膜蛋白拓扑结构:在全基因组中的应用。gydF4y2BaJ. Mol.生物学。gydF4y2Ba305gydF4y2Ba, 567-580(2001)。gydF4y2Ba
米切尔,A. L.等。2019年的InterPro:改善蛋白质序列注释的覆盖面、分类和可访问性。gydF4y2Ba核酸测定。gydF4y2Ba47gydF4y2Ba, d351-d360(2019)。gydF4y2Ba
张,H.等。DbCAN2:碳水化合物活性酶自动注释的元服务器。gydF4y2Ba核酸测定。gydF4y2Ba46gydF4y2Ba, w95-w101(2018)。gydF4y2Ba
黄勇,牛斌,高勇,付林,李伟。CD-HIT套件:一个用于聚类和比较生物序列的网络服务器。gydF4y2Ba生物信息学gydF4y2Ba26gydF4y2Ba, 680-682(2010)。gydF4y2Ba
Katoh, K., Rozewicki, J. & Yamada, K. D. MAFFT在线服务:多序列比对,交互式序列选择和可视化。gydF4y2Ba简短。BioinformgydF4y2Ba.gydF4y2Bahttps://doi.org/10.1093/bib/bbx108gydF4y2Ba(2017)gydF4y2Ba
胡森,D. H.等。树镜:大型系统发育树的交互式查看器。gydF4y2BaBMC Bioinforma。gydF4y2Ba8gydF4y2Ba, 460(2007)。gydF4y2Ba
Pei, J., Kim, B. H. & Grishin, N. V. PROMALS3D:用于多种蛋白质序列和结构比对的工具。gydF4y2Ba核酸测定。gydF4y2Ba36gydF4y2Ba, 2295-2300(2008)。gydF4y2Ba
裴,J. & Grishin, N. V. AL2CO:蛋白质序列比对中位置守恒的计算。gydF4y2Ba生物信息学gydF4y2Ba17gydF4y2Ba, 700-712(2001)。gydF4y2Ba
贝利,T.等。MEME SUITE: motif发现和搜索的工具。gydF4y2Ba核酸测定。gydF4y2Ba37gydF4y2Ba,(2009)。gydF4y2Ba
阿齐兹,R. K.等。RAST服务器:使用子系统技术的快速注释。gydF4y2BaBMC基因组学gydF4y2Ba9gydF4y2Ba, 75(2008)。gydF4y2Ba
确认gydF4y2Ba
我们要感谢原田绫香博士和森田美纪博士,以及光子工厂的工作人员。我们也要感谢Tina Johansen在执行丁酸盐定量的HPLC测量中提供的技术帮助。感谢Takatoshi Arakawa博士管理x晶体学结构数据。感谢Fumihiko Sato和Kentro Ifuku对MALDI-TOF/MS分析的技术支持。我们也感谢Tine Rask Licht教授使用微孔板阅读器进行一些生长实验。我们感谢Dr. in spe Pernille Neve Myers关于早期生命微生物群的分类转变的讨论。本研究由丹麦技术大学(Kgs. Lyngby, Denmark)的硕士博士津贴资助。一个dditional funding was from a PhD scholarship from the Iraqi Ministry of Education to B.S. and Novo Nordisk Foundation- Copenhagen Bioscience PhD Program (grant NNF16CC0020896) supported C.A.S. Carlsberg Foundation is acknowledged for an ITC instrument grant (2011-01-0598) and DSC instrument grant (2013-01-0112). Additional funding is from the Swiss Light Source (grant numbers: 20181219 & 20181299) for the X-ray data collection and from the Swedish Research Council for funding the Swedish infrastructure for biological mass spectrometry (BioMS) used for the glycomics analysis.
作者信息gydF4y2Ba
作者及隶属关系gydF4y2Ba
贡献gydF4y2Ba
蛋白质组学分析用M.J.P.和E.S.进行,蛋白质特征用M.J.P.和M.L.L.进行gydF4y2Ba国际扶轮gydF4y2Ba勒gydF4y2Baa / bgydF4y2Ba第136章由a.g.,To.K执行。, M.S.和Ta.K。黏蛋白制备由B.S.和M.J.P.完成,黏蛋白糖组学由B.S.、C.J.和N.G.K.完成,蛋白质x射线晶体学由C.Y.和S.F.完成,宏基因组分析由c.a.和M.A.完成,实验由M.J.P和M.A.H.设计。论文由M.J.P和M.A.H起草,最终定稿由所有作者共同贡献。gydF4y2Ba
相应的作者gydF4y2Ba
道德声明gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明没有利益竞争。gydF4y2Ba
额外的信息gydF4y2Ba
同行评审信息gydF4y2Ba自然通讯gydF4y2Ba感谢Josef Voglmeir和另一位匿名审稿人对这项工作的同行评审所做的贡献。gydF4y2Ba
出版商的注意gydF4y2Ba施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。gydF4y2Ba
补充信息gydF4y2Ba
源数据gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),允许以任何媒介或格式使用、分享、改编、分发和复制,只要您对原作者和来源给予适当的署名,提供知识共享许可协议的链接,并注明是否有更改。本文中的图像或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果内容未包含在文章的创作共用许可协议中,并且您的预期使用不被法定法规所允许或超出了允许的使用范围,您将需要直接获得版权所有者的许可。要查看此许可证的副本,请访问gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba.gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
皮切勒,M.J.,山田,C.,舒克,B.。gydF4y2Baet al。gydF4y2Ba产生丁酸的结肠梭状芽孢杆菌代谢人乳低聚糖,并通过保守途径交叉饲喂粘蛋白。gydF4y2BaNat CommungydF4y2Ba11gydF4y2Ba, 3285(2020)。https://doi.org/10.1038/s41467-020-17075-xgydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1038/s41467-020-17075-xgydF4y2Ba
这篇文章被引用gydF4y2Ba
在单一人群队列中宿主遗传和饮食对人类肠道微生物群和偶发疾病的联合影响gydF4y2Ba
自然遗传学gydF4y2Ba(2022)gydF4y2Ba
肠道菌群与健康儿童在生命头两年的小肠细胞旁通透性和免疫系统的发育有关gydF4y2Ba
转化医学杂志gydF4y2Ba(2021)gydF4y2Ba
营养的金标准:回顾母乳寡糖及其对婴儿肠道菌群的影响gydF4y2Ba
微生物细胞工厂gydF4y2Ba(2021)gydF4y2Ba
评论gydF4y2Ba
通过提交评论,您同意遵守我们的gydF4y2Ba条款gydF4y2Ba而且gydF4y2Ba社区指导原则gydF4y2Ba.如果您发现一些滥用或不符合我们的条款或指导方针,请标记为不适当。gydF4y2Ba