摘要
严重急性呼吸综合征2型冠状病毒(SARS-CoV-2)是正在进行的2019冠状病毒病(COVID-19)大流行的病原体。除了对SARS-CoV-2的病毒学研究外,了解COVID-19临床表现背后的基本生理和免疫过程对于确定和合理设计有效的治疗方法至关重要。在这里,我们概述了SARS-CoV-2感染的病理生理学。我们描述了SARS-CoV-2与免疫系统的相互作用,以及随后功能失调的免疫反应对疾病进展的贡献。从描述SARS-CoV-2的初步报告中,我们根据其他针对下呼吸道的人类冠状病毒——严重急性呼吸综合征冠状病毒(SARS-CoV)和中东呼吸综合征冠状病毒(MERS-CoV)的平行病理生理和免疫学特征进行了推断。最后,我们强调了这些方法对针对病毒感染和/或免疫调节的潜在治疗干预的影响。
简介
2019冠状病毒病(COVID-19)的首批病例可能是2019年12月在中国发生的人畜共患病传播,与一个大型海鲜市场有关,该市场也交易活的野生动物。致病病毒,严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)能够人际传播,并迅速传播到中国其他地区,然后传播到其他地区。截至2020年3月24日,SARS-CoV-2已在195个国家/地区感染了38.1万多人,造成1.6万多人死亡:世界卫生组织宣布为大流行1.许多国家/地区每天都有新病例数量急剧上升的报告,但由于缺乏对SARS-CoV-2感染的几个重要方面的知识,从病原体生物学到宿主反应和治疗方案,克服病毒的努力受到了阻碍。因此,迫切需要更好地了解COVID-19的宿主-病原体生物学,因为这将为疾病的治疗和管理提供重要见解,包括确定新的治疗方法。在这里,我们回顾了关于SARS-CoV-2病理生理学、其与靶细胞的相互作用以及对病毒的免疫反应的文献,包括功能失调的免疫反应对疾病进展的贡献。具体而言,我们强调了感染的特定特征对有希望的治疗干预措施的影响,这些干预措施可以针对病毒或功能失调的免疫反应。此外,我们还讨论了如何专注于适应性免疫反应的研究将在疫苗和治疗性单克隆抗体的开发中发挥关键作用。
COVID-19的发病机制
冠状病毒已知会在人和动物中引起疾病。其中四种(人类冠状病毒229E、NL63、OC43和HKU1)通常只感染上呼吸道,症状相对较轻2.然而,有三种冠状病毒(严重急性呼吸综合征冠状病毒(SARS-CoV)、中东呼吸综合征冠状病毒(MERS-CoV)和SARS-CoV-2)可以在下呼吸道复制并引起肺炎,这可能是致命的。SARS-CoV-2属于乙型冠状病毒属。它在人类冠状病毒中最接近的亲戚是SARS-CoV,遗传相似性为79%3..然而,在所有已知的冠状病毒序列中,SARS-CoV-2与蝙蝠冠状病毒RaTG13最相似,相似度为98%4,和穿山甲(一种有鳞食蚁兽)的冠状病毒序列也有很高的相似性5.
与其他呼吸道冠状病毒一样,SARS-CoV-2主要通过呼吸道飞沫传播,有一种可能的但未经证实的粪-口传播途径。感染时,潜伏期中位数约为出现症状前4-5天6,7,8,997.5%的有症状患者在11.5天内出现症状8.在入院时,COVID-19患者通常表现为发烧和干咳;不太常见的是,患者还会出现呼吸困难、肌肉和/或关节疼痛、头痛/头晕、腹泻、恶心和咳血6,10,11,12,13,14,15.在症状出现后5-6天内,SARS-CoV-2病毒载量达到峰值,明显早于相关SARS-CoV病毒载量在症状出现后10天左右达到峰值16,17,18,19.重症COVID-19病例在出现症状后平均约8-9天发展为急性呼吸窘迫综合征(ARDS)11,20..
SARS-CoV-2感染的病理生理学与SARS-CoV感染非常相似,侵袭性炎症反应与由此造成的气道损伤密切相关21.因此,患者的疾病严重程度不仅取决于病毒感染,还取决于宿主的反应。随着年龄增长而加重的模式也与SARS-CoV和MERS-CoV的流行病学基本一致6,11,14.
重症COVID-19急性呼吸窘迫综合征以呼吸困难和低血氧水平为特征22.因此,一些患者可能会继发细菌和真菌感染14.ARDS可能直接导致呼吸衰竭,这是70%的COVID-19致命病例的死亡原因22.此外,免疫系统为应对病毒感染和/或继发感染而大量释放细胞因子,可导致细胞因子风暴和败血症症状,28%的COVID-19致命病例是败血症死亡的原因22.在这些病例中,不受控制的炎症会造成多器官损伤,导致器官衰竭,尤其是心脏、肝脏和肾脏系统(图2)。1).大多数SARS-CoV感染患者进展为肾功能衰竭,最终死亡23.
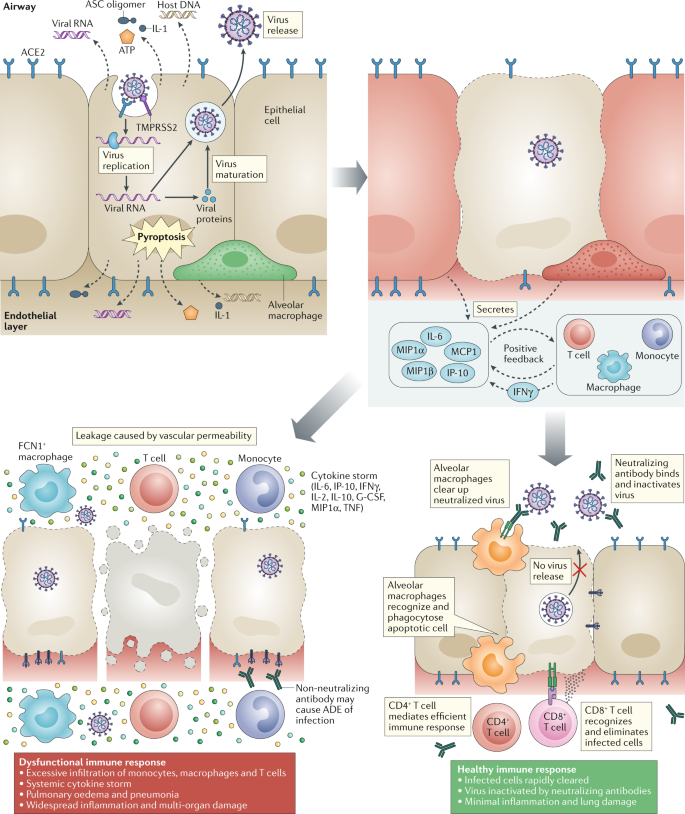
当严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)感染表达表面受体血管紧张素转换酶2 (ACE2)和TMPRSS2的细胞时,病毒的主动复制和释放导致宿主细胞发生热衰竭,并释放与损伤相关的分子模式,包括ATP、核酸和ASC低聚物。这些细胞被邻近的上皮细胞、内皮细胞和肺泡巨噬细胞识别,触发促炎细胞因子和趋化因子的生成(包括IL-6、IP-10、巨噬细胞炎症蛋白1α (MIP1α)、MIP1β和MCP1)。这些蛋白质吸引单核细胞、巨噬细胞和T细胞到感染部位,促进进一步的炎症(加上T细胞产生的IFNγ),并建立促炎反馈回路。在有缺陷的免疫反应(左侧)中,这可能导致免疫细胞在肺部进一步积聚,导致促炎细胞因子的过度产生,最终破坏肺部基础设施。由此产生的细胞因子风暴循环到其他器官,导致多器官损伤。此外,B细胞产生的非中和性抗体可能通过抗体依赖增强(ADE)增强SARS-CoV-2感染,进一步加剧器官损伤。或者,在健康的免疫反应中(右侧),初始炎症会吸引病毒特异性T细胞到感染部位,在那里它们可以在病毒扩散之前消灭被感染的细胞。这些个体的中和抗体可以阻断病毒感染,肺泡巨噬细胞识别中和病毒和凋亡细胞,并通过吞噬作用清除它们。总之,这些过程导致病毒的清除和最小的肺损伤,从而恢复。G-CSF,粒细胞集落刺激因子; TNF, tumour necrosis factor.
宿主细胞感染及其预防
感染的第一步是病毒通过目标受体与宿主细胞结合。早期对SARS-CoV的研究表明,该病毒主要针对呼吸道上皮细胞、肺泡上皮细胞、血管内皮细胞和肺中的巨噬细胞,这些细胞都表达SARS-CoV使用的血管紧张素转换酶2 (ACE2)宿主靶受体24,25,26(无花果。2).由于SARS-CoV-2使用相同的进入受体,这些细胞亚群可能是这种病毒的目标4,27,28.SARS-CoV感染降低了肺细胞ACE2的表达。由于肺ACE2功能丧失与急性肺损伤相关,病毒诱导的ACE2下调可能对疾病病理有重要意义29,30.,31,32.ACE2已被证明可以调节肾素-血管紧张素系统(RAS)。32.因此,病毒感染后ACE2功能降低可能导致RAS功能障碍,从而影响血压和液体/电解质平衡,并增强气道炎症和血管通透性。
COVID-19在男性(2.8%)和女性(1.7%)之间的病死率存在差异33.作为ACE2该病毒位于X染色体上,可能存在对COVID-19具有抗性的等位基因,这就解释了女性致死率较低的原因。另外,雌激素和睾酮性激素具有不同的免疫调节功能,这可能会影响免疫保护或疾病严重程度34.
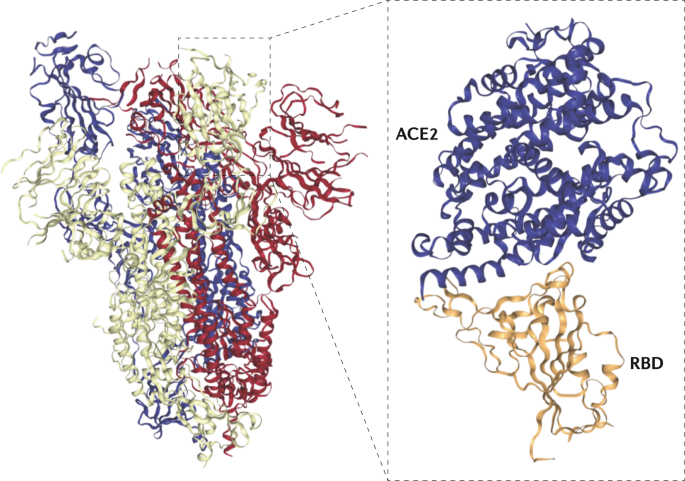
SARS-CoV-2与SARS-CoV的基因组序列相同79%4.刺突(S)蛋白在病毒颗粒表面表达,呈现特有的“冠状”外观。S蛋白由两个亚基组成:S1和S2。S1亚基由一个氨基末端结构域和一个受体结合结构域(RBD)组成,在SARS-CoV中,其范围从氨基酸残基318到氨基酸残基510(参考文献)35,36,37).RBD结合到ACE2作为它的宿主细胞目标受体,开始感染过程4.RBD与ACE2结合触发SARS-CoV-2病毒粒子的内吞作用,并使其暴露于内体蛋白酶38.S2亚基由一个融合肽(FP)区域和两个七磷酸重复区域:HR1和HR2(参考文献)39,40).在核内体内,S1亚基被剥离,露出融合肽,插入宿主膜。然后S2区域自身折叠,将HR1和HR2区域结合在一起。这导致膜融合,并释放病毒包进入宿主细胞质。
SARS-CoV和SARS-CoV-2的rbd氨基酸序列相似性达72%,三级结构高度相似。计算模型和生物物理测量表明,SARS-CoV-2 RBD与ACE2的结合比SARS-CoV具有更高的亲和力41,42.此外,SARS-CoV-2 S蛋白含有一个类似于MERS-CoV和人冠状病毒OC43的呋喃样裂解位点,这在SARS-CoV中没有发现43.这些特征可能导致SARS-CoV-2相对于SARS-CoV的传染性增加。除了糠醛预裂解外,细胞丝氨酸蛋白酶TMPRSS2也需要正确处理SARS-CoV-2刺突蛋白并促进宿主细胞进入44.
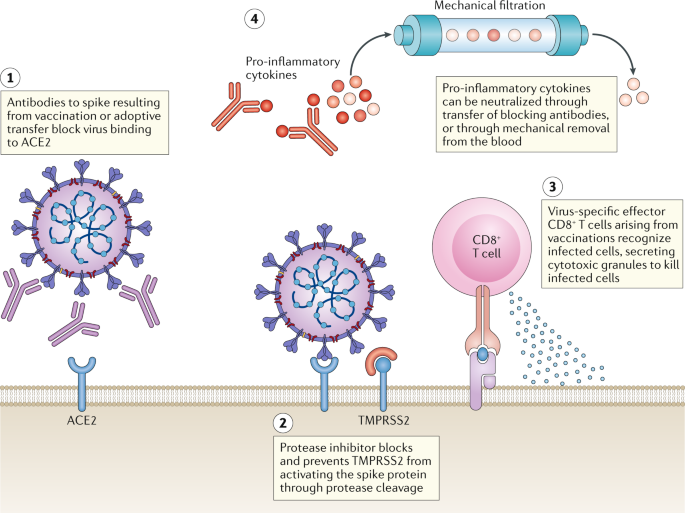
开发抗SARS-CoV-2治疗方法的一种途径是阻断宿主靶标ACE2受体或TMPRSS2(图2)。3.).目前,针对这些分子的化合物已被临床批准用于其他适应症。例如,机器学习算法预测,被批准用于治疗类风湿性关节炎的Janus激酶(JAK)抑制剂baricitinib可以抑制ace2介导的内吞作用45.另一种JAK抑制剂ruxolitinib将于今年晚些时候在治疗COVID-19的临床试验中进行测试46.另一种替代策略是提供高浓度的可溶形式的ACE2,这可能会减少病毒进入目标宿主细胞。APN01是APEIRON公司开发的一种重组形式的ACE2,目前正在进行临床试验47.针对S蛋白的单克隆抗体也可以抑制病毒进入或融合,并在题为B细胞免疫的部分中进一步讨论。Nafamostat甲磺酸48,49还有甲磺酸卡莫司他44是已知的TMPRSS2抑制剂,目前在一些国家/地区被批准用于治疗其他疾病。虽然在撰写本文时,还没有专门针对COVID-19测试这些药物的临床试验,但当对从患者身上分离出的SARS-CoV-2进行甲磺酸卡莫司他测试时,它阻止了病毒进入肺细胞44,50.如果这种方法得到验证,快速重新利用这些药物将在抗击COVID-19中有效和及时。
(1针对刺突蛋白的抗体(通过接种疫苗或过继转移获得)可以阻止严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)与宿主细胞上的血管紧张素转换酶2 (ACE2)受体相互作用。(2)针对丝氨酸蛋白酶TMPRSS2的蛋白酶抑制剂可以防止刺突蛋白裂解,这是病毒融合到宿主细胞所必需的。阻断ACE2相互作用或病毒融合都可以阻止病毒感染宿主细胞。(3.)病毒特异性记忆CD8+来自先前接种疫苗或感染的T细胞可以在再感染过程中分化为效应细胞。当它们识别出呈现病毒特异性表位的感染细胞时,它们会在感染细胞产生成熟病毒粒子之前将其脱粒并杀死。(4在一种针对细胞因子风暴症状的新治疗方法中,2019冠状病毒疾病(COVID-19)患者的血液可以通过专门设计用于捕获促炎细胞因子的定制柱,然后再将纯化的血液输送回患者体内。
炎症免疫发病机理
SARS-CoV-2感染和肺细胞的破坏引发局部免疫反应,招募巨噬细胞和单核细胞,对感染做出反应,释放细胞因子并启动适应性T和B细胞免疫反应。在大多数情况下,这个过程能够解决感染。然而,在某些情况下,出现功能失调的免疫反应,可导致严重的肺部甚至全身病理。
细胞病变病毒,包括SARS-CoV-2(参考文献;51),引起病毒感染细胞和组织的死亡和损伤,这是病毒复制周期的一部分。病毒在气道上皮细胞中的感染和复制52会导致高水平的病毒相关焦缩和相关的血管渗漏,就像在sars冠状病毒患者中看到的那样53.焦亡是程序性细胞死亡的一种高度炎症形式,常见于细胞病变病毒54.这可能是随后炎症反应的一个触发因素55.IL-1β是一种重要的细胞因子,在死亡过程中释放,在SARS-CoV-2感染期间会升高11.通过使用各种模式识别受体(PRRs),肺泡上皮细胞和肺泡巨噬细胞检测释放的病原体相关分子模式(PAMPs),如病毒RNA,和损伤相关分子模式(DAMPs),包括ATP, DNA和ASC低聚物。随之而来的是一波局部炎症,包括促炎细胞因子和趋化因子IL-6、IFNγ、MCP1和IP-10在患者血液中的分泌增加11,22.这些细胞因子是辅助T细胞1 (TH1)细胞极化反应,与SARS-CoV和MERS-CoV的观察结果相似56.这种细胞因子和趋化因子的分泌吸引免疫细胞,特别是单核细胞和T淋巴细胞,而不是中性粒细胞,从血液进入感染部位57,58.免疫细胞从血液中的肺募集和淋巴细胞浸润到气道中,可能解释了约80%的SARS-CoV-2感染患者的淋巴细胞减少和中性粒细胞-淋巴细胞比例升高6,59.
在大多数个体中,招募的细胞清除了肺部的感染,免疫反应减弱,患者康复。然而,在一些患者中,出现功能失调的免疫反应,引发细胞因子风暴,介导广泛的肺部炎症。据观察,需要住院重症监护的COVID-19重症患者血浆中IL-2、IL-7、IL-10、粒细胞集落刺激因子(G-CSF)、IP-10、MCP1、巨噬细胞炎症蛋白1α (MIP1α)和肿瘤坏死因子(TNF)水平较高。11.随着时间的推移,这些患者的IL-6水平持续升高,非幸存者的IL-6水平相对高于幸存者60.值得注意的是,存在高度炎性单核细胞来源的FCN1+COVID-19重症非轻症患者支气管肺泡灌洗液中的巨噬细胞数量(参考文献)。61).此外,严重疾病患者的CD14比例明显更高+CD16+轻症患者外周血炎性单核细胞明显高于轻症患者62.这些细胞分泌炎性细胞因子,有助于细胞因子风暴,包括MCP1, IP-10和MIP1α(图1)。1).
SARS-CoV-2破坏人体固有抗病毒细胞因子反应的机制尚有待研究,但对SARS-CoV的研究表明,多种病毒结构蛋白和非结构蛋白可拮抗干扰素反应。拮抗作用发生在干扰素信号通路的各个阶段,包括通过阻止PRR识别病毒RNA63,64,65通过TBK1/核因子-κB激酶亚基-ε (IKKε)抑制剂,TRAF3和IRF3(参考文献)阻止PRR信号通路63,66),通过阻止下游干扰素信号通过STAT1(参考。67)并通过促进宿主mRNA降解和抑制宿主蛋白质翻译68.很可能至少其中一些途径在SARS-CoV-2中是保守的。干扰素反应的拮抗有助于病毒复制,导致焦上产物释放增加,可进一步诱导异常炎症反应。
无节制的炎症细胞浸润除了病毒造成的直接损伤外,自身还可通过蛋白酶和活性氧的过度分泌介导肺损伤。这些共同导致弥漫性肺泡损伤,包括肺泡细胞脱屑、透明膜形成和肺水肿57,58.这限制了肺内气体交换的效率,导致呼吸困难和低血氧水平。肺部也变得更容易受到继发感染。
除了局部损伤,细胞因子风暴还会对全身产生连锁反应。TNF等细胞因子水平升高可引起感染性休克和多器官衰竭。这些可能导致心肌损伤和循环衰竭在一些患者中观察到69.老年人(60岁以上)和有共同疾病的人更有可能产生这种功能失调的免疫反应,导致病理,也不能成功地根除病原体。具体原因尚不清楚,但其中一个原因可能是肺微环境老化导致树突细胞成熟和向淋巴器官迁移的改变70,从而导致T细胞活化缺陷。相比之下,尽管儿童能够经历高病毒滴度,但往往不会发展成严重的疾病71.在18岁以下的所有年龄组中,50%以上的儿童出现轻度症状或无症状,只有不到6%的儿童出现严重症状72.因此,虽然上述研究代表了重要的进展,但在一些患者中,导致严重炎症反应发展的关键宿主免疫因子的全貌仍然不清楚。
目前仍有争议的是,病毒的持续存在是否是造成持续损害的必要条件。呼吸道样本中病毒滴度的峰值甚至可能出现在SARS-CoV和SARS-CoV-2感染肺炎症状出现之前17,19.然而,一项大型回顾性队列研究表明,在死亡之前,病毒RNA在非幸存者中均可检测到,这表明病毒持久性与疾病预后不良之间存在相关性60.由于病毒RNA即使在活动性感染后也可能残留,并不能代表病毒的传染性,疾病结果不佳是否直接由于大量的感染性颗粒,目前尚不确定。此外,早期对SARS-CoV的研究发现,该病毒除了感染肺细胞外,还可能感染其他目标。值得注意的是,在T淋巴细胞中发现了病毒73、巨噬细胞74,75,76以及单核细胞衍生的树突状细胞77.病毒直接杀伤淋巴细胞可导致患者淋巴细胞减少73.病毒感染免疫细胞,如单核细胞和巨噬细胞,即使病毒感染不产生细胞因子,也会导致细胞因子的异常产生74,75,76,77.SARS-CoV-2针对这些细胞的程度仍然不清楚。了解免疫功能障碍的确切驱动因素对于指导适当的免疫调节治疗的应用至关重要。
几种旨在限制COVID-19免疫介导损伤的免疫抑制疗法处于不同的发展阶段,列在表中1.目前,用于治疗COVID-19的皮质类固醇试验正在进行中78,尽管在2003年SARS流行期间不建议使用这类治疗方法79,80.IL-6拮抗剂tocilizumab的临床试验也在进行中,以测试其疗效81sarilumab也在研究中82.其他临床试验也在测试靶向粒细胞-巨噬细胞集落刺激因子(GM-CSF)的效果,包括gimsilumab的使用83, lenzilumab84和namilumab85.另一种新的辅助疗法是细胞吸收剂86它通过吸收广泛的细胞因子、DAMPs和PAMPs来降低它们的循环水平并改善免疫病理。沙利度胺是一种具有免疫调节特性的药物,也已成功应用于一名COVID-19患者(参考文献)。87).因此,现在已经开始了两项临床试验,以测试其减少肺损伤的潜力88,89.在SARS-CoV感染的背景下,TNF拮抗作用被建议,但尚未进行测试,而且尚未在COVID-19患者中进行测试(参考文献)。90).一项小型开放标签非随机研究表明,羟氯喹(一种已知的抗疟疾药物)和阿奇霉素(一种常见抗生素)联合使用可能有利于治疗重症COVID-19患者(参考文献)。91).虽然羟氯喹对病毒有直接抑制作用92它的抗炎和免疫调节活性是已知的93但这些机制是否在对抗COVID-19中发挥作用仍有待确定94.
T细胞免疫
在COVID-19症状出现约1周后,在血液中检测到针对SARS-CoV-2的T细胞和B细胞反应。CD8+T细胞对于直接攻击和杀死病毒感染细胞很重要,而CD4细胞+T细胞对启动两种CD8都至关重要+T细胞和B细胞。CD4+T细胞还负责细胞因子的产生,以驱动免疫细胞的招募。对一名COVID-19患者的首次尸检显示,肺部单核细胞(可能是单核细胞和T细胞)积聚,外周血中过度活跃的T细胞水平较低57.以及淋巴细胞减少和患者外周血T细胞水平降低的报告6,95,96,97这些发现表明,T细胞被吸引离开血液,进入感染部位,以控制病毒感染。在COVID-19患者中,T细胞衰竭加剧和功能多样性降低预示着严重的疾病98.尽管反应受损,但从SARS-CoV感染中康复的患者产生了冠状病毒特异性记忆T细胞,在康复后长达2年被发现99,One hundred..
SARS-CoV-specific CD4+T细胞表达IFNγ、TNF和IL-2,这表明SARS-CoV感染患者表现出TH1 .细胞反应,主要利用细胞免疫来控制感染101,102.虽然这种促炎特征可能是免疫发病机制CD4的加重因素+人们假设T细胞可以控制SARS,因为小鼠体内这些细胞的减少会导致病毒从宿主体内清除的速度变慢,肺部炎症加剧103.通过使用小鼠适应的SARS-CoV毒株,用携带SARS-CoV多肽的树突状细胞免疫可导致更高数量的病毒特异性CD4+和CD8+T细胞聚集在肺部,增加了存活率104,105.此外,sars - cov特异性CD4细胞的转移+和CD8+将T细胞注入免疫缺陷小鼠,可以更好地抵御小鼠适应的SARS-CoV菌株105.
尽管有证据表明T细胞在控制感染方面发挥着重要作用,但先前在动物模型中测试的几种针对SARS-CoV的疫苗配方显示出与T相关的免疫病理迹象H细胞介导的嗜酸性粒细胞浸润106,107.特别是,接种疫苗的老年小鼠似乎表现出增强的免疫病理,而不是保护108.需要进一步研究保护性和有害T细胞反应的性质,以确定疫苗的最佳T细胞参与策略109.
冠状病毒特异性T细胞在消除病毒和控制疾病发展方面显然很重要,应该在疫苗策略中考虑到这一点。然而,单独的T细胞反应是否能够预防人类环境中的感染仍有待研究。这些知识对疫苗的开发很重要。
B细胞免疫
COVID-19患者的B细胞反应与T滤泡辅助细胞反应同时发生,从症状出现后约1周开始110.在SARS-CoV感染患者中,B细胞反应通常首先出现在核衣壳(N)蛋白上。症状出现后4-8天内,发现对S蛋白有抗体反应111,112.中和抗体反应,可能是对S蛋白的反应,在第2周开始出现,大多数患者在第3周出现中和抗体(参考文献)113,114).鉴于SARS-CoV-2的病毒滴度峰值比SARS-CoV更早16,17,18,19,抗体反应也可能更早出现。似乎有一部分患者可能不会产生对SARS-CoV-2的持久抗体(参考文献)。115).目前尚不清楚这些患者是否容易再次感染,目前有零星的报道116,117.抗体可能对SARS-CoV-2有效:恢复期血清样本已应用于COVID-19,临床效果明显良好(参考文献)。118),也曾成功用于治疗沙士119,120,121.
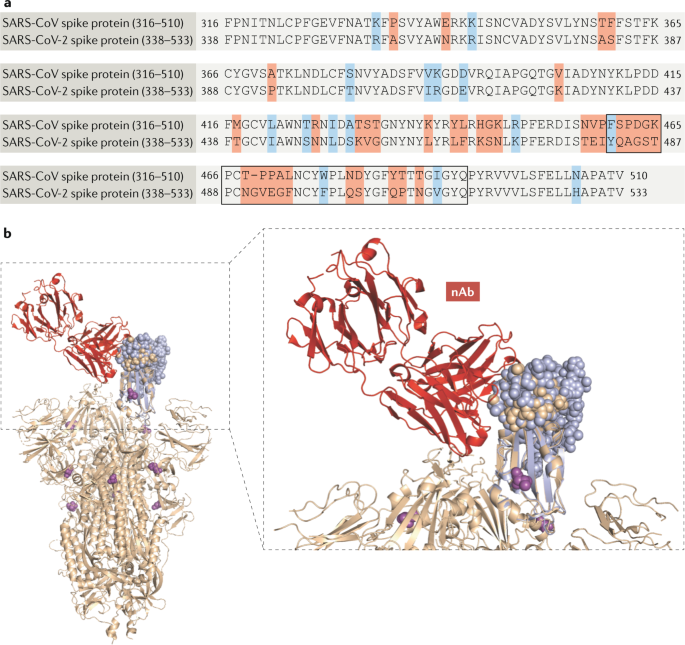
虽然尚未确定人体保护的相关机制,但假定病毒的中和是抗体的重要作用机制,尽管(保护)所需抗体库的具体滴度和特异性仍未确定。在SARS-CoV中,中和抗体的主要目标是RBD122,由S蛋白中193个氨基酸区(氨基酸318-510)组成,可独立与宿主靶ACE2受体结合35,36,37.尽管先前发现的一些SARS-CoV单克隆抗体也能结合或中和SARS-CoV-2(参考文献)。123),大多数人都没有124.这可能是由于SARS-CoV-2和SARS-CoV的rbd存在显著差异(图2)。4).特别是SARS-CoV S蛋白中含有与ACE2接触的关键残基的33个氨基酸(氨基酸460-492)。125),在SARS-CoV-2中只有不到一半(15/33)是保守的。然而,针对SARS-CoV蛋白的小鼠抗血清可以交叉中和SARS-CoV-2假病毒,表明两种病毒之间的中和表位重叠28,126.
在中国,医院已开始使用恢复期血浆作为治疗性多克隆抗体的来源,用于治疗COVID-19,早期数据表明,这对呼吸道病毒载量和死亡率有积极影响127,128.目前正在努力开发针对SARS-CoV-2的治疗性单克隆抗体,方法包括噬菌体文库展示、传统小鼠免疫和杂交瘤分离以及从恢复期人类患者克隆B细胞序列129,130,131,132.SARS-CoV似乎没有强大的机制来逃逸或防止抗体中和,例如糖聚糖屏蔽受体结合位点以防止抗体结合133.SARS-CoV感染患者通常能够产生中和抗体,这进一步证实了这一点。包含SARS-CoV RBD的重组S蛋白片段相对于其他重组S蛋白片段显示出最高的免疫原性,这表明免疫系统能够有效地靶向中和表位134.因此,如果SARS-CoV-2在这方面表现得像SARS-CoV,那么这些努力很可能会成功开发出中和性单克隆抗体。
S蛋白的改变可能会使SARS-CoV-2对某些单克隆抗体产生耐药性,特别是在它传播和突变时。到目前为止,整个RBD仍然是保守的,在S蛋白中只有四个已知的罕见的非同义改变:V483A, L455I, F456V和G476S135.V483A的改变与在MERS- cov中发现的类似的自然改变I529T相对应,在I529T中,它减少了病毒蛋白与宿主受体靶点的结合,也增加了对MERS患者血清样本中抗体中和的抵抗力136.F456V和G476S突变也映射到SARS-CoV的相似突变位置(L443R和D463G),这是在中和逃逸突变体中发现的137.
然而,治疗性候选抗体的选择应包括仔细考虑潜在的不良副作用。例如,现有的其他冠状病毒抗体可能通过抗体依赖性增强加剧SARS-CoV感染138,139,140.此外,之前的动物模型研究表明,在SARS-CoV感染中,中和S蛋白抗体可能通过加剧炎症反应来加剧严重的肺损伤141.此外,在80%的患者中,ARDS的发展与抗病毒IgG血清转化同时存在相关性19.在感染早期产生S蛋白中和抗体的患者发病率较高;死于感染的患者平均只需14.7天就能达到中和抗体活性的峰值水平,而随后康复的患者则需要20天142.同样,对于中东呼吸综合征,病情严重的患者似乎比病情轻的患者具有更高的抗体滴度143,144尽管一项研究认为,与疾病相关的是抗体反应发展的延迟145.抗体-病毒免疫复合物结合激活肺泡巨噬细胞上的Fc受体可以诱导促炎因子的表达,包括IL-8和MCP1,它们增加了免疫刺激环境146.这种复合物也可能激活补体系统,导致进一步不必要的炎症141.因此,重要的是考虑设计具有很少或没有促炎活性但保留其病毒中和能力的治疗性抗体147.例如,可以改变Fc区域和/或其糖基化,以改变其激活Fc受体的结合亲和力146,148.
结论
本文综述了SARS-CoV-2感染的各种机制和COVID-19的免疫发病机制。控制炎症反应可能与针对病毒同样重要。抑制病毒感染和调节功能失调的免疫反应的疗法可能协同在多个步骤阻断病理。同时,COVID-19患者免疫功能障碍与疾病严重程度结局之间的关系应作为疫苗开发和评估的注意事项。有必要对宿主对SARS-CoV-2的免疫反应进行进一步研究,包括对健康与功能障碍结果的决定因素进行详细调查。这些也将有助于识别生物标记物,以确定保护和疾病严重程度的免疫相关性,以有效地对患者进行分类。
参考文献
世界卫生组织。世卫组织总干事2020年3月11日在2019冠状病毒病(COVID-19)疫情媒体通报会上的开幕词。谁https://www.who.int/dg/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19---11-march-2020(2020)。
费尔,A. R. &帕尔曼,S.冠状病毒:其复制和发病机制的概述。方法。摩尔。杂志。1282, 1-23(2015)。
国际病毒分类学委员会冠状病毒研究小组。与严重急性呼吸综合征相关的冠状病毒种类:将2019-nCoV分类并命名为SARS-CoV-2。Microbiol Nat。5, 536-544(2020)。
Zhou, P.等。与一种可能来自蝙蝠的新型冠状病毒有关的肺炎爆发。自然579, 270-273(2020)。
安徒生,K. G.,兰姆波特,A.,利普金,W. I.,霍姆斯,E. C.和加里,R. F. SARS-CoV-2的近端起源。Nat,地中海。https://doi.org/10.1038/s41591-020-0820-9(2020)。
关,W. J.等。2019年中国冠状病毒病临床特征心血管病。j .地中海。https://doi.org/10.1056/NEJMoa2002032(2020)。
庞格,R.等人。新加坡三个COVID-19聚集性调查:对监测和应对措施的影响。《柳叶刀》395, 1039-1046(2020)。
劳尔,S. A.等。2019冠状病毒病(COVID-19)公开报告确诊病例的潜伏期:估计和应用安。实习生。地中海。https://doi.org/10.7326/m20-0504(2020)。
李,Q.等。新型冠状病毒感染的肺炎在中国武汉的早期传播动态心血管病。j .地中海。382, 1199-1207(2020)。
陈,J. F.等。与2019年新型冠状病毒相关的家庭聚集性肺炎表明人传人:对家庭聚集性的研究。《柳叶刀》395, 514-523(2020)。
黄,C.等。武汉地区新型冠状病毒感染患者临床特征分析《柳叶刀》395, 497-506(2020)。这项前瞻性研究最早纳入了对重度和轻度COVID-19细胞因子水平的分析,显示存在类似于SARS-CoV感染的细胞因子风暴.
陈,G.等。2019年重、中度冠状病毒病临床及免疫特征分析。j .中国。投资。https://doi.org/10.1172/jci137244(2020)。
刘,Y.等。2019-nCoV感染患者的临床和生化指标与病毒载量和肺损伤有关。科学。中国人寿63, 364-374(2020)。
陈,N.等。武汉市99例2019年新型冠状病毒肺炎的流行病学和临床特征:描述性研究《柳叶刀》395, 507-513(2020)。
潘,L. T.等。越南新型冠状病毒的输入和人际传播。心血管病。j .地中海。382, 872-874(2020)。
潘艳,张东,杨萍,潘丽丽梅,王强。SARS-CoV-2临床样本病毒载量的研究。柳叶刀感染。说。https://doi.org/10.1016/s1473 - 3099 (20) 30113 - 4(2020)。
金,J. Y.等。韩国前两例SARS-CoV-2感染的病毒载量动力学韩国医学科学。35, e86(2020)。
邹,L.等。患者上呼吸道标本SARS-CoV-2病毒载量。心血管病。j .地中海。382, 1177-1179(2020)。
佩里斯,J. S.等。冠状病毒相关SARS肺炎社区暴发的临床进展和病毒载量:一项前瞻性研究《柳叶刀》361, 1767-1772(2003)。
王,D.等。武汉市138例新型冠状病毒感染的肺炎住院患者临床特征分析《美国医学会杂志》323, 1061-1069(2020)。
王志强等。血浆炎症因子和趋化因子在严重急性呼吸综合征中的应用。中国。Exp Immunol。136, 95-103(2004)。
张,B.等。82例COVID-19死亡病例临床特征分析预印在medRxivhttps://doi.org/10.1101/2020.02.26.20028191(2020)。
朱,K. H.等。冠状病毒相关严重急性呼吸综合征的急性肾损害肾脏Int。67, 698-705(2005)。
贾,H. P.等。ACE2受体表达与严重急性呼吸综合征冠状病毒感染依赖于人气道上皮分化。j .性研究。79, 14614-14621(2005)。
徐,H.等。新型冠状病毒ACE2受体在口腔黏膜上皮细胞高表达。Int。j .口服。科学。12, 8(2020)。
汉明等人。SARS冠状病毒功能受体ACE2蛋白的组织分布。了解SARS发病机制的第一步。j .分册。203, 631-637(2004)。
赵阳,等。武汉新型冠状病毒推定受体ACE2的单细胞RNA表达谱分析。预印在bioRxivhttps://doi.org/10.1101/2020.01.26.919985(2020)。
沃尔斯,a.c.等。SARS-CoV-2刺突糖蛋白的结构、功能和抗原性。细胞https://doi.org/10.1016/j.cell.2020.02.058(2020)。本文与Wrapp等人(2020)一起,展示了用于细胞进入的SARS-CoV-2刺突糖蛋白的冷冻电子显微镜结构,包括对其与SARS-CoV相关的受体结合动力学和抗原性的分析.
Imai, Y.等。血管紧张素转换酶2可预防严重急性肺衰竭。自然436, 112-116(2005)。
Imai, Y., Kuba, K. & Penninger, J. M.血管紧张素转换酶2的发现及其在小鼠急性肺损伤中的作用。Exp。杂志。93, 543-548(2008)。
Kuba, K.等。血管紧张素转换酶2 (ACE2)在SARS冠状病毒诱导的肺损伤中的关键作用Nat,地中海。11, 875-879(2005)。
张志刚,张志刚,张志刚。血管紧张素转换酶2在肺疾病中的应用。咕咕叫。当今。杂志。6, 271-276(2006)。
NCIP流行病应对流行病学工作组。2019年中国新型冠状病毒病(COVID-19)暴发的流行病学特征下巴。j .论文。41, 145-151(2020)。
性激素决定免疫反应。前面。Immunol。9, 1931(2018)。
肖X, Chakraborti, S., Dimitrov, A. S., Gramatikoff, K. & Dimitrov, D. S. SARS-CoV S糖蛋白的表达和功能特征。物化学。Biophys。Commun >,312, 1159-1164(2003)。
Babcock, G. J., Esshaki, D. J., Thomas, W. D. Jr.和Ambrosino, D. M.严重急性呼吸综合征冠状病毒刺突蛋白的270 - 510氨基酸与受体相互作用是必需的。j .性研究。78, 4552-4560(2004)。
黄淑坤,李玮,Moore, m.j, Choe, H. & Farzan, M. SARS冠状病毒S蛋白193个氨基酸片段有效结合血管紧张素转换酶2。生物。化学。279, 3197-3201(2004)。
西蒙斯,G.等。组织蛋白酶L抑制剂可防止严重急性呼吸综合征冠状病毒进入。国家科学院学报美国102, 11876-11881(2005)。
博世,B. J.等。利用刺突蛋白七磷酸重复衍生肽抑制严重急性呼吸综合征冠状病毒感染国家科学院学报美国101, 8455-8460(2004)。
刘,S.等。sars相关冠状病毒刺突蛋白七磷酸重复1和2区相互作用:病毒融合机制和融合抑制剂鉴定的意义《柳叶刀》363, 938-947(2004)。
陈艳,郭艳,潘艳,赵志军。新型冠状病毒受体结合结构分析。物化学。Biophys。Commun >,525, 135-140(2020)。
Wrapp, D.等。预融合构象中2019-nCoV峰值的冷冻电镜结构。科学367, 1260-1263(2020)。本文与Walls等人(2020)一起,展示了用于细胞进入的SARS-CoV-2刺突糖蛋白的高分辨率冷冻电子显微镜结构,包括对其与SARS-CoV相关的受体结合动力学的分析.
库塔德,B.等。新型冠状病毒2019-nCoV的刺突糖蛋白含有相同分支的冠状病毒所没有的糠醛样裂解位点。小红伞。Res。176, 104742(2020)。
霍夫曼,等人。SARS-CoV-2细胞进入依赖于ACE2和TMPRSS2,并被临床证明的蛋白酶抑制剂阻断。细胞https://doi.org/10.1016/j.cell.2020.02.052(2020)。
理查德森等人。巴瑞替尼作为新型冠状病毒急性呼吸道疾病的潜在治疗药物。《柳叶刀》395, e30-e31(2020)。
中国临床试验注册。Chictr.org.cnhttp://www.chictr.org.cn/showprojen.aspx?proj=49088(2020)。
管道审查。APEIRON的呼吸系统药物产品将在中国开始治疗冠状病毒疾病COVID-19的试点临床试验。管道检查https://pipelinereview.com/index.php/2020022673884/Proteins-and-Peptides/APEIRONs-respiratory-drug-product-to-start-pilot-clinical-trial-to-treat-coronavirus-disease-COVID-19-in-China.html(2020)。
王,M.等。瑞德西韦和氯喹在体外能有效抑制新出现的新型冠状病毒(2019-nCoV)。细胞Res。30., 269-271(2020)。
山本等人。利用基于分裂蛋白的细胞-细胞融合试验鉴定nafamostat作为中东呼吸综合征冠状病毒S蛋白介导的膜融合的有效抑制剂Antimicrob。代理Chemother。60, 6532-6539(2016)。
张宏,彭宁杰,李玉玉,钟宁,李玉玉,张浩。血管紧张素转换酶2 (ACE2)作为SARS-CoV-2受体的分子机制及潜在治疗靶点。重症监护室。46, 586-590(2020)。
Park, W. B.等。国内首例SARS-CoV-2患者的病毒分离。韩国医学科学。35, e84(2020)。
张,H.等。1例新型冠状病毒肺炎患者肺组织病理改变及新冠病毒免疫染色安。实习生。地中海。https://doi.org/10.7326/m20-0533(2020)。
陈,I. Y., Moriyama, M., Chang, m.f. & Ichinohe, T.严重急性呼吸综合征冠状病毒病毒porin 3a激活NLRP3炎性小体。前面。Microbiol。10, 50(2019)。
芬克,S. L. & Cookson, B. T.凋亡,焦亡和坏死:死亡和濒死真核细胞的机制描述。感染。Immun。731907-1916(2005)。
细胞焦亡是新型冠状病毒感染的潜在致病机制。SSRNhttps://doi.org/10.2139/ssrn.3527420(2020)。
黄,K. J.等。SARS患者中干扰素- γ相关细胞因子风暴J.医学病毒。75, 185-194(2005)。
徐哲,等。COVID-19与急性呼吸窘迫综合征相关的病理结果和出版的《柳叶刀》杂志上。地中海。8, 420-422(2020)。这项研究首次描述了重症COVID-19的病理结果,并证明了在肺部发现的异常免疫细胞浸润.
田,S.等。2例肺癌患者2019年新型冠状病毒肺炎早期肺部病理分析j . Thorac。肿瘤防治杂志。https://doi.org/10.1016/j.jtho.2020.02.010(2020)。
秦,C.等。中国武汉COVID-19患者免疫反应失调中国。感染。说。https://doi.org/10.1093/cid/ciaa248(2020)。
周,F.等。中国武汉成人COVID-19住院患者的临床病程和死亡危险因素:一项回顾性队列研究《柳叶刀》395, 1054-1062(2020)。
廖,M.等。单细胞RNA测序揭示新冠肺炎患者肺支气管肺泡免疫细胞格局预印在medRxivhttps://doi.org/10.1101/2020.02.23.20026690(2020)。
周,Y.等。致病性T细胞和炎性单核细胞引发COVID-19重症患者炎症风暴国家的科学。牧师。https://doi.org/10.1093/nsr/nwaa041(2020)。
萧桂林,陈昌平,郭桂华,吴朝怡,陈平,金德彦。严重急性呼吸综合征冠状病毒M蛋白抑制先天性抗病毒反应的机制是通过第一跨膜结构域介导的。细胞。摩尔。Immunol。11, 141-149(2014)。
Versteeg, G. A., Bredenbeek, P. J., van den Worm, S. H. & Spaan, W. J.第2组冠状病毒通过保护病毒RNA不被宿主细胞识别来防止立即早期干扰素诱导。病毒学361, 18-26(2007)。
孙,L.等。冠状病毒木瓜蛋白酶样蛋白酶通过破坏sting介导的信号通路负向调节抗病毒先天免疫反应。《公共科学图书馆•综合》7, e30802(2012)。
Frieman, M., Ratia, K., Johnston, R. E., Mesecar, A. D. & Baric, R. S.严重急性呼吸综合征冠状病毒木瓜蛋白酶泛素样结构域和催化结构域调节IRF3和NF-kappaB信号的拮抗作用。j .性研究。83, 6689-6705(2009)。
弗里德曼等人。严重急性呼吸综合征冠状病毒ORF6通过隔离粗糙内质网/高尔基膜上的核输入因子拮抗STAT1功能。j .性研究。81, 9812-9824(2007)。
Narayanan, K.等人。严重急性呼吸综合征冠状病毒nsp1在感染细胞中抑制宿主基因表达,包括I型干扰素的表达。j .性研究。82, 4471-4479(2008)。
阮强,杨凯,王伟,姜林,宋杰。基于中国武汉150例患者数据分析的COVID-19死亡临床预测因子。重症监护室。https://doi.org/10.1007/s00134-020-05991-x(2020)。
赵俊杰,赵俊杰,莱格,K. & Perlman, S.与年龄相关的PGD增加2表达损害呼吸道DC迁移,导致呼吸道病毒感染小鼠T细胞反应减弱。j .中国。投资。121, 4921-4930(2011)。
Kam, K. Q.等。患有2019冠状病毒病(COVID-19)的健康婴儿,病毒载量高。中国。感染。说。https://doi.org/10.1093/cid/ciaa201(2020)。
董,杨,等。中国2143例2019年冠状病毒病儿科患者的流行病学特征儿科https://doi.org/10.1542/peds.2020-0702(2020)。
顾,J.等。SARS的多器官感染及其发病机制。实验,医学。202, 415-424(2005)。本文描述了SARS-CoV病毒颗粒和RNA在T细胞、单核细胞和巨噬细胞中的存在,这表明SARS-CoV和潜在的SARS-CoV-2可能通过直接感染免疫细胞来驱动免疫发病机制.
张,C. Y.等。严重急性呼吸综合征冠状病毒感染巨噬细胞体外细胞因子反应:可能与发病机制相关。j .性研究。79, 7819-7826(2005)。
Yilla, M.等。sars冠状病毒在人外周血单核/巨噬细胞中的复制。病毒Res。107, 93-101(2005)。
曾春涛,朱海华,马野,张志刚,陈志刚。严重急性呼吸综合征与先天性免疫反应:无产生性感染的效应细胞功能调节。j . Immunol。174, 7977-7985(2005)。
劳,H. K.等。sars冠状病毒感染的单核细胞来源的人树突状细胞趋化因子上调血106, 2366-2374(2005)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT04273321(2020)。
斯多克曼,L. J.,贝拉米,R. & Garner, P. SARS:治疗效果的系统回顾。科学硕士。3., e343(2006)。
邰德勇。SARS的药物治疗:目前的知识和建议。安。新加坡医学院。36, 438-443(2007)。
中国临床试验注册。Chictr.org.cnhttp://www.chictr.org.cn/showproj.aspx?proj=49409(2020)。
中国在新的治疗指南中使用罗氏关节炎药物Actemra治疗COVID-19。FiercePharmahttps://www.fiercepharma.com/pharma-asia/china-turns-roche-arthritis-drug-actemra-against-covid-19-new-treatment-guidelines(2020)。
Roivant科学。Roivant宣布开发抗gm - csf单克隆抗体,用于预防和治疗COVID-19患者的急性呼吸窘迫综合征(ARDS)。Roivant科学https://roivant.com/roivant-announces-development-of-anti-gm-csf-monoclonal-antibody-to-prevent-and-treat-acute-respiratory-distress-syndrome-ards-in-patients-with-covid-19/(2020)。
Humanigen。Humanigen与领先的合同研究机构CTI合作,计划进行lenzilumab治疗冠状病毒的III期研究。Humanigenhttps://www.humanigen.com/press/Humanigen-Partners-With-CTI%2C-A-Leading-Contract-Research-Organization%2C-For-Planned-Phase-III-Study-For-Lenzilumab-For-Coronavirus-Treatment(2020)。
Izana生物科学。在意大利启动两中心同情使用研究,涉及纳米单抗治疗快速恶化的COVID-19感染个体患者。Izana生物科学https://izanabio.com/initiation- of-two-centre-compassionate-use-study-involving-namilumab-in-the-treatment-of-individual-patients-with-rapidly-worsening-covid-19-infection-in-italy /(2020)。
CytoSorbents Corportation。CytoSorb、武汉冠状病毒和细胞因子风暴.美通社https://www.prnewswire.com/news-releases/cytosorb-the-wuhan-coronavirus-and-cytokine-storm-300994196.html(2020)。
陈,C.等。沙利度胺联合小剂量糖皮质激素治疗COVID-19肺炎预印本https://www.preprints.org/manuscript/202002.0395/v1(2020)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT04273581(2020)。
美国国家医学图书馆。ClinicalTrials.govhttps://clinicaltrials.gov/ct2/show/NCT04273529(2020)。
tnf - α抑制对SARS冠状病毒感染的潜在治疗调节。咕咕叫。奥平医生。20., 39-40(2004)。
Gautret, P.等。羟氯喹和阿奇霉素治疗COVID-19:一项开放标签非随机临床试验结果Int。j . Antimicrob。代理https://doi.org/10.1016/j.ijantimicag.2020.105949(2020)。
姚,X.等。羟氯喹治疗SARS-CoV-2冠状病毒的体外抗病毒活性及优化给药设计的预测中国。感染。说。https://doi.org/10.1093/cid/ciaa237(2020)。
舒克拉,a.m. &瓦格尔舒克拉,A.氯喹、羟氯喹及相关结构类似物临床应用的拓展。药物上下文。8, 2019-9-1(2019)。
Cortegiani, A., Ingoglia, G., Ippolito, M., Giarratano, A. & Einav, S.氯喹治疗COVID-19的有效性和安全性的系统综述。j .暴击。护理https://doi.org/10.1016/j.jcrc.2020.03.005(2020)。
黄,R. S.等。严重急性呼吸综合征患者的血液学表现:回顾性分析。BMJ326, 1358-1362(2003)。
崔,W.等。重症急性呼吸综合征患者淋巴细胞及淋巴细胞亚群的表达中国。感染。说。37, 857-859(2003)。
李,T.等。重症急性呼吸综合征患者外周血T淋巴细胞亚群的显著变化j .感染。说。189, 648-651(2004)。
郑,H.-Y。et al。外周血中衰竭水平升高和T细胞功能多样性降低可能预示着COVID-19患者的严重进展。细胞。摩尔。Immunol。https://doi.org/10.1038/s41423-020-0401-3(2020)。本文检测了重症和轻症患者的免疫状态,结果显示重症患者T细胞功能多样性降低,支持T细胞功能在控制COVID-19中的作用.
图书馆,D. H.,奥尼尔,K. M.,贝克,L. M.,阿科斯塔,L. P. & Olveda, R. M.人体CD4+记忆t淋巴细胞对SARS冠状病毒感染的反应。病毒学368, 317-321(2007)。
杨,l.t.等。SARS康复患者对严重急性呼吸综合征冠状病毒(SARS- cov) S抗原的长寿命效应/中枢记忆t细胞反应中国。Immunol。120, 171-178(2006)。
哦,h。l。J。甘。k。e。谭玉娟,陈志强,陈志强。SARS冠状病毒感染中T细胞免疫反应的研究进展。紧急情况。微生物。感染。1, e23(2012)。
Shin, H. S.等人。人类感染急性期和恢复期对中东呼吸综合征冠状病毒的免疫反应中国。感染。说。68, 984-992(2019)。
陈,J.等。衰老BALB/c小鼠对严重急性呼吸综合征冠状病毒(SARS-CoV)感染的细胞免疫反应:CD4+ T细胞在控制SARS-CoV感染中很重要。j .性研究。84, 1289-1301(2010)。
罗伯茨等人。小鼠适应的sars冠状病毒在BALB/c小鼠中引起疾病和死亡。公共科学图书馆Pathog。3., e5(2007)。
赵杰,赵杰,帕尔曼,S. T细胞反应在严重急性呼吸综合征冠状病毒感染小鼠的临床疾病保护和病毒清除中是必需的。j .性研究。84, 9318-9325(2010)。
戴明,D.等人。疫苗在感染带有流行和人畜共患spike变体的重组SARS-CoV的衰老小鼠中的有效性。科学硕士。3., e525(2006)。
Yasui, F.等。先前接种严重急性呼吸综合征(SARS)相关冠状病毒(SARS- cov)核衣壳蛋白可导致感染SARS- cov的小鼠严重肺炎。j . Immunol。181, 6337-6348(2008)。
Bolles等人。双灭活的严重急性呼吸综合征冠状病毒疫苗在小鼠中提供不完全保护,并在攻击时诱导增加嗜酸性粒细胞促炎症性肺反应。j .性研究。85, 12201-12215(2011)。
Lurie, N, Saville, M, Hatchett, R. & Halton, J.以大流行的速度开发Covid-19疫苗。心血管病。j .地中海。https://doi.org/10.1056/NEJMp2005630(2020)。
Thevarajan, I.等人。患者康复前伴随免疫反应的广度:非重症COVID-19病例报告Nat,地中海。https://doi.org/10.1038/s41591-020-0819-2(2020)。
谭,Y. J.等。严重急性呼吸综合征冠状病毒重组蛋白抗体应答谱及其作为诊断标志物的潜在应用中国。成岩作用。实验室。Immunol。11, 362-371(2004)。
吴,H. S.等。SARS患者抗SARS相关冠状病毒多种结构蛋白抗体的早期检测j .生物医学。科学。11, 117-126(2004)。
聂,杨,等。重症急性呼吸综合征相关冠状病毒感染患者的中和抗体。j .感染。说。190, 1119-1126(2004)。
坦普尔顿,n.j.等人。SARS冠状病毒假型中和抗体反应的纵向分析。紧急情况。感染。说。11, 411-416(2005)。
CGTN。专家:冠状病毒康复患者仍容易再次感染。YouTubehttps://www.youtube.com/watch?v=GZ99J7mlaIQ(2020)。
海峡时报。日本一名妇女在初步康复几周后再次感染冠状病毒。海峡时报https://www.straitstimes.com/asia/east-asia/japanese-woman-reinfected-with-coronavirus-weeks-after-initial-recovery(2020)。
NHK World-Japan。日本男子冠状病毒检测再次呈阳性。NHKhttps://www3.nhk.or.jp/nhkworld/en/news/20200315_13/(2020)。
新华社。245例新冠肺炎患者接受恢复期血浆治疗。据新华网http://www.xinhuanet.com/english/2020-02/28/c_138828177.htm(2020)。
Cheng, Y.等。香港沙士病人使用恢复期血浆治疗的情况。欧元。j .中国。Microbiol。感染。说。24, 44-46(2005)。
苏,Y. O.等人。SARS患者恢复期血浆与持续大剂量甲基强的松龙治疗的回顾性比较中国。Microbiol。感染。10, 676-678(2004)。
是的,K. M.等。台湾某医院医护人员使用恢复期血浆治疗严重急性呼吸综合征的经验。j . Antimicrob。Chemother。56, 919-922(2005)。
朱,Z.等。人单克隆抗体有效的交叉反应中和SARS冠状病毒分离物。国家科学院学报美国104, 12123-12128(2007)。
王,C.等。阻断SARS-CoV-2感染的人单克隆抗体。预印在bioRxivhttps://doi.org/10.1101/2020.03.11.987958(2020)。
田,等。SARS冠状病毒特异性人单克隆抗体与2019新型冠状病毒刺突蛋白的有效结合。紧急情况。微生物感染。9, 382-385(2020)。
李芳,李伟,李志强,李志强。SARS冠状病毒刺突受体结合域与受体复合物的结构。科学309, 1864-1868(2005)。
Tai, W.等。2019新型冠状病毒受体结合结构域(RBD)的表征:RBD蛋白作为病毒附着抑制剂和疫苗的开发意义细胞。摩尔。免疫学https://doi.org/10.1038/s41423-020-0400-4(2020)。
李,x.y,等。新型冠状病毒肺炎重症患者救治要点下巴。J.肺结核呼吸。说。43, e026(2020)。
中央社。中国医生对COVID-19患者“使用血浆疗法”。中央社https://www.channelnewsasia.com/news/asia/chinese-doctors-using-plasma-therapy-on-covid-19-patients-12444244(2020)。
Johnson, R. F. et al. 3B11-N是一种针对MERS-CoV的单克隆抗体,可以减少呼吸道内接种MERS-CoV Jordan-n3/2012后恒河猴的肺部病变。病毒学490, 49-58(2016)。
梵。新闻稿细节:Vir生物技术应用多平台解决武汉冠状病毒带来的公共卫生风险。梵https://investors.vir.bio/news-releases/news-release-details/vir-biotechnology-applying-multiple-platforms-address-public(2020)。
抗艾滋病毒组合或其他现有药物能否战胜新型冠状病毒?科学https://www.sciencemag.org/news/2020/01/can-anti-hiv-combination-or-other-existing-drugs-outwit-new-coronavirus(2020)。
Duddu, P.冠状病毒治疗:COVID-19疫苗/药物正在研制中。临床试验竞技场https://www.clinicaltrialsarena.com/analysis/coronavirus-mers-cov-drugs/(2020)。
贝里,J. D.等人。中和SARS-CoV s蛋白簇的表位,不依赖于保留库、抗原结构或单抗技术。马伯2, 53-66(2010)。本文显示了SARS-CoV RBD上中和表位的免疫显性性,提示了以RBD为中心的重组抗原策略用于COVID-19疫苗接种的可行性.
邱,M.等。抗体对SARS冠状病毒单个蛋白的反应及其中和活性微生物感染。7, 882-889(2005)。
GISAID。高质量基因组的受体结合监测。GISAIDhttps://www.gisaid.org/(2020)。
克莱恩-韦伯,H.等人。在韩国传播的中东呼吸综合征冠状病毒的刺突蛋白突变增加了对抗体介导的中和的抵抗力。j .性研究。93, e01381-18(2019)。
洛克克斯,B.等人。逃避人单克隆抗体中和对严重急性呼吸综合征冠状病毒体内外适应度的影响j .感染。说。201, 946-955(2010)。
杨振宇,等。新出现的严重急性呼吸综合征冠状病毒的抗体中和逃避。Proc。国家的。学会科学。美国102, 797-801(2005)。
何,M. S.等。中和抗体反应和SARS严重程度。紧急情况。感染。说。11, 1730-1737(2005)。
COVID-19是否从其他冠状病毒那里获得ADE ?微生物感染。22, 72-73(2020)。
刘,L.等。抗刺突IgG在急性SARS-CoV感染期间通过扭曲巨噬细胞反应导致严重的急性肺损伤。江森自控的洞察力https://doi.org/10.1172/jci.insight.123158(2019)。
张,L.等。抗体对SARS冠状病毒的反应与感染个体的疾病结局相关。J.医学病毒。78, 1-8(2006)。
阿拉比,Y. M.等。沙特阿拉伯使用恢复期血浆免疫疗法治疗中东呼吸综合征冠状病毒感染的可行性。紧急情况。感染。说。221554(2016)。
Drosten, C.等人。中东呼吸综合征冠状病毒在家庭接触中的传播。心血管病。j .地中海。371, 828-835(2014)。
Park, W. B.等。人类MERS冠状病毒感染的血清学反应动力学,韩国。紧急情况。感染。说。21, 2186-2189(2015)。
Nimmerjahn, F. & Ravetch, J. V. Fcgamma受体作为免疫反应的调节器。Nat. Rev. Immunol。8, 34-47(2008)。
Bournazos, S. DiLillo, D. J. & Ravetch, J. V. fc - fcgamma相互作用在igg介导的微生物中和中的作用。实验,医学。212, 1361-1369(2015)。
Kaneko, Y., Nimmerjahn, F. & Ravetch, J. V. Fc唾液化引起的免疫球蛋白G的抗炎活性。科学313, 670-673(2006)。
张强,王勇,齐成,沈玲,李娟。国内注册的新型冠状病毒疗法临床试验分析。J.医学病毒。https://doi.org/10.1002/jmv.25733(2020)。
尚,J.等。SARS-CoV-2受体识别的结构基础自然https://doi.org/10.1038/s41586-020-2179-y(2020)。
Prabakaran, P.等。严重急性呼吸综合征冠状病毒受体结合域与中和抗体复合物的结构。生物。化学。281, 15829-15836(2006)。
确认
作者感谢Insight Editing London对早期草稿的投入。这项工作得到了新加坡免疫网络(SIgN)通过生物医学研究理事会(BMRC), A*STAR的核心基金的支持。
作者信息
作者及隶属关系
贡献
作者对文章的各个方面都作了同样的贡献。
相应的作者
道德声明
相互竞争的利益
作者声明没有利益竞争。
额外的信息
同行评审信息
《自然评论》免疫学感谢A. Barrett、A. Hosmalin、K. Ishii和H. Wei对本工作的同行评议所作的贡献。
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
关于本文
引用本文
郑文敏,郑文敏,郑文敏,Rénia,郑文敏。et al。COVID-19三位一体:免疫、炎症和干预。Nat Rev Immunol20., 363-374(2020)。https://doi.org/10.1038/s41577-020-0311-8
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41577-020-0311-8
这篇文章被引用
功能性食品:对抗新冠肺炎的补充
Beni-Suef大学基础与应用科学杂志(2022)
用于COVID-19治疗干预的现成造血干细胞工程不变自然杀伤T细胞的开发
干细胞研究与治疗(2022)
激活TCA循环抑制小鼠肝炎病毒感染细胞中的病毒代谢劫持和病毒复制
细胞与生物科学(2022)
COVID-19住院患者炎症细胞因子与抗sars - cov -2抗体的相关性
免疫与衰老(2022)
SARS-CoV-2可有效感染人脑微血管内皮细胞
神经炎症学杂志(2022)