摘要
对能够诱导强大和持久免疫力的高效疫苗的需求从未像现在这样明显。然而,由于尚不清楚的原因,接种疫苗的免疫反应在不同个体和不同人群之间存在很大差异。此外,在感染传染病风险最大的人群中,包括婴儿、老年人以及生活在低收入和中等收入国家的人群,疫苗的免疫原性往往达不到最佳水平。尽管许多因素都有可能影响疫苗的免疫原性,从而影响疫苗的有效性,但目前临床研究和动物模型中越来越多的证据表明,肠道菌群的组成和功能是调节免疫接种反应的关键因素。在这篇综述中,我们综合了这些证据,讨论了可能介导这些影响的免疫学机制,并考虑了针对微生物群的干预措施优化疫苗有效性的潜力。
简介
全球免疫规划每年防止估计200万至300万人死亡,并显著降低疾病发病率1.疫苗已导致根除或接近根除天花和脊髓灰质炎等疾病,在确实发生感染时降低疾病严重程度,并可通过针对致病病原体(人乳头状瘤病毒)预防某些癌症,如宫颈癌的发展。接种疫苗还可以减少抗生素的使用,从而减少抗生素耐药性。例如,肺炎球菌结合疫苗和口服轮状病毒疫苗(orv)每年在低收入和中等收入国家(LMICs)的5岁以下儿童中分别预防约2380万和1360万例抗生素治疗的疾病2.事实上,疫苗接种规划非常成功,以至于许多人,特别是那些生活在传染病负担低的高收入国家的人,对传染病构成的威胁变得自满。2020年,COVID-19大流行以及需要迅速开发对全球人群非常有效的SARS-CoV-2疫苗,使世界摆脱了这种自满情绪。此外,仍然迫切需要针对许多其他严重传染病,包括疟疾、结核病和艾滋病毒-1的有效疫苗。
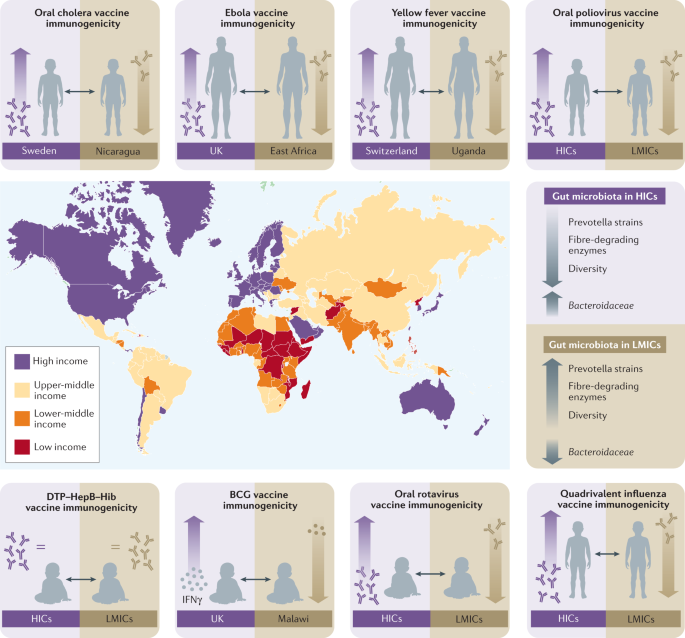
疫苗主要通过诱导产生抗原特异性抗体的B细胞来介导保护,尽管T细胞也有助于由一些疫苗介导的保护,如结核病的芽孢杆菌Calmette-Guérin(卡介苗)疫苗,并且对于确保诱导高亲和力抗体和免疫记忆至关重要3..由于目前尚不清楚的原因,B细胞和T细胞对疫苗接种的反应在个体之间差异很大。例如,季节性流感灭活疫苗诱导的抗体滴度在个体之间可以变化约100倍,抗体对结合肺炎球菌疫苗的反应和免疫应答流感嗜血杆菌在接种了bcg的婴儿中,b型(Hib)疫苗的差异可达40倍,细胞因子召回反应可达10对数倍4.正如我们在下面更详细地讨论的那样,与高收入国家的人相比,生活在低收入和中等收入国家的人的疫苗免疫原性经常被报道受损(图。1).与健康成人相比,婴儿的疫苗免疫原性也差得多5在老年人中6.这些数据表明,低收入和中等收入国家和高收入国家之间以及生命极端阶段不同的特定宿主因素强烈影响疫苗免疫反应的质量和持久性,从而影响疫苗有效性,尽管应该指出,免疫原性以外的因素也会影响疫苗效力。越来越多的证据指向肠道菌群——在生命过程中,个体之间的差异很大7,8以及世界各地不同人群之间的差异9(盒子1) -是调节免疫反应的关键因素10.在这里,我们评估了来自临床队列研究、介入性研究和动物模型的证据,这些证据表明肠道菌群在调节疫苗免疫原性方面发挥着重要作用。来自动物模型的数据强烈支持肠道菌群在调节疫苗免疫反应方面的关键作用;然而,还需要进一步的工作来更好地确定肠道菌群在不同人群中调节疫苗免疫原性中的作用。
重点介绍了比较低收入和中等收入国家(中低收入国家;红色、橙色和黄色)到高收入国家(HICs;紫色);见表1欲知详情。低收入和中等收入国家口服疫苗免疫原性降低的数据尤其令人信服,但需要进一步的工作来确认低收入和中等收入国家对非肠道疫苗的反应是否受损,因为迄今为止的许多报告都是基于对独立队列的事后分析。有趣的是,报道的疫苗免疫原性差异与这些人群之间肠道微生物群组成和功能能力的差异相关。收入状况的分类基于世界银行的数据,在广泛的中低收入国家类别中,将国家分为低收入(红色)、中低收入(橙色)和中上收入(黄色)。卡介苗,芽孢杆菌Calmette-Guérin;白喉、破伤风、百日咳、乙型肝炎病毒-流感嗜血杆菌B型;干扰素γ干扰素-γ。
中低收入国家的疫苗反应不佳
由于尚不完全了解的原因,经常有报道称,与高收入国家的人相比,低收入和中等收入国家的人的疫苗免疫原性受损。口服疫苗的证据尤其明显,但对于一些已获许可的疫苗和候选疫苗似乎也是如此注射用药物的疫苗.
口服疫苗免疫原性
口服疫苗,包括口服口服疫苗、口服脊髓灰质炎病毒疫苗(OPV)以及口服霍乱和伤寒疫苗,一直被发现在低收入和中等收入国家的个体中免疫原性较低(表)1),他们的肠道疾病负担最重11.例如,中等收入家庭的婴儿对orv的平均IgA滴度比高收入家庭的婴儿低四分之一12.免疫原性较差意味着疫苗效力较差。最近一项对Rotarix和RotaTeq orv的所有随机对照试验的荟萃分析发现,疫苗在高收入国家的疗效在2周后为98%,在12个月后为94%,而在中低收入国家分别为66%和44%13.血清杀弧菌抗体滴度在中低收入国家儿童中也显著降低,而杀弧菌抗体滴度是口服霍乱疫苗免疫儿童保护的相关因素14.此外,口服脊髓灰质炎疫苗免疫后,高传染性国家的儿童血清转化率接近100%,而中低收入国家只有约70%15.其他几种口服疫苗,包括预防志贺氏杆菌spp。产肠毒素的大肠杆菌而且空肠弯曲杆菌,目前正在开发中。研究减毒活病毒的试验志贺氏杆菌候选疫苗在美国成人中显示出高水平的免疫原性,但在孟加拉国婴儿中显示出很少或没有免疫原性16.
抗体和T细胞对注射疫苗的反应
一些非注射疫苗,如白喉、破伤风、百日咳-乙型肝炎病毒- hib(百日咳-乙型肝炎病毒- hib)联合疫苗,似乎在低收入国家和高收入国家具有相当水平的免疫原性17.然而,越来越多的研究表明,来自中低收入国家的个体对其他已获许可的和候选的肠外疫苗的反应可能受损(表2)1).例如,最近一项评估灭活四价流感疫苗在三个不同地理区域的儿童中五个流感季节的有效性的III期试验发现,来自社会经济地位较高国家的队列的疫苗效力水平更高18.在7个非洲国家的11个试验点观察到,RTS,S疟疾疫苗三剂后的效力从40%到77%不等19,这表明疫苗的免疫原性也可能在地理上的局部水平上有所不同。还发现乌干达免疫个体对黄热病17D (YF-17D)疫苗的B细胞反应明显低于瑞士免疫个体20.在英国和三个东非国家进行的三个埃博拉候选疫苗I期试验的数据显示,来自英国的参与者在免疫后1年测量的抗体浓度明显较高21.有趣的是,尽管大多数研究表明疫苗效力在低收入和中等收入国家较低,但最近一项关于7价、10价或13价肺炎球菌结合疫苗(PCV7、PCV10或PCV13)抗体反应的系统综述和荟萃分析发现,在非洲、东南亚和西太平洋地区进行的研究报告的抗体滴度高于在欧洲和美洲进行的研究22;对这些数据的潜在解释尚不清楚。此外,需要更仔细的对照研究来比较高收入国家和低收入国家的注射疫苗免疫原性,因为这里概述的许多研究都比较了独立队列或事后数据分析中的疫苗免疫原性。
越来越多的证据还表明,疫苗诱导的T细胞免疫可能在中低收入国家的个体中受损。抗原CD8+接受YF-17D疫苗的乌干达人的T细胞反应明显低于瑞士人20.尽管这些差异可能是由于在人群之间观察到的病毒载量的差异。此外,在接种卡介苗3个月后,英国100%的婴儿对疫苗产生了干扰素γ (IFNγ)反应结核分枝杆菌相比之下,马拉维的婴儿只有53%23.来自肯尼亚的试验参与者对候选腺病毒载体的HIV-1疫苗的T细胞反应低于来自南非或美国的参与者24.这些数据可能对SARS-CoV-2疫苗产生重要影响,T细胞介导的免疫可能对这种疫苗具有重要的保护作用25.
免疫前免疫状态的作用
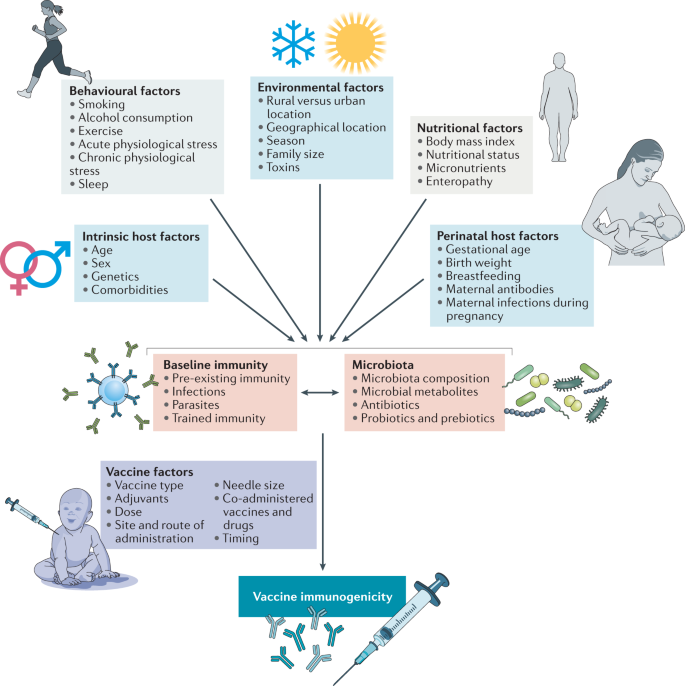
除了显示出显著的地理差异外,婴儿的疫苗免疫原性也明显较低5在老年人中6.例如,流感疫苗在年轻人中的效力估计为70-90%,而在65岁以上的人群中为30-50%6,26.同样,老年人对肺炎球菌多糖和HepB疫苗的反应明显较差6.虽然深入讨论免疫状态随年龄的变化超出了本综述的范围,但人们越来越多地认识到,接种疫苗前个人的免疫状态与他们对疫苗的反应密切相关。已发现基线免疫状态可预测对疫苗的反应,包括流感、YF-17D、HepB和疟疾疫苗27.免疫状态在婴儿期和以后的生活中显著改变28低收入国家和高收入国家的个体之间也存在显著差异29.这为在这些人群中观察到的疫苗接种反应差异提供了一个合理的理由。虽然广泛的因素被认为可以改变疫苗的免疫原性和效力(图。2),包括宿主因素,如遗传、饮食和营养、母体抗体、先前接触和其他感染,以及疫苗相关因素,如疫苗与流行毒株的匹配程度4越来越多的证据表明,肠道菌群是影响基线免疫状态和疫苗接种反应的重要和可靶向因素。
一系列内在宿主因素(如年龄、性别、遗传和共病)和外在因素(如围产期、营养、环境和行为因素)已被建议影响疫苗的免疫原性和/或效力(在参考文献中详细审查)。4).这些因素对疫苗免疫原性的影响可能是通过这些因素对基线免疫和/或微生物群组成的影响间接介导的。当然,疫苗的免疫原性也取决于疫苗本身的因素,例如所使用的佐剂,而且疫苗的效力可能受到疫苗免疫原性以外的因素的影响,例如疫苗与当时流行的毒株之间的匹配程度。
微生物群对疫苗反应的影响
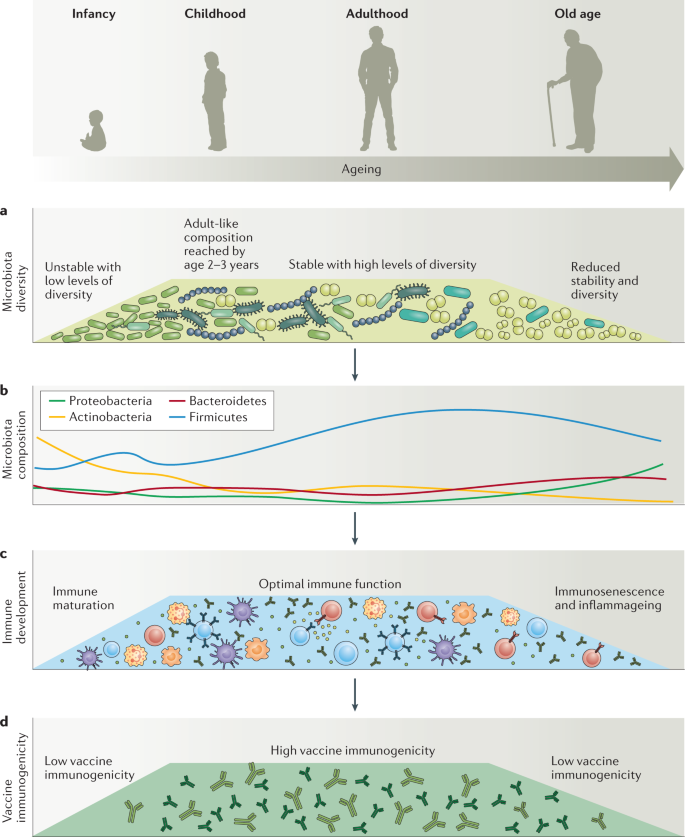
肠道菌群的组成在个体之间是高度可变的,特别是在西化和非西化人群之间(方框)1).此外,微生物群的多样性和稳定性在婴儿期高度可变,并随着年龄的增长而下降,与疫苗免疫原性降低相关(图2)。3.).鉴于有一系列具有成本效益和可扩展的干预措施来调节肠道菌群30.,包括饮食,益生元而且益生菌在美国,肠道菌群越来越被认为是一个有吸引力的靶点,可以增强疫苗在脆弱人群中的有效性。在接下来的章节中,我们将评估来自临床队列研究、介入性研究和动物模型的证据,以表明肠道菌群可以调节免疫接种的免疫反应。
一个|生命早期肠道菌群的组成不稳定,多样性水平低,少数细菌家族往往占主导地位。随着时间的推移,肠道菌群的多样性会增加,直到2 - 3岁之间达到成人的组成8.成人肠道菌群比婴儿时期更复杂(多样性水平更高),但在个体之间也更均匀,并且在没有外部干扰(如抗生素)的情况下,通常相当稳定。b随着人们年龄的增长,肠道菌群的多样性和稳定性会下降7.炎症相关变形菌门的相对丰度也有所增加,放线菌门则有所减少。c|肠道菌群的组成可以强烈影响免疫功能和免疫系统在接种时的基线状态。几项研究表明,基线免疫状态可预测对疫苗接种的反应27.对影响免疫状态随年龄变化的其他因素的深入讨论超出了本综述的范围。d|与健康成人相比,婴儿的疫苗免疫原性较差5在老年人中6.越来越多的数据表明这些现象之间存在因果关系。
临床队列研究的相关证据
几项观察性临床队列研究报告了婴儿微生物群组成与疫苗接种反应之间的关联(补充表1),包括两项研究(一项是加纳的婴儿31还有一种来自巴基斯坦的婴儿32),发现粪便微生物群与对orv的反应之间存在显著关联。在加纳的研究中,疫苗应答者的粪便微生物群(n= 39)与荷兰同龄婴儿(n= 154),而非疫苗应答者(n= 39);来自荷兰的婴儿都被认为是疫苗应答者,因为北欧国家婴儿的ORV血清转换率为>90%。的相对丰度的增加链球菌宝与疫苗接种反应增强显著相关,而相对丰度拟杆菌而且普氏菌种属与疫苗反应呈负相关。对巴基斯坦婴儿的研究规模较小(n= 10每组),并发现在巴基斯坦和荷兰的疫苗应答者的婴儿中,革兰氏阴性细菌,特别是变形菌门的相对丰度增加。有趣的是,肠杆菌科与拟杆菌在加纳的研究中也观察到了疫苗应答者的物种31,这使得作者推测由革兰氏阴性肠杆菌科产生的脂多糖(LPS)可以增强疫苗反应。
在印度和尼加拉瓜对婴儿进行的其他研究没有发现粪便微生物群与对口服口服药物的反应之间存在任何显著联系33,34.然而,有趣的是,在对多项统计比较进行校正之前,尼加拉瓜的研究(可能只有25名婴儿血清转化)确实确定了粪便微生物群中几个属(包括肠杆菌科)的相对丰度与ORV血清转化之间的显著关联。印度研究中的血清转换率非常低(31%),作者推测所有婴儿可能都含有一种抑制轮状病毒疫苗复制的微生物群。一项对中国107名婴儿口服脊髓灰质炎疫苗反应的研究发现,婴儿粪便微生物群中双歧杆菌的相对丰度与脊髓灰质炎病毒特异性IgA反应的增加有关35.相比之下,另一项针对印度婴儿的研究没有发现口服脊髓灰质炎疫苗应答者和非应答者之间特定类群的相对丰度有任何显著差异36.然而,在这两项研究中,微生物群的多样性较高与接种疫苗的反应较差有关。婴儿早期双歧杆菌的相对丰度也被发现与CD4显著相关+在2岁时评估对几种非注射疫苗的T细胞反应和抗体反应37这表明肠道菌群也可能调节对非口服疫苗的反应。
来自介入研究的证据
一些观察性和介入性研究已经调查了抗生素驱动的肠道菌群扰动是否会导致对疫苗接种的反应改变。一项研究分析了墨尔本婴儿研究:卡介苗用于过敏和感染减少(MIS BAIR)的一个子集38发现常规婴儿免疫接种(百白破、HepB、Hib、脊髓灰质炎病毒和PCV13疫苗)的血清保护率或抗体浓度(在7和13月龄时评估)在接种前接触抗生素的婴儿中没有显著差异(大多数婴儿在出生后第一周接受抗生素)。然而,本研究中暴露于抗生素的婴儿样本量有限(n= 29)。一项研究阿奇霉素对健康婴儿口服脊髓灰质炎疫苗免疫原性影响的随机对照试验(RCT)发现,阿奇霉素在11天后接种疫苗前每天注射一次3天,尽管减少了环境肠病的生物标志物和致病性肠道细菌的流行,但并没有提高疫苗的免疫原性39.环境性肠病是一种定义不明确的肠道炎症状态,通常伴有小肠内细菌过度生长,已被认为会导致口服疫苗免疫原性受损40.
另一项针对成年志愿者的随机对照试验(n= 21每组)发现,在口服口服疫苗接种前36小时随机接受广谱抗生素鸡尾酒的参与者,抗轮状病毒IgA滴度没有显著改变。然而,在另一组单独使用万古霉素治疗的志愿者中,与基线相比,接种疫苗后第7天抗轮状病毒IgA滴度增加了两倍以上的比例(作者称之为IgA增强)41.有趣的是,这与加纳婴儿粪便微生物群组成与对orv反应之间关系的研究一致31,肠杆菌科的比例增加拟杆菌在本RCT中,成人疫苗接受者的物种与IgA增强相关。
最近,一种系统疫苗学方法被用于全面评估广谱抗生素对流感疫苗的先天和适应性免疫反应的影响42.广谱抗生素(万古霉素、新霉素和甲硝唑)应用于健康青年(n= 11)接种疫苗前后。抗生素治疗导致肠道细菌负荷减少了1万倍(虽然是短暂的),细菌多样性显著而持久地减少。然而,疫苗接种对中和或抗原结合抗体反应没有显著影响。为了确定这是否是由于预先存在的免疫,对具有低流感病毒基线抗体滴度的个体进行了重复实验。有趣的是,在这些参与者中,抗生素治疗显著降低了h1n1特异性中和和IgG1和IgA结合抗体滴度。此外,在两个研究组中,抗生素治疗导致炎症转录特征的增加,在接种季节性流感疫苗的健康老年受试者中也有类似的增加43,以及不同的代谢轨迹。血清水平降低了1000倍次生胆汁酸在抗生素治疗后,这与炎症的转录特征高度相关,表明次生胆汁酸在抑制炎症中的作用。多组学数据集的综合建模揭示了特定细菌物种和代谢表型之间的显著关联。综上所述,这些结果表明,抗生素驱动的肠道菌群变化可以诱导代谢组发生重大变化,改变炎症反应并损害抗体对疫苗接种的反应。
总之,到目前为止进行的介入研究表明,抗生素驱动的肠道菌群变化可以影响对流感疫苗的反应,也可能影响对orv的反应,尽管所有的研究都受到样本量小的限制,而且抗生素通常是在免疫接种之前施用的。有趣的是,抗生素治疗不影响已有高水平免疫的接受者对流感疫苗的反应,这与抗生素对基线血清阳性水平高的个体对orv反应的有限影响是一致的41.因此,微生物群对接种疫苗的初级反应的影响可能比对次级免疫反应的影响更明显。另一个局限性是,到目前为止,一些研究评估了抗生素对成人疫苗反应的影响。在小鼠实验中(见下一节),研究表明,婴儿期接触抗生素而成年期不接触抗生素会导致对已批准用于婴儿的五种非肠道疫苗的反应受损44这表明,在生命早期对微生物群的改变可能比成年后的改变对疫苗接种的反应有更大的影响。这反过来又提出了一个问题,即抗生素可能对新生儿和婴儿对初级疫苗接种的反应产生什么影响。一项正在进行的临床研究将评估新生儿期直接接触抗生素或分娩时间接接触母亲施用抗生素的婴儿对常规婴儿免疫接种的抗体反应,并与未接触抗生素的婴儿进行比较45.
来自动物模型的证据
来自动物模型的数据提供了令人信服的证据,表明肠道菌群在调节免疫接种反应方面发挥着重要作用。例如,经抗生素治疗和无菌小鼠对口服小鼠轮状病毒株的IgG和IgA反应增强,该病毒株旨在模拟对orv的反应46.相比之下,无菌小鼠和在接受鸡尾酒抗生素治疗的母鼠出生的幼崽在用模型抗原卵清蛋白免疫后,IgG反应受损,尽管差异不大,仅在幼崽在7日龄免疫时观察到,而在随后免疫的幼崽中没有观察到47.更令人信服的是,一项调查微生物群对季节性流感疫苗抗体反应影响的研究发现,抗生素处理后,无菌或Tlr5- / -与对照组小鼠相比,成年小鼠(见下文关于toll样受体5 (TLR5)信号相关性的进一步讨论)的抗体反应明显受损48.在这项研究中,当小鼠接种灭活脊髓灰质炎病毒疫苗时,也观察到类似的效果;然而,抗体对其他几种有反应佐剂的疫苗(如Recombivax HepB疫苗)和活疫苗(如YF-17D疫苗)没有损伤Tlr5- / -老鼠48.最近,研究发现,婴儿时期接触抗生素的小鼠对世界各地婴儿接种的五种不同活疫苗或佐剂许可疫苗的抗体反应明显受损44.这些受损的反应可以通过粪便菌群移植(FMT)来自年龄匹配的未处理小鼠。抗生素驱动的微生物群失调可能影响对疫苗接种的反应,这具有重要意义,因为从2000年到2015年,全球抗生素消费量增加了65%(从211亿剂增加到348亿剂限定日剂量),这主要是由中低收入国家抗生素使用增加造成的49.有趣的是,用抗生素治疗的成年小鼠对相同活疫苗或佐剂疫苗的反应没有受损。这些数据与上述研究是一致的48这也表明,在成年小鼠中,肠道菌群在调节抗体对活疫苗或佐剂疫苗的反应中并没有发挥重要作用。这些数据表明,生命早期存在一个潜在的“机会之窗”,在此期间,微生物群可能对疫苗接种的免疫反应有更显著的影响。这与其他研究一致,这些研究强调了在其他情况下微生物群在免疫系统上留下印记的类似“窗口”。例如,在小鼠中,肠道菌群在断奶时诱导强烈的免疫反应,如果受到抑制,可能导致病理印迹,从而在以后的生活中导致疾病易感性50.
微生物区系和淋巴细胞反应
除了直接调查微生物群在疫苗接种反应中的作用的研究外,其他一些研究强调了肠道微生物群在调节B细胞和T细胞反应中的重要作用,这可能对微生物群对疫苗免疫原性的影响具有重要意义。例如,最近的两项临床前研究表明,粘膜或全身微生物群暴露可形成B细胞组,这对抗原特异性疫苗反应具有重要意义51,52.在第一项研究中,成年无菌小鼠接种A组免疫链球菌(GAS)显著降低b - 1细胞GAS的免疫显性细胞壁多糖特异性的克隆型和血清抗体51.用常规微生物群定植无菌小鼠恢复了这些反应。这些数据可能对婴儿多糖结合疫苗如PCV13具有重要意义。事实上,我们之前已经证明,在婴儿时期接触抗生素的小鼠对PCV13的反应受损44和无菌小鼠(D.J.L.和m.a.l.,未发表的观察)。第二项研究表明,连续暴露于成年无菌小鼠肠道中的不同微生物,导致先前存在的IgA对先前遇到的微生物的反应减弱52.这与连续的系统性微生物暴露形成对比,这导致了不同的IgG库,可以有效地应对这些不同的遭遇。这些数据可以解释口服疫苗反应差的原因,特别是在肠道环境微生物负担高的情况下。
到目前为止,这一领域的大多数工作都集中在微生物群在调节疫苗诱导的抗体反应中的作用。然而,T辅助细胞反应对于B细胞对疫苗接种的最佳反应至关重要3..此外,T细胞介导的免疫被认为在一些许可疫苗(如黄热病和卡介苗)和候选疫苗(如HIV-1疫苗)诱导的保护中起着至关重要的作用。3..T细胞介导的免疫对SARS-CoV-2的重要性也日益得到认识25通过SARS-CoV-2疫苗诱导T细胞免疫可能是长期保护的理想选择。尽管在许多其他情况下,已经报道了微生物群在实质上调节T细胞反应的能力53包括调节对流感病毒感染的反应54,55在美国,相对较少的研究直接调查了微生物群对接种疫苗后T细胞反应的影响。我们已经证明,小鼠早期接触抗生素会导致T细胞在对一系列婴儿疫苗抗原的回忆反应中增加细胞因子的产生44但目前尚不清楚这是否会影响疫苗介导的保护性免疫。
潜在的机制
微生物群调节免疫反应的机制目前尚不完全清楚。已经提出了几种潜在的机制,包括天然佐剂假说、微生物代谢物对B细胞反应的调节以及与疫苗抗原交叉反应的微生物编码表位。在这里,我们讨论支持和反对这些潜在机制的证据。最有可能的是,微生物群可以通过多种方式影响疫苗反应。所涉及的不同途径之间潜在的冗余,以及在不同背景下对微生物群特定组成的依赖,可能解释了为什么到目前为止,完全破译这些机制一直具有挑战性。
模式识别受体对微生物群的先天感知
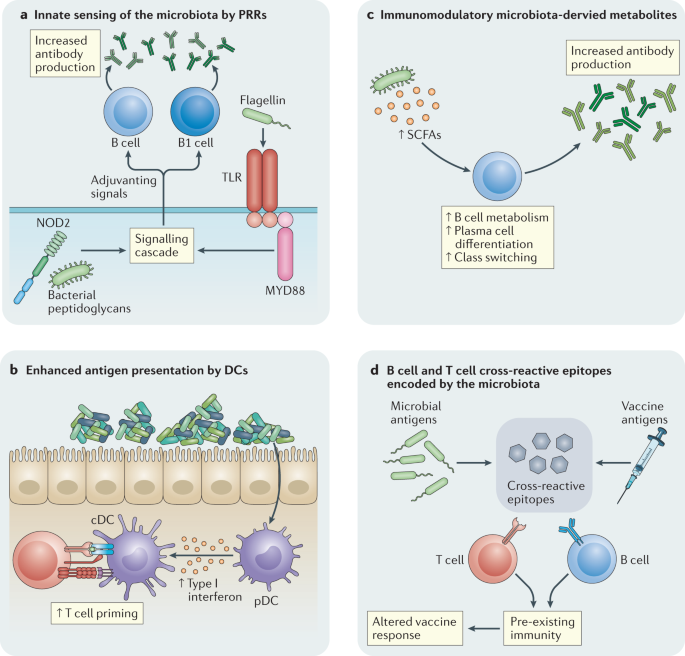
微生物群可能调节疫苗反应的一种潜在方式是通过提供天然佐剂来增强对疫苗的反应(图。4).佐剂是药理学或免疫制剂,如铝盐(明矾),其作用是加速、延长或增强抗原特异性免疫反应。常用的疫苗佐剂通过模式识别受体(PRRs),如TLRs或nod样受体(NLRs),直接或间接激活抗原提呈细胞,如树突状细胞(DCs),它也检测微生物分子,包括微生物菌群产生的分子56.例如,tlr5介导的肠道菌群产生的鞭毛蛋白的感知已被证明是对无佐剂流感疫苗的最佳抗体反应所必需的48.与这些数据一致,TLR5在人外周血单个核细胞上的表达水平与抗体滴度的大小相关血凝抑制试验57.然而,与这些数据相反,另一项研究没有发现年轻小鼠对流感疫苗或PCV13的抗体反应强烈依赖TLR544.这些不同结果的原因还不完全清楚,但有可能是微生物群组成的差异发挥了作用。与肠道菌群明显不同的非同窝野生型小鼠相比,Tlr5- / -小鼠对PCV13的抗体反应明显受损。相反,与具有相似肠道菌群的同窝野生型小鼠相比,对PCV13的抗体反应没有受损44.
一个由微生物产生的免疫调节分子,如鞭毛蛋白和肽聚糖,已在动物模型中显示,通过提供由模式识别受体(PRRs)感知的天然佐剂来调节疫苗反应,如toll样受体(TLRs)和NOD2,由抗原提呈细胞表达。其他免疫调节分子,如脂多糖,也可以类似地调节反应。T细胞和B细胞表达的PRRs也可以直接感知这些分子。b树突状细胞(dc)通过向T细胞呈递疫苗抗原和分泌免疫调节细胞因子,在疫苗免疫应答中发挥重要作用。微生物群通过浆细胞样DCs (pDCs)调节I型干扰素的产生,这反过来指导传统DCs (cdc)中特定的代谢和表观基因组状态,增强T细胞启动。c由微生物群产生的免疫调节代谢物,如短链脂肪酸(SCFAs),可以增强B细胞代谢,以支持抗体产生的能量需求,并可以增加浆细胞分化和类别转换相关基因的表达,可能改变对疫苗接种的反应。d|越来越多的数据表明,微生物群可以编码与病原体编码或疫苗编码的表位交叉反应的表位。交叉反应性B细胞或T细胞的存在可能会改变对疫苗接种的反应。
替代PRR信号通路的激活感应除鞭毛蛋白以外的微生物产物也可能提供类似的辅助信号。与这种可能性一致,NOD2对微生物产生的肽聚糖的感知已被证明是用模型抗原人血清白蛋白和霍乱毒素鼻内免疫的最佳反应所必需的58.此外,已发现微生物群对B-1细胞对GAS反应的影响依赖于MYD88,这是多个TLRs下游的一个关键适配器蛋白51.需要进一步的工作来评估其他PRRs是否也可以调节微生物群对疫苗反应的影响。例如,尽管已经确定细菌LPS(通过TLR4感知)可以对疫苗接种反应产生佐剂作用56,59但是,tlr4介导的对肠道菌群产生的LPS的感知是否能调节疫苗免疫反应仍有待研究。微生物群中不同的细菌类群产生不同类型的LPS,具有不同程度的免疫原性,这可能使情况进一步复杂化60.
微生物群提供天然疫苗佐剂的能力也可能取决于其他因素,包括产生的特定免疫调节产物的数量,以及这些产物是局限于肠道还是逃逸到外围。特定病原体的大量繁殖,如产生LPS的肠杆菌科成员,在肠道发炎或抗生素暴露后经常过度生长,可能导致肠道和周围LPS水平的增加61,从而影响对与这些花同时施用的疫苗的反应。微生物群影响对非注射疫苗反应的能力也可能取决于肠道屏障的完整性。当肠道上皮屏障受损时,例如由于肠道炎症、营养不良或抗生素暴露,由肠道菌群产生的抗原和免疫调节产物水平的增加很容易在外围检测到,在那里它们可以调节全身免疫反应62.此外,肠道微生物群中特定类群产生的代谢物可以通过上调上皮紧密连接蛋白来支持肠道屏障的完整性63这表明,肠道菌群中特定类群的丰度可能会改变肠道“渗漏”的程度,从而改变周围菌群产生的天然佐剂的数量。
微生物群介导的抗原提呈细胞重编程
抗原呈递细胞,如树突状细胞,在将疫苗抗原呈递给T细胞和控制随后免疫反应的大小、质量和持久性方面起着至关重要的作用。PRRs控制这些细胞的关键功能56越来越多的数据表明,微生物群可以有效地调节DC功能,这表明微生物群可以作为疫苗接种的天然佐剂(图2)。4 b).经鼻内接种灭活霍乱毒素后,tlr介导的肺dc对微生物群的感知导致IgA上肠归巢受体α4β7整合素和cc趋化因子受体9的上调+B细胞。这些细胞从肺部迁移到肠道,从而防止霍乱毒素的口服挑战64.在无菌小鼠接受无活性霍乱毒素鼻内免疫后,肠道中抗原特异性IgA水平显著降低。此外,广谱抗生素对微生物群的消耗已被证明可以抑制重症监护室小鼠和人类肺部总IgA的tlr依赖性产生,从而增加对铜绿假单胞菌感染65.
最近,微生物群也被证明可以调节浆细胞样dc的I型干扰素的本构生产66.浆细胞样dc产生的I型干扰素在传统dc中诱导特定的表观基因组和代谢状态,从而更有效地启动抗原特异性T细胞反应。微生物群也可能通过对其他抗原提呈细胞的作用而对疫苗反应产生佐剂效应。例如,研究发现,对于微生物群产生的鞭毛蛋白增强抗体对无佐剂流感疫苗的反应的能力而言,DCs是可有可无的48.相反,这些作用依赖于巨噬细胞,因为在免疫后7天,巨噬细胞耗尽的小鼠未能对疫苗产生可检测的抗体反应。微生物群也被证明可以调节肠上皮细胞的抗原呈递67,这可能会对口服疫苗的免疫反应产生影响,并且,正如下面更详细地讨论的那样,微生物群也可以对B细胞和T细胞产生直接影响。
微生物代谢产物的免疫调节
除了PRRs所感知的分子外,肠道菌群还产生大量的代谢物68有可能调节免疫反应(图。4摄氏度).其中研究得最好的是短链脂肪酸(SCFAs),如醋酸盐、丁酸盐和丙酸盐,它们是结肠中细菌发酵的主要代谢最终产物。SCFAs已被证明可以增加B细胞中的氧化磷酸化、糖酵解和脂肪酸合成,以支持最佳稳态(非病原体特异性)抗体反应的能量需求枸橼酸杆菌属rodentium感染69.该研究还表明,SCFAs增强了浆细胞分化和类转换相关基因的表达。然而,最近的一项研究报道,SCFAs抑制而不是增强对灌胃给药卵清蛋白的抗体反应,以及抑制自身抗体反应70.鉴于这些相互矛盾的报告,需要进一步的工作来评估SCFAs对口服和注射疫苗的抗体反应的影响。
除了SCFAs,许多其他微生物代谢产物的免疫调节特性,包括继发胆汁酸和色氨酸代谢产物,正在越来越多地被发现。例如,抗生素治疗已被证明可显著降低继发性胆汁酸水平,在接种流感疫苗的人体内,继发性胆汁酸的降低与炎症特征的增强有关42.如前所述,微生物群衍生的代谢物也可能通过增强肠道屏障完整性间接调节对疫苗接种的免疫反应71因此,可能会减少增强肠外疫苗反应的微生物分子的逃逸。还需要进一步的工作来评估这些代谢物对其他免疫细胞群的免疫调节作用,这些免疫细胞群调节对疫苗的反应,如T细胞和dc。在其他情况下,SCFAs对T细胞有强大的作用72但SCFAs是否能调节疫苗诱导的T细胞介导的免疫仍有待研究。
微生物编码的交叉反应抗原
之前对人类的研究已经确定了CD4+记忆T细胞特异性的病原体编码抗原的个体之前没有感染这些病原体73.一种可能的解释是T细胞受体(TCR)对环境抗原的交叉反应,特别是由肠道菌群编码的抗原和表位(图2)。4 d).循环和组织驻留CD4+对肠道菌群具有反应性的T细胞在健康个体中大量存在74生物信息学预测表明,在人类蛋白质组、肠道微生物群和致病菌之间存在广泛的TCR表位库共享75因此,疫苗编码的病原体抗原。越来越多的数据表明,这些交叉反应性T细胞(在某些情况下,交叉反应性B细胞)的存在76)可以通过抑制或增强病原体相关抗原表位的免疫原性来调节对病原体的免疫反应76,77.基线交叉反应T细胞的存在也已被证明与流感疫苗的免疫反应呈正相关78.这些研究没有确定交叉反应T细胞的起源,但其他研究已经确定T细胞与流感病毒来源的多肽和微生物区系中分类单元编码的表位发生交叉反应73.最近,MHC i类限制的肿瘤抗原和编码在基因组中的噬菌体蛋白表位之间的交叉反应肠球菌hirae有报道。老鼠在大肠hirae携带这种噬菌体可以改善对免疫治疗的反应79.肠道菌群编码的表位是否会刺激B细胞或T细胞,从而与疫苗抗原发生交叉反应并改变免疫应答,目前尚不清楚,但肠道菌群影响疫苗应答的潜在机制值得进一步研究。
针对微生物群
针对微生物群的干预措施,包括益生元、益生菌、synbiotics, FMT和小分子药物抑制特定的微生物过程,正在许多情况下被广泛研究30.,80.尽管其中一些药物,如FMT,不太可能在人群规模上可行,或处于非常早期的开发阶段,如针对微生物群的药物,但其他一些药物,如益生菌(有或没有益生元或其他饮食干预),由于其安全性、成本效益和可扩展性,可能是提高疫苗疗效的更有吸引力的干预措施81.益生菌已经被证明是预防坏死性小肠结肠炎、急性腹泻和败血症等疾病的有效干预措施82,83,84.此外,最近的一项临床前研究表明,合生素可以增强小鼠对口服霍乱疫苗的反应,这些小鼠被无反应婴儿的微生物群定殖85.
最近的系统回顾86据报道,迄今为止开展的26项随机对照试验中只有~50%发现益生菌对疫苗反应有有益作用(补充表)2).然而,这些试验有一些局限性,包括样本量小(n在许多研究中每组<50)。此外,所调查的益生菌菌株的差异,包括它们的纯度和活力,以及给药的时间、持续时间和剂量,使得这些研究难以直接比较。也许更重要的是,这些试验都没有专门招募微生物群被破坏的参与者(例如,那些接触抗生素的人)。26项rct中有12项未报告参与者是否暴露于抗生素;9特别排除了这些参与者,在那些包括抗生素暴露参与者的研究中,样本量非常小。给已经很好地定殖的健康婴儿服用益生菌,对免疫接种的免疫反应有显著影响,这是极不可能的。因此,有必要开展强有力的随机对照试验,评估针对微生物群的干预措施对微生物群中断的婴儿的有益影响。
研究针对微生物群的干预措施(如益生元和益生菌)对老年人疫苗反应影响的试验主要研究了对流感疫苗的反应。这些研究发现,在补充益生菌的老年人中,疫苗反应几乎没有改善87,88,89,90;然而,参与者的数量很少,这些研究大多使用益生菌含有乳酸菌这些菌株在成人肠道中并不常见。需要进一步的研究来确定适合成年人的益生菌菌株,这些菌株可能对老年人的干预更有益。一些研究表明,益生菌可以意外地延迟抗生素暴露后微生物群的重新建立91,虽然正常的再定殖可能不需要有益的效果。例如,管理双歧杆菌bifidum基于益生菌的抗生素治疗小鼠阻止了病原体的定植和抑制炎症,而没有完全恢复肠道微生物群的多样性92.鉴于肠道屏障完整性和微生物产物易位对疫苗接种反应的潜在影响,针对微生物群的干预措施可能不需要完全将肠道微生物群恢复到“健康”状态才能受益。
结论与展望
上面讨论的研究为肠道菌群调节B细胞和T细胞对疫苗接种的反应这一观点提供了强有力的支持,尽管还需要进一步的工作。越来越多的婴儿观察性研究已经确定了肠道微生物群中的特定细菌门和家族与疫苗免疫反应之间的关联37;然而,因果关系仍有待证实。鉴定介导这些影响的确切细菌种类或菌株对于证明这些因果关系和阐明所涉及的机制至关重要。到目前为止,队列研究在这方面受到限制,因为他们使用的是16S rRNA测序,缺乏物种特异性和菌株特异性的分辨率,而不是鸟枪宏基因组学。此外,介入研究,例如,评估益生菌或抗生素对疫苗反应的影响,迄今为止明显不足,并提供的证据表明,微生物群对疫苗反应的影响相对较小41,42,86尽管它们确实表明,对低水平原有免疫的人的抗体反应有更大的影响,对代谢组和先天免疫反应有主要影响42,93.现在需要更大规模、更有力的试验来扩展这些数据,特别是评估针对适当人群(如生活在中低收入国家的婴儿)的干预措施的试验。
如上所述,广泛的其他因素被认为可以改变疫苗的免疫原性和/或效力(图。2),包括内在宿主因素(年龄、性别和遗传)、营养因素(饮食、体重指数、微量营养素和肠病)、围产期因素(母乳喂养、胎龄和产时抗生素)、环境因素(地理位置、农村与城市位置、家庭规模和季节)和其他感染4.大多数这些因素也已被证明会影响肠道菌群的组成和基线免疫。在人类队列研究中解开这些高度复杂的相互依存关系是非常具有挑战性的。这些复杂性需要使用多组学系统疫苗学方法进行研究,并对潜在的混杂因素进行适当的统计控制,类似于最近用于调查肠道微生物群与流感疫苗反应之间联系的研究42,93.
另一种解开这些相互依存关系的方法是使用精心设计的临床前研究,可以通过严格调节环境和饮食、年龄匹配和性别匹配以及使用同窝伴侣来控制这些因素。我们正在使用的一种方法来建立特定细菌类群和疫苗反应之间的因果关系,是将无菌小鼠与来自微生物群的特定细菌菌株单定殖,这些细菌菌株与人类队列中改变的疫苗反应有关,然后评估这些小鼠对相同疫苗的免疫反应。类似的方法先前已用于在其他情况下确定肠道微生物群中的免疫调节类群94.这些实验可能会发现新的益生菌菌株,这些菌株对疫苗反应有不成比例的有益影响,也可以用于根据个人的微生物群筛选更个性化的益生菌85.这一点很重要,因为人们不能假设对高收入国家婴儿有益的益生菌对低收入和中等收入国家的婴儿有相同的效果,因为在低收入和中等收入国家,微生物群的组成可能有本质上的不同(框)1).在老年人等其他脆弱群体中,疫苗反应也往往不理想6或者肥胖症患者95.衰老和肥胖都与肠道菌群失调有关。考虑到老年人和肥胖者感染COVID-19的风险更高,可以在这些人群中提高疫苗有效性(包括SARS-CoV-2疫苗)的干预措施,即使是小幅提高,也可能是非常可取的96.
我们概述了几种潜在的免疫机制,通过这些机制,微生物群可以影响免疫接种的免疫反应。然而,鉴于不同研究中的数据有时相互矛盾,大多数提出的机制仍然是合理的假设,而不是既定的事实。现在需要进一步的工作来更充分地阐明这些机制在不同的背景下。不同途径之间的冗余,以及特定个体或人群中某些机制的相对重要性与肠道菌群组成之间的潜在依赖关系,可能会使这些努力复杂化。更好地了解微生物群如何在不同人群和不同情况下调节疫苗反应,也可能为使用更有针对性的人群特异性佐剂提供信息,以增强对疫苗的反应。到目前为止,这一领域的大部分研究都集中在肠道菌群,主要是其细菌成分。根据接种途径的不同,其他部位的微生物群也可能发挥关键作用。例如,nod2介导的菌群感知是对模型抗原鼻内免疫的最佳反应所必需的58.此外,鼻腔微生物群的组成与减毒流感活疫苗的IgA反应有关97.皮肤微生物群也可能影响对皮内疫苗的免疫反应98考虑到人们对使用微针阵列进行疫苗注射的兴趣,这一点可能越来越重要99.鉴于我们对真菌菌群和病毒组在调节免疫反应方面的贡献越来越了解,还需要进一步的工作来研究它们调节疫苗反应的潜力79,One hundred..例如,最近的研究表明,肠道病毒比细菌菌群对口服脊髓灰质炎疫苗的反应有更大的影响36.最后,人们日益认识到,疫苗不仅能诱导特异性免疫,而且还能对不相关感染的免疫反应产生强有力的非特异性作用101.肠道菌群是否会影响疫苗的非特异性效果,据我们所知,几乎完全未被探索。鉴于人们日益认识到这些影响的潜在重要性,应该优先考虑这一领域的调查。
参考文献
安德烈,F. E.等。疫苗接种大大减少了世界范围内的疾病、残疾、死亡和不平等。公牛。世界卫生组织。86, 140-146(2008)。
Lewnard, J. A., Lo, N. C., Arinaminpathy, N., Frost, I. & Laxminarayan, R.低收入和中等收入国家的儿童疫苗和抗生素使用。自然581, 94-99(2020)。
sigrist, C. A.疫苗免疫学。在疫苗(Plotkin, s.a., Orenstein, w.a. & Offit, p.a.) 17-36 (Elsevier Inc, 2008)。
齐默尔曼,P.和柯蒂斯,N.影响免疫反应的因素接种。中国。Microbiol。牧师。32, e00084-18(2019)。
普拉布hudas等人。婴儿免疫方面的挑战:对感染和疫苗反应的影响。Immunol Nat。12, 189-194(2011)。
Ciabattini, A.等人。老年人接种疫苗:免疫系统随年龄增长而变化的挑战。Semin。Immunol。40, 83-94(2018)。
DeJong, E. N., Surette, M. G. & Bowdish, D. M.,肠道微生物群与不健康衰老:从结果中分离原因。细胞宿主微生物28, 180-189(2020)。
Backhed, F.等人。生命第一年人类肠道微生物群的动态和稳定。细胞宿主微生物17, 690-703(2015)。
Pasolli, E.等人。从跨越年龄、地理和生活方式的宏基因组中,超过150,000个基因组揭示了广泛的未开发的人类微生物组多样性。细胞176, 649-662(2019)。
Lynn, D. J. & Pulendran, B.微生物群影响疫苗反应的潜力。j . Leukoc。医学杂志。103, 225-231(2017)。
帕克,e.p.等人。发展中国家口服疫苗效力受损的原因。未来Microbiol。13, 97-118(2018)。
帕特尔,等人。抗轮状病毒血清IgA抗体滴度作为轮状病毒疫苗疗效的潜在相关因素的系统综述j .感染。说。208, 284-294(2013)。
克拉克等人。口服轮状病毒活疫苗随访时间的疗效:一项随机对照试验的meta回归柳叶刀感染。说。19, 717-727(2019)。这项荟萃分析显示,口服轮状病毒疫苗的效力在低收入国家的婴儿中显著受损.
哈兰德,H. O.等人。校准的血清学技术表明,瑞典和尼加拉瓜儿童对口服灭活霍乱疫苗的血清反应率显著不同。疫苗21, 138-145(2002)。
帕特里卡,P. A.,赖特,P. F.和约翰,T. J.影响口服脊髓灰质炎病毒疫苗免疫原性的因素在发展中国家:综述。启感染。说。13, 926-939(1991)。
Levine, m.m., Kotloff, k.l., Barry, e.m., Pasetti, m.f. & Sztein, m.b.志贺氏菌疫苗的临床试验:在漫长而艰难的道路上,前进两步,后退一步。Nat. Rev.微生物。5, 540-553(2007)。
Rusmil, K.等。印度尼西亚百白破-乙肝- hib联合疫苗在扩大免疫计划中的免疫原性、安全性和一致性BMC Pediatr。15, 219(2015)。
Dbaibo, G.等。四价流感疫苗在五个流感季节预防疾病并减少不同地理区域的医疗保健利用:一项随机临床试验Pediatr。感染。说。J。39, e1-e10(2020)。
Rts, S/AS01疟疾疫苗在接种后18个月内的有效性和安全性:一项在11个非洲地点的儿童和幼儿中进行的3期随机对照试验。科学硕士。11, e1001685(2014)。
Muyanja, E.等人。免疫激活改变了对黄热病17D疫苗的细胞和体液反应。j .中国。投资。124, 3147-3158(2014)。
Pasin, C.等人。对主要增强埃博拉疫苗的体液免疫反应的动态:量化和变异来源j .性研究。93, e00579-19(2019)。
Choe, Y. J., Blatt, D. B., Lee, H. J.和Choi, E. H.临床试验中肺炎球菌结合疫苗的地理区域和免疫反应变化之间的关联:系统回顾和荟萃分析。Int。j .感染。说。92, 261-268(2020)。
拉洛,M. K.等人。婴儿卡介苗免疫应答的人群差异。j .感染。说。199, 795-800(2009)。
巴登,L. R.等。2种新型HIV-1预防疫苗平台的安全性和免疫原性评估:一项随机试验安。实习生。地中海。164, 313-322(2016)。
不仅是抗体:B细胞和T细胞介导对COVID-19的免疫。Nat. Rev. Immunol。20., 581-582(2020)。
Osterholm, m.t., Kelley, n.s., Sommer, a . & Belongia, E. a .流感疫苗的疗效和有效性:系统综述和荟萃分析。柳叶刀感染。说。12, 36-44(2012)。
曾,J. S.等。提高疫苗诱导免疫:基线能预测结果吗?Immunol趋势。41, 457-465(2020)。
西蒙,A. K.霍兰德,G. A.和麦克迈克尔,A.人类从婴儿到老年免疫系统的进化。Proc,杂志。科学。282, 20143085(2015)。
希尔,D. L.等。非洲儿童的免疫系统发育因年龄、部位和贫血而异。科学。Transl地中海。12, eaaw9522(2020)。这项研究比较了非洲和欧洲儿童的免疫系统发育,表明这些人群之间的基线免疫状态有显著差异.
沃戈,J. A.调节肠道微生物。科学369, 1302-1303(2020)。
哈里斯,v.c.等人。加纳农村婴儿肠道微生物组与轮状病毒疫苗反应显著相关。j .感染。说。215, 34-41(2017)。这项研究表明,婴儿肠道微生物群中的特定类群与口服轮状病毒疫苗的反应相关.
哈里斯,V.等。轮状病毒疫苗应答与巴基斯坦婴儿肠道菌群组成相关。肠道微生物9, 93-101(2018)。
帕克,E. P. K.等。肠道菌群对印度南部婴儿口服轮状病毒疫苗免疫原性的影响疫苗36, 264-272(2018)。
Fix, J.等人。尼加拉瓜婴儿肠道微生物组组成与轮状病毒疫苗反应之间的关联。点。j .太多。地中海,Hyg。102, 213-219(2020)。
赵,T.等。肠道菌群对脊髓灰质炎疫苗黏膜IgA抗体应答的影响NPJ疫苗5, 47(2020)。
普拉哈拉杰,我等人。非脊髓灰质炎肠道病毒和肠道细菌菌群对口服脊髓灰质炎病毒疫苗反应的影响:来自南印度的一项研究j .感染。说。219, 1178-1186(2019)。
胡达,M. N.等。婴儿早期双歧杆菌丰度和2岁时的疫苗反应。儿科143, e20181489(2019)。这项研究表明,婴儿肠道菌群中双歧杆菌的相对丰度与对非注射疫苗的反应相关.
齐默尔曼等人。生理性别影响婴儿出生后第一年对常规疫苗接种的抗体反应。学报。Paediatr。109, 147-157(2020)。
Grassly, n.c.等人。阿奇霉素对口服脊髓灰质炎病毒疫苗免疫原性的影响:在血清阴性的印度婴儿中进行的一项双盲随机安慰剂对照试验柳叶刀感染。说。16, 905-914(2016)。
吉尔马丁,A. A. &佩特里,W. A. Jr.探讨环境肠病在营养不良、婴儿发育和口服疫苗反应中的作用。费罗斯。反式。R Soc。Lond。B杂志。科学。370, 20140143(2015)。
哈里斯,v.c.等人。抗生素介导的微生物组调节对轮状病毒疫苗免疫原性的影响:一项人类随机对照概念验证试验细胞宿主微生物24, 197-207(2018)。
Hagan, T.等。抗生素驱动的肠道微生物群扰动改变了人类对疫苗的免疫力。细胞178, 1313-1328(2019)。这项研究表明,既往免疫水平较低的成年志愿者在接受抗生素治疗后,对季节性流感疫苗的反应明显减弱.
Nakaya, H. I.等。对不同人群多年流感疫苗免疫的系统分析揭示了共同的分子特征。免疫力43, 1186-1198(2015)。
Lynn, m.a.等。早期抗生素驱动的生态失调导致小鼠的疫苗免疫反应失调。细胞宿主微生物23, 653-660(2018)。这项研究表明,在小鼠中,早年接触抗生素会导致对获准用于婴儿的五种不同活疫苗和佐剂疫苗的反应受损.
澳大利亚新西兰临床试验注册中心(ANZCTR)。一项确定抗生素驱动的生态失调是否与婴儿疫苗反应受损相关的临床研究。ANZCTRhttps://www.anzctr.org.au/Trial/Registration/TrialReview.aspx?id=373071&isReview=true(2017)。
内山,R., Chassaing, B., Zhang, B. & Gewirtz, A. T.抗生素治疗抑制轮状病毒感染和增强特异性体液免疫。j .感染。说。210, 171-182(2014)。
Lamousé-Smith, E. S., Tzeng, A. & Starnbach, M. N.肠道菌群是支持婴儿和无菌小鼠系统免疫的抗体反应所必需的。《公共科学图书馆•综合》6, e27662(2011)。
哦,j。z。等人。tlr5介导的肠道菌群检测对于季节性流感疫苗的抗体应答是必要的。免疫力41, 478-492(2014)。这项研究表明,感知微生物群产生的鞭毛蛋白是小鼠对季节性流感疫苗的最佳反应所必需的.
克莱因,E. Y.等。2000年至2015年期间抗生素消费的全球增长和地理趋同。国家科学院学报美国115, e3463-e3470(2018)。
Al Nabhani, Z.等。对微生物群的断奶反应是成人对免疫病理的抵抗所必需的。免疫力50, 1276-1288(2019)。
New, J. S.等。新生儿暴露于共生细菌来源的抗原指导多糖特异性B-1 B细胞库的发展。免疫力53, 172-186(2020)。本研究表明,用GAS免疫的无菌小鼠显著降低了B-1细胞的克隆型和免疫显性GAS细胞壁多糖特异性的血清抗体水平.
李,H.等。粘膜或系统微生物暴露形成B细胞库。自然584, 274-278(2020)。
Kageyama, T, Matsuo, T, Kurakake, R. & Sano, T. T细胞与微生物群在健康和疾病中的关系。掠夺。摩尔。杂志。Transl科学。171, 95-129(2020)。
Abt, m.c.等。共生菌调节先天抗病毒免疫的激活阈值。免疫力37, 158-170(2012)。
Ichinohe, T.等。微生物区系调节呼吸道甲型流感病毒感染的免疫防御。国家科学院学报美国108, 5354-5359(2011)。
葛格,P. &桑德,L. E.调节疫苗反应的先天传感器。咕咕叫。当今。Immunol。59, 31-41(2019)。
Nakaya, H. I.等。人类季节性流感疫苗接种的系统生物学。Immunol Nat。12, 786-795(2011)。
金,D.等人。nod2介导的菌群识别对于霍乱毒素的粘膜佐剂活性至关重要。Nat,地中海。22, 524-530(2016)。
Kasturi, s.p.等。编程先天免疫的抗体反应的大小和持久性。自然470, 543-547(2011)。
Vatanen, T.等。微生物组LPS免疫原性的变化有助于人类自身免疫。细胞165, 842-853(2016)。
曾明义,Inohara, N. & Nunez, G.炎症驱动的肠道细菌失调机制。粘膜Immunol。10, 18-26(2017)。
穆Q, Kirby, J., Reilly, C. M. & Luo X. M.肠道渗漏是自身免疫性疾病的危险信号。前面。Immunol。8, 598(2017)。
辛格,R.等。微生物代谢产物通过Nrf2途径增强肠道屏障的完整性。Commun Nat。10, 89(2019)。
Ruane, D.等人。微生物群调节肺树突状细胞诱导IgA类开关重组和产生保护性胃肠道免疫反应的能力。实验,医学。213, 53-73(2016)。
罗巴克,o.h.等人。抗生素治疗引起的继发性IgA缺乏症增加了铜绿假单胞菌肺炎的易感性。j .中国。投资。128, 3535-3545(2018)。
Schaupp, L.等。微生物群诱导的I型干扰素指导树突细胞处于平衡的基础状态。细胞181, 1080-1096(2020)。这项研究表明,微生物群通过浆细胞样dc调节I型干扰素的本构性表达,导致在传统dc中诱导特定的表观基因组和代谢状态,从而更有效地启动抗原特异性T细胞反应.
小山,等人。MHC II类抗原呈递肠上皮引发移植物抗宿主病,并受到微生物群的影响。免疫力51, 885-898(2019)。
Bittinger, K.等人。细菌定植重组新生儿肠道代谢组。Microbiol Nat。5, 838-847(2020)。
Kim, M., Qie, Y., Park, J. & Kim, C. H.肠道微生物代谢物燃料宿主抗体反应。细胞宿主微生物20., 202-214(2016)。这项研究表明,由微生物群产生的SCFAs增强B细胞代谢和基因表达,以支持最佳的稳态和病原体特异性抗体反应.
桑切斯,H. N.等人。膳食纤维衍生的短链脂肪酸对抗体反应的B细胞固有表观遗传调节。Commun Nat。11, 60(2020)。
Scott S. A., Fu J. & Chang P. V.微生物色氨酸代谢物通过芳香烃受体调节肠道屏障功能。国家科学院学报美国117, 1936 - 19387(2020)。
微生物代谢产物的免疫识别。Nat. Rev. Immunol。20., 91-92(2020)。
苏丽芳,基德,韩安安,高钦,J. J. &戴维斯,m.m.病毒特异性CD4+记忆表型T细胞在未暴露的成年人中大量存在。免疫力38, 373-383(2013)。
赫加齐,A. N.等。循环和组织驻留CD4+对肠道菌群具有反应性的T细胞在健康个体中大量存在,并且在炎症期间功能发生改变。胃肠病学153, 1320-1337(2017)。
Bremel, R. D. & Homan, E. J.人类蛋白质组、胃肠道微生物组和致病菌之间广泛的t细胞表位库共享:对自我定义的影响。前面。Immunol。6, 538(2015)。
威廉姆斯,W. B.等。hiv - 1疫苗。gp41-菌群交叉反应抗体转移HIV-1疫苗诱导的免疫科学349, aab1253(2015)。
卡拉斯科Pro, S.等。微生物区系表位的相似性可以抑制或增强疾病相关抗原表位的免疫原性。《公共科学图书馆•综合》13, e0196551(2018)。
威尔金森,t.m.等人。预先存在的流感特异性CD4+T细胞与人类抵御流感挑战的疾病保护相关。Nat,地中海。18, 274-280(2012)。
弗卢基格,A.等。肿瘤MHC i类限制性抗原和肠球菌噬菌体之间的交叉反应。科学369, 936-942(2020)。
Cully, M.微生物组疗法采用小分子疗法。Nat. Rev.药物发现18, 569-572(2019)。
桑德斯,M. E,梅伦斯坦,D. J.,里德,G.,吉布森,G. R. &拉斯托尔,R. A.肠道健康和疾病中的益生菌和益生元:从生物学到临床。胃肠醇。乙醇。16, 605-616(2019)。
益生菌预防早产儿坏死性小肠结肠炎。Evid。基础的孩子。健康9, 584-671(2014)。
szjewska, H.等人。系统综述与荟萃分析:鼠李糖乳杆菌GG治疗儿童急性胃肠炎- 2019年更新。滋养品。杂志。其他。49, 1376-1384(2019)。
Panigrahi, P.等人。一项旨在预防印度农村婴儿败血症的随机共生试验。自然548, 407-412(2017)。
Di Luccia, B.等人。联合益生元和微生物干预改善口服霍乱疫苗在儿童营养不良小鼠模型中的反应。细胞宿主微生物27, 899-908(2020)。这项研究表明,合生素可以增强小鼠对口服霍乱疫苗的免疫反应,这些小鼠被非反应婴儿的微生物群定殖.
齐默尔曼,P. &柯蒂斯,N.益生菌对疫苗反应的影响-一项系统综述。疫苗36, 207-213(2018)。
Maruyama, M.等。非活乳酸菌对老年人免疫功能的影响:一项随机、双盲、安慰剂对照研究Int。j .食物。科学。减轻。67, 67-73(2016)。
Akatsu, H.等。果冻中的乳酸菌可增强老年人流感疫苗接种的效果。j。Geriatr。Soc。61, 1828-1830(2013)。
Bunout, D.等。营养补充剂对自由生活的智利老年人免疫反应和细胞因子产生的影响帕尔特。肠内减轻。28, 348-354(2004)。
博格,T.等人。在两项随机对照试验中,益生菌发酵乳饮料提高了老年人对流感疫苗的抗体反应。疫苗27, 5677-5684(2009)。
科特勒,E.等。抗生素后肠道粘膜微生物群重建被益生菌破坏,并通过自体FMT改善。细胞174, 1406-1423(2018)。
Ojima, m.n.等人。两歧双歧杆菌抑制反复抗生素干扰引起的小鼠肠道炎症,但没有恢复小鼠肠道微生物群多样性。前面。Microbiol。11, 1349-1349(2020)。
B.用疫苗教授免疫学。科学366, 1074-1075(2019)。
Geva-Zatorsky, N.等人。挖掘人体肠道微生物群中的免疫调节有机体。细胞168, 928-943(2017)。
Painter, s.d., Ovsyannikova, i.g. & Poland, g.a.肥胖对人体免疫反应的影响。疫苗33, 4422-4429(2015)。
肥胖如何给COVID疫苗带来问题。自然586, 488-489(2020)。
索尔克,h.m.等人。鼻腔微生物群的分类单元与流感特异性IgA对减毒活疫苗的反应相关。《公共科学图书馆•综合》11, e0162803(2016)。
陈,Y. E, Fischbach, m.a.和Belkaid, Y.皮肤微生物-宿主相互作用。自然553, 427-436(2018)。
金,E.等人。微针阵列递送重组冠状病毒疫苗:免疫原性和快速转化开发。EBioMedicine55, 102743(2020)。
杨,F.等。实验室小鼠在自然环境中的免疫改变与真菌定植有关。细胞宿主微生物27, 809-822(2020)。
Aaby, P.等。疫苗的非特异性和性别差异效应。Nat. Rev. Immunol。20., 464-470(2020)。
肠道微生物群:西方化和肠道多样性的消失。咕咕叫。医学杂志。25, r611-r613(2015)。
Smits, S. A.等。坦桑尼亚哈扎族狩猎采集者肠道微生物群的季节性循环。科学357, 802-806(2017)。
De Filippo, C.等人。一项针对欧洲和非洲农村儿童的比较研究揭示了饮食对塑造肠道微生物群的影响。国家科学院学报美国107, 14691-14696(2010)。
Brushett, S, Sinha, T, Reijneveld, S. A, de Kroon, M. L. A. & Zhernakova, A.城市化对婴儿肠道微生物群和健康结果的影响。前面。Pediatr。8, 408(2020)。
范盖,P.等人。美国移民使人类肠道微生物群西化。细胞175, 962-972(2018)。
确认
这项工作得到了澳大利亚国家健康和医学研究委员会的资助(APP1156415和APP1098429给D.J.L.)和EMBL澳大利亚小组组长奖(给D.J.L.)。B.P.实验室的工作由NIH资助U19AI090023(给B.P.), U19AI057266(给R. Ahmed和B.P.),肖恩帕克癌症研究所,索弗捐赠基金和Violetta Horton捐赠基金支持。作者感谢Lynn实验室的其他成员和S. Wesselingh对手稿的有益评论。由于篇幅限制,作者很遗憾不能在这篇综述中引用所有相关文献。
作者信息
作者及隶属关系
贡献
所有作者都对本评论的写作、编辑和准备做出了贡献。
相应的作者
道德声明
相互竞争的利益
作为该领域合作研究协议的一部分,D.J.L.得到了葛兰素史克的资助。B.P.是葛兰素史克(GlaxoSmithKline)外部免疫学网络的成员,也是Medicago的科学顾问委员会成员。s.c.b和m.a.l声明没有利益冲突。
额外的信息
同行评审信息
《自然评论》免疫学感谢D. Kasper, G. Stefanetti和P. Zimmermann对这项工作的同行评审所做的贡献。
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
补充信息
术语表
- 注射用药物的疫苗
-
非口服注射入体内的疫苗。
- 益生元
-
宿主菌群选择性使用的基质,对健康有益。
- 益生菌
-
当施用适量时,对宿主的健康有益的活微生物。
- 次生胆汁酸
-
由肠道菌群在肝脏中合成的初级胆汁酸(如胆酸和鹅去氧胆酸)代谢产生的代谢物(如脱氧胆酸和石胆酸)。
- 佐剂的疫苗
-
佐剂疫苗含有佐剂的疫苗,佐剂是一种增强免疫系统对疫苗抗原反应的物质
- 粪便菌群移植
-
(FMT)。将供者的粪便溶液注入受者体内,以将供者的微生物群转移到受者体内。
- b - 1细胞
-
先天B细胞一种专门的先天B细胞,在胎儿和新生儿生活中占主导地位
- 血凝抑制试验
-
一种利用某些病毒血凝(结合)红细胞的能力来滴定抗体对病毒感染或疫苗接种的反应的方法。
- Synbiotics
-
一种活微生物(益生菌)和宿主微生物(益生元)选择性使用的基质的混合物,它们共同对宿主的健康有益。
权利和权限
关于本文
引用本文
林恩,dj,本森,s.c.,林恩,硕士et al。微生物群对疫苗免疫反应的调节:影响和潜在机制。Nat Rev Immunol22, 33-46(2022)。https://doi.org/10.1038/s41577-021-00554-7
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/s41577-021-00554-7
进一步的阅读
雷帕霉素和菊粉用于增强疫苗反应刺激(RIVASTIM) -雷帕霉素:用雷帕霉素进行免疫抑制修饰以改善肾移植受者SARS-CoV-2疫苗反应的随机对照试验的研究方案
试用(2022)
COVID-19患者微生物群的改变:潜在机制和治疗干预
信号转导与靶向治疗(2022)
感染IBV的实验自交系MHC-B盲肠菌群组成因遗传和接种疫苗不同而不同
科学报告(2022)
抗击SARS-CoV-2大流行需要采取全球方法来了解疫苗反应的异质性
自然免疫学(2022)
母猪接种强毒性副猪格莱斯菌疫苗可形成其后代的鼻腔菌群
科学报告(2022)