文摘
缺乏coronavirus-specific抗病毒药物有煽动多个药物再利用研究定向之前批准药物治疗SARS-CoV-2,持续COVID-19背后的冠状病毒大流行。最近,大规模、回顾性临床研究表明,法莫替丁,服用高剂量时COVID-19住院病人,减少插管率和死亡率。一个单独的,patient-reported研究相关法莫替丁使用改善轻度至中度症状,比如咳嗽和气短。虽然前瞻性,多中心临床研究正在进行,两个平行的计算机研究中提出了一个两个SARS-CoV-2蛋白酶,3 cl箴或PL箴,法莫替丁的潜在分子目标活动;然而,这还有待实验验证。在这个报告中,我们系统地分析了法莫替丁对病毒蛋白酶的影响和病毒复制。利用一系列生物物理和酶化验,我们表明,法莫替丁结合和抑制的功能3 cl箴和PL箴。同样,没有直接观察抗病毒活性的法莫替丁在200µM浓度,当测试SARS-CoV-2在两个不同的细胞系,包括人类细胞系来自肺部,COVID-19的主要目标。这些结果排除法莫替丁的直接的抑制剂SARS-CoV-2复制和值得进一步研究的分子机制行动COVID-19的上下文中。
介绍
当前治疗发现的很大一部分精力对严重急性呼吸系统综合症冠状病毒2(冠)2是关注药物的再利用1。这样的代理,到目前为止只有remdesivir临床证据显示抗病毒效果2,而其他几个人没有见过他们的主要端点各临床研究3,4。最近,法莫替丁对SARS-CoV-2作为治疗药物引起了人们的关注,最初基于证据的正面影响,COVID-19患者在中国。法莫替丁(法莫替定®)histamine-2受体(H2R)拮抗剂,是FDA批准的药物治疗胃食管反流病(GERD)和胃溃疡5。
早些时候的报道,法莫替丁的有益作用在中国最近支持涉及在美国的1620名患者的回顾性临床研究,which noted that hospitalized COVID-19 patients receiving a total median dose of 136 mg famotidine, in oral or IV formulation once daily, for 6 days had a reduced risk of death or intubation6。另一项研究涉及10 non-hospitalized病人有关的使用大剂量口服法莫替丁(240毫克每天平均11天)与patient-reported改善呼吸困难和咳嗽等症状7。这两个报告得出结论,使用高剂量法莫替丁可能与改善COVID-19的轻微和严重的症状。虽然大,多中心临床试验来证实这些观察是在进步,法莫替丁的机制据称COVID-19患者改善临床结果是未知的。在计算机建模和分子对接研究分别提出的两个SARS-CoV-2蛋白酶法莫替丁活动的潜在目标8,9。在一个计算研究中,吴等人批准的药品停靠一个图书馆在可用的x射线晶体结构的3-chymotrypsin-like蛋白酶(3 cl箴SARS-CoV-2),识别法莫替丁的药物可能作用于蛋白酶8。其他计算报告预测法莫替丁Papain-like蛋白酶的抑制剂(PL箴),第二个SARS-CoV-2蛋白酶9。综合来看,这些研究的前景提出了直接法莫替丁的抗病毒效应SARS-CoV-2复制。而蛋白质是吸引SARS-CoV-2药物开发的目标10,11,12,13,14,15,16,17,18,19,目前没有临床分期或批准药物目标蛋白质。法莫替丁的可能性,一个批准的药物,作用于SARS-CoV-2蛋白酶是重要的临床利益。在这个体外研究中,我们进行了一系列的生物化学,生物物理,和抗病毒实验测试法莫替丁是SARS-CoV-2蛋白酶的效应,在培养细胞是否能抑制病毒复制。
结果
法莫替丁不是一个SARS-CoV-2蛋白酶抑制剂
处理SARS-CoV-2多蛋白的生成至关重要功能复杂的病毒复制11,18,20.。这个重要的蛋白水解功能,SARS-CoV-2基因组编码两个半胱氨酸蛋白酶,称为PL箴和3氯箴18。由于其关键角色病毒多蛋白加工和病毒扩散,蛋白酶的药物发现目标被认为更有吸引力10,11,13,14,15,16,17,21。因为在网上对接研究预测这些蛋白酶作为法莫替丁的假定的分子靶点6,8,9,我们系统地调查了法莫替丁对每个蛋白酶的催化功能的影响。
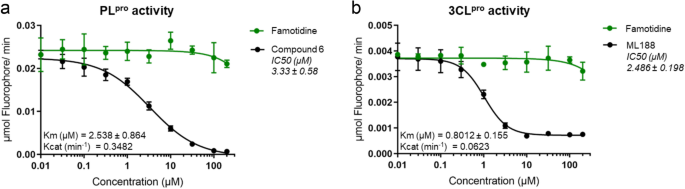
首先,我们开发了一个体外PL的活动分析箴。PL箴大型多域内蛋白酶域发现nsp3 SARS-CoV-2蛋白质编码。虽然许多冠状病毒编码两个papain-like蛋白酶、冠MERS-CoV和SARS-CoV-2拥有唯一PL箴结束,过程伴病毒多蛋白解放nsp1、nsp2 nsp319,21。此外,PL箴deubiquitinates宿主细胞蛋白进行酶LXGG的普遍主题18,19被有效地水解diubiquitin和合成肽底物19。我们利用deubiquitinating PL的属性箴建立一个使用ubiquitin-AMC机能活动分析,PL fluorogenic衬底劈得开的箴。在孵化与PL箴泛素是识别和糖基裂解解放AMC (amido-4-methylcoumarin)荧光团的结果在增加荧光读取使用激发和发射波长的355/460 nm。我们评估了法莫替丁抑制PL的蛋白水解活性的能力箴在一个广泛的药物浓度相对化合物6先前报道,PL的抑制剂箴活动21。实验条件包括蛋白质和底物浓度,缓冲组合,测定动力学优化的使用化合物6。而化合物6抑制PL箴活动预期的低个位数μM IC50值,法莫替丁PL没有降低箴滴定的活动范围的0.01 -200μM(无花果。1一个)。
我们下一个测试法莫替丁是否能抑制酶活性的3 cl箴,第二个蛋白酶SARS-CoV-2基因组编码。这种蛋白质,也称为主要蛋白酶(M箴)或nsp5,劈开病毒多蛋白11点独特的网站11。该蛋白水解活性生成多个独立功能蛋白质组装SARS-CoV-2复制/转录所需的复杂,使病毒基因组复制20.。由于冠状病毒生命周期中所起的核心作用,3 cl箴已经作为药品中引起相当大的关注目标导致一些强有力的抑制剂的发现10,14,15,17。本机3氯箴是一种为,需要二聚作用的蛋白水解活性11。3 cl的催化机理箴活动是典型的半胱氨酸蛋白酶,Cys-His催化双驱动特定站点基质的乳沟。我们评估3 cl的酶活性箴使用FRET-peptide衬底猝灭荧光的完整形式,然而,乳沟肽底物的3 cl箴产生荧光,可以测量在激发/发射波长的490/535 nm。的包容ML188先前报道,3 cl箴抑制剂作为控制,也协助分析设置和优化。对各种烦恼的结果分析ML188和法莫替丁浓度图所示。1b。这两个化合物进行了测试范围为0.01 -200μM之间。而ML188产生剂量依赖性抑制3 cl箴活动预期的IC502.4μM,法莫替丁没有抑制3 cl箴活动。
单独测试时,法莫替丁和自发荧光产生的其他测试化合物在355/460和490/535 nm波长,分别。这两个实验表明,法莫替丁不会干扰两SARS-CoV-2蛋白酶的催化活性。
法莫替丁不直接接触PL箴或3氯箴的SARS-CoV-2
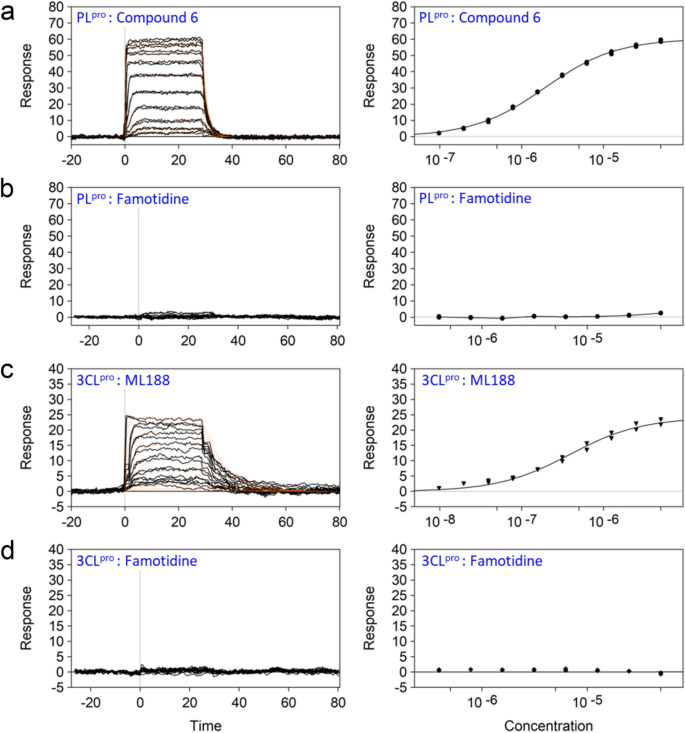
许多酶的功能,如蛋白酶和激酶,可以超越他们的催化角色和包括一个广泛的非活动如变构调节、脚手架、蛋白质-蛋白质之间的关系,和protein-DNA交互22。排除法莫替丁是否可以绑定远离这两个病毒蛋白酶的活性部位,并通过干扰non-proteolytic施加影响函数,我们问如果直接与法莫替丁可以绑定两个SARS-CoV-2蛋白酶。为此,我们采用两种不同的生物物理技术即表面等离子体共振(SPR)和差示扫描荧光(DSF),通常用于探针药物参与。
为我们的SPR研究,生物素化的病毒蛋白酶被抓获的高密度传感器通过neutravidin芯片,允许实时检测小分子绑定到目标病毒蛋白酶。小分子化合物的接触记录为剂量依赖性的增加反应单位(俄文)测定。实验条件包括缓冲区组成和温度进行了优化使用控制化合物法莫替丁之前进行研究。平衡离解常数(Kd)值运用动力学分析和确定适合的剂量响应数据绑定等温线(无花果。2)。观察到的Kd值已知3 cl箴和PL箴抑制剂(补充信息表S1)符合发布的集成电路50数据14,21指示的鲁棒性分析方法。这些优化的条件下,法莫替丁也没有找到与两个病毒蛋白酶浓度范围的100嗯。
绑定的法莫替丁PL箴和3氯箴分析了SPR。可溶性生物素化的PL箴(一个,b3)和氯箴(c,d)被固定在一个neutravidin-coated传感器芯片和一系列化合物浓度注射溶剂(DMSO)修正。,(一个)化合物6,已知的PL箴抑制剂和(c)ML188,3氯箴抑制剂结合PL存在剂量依赖的相关性显示箴和3氯箴,分别。然而,(b,d)没有绑定的法莫替丁发现的蛋白质。离解常数(Kd)的值控制化合物如表所示S1(Supplementry信息)。
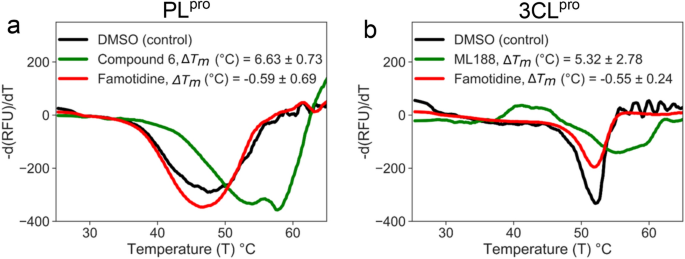
从我们的SPR分析验证结果,我们采用正交DSF化验。DSF fluorescence-monitored热变性技术中,熔化温度(T米)的蛋白质是通过荧光跟踪样品温度逐步提高疏水性染料的存在。已知药物结合靶蛋白稳定(或破坏)蛋白质结构导致的一种变体T米配置文件没有或药物的存在。DSF提供明确的确认目标接触的增加热温度(Δ展开T米)只有当化合物结合蛋白质的折叠状态。Δ的T米成正比Kd交互和浓度的化合物。我们测试了法莫替丁的能力和控制抑制剂改变PL的热稳定性资料箴和3氯箴。最优信号配置文件获得了7μM PL箴或3氯箴。蛋白质都是单独测试的DMSO(负控制),各自控制抑制剂,与法莫替丁含量的2.5和5毫米。与SPR数据,协议控制抑制剂产生增加定量观察T米(无花果。3)。而化合物6,已知的PL箴抑制剂,稳定PL箴由一个T米转变为6.6°C(图。3一个),ML188,3氯箴抑制剂,产生了T米转变为5.3°C(图。3b),法莫替丁并没有改变T米的两个病毒蛋白酶。综上所述,生物物理数据果断排除的可能性法莫替丁对PL施加其影响箴或3氯箴通过与催化或非干扰蛋白质的功能,因为它无法结合的两种蛋白酶。
法莫替丁不抑制SARS-CoV-2培养细胞中复制
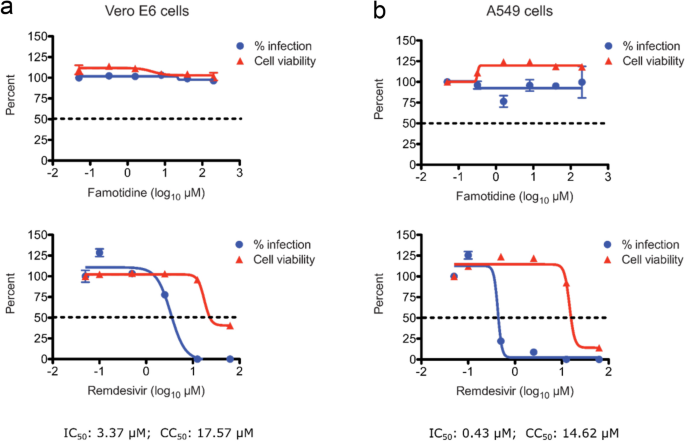
建立了法莫替丁不抑制SARS-CoV-2蛋白酶,我们研究了法莫替丁的能力来阻止病毒在细胞培养中复制。维罗E6细胞,为此,我们被感染的常用的细胞模型SARS-CoV-2感染来自非洲绿猴肾。感染效率是通过多个量化,正交读数,包括定量实时PCR(存在),斑块形成,免疫荧光。Remdesivir抑制病毒复制,估计半峰抑制浓度(IC503.3μM)值,由免疫荧光(图4a)。相比之下,法莫替丁没有产生任何明显的抑制浓度高达200μM 72 h后感染病例。类似的结果当传染性病毒粒子了病毒复制生产使用斑块形成化验或量化病毒RNA复制的数字使用中存在细胞培养基(补充数据S1和S2)。
来证实这些结果在一个更生理相关SARS-CoV-2感染的细胞模型,我们评估了法莫替丁在人类肺癌A549细胞的抗病毒活性。这些细胞被设计来表达基本因素SARS-CoV-2条目,ACE2 TMPRSS223。这些细胞被感染SARS-CoV-2和培养没有或控制或测试化合物的存在。病毒复制(感染)效率测量和报告作为化合物浓度的函数(无花果。4)。虽然remdesivir强烈抑制病毒复制与IC剂量依赖性的方式50价值0.43µM,法莫替丁(图没有可衡量的影响。4b)。我们的研究结果与之前报道的研究相一致,remdesivir施加在人类肺癌A549细胞抗病毒效果大于州立E6细胞24。事实上,法莫替丁不抑制SARS-CoV-2 A549细胞中复制具有丝氨酸蛋白酶TMPRSS2也可能指向没有影响宿主蛋白酶参与病毒条目。
并联平行细胞毒性分析,开展维罗E6和A549细胞,显示,法莫替丁没有毒性的测试浓度最高200μM(无花果。4)。Remdesivir,另一方面,表现出剂量依赖性细胞毒性较高的浓度,大大高于它的集成电路50。总之,这些结果表明,法莫替丁不抑制SARS-CoV-2复制培养细胞,其所谓的临床效益可能是由于另一种作用机制。
讨论
两个在网上研究分别预测3 cl箴或PL箴法莫替丁的SARS-CoV-2为潜在的分子靶点8,9,这意味着法莫替丁COVID-19相关改善患者可能是由于直接抗病毒作用机理6。尽管最近计算技术的进步,有许多挑战与分子对接的使用准确预测protein-ligand交互。这些挑战来自靶蛋白的灵活性,缺乏先验知识drug-binding网站,氨基酸和质子化作用的目标25。而分子对接结果可以作为依据新的假设,实验验证是必要的。我们的配体结合实验利用SPR和DSF不支持以前的计算机预测法莫替丁之间的直接绑定和SARS-CoV-2蛋白酶。我们进一步用实验方法表明,法莫替丁的数组没有影响SARS-CoV-2蛋白酶功能或一般病毒复制。必须指出的是,由于临床研究相关的假定的临床效益使用更高剂量的法莫替丁,我们测试了法莫替丁在显著提高体外比等离子体浓度的峰值浓度(0.5 2µM)血液中取得病人的临床研究6,7。我们的数据表明,法莫替丁的可能的临床益处可能出现独立的抗病毒作用机制。
COVID-19并发症与严重感染患者的肺部炎性反应26。“细胞因子风暴”由于炎症是一个关键的特殊的特性COVID-19和呼吸衰竭和死亡的主要原因27。严重COVID-19病例特点是肺浸润和广泛的肺水肿,导致炎性细胞渗出的肺泡空间,导致广泛的肺合并导致肺炎和成人呼吸窘迫综合征(ARDS)28,29日,30.,31日。结果两个famotidine-related COVID-19临床报告,综合起来的时候6,7表明,法莫替丁可能有助于缓解中度到重度呼吸道症状包括呼吸短促插管。我们的数据并不排除这种可能性,法莫替丁COVID-19患者相关的改进是通过抗炎作用。例如,COVID-19患者细胞因子风暴的发展特点是海拔炎性I型细胞因子,分泌的一种多形核细胞等多种细胞、自然杀伤细胞、内皮细胞等27。因此可以想见,famotidine-related效益管理呼吸道症状可能是由于抗炎的作用机制。
值得注意的是H2R,法莫替丁的分子建立目标,参与的几个介质的激活适应性免疫反应,如Th1淋巴细胞,与促炎细胞因子的生产32。组胺,H2R配体,也调节支气管收缩,气道炎症和血管舒张32。肥大细胞组胺的主要来源,其激活报道后呼吸道病毒感染33,34,35。因此,肥大细胞可能代表一个被低估了的促炎细胞因子释放来源COVID-19病人33。更好的理解在COVID-19 H2R的作用途径将有助于阐明法莫替丁的分子细节如何减少了疾病的严重程度。
我们的体外研究重定向法莫替丁的潜在益处,背后的机制从一种抗病毒效果可能COVID-19患者的抗炎作用。考虑到有一个正在进行的随机临床试验(NCT04370262),我们的研究结果可以帮助研究人员在重塑他们的介入研究,包括炎症相关的结果。同时,应该注意的是,虽然法莫替丁是一种相对安全的药物,使用它并不是没有风险36,37,38,尤其是在老年病人(COVID-19高危人群),法莫替丁的使用与中枢神经系统并发症有关39。正在进行的临床试验提供收益率有前景的结果,进一步研究不同年龄方括号法莫替丁及其安全性的需要可以使用药物之前,最有可能作为综合治疗的一部分,COVID-19疾病管理。
材料和方法
化合物
法莫替丁收购从西格玛奥德里奇(美国密苏里州;猫。不。F6889)。化合物6,先前报道SARS-CoV-2 PL的抑制剂箴函数21从MedChem表达收购公司(美国新泽西州;猫没有。hy - 17542)。ML188,与已知化合物3 cl箴抑制活性15也从MedChem获得表达,Inc .(猫。没有hy - 136259)。同样,remdesivir。(猫。没有hy - 104077) SARS-CoV-2复制的抑制剂2从相同的供应商购买。所有化合物溶解在100% DMSO 100毫米。
克隆、表达和纯化的蛋白质
完整的序列编码3 cl箴PL和残留746 - 1060箴(加入基因库NC_045512 Wuhan-Hu-1隔离)被克隆到一个负责修改相扑融合表达载体,生成的内部。24小时的融合蛋白表达Rosetta-2 (DE3) pLysS zyp - 5052年18°C autoinducing媒体。收获细胞在50 mM resuspended消息灵通的pH值7.5,包含150毫米氯化钠由声波降解法和细胞溶解。澄清上层清液被加载到一个HiTrap惠普SP列(Cytiva,马萨诸塞州,美国;猫没有。17115201)和目标融合蛋白在阳离子交换层析一步被捕并使用氯化钠梯度筛选了。相扑水解酶被添加到混合分数解放靶蛋白与20毫米三样例透析,v / v甘油10%,5毫米德勤pH值7.0一夜之间在4°C。蛋白质是重载HiTrap惠普SP列移除相扑蛋白和水解酶在减去步骤。主要材料,包含3 cl箴或PL箴由阴离子交换层析进一步纯化使用HiTrap惠普问列(Cytiva;猫。不。17115401)采用氯化钠梯度洗提蛋白。混合分数大小排阻层析进一步纯化的20毫米三pH值7.4,德勤氯化钠150毫米和5毫米。最后蛋白集中为PL 4毫克/毫升箴和5毫克/毫升3 cl箴和flash冻结在整除。
体外病毒酶化验
PL箴使用ubiquitin-AMC蛋白水解活性测定
PL箴活动用一个384孔板测量格式(康宁# 3574)动力学试验使用fluorogenic衬底Ubiquitin-AMC(美国马萨诸塞州波士顿生物化学有限公司;猫。不。u - 550)激发和发射波长的Ex355nm / Em: 460海里。协议之前报道条件出台了一些细微的修改13,16。荧光监控在25°C,每5分钟50分钟在维克多X5(珀金埃尔默)多模板读者。最佳的酶和底物浓度为550 nM PL中被发现箴滴定的底物范围0.2 - 3μM。分析缓冲区(20μL)包含25毫米消息灵通的pH值7.5,100毫米氯化钠,0.1毫克/毫升BSA和550 nM PL箴。测试抑制剂,法莫替丁和PL箴控制抑制剂(化合物6)都是滴定μMμM 0.01 - 200的浓度范围。化合物与酶孵化前30分钟的板25°C的反应是由1μM Ub-AMC。所有样品都是运行在一式三份和他们最初的斜坡从相对荧光转换单位(RFU) /分钟μmol AMC /分钟使用一个AMC标准曲线和绘制化合物浓度测试。
3氯箴蛋白水解活性测定
3氯箴活动是用384孔板化验使用3 cl箴烦恼衬底(美国加州AnaSpec有限公司;猫。不。- 65599)激发和发射波长的例:490 nm / Em: 535海里。之前报道的协议是用于一些修改12,17。荧光动力学变化监测每分钟25分钟。最佳浓度为3 cl箴和底物分别为150 nM和600 nM。之前报道3 cl箴抑制剂14,ML188用作抑制积极控制,控制和测试化合物浓度范围的滴定μMμM 0.01 - 200。最初的斜坡RFU /分钟被转换为μM水解底物/分钟使用标准曲线HiLyte Fluor488胺,组织盐。
生化数据分析
背景减法后荧光读数,公里和EC50值拟合得到的实验数据与Michaelis-Menten (y = (Vmax * x) /(公里+ x))和四个参数物流(4 pl)方程(y =分钟+(极大极小)/ (1 + (x / EC50) ^ Hillslope))分别使用GraphPad棱镜8。
动态扫描荧光测定法(DSF)
热的蛋白质在20 uL卷监控Micro-Amp EnduraPlate光384 -板(ThermoFisher:猫没有明显的反应。4483285)。反应包含50 mM消息灵通的pH值7.5,62.5毫米氯化钠,7μM 3 cl箴或PL箴,5% DMSO, 4×SYPRO-orange蛋白质凝胶染色(美国马萨诸塞州ThermoFisher科学;猫没有。S6651)。法莫替丁和积极的控制ML188和化合物63氯箴和PL箴分别是孵化前15分钟的蛋白质添加SYPRO橙色。盘子满是Micro-Amp光学胶膜(美国马萨诸塞州ThermoFisher科学;猫没有。4360954)和运行在应用生物系统公司7900 ht(美国加州)实时PCR仪。样本在25°C孵化2分钟后,1°C /分钟温度高达95°C。荧光是连续监测。每个样品一式三份和化合物测试运行在1毫米,2.5毫米和5毫米。熔化温度(T米)得到的一阶导数生热变性数据测定和平滑计算熔化温度(T米)值40。
表面等离子体共振(SPR)
SPR研究进行Biacore 3000仪器(Cytiva,麻萨诸塞州,美国)在10°C。PL的箴和3氯箴蛋白质是由最小的生物素化的生物素酰化方法与EZ-LINK Sulfo-NHS-LC-LC-biotin试剂(美国马萨诸塞州ThermoFisher科学;猫没有。A35358)和固定化neutravidin涂布CM5传感器芯片的4000响应单位(俄文)。蛋白质固定在1μM PL期间使用箴和1μM 3 cl箴。过程中测定不同浓度的化合物注入。化合物是连续运行缓冲液稀释(两个)25毫米的消息灵通的pH值7.0,200毫米氯化钠,2毫米TCEP, 0.005% DMSO P20和1%。法莫替丁和控制抑制剂,化合物6和ML188测试的最大剂量100μM 50μM和5μM,分别。最终的反应是减去空白的通道(没有蛋白质)和缓冲注入样品通道。原始数据分析Scrubber2项目(生物软件)通过拟合数据简单的1:1平衡和动力学模型。
抗病毒药物化验
病毒和滴定法
病毒传染性化验使用2019 - ncov / SARS-CoV-2 USA-WA1/2020隔离(NCBI加入数字:MN985325),来自疾病控制与预防中心和贝资源(美国弗吉尼亚州)。股票的病毒传播州立E6细胞和病毒滴度决定使用空斑形成化验,如前所述41。
抗病毒药物化验
人类肺癌A549细胞表达SARS-CoV-2维罗E6输入因素和非洲绿猴肾细胞在DMEM补充维持10%胎牛血清的边后卫。96 -孔板细胞被播种到poly-L-lysine-coated 15000细胞的密度。然后细胞治疗4 h和五倍连续稀释法莫替丁,介于0.32µM和200µM。DMSO作为消极的控制,而五倍系列稀释remdesivir,介于0.1µM和62.5µM,作为一个积极的控制。细胞被感染SARS-CoV-2在感染复数(MOI)为0.1。感染细胞,容器中移除,这些细胞被孵化的病毒1 h在37ºC。病毒培养液被移除,细胞单层与1 x PBS冲洗两次。化合物添加回来后跟孵化72 h,在细胞培养基是收获定量实时PCR(存在)和斑块化验,而细胞免疫荧光显微镜与4%多聚甲醛固定。
病毒RNA提取和定量实时PCR(存在)
RNA是隔绝SARS-CoV-2-infected细胞的细胞培养上清液使用Quick-RNA病毒工具包(美国加州Zymo猫没有。R1035)根据制造商的指示。病毒RNA是量化使用单步使用qScript RT-quantitative实时PCR一步RT-qPCR工具包(Quantabio,马萨诸塞州,美国;猫没有。95058)引物和Taqman探测目标SARS-CoV-2 E基因如前所述42。数据获得使用Quantstudio3实时PCR系统(应用生物系统公司)使用下列条件:55°C 10分钟,变性在94°C 3分钟,45变性的周期为15秒94°C,和退火58°C 30年代。使用的引物和探针一样:E_Sarbeco_Forward: ACAGGTACGTTAATAGTTAATAGCGT;E_Sarbeco_Probe: FAM-ACACTAGCCATCCTTACTGCGCTTCG-BBQ;E_Sarbeco_Reverse: ATATTGCAGCAGTACGCACACA。绝对量化的病毒RNA, 389个基点从SARS-CoV-2 E基因片段克隆到pIDTBlue质粒在SP6发起人使用内PCR克隆工具包(美国马萨诸塞州新英格兰生物科学;猫没有。E1202S)。克隆的片段体外转录使用mMessage 1 SP6转录工具包(ThermoFisher,马萨诸塞州,美国;猫没有。AM1340)生成中存在的标准。
免疫荧光显微镜
感染病毒的细胞与4%多聚甲醛固定了30分钟。固定剂移除,和细胞单层1 x PBS洗两次。细胞被permeabilized和彩色anti-SARS-CoV核衣壳(N)抗体(美国宾夕法尼亚州罗克兰Inc .的;猫。不。200 - 401 a50;下稀释)。孵化与主抗体进行隔夜4ºC。细胞被洗了5次1 x PBS和沾Alexa 568 -共轭anti-rabbit抗体(1:1000稀释)在黑暗中在室温下与DAPI 1 h和复染色。图像捕获使用evo M5000成像系统(美国马萨诸塞州ThermoFisher科学)。固定细胞的定量和分析图像进行了使用MuviCyte Live-Cell成像系统(PerkinElmer,麻萨诸塞州,美国)。 At least 7–10 microscopic fields were imaged per well using a 10X objective lens, the number of cells positive for the SARS-CoV-2 N protein and the nuclear DAPI stain, were counted. For each image, the percentage of DAPI-positive cells expressing the viral N protein were calculated, and the mean ± SD of multiple images for each condition was plotted.
细胞毒性和细胞的可行性分析
CellTiter-Glo发光细胞生存能力分析(美国威斯康辛州Promega;猫没有。G7570)是用来确定化合物的细胞毒性效应。简单地说,这些细胞被孵化五倍连续稀释法莫替丁或remdesivir 72 h,之后CellTiter-Glo试剂添加到每个在一个体积等于体积的培养基。的内容被摇晃混合板轨道瓶2分钟,紧随其后的是一个10分钟在室温下孵化。发光记录使用Varioskan勒克斯多模板读者(美国马萨诸塞州ThermoFisher科学)。
数据可用性
在生成的数据集和/或分析在当前研究可从相应的作者以合理的要求。
引用
哈里森,c .冠状病毒药物再利用在快车道上。生物科技Nat。》。38,379 - 381。https://doi.org/10.1038/d41587 - 020 - 00003 - 1(2020)。
Beigel, j . H。et al。Remdesivir治疗Covid-19——初步报告。心血管病。j .地中海。https://doi.org/10.1056/NEJMoa2007764(2020)。
Boulware, d R。et al。随机试验的羟氯喹作为covid-19曝光后预防。心血管病。j .地中海。https://doi.org/10.1056/NEJMoa2016638(2020)。
曹,B。et al。洛的审判成年人严重covid-19住院。心血管病。j .地中海。382年,1787 - 1799。https://doi.org/10.1056/NEJMoa2001282(2020)。
吉时利,j·k·组胺H2-receptor拮抗剂。孕育中国北部是26,361 - 373 (1991)。
Freedberg d E。et al。法莫替丁使用与改进COVID-19住院患者的临床结果:一个倾向得分匹配的回顾性队列研究。胃肠病学https://doi.org/10.1053/j.gastro.2020.05.053(2020)。
Janowitz, T。et al。法莫替丁使用跟踪和量化症状COVID-19 non-hospitalised患者:一个案例系列。肠道https://doi.org/10.1136/gutjnl - 2020 - 321852(2020)。
吴,C。et al。分析SARS-CoV-2和发现潜在的药物治疗靶点的计算方法。Acta制药。罪。Bhttps://doi.org/10.1016/j.apsb.2020.02.008(2020)。
谢弗,l . 15药物治疗COVID-19正在测试,他们将如何工作。Nat,地中海。https://doi.org/10.1038/d41591 - 020 - 00019 - 9(2020)。
张,L。et al。晶体结构SARS-CoV-2主要蛋白酶改善alpha-ketoamide抑制剂的设计提供了依据。科学368年,409 - 412。https://doi.org/10.1126/science.abb3405(2020)。
Muramatsu表示,T。et al。冠3 cl蛋白酶裂解c端自动处理由小说网站子站协同。Proc。国家的。学会科学。美国113年,12997 - 13002。https://doi.org/10.1073/pnas.1601327113(2016)。
可以喝,S。et al。即Ligand-induced二聚的中东呼吸系统综合症冠状病毒nsp5蛋白酶(3 clpro):影响nsp5监管和抗病毒药物的发展。生物。化学。290年,19403 - 19422。https://doi.org/10.1074/jbc.M115.651463(2015)。
Baez-Santos, y . M。Mielech, a . M。邓,X。,B一个ker, S. & Mesecar, A. D. Catalytic function and substrate specificity of the papain-like protease domain of nsp3 from the Middle East respiratory syndrome coronavirus.j .性研究。88年,12511 - 12527。https://doi.org/10.1128/JVI.01294-14(2014)。
雅各布斯,J。et al。发现、合成和基于结构优化的一系列N -(叔丁基)- 2 - (N-arylamido) 2 (pyridin-3-yl)乙酰胺(ML188)的共价的小分子抑制剂的严重急性呼吸系统综合症冠状病毒3 cl蛋白酶(冠)。j .地中海,化学。56,534 - 546。https://doi.org/10.1021/jm301580n(2013)。
雅各布斯,J。et al。调查报告从美国国立卫生研究院分子库项目(2010)。
、K。et al。一类共价papain-like蛋白酶/ deubiquitinase SARS病毒复制抑制剂块。Proc。国家的。学会科学。美国105年,16119 - 16124。https://doi.org/10.1073/pnas.0805240105(2008)。
陆,i L。et al。基于结构的药物设计和结构生物学研究的小说nonpeptide主要严重急性呼吸系统综合症冠状病毒蛋白酶抑制剂。j .地中海,化学。49,5154 - 5161。https://doi.org/10.1021/jm060207o(2006)。
林德纳,h·A。et al。papain-like蛋白酶的严重急性呼吸系统综合症冠状病毒是一种deubiquitinating酶。j .性研究。79年,15199 - 15208。https://doi.org/10.1128/jvi.79.24.15199 - 15208.2005(2005)。
Barretto, N。et al。严重急性呼吸系统综合症冠状病毒的papain-like蛋白酶deubiquitinating活动。j .性研究。79年,15189 - 15198。https://doi.org/10.1128/jvi.79.24.15189 - 15198.2005(2005)。
van Hemert m . J。et al。发热、复制/转录复合体membrane-protected和需要一个宿主体外因素的活动。公共科学图书馆Pathog。4,e1000054。https://doi.org/10.1371/journal.ppat.1000054(2008)。
Freitas, b . T。et al。描述和共价deubiquitinase和deISGylase活动的抑制SARS-CoV-2 papain-like蛋白酶。ACS感染。说。https://doi.org/10.1021/acsinfecdis.0c00168(2020)。
宫,j . e . &侏罗山脉:结构性蛋白激酶的非催化功能的基础。结构24,7-24。https://doi.org/10.1016/j.str.2015.10.020(2016)。
妈,D。et al。人类主要表达SARS-CoV-2受体ACE2 TMPRSS2角膜结膜和翼状胬肉细胞株和老鼠。眼睛34,1212 - 1219。https://doi.org/10.1038/s41433 - 020 - 0939 - 4(2020)。
谢,X。et al。一个nanoluciferase SARS-CoV-2快速中和COVID-19测试和筛选抗感染药物。bioRxivhttps://doi.org/10.1101/2020.06.22.165712(2020)。
Palacio-Rodriguez, K。局域网,我。,Cavasotto, C. N. & Cossio, P. Exponential consensus ranking improves the outcome in docking and receptor ensemble docking.科学。代表。9,5142年。https://doi.org/10.1038/s41598 - 019 - 41594 - 3(2019)。
茶,m Z。,Poh, C. M., Renia, L., MacAry, P. A. & Ng, L. F. P. The trinity of COVID-19: immunity, inflammation and intervention.启Immunol Nat。20.,363 - 374。https://doi.org/10.1038/s41577 - 020 - 0311 - 8(2020)。
你们问。,Wang, B. & Mao, J. The pathogenesis and treatment of the `Cytokine Storm’ in COVID-19.j .感染。80年,607 - 613。https://doi.org/10.1016/j.jinf.2020.03.037(2020)。
Carsana, L。et al。肺事后发现在一系列COVID-19情况下从意大利北部:two-centre描述性研究。柳叶刀感染。说。https://doi.org/10.1016/s1473 - 3099 (20) 30434 - 5(2020)。
Bhatraju p K。et al。Covid-19危重患者在西雅图region-case系列。心血管病。j .地中海。382年,2012 - 2022。https://doi.org/10.1056/NEJMoa2004500(2020)。
田,J。et al。临床特点和危险因素与COVID-19疾病严重程度患者的癌症在武汉,中国:一个多中心回顾性队列研究。柳叶刀杂志。https://doi.org/10.1016/s1470 - 2045 (20) 30309 - 0(2020)。
杨,K。et al。临床特点、结果和死亡率的危险因素在癌症患者和COVID-19湖北,中国:一个多中心回顾性队列研究。柳叶刀杂志。https://doi.org/10.1016/s1470 - 2045 (20) 30310 - 7(2020)。
Thangam, e . B。et al。在肥大细胞组胺和组胺受体的作用过敏和炎症:寻找新的治疗靶点。前面。Immunol。9,1873年。https://doi.org/10.3389/fimmu.2018.01873(2018)。
马歇尔,j·S。,Portales-Cervantes, L. & Leong, E. Mast cell responses to viruses and pathogen products.Int。j .摩尔。科学。https://doi.org/10.3390/ijms20174241(2019)。
Zarnegar B。et al。流感病毒感染小鼠诱发肺肥大细胞积累通过招聘和肥大细胞祖细胞的成熟。前面。Immunol。8,310年。https://doi.org/10.3389/fimmu.2017.00310(2017)。
胡,Y。et al。桅杆cell-induced肺损伤小鼠感染H5N1型流感病毒。j .性研究。86年,3347 - 3356。https://doi.org/10.1128/JVI.06053-11(2012)。
Kirch, W。,Halabi, A., Linde, M., Santos, S. R. & Ohnhaus, E. E. Negative effects of famotidine on cardiac performance assessed by noninvasive hemodynamic measurements.胃肠病学96年,1388 - 1392。https://doi.org/10.1016/0016 - 5085 (89) 90503 - 9(1989)。
李,c . c . y . c & Wang Famotidine-induced视网膜病变。眼睛(Lond)20.,260 - 263。https://doi.org/10.1038/sj.eye.6701839(2006)。
Kallal, s m & Lee m .血栓性thrombo-cytopenic紫癜与组胺H2-receptor拮抗剂治疗。西方。j .地中海。164年,446 - 448 (1996)。
坎图,t . g . & Korek j . s .中枢神经系统反应histamine-2受体阻滞剂。安。实习生。地中海。114年,1027 - 1034。https://doi.org/10.7326/0003 - 4819 - 114 - 12 - 1027(1991)。
太阳,C。,Li, Y., Yates, E. A. & Fernig, D. G. SimpleDSFviewer: a tool to analyze and view differential scanning fluorimetry data for characterizing protein thermal stability and interactions.蛋白质科学。29日,19-27。https://doi.org/10.1002/pro.3703(2020)。
Ogando: S。et al。SARS-coronavirus-2复制州立E6细胞:复制动力学,快速适应和细胞病理学。j .性研究。https://doi.org/10.1099/jgv.0.001453(2020)。
科曼,v . M。et al。2019年的小说《冠状病毒检测实时rt - pcr (2019 - ncov)。欧元Surveillhttps://doi.org/10.2807/1560 - 7917(2020)。
资金
这项工作是支持的部分恒大女士和DYC MassCPR奖。
作者信息
作者和联系
贡献
概念化:A.H.M.;数据管理和分析:上半叶,学士,S.B.,硕士,A.H.M., methodology and investigation: M.L., H.L., D.Y.C., S.D.G., S.B., A.M., S.D.W., A.O., F.D. M.S., A.H.M.; writing (original draft): A.H.M.; writing (review and editing): A.H.M., M.S., F.D., S.D.W., H.L., S.B.
相应的作者
道德声明
相互竞争的利益
作者宣称没有利益冲突。
额外的信息
出版商的注意
施普林格自然保持中立在发表关于司法主权地图和所属机构。
补充信息
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图片或其他第三方材料都包含在本文的创作共用许可证,除非另有说明在一个信用额度的材料。如果材料不包括在本文的创作共用许可证和用途是不允许按法定规定或超过允许的使用,您将需要获得直接从版权所有者的许可。查看本许可证的副本,访问http://creativecommons.org/licenses/by/4.0/。
关于这篇文章
引用这篇文章
Loffredo, M。产品,所的的,Lucero H。DY,陈。et al。法莫替丁的体外影响SARS-CoV-2蛋白酶和病毒复制。Sci代表115433 (2021)。https://doi.org/10.1038/s41598 - 021 - 84782 - w
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/s41598 - 021 - 84782 - w