摘要
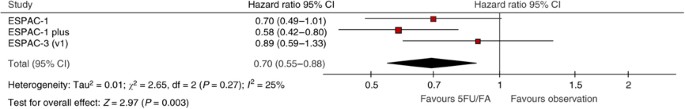
ESPAC-1、ESPAC-1 +和早期ESPAC-3(v1)结果(458名随机患者;364例死亡)用于评估辅助5FU/FA的有效性vs使用荟萃分析单独切除胰腺癌。合并风险比为0.70 (95% CI= 0.55-0.88)P=0.003, 5FU/FA组中位生存期为23.2个月(95% CI= 20.1-26.5)vs仅切除16.8个月(95% CI= 14.3-19.2)支持在胰腺癌中使用辅助5FU/FA。
主要
最近两项胰腺癌辅助治疗的随机对照试验结果(Oettle等人,2007年;Regine等人,2008年)进一步提高了对这种疾病的最佳治疗方法的兴趣。CONK-001试验表明,与单独观察相比,术后吉西他滨显著延迟复发性疾病的发展(Oettle等人,2007年),随后的分析显示总体中位生存期改善(Neuhaus等人,2008).放射治疗肿瘤组研究(RTOG) 9704试验显示,两种放化疗方案之间的总生存期没有差异,尽管在亚组分析中显示,在术后以5FU为基础的辅助放化疗中添加吉西他滨(而不是5FU)显著提高了胰腺头部癌症患者的生存期(Regine等人,2008年).
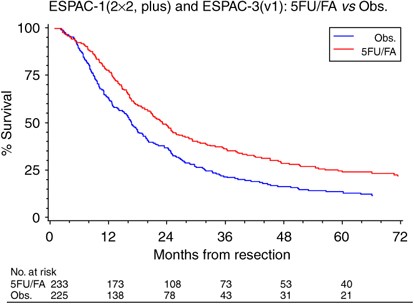
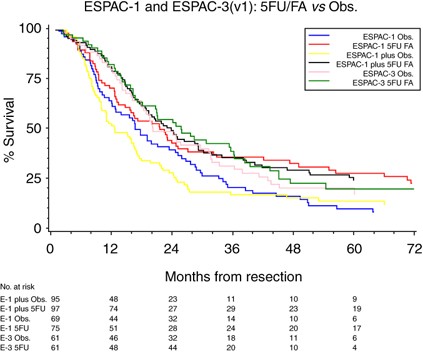
欧洲胰腺癌研究小组(ESPAC)招募了550名患者参与ESPAC-1辅助试验(图1),其中289例患者采用2 × 2因子设计,旨在研究辅助化疗(5FU + folinic acid (FA))和放化疗对总生存期(Neoptolemos等人,2001年,2004).最终结果证实,只有辅助化疗提供了显著的生存获益(Neoptolemos等人,2004年).然而,该试验并没有在5FU/FA组和2 × 2设计的单独手术组之间进行直接比较。在ESPAC-1的550例患者中,192例患者进行了直接随机比较,分别是5FU/FA和单独观察,如果有必要,由临床医生选择背景放化疗。该随机比较被称为ESPAC-1加试验,是基于相同的资格标准和治疗计划的ESPAC-1辅助试验的一部分。患者是在招募目标之外并行招募的,因此总是打算作为额外的证据,不能单独进行分析。ESPAC-3(v1)试验最初是一项辅助5FU/FA的三组研究vs吉西他滨vs观察。在公布ESPAC-1的最终结果后(Neoptolemos等人,2004年)时,独立数据监测委员会建议将观测臂从ESPAC-3(v2)中删除。独立数据监测委员会还建议报告5FU/FA的综合结果vs这是ESPAC-3(v1)原始方案的一部分。在ESPAC-1的2 × 2分量中(图1),根据2 × 2设计,将随机接受化疗(单独化疗或合并放化疗)的患者与随机不接受化疗(单独手术或合并放化疗)的患者进行比较,但放化疗的意外负面影响可能影响了结果。因此这些数据比较单独的辅助化疗vs2 × 2设计的单独手术亚组很重要,因为包括单独手术的试验现在不太可能重复。因此,该结果是独一无二的,首次提供了5FU/FA佐剂的无偏倚随机比较vs胰管腺癌切除术后观察。此外,使用元分析来结合三个研究中的个体患者数据,增加了总体样本量,从而增加了分析的统计力。
方法
在这些研究中,ESPAC-1、ESPAC-1 plus和ESPAC-3(v1)的纳入标准是相同的,术后再定位和CA 19.9值未用于确定患者的纳入(Neoptolemos等人,2001年,2004;www.cancernorth.nhs.uk portal_repository /文件/ trial_sum_espac.pdf).同样,在所有三个研究中使用的化疗方案是相同的,包括静脉注射亚叶酸(亚叶酸;20毫克米−2),然后静脉注射5FU (425 mg m−2),每28天,连续5天,共6个周期。ESPAC-1 2 × 2设计两组144例患者(69例观察,75例5FU/FA), 24例存活患者中位随访78个月(四分位数范围= 45-92)(表1).ESPAC-1 +组件招募了192例患者(95例观察,19例(20%)接受背景放化疗;97例5FU/FA,其中25例(26%)接受背景放化疗),40例存活患者的中位随访时间为64个月(四分位数范围= 20-89)。在本试验中,在观察臂关闭时,有122例患者接受ESPAC-3(v1)治疗(61例观察,61例5FU/FA), 30例存活患者的中位随访时间为54个月(四分位数范围= 34-60)。这些数据提供了5FU/FA的直接随机比较vs仅根据意向治疗原则进行观察。对于总生存期的结果,使用一个随机效应模型来结合试验水平风险比(HRs),使用逆方差荟萃分析,从单个患者数据中估计。在所有试验中,生存估计以简单的、非分层的Kaplan-Meier曲线表示。治疗效果的总体估计因试验的任何影响而调整。
结果
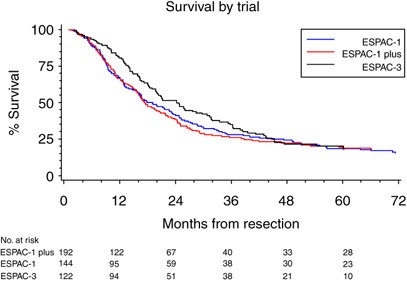
所有试验的合格标准相似,因此患者和肿瘤特征(表1)的治疗方案在试验中也相同。在分析时,ESPAC-1患者死亡120例(83.3%),ESPAC-1 +患者死亡152例(79.2%),ESPAC-3(v1)患者死亡92例(75.4%)(表2).试验间的异质性不显著,合并数据被认为是合理的(图2而且3.).总生存率(图4)在随机分配到5FU/FA组的患者中优于随机分配到观察组的患者(合并HR=0.70 (95% CI= 0.55-0.88);P= 0.003 (表2)),并有证据显示统计异质性较低(P= 0.27,我2= 25%,图3).据估计,与单独手术相比,化疗的综合效应可将死亡风险降低30%。综合总中位生存期(通过试验非分层的简单Kaplan-Meier曲线获得),5FU/FA组为23.2 (95% CI= 20.1-26.5)个月,而观察组为16.8 (95% CI= 14.3-19.2)个月,2年和5年生存期分别为49%和24%,观察组为37%和14% (图4而且5,表2).一项不包括ESPAC-1 +研究的敏感性分析估计,与单独手术相比,化疗可降低23%的死亡风险(HR=0.77, 95%CI=0.59, 1.01)。
讨论
这项针对ESPAC-1、ESPAC-1 +和ESPAC-3试验的个体患者数据荟萃分析显示,随机分配到5FU/FA的患者总生存率显著提高,HR为0.70 (95% CI=0.55, 0.88;P=0.003)表明与单独手术相比,5FU/FA组的死亡风险显著降低30%。
CONKO-001试验(Oettle等人,2007年)发现吉西他滨组的中位无病生存期显著改善(13.4(范围= 11.4-15.3)个月),而观察组为6.9(范围= 6.1-7.8)个月;P< 0.001)。吉西他滨组的总中位生存期为22.1个月(范围为18.4-25.8),而单独手术组的总中位生存期为20.2个月(范围为17-23.4)(HR=0.79 (95% CI= 0.62-1.01);P= 0.06)。主要终点是无病生存期,而总体生存期的一个混杂因素是对照组的很大一部分患者在复发时接受了吉西他滨。CONKO-001研究人员得出结论,吉西他滨化疗在目前所有可用的辅助治疗方案中具有最佳的获益/风险比(Oettle等人,2007年).与当前研究的比较采用了调整后的间接比较,保持了试验内随机化(布赫等人,1997)表明,辅助剂5FU/FA至少与吉西他滨具有相似的生存结果(5FU与吉西他滨相比,调整后的间接HR为0.89 (95% CI= 0.63-1.25),尽管由于置信区间宽,不能声称等效,应谨慎地解释为不如直接比较可靠。此外,在CONKO-001试验中,吉西他滨的毒性似乎低于5FU/FA (Neoptolemos等人,2001年,2004),但收益/风险比的可靠评估只能通过同时进行的随机比较来正确处理,正如ESPAC-3中所进行的那样。
RTOG-9704试验比较了放化疗前后吉西他滨(1000 mg m−2一天−1)到放化疗前后5FU (250 mg m−2一天−1接受胰腺切除术的患者(Regine等人,2008年).研究的两组均接受了以5fu为基础的放化疗(50.4 Gy),放化疗前3周和放化疗后12周均给予化疗(Regine等人,2008年).分析仅限于最初招募的538名患者中的442名“合格”患者。两组之间的总生存期没有差异,但对380例胰头癌患者的前瞻性亚组分析显示,吉西他滨为基础的放化疗组患者的死亡风险降低(HR=0.79;95%可信区间= 0.63 - -0.99;P= 0.047)。ESPAC-1试验的结论和随后与其他辅助试验的荟萃分析表明,在辅助治疗中,胰腺癌使用放化疗没有良好的临床证据(Neoptolemos等人,2001年,2004;Stocken等人,2005年)或患有局部晚期疾病的病人(叶等人,2006;Sultana等人,2007a,2007 b),但最近的研究结果却自相矛盾(Chauffert et al, 2008;Loehrer等人,2008年).胰腺癌放化疗的明显失败可能归因于系统化疗计划的干扰和/或显著的生物效应,如电离辐射的前转移效应(Biswas等人,2007年).
总之,目前的证据支持继续使用辅助剂5FU/FA治疗胰腺癌。ESPAC-3(v2)试验的结果将决定吉西他滨是否优于这种治疗。
参考文献
Biswas S, Guix M, Rinehart C, Dugger TC, Chytil A, Moses HL, Freeman ML, Arteaga CL(2007)中和抗体抑制tgf - β可防止辐射诱导的转移性癌症进展加速。J临床投资117(5): 1305 - 1313
Bucher H, Guyatt G, Griffith L, Walter S(1997)随机对照试验meta分析中直接和间接治疗比较的结果。临床流行病学50(6): 683 - 691
Chauffert B, Mornex F, Bonnetain F, Rougier P, Mariette C, Bouché O, Bosset JF, Aparicio T, Mineur L, Azzedine A, Hammel P, Butel J, Stremsdoerfer N, Maingon P, Bedenne L(2008)比较强化诱导放化疗(60 Gy,输注5-FU和间歇性顺铂)后维持吉西他滨和单独吉西他滨治疗局部晚期不可切除胰腺癌的III期试验。2000-01年FFCD/SFRO研究的最终结果。安杂志19(9): 1592 - 1599
Loehrer PJ, Powell ME, Cardenes HR, Wagner L, Brell JM, Ramanathan RK, Crane CH, Alberts SR, Benson AB(2008)一项局部不可切除胰腺癌患者吉西他滨联合放疗与单独吉西他滨的随机III期研究:E4201。J clinin OncolASCO年会论文集(会后版)。第26卷,没有。15S(5月20日增刊):4506)
Neoptolemos JP, Dunn JA, Stocken DD, Almond J, Link K, Beger H, Bassi C, Falconi M, Pederzoli P, Dervenis C, Fernandez-Cruz L, Lacaine F, Pap A, Spooner D, Kerr DJ, Friess H, Buchler MW,欧洲胰腺癌研究小组(2001)可切除胰腺癌的辅助放化疗:一项随机对照试验。《柳叶刀》358(9293): 1576 - 1585
Neoptolemos JP, Stocken DD, Friess H, Bassi C, Dunn JA, Hickey H, Beger H, Fernandez-Cruz L, Dervenis C, Lacaine F, Falconi M, Pederzoli P, Pap A, Spooner D, Kerr DJ, Buchler MW,欧洲胰腺癌研究小组(2004)胰腺癌切除术后放化疗的随机试验。新英格兰医学350(12): 1200 - 1210
Neuhaus P, Riess H, Post S, Gellert K, Ridwelski K, Schramm H, Zuelke C, Fahlke J, Langrehr J, Oettle H (2008) CONKO-001:吉西他滨辅助化疗与切除胰腺癌(PC)患者观察的随机、前瞻性、多中心III期临床试验的最终结果。J clinin Oncol(2008 ASCO年会论文集(会后版)。第26卷,没有。15S(5月20日增刊):LBA4504)
Oettle H, Post S, Neuhaus P, Gellert K, Langrehr J, Ridwelski K, Schramm H, Fahlke J, Zuelke C, Burkart C, Gutberlet K, Kettner E, Schmalenberg H, Weigang-Koehler K, Bechstein WO, Niedergethmann M, Schmidt-Wolf I, Roll L, Doerken B, Riess H(2007)胰腺癌治疗性切除术患者吉西他宾辅助化疗与观察:一项随机对照试验。《美国医学会杂志》297(3): 267 - 277
Regine WF, Winter KW, Abrams R, Safran H, Hoffman JP, Konski A, Benson AB, Macdonald JS, Kudrimoti MR, Fromm ML, Haddock MG, Schaefer P, Willett CG, Rich TA(2008)胰腺腺癌切除术后基于氟尿嘧啶的放化疗前后氟尿嘧啶vs吉西他滨:一项随机对照试验。《美国医学会杂志》299(9): 1019 - 1026
Stocken DD, Büchler MW, Dervenis C, Bassi C, Jeekel H, Klinkenbijl JH, Bakkevold KE, Takada T, Amano H, Neoptolemos JP(2005)胰腺癌随机辅助治疗试验的meta分析。Br J癌92(8): 1372 - 1381
苏丹娜,杜杜尔·史密斯C,坎宁安D,斯塔林N, Neoptolemos JP, Ghaneh P (2007a)局部晚期和转移性胰腺癌化疗的meta分析。J clinin Oncol25(18): 2607 - 2615
Sultana A, Tudur Smith C, Cunningham D, Starling N, Tait D, Neoptolemos JP, Ghaneh P (2007b)局部晚期胰腺癌放疗/联合治疗的系统综述,包括荟萃分析。Br J癌96(8): 1183 - 1190
Yip D, Karapetis C, Strickland A, Steer CB, Goldstein D(2006)不能手术的晚期胰腺癌的化疗和放疗,(Cochrane系统评价数据库,第3期。货号。:CD002093.DOI:10.1002/14651858.CD002093. pub2)
确认
本研究代表欧洲胰腺癌研究小组成员以及胰腺癌ESPAC-1和ESPAC-3辅助试验的贡献者发表。该研究由英国癌症研究中心资助;加上法国研究基金会Société国家Française de Gastroentérologie;意大利,罗马,维罗纳大学研究联盟和Università科学技术部(Cofin 9906195987);米兰意大利Ricerca Cancro协会(AIRC);欧洲共同体授予BIOMED 2 ce合同编号:bmh4 - ct98 - 3805;加拿大国家癌症研究所;和澳大利亚医学研究理事会。
作者信息
作者及隶属关系
财团
相应的作者
权利和权限
本作品遵循创作共用署名-非商业用途-禁止衍生3.0许可。要查看此许可证的副本,请访问http://creativecommons.org/licenses/by-nc-nd/3.0/。
关于本文
引用本文
Neoptolemos, J., Stocken, D., Tudur Smith, C.。et al。辅助剂5-氟尿嘧啶和亚叶酸vs胰腺癌的观察:来自ESPAC-1和-3(v1)试验的综合数据。Br J癌One hundred., 246-250(2009)。https://doi.org/10.1038/sj.bjc.6604838
修改后的:
接受:
发表:
发行日期:
DOI:https://doi.org/10.1038/sj.bjc.6604838
关键字
- 胰腺癌
- 吉西他滨
- 5-flurouracil
- 同步放化疗
- 随机试验
这篇文章被引用
胰管腺癌切除术的辅助放化疗:益处在哪里?风险分层和患者选择的Nomogram
胃肠外科杂志(2022)
血浆生物标志物预测胰腺导管腺癌切除术后早期肿瘤复发
科学报告(2021)
可手术胰腺癌的新辅助和辅助治疗:蜂蜜和牛奶(但没有面包?)
肿瘤学与治疗(2021)
将竞争风险理论纳入癌症生存变化的评估:充分利用死亡原因和常规关联的社会人口学数据
BMC公共卫生(2020)