文摘
黄蜂家庭Verprolin-homologous protein-2 (WAVE2)的成员Wiskott-Aldrich综合症蛋白质(黄蜂)家族的肌动蛋白成核促进因素,是肌动蛋白细胞骨架的中央监管机构聚合动力学。多个信号通路的操作通过WAVE2促进actin-nucleating活动actin-related蛋白质2/3 (Arp2/3)复杂。WAVE2存在的一部分pentameric蛋白复合物称为波监管复杂的人们,在缺乏其个人的不稳定的蛋白质。虽然WAVE2参与肌动蛋白聚合已经有据可查的,其负面的监管机制是差的特点。在这里,我们表明,WAVE2经历ubiquitylation t细胞激活依赖的方式,其次是蛋白酶体降解。的WAVE2 ubiquitylation网站映射到赖氨酸45,位于n端WAVE2结合该中心的地方。使用福斯特共振能量转移(FRET),我们发现中心维护的autoinhibitory构象的稳定性WAVE2静息细胞;释放后自动阻尼ubiquitylation t细胞激活促进WAVE2的暴露,导致降解。期间WAVE2细胞激活的动态构象结构决定其退化。
介绍
黄蜂家庭Verprolin-homologous(波)(也称为疤痕)蛋白在哺乳动物中包括三个亚型,称为WAVE1-3。所有家庭成员是肌动蛋白聚合的基本监管机构1等,在许多细胞功能所需的免疫反应,胚胎发育、组织修复、细胞能动性和迁移。他们的生产和动力学的重要介质大多数actin-rich突起,包括伪足、板状伪足2,3,丝状伪足4。WAVE1和WAVE3主要表达在神经元细胞,而WAVE2主要表达在细胞的造血系统5。有趣的是,WAVE2-deficient老鼠死在妊娠和显示缺陷的发展过程中,细胞迁移,板状伪足的形成和背激怒,确凿的肌动蛋白装配的关键作用的因素6,7,8,9。肌动蛋白细胞骨架重组是至关重要的T细胞激活T细胞传播中起着重要的作用,免疫突触(是)形成,Ca2 +流入和t细胞分泌的细胞因子和细胞溶解的颗粒:抗原呈递细胞(APC)联系网站10,11。WAVE2被确认为一个中央监管机构f -肌动蛋白聚合反应和重排下游的T细胞受体(TCR)12,13。结果表明:WAVE2招募到,这RNAi-mediated损耗WAVE2抑制TCR-induced传播和f -肌动蛋白聚合12,13。WAVE2还发现参与integrin-mediated TCR-stimulated附着力14,15、钙2 +release-activated Ca2 +(坚固)channels-mediated Ca2 +条目,TCR-mediated激活核转录因子的激活T细胞(NFAT),和需要TCR-stimulated - 2启动子活动12,14,16。这些早期的观察建立WAVE2作为细胞信号级联的不可或缺的组成部分。
结构上,波蛋白质包含波/疤痕同源域举行/梅毒性心脏病)n端,立即紧随其后的是一个基本的区域(B)17,18,19。毗邻B域名,脯氨酸域(PRD),作为一个结合位点的蛋白质含有Src-homology 3 (SH3)域。波蛋白具有守恒verprolin-homology cofilin-homology酸性(VCA)域的糖基,使他们能够刺激肌动蛋白的成核与肌动蛋白单体和交互actin-related蛋白质2/3 (Arp2/3)复杂17,18,19,20.。这个域必须严格监管,以确保适当的空间和时间控制肌动蛋白组装,肌动蛋白成核的失调可以导致一些疾病的发病机制,如慢性炎性疾病,肿瘤进展和转移21,22,23。
波内蛋白质结构上存在heteropentameric复杂,称为波监管复杂的人们,在不同的生物体,包括哺乳动物细胞24,25,26。整个复杂的真核生物进化高度保守的27和包括四个额外的蛋白质,即Sra1 / PIR121 Nap1 / Hem-1 Abi1/2, HSPC300 1:1:1:1:1摩尔比24,28,29日。波与该中心复杂的成员主要是在n端30.。
调节其成员的稳定性的因素尚不清楚。以前这是Nolz所示等。稳定的中心组件相互依赖;消除任何组件导致减少数量的波动以及其他成分的复杂12。然而,另一项研究声称,否则,整个复杂波稳定性的影响可拆卸的单个组件的复杂的T细胞13。此外,它是所示盘基网柄菌细胞表达突变疤痕(波同族体),缺乏其结合位点,产生一个稳定的蛋白质在野生型细胞和细胞缺失的各种复杂的成员30.。因此,我们对该中心的完整性的理解是不完整的。
与prenylated Rac-GTP、酸性磷脂和蛋白质激酶,Abl等是必不可少的激活WAVE2及其监管的复杂31日,32。这些监管机构必须同时存在,部分激活这些介质的不通过任何子集31日。此外,这些催化剂函数在一个高度合作的过程他们招募和集群中心质膜,导致多个波小区附近的激活31日,33。
人类的WAVE1复杂的晶体结构28表明,该中心由Sra1: Nap1二聚体形成的平台WAVE1: Abi2: HSPC300三聚物。三聚物接触二聚体在三方的方式,通过广泛的交互沿着一个轴形成的二聚体。虽然WAVE1用于晶体结构测定PRD的被删除,建议其VCA隔离在一个凹面由Sra1 WAVE1和残留82 - 184。因此,波是保持在一个不活跃的形式向Arp2/3在该中心28。一个构象的变化,引起Sra1 Rac-GTP绑定,导致隔离VCA的释放,没有复杂的区别28。尚不清楚WAVE1的构象结构类似于WAVE2,以及珠江三角洲波构象变化的作用尚未阐明。此外,分子之间的联系WAVE2激活及其降解仍然未知。
而积极的控制机制WAVE2调节其参与肌动蛋白聚合已经有据可查的,途径导致其负面监管没有描述。在这项研究中,我们描述了分子之间的联系WAVE2激活及其退化。我们表明,ubiquitylation WAVE2依赖于t细胞激活,紧随其后的是蛋白酶体降解。我们进一步映射WAVE2降解氨基端举行地点,特别是赖氨酸45。WAVE2复杂掩盖自己的土地退化的网站与VCA的交互领域,和释放WAVE2 autoinhibitory构象导致细胞激活后降解。因此,我们的研究结果表明,监管退化WAVE2取决于其构象变化在细胞活化。
结果
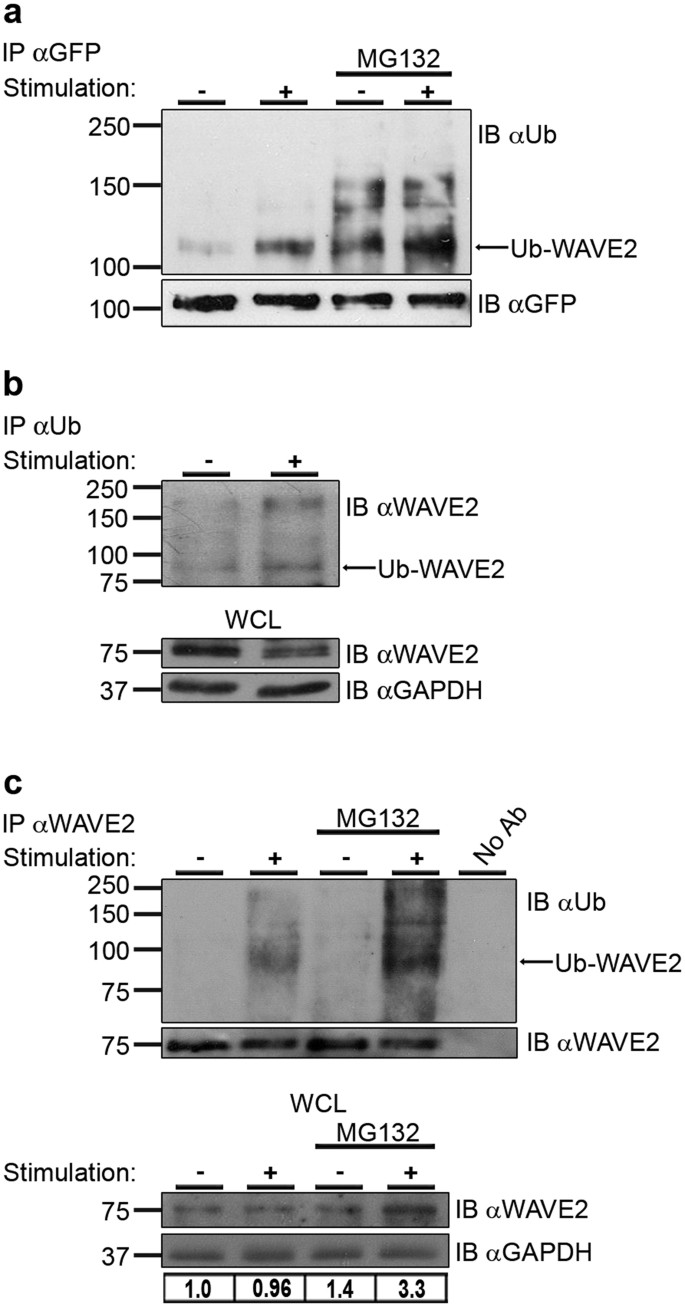
修改WAVE2 ubiquitylation诱导细胞激活,标记蛋白酶体降解
我们最近证明WAVE2招募了TCR站点和硝唑与成核促进因素(NPF),黄蜂,在t细胞活化的起始15。以前,我们表明,招聘TCR-based集群后,黄蜂经历ubiquitylation-dependent退化34。这种模式提出的问题是否激活WAVE2差别的对这些分子可能也会发生类似的过程。确定这样一个途径,我们研究了这种蛋白质是否ubiquitylated在T细胞。我们也决定这是否ubiquitylation proteasome-mediated和依赖于细胞的刺激。未经处理的Jurkat T细胞或MG132蛋白酶体inhibitor-pretreated细胞要么离开如果,还是co-stimulated anti-CD3和anti-CD28抗体。细胞刺激后,免疫沉淀反应的YFP-WAVE2共同沉淀了ubiquitylated WAVE2。的ubiquitylation WAVE2出现如上的涂片乐队YFP-WAVE2的分子量(MW) (~ 102 kDa)著名乐队大约110 kDa,模式类似于其他ubiquitylated蛋白质在T细胞,黄蜂34,Nck35(图1一个)。这个ubiquitylation增加细胞的刺激。此外,抑制蛋白酶体使用MG132导致积累ubiquitylated YFP-WAVE2蛋白质,表明WAVE2退化proteasome-dependent (图1一个)。这些结果证实了互惠的免疫沉淀反应,展示乐队的梯子ubiquitylated内生WAVE2兆瓦以上的WAVE2 (75 kDa)的强烈的沉淀ubiquitylated WAVE2约为83 kDa,增加刺激T细胞(图1 b)。同时,ubiquitylation WAVE2非转换中发现,人类主要外周血淋巴细胞(人外周血),和出现的涂片乐队兆瓦以上的内生WAVE2 (75 kDa)著名乐队约83 kDa (图1 c,上半部分)。这ubiquitylation进一步加强了MG132的存在。此外,表明全细胞溶解产物(水控制法)准备从这些样本,MG132治疗积累了WAVE2刺激和如果细胞(图1 c较低的面板)。WAVE2显示为两个相邻。351丝氨酸残占大多数的ERK-induced WAVE2磷酸化36我们验证上兆瓦,磷酸化形式的WAVE2通过免疫印迹phospho-specific (Ser (P) -351) WAVE2抗体(见补充图S1)。
(一个)Jurkat T细胞表达YFP-WAVE2剩下如果(−),或与anti-CD3 co-stimulated anti-CD28抗体(+)。MG132-treated细胞也离开如果(−)或co-stimulated (+, MG132)。同等数量的细胞为每个样本细胞溶解。细胞溶解产物免疫沉淀反应为泛素使用anti-GFP抗体和免疫印迹。类似数量的WAVE2被沉淀为每个示例使用沉淀抗体作为限制因素。Ubiquitylated YFP-WAVE2乐队110 kDa的诽谤。数据显示是代表四个独立的实验。(b)Jurkat T细胞离开如果(−),或与anti-CD3 co-stimulated anti-CD28抗体(+)。细胞溶解产物免疫沉淀反应为WAVE2使用anti-Ub抗体和免疫印迹。Ubiquitylated内生WAVE2出现的涂片乐队75 kDa兆瓦以上的知名乐队大约83 kDa。数据显示是代表三个独立的实验。(c)上面板:主要人类外周血淋巴细胞(人外周血)如果(−)或co-stimulated anti-CD3和anti-CD28抗体(+)。MG132-treated细胞也离开如果(−)或co-stimulated (+, MG132)。同等数量的细胞为每个样本细胞溶解。细胞溶解产物免疫沉淀反应为泛素使用anti-WAVE2抗体和免疫印迹。类似数量的WAVE2被沉淀为每个示例使用沉淀抗体作为限制因素。Ubiquitylated内生WAVE2出现的涂片乐队兆瓦以上的75 kDa,与著名乐队~ 83 kDa。数据显示代表至少有三个独立的实验。降低面板:细胞溶解产物从活性和非活性人外周血准备使用MG132或不及时治疗,并分析WAVE2蛋白水平。ImageJ WAVE2表达水平测定。微结果WAVE2正常化后相对于GAPDH值。
确认ubiquitylated乐队被WAVE2免疫沉淀反应包括修改WAVE2而不是WAVE2-associated蛋白质,我们免疫沉淀反应WAVE2从人外周血和煮的免疫沉淀反应蛋白质SDS,允许他们电离,然后re-immunoprecipitated WAVE2。所示补充图S2~ 83 kDa的ubiquitylated乐队中检测出第一和第二WAVE2免疫沉淀反应,表明乐队直接探测到乌兰巴托抗体代表ubiquitylated WAVE2。正如所料,WAVE2-Hem1 co-immunoprecipitate证明只有前两道而不是re-immunoprecipated车道(第三和第四道)。
映射的WAVE2 ubiquitylation网站
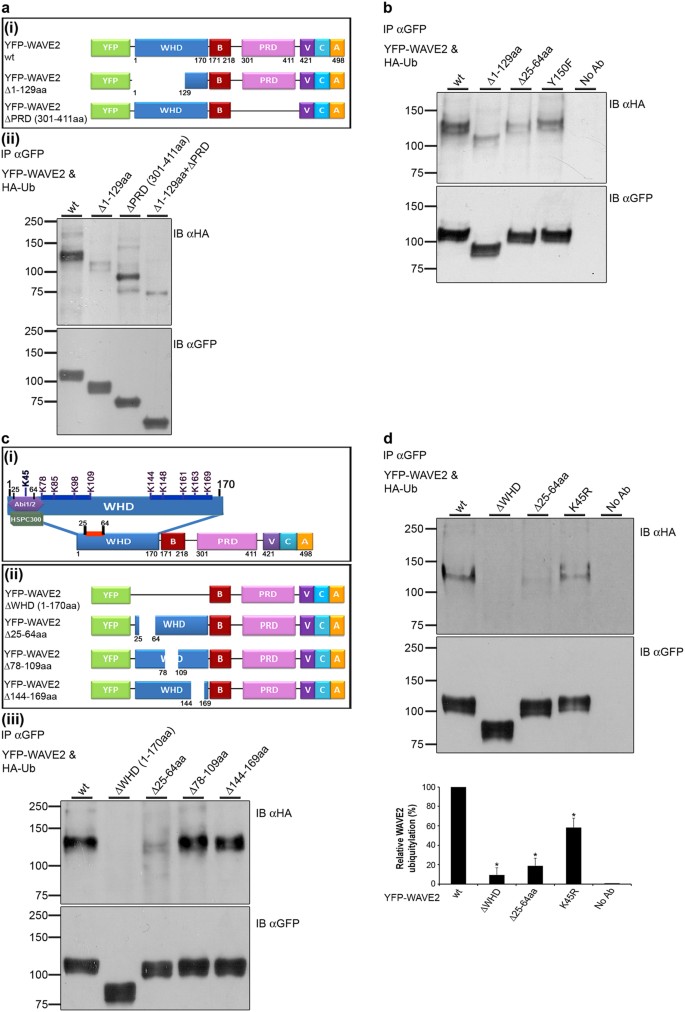
识别WAVE2 ubiquitylation网站,我们表达了一系列YFP-tagged删除突变体293年WAVE2 T细胞,加上HA-Ub,并评估其ubiquitylation。删除第一个129 aa WAVE2举行域的,(YFP-WAVE2Δ1 - 129 aa,图2(我)),但不位于的氨基酸144 - 169年底这一领域(YFP-WAVE2Δ144 - 169 - aa),造成一个戏剧性的减少WAVE2 ubiquitylation,相比WAVE2 wt (图2 (2)和S3补充图。)。删除的珠三角Δ301 - 411 aa (YFP-WAVE2ΔPRD,图2(我))没有影响的程度WAVE2 ubiquitylation (图2 (2))。然而,应该注意的是,删除PRD单独或结合举行,造成一个完整的损失这两个乐队之一出现在所有其他突变形式。自ERK磷酸化WAVE2在珠三角36,可以删除这个网站废除ERK的磷酸化,独家的外观检测的低兆瓦,磷酸化的WAVE2形式。
(一个(我)方案YFP-WAVE2 wt YFP-WAVE2缺失突变体。举行波同源域;B,基本的地区;珠江三角洲脯氨酸域;VCA,verprolin-homology cofilin-homology酸性域。(一个(ii)) 293 T细胞与构造编码co-transfected HA-tagged泛素结合YFP-WAVE2 wt或YFP-WAVE2突变形式表示。YFP-WAVE2使用anti-GFP抗体是免疫沉淀反应;复合物被解决通过sds - page和免疫印迹使用anti-HA泛素的抗体,和使用anti-GFP YFP-WAVE2抗体。Ubiquitylated YFP-WAVE2 wt出现在MW ~ 110 kDa, 8 MW以上kDa的YFP-WAVE2 (~ 102 kDa)。数据显示代表至少有三个独立的实验。(b)293 T细胞与构造编码co-transfected HA-tagged泛素结合YFP-WAVE2 wt或YFP-WAVE2突变形式表示。细胞细胞溶解和anti-GFP免疫沉淀反应。IPs被sds - page分离、转移和涂抹anti-HA和anti-GFP抗体。数据显示是代表三个独立的实验。(c(我)示意图说明WAVE2结构域。的WAVE2举行域包含十个赖氨酸残基,表示。(c(2)计划YFP-WAVE2缺失突变体。(c(3))293 T细胞与构造编码co-transfected HA-tagged泛素结合YFP-WAVE2 wt或YFP-WAVE2 cii中描述的变异形式。细胞细胞溶解和anti-GFP免疫沉淀反应。IPs被sds - page分离、转移和涂抹anti-HA和anti-GFP抗体。数据显示代表至少四个独立的实验。(dco-transfected) 293 T细胞,免疫沉淀反应,涂抹如上所述。光密度分析的乐队表演使用ImageJ和规范化GFP微密度值。误差线显示平均数标准误差(SEM)。意义由双尾决定学生的学习任务,由星号(*表示P< 0.05)。数据显示代表至少有三个独立的实验。
先前的研究表明,Abl-mediated WAVE2于150年酪氨酸的磷酸化,位于举行,诱发其激活和后续WAVE2-driven肌动蛋白聚合32。进一步阐明WAVE2激活及其ubiquitylation之间的协会,我们生成一个YFP-WAVE2构造包含phospho-abolishing突变在150年酪氨酸(YFP-WAVE2 Y150F)。然后我们检查这个突变形式的表达如何影响WAVE2 ubiquitylation。见图2 b,phospho-abolishing变异减少WAVE2 ubiquitylation 1.9折以上相比WAVE2 wt(比较巷1巷4)表明磷酸化,活跃WAVE2经历ubiquitylation,从而支持的角色ubiquitylation负WAVE2监管作为一种机制。总之,这些数据表明,举行域ubiquitylation WAVE2调和。基于这些结果,我们进一步分析这一领域的功能。
所示图2 c(我),举行包含十个赖氨酸残基。基于这些残留的位置,我们将举行分成子域,并准备额外的YFP-WAVE2删除突变形式(图2 c (2))。突变体的准备包括WAVE2ΔWHD;WAVE2Δ25 - 64 aa,其中包含一个赖氨酸,以前发现作为对接网站监管复杂30.;WAVE2Δ78 - 109 aa,包括四个赖氨酸残基;和WAVE2Δ144 - 169 aa,其中包括五个赖氨酸残基。YFP-WAVE2突变形式表达,检测ubiquitylation WAVE2免疫沉淀反应,与anti-HA IB。完全删除举行(YFP-WAVE2ΔWHD 1 - 170 - aa)完全废除WAVE2 ubiquitylation,相比wt形式(图2 c (iii)),而没有减少WAVE2 ubiquitylation发现后删除氨基酸78 - 109,或氨基酸144 - 169,而WAVE2 wt (图2 c (iii),比较车道4和5巷1)。有趣的是,删除氨基酸25 - 64导致大量减少WAVE2 ubiquitylation (图2 c (iii),比较车道3和1)。这种减少的删除其结合位点(Δ25 - 64 aa)可以解释为缺乏赖氨酸45,这是唯一的赖氨酸残基位于这个地区,也可能是由于缺乏与theWAVE2复杂,可能需要的其他成员为WAVE2 ubiquitylation。测试是否WAVE2 ubiquitylated赖氨酸45,我们专门突变赖氨酸(YFP-WAVE2 K45R)。的Immunoprecepitation YFP-WAVE2 K45R突变体表现出减少ubiquitylation wt WAVE2(相比P≤0.04)(图2 d车道4比1),尽管减少明显比通过移除举行或其结合位点(P≤0.006,P分别为≤0.009)(图2 d)。这些数据表明,WAVE2 ubiquitylated赖氨酸45,和建议的参与成员的复杂ubiquitylation和退化过程。消除的可能性K45R突变损害WAVE2绑定到中心,我们免疫沉淀反应三种WAVE2 (wt、K45RΔ25 - 64 aa)和比较他们的绑定到该中心蛋白,Hem-1。正如预期的那样,而其结合位点的缺失破坏了这种交互,K45R突变没有影响(见WAVE2-Hem-1交互补充图。S4)。
该中心的角色在WAVE2 ubiquitylation
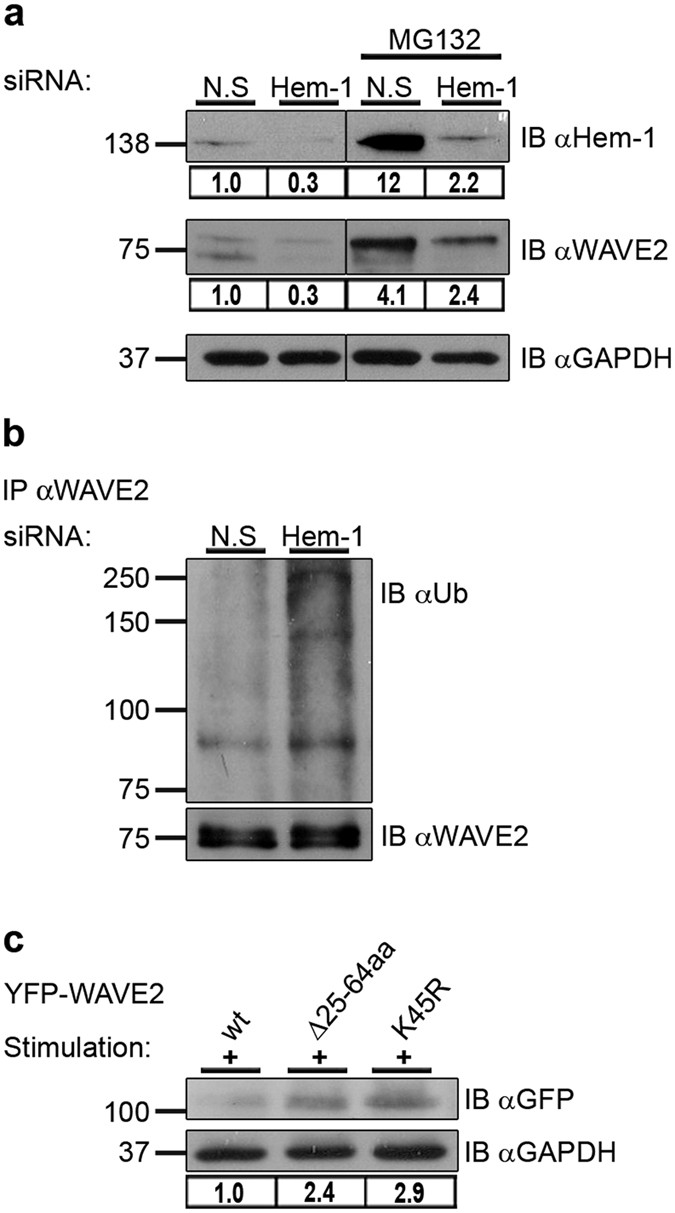
进一步确定的角色复杂的组件WAVE2退化,造血具体成员,Hem-1,使用特定的核基因沉默在t细胞。控制细胞的治疗非特异性蛋白(n)炒siRNA池作为消极的控制。细胞被MG132处理不及时治疗或刺激紧随其后。Hem-1表达降低了70%,由微密度分析(图3)。有趣的是,基因沉默的Hem-1造成大幅减少WAVE2表达式。验证结果减少WAVE2表达式是由Hem-1的沉默,而不是由一个核的脱靶效应,我们进行了一项实验,使用Hem-1-specific siRNA略有不同。减少类似WAVE2水平观察,证明效果是特定于Hem-1基因沉默(见补充图S5)。在MG132 (图3右面板),大量积累Hem-1 WAVE2演示了在N。年代,在较小程度上,在Hem-1 siRNA-treated细胞(图3)。沉默的Hem-1进一步加强WAVE2 ubiquitylation由激活T细胞的免疫沉淀反应分析,表明存在需要Hem-1 WAVE2稳定性(图3 b)。此外,由于击倒Hem-1导致增加WAVE2 ubiquitylation及其随之恶化,很可能该中心结合位点氨基酸(25 - 64)包含一个退化为WAVE2网站。
(一个)Jurkat T细胞转染核特定人类Hem-1以及非特异性(n)炒核控制。24小时后,细胞治疗与MG132或不及时治疗,其次是co-stimulation anti-CD3和anti-CD28抗体。细胞溶解产物制备和分析Hem-1 WAVE2蛋白质水平。的基因沉默效率Hem-1以及WAVE2表达水平被ImageJ测量。微结果Hem-1或WAVE2正常化后相对于GAPDH值。竖线表示非邻接的屁股。所有航线都来自同一个电影和曝光时间。(b)描述的溶解产物(一个)从细胞没有MG132处理,使用anti-WAVE2抗体免疫沉淀反应和泛素的免疫印迹。Ubiquitylated内生WAVE2出现75 kDa兆瓦以上的知名乐队~ 83 kDa。(c)Jurkat T细胞表达YFP-WAVE2 wt或YFP-WAVE2突变形式,Δ25 - 64 aa和K45R YFP-positive细胞分类。细胞与anti-CD3 co-stimulated anti-CD28抗体溶解紧随其后。溶菌产物分析WAVE2蛋白质水平通过免疫印迹anti-GFP抗体或anti-GAPDH加载控制。光密度分析的乐队使用ImageJ执行和规范化GAPDH微密度值。数据显示是代表三个独立的实验。
进一步检查的重要性,其结合位点WAVE2稳定,我们使用T细胞稳定表达YFP-WAVE2 wt,或其变异形式,Δ25 - 64 aa或K45R。细胞溶解产物从YFP准备排序(见补充图S6)。大量积累的WAVE2突变形式,即。,WAVE2 Δ25-64aa and WAVE2 K45R was seen relative to WAVE2 wt following activation; protein levels of these mutant forms were increased by 2.4 and 2.9 fold, respectively (图3 c),这表明25 - 64 aa的片段,特别是赖氨酸45扮演一个角色在activation-dependent WAVE2退化。
VCA域WAVE2稳定中扮演着关键角色
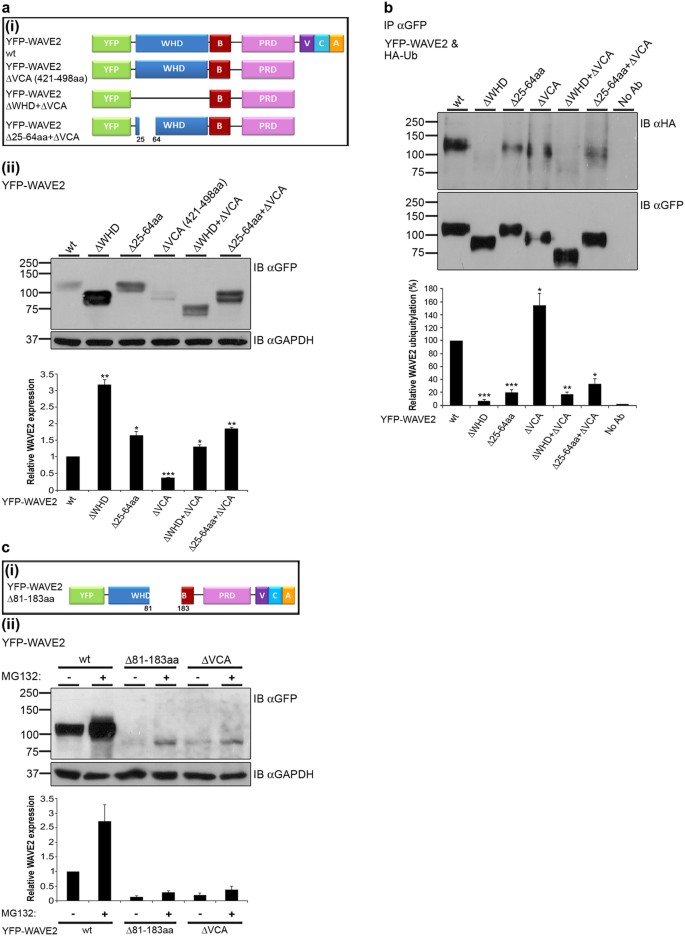
接下来,我们检查是否VCA WAVE2领域扮演重要角色在WAVE2稳定除了其结合位点(片段25 - 64 aa)。因此,一些附加YFP-WAVE2突变形式准备,包括WAVE2ΔVCA, WAVE2ΔWHD +ΔVCA和WAVE2Δ25 - 64 aa +ΔVCA (图4(我))。YFP-WAVE2突变形式引入293 T细胞,通过免疫印迹分析和分析表达式。所示图4 (2)、删除引起的VCA域明显降低(2.7±0.01折)WAVE2蛋白质含量比wt (P≤0.0003),这表明VCA域对维护WAVE2稳定是至关重要的。不足为奇的是,删除单独举行或其结合位点(Δ25 - 64 - aa),积累了这些non-ubiquitylated形式相比WAVE2 wt (图4 (2))。量化蛋白质的表达表明YFP-WAVE2ΔWHD或Δ25 - 64 aa蛋白水平增加了超过3.1±0.1,1.6±0.1折,分别与细胞表达wt WAVE2 (P≤0.005,P分别为≤0.03)(图4 (2))。删除VCA域一起举行或其结合位点恢复WAVE2蛋白表达水平较高,超过1.3±0.05,1.8±0.04折,分别比全长WAVE2 wt (P≤0.02,P分别为≤0.002)(图4 (2))。
(一个(我)计划YFP-WAVE2缺失的突变体。(一个(2))转染293 T细胞构造编码YFP-WAVE2 wt或YFP-WAVE2突变形式表示。细胞细胞溶解和分析WAVE2蛋白质含量与anti-GFP抗体免疫印迹或anti-GAPDH加载控制。光密度分析的乐队使用ImageJ执行和规范化GAPDH微密度值。数据显示的代表(污点),或平均水平低(图)5个独立的实验。误差线显示扫描电镜。意义由双尾决定学生的学习任务,由星号(*表示P< 0.05;* *P< 0.005;* * *P< 0.0005)。(b)293 T细胞与构造编码co-transfected HA-tagged泛素结合YFP-WAVE2 wt或YFP-WAVE2突变形式,表示。YFP-WAVE2被anti-GFP免疫沉淀反应,膜与anti-HA和anti-GFP涂抹。Ubiquitylated YFP-WAVE2 wt出现在~ 110 kDa的兆瓦。光密度分析的乐队表演使用ImageJ和规范化GFP微密度值。数据显示的代表(污点),或平均水平低(图)三个独立的实验。误差线显示扫描电镜。意义是由双尾决定学生的学习任务,并由星号(*表示P< 0.05;* *P< 0.005;* * *P< 0.0005)。(c(我)方案81 - 183 aa - YFP-WAVE2删除。(c(2))转染293 T细胞构造编码YFP-WAVE2 wt或YFP-WAVE2突变形式,表示。细胞不及时治疗或使用0.5μM MG132一夜之间,细胞溶解,通过免疫印迹分析,如上所述。光密度分析的乐队使用ImageJ执行和规范化GAPDH微密度值。
接下来,我们检查了这些突变体的ubiquitylation形式。WAVE2删除构造举行,25 - 64 aa和VCA域,单独或组合,与HA-Ub中的GFP免疫沉淀反应和anti-HA免疫印迹。正如前面所示的,删除举行完全废除WAVE2 ubiquitylation,同时删除该中心结合位点导致大幅减少WAVE2 ubiquitylation (图4 b)。删除VCA的领域,另一方面,导致WAVE2 ubiquitylation增加,这表明VCA域参与WAVE2稳定性(图4 b和补充图S7)。正如所料,表达WAVE2ΔWHD +ΔVCA突变没有ubiquitylation,虽然表达WAVE2Δ25 - 64 aa +ΔVCA显示大量减少ubiquitylation (图4 b)。
进一步建立VCA的影响域WAVE2稳定、293 T细胞表达YFP-WAVE2 wt,Δ81 - 183 aa(这是在WAVE2 VCA结合位点,图4 c(我))28、ΔVCA用MG132预处理,或不及时治疗。细胞YFP-WAVE2表达进行分析。删除81 - 183或氨基酸的VCA域导致大量减少WAVE2蛋白质含量超过2倍相比wt形式(图4 c (2)分别,比较车道3或5巷1)。有趣的是,WAVE2蛋白质水平显著增加细胞中表达WAVE2Δ81 - 183 aa或WAVE2ΔVCA,使用0.5μM MG132一夜之间,尽管程度低于YFP-WAVE2 wt (图4 c (2)),表明氨基酸快速和强烈退化通过清除81 - 183或VCA域。为了确认降解过程主要由proteasome-dependent通路介导,我们ΔVCA预处理和50 wt WAVE2表达细胞μM MG132 3 h。这实际上导致突变的完成救援WAVE2(见补充图S8a)。我们另外确认这些发现使用环己酰亚胺追逐化验证明proteasome-dependent过程占主导地位的WAVE2降解途径,和比较稳定的波ΔVCA突变的wt(见补充图S8b, c)。验证VCA域对WAVE2 T细胞的稳定至关重要,我们转染Jurkat T细胞与YFP-WAVE2 wt或YFP-WAVE2ΔVCA,并演示了减少的表达通过西方和流式细胞仪分析(见突变补充图S9)。综上所述,我们的研究结果表明WAVE2 VCA域稳定的重要性。
WAVE2中找到一个释放细胞激活后autoinhibitory构象
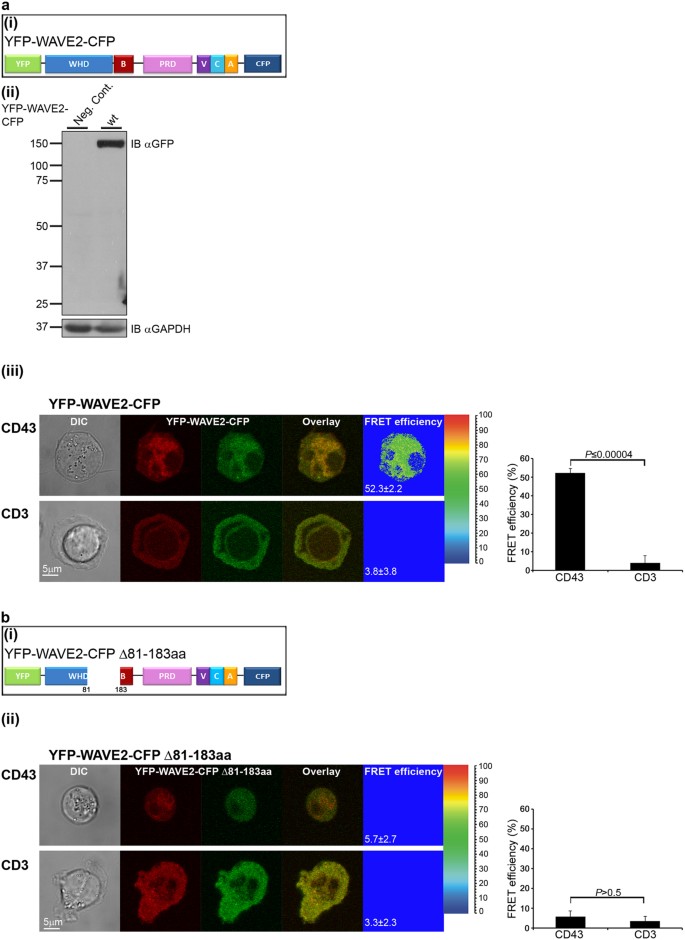
然后我们确定WAVE2后发生构象变化释放其VCA域识别激活。福斯特共振能量转移(FRET)技术使内部的检测,以及国际米兰——分子在纳米范围内的相互作用37,38。我们利用这种技术来监测可能的构象变化WAVE2通过构造一个FRET-based探测器组成的WAVE2标记与YFP的n端和CFP的糖(YFP-WAVE2-CFP,图5(我))。验证的细胞功能调查,我们调查它的酪氨酸残基磷酸化,之前对其活动至关重要32。的确,磷酸化YFP-WAVE2-CFP被发现正常(见补充图S10a)。此外,我们确定的细胞分布YFP-WAVE2-CFP相比前面描述YFP-WAVE2蛋白质15(见补充图S10b)。最重要的是,我们决定YFP-WAVE2-CFP恢复T细胞的能力activation-dependent LFA-1构象改变内源性WAVE2击倒的T细胞。为此,YFP-WAVE2-CFP质粒包含沉默突变,使它对所使用的核(见方法)。像以前我们所示,WAVE2击倒扰乱LFA-1的激活,演示了使用KIM127,抗体特定LFA-1的活性构象15。在这里,我们表明,YFP-WAVE2-CFP表达式救援LFA-1 WAVE2击倒细胞激活,展示YFP-WAVE2-CFP的正常功能(见补充图S10c)。
(一个(我)的示意图表示标记WAVE2蛋白质用于烦恼分析。(一个(2)Jurkat细胞表达YFP-WAVE2-CFP和untransfected(负控制底片。续与anti-GFP)被免疫印迹分析。GAPDH作为加载控制。(一个(iii)) Jurkat T细胞表达YFP-WAVE2-CFP镀在要么non-stimulatory盖玻片覆盖anti-CD43抗体(上部面板中,n = 89个细胞),或刺激盖玻片涂anti-CD3抗体(较低的面板中,n = 42细胞)。激活的细胞被固定后3分钟,共焦显微镜成像。为分析使用donor-sensitized受体发射技术(有关详细信息,请参阅方法)。图表总结的意思是担心效率在细胞表达镀YFP-WAVE2-CFP表示盖玻片呈现在右边。图显示了三个独立的实验意味着±SEM。意义是由双尾学生的学习任务。(b(我)方案81 - 183 aa - YFP-WAVE2-CFP删除。(b(2))Jurkat T细胞转染质粒编码YFP-WAVE2-CFPΔ81 - 183 aa镀在要么non-stimulatory (anti-CD43,上面板,n = 76细胞)或刺激(anti-CD3,较低的面板中,n = 48细胞)盖玻片和固定后3分钟的激活。图表显示细胞表达的意思是担心效率YFP-WAVE2-CFPΔ81镀- 183 aa表示盖玻片呈现在右边。图显示了三个独立的实验意味着±SEM。意义是由双尾学生的学习任务。
T细胞稳定表达YFP-WAVE2-CFP镀在要么non-stimulatory (anti-CD43) (图5 (3)、上面板)或刺激(anti-CD3) (图5 (3)、较低的面板)预涂盖玻片,固定后3分钟的激活。的分子内亲近doubly-tagged WAVE2被烦恼测量分析。高为52.3±2.2%的效率以幼稚细胞,表明近距离WAVE2的n端和糖之间。相比之下,担心效率测量之间的N和C -末端刺激T细胞,显著降低(3.8±3.8%,P≤0.00004),这表明这些地区不再在近距离(图5 (3)正确的图)。这些数据提供直接的和令人信服的证据表明WAVE2假定autoinhibitory构象处于静息状态,也就是改变细胞受体激活。
我们下建立的必要性残留81 - 183 WAVE2 autoinhibitory构象。我们表示FRET-labelled WAVE2探测器删除残留81 - 183 (YFP-WAVE2-CFPΔ81 - 183 aa,图5 b(我)在T细胞),测量了烦恼效率CFP和YFP之间。删除81 - 183氨基酸导致大量退化(图4 c (2)),使用MG132转染T细胞。几乎没有烦恼以天真的(图5 b (2)上半部分)或激活细胞(图5 b (2)较低的面板)(5.7±2.7%和3.3±2.3%,分别P> 0.5)(图5 b (2)正确的图),这表明删除VCA的结合位点在WAVE2 n端,扰乱了WAVE2 autoinhibitory构象。总的来说,担心数据明显表明WAVE2被发现其autoinhibitory构象通过分子内举行,VCA域之间的相互作用。破坏这些分子内相互作用的细胞受体激活或删除VCA结合位点,结果在分子构象变化,假设non-inhibited状态(见图解模型补充图S11a-c)。
WAVE2构象的变化决定其ubiquitylation和顺向退化
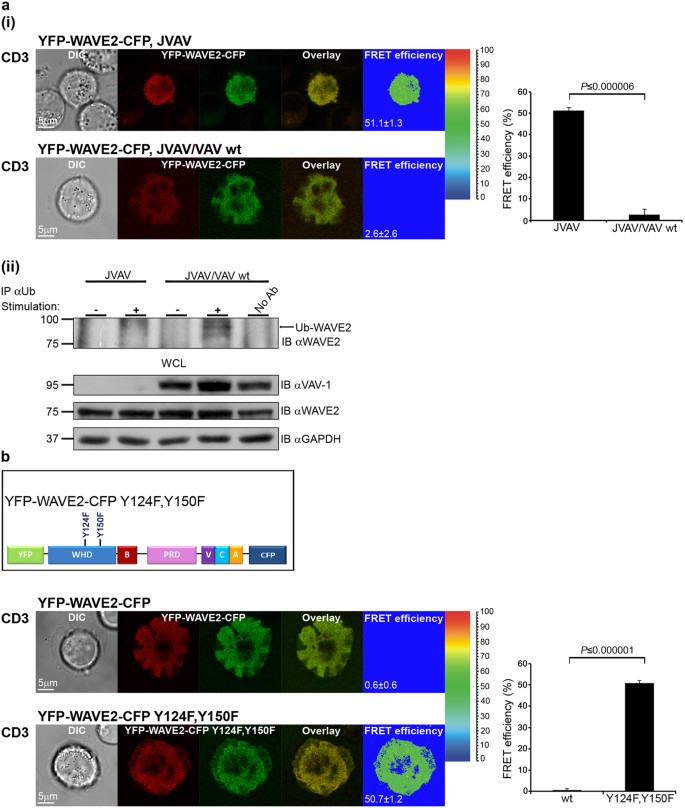
到目前为止,我们已经表明,WAVE2构象变化和ubiquitylation都依赖于细胞的激活。我们下一个调查这两个流程之间是否有联系。有几种催化剂的中心,其中,小GTPase Rac1,一个重要的球员在细胞运动和趋化性39。然而,波蛋白质缺乏的能力将直接绑定到小gtpase,和一些蛋白质已经提出调解Rac1和波之间的相互作用,包括Sra140。确定Rac1 WAVE2激活的信号级联的影响在其构象结构,我们研究VAV-1的作用,功能作为一个鸟嘌呤核苷酸交换因子(GEF) Rac141,释放WAVE2 autoinhibited构象。Jurkat T细胞缺乏VAV-1 (JVAV)和JVAV细胞重组VAV-1 wt (JVAV /变风量空调wt),表达YFP-WAVE2-CFP镀在刺激预涂盖玻片,固定,CFP之间的烦恼效率和YFP测量(图6(我))。担心JVAV效率明显高于在JVAV细胞重组VAV-1(51.1±1.3%和2.6±2.6%,分别P≤0.000006),表明在缺乏VAV-1, WAVE2维持在一个autoinhibited构象(图6(我)正确的图)。接下来,我们决定是否开设non-inhibited构象ubiquitylation WAVE2是必要的。JVAV和JVAV重组VAV-1 wt细胞离开如果或co-stimulated anti-CD3和anti-CD28其次是泛素抗体免疫沉淀反应。WAVE2 ubiquitylation进行了分析;~ 83 kDa的著名乐队,代表WAVE2 ubiquitylation,几乎完全没有在VAV-1-deficient T细胞后细胞激活(图6 (2))。这些结果支持我们的观察WAVE2构象发生改变后其激活(图5 (3)),并证明的重要性WAVE2 ubiquitylation构象状态。
(一个(我)Jurkat T细胞缺乏VAV-1 (JVAV,上面板,n = 10细胞),和JVAV细胞重组VAV-1 wt (JVAV /变风量空调wt、较低的面板中,n = 16个细胞)转染质粒编码YFP-WAVE2-CFP镀在鼓舞人心的盖玻片,固定后3分钟激活,担心效率CFP和YFP之间测量。图表显示的意思是担心效率表示细胞表达YFP-WAVE2-CFP镀在鼓舞人心的盖玻片呈现在右边。图显示了三个独立的实验意味着±SEM。意义是由双尾学生的学习任务。(一个(2)JVAV和JVAV /变风量空调wt剩下如果(−),或被co-stimulated(+)和anti-CD3 anti-CD28抗体。细胞溶解产物受到免疫沉淀反应和anti-Ub抗体(IP),和样品分析西方墨点法(IB) anti-WAVE2抗体。Ubiquitylated WAVE2出现在83 kDa的分子量。底:水控制法在免疫沉淀反应进行了分析通过免疫印迹显示抗体。所有的西方墨迹是代表三个独立的实验。(b)方案point-mutated YFP-WAVE2-CFP 124年和150年与酪氨酸残基被苯丙氨酸残基所取代。Jurkat T细胞转染质粒编码YFP-WAVE2-CFP wt(上部面板中,n = 43细胞)或YFP-WAVE2-CFP Y124F, Y150F(较低的面板中,n = 21细胞)镀在鼓舞人心的盖玻片,固定后3分钟激活,担心效率CFP和YFP之间测量。图表显示的意思是担心效率在细胞表达YFP-WAVE2-CFP wt或YFP-WAVE2-CFP Y124F, Y150F镀是在刺激盖玻片呈现在右边。图显示了三个独立的实验意味着±SEM。意义是由双尾学生的学习任务。
波的磷酸化蛋白质也是必不可少的中心激活32,36,42,43(引用文献综述。44),尽管它的机制在很大程度上是未知的。以前的研究已经表明WAVE1磷酸化,特别是在125年酪氨酸和酪氨酸151(相当于124酪氨酸和酪氨酸150,分别在WAVE2),可以激活这个蛋白质28。地址是否WAVE2磷酸化的酪氨酸残基124年和150年撼动其autoinhibited构象,从而释放VCA域和顺向ubiquitylation,我们构建了一个FRET-based phospho-abolishing突变的探测器在124年和150年的酪氨酸残基(YFP-WAVE2-CFP Y124F, Y150F,图6 b)。T细胞表达这种突变形式是镀在刺激盖玻片,CFP之间的烦恼效率和YFP测量(图6 b)。担心效率明显高于细胞中表达YFP-WAVE2-CFP Y124F, Y150F,类似于如果细胞(图5 (3)上半部分),在细胞表达wt形式相比,显示几乎没有烦恼(50.7±1.2%和0.6±0.6%,分别P≤0.000001)(图6 b正确的图)。这些结果表明,WAVE2 autoinhibited在YFP-WAVE2-CFP Y124F, Y150F表达细胞。事实上正如上面提到的,WAVE2 Y150F phospho-abolishing突变更容易ubiquitylation相比WAVE2 wt (图2 b),进一步建立WAVE2构象变化及其ubiquitylation之间的联系。
讨论
肌动蛋白细胞骨架的主要监管机构,波蛋白质作为枢纽,连接上游信号激活Arp2/3复杂,从而介导的信号级联传播导致肌动蛋白聚合。
蛋白质在细胞中,波被发现的大分子量蛋白复合物,被指定为该中心,有四个额外的参与蛋白质:Sra1, Nap1, Abi1/2, HSPC300,或者他们的同系物24,45。
大多数研究表明,该中心成员参与波稳定8,12,46。然而,本条例的确切性质的分子机制,及其生物学意义还不清楚。在当前的研究中,我们旨在描述分子机制管理WAVE2的退化,并提供一个全面的视图的负调控。
我们证明WAVE2 ubiquitylation是诱导细胞激活,并由蛋白酶体介导的。我们表明,举行,特别是赖氨酸45,位于其结合位点,是必不可少的WAVE2 ubiquitylation。这些结果支持的一项研究表明盘基网柄菌细胞表达波同系物,疤痕,缺乏其结合位点产生一个稳定的蛋白质在野生型细胞,并且在复杂的遗传背景缺失的不同成员30.。引人注目的是,我们在这里展示,删除WAVE2举行或其结合位点(Δ25 - 64 - aa),导致大量这些蛋白质在细胞中积累。表达式的25 - 64 aa删除突变导致较小的降低WAVE2 ubiquitylation比ΔWHD突变。有趣的是,突变的赖氨酸45没有完全废除WAVE2 ubiquitylation,暗示其他潜在的赖氨酸残基或ubiquitylation主题/ s位于举行,也参与这个过程。
波已经提出蛋白质在该中心在静息状态是不活跃的29日,31日,47,晶体结构的分辨率WAVE1及其监管复杂的记录28。然而,应该注意的是,在使用的重组WAVE1复杂晶体研究,c端脯氨酸区域,以及SH3 Abi2领域,基因删除,和大珠三角WAVE1换成了一个18-residue链接器,使结晶,因此不确定。这些领域是高度保守的,生理上很重要。因此,在本研究中,我们使用完整WAVE2探索之间的联系WAVE2激活和其构象状态退化的生理系统。为此,我们利用FRET-based传感器使WAVE2构象进行监视在活的有机体内。使用这种传感器,我们检测到一个糖基之间的直接交互WAVE2及其n端在静息细胞。具体地说,这个分子内相互作用涉及残留81 - 183,结合c端VCA域。这autoinhibited构象似乎是动态的,因为细胞刺激后激活WAVE2动摇分子内相互作用,释放其自动阻尼。重要的是,TCR-induced WAVE2构象变化被废除的情况下,防止的活化中心,即。,一个brogating Rac1-mediated activation, or perturbing WAVE2 phosphorylation, indicating the importance of proper WAVE2 activation for its conformational change.
WAVE2负监管的模式显示在这里似乎像黄蜂34。类似于WAVE2,黄蜂在本质上是不活跃的幼稚T细胞,存在于一个autoinhibited状态的c端VCA域分子内相互作用与其GTPase-binding域(GBD)48分子间,与WASp-interacting蛋白(在制品)37。此外,在这些细胞,黄蜂强烈associates在制品通过56 - 102位于黄蜂n端氨基酸WH1域34,49,50。删除黄蜂VCA域的破坏与在制品的互动,从而揭露黄蜂ubiquitylation,随后,退化37。在某种程度上类似于黄蜂规定,WAVE2还需要释放的autoinhibitory构象分离VCA域。此外,我们之前发现细胞刺激后,WASp-WIP分子复杂的部分分离,导致激活黄蜂的ubiquitylation赖氨酸残基76年和81年,其退化34,37。的确,我们在这里展示的重要作用non-inhibited开放构型的WAVE2 ubiquitylation。预防中心激活不仅废除了WAVE2构象改变,但也导致大量减少WAVE2 ubiquitylation,生化分析做了演示。因此,建立了强有力的联系WAVE2构象变化及其ubiquitylation之间。这activation-linked降解机制是合理的对其他结构相关蛋白质黄蜂家族的蛋白质,需要进一步调查。
我们的数据可以集成WAVE2负监管提出一个新颖的机制。WAVE2 VCA域作为一个帽,锚拉力锦标赛的组件的结合位点WAVE2 (25 - 64 - aa),从而导致了屏蔽和保护WAVE2 ubiquitylation网站/ s。识别,WAVE2招募到TCR-APC网站与蛋白质酪氨酸激酶和同事接触,即。,ZAP-70 and the adaptor proteins LAT, SLP-76, VAV-1 and Nck, forming signaling clusters, which facilitate its activation and function15。WAVE2激活触发构象改变,释放隐藏VCA域,暴露WAVE2举行,具体来说,赖氨酸45岁ubiquitylation,促进WAVE2退化(见补充图S11d)。
WAVE2缺乏是胚胎致死,由于出血引起的异常的肌动蛋白重组导致血小板破坏7。这表明WAVE2肌动蛋白dependent-cellular功能的至关重要的作用。WAVE2的要求适当的免疫反应也建议通过对老鼠的研究缺乏或突变在该中心的其他成员。因此,Hem-1缺陷小鼠表现出淋巴细胞减少,嗜中性,和贫血,提供有价值的线索,可能生理WAVE2不足的后果。从Hem-1缺陷小鼠T细胞受损的发展,显示激活,和扩散,造成异常的肌动蛋白聚合,减少integrin-mediated粘附纤连蛋白51。因为我们在这里展示基因沉默WAVE2 Hem-1导致几乎完全退化(图3 a, b),这些缺陷可能来自WAVE2缺失的情况下,积极参与这些过程。此外,它表明,除了integrin-mediated细胞粘附和肌动蛋白聚合,WAVE2也是必不可少的钙熔剂,NFAT激活和2转录活动11,13,14,15。因此,增强的自然降解级联WAVE2可能是一个有效的方法来防止不受欢迎的肌动蛋白成核导致hyper-activation T细胞的表现在慢性炎症反应。
因此,识别的机制可能会提供一个有价值的差别WAVE2对这些框架开发一种创新的方法调节WAVE2-dependent过程在健康和疾病。
方法
抗体和试剂
抗体及其来源如下。抗体成像:鼠标anti-CD3ε(UCHT)和anti-CD43 (BD生物科学)。主要抗体免疫沉淀反应和免疫印迹:鼠标anti-GFP,老鼠anti-HA过氧化物酶3 f10(罗氏应用科学);鼠标anti-GAPDH(生物设计);兔子anti-ubiquitin (Dako);兔子anti-Hem-1(罗福斯);山羊anti-WAVE2 D16、鼠标anti-ubiquitin P4D1、鼠标anti-Vav D7(圣克鲁斯生物技术公司);兔子anti-phospho WAVE2 (ser - 351),鼠标anti-phosphotyrosine(企业)4 g10(微孔)。所提供的额外WAVE2抗体请D。从医学院的D Billadeau,梅奥诊所,MN,美国。 Secondary antibodies for immunoblotting: goat anti-mouse (Sigma-Aldrich); goat anti-rabbit, donkey anti-goat (Santa Cruz Biotechnology, Inc). Alexa-conjugated, isotype-specific secondary antibody was purchased from Thermo Fisher Scientific. Pools of three independent RNA duplexes specific for human Hem-1 were obtained from Invitrogen, with the following sequences: CCACCUUCAGUACUUGGCAAGAUUU, CCAAGGUGAUGAACCUCAUUGUCUU, and CCUUGCCACUGACCCUUCUUCCUUU.
此外,另一个RNA双工是来自Sigma-Aldrich,下列顺序:
UCUAACAACAAGAACAUUGA。
特定于内源性RNA双人类WAVE2获得Sigma-Aldrich,下列顺序:
GAAGAGAAAGCACAGGAAA。
联合国的新池(非特异性)负控制核工器是从Dharmacon买来的,有以下序列:UAGCGACUAAACACAUCAA, UAAGGCUAUGAAGAGAUAC, AUGUAUUGGCCUGUAUUAG AUGAACGUGAAUUGCUCAA, UGGUUUACAUGUCGACUAA。
表达载体和质粒
默默地变异人类WAVE2 cDNA请提供的数字显示Billadeau从医学院的梅奥诊所,MN,美国。这些突变呈现产品的质粒抗WAVE2-specific siRNA使用(目标序列改变aAAaAGgAAaCACAGGAAA;小写字母表示核苷酸变化不会影响氨基酸序列)。的cDNA克隆成pcDNA3 +新霉素向量表达载体,然后被克隆到表达载体pEYFP-C1 pECFP-N1 Clontech,获取YFP或CFP-tagged WAVE2。GFP融合单体的呈现了A206K替换被撒迦利亚52。YFP-WAVE2-CFP构造是由WAVE2-CFP段的插入,使用限制性内切酶BamHI和NotI YFP-WAVE2质粒。WAVE2点突变,每个赖氨酸与精氨酸/苯丙氨酸/酪氨酸取代,分别WAVE2删除突变体WAVE2ΔWHD (1 - 170 - aa), WAVE2Δ25 - 64 aa, WAVE2Δ78 - 109 aa, WAVE2Δ141 - 169 aa, WAVE2ΔPRD (301 - 419 - aa), WAVE2ΔVCA (421 - 498 - aa), WAVE2Δ81 - 183 aa和组合的删除被引入YFP-WAVE2 / YFP-WAVE2-CFP构造使用Quickchange II XL定点诱变工具包(Stratagene)根据制造商的指示。所有结构都是使用DNA测序验证。的HA-tagged泛素质粒是先前描述53。
细胞培养和转染293 T细胞
人类胚胎肾293 T细胞在DMEM培养,补充了10%的边后卫,2毫米谷酰胺,50μg /毫升青霉素、链霉素和50μg /毫升。磷酸的瞬变转染293 T细胞DNA-calcium共同沉淀,根据制造商的指示(Biontex)。
转染Jurkat T细胞,生成稳定的细胞,流式细胞仪分析
Jurkat E6.1 T细胞转染了要么Lonza Nucleofector™H-10 2 b设备使用厂家的协议,或Bio-Rad electroporator设置:1000μF, 254 v。暂时性的转染T细胞培养被用于这项研究转染后48 h。稳定的克隆来自暂时性的转染细胞的联合药物选择和细胞排序。细胞在新霉素选择暂时性的嵌合蛋白质表达。荧光分析和细胞排序进行使用FACSVantage正欲(生物科学)和FlowJo软件54,55。
PBL隔离和刺激
匿名外周血淋巴细胞(人外周血)是获得健康的捐赠者的血液服务中心示巴医学中心按照批准的指导方针,并从所有捐助者获得知情同意。所有实验协议被以色列国家血液银行批准,并根据批准的指导方针进行从大卫王之星Adom在以色列,以色列红十字会社会国家。人外周血被聚蔗糖密度梯度离心法分离,如前所述56。这些细胞被激活与anti-CD3ε(OKT3 10μg /毫升)和anti-CD28(10μg /毫升)30分钟在冰上。细胞被加热到37°C 10分钟和刺激与反人类免疫球蛋白(50μg /毫升)为2分钟。
核处理
细胞转染和控制人类Hem-1 siRNA或阻止特定或内源性人类使用Lonza WAVE2 Nucleofector™H-10 2 b设备和制造商的协议。
免疫沉淀反应和免疫印迹
T细胞是刺激与anti-CD3ε(OKT3 10μg /毫升)和anti-CD28(10μg /毫升)抗体为2分钟37°C,不及时治疗或裂解紧随其后。人外周血是刺激和细胞溶解,如前所述57。转染293 T细胞转染后细胞溶解48 h在冰冷的NP-40裂解缓冲包含50 mM Tris-HCl pH值7.4,150毫米氯化钠,EDTA 5毫米,5毫米EGTA, 50 mM氟化钠,1% NP-40平板电脑和完整的蛋白酶抑制剂(罗氏应用科学)。蛋白酶体活性被添加MG132 (Sigma-Aldrich)人外周血和T -细胞介质的最终浓度50μM细胞收获前3 h。一夜之间,293 T细胞被孵化0.5μM MG132。免疫沉淀反应和免疫印迹进行如前所述57。蛋白质变性的免疫沉淀反应复合物和re-precipitation WAVE2进行如前所述53。短暂,沉淀复杂resuspended和煮5分钟100年μl变性缓冲区(20毫米Tris-HCl pH值8日50 mM氯化钠,5毫米德勤,1% SDS,原钒酸钠和1毫米),然后变性样本稀释1毫升细胞溶菌作用缓冲区,和第二次免疫沉淀反应进行如上所述。光密度分析使用ImageJ软件与最终结果规范化使用GAPDH或GFP作为全细胞溶解产物和免疫沉淀反应样本加载控制,分别。相对蛋白质丰度或相对数量的共沉淀蛋白质相比,相关的控制。
环己酰亚胺追逐化验
WAVE2 (wt或ΔVCA)蛋白质稳定的存在与否决定蛋白质生物合成抑制剂,放线菌酮(Sigma-Aldrich)和蛋白酶体抑制剂MG132的存在与否。转染293 T细胞与YFP-WAVE2 wt或ΔVCA镀到60毫米盘子。24 h后,新鲜培养基含有环己酰亚胺(0.1毫克/毫升)补充道。在指定的时间间隔(0 h, 2 h, 4 h, 6 h)细胞细胞溶解(如前所述)57。评估的影响MG132 WAVE2周转率,同时细胞治疗50μM MG132和0.1毫克/毫升环己酰亚胺为指定的时间间隔。
共焦显微镜:扩散试验和烦恼的分析
传播分析
传播进行了化验如前所述56,58。简单地说,T细胞(2×106细胞/毫升)被播种在底部有房间的覆盖眼镜(Lab-Tek)预镀有anti-CD3刺激单克隆抗体(10μg /毫升)。细胞被孵化的成像缓冲区(RPMI无酚红含10%胎牛血清和消息灵通的25毫米)在37°C, 5%的二氧化碳,3分钟。细胞2.5%多聚甲醛固定25分钟磷酸盐(PBS),然后与PBS洗了三次。动态荧光和微分干涉对比(DIC)图像收集在蔡司LSM510元共焦显微镜。所有图片收集63 x Plan-Apochromat客观(卡尔蔡司)。
为分析
福斯特共振能量转移(FRET)被donor-sensitized受体荧光测量技术。三套过滤器使用:一个优化了供体荧光(激发,468海里;发射,475−505海里);第二,对于受体荧光(励磁,514海里;发射,530 nm LP);和第三,烦恼(激发,468海里;发射,530 nm LP)。烦恼是纠正,其效率是决定我们所详细描述的15,37,38,58。
LFA-1激活试验
的激活LFA-1整合蛋白是由流式细胞术,如前所述59。简单地说,3×105细胞被刺激与5μg /毫升anti-CD3 37°C,持续15分钟。刺激后,细胞被洗和孵化conformation-sensitive anti-LFA-1 KIM127马伯30分钟的37°C。细胞被洗和孵化Alexa 568 -共轭山羊anti-mouse IgG1冰上30分钟。洗后,分析了细胞FACSARIA三世流式细胞分析仪(生物科学)正欲。
分析WAVE2细胞分布
分析YFP-WAVE2-CFP YFP-WAVE2分布和扩散细胞的直径进行了通过测量荧光强度以及虚拟线从一个点在细胞的边缘,通过中心,细胞的另一边。两个垂直的直线绘制和计算为每个细胞成像。细胞直径标准化为1,结果每个采样组被分成100箱代表他们的相对位置以及突触的直径。对于每一个本,平均强度计算的平均强度和规范化使用每个测量线来确定WAVE2褶皱强度沿直径。所有YFP-WAVE2-CFP和YFP-WAVE2分布分析3分钟后激活和使用ImageJ。PERL和Microsoft Excel被用于数据装箱和统计数据。
统计分析
标准误差计算与Microsoft Excel的使用。学生的t测试是用来评估的意义。在所有情况下,阈值P价值所需的意义是0.05。
额外的信息
本文引用:约瑟夫,N。等。WAVE2中的构象变化复杂的调节其降解细胞激活后。科学。代表。7,44863;doi: 10.1038 / srep44863 (2017)。
出版商的注意:施普林格自然保持中立在发表关于司法主权地图和所属机构。
引用
Insall, r·h·& Machesky l . m .肌动蛋白动力学前沿:从简单的机械到复杂网络。Dev细胞。17,310 - 322 (2009)。
Hahne, P。,Sechi, A., Benesch, S. & Small, J. V. Scar/WAVE is localised at the tips of protruding lamellipodia in living cells.2月列托人。492年,215 - 220 (2001)。
法律,a . L。et al . Lamellipodin和疤痕/波复杂的合作来促进细胞迁移在活的有机体内。J细胞(2013)。
Biyasheva,。,Svitkina, T., Kunda, P., Baum, B. & Borisy, G. Cascade pathway of filopodia formation downstream of SCAR.J细胞科学。117年,837 - 848 (2004)。
Suetsugu, S。,Miki, H. & Takenawa, T. Identification of two human WAVE/SCAR homologues as general actin regulatory molecules which associate with the Arp2/3 complex.物化学Biophys Res Commun。260年,296 - 302 (1999)。
山崎,d . et al . WAVE2需要定向细胞迁移和心血管的发展。自然424年,452 - 456 (2003)。
燕,c . et al . WAVE2缺陷显示不同的角色在胚胎发生和Rac-mediated actin-based能动性。EMBO J。22,3602 - 3612 (2003)。
史蒂芬,a . et al . Sra-1 Nap1 Rac与肌动蛋白组装驾驶板状伪足的形成。EMBO J。23,749 - 759 (2004)。
史蒂芬,a . et al .丝状伪足的形成没有功能,Arp2/3-complexes浪潮。细胞杂志。17,2581 - 2591 (2006)。
Matalon, O。,Reicher, B. & Barda-Saad, M. Wiskott-Aldrich syndrome protein–dynamic regulation of actin homeostasis: from activation through function and signal termination in T lymphocytes.免疫的评论。256年10-29 (2013)。
约瑟夫,N。,Reicher, B. & Barda-Saad, M. The calcium feedback loop and T cell activation: how cytoskeleton networks control intracellular calcium flux.Biochimica et biophysica学报。1838年,557 - 568 (2014)。
Nolz, j . c . et al . WAVE2复杂调节肌动蛋白细胞骨架重组在T细胞活化和CRAC-mediated钙条目。咕咕叫杂志。16,24到34 (2006)。
Zipfel, p . a . et al .角色Abi /波蛋白质复合体在T细胞受体介导增殖和细胞骨架重塑。咕咕叫杂志。1635-46 (2006)。
Nolz, j . c . et al . WAVE2调节高亲和性由招聘vinculin和整合素结合蛋白免疫突触。摩尔细胞生物。27,5986 - 6000 (2007)。
Pauker, m . H。et al。黄蜂家庭Verprolin-Homologous Protein-2 (WAVE2)和Wiskott-Aldrich综合症蛋白质(黄蜂)从事不同的下游信号相互作用的T细胞抗原受体。J临床生物化学(2014)。
Nolz, j . C。,Fernandez-Zapico, M. E. & Billadeau, D. D. TCR/CD28-stimulated actin dynamics are required for NFAT1-mediated transcription of c-rel leading to CD28 response element activation.J Immunol。179年,1104 - 1112 (2007)。
米勒德,t·H。,Sharp, S. J. & Machesky, L. M. Signalling to actin assembly via the WASP (Wiskott-Aldrich syndrome protein)-family proteins and the Arp2/3 complex.生物化学J。380年1卷(2004)。
Stradal, t . e . et al .调节肌动蛋白动力学黄蜂和波家族蛋白质。趋势细胞生物。14,303 - 311 (2004)。
Takenawa t &杨爱瑾,h .黄蜂和波家族蛋白质:关键分子快速重排的皮质肌动蛋白细丝和细胞运动。J细胞科学。114年,1801 - 1809 (2001)。
波拉德,t·d·监管的肌动蛋白丝装配Arp2/3复杂和甲酸精。为Biophys Biomol结构。36,451 - 477 (2007)。
Kanaan, Z。,Qadan, M., Eichenberger, M. R. & Galandiuk, S. The actin-cytoskeleton pathway and its potential role in inflammatory bowel disease-associated human colorectal cancer.基因检测和分子生物标志物。14,347 - 353 (2010)。
梅恩,m . et al . CYFIP2高度丰富的多发性硬化症患者CD4 +细胞和T细胞粘附。欧洲免疫学杂志。34,1217 - 1227 (2004)。
Kotula, l . Abi1关键分子协调肌动蛋白细胞骨架重组PI-3激酶和增长的信号。2月列托人。586年,2790 - 2794 (2012)。
琳,a . et al .净化和无处不在的波复杂的体系结构。《美国国家科学院刊101年,4379 - 4383 (2004)。
罗杰斯,s . L。,Wiedemann, U., Stuurman, N. & Vale, R. D. Molecular requirements for actin-based lamella formation in Drosophila S2 cells.J细胞。162年,1079 - 1088 (2003)。
孔达P。,Craig, G., Dominguez, V. & Baum, B. Abi, Sra1, and Kette control the stability and localization of SCAR/WAVE to regulate the formation of actin-based protrusions.咕咕叫杂志。13,1867 - 1875 (2003)。
Veltman, d . m . & Insall r·h·黄蜂家族蛋白质:他们的进化及其生理意义。细胞杂志。21,2880 - 2893 (2010)。
陈,z . et al .肌动蛋白的结构和控制监管波复杂。自然。468年,533 - 538 (2010)。
伊斯梅尔,a . M。,P一个drick, S. B., Chen, B., Umetani, J. & Rosen, M. K. The WAVE regulatory complex is inhibited.Nat Struct杂志。16,561 - 563 (2009)。
Caracino D。琼斯,C。,Compton, M. & Saxe, C. L. 3rd. The N-terminus of Dictyostelium Scar interacts with Abi and HSPC300 and is essential for proper regulation and function.细胞杂志。18,1609 - 1620 (2007)。
Lebensohn, a . m . &柯式m . w .激活波复杂的同步信号控制肌动蛋白组装。摩尔细胞。36,512 - 524 (2009)。
愣,y . et al . Abelson-interactor-1促进WAVE2膜易位和Abelson-mediated WAVE2所需酪氨酸磷酸化激活。《美国国家科学院刊102年,1098 - 1103 (2005)。
Padrick, s b &罗斯,m . k .信号集成黄蜂家族蛋白质的物理机制。学生物化学为基础。79年,707 - 735 (2010)。
理查,B。et al . Ubiquitylation-dependent负调节黄蜂actin-cytoskeleton动力至关重要。摩尔细胞生物(2012)。
约瑟夫,N。,Reicher, B., David, A., Matalon, O. & Barda-Saad, M. Ubiquitylation-dependent downregulation of Nck regulates its functional activity.2月列托人。588年,3808 - 3815 (2014)。
门多萨,m . c . et al . ERK-MAPK驱动器板状伪足突出通过激活WAVE2监管复杂。摩尔细胞。41,661 - 671 (2011)。
炸,s . et al . Triple-color烦恼分析揭示了构象变化WIP-WASp actin-regulating复杂。科学的信号。7ra60 (2014)。
Pauker, m . H。哈桑,N。纳,E。,Reicher, B. & Barda-Saad, M. Studying the dynamics of SLP-76, Nck, and Vav1 multimolecular complex formation in live human cells with triple-color FRET.科学的信号5rs3 (2012)。
Heasman, s . j . & Ridley a . j .哺乳动物ρgtpase:洞察他们的功能在活的有机体内研究。Nat牧师摩尔细胞杂志。9,690 - 701 (2008)。
小林,k等人p140Sra-1(特别是Rac1-associated蛋白)是一种新型Rac1小GTPase的具体目标。J临床生物化学。273年,291 - 295 (1998)。
克雷斯波,P。,Schuebel, K. E., Ostrom, A. A., Gutkind, J. S. & Bustelo, X. R. Phosphotyrosine-dependent activation of Rac-1 GDP/GTP exchange by the vav proto-oncogene product.自然385年,169 - 172 (1997)。
唐禹哲,c . M。,Pocha, S. M., Bloomberg, G. B. & Cory, G. O. Phosphorylation of WAVE2 by MAP kinases regulates persistent cell migration and polarity.J细胞科学。120年,4144 - 4154 (2007)。
Kim y . et al . WAVE1的磷酸化调节肌动蛋白聚合和树突棘的形态。自然442年,814 - 817 (2006)。
门多萨,m . c . Phosphoregulation波监管复杂和信号的集成。研讨会在细胞和发育生物学24,272 - 279 (2013)。
伊甸园,S。,Rohatgi, R., Podtelejnikov, A. V., Mann, M. & Kirschner, M. W. Mechanism of regulation of WAVE1-induced actin nucleation by Rac1 and Nck.自然418年,790 - 793 (2002)。
Innocenti, m . et al . Abi1至关重要的形成和活化WAVE2信号复杂。Nat细胞生物。6,319 - 327 (2004)。
Derivery E。,Lombard, B., Loew, D. & Gautreau, A. The Wave complex is intrinsically inactive.细胞Motil细胞骨架。66年,777 - 790 (2009)。
金,a S。,Kakalis, L. T., Abdul-Manan, N., Liu, G. A. & Rosen, M. K. Autoinhibition and activation mechanisms of the Wiskott-Aldrich syndrome protein.自然404年,151 - 158 (2000)。
de la葡萄酒,m . a . et al .在制品是Wiskott-Aldrich综合征伴护蛋白质(黄蜂)。《美国国家科学院刊104年,926 - 931 (2007)。
拉梅什N。,Anton, I. M., Hartwig, J. H. & Geha, R. S. WIP, a protein associated with wiskott-aldrich syndrome protein, induces actin polymerization and redistribution in lymphoid cells.《美国国家科学院刊94年,14671 - 14676 (1997)。
公园,h . et al。一个点突变小鼠Hem1造血蛋白1基因揭示了一个重要角色在淋巴细胞增殖和先天免疫。《实验医学杂志》上205年,2899 - 2913 (2008)。
撒迦利亚,d . A。,小提琴,j . D。,Newton, A. C. & Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells.科学296年,913 - 916 (2002)。
Balagopalan, l .等人c-Cbl-mediated LAT-nucleated调节信号复合物。摩尔细胞生物。27,8622 - 8636 (2007)。
Pauker, m . H。理查,B。、油炸、S。,Perl, O. & Barda-Saad, M. Functional cooperation between the proteins Nck and ADAP is fundamental for actin reorganization.摩尔细胞生物。31日,2653 - 2666 (2011)。
Shoham, T。,P一个rameswaran, R., Shav-Tal, Y., Barda-Saad, M. & Zipori, D. The mesenchymal stroma negatively regulates B cell lymphopoiesis through the expression of activin A.纽约科学院上996年,245 - 260 (2003)。
Barda-Saad, m . et al .动态分子交互连接肌动蛋白细胞骨架的T细胞抗原受体。Nat Immunol。6,80 - 89 (2005)。
Braiman,。,B一个rda-Saad, M., Sommers, C. L. & Samelson, L. E. Recruitment and activation of PLCgamma1 in T cells: a new insight into old domains.EMBO J。25,774 - 784 (2006)。
Barda-Saad, m . et al .合作交互slp - 76复杂的肌动蛋白聚合的关键。EMBO J。29日,2315 - 2328 (2010)。
陆,C。,Ferzly, M., Takagi, J. & Springer, T. A. Epitope mapping of antibodies to the C-terminal region of the integrin beta 2 subunit reveals regions that become exposed upon receptor activation.J Immunol。166年,5629 - 5637 (2001)。
确认
作者感谢乌列玉米的技术援助。这项研究是由以色列科学基金会和批准号3 - 10151首席科学家办公室的卫生部、以色列。
作者信息
作者和联系
贡献
M.B.S.和新泽西州设计的研究。新泽西州,G.B., S.F., B.R., O.L. and B.S. performed the experiments. N.J., S.F., B.R., E.N. and M.B.S. analyzed the data. M.B.S. wrote the manuscript.
相应的作者
道德声明
相互竞争的利益
作者声明没有竞争的经济利益。
补充信息
权利和权限
这项工作是基于知识共享署名4.0国际许可证。本文中的图片或其他第三方材料都包含在本文的创作共用许可,除非另有说明在信贷额度;如果材料不包括在Creative Commons许可下,用户需要获得许可证持有人的许可复制的材料。查看本许可证的副本,访问http://creativecommons.org/licenses/by/4.0/
关于这篇文章
引用这篇文章
约瑟夫,N。,Biber, G., Fried, S.et al。WAVE2中的构象变化复杂的调节其降解细胞激活后。Sci代表744863 (2017)。https://doi.org/10.1038/srep44863
收到了:
接受:
发表:
DOI:https://doi.org/10.1038/srep44863
本文引用的
PPP2R1A调节通过NHSL1-containing波壳复杂迁移的持久性
自然通讯(2023)
监管的疤痕/波复杂的迁移细胞:总结我们的理解
生物科学杂志》(2023)
Nance-Horan症状1蛋白质负调节疤痕/ WAVE-Arp2/3活动和抑制板状伪足稳定性和细胞迁移
自然通讯(2021)
针对肌动蛋白成核促进因素黄蜂提供了造血系统恶性肿瘤的治疗方法
自然通讯(2021)