摘要
背景
在老鼠和人类身上进行的研究已经承认肥胖是一种低度炎症性疾病。一些分子机制已被令人信服地证明参与激活炎症过程和改变白色脂肪组织(WAT)的细胞组成。然而,这些改变的总体重要性及其对WAT代谢功能和形态的长期影响尚不清楚。
结果
在这里,我们分析了肥胖受试者、体重稳定的受试者和减肥手术后体重减轻的受试者皮下WAT的转录组特征。为了构建定义肥胖WAT的转录相互作用的综合图谱,应用了一种原始的整合功能基因组学方法来量化注释差异表达基因的相关结构和功能主题之间的关系。这些分析强调了与细胞外基质(ECM)成分(包括整合素家族成员)相关的基因和生物学主题的显著上调,并表明这些元素可能在将局部炎症现象与肥胖受试者WAT代谢功能改变联系起来的相互作用链中发挥主要的中介作用。由转录相互作用分析驱动的组织和细胞调查显示,肥胖WAT中间质纤维化的增加与不同类型炎症细胞的浸润有关,并提示由促炎环境诱导的人类前脂肪细胞的表型改变可能导致ECM成分的过度合成。
结论
这项研究为理解人类WAT的生物学及其与肥胖发展相关的组织退化的病理变化开辟了新的视角。
背景
在小鼠和人类身上进行的调查得出了一种病理生理学范式,承认肥胖是一种低度炎症性疾病。肥胖个体炎症蛋白升高[1]表明炎症可能在肥胖与代谢、肝脏和心血管疾病之间的联系中起决定性作用[2],以及某些癌症[3.].在这些慢性病理中,肥胖似乎是一个公认的危险因素,免疫炎症过程的突出作用已被提出,有助于疾病进展和组织退化[4].然而,尽管大量证据表明肥胖中存在低级炎症成分[5],但人们对炎症变化与肥胖状态的发展、加重、维持和抵抗治疗之间的分子机制仍然知之甚少。
白色脂肪组织(WAT),现在被认为是一个关键的内分泌器官,通过产生生物分子,包括促炎介质,有助于全身炎症,其估计数量不断增长,其合成随着脂肪组织的扩张而改变[6,7].这些分子被输送到血液中,发挥代谢和免疫功能,如广泛研究的脂肪激素瘦素和脂联素所示。它们的功能对于器官间的相互作用、体重内稳态以及可能将脂肪组织与肥胖相关的下游并发症联系起来至关重要[8].构成WAT的细胞类型包括成熟脂肪细胞、特化代谢细胞和各种其他分组在“间质血管分数”(SVF)中的细胞,这些细胞在人类中没有很好的特征。虽然WAT分泌的一些分子,如瘦素和脂联素,是由成熟的脂肪细胞合成的[8],非脂肪SVF,包括浸润的巨噬细胞和其他细胞类型,是炎症相关分子的来源,可能对脂肪组织生物学起局部作用,特别是在扩大的WAT内[9- - - - - -11].肥胖的WAT可能被其他炎症细胞浸润,最近对小鼠的分析也表明,在高脂肪饮食喂养的动物中,T细胞和自然杀伤(NK)细胞亚型被调节[12].脂肪减少可改善炎症状况[11],同时减少浸润的巨噬细胞[13].
在肥胖受试者中,在体重稳定或体重减轻期间对WAT进行大规模转录组分析,主要是对炎症变化的描述,并产生了涉及许多生物学功能的大量调控基因列表[14].然而,这些基因之间的关系,它们参与的细胞过程,和组织结构作为一个整体仍然知之甚少。为了解决这个问题,我们利用了复杂生物相互作用分析的不断进步,这在各个领域都引起了极大的兴趣。研究这种生物相互作用网络的一个重要动机在于,它们能够正式描述构成细胞环境的各种相互作用元素所起的作用,从而有助于进一步的机制研究。特别是,通过关联共表达基因(即具有相似表达谱的基因)构建的基因相互作用网络的研究,有助于描述生物网络的几个关键特性,例如它们连通性的无标度分布[15],它们的层次结构由功能相关的组件模块(即基因、酶、代谢物)构建而成[15]、各种类型的网络集线器[16],或者它们的快速同步性的小世界方面[17].随着相互作用分析的发展,大规模基因表达谱数据的生物学解释逐渐演变为高度标准化和强大的分析框架。可用的探索性工具依赖于策划的基因注释资源和标准化的统计评估技术,以识别高通量基因表达数据集中显著过度代表的生物学主题[18].
本研究的目的是构建肥胖受试者中定义WAT转录组特征的生物相互作用的完整图谱。为此,我们设计了一种原始的分析方法,进一步扩展了传统的基因共表达网络分析,包括评估相关生物学主题之间的转录组相互作用,包括细胞成分、生物过程和调节或代谢途径。这种方法被应用于分析两组微阵列基因表达谱,这些基因表达谱是以前从体重稳定的肥胖受试者的人体WAT中获得的[11,19]及胃手术后体重明显减轻3个月[13].我们的分析揭示了肥胖人群中WAT转录组特征的主要和相关的变化,涉及细胞外基质(ECM)、炎症和脂肪代谢过程。根据基因和功能相互作用分析提出的假设,组织和细胞研究表明,肥胖受试者的皮下脂肪组织以过度的间质纤维化为特征,提示促炎环境诱导的人类前脂肪细胞的表型变化与过度合成ECM成分有关,这可能导致组织退化。
结果
肥胖受试者皮下WAT的转录组特征
对25例体重稳定型肥胖(BMI为40.58±1.58 kg/m)受试者进行了35次cDNA芯片实验2,范围32.6-60.5 kg/m2)和10个健康瘦对照(BMI 23.67±0.48 kg/m)2,范围21.4-26.2 kg/m2)来描述与慢性肥胖相关的皮下WAT的转录组特征。研究人群的总体临床和生化参数见表1,并在相关网站上作为网上补充资料[20.].微阵列显著性分析(SAM)程序分析差异基因表达[21],在至少80%的微阵列实验中恢复信号的cDNA测量中,检测到366个上调和474个下调基因,对应5%的错误发现率(FDR)。这些基因的功能分析鉴定了704个基因(307个上调基因和397个下调基因),并标注了基因本体论(GO)类别[22],以及253个基因(101个上调,152个下调)被京都基因和基因组百科全书(KEGG)分类注释[23].
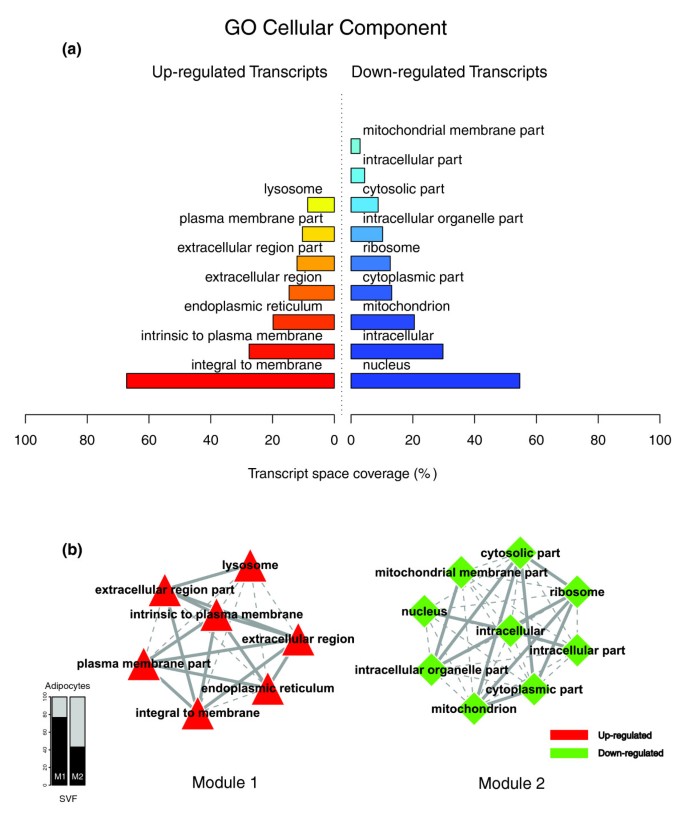
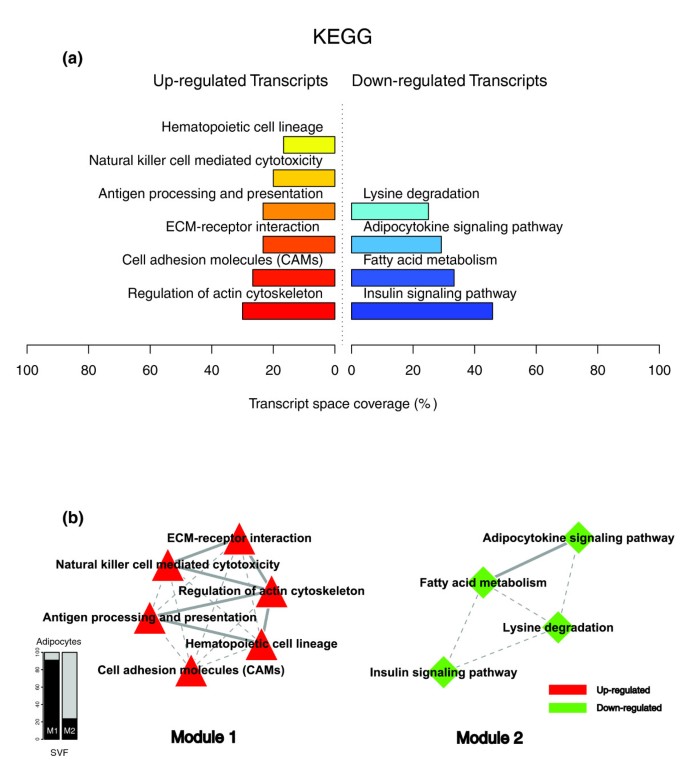
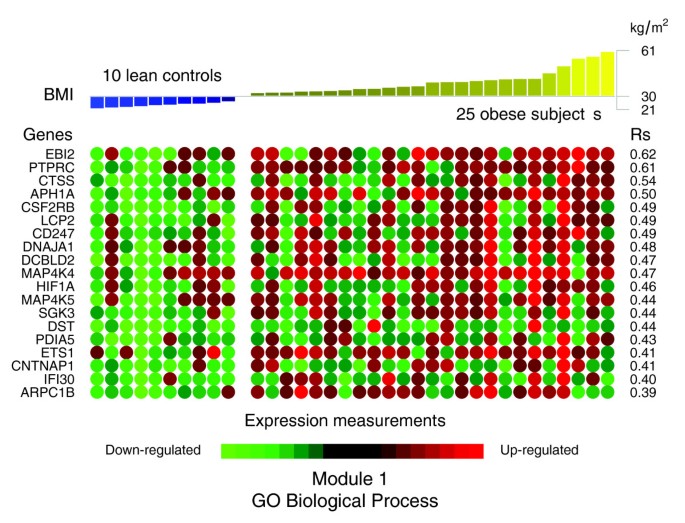
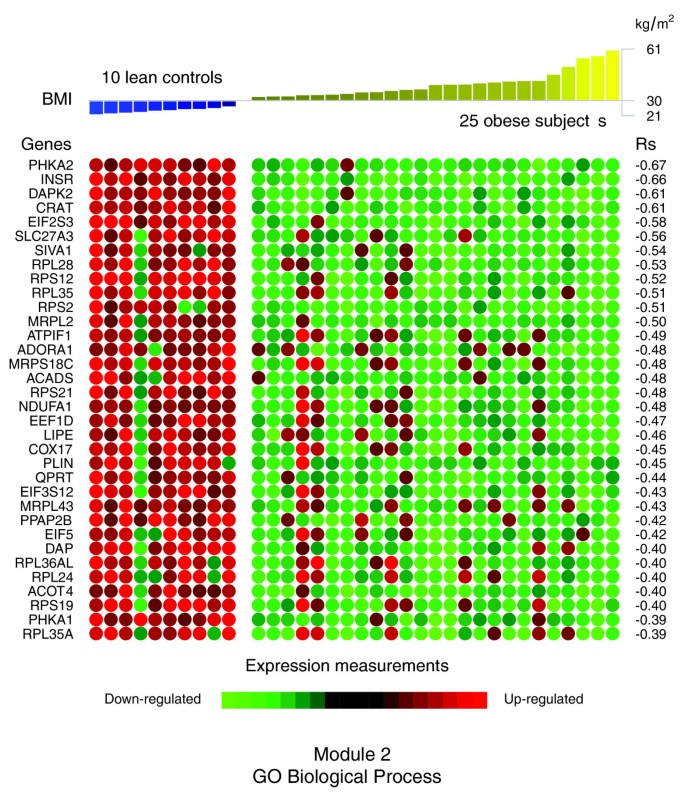
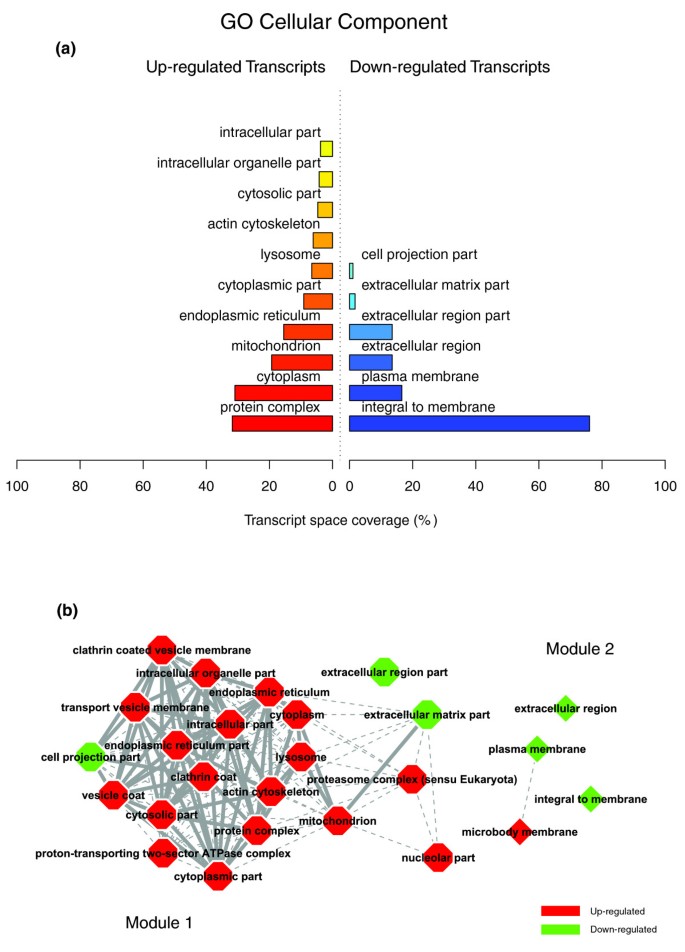
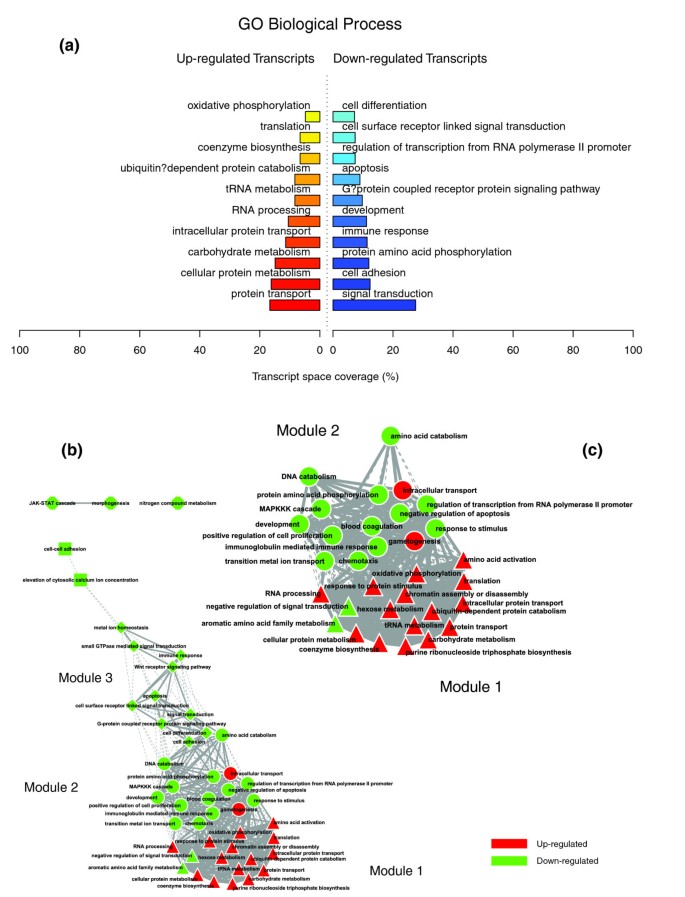
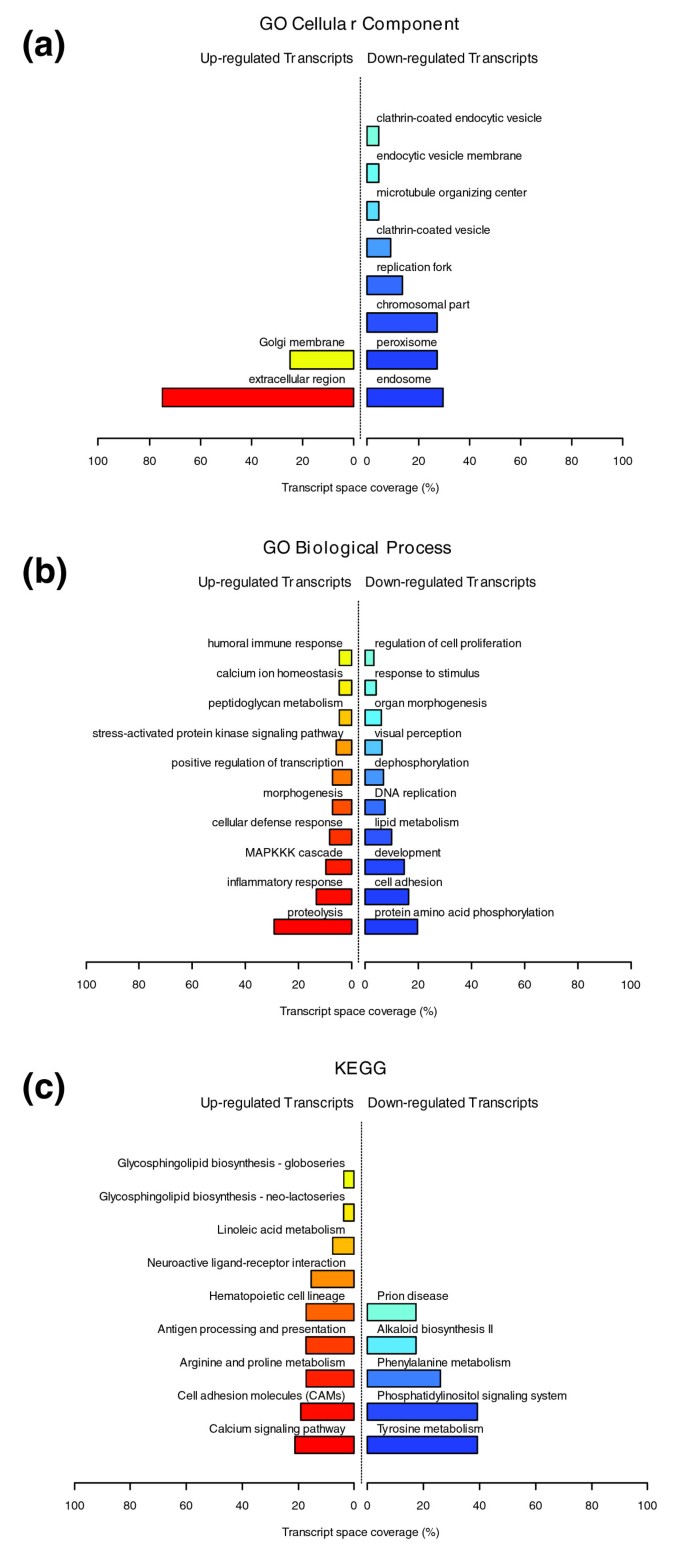
数据1,2而且3说明肥胖受试者皮下WAT转录组特征的生物学主题。相关的生物学主题,与瘦人对照相比,肥胖WAT中差异表达的基因,由GO细胞成分和生物过程本体论以及KEGG中显著过度代表的类别表示。肥胖WAT中上调的基因主要以细胞膜和细胞外空间相关的结构和功能主题标注,下调的基因主要以细胞内区域相关的主题标注。我们依靠我们内部的分析方法,通过汇总它们注释的基因表达谱的相似性来量化这些主题之间的转录组相互作用(详见材料和方法),然后将它们联系起来,构建生物相互作用图。该分析揭示了一种高度分离的转录组相互作用模式,无论用于注释差异表达基因的系统如何(图)1 b,2 b而且3 b).已经确定了两种不同类型的生物相互作用模块(以下称为模块1和模块2),一种关联与细胞膜和细胞外空间相关的结构成分、过程和调控途径(模块1),而另一组与细胞内结构域相关的成分、过程和途径(模块2)。
GO细胞成分类别注释上调基因(图1)形成第一个模块(图1 b(模块1)由主要与膜成分(“膜的整体”、“质膜部分”、“质膜固有”)和细胞外区域(“细胞外区域”、“细胞外区域部分”)相关的主题组成。“溶酶体”和“内质网”是该模块中唯一指定细胞内细胞器的类别。由GO生物过程类别指定的生物过程注释了上调的基因(图2 a, b)与免疫、炎症和应激反应(“免疫球蛋白介导的免疫反应”、“抗菌体液反应”、“免疫反应”、“应激反应”)以及细胞粘附和信号传导过程(“细胞粘附”、“细胞表面受体连接的信号转导”)有关。在肥胖WAT中,KEGG通路注释基因上调(图3)形成了一个强相互作用模块,将与免疫和炎症反应以及细胞粘附和信号机制相关的类别联系起来(图3 b,模块1)。
在肥胖的WAT中,与下调的基因相关的主题被观察到一个非常独特的生物学模式。GO细胞成分结构类别注释这些基因(图1)形成第二个模块(图1 b(模块2),对与细胞内成分相关的主题进行分组,其中包括细胞核、细胞质、核糖体和线粒体(“细胞内”、“细胞核”、“细胞质部分”、“核糖体”、“细胞内细胞器部分”、“细胞质部分”、“细胞内部分”、“线粒体”、“线粒体膜部分”)。GO生物过程分类注释下调基因(图2 a, b)主要与脂质、蛋白质和能量代谢(“脂质代谢”、“脂肪酸代谢”、“蛋白质生物合成”、“前体代谢产物和能量的生成”)以及凋亡机制的调节(“诱导凋亡”)有关。KEGG通路的检查显示了一个相似的相互作用模式,关联着许多关键的脂肪细胞代谢和调节通路(图3 a, b,模块2)
由于肥胖WAT中转录组相互作用的分析显示了一个整齐的分离模式,我们试图确定两种类型相互作用模块的组织分数特异性。利用我们之前的大规模转录组分析[11],我们探索了分离的WAT细胞片段在基因中的特异性富集,这些基因的类别属于两种类型模块之一。该分析表明,与细胞外空间相关的生物主题(模块1)是主要在WAT的SVF中表达的注释基因,而与细胞内区域相关的主题(模块2)注释的基因主要在成熟脂肪细胞中表达(图)1 b,2 b而且3 b).
ECM重塑与炎症相关基因
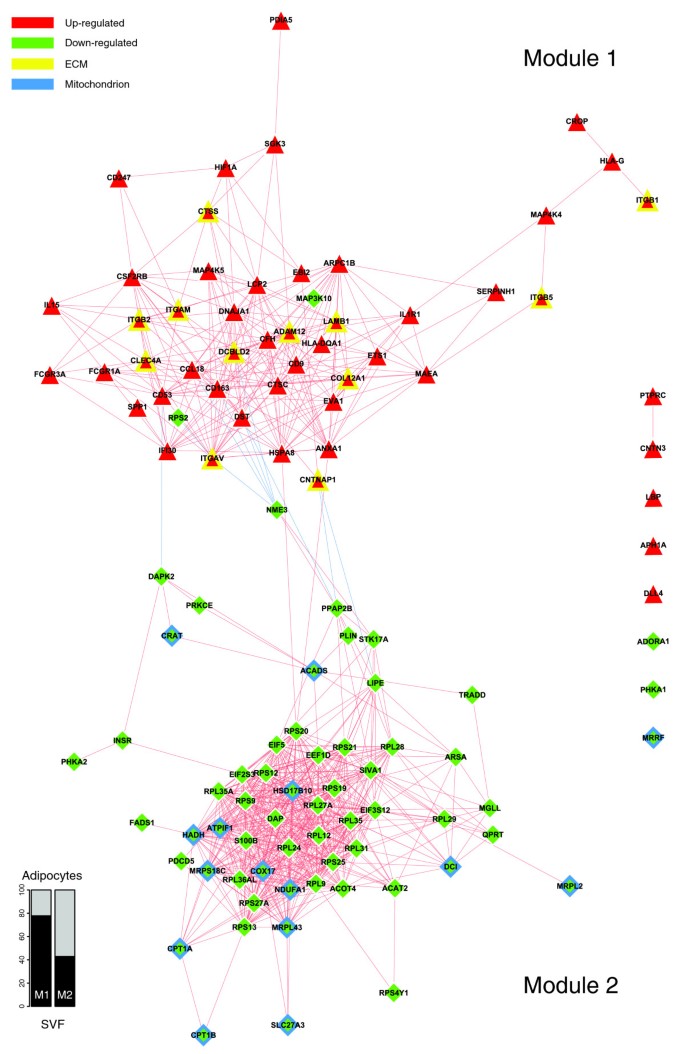
然后,我们检测了单个基因表达谱之间的相似性,以构建所描述的功能相互作用下的共表达网络。在标注GO类别显著过量的基因中,有40个基因(12.5%,其中24个基因上调,16个基因下调)编码ECM的各种结构成分或参与ECM重构和调控的分子(补充数据文件2和补充在线表1)。
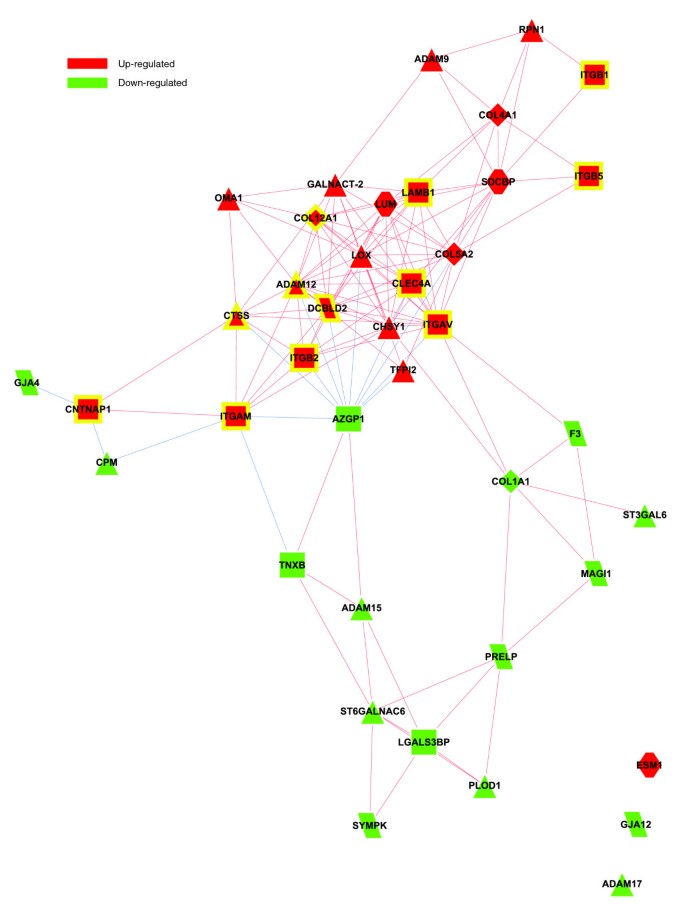
数字4描述了一个双模共表达网络,该网络与肥胖WAT中显着过度代表的GO生物过程类别注释的基因相关(图2).第一个共表达式模块(图4模块1)将与构成第一个功能相互作用模块的过程相关的上调基因分组(图2 b该模块包括ECM所有主要成分的代表,即结构蛋白,如胶原蛋白家族成员,粘附蛋白,如纤维连接蛋白和层粘连蛋白家族成员,糖胺聚糖和蛋白聚糖,特化糖蛋白,如整合素,以及参与ECM重塑的几种酶(附加数据文件2和补充在线表1)。一个分组所有ECM相关基因的子网络,在肥胖WAT中表达差异显著,见图5.
在各种ECM成分中,有几个编码整合素家族成员的基因被发现在肥胖WAT中显著诱导并共表达,在第一个共表达模块中占据中心位置(图4本模块包括整合素α V (ITGAV),称为vitronectin受体,而alpha M (ITGAM),以及整合素β 1 (ITGB1;也称为纤维连接蛋白受体或β多肽),β 2 (ITGB2)及beta 3 (ITGB5).这些整合素与ECM的其他关键成分表现出强烈的共表达(图4而且5;附加数据文件2和补充在线表1),如胶原蛋白家族成员,包括主要的IV型α胶原蛋白基膜链(COL4A1),以及纤维相关的胶原蛋白(COL5A2而且COL12A1).它们也与糖胺聚糖和蛋白聚糖家族的成员(syndecan结合蛋白(SDCBP), lumican (亮度)),已知在炎症现象的发生,以及淋巴细胞的聚集、滚动和随后的外渗中起重要作用[24],层粘连蛋白β 1 (LAMB1),并与几种蛋白酶和其他酶参与ECM重塑和细胞-细胞或细胞-基质相互作用。一些编码这些酶的基因在肥胖的WAT中被显著诱导。其中金属蛋白酶结构域12 (ADAM12)和领域9 (ADAM9),它们属于分解蛋白家族,可调节富含纤维连接蛋白的ECM与肌动蛋白细胞骨架之间的通讯,也参与脂肪细胞前分化的早期阶段[25].赖氨酸氧化酶(液态氧)参与交联细胞外基质蛋白,而硫酸软骨素GalNAcT-2 (GALNACT-2)在糖胺聚糖和蛋白聚糖家族的一些成员的合成中起核心作用。其他ECM相关基因在肥胖人群WAT中显著低表达,如金属肽酶结构域17 (ADAM17)和域15 (ADAM15),或I型胶原蛋白α 1 (COL1A1).
有趣的是,第一个共表达模块(图4(模块1)不仅对与ECM成分相关的基因进行了分组,还对肥胖受试者中可能浸润WAT的免疫细胞分泌的细胞因子和表面标记进行了编码。这些基因中有许多与整合素家族成员显著共表达,并且已知参与免疫循环细胞(如单核细胞、淋巴细胞或中性粒细胞)的募集和激活。其中包括巨噬细胞激活替代途径的标记物,如CC趋化因子配体18 (CCL18)和巨噬细胞清道夫受体(CD163),与整合素α V表现出强共表达(ITGAV)和巨噬细胞受体1 (Mac-1)整合素α M (ITGAM)及beta 2 (ITGB2).现有数据表明,交替激活的巨噬细胞合成CCL18是由Th2细胞因子,整合素β 2 (ITGB2)和清道夫受体(CD163) [26].众所周知,CCL18还参与CD4+和CD8+ T细胞的招募和激活,更值得注意的是,它通过参与将激活的巨噬细胞与成纤维细胞连接起来的正反馈循环,被认为在延续纤维化过程中发挥核心作用[26].此外,Mac-1复合物的表达在糖尿病、超重和组织缺氧等情况下也会增加[27,28],在循环单核细胞和中性粒细胞的募集、粘附和激活以及补体包被颗粒的吞噬中起重要作用[28,29].与Mac-1共表达的缺氧诱导因子1 (HIF1A)是一种在细胞缺氧反应中起重要作用的转录因子。HIF1A还参与巨噬细胞迁移的调节,并调节炎症组织缺氧区域暴露于低氧张力的免疫细胞的代谢[30.].
同一类促炎分子还属于白细胞介素(IL)1受体I型(IL1R1),可调节多种细胞因子诱导的免疫和炎症反应,而il - 15 (IL15),调节T细胞和自然杀伤细胞的活化和增殖[31,32].两者均与Mac-1复合物和c型凝集素结构域家族4成员A (CLEC4A),已知其在介导免疫和炎症反应,特别是在中性粒细胞中发挥重要作用[33].
一些分子与IL1R1表现出强烈的共表达,其中包括CD53 (CD53)及CD9 (CD9)标记,已知与整合素和膜联蛋白I (ANXA1),被认为具有潜在的抗炎活性,它们都通过调节先天免疫发挥重要的体内平衡作用[34- - - - - -36].在同一光谱中,整合素α V (ITGAV)显示出与CD163强共表达,CD163是一种众所周知的巨噬细胞特异性标记物,介导包括IL10在内的抗炎途径,其合成被证明与局部和全身炎症现象密切相关[37,38].此外,热休克蛋白8 (HSPA8),是人类胚胎干细胞表面表达的未分化细胞状态的表面标记[39],在有害组织损伤(如出血或局部缺血)后的修复过程中发挥重要作用[40],并与整合素α V、膜联蛋白I等ECM组分显著共表达。
在共表达网络模块1中聚集的基因面板(图2)4)在肥胖和非肥胖受试者WAT中的表达水平与肥胖和非肥胖受试者BMI呈显著正相关(图6和表2).在与BMI关系最密切的基因中,组织蛋白酶S (CTSS),参与降解细胞外基质的若干成分[19],淋巴细胞胞浆蛋白2 (LCP2)及CD247 (CD247),两者都与T细胞的发育和活化有关,以及缺氧诱导因子1 (HIF1A).
脂肪代谢相关基因
第二个共表达式模块(图4,模块2)将几个编码脂肪分解途径相关蛋白质的基因分组,这些蛋白质在肥胖的WAT中下调,包括激素敏感的脂肪酶(时间), perilipin (PLIN)和单甘油酯脂肪酶(MGLL).胰岛素受体(INSR)和抗脂解腺苷A1受体(ADORA1),以及一些编码线粒体酶的基因,包括NADH脱氢酶1 α亚复合物(NDUFA1)和细胞色素c氧化酶组装同源物(COX17).的NDUFA1该基因编码呼吸链复合体I的一个组成部分,将电子从NADH转移到泛醌,而COX17可能在线粒体末端复合体中有助于细胞色素c氧化酶的功能,其催化电子从还原的细胞色素c转移到氧气。模块2的几个基因(图4;在线补充数据[20.)参与多种脂肪酸的合成、转运和氧化。其中,已知一些基因编码干预初始步骤的蛋白质(酰基辅酶A脱氢酶(阿德莱德大学),以及加工(3-羟酰辅酶a脱氢酶II型(HADH), 3,2反式烯酰辅酶a异构酶(DC1)和终止(酰基辅酶a硫酯酶4 (ACOT4))的线粒体脂肪酸β氧化途径。长链脂肪酸的β氧化通常涉及肉碱棕榈酰转移酶I和肉碱棕榈酰转移酶II与肉碱-酰基肉碱转位酶的顺序作用。肉碱/胆碱乙酰转移酶家族两个成员的表达水平(CPT1A而且CPT1B)参与跨越线粒体内膜这一速率限制步骤的蛋白和线粒体的蛋白均减少板条箱该基因催化酰基从酰基辅酶a硫酯向肉碱的可逆转移,并调节线粒体区室中酰基辅酶a /辅酶a的比例。有趣的是,模块2还收集了几个参与诱导凋亡的基因,如死亡相关蛋白(衣冠楚楚的),死亡相关蛋白激酶2 (DAPK2),丝氨酸/苏氨酸激酶17a (STK17A),是DAP激酶相关细胞凋亡诱导蛋白激酶家族的成员,也是细胞凋亡诱导因子(SIVA1), tnfrsf1a通过死亡域关联(TRADD)和程序性细胞死亡5 (PDCD5),其中一些与上述线粒体酶强共表达。蛋白激酶C (PRKCE),参与几种细胞内信号通路,特别是凋亡,与DAPK2,板条箱,阿德莱德大学在本模块中。其他下调的基因编码的细胞质或线粒体核糖体亚单位的成分,这是核糖体蛋白质的一部分,以及一些真核翻译伸长因子涉及蛋白质合成。
与共表达模块1组成的基因相比,组成模块2的大多数基因的表达谱与BMI呈显著负相关(图2)7和表2).其中,一些最强的负相关被观察到的胰岛素受体(INSR)、脂肪细胞脂解途径的分子(时间,PLIN)、部分线粒体成分(板条箱,阿德莱德大学,NDUFA1,COX17),以及一些凋亡途径的成员(DAPK2,SIVA1,衣冠楚楚的).此外,许多细胞质或线粒体核糖体亚基成分的表达谱与BMI呈显著负相关(RPL28,RPS12,RPL35,RPS2,RPS21等)。
因为在功能水平上,这些过程与免疫、炎症和应激反应以及细胞粘附和信号传导有关(图2 b而且3 b,模块1),表现出与代谢功能相反的调节模式(图2 b而且3 b(模块2),我们在基因水平上研究了可能连接这两个功能模块的链接,并寻找哪些基因可以通过连接ECM和细胞内通路发挥中介作用。如图所示4,部分ECM相关基因与一组炎症基因共表达(模块1),而与代谢模块相关基因呈显著的反向表达(模块2)。其中整合素α V (ITGAV), CD163和CCL18,两种巨噬细胞激活替代途径的标志物,热休克蛋白8 (HSPA8),以及接触蛋白相关蛋白1 (CNTNAP1),参与细胞内信号通路的激活,与几个编码脂解途径酶的基因密切相关,包括激素敏感脂肪酶(时间)和perilipin (PLIN)、2B型磷酸酶(PAP2B),是脂质磷酸酶家族的成员,与凋亡相关的基因,如死亡相关蛋白激酶2 (DAPK2)和非转移性细胞3蛋白(NME3).
减肥手术后3个月WAT转录组特征的功能变化
我们之前已经证明,体重减轻与炎症状况的改善有关,同时与WAT中巨噬细胞浸润的消退有关[11].为了更好地描述脂肪质量变化、局部炎症现象和ECM重塑之间的关系,我们进一步检查了减肥手术导致显著体重减轻后肥胖WAT转录组特征的功能特征。在病态肥胖(BMI 47.65±4.4 kg/m)受试者的皮下WAT活检中进行了10个cDNA微阵列实验2,范围42.5-57 kg/m2)、腹腔镜胃分流术前及术后三个月[41].这些受试者的详细临床和生化参数已在其他地方介绍[13],并作为网上补充资料提供[20.].应用SAM程序分析差异基因表达[21],在cDNA测量上进行,在至少80%的微阵列实验中恢复信号,检测到1744个上调和1627个下调基因,对应5%的FDR。对这些基因进行功能分析,发现有2687个基因(1390个上调和1297个下调)标注了GO类别,868个基因(450个上调和418个下调)标注了KEGG类别。
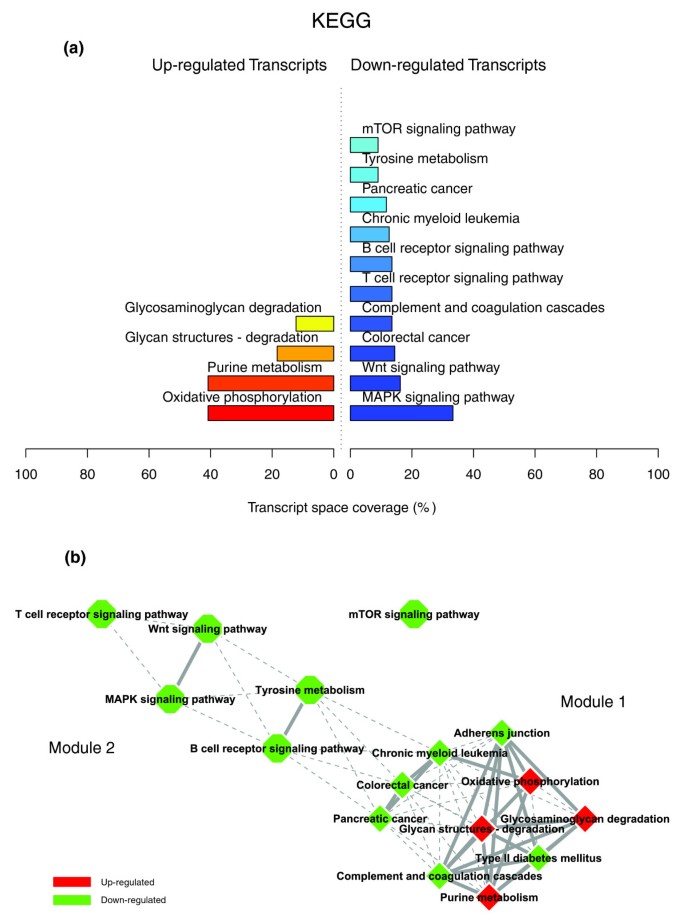
数据8,9而且10说明了胃手术后3个月肥胖WAT转录组特征的生物学主题,由GO细胞成分中显著过度代表的类别所示(图8)和GO生物过程本体(图9),以及来自KEGG(图10).这一分析表明,肥胖WAT的功能特征与体重减轻有关。事实上,胃分流术后WAT中上调的大部分基因与细胞内结构域和细胞器(“蛋白质复合物”、“细胞质”、“线粒体”、“内质网”、“溶酶体”、“肌动蛋白骨架”、“细胞质部分”)相关的结构主题(GO细胞成分)有关,而下调的基因(图8)主要与细胞膜和细胞外空间相关的特定主题(“膜的组成部分”,“质膜”,“细胞外区域”,“细胞外基质部分”)。与WAT上调基因相关的细胞过程(GO生物过程)(图9)主要与碳水化合物和蛋白质代谢有关,包括泛素依赖的蛋白质分解代谢(“细胞蛋白质代谢”、“碳水化合物代谢”、“泛素依赖的蛋白质分解代谢”)、能量代谢(“氧化磷酸化”)以及转录、翻译和转运过程(“RNA加工”、“tRNA代谢”、“翻译”、“蛋白质转运”)。相比之下,下调的基因主要与细胞粘附和信号通路相关的过程相关(图9),特别是通过g蛋白偶联受体蛋白(“信号转导”,“细胞粘附”,“g蛋白偶联受体蛋白信号通路”,“细胞表面受体连接信号转导”),以及免疫反应和凋亡(“免疫反应”,“凋亡”)。最后,涉及WAT基因的KEGG通路在体重减轻后上调(图10)与能量和核苷酸代谢有关(“氧化磷酸化”,“嘌呤代谢”),以及与一些关键ECM成分的降解有关,即糖胺聚糖(“聚糖结构-降解”,“糖胺聚糖降解”)。根据GO注释,下调的KEGG通路主要与信号转导过程以及免疫和炎症反应相关(图10),包括补体和凝血级联与T和B细胞受体信号通路(“MAPK信号通路”、“Wnt信号通路”、“补体和凝血级联”、“T细胞受体信号通路”、“B细胞受体信号通路”、“mTOR信号通路”等)。
对与各种结构、过程或调控途径相关的生物主题的转录组相互作用进行量化,确定了与先前条件下观察到的非常不同的相互作用模式。数据8,9而且10说明在一个强相互连接的网络中,与上调和下调过程相关的非常密集的交互模式。数字9 c描述了该条件下最具代表性的两个功能交互模块(GO生物过程);这说明了强烈的相互作用,将组成第一个功能模块的上调主题(主要与碳水化合物、能量和蛋白质代谢有关)与组成第二个相互作用模块的下调主题(主要与免疫和炎症反应、信号转导、细胞增殖和凋亡过程有关)联系起来。
这些功能模块下的共表达网络(见在线补充数据[20.])证实了ECM与炎症和代谢过程相关基因的密集相互作用模式。许多ECM成分的表达模式与前一种情况相反,一些是由体重减轻引起的,而另一些是下调的(在线补充表2 [20.])。其中,一些结构蛋白编码基因在减肥后明显下调(在线补充表2 [20.]),包括整合素家族的成员,如整合素α V (ITGAV),整合素β 4 (ITGB4)和整合素β 6 (ITGB6).参与糖胺聚糖和蛋白聚糖降解的酶在体重减轻后也显著上调,相关KEGG通路的诱导可见(在线补充数据[20.])。此外,一些参与其他ECM组分降解的金属肽酶也同样被诱导,如基质金属肽酶2 (MMP2),与金属蛋白酶家族组织抑制剂中的几种金属肽酶抑制剂(TIMP1,TIMP2).最后,大量与线粒体酶相关的基因参与氧化磷酸化途径(图10;在线补充数据[20.])在体重减轻后显著上调,包括编码NADH脱氢酶(NDUFA3,NDUFA5,NDUFA6,NDUFA9,NDUFA11,NDUFA4L2,NDUFB7,NDUFB11,NDUFS2,NDUFS8)、ATP合酶(ATP5G1,ATP5G2,ATP5H,ATP5I,ATP5O,ATP6AP1)和细胞色素c-1 (CYC1).
肥胖受试者皮下WAT的形态学特征
对功能和基因共表达网络的分析表明,ECM重塑、炎症变化和脂肪细胞代谢失调与肥胖程度之间存在联系。在慢性低级别炎症疾病中,长期的炎症刺激导致组织损伤,可导致ECM元素的过度合成及其进行性沉积。对功能相互作用网络的检查表明,类似的现象可能发生在肥胖的WAT中,涉及炎症细胞的存在,以及成纤维细胞衍生的前脂肪细胞在产生ECM成分方面的可能贡献。因此,我们结合一系列光学、电子显微镜和免疫组织化学分析来检查肥胖WAT的细胞外间隙,并量化体重稳定条件下和体重减轻后的瘦和肥胖受试者WAT的纤维化。
重度肥胖者脂肪组织中的巨噬细胞、淋巴细胞和NK细胞
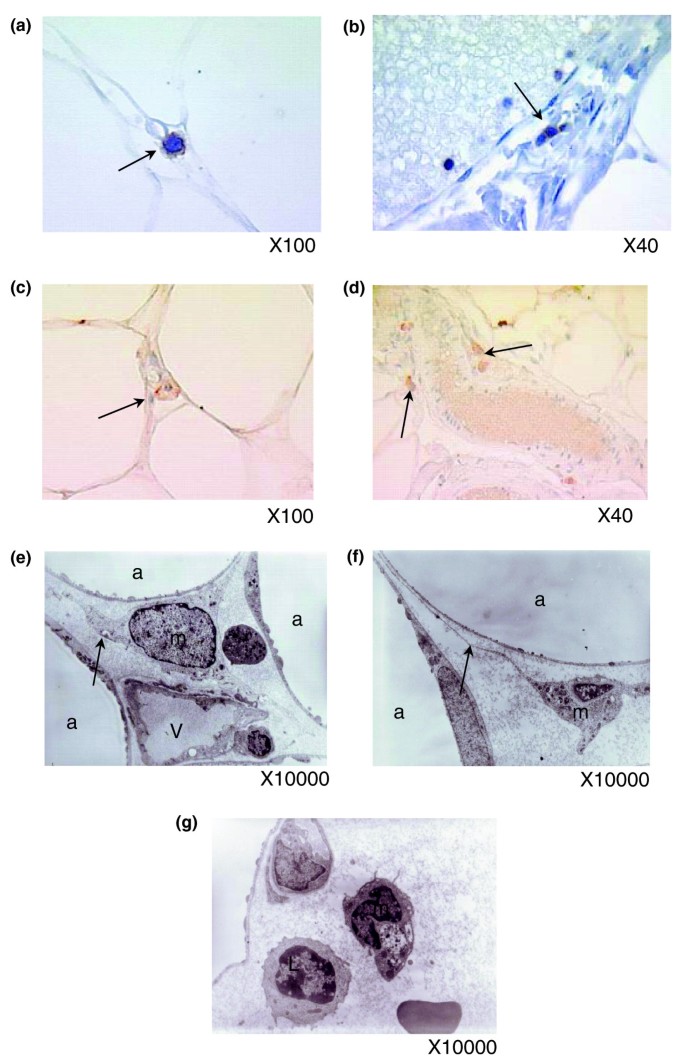
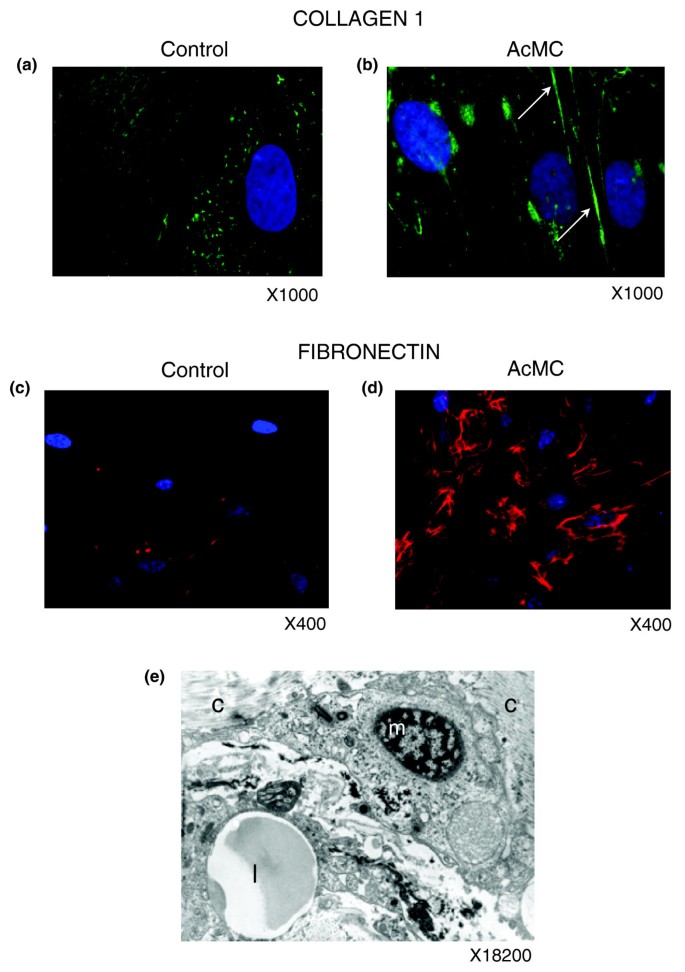
KEGG注释功能分析显示,NK细胞介导的细胞毒性通路在肥胖WAT中表达上调的基因中显著富集(图3),而T细胞受体信号通路富集的基因在胃分流术后下调(图10).使用CD3和NKp46抗体对T淋巴细胞和NK细胞进行免疫染色,证实这些细胞存在于病态肥胖受试者的脂肪组织中(图11模拟),尽管丰度较低。电镜下可见脂肪细胞附近和血管壁附近的巨噬细胞和淋巴细胞(图11 eg).
肥胖脂肪组织纤维化增加
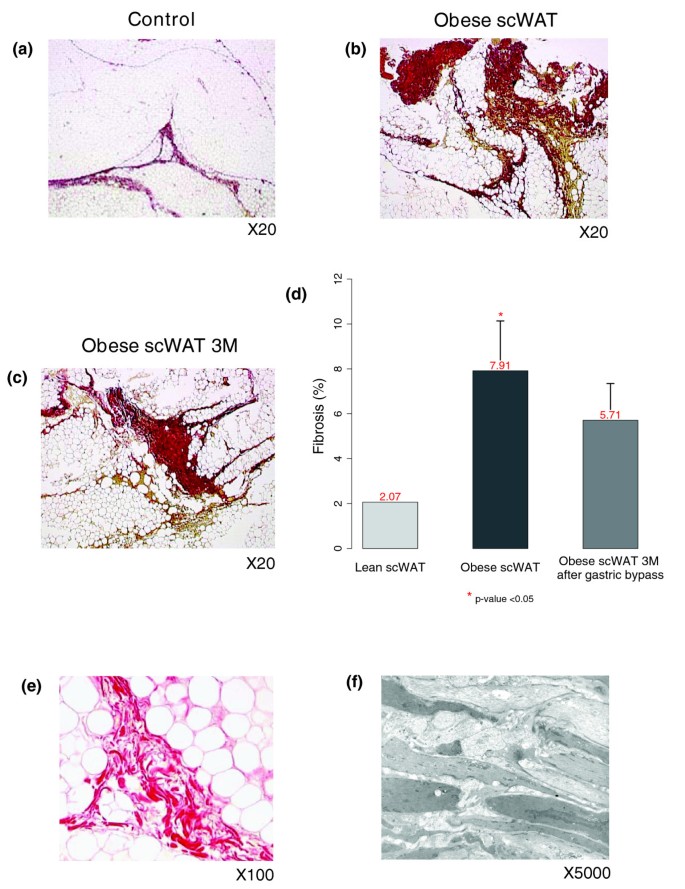
我们量化了10名病态肥胖受试者在接受减肥手术前和术后3个月的WAT纤维化,以及10名年龄匹配的瘦对照组(图12个模拟).与瘦对照组相比,肥胖受试者皮下WAT纤维化百分比显著增加(6.29%±2 vs 2.19%±0.25,p值< 0.05;数字12 a, b, d),且在减肥手术后3个月仍保持较高水平(5.7%±1.63;数字12个罪犯).肥胖受试者的WAT纤维化带检查显示,脂肪细胞小叶之间分布着旋旋的苦天狼星染色纤维区(图12 e).类似纤维化区域的电子显微镜研究显示细胞外基质特征的无细胞无定形结构层(图12 f).此外,我们对同一肥胖受试者的肝纤维化进行评分,并分析其与WAT中纤维化量的关系。该分析表明,肝纤维化评分最高(纤维化= 2)的患者也比肝纤维化评分较低(纤维化= 0或1)的患者有更多的WAT纤维化(p值< 0.05)。
巨噬细胞分泌物促进前脂肪细胞ECM成分的表达和分泌
进一步进行细胞研究,以检查前脂肪细胞在受到炎症刺激时产生具有纤维化特性的ECM成分和细胞因子的可能性。为了解决这个问题,我们使用了我们之前描述的细胞培养系统,其中人类前脂肪细胞用活化巨噬细胞(AcMC)条件培养基培养[42].对这些细胞进行转录组分析,以确定这种促炎刺激诱导的基因和功能。在AcMC培养基处理的前脂肪细胞中,有超过5200个基因显著上调(附加数据文件1)。使用GO或KEGG标注的功能分析显示,大多数过表达基因参与炎症、免疫和应激反应,以及细胞粘附相关过程,如图所示13.对这些功能分组的基因的检查从所有类别的ECM成分中检索到代表,如结构蛋白,包括胶原蛋白家族成员和胶原蛋白形成的几种前体,粘附蛋白,如纤维连接蛋白1及其受体,以及层粘连蛋白家族成员,糖胺聚糖和蛋白聚糖(lumican (亮度))和特化糖蛋白,包括几种整合素。ECM重塑酶(参与胶原合成和降解的金属蛋白酶和羟化酶),以及基质金属蛋白酶的天然抑制剂TIMP1也被诱导(在线补充表3 [20.])。与瘦对照相比,在肥胖WAT中显示显著差异表达的ecm相关基因中,71.4%在用AcMC培养基培养的前脂肪细胞中也有显著表达变化(附加数据文件2)。60%的这些ecm相关基因在两者中表现出相似的表达模式变化在活的有机体内而且在体外条件下,比例显著增大(p值< 0.05)高于在人类和细胞研究中表现出显著差异表达的基因之间共享相似表达模式的总体百分比。
此外,我们还在细胞培养研究中观察到一组炎症细胞因子,包括白介素及其诱导剂(干扰素家族成员)、急性期蛋白(SAA)和趋化因子(CCL5)及其受体上调(在线补充表3 [20.])。其中,我们注意到IL13RA1的诱导,IL13RA1是IL13受体复合物的一个亚单位,据报道在IL13的内化中起作用,是一种主要的促纤维化蛋白,已知可诱导转化生长因子β,还有IL4受体的诱导,它结合IL13和IL4,是另一种公认的促纤维化细胞因子。确实有研究表明,IL4可能参与了纤维化前事件的调节[43].CCL5/rantes,已知刺激肝纤维化[43,44],也被诱导。此外,在这组实验中,对编码转化生长因子β的基因的实时定量PCR (RTqPCR)分析显示,经acmc条件培养基处理的前脂肪细胞增加了2.5倍(p值< 0.05)。
为了发现这种基因表达模式的变化是否与ECM蛋白分泌的增加有关,我们使用相同的细胞培养系统,并在acmc条件下的培养基中培养前脂肪细胞10天后,使用抗胶原蛋白I型(ECM中最丰富的成分)和抗纤连蛋白抗体进行免疫荧光实验。I型胶原蛋白和纤维连接蛋白在acmc条件下过度表达,并组织成纤维网络结构(图14模拟).ECM区域的电子显微镜显示巨噬细胞与I型胶原纤维密切接触(图14 e).
讨论
肥胖WAT的转录组特征说明了ECM成分在连接炎症和脂肪代谢异常中的核心作用
在本研究中,我们依赖于一种原始策略,将功能基因组分析和基因共表达网络分析这两种传统框架结合成一种集成的分析方法。这一策略使我们能够评估相关功能主题之间的转录组相互作用,并量化它们在肥胖WAT的全球转录组谱中的总体意义。基因表达数据的生物信息学分析确定了相关的生物学主题,包括结构成分、细胞过程和调控途径,显著富集在上调或下调的基因中,并将其编译成说明肥胖WAT转录组特征的相互作用的综合图谱(图15).与传统的功能分析或转录组网络分析方法相比,这种系统方法具有显著的优势,因为它允许从相关基因的表达相似性(即共表达)中提取有关生物主题的转录组接近性的可靠信息。分析生物学主题之间转录组相互作用的优势在“减肥”条件下得到了特别好的说明,其中基因共表达网络(在线补充数据[20.])是非常密集的,并不能立即全面地了解脂肪组织中相互作用的基因和相关功能。
我们对肥胖WAT转录组特征的全面探索性分析强调了炎症和免疫过程占据的中心位置,并显示了与分组在同一模块(模块1)中的ECM成分的强相互作用。对该模块更精确的检查还表明,除了巨噬细胞外,还涉及几种炎症细胞类型,其中包括T淋巴细胞和NK细胞。该分析还强调了肥胖WAT中分离的转录组相互作用模式,区分了两个相互作用模块:一个(模块1)分组炎症和ECM相关过程,另一个(模块2)关联脂肪代谢功能和与凋亡和蛋白质合成过程相关的其他主题。这种分离的相互作用模式也被观察到,组成模块1的基因中有相当一部分与BMI呈正相关,而组成模块2的大部分基因与肥胖程度呈负相关。
尽管存在分离的相互作用模式,但基于两个功能相互作用模块的基因共表达网络的分析确定了几个候选基因在炎症现象和ECM重塑与脂肪细胞生物学之间的关系中具有中介作用。整合素家族中编码ECM成分的上调基因与编码脂质和能量代谢相关酶的下调基因呈显著的反向表达模式。众所周知,ECM调节传递到整合素复合物,调节细胞骨架动力学和细胞内通路。这些现象必须在脂肪细胞生物学的背景下更好地理解,特别是连接ECM变化和整合素介导的信号与细胞凋亡、蛋白质合成和线粒体中脂肪酸氧化等过程的联系。在人类WAT中,后一种过程最近似乎比最初认为的更重要。45].
有趣的是,手术诱导的体重减轻与WAT调节和相互作用模式的重大转变有关,这逆转了肥胖WAT的功能基因组谱,并显著增加了上调的脂肪代谢过程与下调的炎症和免疫反应之间的相互作用强度。与炎症介质编码基因下调相关的是,大量与氧化磷酸化和其他各种线粒体酶相关的基因,以及与糖胺聚糖和蛋白聚糖降解相关的酶的编码基因,在体重减轻后表达显著增加。
人体脂肪组织中的炎症细胞
我们的分析策略提出了几个病理生理学假设,提出ECM成分的过度合成在肥胖WAT的异常特征中起着机械性作用。模块1中的功能主题在SVF中主要表达的基因中富集,这表明几种免疫细胞类型可能提供局部慢性炎症刺激。其中,我们证实了人WAT中巨噬细胞的显著存在[46].在肥胖小鼠中,观察到WAT巨噬细胞的激活状态从M2“交替激活”状态转变为M1“促炎状态”,以响应饮食诱导的肥胖[47].人类WAT中巨噬细胞的确切表型仍然未知。我们的分析显示,已知由Th2细胞因子诱导的几个基因的上调,如CCL18而且CD163,提示m2极化巨噬细胞浸润严重肥胖受试者的WAT。这可能与M1巨噬细胞的存在有关,因为编码促炎因子的基因也被诱导。
除巨噬细胞外,其他几种淋巴样细胞也可合成细胞因子家族,促进局部炎症状态,从而影响纤维化反应。模块1的几个基因,已知是淋巴细胞和NK细胞激活的标记物,与ECM成分强共表达。我们观察到肥胖WAT中存在NK和T淋巴细胞,尽管它们似乎不如巨噬细胞丰富。NK细胞和自然杀伤T细胞(NKT),以及T淋巴细胞的亚类,此前已在肥胖WAT动物模型中被描述过。淋巴细胞计数与内脏和皮下脂肪垫重量的关系也被注意到[48].迄今为止,只有少数比较研究描述了肥胖受试者WAT中的淋巴样积聚[49].
人体脂肪组织间质纤维化
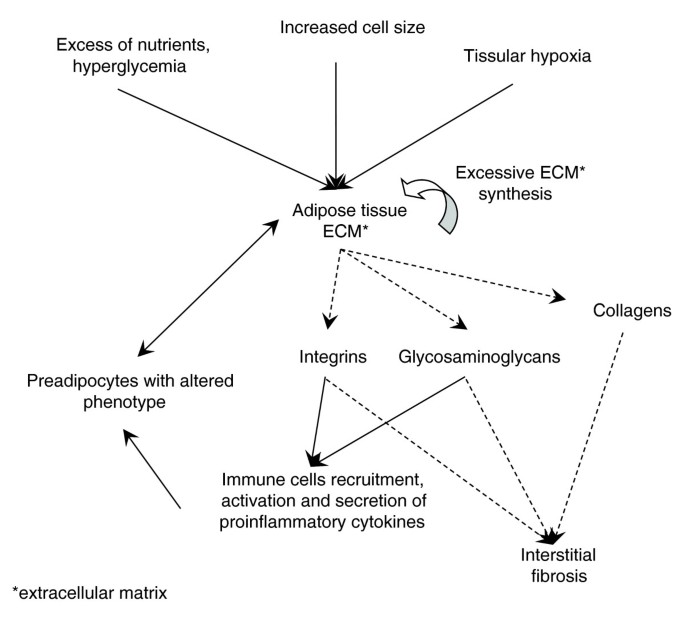
在几种常见疾病中研究的纤维化[50- - - - - -54],通常由大量ECM蛋白的数量和组成的修饰来定义,包括胶原类型(尤其是纤原性胶原I和III)和糖蛋白(层粘连蛋白、纤维连接蛋白、弹性蛋白)。随着时间的推移,组织损伤的持续可导致ECM成分的过度产生,逐渐积累,最终可能导致组织功能受损。我们的功能分析和细胞研究都表明,这种病理过程可能发生在肥胖WAT中。组织学检查证实,肥胖受试者的皮下WAT间质纤维化显著增加,先前在肥胖儿童中进行的更有限的评估表明[55].纤维性物质位于脂肪细胞周围,在电子显微镜下形成非晶区,可能表明组织恶化。在减肥手术后3个月,对同一受试者的纤维化定量研究发现,尽管与炎症和免疫反应相关的基因显著下调,与ECM重塑相关的基因表达广泛变化,但间质纤维化没有明显减少。一种可能是WAT间质纤维化具有一定程度的不可逆性,与先前在肝脏中描述的过程一致[56].肝纤维化的不可逆性受到了挑战,因为一些作者假设了一个潜在的解决步骤,涉及基质金属蛋白酶家族中的ECM降解酶的激活[57].共表达网络分析显示基质金属蛋白酶和金属蛋白酶家族组织抑制剂相关基因同时上调(在线补充表2 [20.]),这可以解释ECM组件减重后降解率降低的原因。另一种可能是,纤维化可能需要三个多月才能解决,滞后于减肥手术后观察到的WAT炎症状态的改善。值得注意的是,一些调节纤维化的机制与炎症过程之间的分离也被提出[58].
脂肪组织中产生ECM成分的细胞类型:前脂肪细胞的作用
在纤维化疾病中,已证明ECM成分的积累主要是由炎症过程驱动的[59].脂肪组织中的几种细胞类型可能具有合成ECM成分的能力,特别是在以过度产生大量细胞因子和趋化因子为特征的促炎环境中,其中一些具有良好的促纤维化特性。从超重的人类受试者中获得的脂肪组织的两种主要细胞组分(脂肪细胞和SVF细胞)的转录组谱[13]表明编码ECM成分或与炎症过程相关的基因主要在SVF中表达。这一观察结果得到了一组ECM相关基因的RTqPCR定量的支持,分别在肥胖和瘦弱受试者的两个细胞部分中进行。事实上,这一量化表明,对于大多数所分析的基因而言,肥胖状态下其表达水平的增加主要发生在SVF细胞中,而不是成熟脂肪细胞[20.],从而支持了这些细胞在过度产生影响肥胖受试者脂肪组织的ECM成分中的主要作用。然而,这些结果并不排除成熟脂肪细胞在过度合成一些ECM成分中的作用。
我们提出假设,在炎症刺激下,脂肪前细胞可能有助于ECM成分的合成。我们团队最近提供的数据显示,与活化的巨噬细胞介质接触的人前脂肪细胞显示成纤维细胞样外观,显著增殖并获得促炎特性[42].微阵列分析证实,经acmc条件培养基处理的前脂肪细胞显示出一组与ECM成分相关或参与炎症过程的基因表达增加。同样,在AcMCs存在下培养的人类前脂肪细胞增加了纤维连接蛋白和I型胶原的产生,它们在前脂肪细胞周围形成了纤维网络。肥胖受试者中其他脂肪SVF细胞产生的不同因素是否有助于以类似于AcMC培养基观察到的方式改变脂肪前细胞表型,以及其他细胞类型的参与,如肌成纤维细胞或来自血源性间充质祖细胞的成纤维细胞,需要进一步探索。需要对构成脂肪SVF的细胞进行更精确的表征,以确定这种细胞类型是否也是人类WAT的组成部分。
结论
从时间的角度来看,人类肥胖可以被认为是一组随着时间相继发展的表型。在这个序列中,我们可以区分:“肥胖前静态阶段”,即有肥胖风险的个体拥有稳定的体重和能量平衡状态;一个“动态增重阶段”,在此阶段,由于摄入超过消耗的正能量平衡,体重增加;还有一个“肥胖静止期”,即个体将体重稳定在一个较高的水平,并重新建立能量平衡。60].一旦达到肥胖阶段,新的体重状态似乎受到生物和心理调节机制的强烈保护。在初始阶段,行为和环境因素可能在遗传倾向背景下脂肪组织过剩的构成中发挥关键作用[61].脂肪组织代谢的进行性生物学改变也可能导致某种程度的不可逆性,并有助于肥胖相关代谢和心血管并发症的发展。在小鼠身上的研究表明,以各种类型的循环免疫细胞浸润为特征的炎症似乎遵循脂肪堆积的不同阶段,但这些炎症现象在人类肥胖的不同阶段的机制和作用仍有待确定。我们对肥胖静止期受试者脂肪组织的功能特征和转录组相互作用的研究证实了炎症过程和ECM重塑之间的强烈关系,与不同的炎症细胞类型和WAT中一定程度的间质纤维化有关。纤维化可能不仅仅是组织病理状态的被动见证,可能表明在肥胖的演变中有一定程度的不可逆性,这似乎表明,尽管局部炎症现象已经消退,但在脂肪量急剧减少后,它仍然存在。关于WAT纤维化在肥胖不同阶段的动态,它在前脂肪细胞和脂肪细胞生物学扰动中的作用,以及在减肥阻力中的作用,还需要更多的了解。不管解释其持久性的实际机制是什么,脂肪组织中间质纤维化的增加可能损害细胞-细胞接触,因此,干扰调节脂肪生成和WAT代谢功能的细胞信号机制。我们的工作为参与纤维化发展的分子机制及其对脂肪组织功能的可能后果开辟了新的视角。
材料与方法
受试者和研究设计
肥胖55例(BMI 44.07±9.06 kg/m2体重指数(BMI)为23.67±1.51 kg/m2(年龄34.2±8.52岁)于2002 - 2006年在Hôtel-Dieu医院(法国巴黎)营养科前瞻性招募。我们排除了伴有急性或慢性炎症疾病、感染和/或癌症的受试者。所有肥胖受试者在纳入前至少三个月体重稳定。10例肥胖受试者在Hôtel-Dieu医院(法国巴黎)外科行胃旁路手术。在减肥手术前和术后3个月评估和记录患者的临床和生化参数。空腹一晚后抽取血液样本进行循环蛋白生化检测(如血清瘦素、脂联素、白细胞介素6、肿瘤坏死因子(TNF)α和高敏C反应蛋白(hsCRP))。对照组是接受美容手术的健康瘦弱受试者,没有个人肥胖史。分析对象的总体临床和生化参数见表1.有关每组研究对象的详细资料,可作为网上补充资料提供[20.].肥胖受试者和瘦人对照组在年龄方面没有显著差异。所有临床调查均根据《赫尔辛基宣言》进行,并得到Hôtel-Dieu医院(法国巴黎)伦理委员会的批准。所有参与研究的受试者均获得签署的知情同意书。
实验室测试
在夜间禁食12小时后采集血液样本。用酶促法测定血糖。使用商业IRMA试剂盒(Bi-INSULINE IRMA, CisBio International, Saclay France)测量血清胰岛素浓度。根据制造商的建议,使用Linco研究公司(圣路易斯,MI, USA)的放射免疫测定试剂盒测定血清瘦素和脂联素。瘦素和脂联素的灵敏度分别为0.5 ng/ml和0.8 ng/ml。采用超灵敏ELISA系统(QuantikineUS, R&D Systems Europe Ltd, Abingdon UK)检测血清il - 6和tnf - α水平。该方法对IL-6和TNFα的敏感性分别为< 0.04 pg/ml和0.12 pg/ml。IL6的检测内和检测间变异系数(CV)分别低于8%,TNFα的变异系数分别低于8.8%和16%。使用image自动免疫测定系统(Beckman-Coulter, Fullerton, CA, USA)测定类orosomucucoid和hsCRP。敏感性分别为35 mg/dl和0.02 mg/dl。 Intra-assay and inter-assay CV were below 4% and 6%, respectively, for orosomucoid and below 5% and 7.5%, respectively, for hsCRP.
采用定量胰岛素敏感性检查指数(QUICKI)法评价受试者的胰岛素敏感性,该方法与参考方法高胰岛素-正糖钳夹法相关性良好。如前所述,计算空腹血糖和胰岛素[62].
微阵列实验
通过针吸法从肥胖和瘦弱受试者脐周区域获得皮下WAT样本。根据制造商的方案,使用RNeasy总RNA Mini试剂盒(Qiagen, Courtaboeuf, France)制备总RNA。使用Ultrospec 2000分光光度计(Pharmacia Biotech, Piscataway, NJ, USA)测定总RNA的浓度,使用2100生物分析仪(Agilent Technologies, Massy, France)评估RNA的完整性。使用MessageAmp RNA试剂盒(Ambion, Austin, TX)从每个样品制备中扩增1微克总RNA,并使用CyScribe第一链cDNA标记试剂盒(Amersham Biosciences, Orsay,法国)对3 μg扩增RNA (aRNA)进行cy染色标记[63,64].
为了比较在肥胖和瘦弱受试者中进行的微阵列实验,我们使用了一个共同的参考池,该参考池由从所有分析患者的脂肪组织样本中提取的等量总RNA混合而成。参考库中的aRNA标记为Cy3,而测试样品中的aRNA标记为Cy5。在此条件下共进行了35个cDNA微阵列。
在胃手术条件下,术前从每个WAT样本中提取的aRNA用Cy3染料标记,而手术后三个月从WAT样本中提取的aRNA用Cy5染料标记。在这种情况下,总共进行了10个单独的cDNA微阵列。
从先前描述的超重受试者的皮下WAT标本中检测分离的脂肪细胞和SVF细胞之间的基因表达差异(女性、n= 9, BMI 27.9±6.8 kg/m2) [11].这组受试者与参与临床调查方案的受试者不同。我们比较了分别从脂肪细胞和SVF细胞中提取的总RNA,这些总RNA是在对WAT标本进行酶解后获得的,并如前所述分离了两个细胞部分[11].不能排除这种酶消化技术可能对分离细胞的表达谱有潜在影响,如先前在小鼠研究中所指出的[65].在此条件下,从脂肪细胞和SVF细胞制剂中汇集等量的总RNA,重复6次后进行cDNA微阵列实验。SVF细胞的aRNA用Cy3标记,而脂肪细胞的aRNA用Cy5标记。
最后,我们进行了8个cDNA芯片实验,以评估由脂多糖激活循环单核细胞(AcMCs)分泌的炎症因子诱导培养的人前脂肪细胞的基因表达变化。用对照RPMI培养基培养的预脂肪细胞提取的aRNA用Cy3染料标记,用acmc条件培养基培养的预脂肪细胞提取的aRNA用Cy5染料标记。
对于所有这些条件,杂交、洗涤和扫描程序如前所述进行[11].还进行了几次质量交叉检查(总RNA质量、aRNA质量、染料掺入效率等)和微阵列“染料交换”实验。与所有这些条件相关的原始微阵列数据已存入基因表达综合系统[66公共存储库(登录号:GSE9157)。
实时定量PCR
我们通过逆转录和RTqPCR验证了基因表达的变化,如[63].这些结果作为在线补充数据呈现[20.].我们使用18S核糖体RNA(核糖体RNA对照TaqMan检测试剂盒,应用生物系统公司,福斯特城,CA,美国)作为标准化对照。mRNA引物和TaqMan探针均来自Applied Biosystems。这些探针在5'端用报告染料(FAM)标记。18S核糖体RNA探针分别在5'端和3'端用报告染料VIC和TAMRA标记。对于每个引物和探针对,在mRNA定量之前,使用人类脂肪组织cDNA序列稀释得到标准曲线。
统计分析
在对经过背景校正的表达式测量值进行对数变换后,对微阵列实验进行了打印尖端黄土归一化,如[67].应用SAM程序鉴定有显著表达变化的转录本[21].通过在SAM选择过程中对所有条件施加5%的FDR阈值来建立显著差异表达。Wilcoxon检验进一步用于评估RTqPCR分析的基因表达差异(例如,肥胖与精益,减肥手术前与手术后)。基因表达测量值与临床和生化参数之间的相关性用斯皮尔曼秩检验检验。在所有分析中,统计显著性的阈值被认为对应于ap值< 0.05。在所有可能出现多个测试错误的情况下,由于连续统计计算的数量较多,计算结果为p应用Storey(2002)修正方法对上述试验计算的数值进行了调整[68],相当于罗斯福总统估计的5%。所有统计分析均采用R软件环境进行统计计算[69].
肥胖WAT转录组特征的生物学相互作用分析
应用于分析差异调控基因的综合策略包括三个连续步骤:首先,通过差异调控基因的自动注释识别上下文相关的生物学主题;第二,量化与相关生物学主题相关的转录组相互作用,并构建在两种分析的临床情况下表征肥胖WAT转录组特征的功能相互作用图;第三,分析生物相互作用模块下的基因共表达网络,计算相关基因节点的网络中心性测度。
差异调控基因的生物学注释
基于GO的微阵列实验中差异调控基因的自动注释过程[22]和KEGG [23]注释系统[70,71].EntrezGene数[72]被用作标准的转录本接入系统,以确保正确的过度表示分析,因为它们允许将基因标识符映射到GO或KEGG生物类别。基因注释程序分别应用于三个GO本体(生物过程、细胞成分和分子功能)以及KEGG类别。
为了最大限度地减少与基因在GO晶格中角色冗余标注相关的GO类别的虚假过度表示,并确保提取的生物标注信息的同质特异性程度,设计并应用信息驱动程序计算每个标注GO类别的基因富集度(即标注某个类别的差异表达基因相对于所有标注该类别的基因的比例)。该过程将基因富集计算与特定信息水平的GO相关,根据本体论晶格中编码的注释信息的精度定义。定义最大注释专一性的参考级别,首先考虑每个GO类别只考虑其直接注释的转录本,而不管类别在GO格中的位置。然后,参考这一层次,我们通过在GO格中传递性地重新分配注释基因(即通过将注释基因重新分配到不那么具体的本体论类别,由本体论格中编码的包容关系指导),推导出了一系列越来越不具体的后续层次。然后,计算每个GO类别的基因富集测量,在每个特定于信息的级别上,这是由GO注释的逐步重新分配产生的(即从每个GO类别到其直接本体论上位词)。一个p基因富集显著性值,由费雪精确检验计算,如前所述[13,73],使我们能够在每个特定信息级别上识别显著过度代表的生物学主题。对KEGG类别进行了类似的基因富集计算,除了在这种情况下不考虑信息特定水平,因为这些类别不受本体关系的约束。由此产生的p应用Storey (2002) FDR校正方法对多个测试误差进行了校正[68].在专家对自动注释结果进行检查后,GO的第四个信息特定级别被保留以进行进一步分析,因为它在注释信息的特异性与其生物学可解释性之间提供了最佳权衡。
过度代表的生物学主题之间的转录组相互作用分析
转录组相互作用的分析旨在从与这些主题相关的显著丰富的GO或KEGG类别注释的基因表达谱的相似性中提取有关人类WAT中各种结构和功能主题(即结构成分、细胞过程和调控途径)之间复杂关系的相关信息。为此,我们依赖于一个分析框架,旨在探索抽象的“多实例”对象之间的接近关系,对应于我们上下文中的注释类别,构成由其表达度量向量表示的注释基因实例集[73,74].一个非线性动态系统模型,将GO和KEGG类别的多实例表示与其被注释基因的表达谱联系起来,用于从其被注释基因的表达相似性中提取关于注释类别之间的接近性的信息(C Henegar, K. Clement和J-D。朱克,手稿正在准备中)。无监督光谱技术[75]应用于结果的邻接矩阵,编码接近信息,将主题聚类到生物相互作用模块(C Henegar, K. Clement和J-D。朱克,手稿正在准备中)。最佳聚类分区的选择依赖于Silhouette质量指数,该指数用于比较聚类结果,因为它与之前评估中强调的基因组上下文具有良好的相关性[76].最后,生物分子相互作用网络分析的Cytoscape软件环境[77]用于构建综合图谱,以说明在分析条件下表征肥胖WAT转录组特征的生物学主题之间的相互作用。
WAT中潜在生物相互作用的基因共表达网络分析
共表达网络分析将与相关生物学主题注释的差异表达基因联系起来,并基于网络中心性的常规测量来评估其生物学重要性。用于构建共表达基因网络的分析框架已在[78].首先通过Spearman相关系数计算共表达矩阵,量化分析条件下基因表达谱的相似性。然后,应用a得到邻接矩阵征函数的共表达式矩阵。的征邻接函数实现了一种依赖于预定阈值参数的“硬”阈值方法。此阈值参数表示共表达式显著性指标,由最大化无标度拓扑条件确定,如前所述[78].为了评估单个基因的潜在生物学相关性,网络中心性测量,如基因节点的中间性和模块内连通性,根据先前提出的方法,从构建的共表达网络中计算[79].
形态测量学
由外科医生在胃手术干预期间进行脐周皮下WAT活检。样品在4°C的4%多聚甲醛中固定过夜,然后进行标准石蜡包埋。薄切片(5 μm厚)经苏木精-伊红染色,由3位独立观察者用Zeiss 20 Axiostar Plus显微镜(Zeiss, Germany)进行盲法分析。数码图像由索尼triCCD相机(索尼,法国)拍摄。使用PerfectImage软件(Claravision, Orsay France)在每个样本中测量400个脂肪细胞的细胞直径。计算每个WAT活检的平均直径。
肝脏组织病理学
在体重减轻前后分别对10名瘦弱受试者和10名肥胖患者进行肝活检。肝脏样本用福尔马林固定,石蜡包埋,常规染色(苏木精和伊红,马松三色,苦天狼星红和Perl染色)。切片由一位病理学专家编码并分析,而不考虑活检的身份。根据先前发表的标准记录主要组织病理学特征并进行半定量[80].纤维化分为0期(无),1期(仅1a-b 3区肝窦周围纤维化,仅1c门脉纤维化),2期(3区肝窦周围纤维化和门脉周围纤维化,无桥接),3期(桥接纤维化)和4期(肝硬化,可能和确定)。
纤维化量化
在减肥手术前和术后3个月分别收集10名精瘦和10名肥胖受试者的脂肪组织,并按上述方法进行石蜡包埋。这些患者是用于肝脏组织病理学研究的同一组患者。载玻片用苦天狼星红染色[81].简单地说,切片在0.2%磷钼酸、0.1%苦天红(饱和苦味酸中的直接红80)和0.01 N HCl中孵育,然后干燥并安装在Permount中。纤维化分析使用Alphalys平台(hisolab软件,Plaisir, France)在×100放大倍率下进行,颜色阈值不变。定量评估为红色染色(纤维化)/组织表面比的百分比。
免疫组织化学
免疫组化检测T淋巴细胞CD3 (Neomarker Microm, Francheville France),亲和素-生物素过氧化物酶(ABC)法[82].NK细胞的免疫组化检测采用NKp46 (RnDsystem, Lille France), EAC (Dako Cytomation, Trappes France)。皮下WAT脱蜡切片(5 μm厚)经过以下培养步骤:首先,在柠檬酸缓冲液(10 mM pH 6.0)中,用750 W微波洗涤3次,揭去抗原;二、过氧化氢在3%的水中浸泡15分钟,阻断内源性过氧化物酶;第三步,tris缓冲盐水/Tween20-Casein 0.02 M溶液(TBS-TC) 10分钟;第四种小鼠单克隆抗体在TBS-TC中室温稀释1:200 (1 h);第五步,多联抗小鼠生物素化免疫球蛋白(Dako流式细胞术)1:200稀释于TBS-TC, 20分钟;第六,采用标准链霉亲和素-生物素-过氧化物酶复合物(SABC)方法,使用市售试剂盒(ABCYS, Biospa,米兰,意大利);第七步,用二氨基联苯胺显影染色,用梅氏苏木精反染色。处理后的幻灯片图像由显微镜摄像系统获取(尼康,法国)。
电子显微镜
将小块组织固定在4%戊二醛0.1 M磷酸盐缓冲液(pH 7.4)中4小时,后固定在1%四氧化锇中,并嵌入Epon-Araldite混合物中。用甲苯胺蓝染色半薄片(2 μm),用超微显微镜取薄片,用柠檬酸铅染色,透射电镜观察。
细胞培养
前脂肪细胞是从5名接受择期手术的健康非肥胖妇女脐周区域的皮下脂肪组织中分离出来的,并按照[83,84].简单地说,切碎的脂肪组织用胶原酶处理消化。消化后的物质经过过滤和离心。所得到的颗粒(SVF)在红细胞裂解缓冲液(154 mM NH)中重悬4Cl, 5.7 mM K2HPO4,和0.1 mM EDTA, pH 7.0), 250 g, 10分钟。在磷酸盐缓冲盐水(PBS)中洗涤后,将SVF细胞悬浮在DMEM-10%胎牛血清中,并在传代2时用于细胞培养,以消除巨噬细胞标记物(Ham 56和Mac-1)阴性染色证实的非脂肪细胞前污染。分离的前脂肪细胞在1ml DMEM-10%胎牛血清中进一步培养24 h,细胞密度为105每孔的细胞在12孔板的圆形玻璃罩上。然后用(AcMC)或不用(对照)0.25 ml AcMC条件培养基培养[42],加入0.75 ml DMEM/F12诱导培养基(终浓度为50 nM胰岛素、100 nM地塞米松、0.25 mM抑制剂1-甲基-3-异丁基黄嘌呤、100 nM罗格列酮),连续4天。然后,用0.25 ml对照或AcMC培养基和0.75 ml DMEM/F12培养基(终浓度为50 nM胰岛素和100 nM罗格列酮)替代该培养基。培养基每两天更换一次,直到第10天。然后用4%多聚甲醛固定细胞并进行免疫染色:在PBS渗透5分钟后,3%牛血清白蛋白和0.1% triton(仅用于I型胶原蛋白染色),并在PBS和3%牛血清白蛋白中阻塞1小时后,细胞在抗纤连蛋白(BD Bioscience, San-Jose, CA, USA)或I型胶原蛋白(NOVUS, Littleton, CO, USA)抗体1:100稀释中在4℃下持续搅拌下孵育过夜。Revelation使用蓝蛋白2检测纤连蛋白,蓝蛋白3检测I型胶原蛋白,DAPI核染色。封面安装在Fluoprep介质中(Biomérieux, Narcy L’etoile,法国),并用Axiovert显微镜连接Axiocam HR摄像机(蔡司)进行观察。颜色可以任意应用于灰度图片。
缩写
- AcMC:
-
激活巨噬细胞
- aRNA:
-
放大RNA
- 体重指数:
-
身体质量指数
- 创新领导力:
-
CC趋化因子配体
- 辅酶a:
-
辅酶A
- DMEM:
-
杜尔贝科改良的鹰牌中号
- ECM:
-
细胞外基质
- 罗斯福:
-
错误发现率
- 走:
-
基因本体论
- 低氧诱导因子:
-
低氧诱导因子
- hsCRP:
-
高敏C反应蛋白
- IL:
-
白介素
- KEGG:
-
京都基因与基因组百科全书
- NK:
-
自然杀伤细胞
- NKT:
-
自然杀伤T细胞
- PBS:
-
磷酸盐
- QUICKI:
-
定量胰岛素敏感性检查指数
- RTqPCR:
-
实时定量PCR
- 山姆:
-
微阵列的显著性分析
- SVF:
-
间质血管组分
- TBS-TC:
-
tris缓冲盐水/Tween20-Casein, TNF,肿瘤坏死因子
- 窟:
-
白色脂肪组织。
参考文献
Ridker PM、burn JE、Cook NR、Rifai N: c反应蛋白、代谢综合征和心血管事件发生风险:对14719名最初健康的美国女性进行了8年随访。《中国农业科学》,2003,27(3):391-397。cir.0000055014.62083.05 10.1161/01.。
GS:炎症和代谢紊乱。自然科学,2006,44(3):366 - 366。10.1038 / nature05485。
Hursting SD, Nunez NP, Varticovski L, Vinson C:肥胖与癌症的联系:从减肥老鼠身上学到的教训。癌症法案,2007,67:2391-2393。10.1158 / 0008 - 5472. - 06 - 4237。
Hansson GK:炎症、动脉粥样硬化和冠状动脉疾病。中华实用医学杂志,2005,27(3):344 - 344。10.1056 / NEJMra043430。
Cottam DR, Mattar SG, Barinas-Mitchell E, Eid G, Kuller L, Kelley DE, Schauer PR:病态肥胖相关发病率的慢性炎症假说:减肥的意义和影响。中华外科杂志,2004,14:589-600。10.1381 / 096089204323093345。
作为内分泌器官的脂肪组织。中华医学杂志,2000,24(增刊2):S1-3。
Lyon CJ, Law RE, Hsueh WA:综述:肥胖、炎症和动脉粥样硬化。中华内分泌杂志,2003,29(3):344 - 344。10.1210 / en.2003 - 0285。
脂肪细胞激素:调节能量平衡和碳水化合物/脂质代谢。糖尿病杂志,2004,53(增刊1):S143-151。10.2337 / diabetes.53.2007.S143。
徐华,Barnes GT,杨强,谭刚,杨东,周cj, Sole J, Nichols A, Ross JS, Tartaglia LA,陈h:脂肪慢性炎症在肥胖相关胰岛素抵抗的发展中起着关键作用。《中国经济》,2003,29(3):344 - 344。10.1172 / JCI200319451。
Curat CA, Miranville A, Sengenes C, Diehl M, Tonus C, Busse R, Bouloumie A:从血液单核细胞到脂肪组织巨噬细胞:成熟脂肪细胞诱导减脂。中华糖尿病杂志,2004,53:1285-1292。10.2337 / diabetes.53.5.1285。
Clement K, Viguerie N, Poitou C, Carette C, Pelloux V, Curat CA, Sicard A, Rome S, Benis A, Zucker JD, Vidal H, Laville M, Barsh GS, Basdevant A, Štich V, Stich V, Cancello R, Langin D:体重减轻调节肥胖患者白色脂肪组织中的炎症相关基因。王志强,2004,30(1):1 - 4。10.1096 / fj.04 - 2204 com。
caspa - bauguil S, Cousin B, Galinier A, Segafredo C, Nibbelink M, Andre M, cassteilla L, Penicaud L:脂肪组织作为一种祖先免疫器官:肥胖的位点特异性变化。清华大学学报(自然科学版),2005,29(3):349 -349。10.1016 / j.febslet.2005.05.031。
Cancello R, Henegar C, Viguerie N, Taleb S, Poitou C, Rouault C, Coupaye M, Pelloux V, Hugol D, Bouillot JL, Bouloumié A, Barbatelli G, Cinti S, Svensson PA, Barsh GS, Zucker JD, Basdevant A, Langin D, Clément K:手术诱导体重减轻后,病状肥胖患者白色脂肪组织中巨噬细胞浸润和趋化基因表达变化的减少。中华糖尿病杂志,2005,34(4):357 - 357。10.2337 / diabetes.54.8.2277。
Viguerie N, Poitou C, Cancello R, Stich V, Clement K, Langin D:转录组学应用于肥胖和热量限制。生物化学学报,2005,27(3):344 - 344。10.1016 / j.biochi.2004.12.011。
Barabasi AL, oltai ZN:网络生物学:理解细胞的功能组织。中国科学院学报,2004,(5):344 - 344。10.1038 / nrg1272。
Guimera R, Nunes Amaral LA:复杂代谢网络的功能制图。自然科学学报,2005,37(3):344 - 344。10.1038 / nature03288。
Watts DJ, Strogatz SH:“小世界”网络的集体动力学。自然科学,1998,39(3):344 - 344。10.1038/30918。
微阵列实验的功能解释。组学。2006, 10: 398-410。10.1089 / omi.2006.10.398。
Taleb S, Lacasa D, Bastard JP, Poitou C, Cancello R, Pelloux V, Viguerie N, Benis A, Zucker JD, Bouillot JL, Coussieu C, Basdevant A, Langin D, Clement K:组织蛋白酶S,一种新的肥胖生物标志物:与动脉粥样硬化的相关性。王志强,2005,30(1):1 - 4。
本研究的配套网站。[http://corneliu.henegar.info/projects/FunNet/genome_biol_2008/index.htm]
杜晓峰,朱国强,王晓明,王晓明:微阵列对电离辐射响应的显著性分析。美国国家科学研究院。2001, 32(3): 344 - 344。10.1073 / pnas.091062498。
基因本体论。[http://www.geneontology.org]
京都基因与基因组百科全书。[http://www.genome.jp/kegg/]
Taylor KR, Gallo RL:糖胺聚糖及其蛋白聚糖:宿主相关的引发和调节炎症的分子模式。王志强,2006,30(1):1 - 4。10.1096 / fj.05 - 4682转速。
Kawaguchi N, Sundberg C, Kveiborg M, Moghadaszadeh B, Asmar M, Dietrich N, Thodeti CK, Nielsen FC, Moller P, Mercurio AM, Albrechtsen R, Wewer UM: ADAM12通过调节β - a1整合素功能诱导早期脂肪细胞分化过程中肌动蛋白细胞骨架和细胞外基质重组。中国生物医学工程学报,2003,29(3):344 - 344。10.1242 / jcs.00699。
Prasse A, Pechkovsky DV, Toews GB, Jungraithmayr W, Kollert F, Goldmann T, Vollmer E, Muller-Quernheim J, Zissel G:肺泡巨噬细胞和成纤维细胞的恶性循环通过CCL18使肺纤维化永久存在。中华呼吸危重症杂志,2006,29(4):489 - 497。10.1164 / rccm.200509 - 1518摄氏度。
孔涛,李丽娟,李丽娟,谢丽娟:缺氧时白细胞粘附与hif -1诱导β 2整合素基因表达有关。美国国家科学研究院。2004, 21(4): 344 - 344。10.1073 / pnas.0401339101。
Fogelstrand L, Hulthe J, Hulten LM, Wiklund O, Fagerberg B:女性糖尿病和糖耐量受损患者中CD14和CD18的单核细胞表达、循环粘附分子和炎症标志物。中华糖尿病杂志,2004,47:1948-1952。10.1007 / s00125 - 004 - 1553 - x。
Le Cabec V, Carreno S, Moisand A, Bordier C, Maridonneau-Parini I:补体受体3 (CD11b/CD18)分别在非语音吞噬和语音吞噬过程中介导I型和II型吞噬。中华免疫杂志,2002,19(3):394 - 397。
Sitkovsky M, Lukashev D:局部组织氧张力对免疫细胞的调节:HIF1 α和腺苷受体。中华免疫杂志,2005,5:712-721。10.1038 / nri1685。
罗dolce J, Burkett P, Koka R, Boone D, Chien M, Chan F, Madonia M, Chai S, Ma A:白细胞介素15与淋巴稳态的调控。中华免疫杂志,2002,39:537-544。10.1016 / s0161 - 5890(02) 00211 - 0。
Do H, Vasilescu A, Carpentier W, Meyer L, Diop G, Hirtzig T, Coulonges C, Labib T, Spadoni JL, Therwath A, Therwath A, Lathrop M, Matsuda F, Zagury JF:法国队列中白细胞介素-1家族基因的详尽基因分型及其与艾滋病进展的关系。中华流行病学杂志,2006,29(3):344 - 344。10.1086/508545。
Richard M, Thibault N, Veilleux P, Breton R, Beaulieu AD:含有itm的CLECSF6 (DCIR)在中性粒细胞中被中性粒细胞激活剂下调。生物化学学报,2003,31(3):357 - 357。10.1016 / j.bbrc.2003.09.077。
D'Acquisto F, Merghani A, Lecona E, Rosignoli G, Raza K, Buckley CD, Flower RJ, Perretti M: Annexin-1调节t细胞激活和分化《血液》,2007,109:1095-1102。10.1182 / - 2006 - 05 - 022798血。
CD53四跨蛋白抗原对细胞凋亡的保护作用及存活信号的研究。中国生物医学工程学报,2003,22:1219-1224。10.1038 / sj.onc.1206183。
Cook GA, Longhurst CM, Grgurevich S, Cholera S, Crossno JT, Jennings LK: CD9细胞外结构域在调节CHO细胞黏附纤维连接蛋白和纤维连接蛋白细胞周围基质组装中的重要作用。《血液》,2002,100:4502-4511。10.1182 / blood.V100.13.4502。
韦伟,王晓明,王晓明,王晓明,王晓明:细胞表面toll样受体活化对人单核细胞CD163表达的影响。中国生物医学工程学报,2007,29(3):344 - 344。10.1189 / jlb.0706428。
Philippidis P, Mason JC, Evans BJ, Nadra I, Taylor KM, Haskard DO, Landis RC:血红蛋白清除剂受体CD163介导白细胞介素-10释放和血红素加氧酶-1合成:抗炎单核细胞-巨噬细胞反应在体外,在解决皮肤水泡在活的有机体内以及体外循环手术后。中国宪法第2004,94号:119-126。res.0000109414.78907.f9 10.1161/01.。
Son YS、Park JH、Kang YK、Park JS、Choi HS、Lim JY、Lee JE、Lee JB、Ko MS、Kim YS、Kob JH、Yoonc HS、Leed KW、sed RH、Moonf SY、Ryua CJ、Hong HJ:热休克70-kDa蛋白8亚型1在人胚胎干细胞表面表达,并在分化后下调。中国生物医学工程学报,2005,23:1502-1513。10.1634 / stemcells.2004 - 0307。
姜景光:诱导性热休克蛋白70kd和诱导性一氧化氮合酶在出血/复苏损伤中的作用。决议草案,2004,14:450-459。10.1038 / sj.cr.7290247。
Suter M, Giusti V, Heraief E, Zysset F, Calmes JM:腹腔镜下Roux-en-Y胃旁路手术:最初2年的经验。中华外科杂志,2003,27(3):344 - 344。10.1007 / s00464 - 002 - 8952 - 1。
Lacasa D, Taleb S, Keophiphath M, Miranville A, Clement K:巨噬细胞分泌因子损害人类脂肪形成:前脂肪细胞参与促炎状态。中华内分泌杂志,2007,27(3):344 - 344。10.1210 / en.2006 - 0687。
Bataller R, Brenner DA:肝纤维化。中华临床医学杂志,2005,29(4):344 - 344。10.1172 / JCI200524282。
Wu H, Ghosh S, Perrard XD, Feng L, Garcia GE, Perrard JL, Sweeney JF, Peterson LE, Chan L, Smith CW, Ballantyne CM:肥胖患者脂肪组织中T细胞的积累和激活调控、正常T细胞的表达和分泌上调流通,2007,115:1029-1038。10.1161 / CIRCULATIONAHA.106.638379。
Rosen ED, Spiegelman BM:脂肪细胞作为能量平衡和葡萄糖稳态的调节因子。自然科学进展,2006,29(4):344 - 344。10.1038 / nature05483。
Cancello R, Tordjman J, Poitou C, Guilhem G, Bouillot JL, Hugol D, Coussieu C, Basdevant A, Hen AB, Bedossa P, Guerre-Millo M, Clément K:大网膜脂肪组织巨噬细胞浸润增加与人类病态肥胖中明显的肝脏病变相关。中华医学会糖尿病杂志,2006,29(4):344 - 344。10.2337 / db06 - 0133。
吕孟,李志刚,李志刚,王志刚,等:肥胖诱导脂肪巨噬细胞极化的表型切换。中华临床医学杂志,2007,27(3):344 - 344。10.1172 / JCI29881。
caspa - bauguil S, Cousin B, Andre M, Nibbelink M, Galinier A, Periquet B, cassteilla L, Penicaud L:脂肪组织中免疫系统的体重依赖变化:瘦素的重要性。研究与发展,2006,31(2):1 - 5。10.1016 / j.yexcr.2006.03.023。
Marti A, Marcos A, Martinez JA:肥胖与免疫功能的关系。《经济科学》2001,2:131-140。10.1046 / j.1467 - 789 x.2001.00025.x。
Schnaper HW, Hayashida T, Hubchak SC, Poncelet AC: tgf - β信号转导与系膜细胞纤维化。中华实用医学杂志,2003,26(3):344 - 344。
Morrisey EE: Wnt信号通路与肺纤维化。中华民国病理学杂志,2003,26(3):344 - 344。
Chevalier RL:阻塞性肾病:生物标志物的发现和基因治疗。中华临床医学杂志,2006,(2):157-168。10.1038 / ncpneph0098。
王志强,王志强,王志强:小鼠肝纤维化模型的研究进展。中华胃肠病杂志,2007,45:43-50。10.1055 / s - 2006 - 927387。
Wynn TA:在各种纤维增生性疾病中,常见和独特的机制调节纤维化。中华临床医学杂志,2007,29(4):344 - 344。10.1172 / JCI31487。
Sbarbati A, Osculati F, Silvagni D, Benati D, Galie M, Camoglio FS, Rigotti G, Maffeis C:肥胖和炎症:基础病变的证据。中华儿科杂志,2006,27(3):344 - 344。10.1542 / peds.2004 - 2854。
Ricard-Blum S, Bresson-Hadni S, Vuitton DA, Ville G, Grimaud JA:羟基吡啶胶原交联在人肝纤维化中的作用:肺泡棘球蚴病的研究。中华肝病杂志,1999,15:599-602。10.1002 / hep.1840150408。
Friedman SL, Bansal MB:肝纤维化逆转-事实还是幻想?国际肝病杂志,2006,43:S82-88。10.1002 / hep.20974。
Wynn TA:纤维化疾病和T(H)1/T(H)2范式。中华免疫杂志,2004,4:583-594。10.1038 / nri1412。
Iredale JP:肝纤维化的模型:探索固体器官炎症和修复的动态性质。中华临床医学杂志,2007,29(4):344 - 344。10.1172 / JCI30542。
肥胖:预防和管理全球流行病。世卫组织协商会议报告。世界卫生器官技术代表,2000年第894页:i-xii。1 - 253。
穆奇DM,克莱门特K:揭示人类肥胖的遗传学。公共科学学报,2006,2:e188-10.1371/journal.pgen.0020188。
Katz A, Nambi SS, Mather K, Baron AD, Follmann DA, Sullivan G, Quon MJ:定量胰岛素敏感性检查指数:一种简单、准确的评估人类胰岛素敏感性的方法。中华内分泌杂志,2000,29(3):344 - 344。10.1210 / jc.85.7.2402。
Clement K, Viguerie N, Diehn M, Alizadeh A, Barbe P, Thalamas C, Storey JD, Brown PO, Barsh GS, Langin D:在活的有机体内甲状腺激素对人骨骼肌基因表达的调控。中国生物医学工程学报,2002,26(4):344 - 344。10.1101 / gr.207702。
Ruan H, Zarnowski MJ, Cushman SW, Lodish HF:小鼠附睾脂肪垫中原代脂肪细胞的标准分离诱导炎症介质和下调脂肪细胞基因。中国生物医学工程学报,2003,27(3):357 - 357。10.1074 / jbc.M305257200。
基因表达综合。[http://www.ncbi.nlm.nih.gov/geo/]
Smyth GK, Speed T: cDNA微阵列数据归一化。方法,2003,31:265-273。10.1016 / s1046 - 2023(03) 00155 - 5。
Storey JD, Tibshirani R:全基因组研究的统计学意义。美国国家科学研究院。2003, 30(4): 344 - 344。10.1073 / pnas.1530509100。
R:统计计算的语言和环境。[http://www.R-project.org]
Kanehisa M, Goto S: KEGG:京都基因和基因组百科全书。中国生物医学工程学报,2000,28:27-30。10.1093 / nar / 28.1.27。
Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM, Davis AP, Dolinski K, Dwight SS, Eppig JT, Harris MA, Hill DP, Issel-Tarver L, Kasarskis A, Lewis S, Matese JC, Richardson JE, Ringwald M, Rubin GM, Sherlock G:基因本体论:生物学统一的工具。基因本体联盟。王文杰,2000,25:25-29。10.1038/75556。
Maglott D, Ostell J, Pruitt KD, Tatusova T: Entrez基因:NCBI的基因中心信息。中国生物医学工程学报,2007,35:D26-31。10.1093 / nar / gkl993。
Henegar C, Cancello R, Rome S, Vidal H, Clement K, Zucker JD:聚类生物注释和基因表达数据以识别推定的共同调控生物过程。中国生物医学工程学报,2006,4:833-852。10.1142 / S0219720006002181。
Henegar C, Clement K, Zucker JD:基因组数据功能分析的无监督多实例学习。计算机科学讲座讲稿:欧洲机器学习会议;柏林。编辑:Fürnkranz J, Scheffer T, Spiliopoulou M. 2006,柏林:施普林格,186-197。
吴志强,吴志强,魏志勇:光谱聚类的分析与算法。神经信息处理系统研究进展。编辑:Dietterich TG, Becker S, Ghahramani Z. 2002,剑桥,马萨诸塞州:麻省理工学院出版社,849-856。
Bolshakova N, Azuaje F:估计DNA微阵列数据中的簇数。方法中华医学杂志,2006,45:153-157。
Shannon P, Markiel A, Ozier O, Baliga NS, Wang JT, Ramage D, Amin N, Schwikowski B, Ideker T:细胞景观:生物分子相互作用网络集成模型的软件环境。基因组学报,2003,13:2498-2504。10.1101 / gr.1239303。
张波,霍华。加权基因共表达网络分析的一般框架。中华生物医学杂志,2005,4:第17-Epub 2005
Hahn MW, Kern AD:三种真核蛋白质相互作用网络中中心性和重要性的比较基因组学。中国生物医学工程学报,2005,26(3):344 - 344。10.1093 / molbev / msi072。
Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, Ferrell LD, Liu YC, Torbenson MS, Unalp-Arida A, Yeh M, McCullough AJ, Sanyal AJ,非酒精性脂肪性肝炎临床研究网络:非酒精性脂肪性肝病组织学评分系统的设计和验证。中华肝病杂志,2005,41:1313-1321。10.1002 / hep.20701。
李志强,李志强,李志强,等。胰腺组织中胶原蛋白含量的定量分析。消化,1989,44:7-13。
徐秀敏,李丽娟,方兴华:亲和素-生物素-过氧化物酶复合物(ABC)在免疫过氧化物酶技术中的应用:ABC与未标记抗体(PAP)的比较。中华细胞化学杂志,2004,29(4):357 - 357。
李志刚,李志刚,李志刚,李志刚,李志刚:人脂肪细胞前体在无血清培养基中的分化。中华医学杂志,1987,11:19-27。
Hauner H, Entenmann G, Wabitsch M, Gaillard D, Ailhaud G, Negrel R, Pfeiffer EF:糖皮质激素对化学培养基培养的人脂肪细胞前体细胞分化的促进作用。《中国经济与投资》,2007,30(4):344 - 344。
确认
作者感谢Veronique Pelloux、Christine Rouault、Nathalie Colnot、Christiane Coussieu出色的技术帮助,Danielle Hugol在组织病理学技术方面的帮助,David M Mutch对手稿的有意义的批评,患者和他们的外科医生,Jean-Louis Bouillot教授,Marc Slama博士和Philippe Sellam博士,他们根据伦理法律提供了获取人体组织的途径。我们也感谢Michele Savoldelli和Jean-Marc Legeais教授的技术帮助和电子显微镜设备的可用性。这项工作由法国临床研究方向(DRC)/法国公共援助Hôpitaux de Paris (PHRC项目02076)和Hôtel-Dieu医院推动,其资金由INSERM (PRNH N°4NU10G)、法国国家研究机构(RIOMA项目N°ANR-05-PCOD-030-02)和欧洲共同体第6框架HEPADIP项目支持。
作者信息
作者及隶属关系
相应的作者
额外的信息
作者的贡献
CH、JT、DaL、JDZ和KC设计了研究;CH、JT、VA、DaL、IC、KC进行实验;AB、VS、NV、DoL、PB参与受试者招募及受试者临床生化参数评估;CH开发了分析算法,分析了微阵列数据;CH、JT、VA、MGM和KC撰写了这篇论文。作者声明没有利益冲突。
电子辅助材料
13059 _2007_1876_moesm1_esm.xls
附加数据文件1:AcMC培养基培养的人前脂肪细胞差异表达分析结果。(xls7mb)
13059 _2007_1876_moesm2_esm.pdf
附加数据文件2:ecm相关基因在肥胖WAT中与瘦对照相比,在AcMC培养基培养的前脂肪细胞中表达有显著差异。(pdf 138kb)
作者提交的图片原始文件
权利和权限
关于本文
引用本文
赫内加,C.,托吉曼,J.,阿查德,V.。et al。脂肪组织转录组特征强调细胞外基质在人类肥胖中的病理相关性。基因组医学杂志9, r14(2008)。https://doi.org/10.1186/gb-2008-9-1-r14
收到了:
修改后的:
接受:
发表:
DOI:https://doi.org/10.1186/gb-2008-9-1-r14
关键字
- 基因本体论
- 白色脂肪组织
- 附加数据文件
- 间质血管组分
- 在线补充表