微生物抗炎分子(MAM)Faecalibacterium prausnitzii通过抑制NF-κB通路对DNBS和dss诱导的小鼠结肠炎模型有保护作用
- 1Micalis研究所,国家农学研究所(INRA), AgroParisTech, Université法国Jouy-en-Josas巴黎-萨克雷
- 2巴西米纳斯吉拉斯州联邦大学微生物系遗传细胞分子实验室贝洛奥里藏特
Faecalibacterium prausnitzii其上清液对不同化学诱导的小鼠结肠炎模型均有保护作用。最近,我们描述了7个肽发现f . prausnitzii都属于一种叫做微生物抗炎分子(MAM)的蛋白质。这些肽均能抑制NF-κB通路在体外显示出抗炎特性在活的有机体内硫酸二硝基苯(DNBS)诱导的结肠炎模型。在目前的证据中,我们测试了MAM对NF-κB通路的影响在活的有机体内,利用NF-κB启动子控制下产生荧光素酶的转基因小鼠模型。此外,我们在右旋糖酐硫酸钠(DSS)诱导的小鼠结肠炎上测试了该蛋白。为了研究MAM的作用,我们给小鼠口服MAMLactococcus lactis在真核启动子控制下,携带含有MAM cDNA的质粒的菌株。l . lactis在肠膜上皮细胞中传递质粒,从而使宿主直接产生MAM。我们发现MAM可抑制NF-κB通路在活的有机体内.我们证实了MAM在dnbs诱导的结肠炎和DSS模型中的抗炎作用。在DSS模型中,MAM能够抑制Th1和Th17的免疫反应,而在DNBS模型中,MAM能够降低Th1, Th2和Th17的免疫反应,并增加TGFβ的产生。
简介
肠道菌群稳态是肠道黏膜对慢性炎症发展的保护机制之一。在小鼠体内,一些共生细菌,如节段性丝状细菌(Gaboriau-Routhiau等人,2009;伊万诺夫等,2009年),脆弱拟杆菌(Round and Mazmanian, 2017)和梭状芽孢杆菌属为Faecalibacterium prausnitzii能够形成肠道免疫反应(索科尔等人,2008年;Atarashi等,2013).的f . prausnitzii细菌占粪便细菌总数的3-5%,是人类粪便中的主要细菌群之一。降低肠道内的f . prausnitzii会导致对炎症反应的自我防御能力降低。这种保护机制可能涉及活性分子抑制促炎细胞因子和刺激抗炎细胞因子分泌(Zhang et al., 2014;Quévrain等,2016a .).使用的一种机制f . prausnitzii抑制炎症的方法是分泌能够阻止核因子kB (NF-κB)激活的生物活性分子(索科尔等人,2008年).我们最近通过一种名为微生物抗炎分子(MAM)的生物活性分子证明了NF-κB的阻塞f . prausnitzii在上皮细胞培养中(Quévrain等,2016a .).多年的研究表明,其他一些生物活性分子能够减少肠道炎症。例如,有两种蛋白质分泌乳杆菌GG, p75, p40,能够抑制促炎细胞因子诱导的上皮细胞凋亡(Yan等,2007).另一方面,共生菌产生的最具特征的生物活性分子之一是多糖A (PSA)b . fragilis,是一种具有抗炎特性的共生细菌(Mazmanian等人,2005年,2008).前列腺特异性抗原,可在腺泡表面发现b . fragilis,诱导CD4 (+) T细胞转化为Foxp3 (+) Treg细胞,从而减轻肠道炎症(Round and Mazmanian, 2017).这些发现强调,寻找这种生物活性分子在科学上仍然具有挑战性,但可以为创新的治疗策略打开大门。
既然我们描述了损失f . prausnitzii可预测克罗恩病(CD)术后复发(索科尔等人,2008年在对…的理解方面已经取得了很大的进展f . prausnitzii角色及行动机制(Miquel等,2013).炎症性肠病(IBD)、乳糜泻和溃疡性结肠炎(UC)仍然是公共卫生的大问题,因为只有暂停治疗可用。f . prausnitzii其上清液对各种化学诱导的小鼠结肠炎模型均有保护作用(索科尔等人,2008年;Martín等,2014,2015).最近,我们发现MAM具有抗炎特性在活的有机体内在dnbs诱导的结肠炎模型中(Quévrain等,2016a .).为了做到这一点,我们使用了一种食品级细菌,Lactococcus lactis在真核启动子(pCMV)的控制下,修饰为含有携带MAM cDNA编码的表达盒的质粒。我们已经证明了这种重组l . lactis菌株能够将功能完整的质粒转移到真核细胞在体外而且在活的有机体内导致宿主产生感兴趣的蛋白质(Chatel et al., 2008;德尔卡门等人,2013年;Aubry et al., 2015;Souza等人,2016).在体外,表达GFP的细胞百分比l . lactis携带GFP cDNA可达1% (伊诺森等人,2009年).如MAM或GFP所述,质粒转移发生在小肠,但也发生在结肠(阿尔梅达等人,2014;Quévrain等,2016a .).结肠中转染的肠细胞数量是小肠的2倍(阿尔梅达等人,2014),但我们最近发现,质粒转移也靶向小肠或结肠中5%的dc (Michon et al., 2015).
在这里,我们想进一步描述MAM的抗炎特性。为此,我们利用NF-κB启动子调控荧光素酶表达的转基因小鼠模型,检测MAM对NF-κB通路的抑制作用在活的有机体内.我们还研究了MAM对dss诱导的结肠炎模型的影响。
材料与方法
菌株和生长条件
Lactococcus lactisMG1363含pILEMPTY (LL-pILEMPTY)质粒l . lactisMG1363含pILMAM质粒(LL-pILMAM) (Quévrain等,2016a .)在添加1%葡萄糖和红霉素(10 μg/mL)的M17培养基(Difco)中培养,30℃无搅拌过夜。第二天,将培养物在M17培养基中稀释1/20,在30°C下无搅拌生长。根据我们的知识,在OD = 1时,细菌浓度约为5 × 108CFU /毫升。小鼠灌胃5 × 109CFU /鼠标。对于所有灌胃,均预先按照所述制备1OX浓缩物,并在−80°C冷冻。为了使用,将等分逐渐放入冰浴中以保存所有结构,并用PBS稀释。
老鼠实验
本研究按照当地伦理委员会的指导方针进行。饲养条件和程序由法国关于保护实验动物的法律规定(法国兽医服务授权# 78-149)。6周龄C57BL/6J小鼠组(n=每组8只)(Janvier,法国)被关在标准环境条件下的塑料笼子里,每组4只老鼠,在国家农艺研究所的动物设施中免费获得食物和水。
DNBS-Induced结肠炎
在轻度麻醉下,单次直肠内灌注DNBS (100 mg)诱导小鼠结肠炎。公斤−1在30%乙醇中稀释。在整个长时间实验中,从DNBS (MPBio)灌注前7天至小鼠死亡,每天灌胃重组菌株(LL-pILEMPTY和LL-pILMAM 5 × 10)9CFU/200 μL/只)或PBS。
每天监测小鼠的体重减轻情况。第4天处死小鼠,中线切开腹部,切除降结肠和肠系膜淋巴结(Mesenteric lymph Node, MLN)。MLN在RPMI培养基中冷藏,捣碎后计数细胞,用抗cd3和抗cd28在37°C和5% CO刺激48小时2.用PBS冲洗结肠,沿肠系膜边缘打开,清洗并切开,进行细胞因子测定。
DSS-Induced结肠炎
从第0天到第7天,通过口服溶解在饮用水中的分子量为36,000-50,000的2.5% (w/v)右旋糖酐硫酸钠盐(DSS)诱导小鼠结肠炎。在整个长时间实验中,从DSS给药前7天至祭祀日(D14),小鼠灌胃重组菌株(LL-pILEMPTY和LL-pILMAM-5 × 10)9CFU/200 μL/只)或PBS。
每天监测小鼠的体重减轻、粪便稠度和粪便潜血(Hemoccult, Beckman Coulter)。根据方案计算了疾病活动指数(DAI)库珀等人(1993).第14天处死小鼠,按上述方法收集MLN和结肠。
结肠蛋白质提取
将1厘米的结肠组织用GentleMax™(Miltenyl Biotec)在1ml PBS加抗蛋白酶(Roche)中捣碎。裂解液离心,上清采用ELISA (Mabtech)检测细胞因子水平。检测的细胞因子为Th1相关细胞因子(IFNγ和IL12);th2相关细胞因子(IL4和IL5);th17相关细胞因子(IL17)和treg相关细胞因子(IL10和TGFβ), Th22相关细胞因子(IL22)和IL6 (NF-κ b通路)。
受刺激淋巴细胞分泌白介素
从小鼠分离的肠系膜淋巴结(MLN)捣碎并过滤(70 μm, BD biosciences)。用流式细胞仪(Accuri C6)计数淋巴细胞,用100单位链霉素、青霉素、PAA实验室和10%胎牛血清(FCS) (Lonza)(浓度为2,5.10)悬浮在RPMI (Lonza)中6细胞/mL, 24孔板(Costar)与抗cd3和抗cd28抗体预孵育,每种抗体4 μg/mL (eBioscience)在0.5% FCS的PBS中。在37°C, 5% CO下孵育48小时2ELISA (Mabtech)检测细胞因子水平。检测的细胞因子为Th1相关细胞因子(IFNγ);th2相关细胞因子(IL5);th17相关细胞因子(IL17)和treg相关细胞因子(IL10和TGFβ)以及Th22相关细胞因子(IL22)。
新(分析在活的有机体内)
采用NF-κB-荧光素酶转基因小鼠模型,荧光素酶表达受NF-κB启动子调控,检测MAM对NF-κB通路的影响在活的有机体内.用0.1%氯胺酮(Imalgene 1000, Merial, France)、0.06%木lazine (Rompun, Alcyon, France)和15 mg/mL的荧光素混合麻醉小鼠,腹腔注射(50 μl)。采用IVIS法评价NF-κB重组小鼠的发光特性(在活的有机体内成像系统)200 (Perkin Elmer) D2和D4在DNBS刺激后。感兴趣区域(ROI)的测量是通过光子量化获得的。
统计分析
所有统计数据和图形都在Prism-GraphPad上执行®.结果以均数±s.e.m表示,Mann-Whitney检验具有统计学意义。人们认为*P< 0.05, **P< 0.01, ***P< 0.001。
结果
MAM通过降低NF-κB激活、增加调节和修复通路对dnbs诱导的结肠炎具有保护作用
用LL-pILMAM或LL-pILEMPTY治疗或不治疗NF-κ b -荧光素酶小鼠诱导结肠炎。用IVIS直接监测活体动物NF-κB活化情况。在D4时,用LL-pILMAM处理的DNBS诱导的结肠炎小鼠的发光低于LL-pILEMPTY或对照小鼠(PBS)。此外,在LL-pILMAM处理小鼠中,NF-κB信号从D2到D4没有增加,而LL-pILEMPTY和对照小鼠中NF-κB信号增加。这表明LL-pILMAM通过抑制NF-κB通路具有较强的保护作用。感兴趣区域(ROI)的测量证实了这些证据(图1).
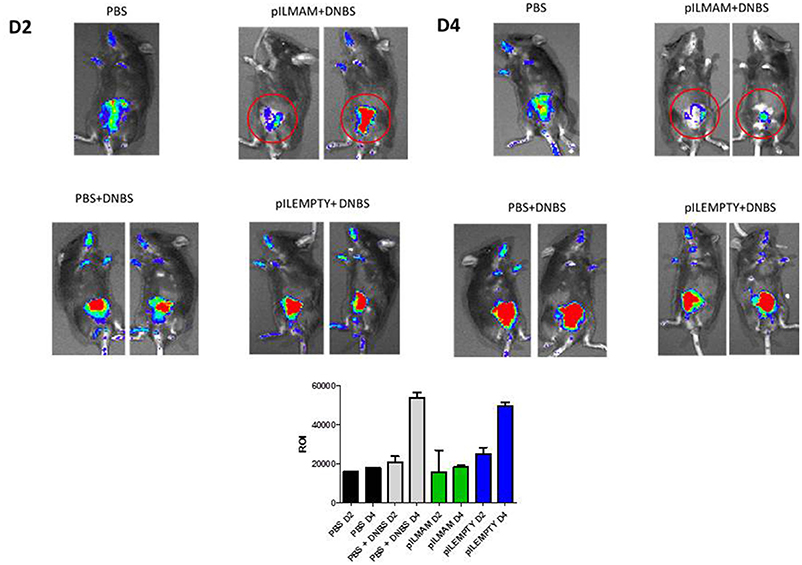
图1。NF-κB通路的抑制作用在活的有机体内LL-pILMAM管理后.NF-κB荧光素酶小鼠为NF-κB调控下表达荧光素酶的转基因小鼠,在DNBS直肠内注射(D0)前7天口服PBS、LL-pILEMPTY或LL-pILMAM,直至死亡(D4)。荧光法检测NF-κB活化情况在活的有机体内使用IVIS光谱对整个动物进行检测。ROI(感兴趣区域)测量用于确定有多少光子从源辐射。
在DNBS给药后4 d监测MLN淋巴细胞分泌的Pro和抗炎细胞因子。如图所示2经LL-pILMAM处理的小鼠淋巴细胞上清中il - 17、IFNγ和IL5明显低于LL-pILEMPTY和对照小鼠。与LL-pILEMPTY小鼠相比,LL-pILMAM小鼠il - 10浓度显著升高,但与对照动物相比无统计学差异。然而,TGFβ和IL22浓度在各组小鼠中没有观察到差异(图2)2).
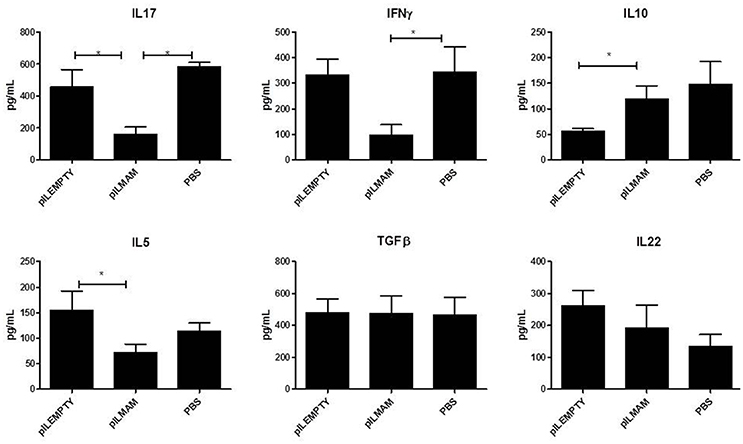
图2。dnbs诱导的结肠炎模型中MLN活化淋巴细胞分泌的细胞因子.NF-κB荧光素酶小鼠在DNBS直肠内注射(D0)前7天口服PBS、LL-pILEMPTY或LL-pILMAM,直至死亡(D4)。在D4时,MLN被撤回,分离的淋巴细胞被抗cd3 /抗cd28抗体重新激活。ELISA法检测活化48 h后培养基中细胞因子浓度。*P< 0.05。
同时,从结肠组织中提取蛋白质,并测定细胞因子浓度。我们观察到,与LL-pILEMPTY和对照小鼠相比,LL-pILMAM处理小鼠的TGFβ含量显著增加。此外,与LL-pILEMPTY小鼠相比,LL-pILMAM小鼠和对照组小鼠的IL5和IL17细胞因子水平下降3.).我们没有观察到各组小鼠中IL4和IL10的产生有任何差异。值得注意的是,与对照组小鼠相比,LL-pILEMPTY治疗诱导了IL5, IL17和IFNγ的增加。
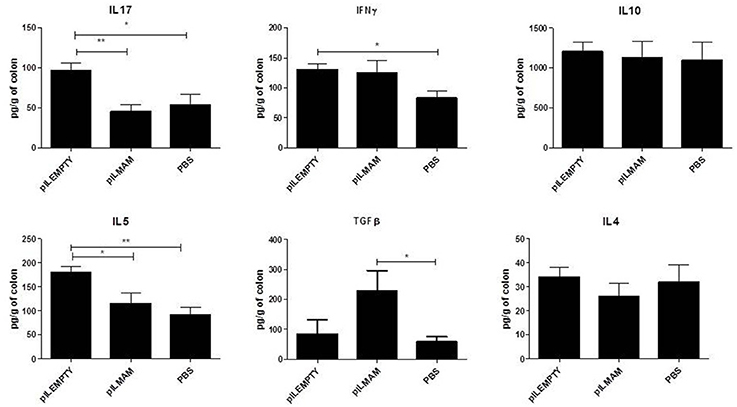
图3。dnbs诱导的结肠炎模型中结肠组织产生的细胞因子.NF-κB荧光素酶小鼠在DNBS直肠内注射(D0)前7天口服PBS、LL-pILEMPTY或LL-pILMAM,直至死亡(D4)。D4时,结肠切除,蛋白提取。ELISA法检测蛋白提取物中细胞因子浓度。*P< 0.05, **P< 0.01。
Mam保护小鼠免受dss诱导的结肠炎
为了确定MAM的局部生产对另一种化学诱导的结肠炎模型的影响,我们对口服LL-pILMAM或LL-pILEMPTY或PBS的小鼠进行了dss诱导的结肠炎模型。重组细菌在结肠炎诱导前、诱导中、诱导后7天给予。我们没有观察到各组小鼠的体重减轻有任何差异(图4).与pILEMPTY或对照小鼠相比,口服LL-pILMAM可降低D5时的DAI。在D8和D9时,DAI差异仅与pILEMPTY处理的小鼠相比显著。在结肠炎的这个阶段,每天给药细菌似乎增加了DAI(图4 b).MAM对出血的影响尤其显著(图4摄氏度).
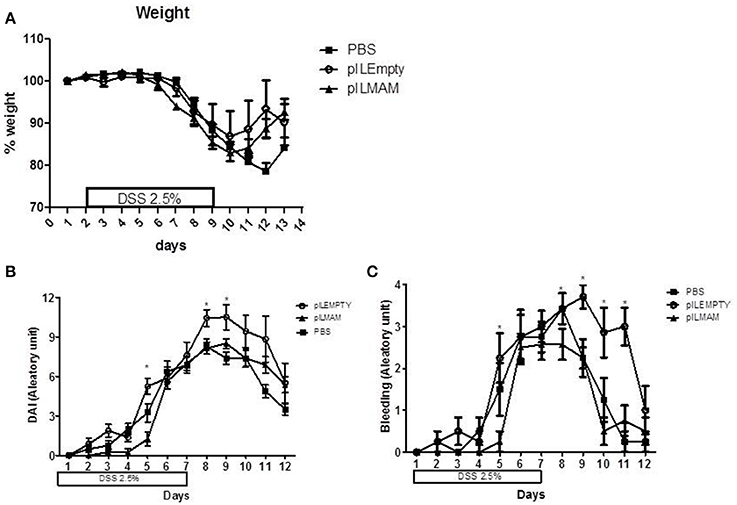
图4。MAM对dss诱导的结肠炎模型宏观评分的影响.小鼠在结肠炎诱导前和诱导期间7天口服LL-pILMAM、LL-pILEMPTY或PBS。连续7天(d0 ~ d7)在饮用水中添加DSS诱导结肠炎。然后将DSS从饮用水中去除,让小鼠在5天内恢复(D7-D12)。重量(一)和戴(B)包括出血(C)每天进行监测。*P< 0.05。
在7天的炎症和5天的恢复后,去除MLN和结肠组织并分析免疫反应。在MLN上清液中,LL-pILMAM组与LL-pILEMPTY组相比,INFγ和IL17均降低(图5)与之前DNBS实验中观察到的相同。TGFβ也降低了,而IL5和IL10的浓度在各组小鼠中没有观察到差异。在结肠组织的蛋白质提取物中,我们只能观察到LL-pILMAM中IL-6与其他组相比有所下降(图6).各组小鼠IFNγ、IL-10、IL-12、TGFβ和IL-22浓度无差异。
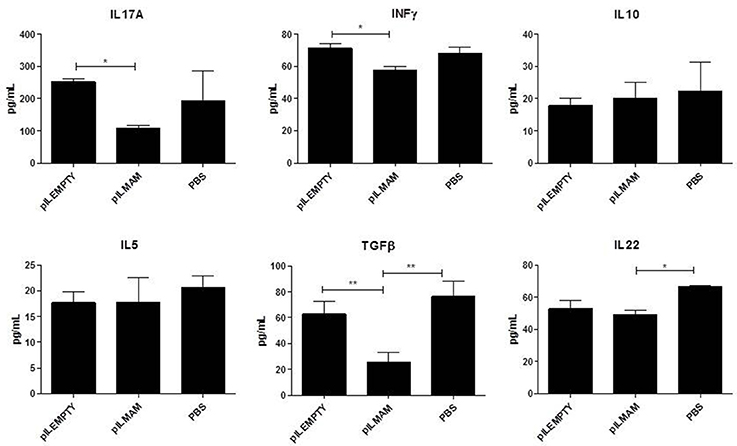
图5。dss诱导结肠炎模型中MLN活化淋巴细胞分泌的细胞因子.小鼠在结肠炎诱导前和诱导期间7天口服LL-pILMAM、LL-pILEMPTY或PBS。连续7天(d0 ~ d7)在饮用水中添加DSS诱导结肠炎。然后将DSS从饮用水中去除,让小鼠在5天内恢复(D7-D12)。D12时处死小鼠,退出MLN,分离细胞,用anti- d3 /anti-CD28抗体重新激活淋巴细胞。ELISA法检测活化48 h后培养基中细胞因子浓度。*P< 0.05, **P< 0.01。
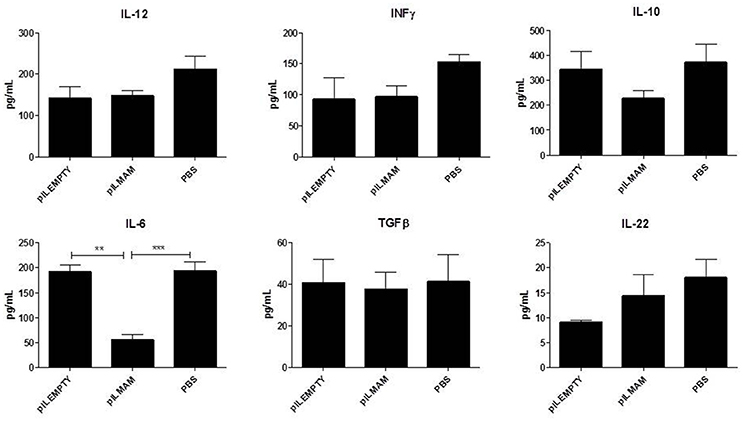
图6。dss诱导的结肠炎模型中结肠组织产生的细胞因子.小鼠在结肠炎诱导前和诱导期间7天口服LL-pILMAM、LL-pILEMPTY或PBS。连续7天(d0 ~ d7)在饮用水中添加DSS诱导结肠炎。然后将DSS从饮用水中去除,让小鼠在5天内恢复(D7-D12)。D12时处死小鼠,取结肠,提取蛋白。ELISA法检测蛋白提取物中细胞因子浓度。**P< 0.01, ***P< 0.001。
讨论
MAM的抗炎特性通过抑制NF-κB来表征在体外以及dnbs诱导的结肠炎模型对体重减轻、宏观评分和MLN激活淋巴细胞分泌的IL-17A和IFNγ的降低的保护作用(Quévrain等,2016a .).本研究首次证实MAM可抑制NF-κB通路在活的有机体内采用NF-κ b -荧光素酶转基因小鼠。我们的结果清楚地表明,MAM cDNA在肠粘膜的传递减少了DNBS激活的NF-κB通路。
在dss诱导的结肠炎模型中,MAM并没有像dnbs诱导的结肠炎模型那样显著地改变体重减轻(Quévrain等,2016a .),但在数天内对疾病活动指数(DAI)表现出积极作用,特别是对出血。DAI是一种主要的宏观指标,通过综合不同评分、出血、大便稠度和体重减轻等指标来建立,反映消化道的整体生理状态。这些结果表明,MAM可能能够恢复组织完整性,但其机制尚不清楚,因为参与组织修复的细胞因子IL22略有减少。需要注意的是,仅考虑pILEMPTY组而不考虑PBS对照组,这种差异是显著的。
我们还希望通过深入研究免疫反应描述和使用dss诱导的结肠炎模型,更准确地描述MAM的作用机制,这两种模型都是常用的,但具有不同的特征。尽管存在缺陷,但DNBS模型通常被描述为主要由Th1和Th17偏倚免疫反应驱动的CD的良好模型,而且对于研究适应性免疫反应在IBD中的作用非常有用(Kiesler等人,2015).另一种用于诱导结肠炎模型的主要化学物质是DSS。DSS模型被描述为更接近于Th2加剧免疫反应的UC。但DSS炎症也主要由先天免疫反应驱动(Chassaing等人,2014年).
首先,我们证实了我们的结果,在dnbs诱导的结肠炎中,LL-pILMAM组的MLN中IL-17A (Th17)和IFNγ (Th1)下降。抑制Th1和Th17细胞因子与抗结肠炎的有益作用相关(雷耶斯等人,2016).我们还可以观察到IL-5的减少和IL-10和Th2细胞因子的增加。需要注意的是,这些差异仅在LL-pILEMPTY组显著。在DSS模型中,MAM与DNBS模型中MLN淋巴细胞活化后分泌的IL17相比降低2倍。IFNγ也减少,但少于DNBS。令人惊讶的是,MAM处理组TGFβ和IL22的分泌低于pILEMPTY或PBS组。因此,MAM在两种模型中都对MLN中IL17和IFNγ的分泌有很强的抑制作用。
我们扩大了调查范围,寻找结肠细胞因子的产生。在DNBS模型中,我们观察到,与MLN一样,IL17和IL5在结肠中减少,但仅与pILEMPTY有关。更引人注目的是,我们发现在结肠组织中,参与Treg发育的TGFβ因MAM而增加。在健康状态下,Treg细胞在控制免疫稳态中发挥重要作用。在IBD中,Th1和Th17反应压倒了Treg细胞的控制机制。IBD患者肠道免疫失衡,向促炎一侧转移,导致肠道炎症。在DSS模型中,我们仅观察到MAM治疗小鼠结肠中IL6的产生减少。核因子- kb参与控制各种促炎细胞因子基因如IL6、IFNγ或IL17的激活,提示MAM处理后的DSS结肠炎小鼠NF-κB通路也被关闭。
如上所述,我们观察到在dnbs诱导的结肠炎中,与对照组相比,LL-pILEMPTY治疗的小鼠结肠组织中IL-5、IL-17和IFNγ含量增加,il - 10有下降趋势,即使差异没有统计学意义。此响应概要描述l . lactis作为一种促炎细菌。这和我们之前的结果是一致的l . lactis与PBMC共孵育的IL10/IL12比率非常低(索科尔等人,2008年;柯超等,2013)或TNFα激活后HT-29分泌的IL-8略有增加(柯超等,2013).这两个标准是促炎菌株的特征。然而,我们的细菌载体的这种轻微的促炎作用并没有抵消MAM的抗炎特性,因为与pILEMPTY治疗组相比,MAM治疗组的体重减轻更少或宏观评分更低(Quévrain等,2016a .).
我们的质粒转移策略导致MAM通过上皮细胞表达。我们没有证据证明MAM或其多肽自然产生f . prausnitzii(Quévrain等,2016b .)必须进入肠膜细胞内才能显示其保护作用。我们试图通过异种蛋白生产或化学合成的方法生产MAM或其多肽,但没有成功(Quévrain等,2016a .).尽管如此,我们通过上皮细胞产生MAM的策略模仿了用f . prausnitzii或其含有MAM的上清液抑制NF-kB,防止体重减轻,增加IL10 (索科尔等人,2008年), IL17降低(Zhang et al., 2014), IL6或IFNγ (Martín等,2014)来验证我们的方法。
我们的观察表明,MAM可以通过影响NF-κB活化的机制,降低DNBS和DSS结肠炎模型MLN和结肠组织中Th1和Th17促炎细胞因子的表达,增强DNBS模型中TGFβ的表达,从而增强宿主保护作用,减轻肠道炎症。然而,MAM不能降低通常在DSS结肠炎中诱导的Th2免疫反应,这导致保护效果较差。
这些结果可以被认为是表征MAM作用机制的新一步,从而开发基于使用这种生物活性分子的创新治疗策略。挑战在于定义与该蛋白相关的免疫调节,该蛋白的位置和用于传递的载体能够抑制炎症,并确定将这些知识转化为炎症疾病治疗的最佳方法。
作者的贡献
这项工作是由JC和PL起草的,他们获得了INRA转让的支持资金,用于这项研究。NB和CM负责实验,分析和解释数据。CD, PV和FC帮助他们开发了一些关键的实验,他们也参与了这些数据的解释。所有数据都与所有作者进行了讨论,以建立一个完整和连贯的分析。JC、PL和VA最终批准了要发布的版本。
利益冲突声明
作者声明,这项研究是在没有任何商业或财务关系的情况下进行的,这些关系可能被解释为潜在的利益冲突。
致谢
我们感谢来自Jouy en Josas INRA的动物设施成员在小鼠护理和实验方面的帮助;显微镜平台成员来自Micalis-INRA, Aubry C, Lamas B, da Costa G, Lavie-Richard M, Martin Rosique R, Natividad J, Lenoir M, Bridonneau C, Le-Guin S进行了富有成效的讨论和技术帮助。资金由国家资源研究所转让和cape - cofeecub(720/11项目)提供。
参考文献
阿尔梅达,J. F., Mariat, D., Azevedo, V., Miyoshi, A., de Moreno de LeBlanc, A., Del Carmen, S.等人(2014)。重组蛋白表面纤维连接蛋白结合蛋白A表达水平的相关性Lactococcus lactis质粒转移在体外而且在活的有机体内.BMC Microbiol。14:248。doi: 10.1186 / s12866 - 014 - 0248 - 9
Atarashi, K., Tanoue, T., Oshima, K., Suda, W., Nagano, Y., Nishikawa, H.等人(2013)。由合理选择的混合物诱导梭状芽胞杆菌菌株来自人类微生物群。自然500年,232 - 236。doi: 10.1038 / nature12331
Aubry, C., Michon, C., Chain, F., Chvatchenko, Y., Goffin, L., Zimmerli, s.c,等人(2015)。TSLP在重组乳酸菌肠黏膜水平对dss诱导的小鼠结肠炎模型的保护作用活细胞。细胞的事实。14日,176年。doi: 10.1186 / s12934 - 015 - 0367 - 5
Chassaing, B., Aitken, J. D., Malleshappa, M., and Vijay-Kumar, M.(2014)。右旋糖酐硫酸钠(DSS)诱导小鼠结肠炎。咕咕叫。Protoc。Immunol。104:15.215。im1525s104 doi: 10.1002/0471142735.
夏特尔、波瑟伦、阿梁、柯提耶、华、杰米、兰盖拉(2008)。在活的有机体内质粒从食品级转运乳酸球菌转移到小鼠上皮细胞。其他的基因。15日,1184 - 1190。doi: 10.1038 / gt.2008.59
德尔卡门,S.,苏里塔-土耳其,M.,利马,F. A.,科埃略·多斯桑托斯,J. S.,勒克莱尔,S. Y.,夏泰尔,J. M.等人(2013)。一种新的白细胞介素-10 DNA粘膜递送系统在小鼠模型中减弱肠道炎症。欧元。j . Inflamm。11日,641 - 654。doi: 10.1177 / 1721727 x1301100308
Gaboriau-Routhiau, V., Rakotobe, S., Lecuyer, E., Mulder, I., Lan, A., Bridonneau, C.等人(2009)。节段丝状细菌在肠道辅助T细胞反应的协调成熟中的关键作用。免疫力31日,677 - 689。doi: 10.1016 / j.immuni.2009.08.020
因诺岑,S.,吉马良斯,V., Miyoshi, A., Azevedo, V., Langella, P., Chatel, J. M.等(2009)。Lactococcus lactis表达或金黄色葡萄球菌纤维连接蛋白结合蛋白A或单核增生李斯特菌内源性A可以有效地内化和递送人上皮细胞中的DNA。达成。环绕。Microbiol。75年,4870 - 4878。doi: 10.1128 / AEM.00825-09
伊万诺夫,阿塔拉希,K.,曼奈尔,N.,布罗迪,E. L.,岛,T., Karaoz, U.等(2009)。节段丝状细菌诱导肠道Th17细胞。细胞139年,485 - 498。doi: 10.1016 / j.cell.2009.09.033
科乔,N., Chain, F., Gratadoux, J. J., Blugeon, S., Bertho, N., Chevalier, C.等(2013)。通过大规模筛选,确定了一株抗小鼠流感病毒感染的新型植物乳杆菌益生菌候选菌株。达成。环绕。Microbiol.79年,1491 - 1499。doi: 10.1128 / AEM.03075-12
Kiesler, P., Fuss, I. J. and Strober, W.(2015)。炎症性肠病的实验模型。细胞Mol,肠胃醇。乙醇。1, 154 - 170。doi: 10.1016 / j.jcmgh.2015.01.006
Martín, R., Chain, F., Miquel, S., Lu, J., Gratadoux, J. J., Sokol, H.,等(2014)。共生细菌Faecalibacterium prausnitzii对dnbs诱导的慢性中重度结肠炎模型具有保护作用。Inflamm。肠道说。20岁,417 - 430。mib.0000440815.76627.64 doi: 10.1097/01.
Martín, R., Miquel, S., Chain, F., Natividad J. M., Jury, J., Lu, J.等(2015)。Faecalibacterium prausnitzii预防慢性低度炎症小鼠模型的生理损伤。BMC Microbiol。15:67。doi: 10.1186 / s12866 - 015 - 0400 - 1
马兹曼尼安,刘春华,齐亚纳博斯,A. O.和卡斯珀,D. L.(2005)。共生细菌的一种免疫调节分子指导宿主免疫系统的成熟。细胞122年,107 - 118。doi: 10.1016 / j.cell.2005.05.007
马兹曼尼亚,S. K. Round, J. L.和Kasper, D. L.(2008)。微生物共生因子预防肠道炎症性疾病。自然453年,620 - 625。doi: 10.1038 / nature07008
Michon, C., Kuczkowska, K., Langella, P., Eijsink, V. G., Mathiesen, G.和Chatel, J. M.(2015)。抗dec -205单链Fv破片的表面显示乳杆菌增加内化和质粒转移到树突细胞在体外而且在活的有机体内.活细胞。细胞的事实。14日,95年。doi: 10.1186 / s12934 - 015 - 0366 - 6
Miquel, S., Martin, R., Rossi, O., Bermudez-Humaran, L., Chatel, J., Sokol, H.等人(2013)。Faecalibacterium prausnitzii以及人体肠道健康。咕咕叫。当今。Microbiol。16, 255 - 261。doi: 10.1016 / j.mib.2013.06.003
Quévrain, E., Maubert, M. A., Michon, C., Chain, F., Marquant, R., Tailhades, J.等(2016a)。一种抗炎蛋白的鉴定Faecalibacterium prausnitzii这是一种缺乏克罗恩病的共生细菌。肠道.65年,415 - 425。doi: 10.1136 / gutjnl - 2014 - 307649
Quévrain, E., Maubert, M. A., Sokol, H., Devreese, B.和Seksik, P. (2016b)。抗炎蛋白MAM的存在,来自Faecalibacterium prausnitzii在肠道生态系统中。肠道65年,882年。doi: 10.1136 / gutjnl - 2015 - 311094
雷耶斯,J. L.,洛佩斯,F.,梁,G.,曼奇尼,N. L.,马蒂斯,C. E.,王,A.等(2016)。用虫寄生抗原处理会导致CCR2的募集+骨髓细胞过继移植可改善结肠炎。感染。Immun。84年,3471 - 3483。doi: 10.1128 / IAI.00681-16
Round, J. L.和Mazmanian, S. K.(2017)。诱导Foxp3+由肠道菌群的共生细菌调节t细胞的发育。Proc。国家的。学会科学。美国107年,12204 - 12209。doi: 10.1073 / pnas.0909122107
索科尔,H., Pigneur, B., Watterlot, L.,拉赫达里,O., bermuez - humaran, L. G., Gratadoux, J. J.等(2008)。Faecalibacterium prausnitzii是一种抗炎共生细菌,通过克罗恩病患者肠道菌群分析确定。Proc。国家的。学会科学。美国105年,16731 - 16736。doi: 10.1073 / pnas.0804812105
Souza, b.m., Preisser, t.m., Pereira, v.b., Zurita-Turk, m.d Castro, c.p., da Cunha, v.p.,等人(2016)。Lactococcus lactis携带编码IL-4的pValac真核表达载体通过增加il -10产生调节细胞的水平来减少化学诱导的肠道炎症。活细胞。细胞的事实。15日,150年。doi: 10.1186 / s12934 - 016 - 0548 - x
闫芳,曹海华,盖,T. L.,怀特海德,R.,华盛顿,M. K.,波尔克,D. B.(2007)。益生菌产生的可溶性蛋白调节肠道上皮细胞的生存和生长。胃肠病学132年,562 - 575。doi: 10.1053 / j.gastro.2006.11.022
关键词:Faecalibacterium prausnitzii、炎症、结肠炎模型、MAM(微生物抗炎分子)、Lactococcus lactisNF -κB
引用:Breyner NM, Michon C, de Sousa CS, Vilas Boas PB, Chain F, Azevedo VA, Langella P和Chatel JM (2017Faecalibacterium prausnitzii通过抑制NF-κB通路对DNBS和dss诱导的小鼠结肠炎模型有保护作用。前面。Microbiol.8:114。doi: 10.3389 / fmicb.2017.00114
收到:2016年10月25日;接受:2017年1月17日;
发表:2017年2月1日。
编辑:
安德里亚Gomez-Zavaglia,阿根廷食品冷冻技术研究与发展中心(CIDCA, CONICET)版权©2017 Breyner, Michon, de Sousa, Vilas Boas, Chain, Azevedo, Langella和Chatel。这是一篇开放获取的文章,根据创作共用署名许可(CC BY).在其他论坛上的使用、分发或复制是允许的,前提是原作者或许可人注明出处,并按照公认的学术惯例引用本刊上的原始出版物。不得使用、分发或复制不符合这些条款的内容。
*通信:Jean M. Chatel,jean-marc.chatel@inra.fr
__这些作者对这项工作做出了同样的贡献。
 Natalia M. Breyner
Natalia M. Breyner Cristophe (
Cristophe ( Cassiana S. de Sousa
Cassiana S. de Sousa 普莉希拉·b·维拉斯·博阿斯
普莉希拉·b·维拉斯·博阿斯 Florian链
Florian链 Vasco A. Azevedo
Vasco A. Azevedo 菲利普Langella1而且
菲利普Langella1而且 Jean M. Chatel
Jean M. Chatel