修改后:二五年十一月二十八日
接受:二六年一月十四日
网上发表:二六年六月二十一日
目的分析了不同双歧杆菌菌株对非炎症和炎症肠上皮HT-29细胞(iec)的影响。
方法利用HT-29细胞中的报告基因系统检测双歧杆菌攻毒后或LPS攻毒后细菌预处理后的NF-κB活化水平。用正常HT-29细胞检测IL-8蛋白和促炎基因的表达。
结果:双歧杆菌均未诱导核因子κB (NF-κB)活化,表明双歧杆菌本身不会诱导IECs炎症事件。然而,8种双歧杆菌中有6种以剂量和菌株依赖的方式抑制脂多糖(LPS)诱导的NF-κ b活化。相比之下,在肿瘤坏死因子-α (TNF-α)攻击下,NF-κB的激活不受双歧杆菌的影响,这表明双歧杆菌对lps诱导的IECs炎症的抑制作用是特异性的。在6个抑制阳性双歧杆菌中有2个显示,lps诱导的NF-κB活化抑制伴随着白细胞介素8 (IL-8)分泌的剂量依赖性降低,以及IL-8、TNF-α、环氧化酶2 (Cox-2)和细胞间粘附分子1 (ICAM-1) mRNA水平的降低。
结论:双歧杆菌的某些菌株能有效抑制脂多糖诱导的炎症,因此可能是益生菌干预慢性肠道炎症的合适候选者。
- 引用:李建军,张建军,李建军,等。双歧杆菌抗炎作用的研究进展。世界J胃肠醇2006;12 (23): 3729 - 3735
- URL:https://www.wjgnet.com/1007-9327/full/v12/i23/3729.htm
- DOI:https://dx.doi.org/10.3748/wjg.v12.i23.3729
炎症性肠病,如克罗恩病(CD)和溃疡性结肠炎(UC)是多因素疾病,以肠上皮慢性炎症为特征。除了遗传易感性之外[1],肠道菌群似乎参与了引发炎症,正如在几个动物模型中观察到的那样,无菌动物没有引起结肠炎[2-4]。有研究表明,肠道菌群耐受性的破坏和调节性t细胞的功能障碍与慢性肠道炎症的发生有关[5-8]。
介导炎症反应的核心转录因子之一是核因子κB。激活后,通过TNF-α、IL-1β或LPS等多种刺激,NF-κB易位至细胞核[9,10],它调节一系列参与急性损伤反应和慢性肠道炎症的基因的转录,包括IL-1β、TNF-α、IL-6、IL-8、IL-12、Cox-2、ICAM-1、血管内皮生长因子-1、t细胞受体-α和主要组织相容性复合体II类分子的基因[11,12]。LPS通过toll样受体4 (TLR4)激活NF-κB [13]。在LPS与TLR4实际结合之前的事件包括LPS结合蛋白(LBP)和中间受体CD14[14,15]。LBP将LPS传递到CD14,然后CD14促进LPS与由TLR4和MD-2组成的LPS受体复合物结合,MD-2是通过TLR4传递LPS信号所必需的共受体[16]。在单核细胞和巨噬细胞上,CD14被糖基磷酸肌醇锚定物膜结合[17]。用LPS刺激内皮细胞和上皮细胞需要第二种形式的CD14,即可溶性CD14 (sCD14)[18]。
越来越多的证据表明,在慢性肠道炎症中,IECs上TLR4和CD14的表达异常。在正常情况下,TLR4和CD14在IECs中的表达水平很低在活的有机体内[19,20.]并且局限于隐窝的未分化细胞,这些细胞不会暴露于大量的腔内抗原[21]。相比之下,两种结肠炎动物模型的IECs中TLR4和CD14的表达均显著升高[22,23]和IBD患者[19]。对这种增加的表达的一种可能的解释可能来自基因研究。TLR4细胞外区域的Asp299Gly等位基因频率较高,CD14基因-159位置的T等位基因和TT基因型与CD和UC呈正相关[24-27]。通过IECs中TLR4和CD14水平升高而产生的异常LPS信号传导可能导致IBD中持续的粘膜炎症。
双歧杆菌是革兰氏阳性的厌氧微生物,主要存在于健康婴儿和成人的结肠中。在母乳喂养的婴儿中,出生后不久,荧光检测到粪便样本中高达90%的细菌原位杂交是双歧杆菌[28它们仍然占成年菌群的3%-5% [29]。因此,双歧杆菌无疑是人类结肠菌群的主要物种之一[30.]。的基因组序列分析与注释b . longumNCC2705说明了这种细菌与其人类宿主的密切关系[31]。一些有益的健康效应被认为与结肠中双歧杆菌的存在有关[32-41]。基于这些特性,双歧杆菌在益生菌中的应用越来越受到关注,无论是在制药应用还是在乳制品中[42]。其中一个应用是它们在益生菌干预慢性肠道炎症中的应用。含有双歧杆菌的益生菌已被证明可有效减轻几种啮齿动物模型和IBD患者的炎症严重程度[38,43-47]。
在本研究中,双歧杆菌的选择对IECs的影响进行了研究在体外模拟IECs对LPS反应性增强的情况。在该模型中,几种双歧杆菌对lps诱导的IECs炎症反应的拮抗潜力被证明是通过阻断NF-κB激活介导的。这表明一些双歧杆菌属系,尤指b . bifidum,可能是益生菌干预IBD的良好候选者。
所使用的所有菌株见表1.实验中,细菌在37℃下培养16 h(双歧杆菌:de Man-Rogosa Sharpe培养基,0.5 g/L半胱氨酸,厌氧;大肠杆菌:脑心输注介质,有氧;所有媒体BD Difco,巴塞尔,瑞士)。HT-29细胞维持在50% CO下2在DMEM中(4.5 g/L葡萄糖;Amimed,巴塞尔,瑞士)添加100 mL/L胎牛血清(FCS;Amimed), 10 mL/L非必需氨基酸(NEAA, Sigma,巴塞尔,瑞士),10 mL/L青霉素-链霉素溶液(pen-strep, Sigma)。用pNF-κB-SEAP-NPT质粒稳定转染HT-29细胞系,获得HT-29克隆34个细胞。48]。该质粒含有分泌性碱性磷酸酶(SEAP)的报告基因。它含有融合到单纯疱疹病毒胸苷激酶启动子tata样启动子区域的κB4增强子元件,允许在NF-κB信号通路激活后报告基因的表达。SEAP编码序列之后是SV40晚期聚腺苷化信号,以确保SEAP转录物在真核细胞中得到正确和有效的处理。载体主干还包含一个用于复制的pUC起源和一个用于繁殖和选择的氨苄西林抗性基因大肠杆菌.此外,它还含有新霉素磷酸转移酶基因,是真核细胞遗传素抗性的优势选择标记。放大后大肠杆菌使用lipofectamine (Invitrogen, Basel, Switzerland)将质粒TG1转染到HT-29细胞中等[48用重组人TNF-α (10 μg/L, R&D Systems, Oxon, England)作为刺激,稳定克隆34表现出良好的报告基因激活动力学,用于报告基因检测。将HT-29克隆34个细胞培养于含有100 mL/L FCS、10 mL/L NEAA、0.5 g/L遗传素的DMEM中;英杰公司)。实验中,HT-29和HT-29克隆34个细胞均以2 × 10的倍率接种5细胞/mL, 12孔格式细胞培养板(Falcon®(Milian, Geneva, Switzerland),并在各自的培养基中培养,直到达到90%-100%的融合。在这个阶段,大约是1 × 106细胞/孔计数。
按上述方法培养HT-29或HT-29克隆34个细胞。在90%-100%汇合时,洗涤细胞,将培养基改为0.9 mL DMEM,加入100 mL/L FCS, 10 mL/L NEAA, 50 mmol/L Hepes (Invirogen)和青霉素G (100 kU/L;丙烯酰胺)。按照上述方法培养细菌,并在指定的感染倍数(莫伊)加入0.1 mL细胞培养基中。在一些实验中,细胞与细菌一起预孵育1小时,然后用TNF-α (10 μg/L)或LPS (10 μg/L,血清型B55:O5;σ)。如有指示,在50ml /L人乳(HM)的存在下进行攻毒。从不同的母亲(哺乳期第20天)抽取乳汁并汇总。本研究使用的HM池含有26 mg/L的sCD14 (ELISA测定;P.仆人,个人沟通)。孵育16 h后,离心收集上清液,用于定量SEAP或IL-8。通过台盼蓝(Sigma)排除镜连续检查真核细胞的活力,所有实验的真核细胞活力均为95%。
使用PhosphaLight™试剂盒(Tropix, MA, USA)通过生物发光定量SEAP的磷酸酶活性。生物发光在TECAN SPECTRAFluor Plus光谱仪中以相对光单位(RLU)测量,积分时间为100毫秒,增益设置为100。数据分析采用XFlour 4.40版软件。RLU因实验性质不同而不同。如果使用多个实验来呈现数据和进行统计分析,则通过将数据归一化来校正这些日常变化,为阳性对照(LPS + HM)设置100 RLU单位。在一个实验中,10 μg/L TNF-α和10 μg/L LPS联合HM后,NF-κB活化水平相似。
采用IL-8酶联免疫吸附测定试剂盒(Diaclone, CT, USA),定量测定分泌的IL-8蛋白。用Dynex MRX微孔板读卡器(Dynex Technologies, Worthing, England)在450 nm处测量吸光度。
real-time PCR的方法是,在5% (v/v) HM存在下,用NucleoSpin对HT-29细胞进行细菌预处理和LPS攻毒4小时后分离RNA®RNAII试剂盒(Macherey-Nagel, d
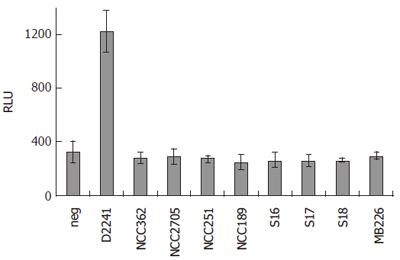
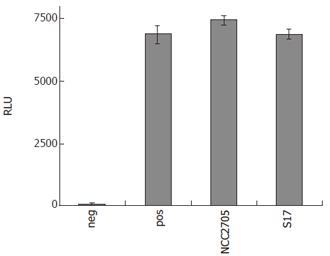
为了研究双歧杆菌对IECs炎症事件的影响,即对NF-κB激活的影响,我们在HT-29克隆34细胞中进行了报告基因检测。细胞与细菌(莫伊= 100)作用16 h。随后,在培养上清液中测定NF-κ b驱动的报告蛋白SEAP的活性(图2)1).而非致病性大肠杆菌D2241诱导了显著的报告基因活性,所有测试的双歧杆菌都没有诱导任何高于背景水平的NF-κB活化。同样的基于细胞的实验用于研究双歧杆菌对lps诱导的IECs炎症的影响。用LPS刺激HT-29克隆34个细胞16 h,随后在培养上清液中测定SEAP活性(表2)2).仅LPS对NF-κB活化的诱导作用是未刺激细胞的2.5倍。为了模拟IBD患者肠上皮中CD14表达增加的情况,在实验中加入50 mL/L含有sCD14的HM。添加HM可使lps诱导的NF-κB活化增加50倍,而HM单独不导致NF-κB活化。此外,在HM存在的情况下,没有一种双歧杆菌在刺激时诱导NF-κ b依赖性报告基因活性高于背景水平大肠杆菌D2241增强约200倍(数据未显示),进一步支持双歧杆菌不会诱导IECs炎症事件的结果。
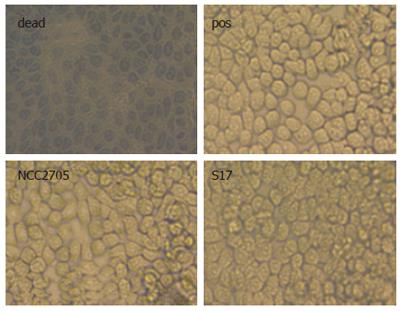
一些报告表明含有双歧杆菌的益生菌具有抗炎作用[38,44,49]。因此,本研究中使用的所有双歧杆菌在不同细菌剂量下对lps诱导的NF-κB活化的潜在抑制作用进行了评估。在一个莫伊结果1,没有双歧杆菌对nfκ b依赖性报告基因活性有影响(数据未显示)。如图所示2,在一个莫伊= 10,然而,预处理用b . lactisNCC362和b . bifidumNCC189、S16和S17显著降低NF-κ b依赖性报告基因活性,为阳性对照的47%-71%。当预处理的细菌剂量进一步增加到每个细胞100个细菌(莫伊= 100),抑制作用b . bifidumNCC189和b . bifidumS17几乎完全(阳性对照的5%)b . lactisNCC362,b . longumNCC2705,b . adolescentisNCC251和b . bifidumS16为中度(阳性对照的20%-52%)。相比之下,b . longum /对象E18和b .谕令MB226对两者的SEAP激活均无抑制作用或仅有极轻微的抑制作用莫伊.为了评估双歧杆菌的物理存在是否需要其抑制作用,进一步的实验使用双歧杆菌预处理16 h的细胞培养基,然后使用过滤器灭菌去除双歧杆菌细胞。使用这种条件培养基对lps诱导的HT-29克隆34细胞的NF-κB活化没有任何抑制作用(数据未显示)。这些结果表明,8种双歧杆菌中有6种显著抑制lps诱导的IECs中NF-κ b的激活,并且双歧杆菌的这种抑制能力是菌株和剂量依赖性的。此外,双歧杆菌细胞在LPS攻击期间的存在是其抗炎作用所必需的,这表明这种抑制不是由于分泌的化合物。为了证明报告蛋白活性的降低不是高剂量细菌与LPS联合作用导致细胞凋亡的结果,我们用台锥蓝排斥法证实了细胞的活力。用两种代表性菌株(b . longumNCC2705和b . bifidumS17),在所有实验中,LPS + HM激发的双歧杆菌的生存能力为bb0 95%,这表明双歧杆菌抑制LPS诱导的报告基因活性不是由于细胞死亡(图17)3.).
为了进一步研究双歧杆菌对NF-κB激活后炎症事件的影响,我们在细菌预处理后的HT-29细胞中监测IL-8分泌和IL-8、TNF-α、COX-2和ICAM-1编码基因mRNA水平b . bifidum肌力和b . longumNCC2705和随后的LPS挑战。Pre-incubation与b . bifidumS17使IECs的IL-8分泌减少到阳性对照的20%左右莫伊= 10,在每个细胞100个细菌时能够完全抑制IL-8的分泌(表2)3.).有效抑制b . longumNCC2705仅在a莫伊= 100。因此,IECs对IL-8分泌的剂量反应与对NF-κ b驱动的SEAP报告基因活性的剂量反应相似。
| 治疗 | 引发(μg / L)1 | |
| 莫伊= 10 | 莫伊= 100 | |
| 无(未经处理的对照) | 2±1 | |
| 有限合伙人+嗯 | 36±3 | |
| NCC2705 /有限合伙人+ HM 1 | 30±2 | 7±3 |
| 肌力/有限合伙人+ HM 1 | 7±2 | 2±0 |
采用实时荧光定量PCR技术研究双歧杆菌预处理HT-29细胞对已知受NF-κB调控基因mRNA水平的影响。预处理与b . longumNCC2705和b . bifidumS17 at a莫伊= 100严重抑制了HM存在下LPS刺激HT-29细胞中IL-8、TNF-α、COX-2和ICAM-1基因的转录激活(表2)4).再一次。b . bifidumS17比b . longumNCC2705。综上所述,这些结果表明,选定的双歧杆菌菌株能够抑制lps诱导的iec炎症事件。
除LPS外,NF-κB可通过多种刺激被激活(见介绍)。因此,有趣的是,测试是否可以观察到双歧杆菌对除LPS以外的促炎刺激(如TNF-α)的类似抑制。在莫伊= 100时,当10 μg/L TNF-α攻毒HT-29克隆34个细胞时,所测双歧杆菌均未对NF-κ b依赖性报告基因活性产生抑制作用(图2)4).进一步实验采用低剂量TNF-α (1 μg/L)作为刺激,不同剂量细菌(莫伊= 10和100)。在所有测试条件下,双歧杆菌对TNF-α诱导的NF-κB活化均无抑制作用(数据未显示)。这些结果表明双歧杆菌对lps诱导的IECs中NF-κB活化的抑制能力是特异性的。
先前的研究表明,肠道菌群与IBD的发病机制有关[2-4]。CD14和TLR4在IECs中的表达升高[j]19]可能导致IBD患者的上皮持续炎症。另一方面,对于几种益生菌制剂,在培养的IEC系和慢性肠道炎症小鼠模型中对炎症的影响已被报道,但我们对益生菌下调肠道炎症的分子机制的理解明显缺乏。大多数关于益生菌抗炎作用的研究都是使用不同益生菌菌株的混合物进行的,主要是乳酸菌和双歧杆菌[50]。对于HT-29和T84细胞,研究表明,将这些细胞与含有8种不同菌株(包括3种双歧杆菌)的VSL#3孵育,可导致IL-8分泌减少,以响应非致病性攻击大肠杆菌或致病都柏林沙门氏菌[51]。在结肠炎IL-10敲除模型中,在饮食中引入VSL#3对结肠粘膜活检中基础和lps刺激的TNF-α分泌有抑制作用[44]。在相同的小鼠模型中,喂食含有b . infantiS 35624优于唾液l .UCC118有效降低胃肠道炎症总评分[38]。最后,VSL#3已成功用于治疗一些ibd [43,45]。
在这里,我们研究了双歧杆菌对IECs的影响,特别强调了lps诱导的炎症。据我们所知,这是第一次尝试表征单个双歧杆菌菌株的整个细胞的抗炎作用。在HT-29克隆34细胞中,没有一种双歧杆菌能诱导NF-κB的活化大肠杆菌D2241显著诱导该细胞系NF-κB驱动的报告基因活性。仅用LPS刺激HT-29克隆34细胞,仅诱导NF-κ b依赖性报告基因活性高于背景水平2.5倍。这与其他研究小组的结果一致,表明结肠上皮细胞对LPS的反应较差[20.]。然而,将HM作为sCD14的来源[52], HT-29 IECs对LPS的NF-κB应答显著增加。这一结果支持了先前的研究,即HM存在时HT-29细胞对LPS的反应性增加[52-54]。在牛奶存在的情况下,HT-29细胞对LPS的反应性增加可被抗cd14抗体阻断[52]。
乳环境下LPS对NF-κ b依赖性报告基因的激活可通过双歧杆菌预孵育抑制,且呈菌株依赖性和剂量依赖性b . bifidum菌株(NCC189、S16和S17)最有效。为了达到这种抑制效果,双歧杆菌细胞的存在是必要的,因为双歧杆菌预处理过滤器灭菌的细胞培养基对lps诱导的NF-κB活化没有任何抑制作用。这表明双歧杆菌不会主动分泌抗炎化合物,也不会从裂解细胞中释放。此外,HT-29细胞与b . longumNCC2705和b . bifidumLPS攻击前的S17降低了IL-8的分泌,并对TNF-α、IL-8、ICAM-1和COX-2基因的mRNA水平有显著抑制作用,这些基因均受NF-κB的调节[9]。在一项类似的研究中,VSL#3在条件永生化小鼠结肠细胞中抑制TNF-α攻击后NF-κB报告基因活性和MCP-1分泌[49]。在本实验中,没有一株双歧杆菌对TNF-α有抑制NF-κB活化的作用。这些结果表明,双歧杆菌干扰了LPS和TNF-α共同激活NF-κB途径上游的促炎信号。
两株乳酸菌脂质胆酸(LTA)能抑制LPS对HT-29细胞IL-8的分泌[j]。54]。最近的一项研究表明,LTA的组成对大鼠的免疫原性和抗炎能力有影响l .杆菌[55]。值得注意的是,与野生型相比,LTA脊骨缺乏d -丙氨酸取代的突变体表现出显著改善的抗炎特性。双歧杆菌发挥其抑制作用的机制仍有待阐明。一项对VSL#3混合物DNA的研究表明,双歧杆菌菌株的DNA可以有效地限制il -10缺陷小鼠和TNF-α激发的HT-29细胞的上皮促炎反应。然而,HT-29细胞对LPS的促炎反应并未被益生菌DNA抑制[56]。这在一定程度上排除了在实验中观察到的效应源于DNA从裂解的双歧杆菌中泄漏的可能性。此外,这表明双歧杆菌全细胞抑制炎症反应的机制不同于它们的DNA。
虽然益生菌的抗炎活性之前已经有报道,但据我们所知,这是第一次报道双歧杆菌对lps诱导的IECs炎症事件的特异性抑制作用,这表明双歧杆菌在下调促炎细胞因子中的作用[57]。双歧杆菌阻断脂多糖诱导的NF-κB活化,至少在一定程度上可以解释脂多糖对慢性肠道炎症的积极作用在活的有机体内通过防止暴露于LPS后促炎信号的进一步放大。我们的研究结果表明,抑制lps诱导的NF-κB活化的能力是菌株依赖的。尤其是…的菌株b . bifidum是益生菌干预胃肠道炎症性疾病的有希望的候选者。
C.U.R是由雀巢雀巢博士奖学金资助的。b .谕令MB226由D. Matteuzzi慷慨提供。P. Serrant好心地提供了一池母乳。
S-编辑Pan BR L-编辑Lakatos PL E-编辑Ma WH
| 1. | Bouma G炎症性肠病的免疫学和遗传学基础。Nat Rev immuno1.2003;3.: 521 - 533。[PubMed][DOI][本文引用:][引用于Crossref: 1283][引用于f6出版社:1376][文章影响:64.2][参考引文分析(0)] |
| 2. | Dianda L, Hanby AM, Wright NA, Sebesteny A, Hayday AC, Owen MJ。缺乏T细胞受体的小鼠在没有微生物环境的情况下不会发生结肠炎。我是J。.1997;150: 91 - 97。[PubMed][本文引用:] |
| 3. | 承包商NV(1), Baumgart DC, Wasik MA, Emerson SG, Carding SR.结肠炎小鼠的淋巴样增生、自身免疫和肠道上皮内淋巴细胞发育受损。J Immunol.1998;160: 385 - 394。[PubMed][本文引用:] |
| 4. | Sellon RK, Tonkonogy S, Schultz M, Dieleman LA, Grenther W, Balish E, Rennick DM, Sartor RB。在白细胞介素-10缺乏的小鼠中,肠道细菌是自发结肠炎和免疫系统激活的必要条件。感染Immun.1998;66: 5224 - 5231。[PubMed][本文引用:] |
| 5. | 库恩R, Löhler J, Rennick D, Rajewsky K, m |
| 6. | Duchmann R,凯泽1,Hermann E, Mayet W, Ewe K, Meyer zum b |
| 7. | Duchmann R, Schmitt E, Knolle P, Meyer zum b |
| 8. | 纽赖特MF, Fuss I, Kelsall BL, Presky DH, Waegell W, Strober W.诱导tgf - β介导的口服耐受性可消除小鼠实验性肉芽肿性结肠炎。J经验医学.1996;183: 2605 - 2616。[PubMed][DOI][本文引用:][引用于Crossref: 321][引自f6出版社:338][文章影响:11.9][参考引文分析(0)] |
| 9. | 李问我是维尔玛。nf - κ b在免疫系统中的调控。Nat Rev immuno1.2002;2: 725 - 734。[PubMed][DOI][本文引用:][引用于Crossref: 2902][引用于f6出版:3047][文章影响:138.2][参考引文分析(0)] |
| 10. | 海登女士,高晓华。nf - κ b信号转导。基因开发.2004;18: 2195 - 2224。[PubMed][DOI][本文引用:][引用于Crossref: 3002][引用于f6出版社:3153][文章影响力:158.0][参考引文分析(0)] |
| 11. | 巴恩斯PJ核因子- kappab:慢性炎症性疾病的关键转录因子。[英]医学.1997;336: 1066 - 1071。[PubMed][DOI][本文引用:][引用于Crossref: 3534][引自f6出版社:3732][文章影响:135.9][参考引文分析(0)] |
| 12. | 纽赖特MF[2]张建军,张建军,张建军,等。nf - κ b在肠道免疫和炎症反应中的作用。肠道.1998;43: 856 - 860。[PubMed][DOI][本文引用:][引用于Crossref: 246][引用于f6出版社:220][文章影响力:9.8][参考引文分析(0)] |
| 13. | 彰年代, Takeda K. toll样受体信号传导。Nat Rev immuno1.2004;4: 499 - 511。[PubMed][DOI][本文引用:][引用于Crossref: 6034][引用于f6出版社:6289][文章影响力:317.6][参考引文分析(0)] |
| 14. | 赖特SD, Tobias PS, Ulevitch RJ, Ramos RA。脂多糖(LPS)结合蛋白对巨噬细胞上一种新的受体识别的脂多糖颗粒进行调理。J经验医学.1989;170: 1231 - 1241。[PubMed][DOI][本文引用:][引用于Crossref: 227][引用于f6出版:250][文章影响:6.7][参考引文分析(0)] |
| 15. | 舒曼RR, Leong SR, Flaggs GW, Gray PW, Wright SD, Mathison JC, Tobias PS, Ulevitch RJ。脂多糖结合蛋白的结构与功能。科学.1990;249: 1429 - 1431。[PubMed][DOI][本文引用:][引用于Crossref: 1164][引用于f6出版社:1241][文章影响:35.3][参考引文分析(0)] |
| 16. | Shimazu R王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,王晓明,等。J经验医学.1999;189: 1777 - 1782。[PubMed][DOI][本文引用:][引用于Crossref: 1548][引用于f6出版:1600年][文章影响力:64.5][参考引文分析(0)] |
| 17. | Haziot一,陈绍平,刘建军,刘建军,刘建军。单核细胞分化抗原CD14通过磷脂酰肌醇连接固定在细胞膜上。J Immunol.1988;141: 547 - 552。[PubMed][本文引用:] |
| 18. | 普金J[3]张建军,张建军,李建军,等。脂多糖结合蛋白对人内皮细胞和上皮细胞活性的影响。美国国家科学基金委.1993;90: 2744 - 2748。[PubMed][DOI][本文引用:][引用于Crossref: 580][引用于f6出版社:620][文章影响:19.3][参考引文分析(0)] |
| 19. | 开罗E波多尔斯基DK。炎症性肠病患者肠上皮细胞toll样受体3 (TLR3)和TLR4表达的差异改变感染Immun.2000;68: 7010 - 7017。[PubMed][DOI][本文引用:][引用于Crossref: 937][引自f6出版社:987][文章影响力:40.7][参考引文分析(0)] |
| 21. | Furrie E李建军,李建军,李建军,等。toll样受体-2、-3和-4在人结肠粘膜相关菌中的表达及其调控。免疫学.2005;115: 565 - 574。[PubMed][DOI][本文引用:][引用于Crossref: 203][引用于f6出版社:212][文章影响:11.3][参考引文分析(0)] |
| 22. | Meijssen马, Brandwein SL, Reinecker HC, Bhan AK, Podolsky DK。白细胞介素-2缺乏小鼠结肠炎前肠上皮细胞基因表达的改变。我是物理学家.1998;274: G472-G479。[PubMed][本文引用:] |
| 23. | Ortega-Cava CF,石原S,马鲁美,川岛K,石村N, Kazumori H, Udagawa J, Kadowaki Y,木下Y. toll样受体4在小鼠肠道中的策略区室化。J Immunol.2003;170: 3977 - 3985。[PubMed][本文引用:] |
| 24. | 克莱恩W, Tromm A, Griga T, Fricke H, Folwaczny C, Hocke M, Eitner K, Marx M, Duerig N, Epplen JT。CD14基因的多态性与克罗恩病有关。[J]胃肠醇.2002;37: 189 - 191。[PubMed][DOI][本文引用:][引用于Crossref: 67][引自f6出版社:59][文章影响:3.2][参考引文分析(0)] |
| 25. | Obana N,高桥S, Kinouchi Y, Negoro K, Takagi S, Hiwatashi N, Shimosegawa T.溃疡性结肠炎与脂多糖受体基因CD14启动子多态性相关。[J]胃肠醇.2002;37: 699 - 704。[PubMed][DOI][本文引用:][引用于Crossref: 51][引用于f6出版:51][文章影响:2.4][参考引文分析(0)] |
| 26. | Franchimont D[2],吴建军,吴建军,吴建军,吴建军,吴建军,吴建军,吴建军,吴建军,吴建军,吴建军,吴建军,吴建军,吴建军。肠道.2004;53: 987 - 992。[PubMed][DOI][本文引用:][引用自Crossref: 435][引用于f6出版社:398][文章影响力:22.9][参考引文分析(0)] |
| 27. | Gazouli米, Mantzaris G, Kotsinas A, Zacharatos P, Papalambros E, Archimandritis A, Ikonomopoulos J, Gorgoulis VG。希腊人群中toll样受体4、CD14和CARD15/NOD2多态性与炎症性肠病之间的关系世界J胃肠醇.2005;11: 681 - 685。[PubMed][本文引用:] |
| 28. | Harmsen HJ, Wildeboer-Veloo AC, Raangs GC, wangenorp AA, Klijn N, Bindels JG, Welling GW。用分子鉴定和检测方法分析母乳喂养和配方奶喂养婴儿肠道菌群发育。[J]儿科胃肠病学杂志.2000;30.: 61 - 67。[PubMed][DOI][本文引用:][引用于Crossref: 967][引自f6出版社:942][文章影响力:42.0][参考引文分析(0)] |
| 29. | Harmsen HJ,何涛,陈德杰,王志强。广泛的基于16S rrna的探针用于检测人类粪便中的细菌。苹果环境微生物.2002;68: 2982 - 2990。[PubMed][DOI][本文引用:][引用于Crossref: 297][引用于f6出版社:305][文章影响:14.1][参考引文分析(0)] |
| 30. | Guarner F健康和疾病中的肠道菌群。《柳叶刀》.2003;361: 512 - 519。[PubMed][DOI][本文引用:][引用于Crossref: 2111][引用于f6出版社:2222][文章影响:105.6][参考引文分析(0)] |
| 31. | 马谢尔, Karmirantzou M, Snel B, Vilanova D, Berger B, Pessi G, Zwahlen MC, Desiere F, Bork P, Delley M.长双歧杆菌的基因组序列反映了其对人类胃肠道的适应性。美国国家科学基金委.2002;99: 14422 - 14427。[PubMed][DOI][本文引用:][引用于Crossref: 716][引用于f6出版社:747][文章影响:34.1][参考引文分析(0)] |
| 32. | 贝内曼氏金融李建军,李建军,李建军,等。双歧杆菌对人肠道上皮细胞的粘附作用及其对肠道病原菌-细胞相互作用的抑制作用。苹果环境微生物.1993;59: 4121 - 4128。[PubMed][本文引用:] |
| 33. | 萨维德拉JM, Bauman NA, young I, Perman JA, Yolken RH。给住院婴儿喂食两歧双歧杆菌和嗜热链球菌以预防腹泻和轮状病毒的传播。《柳叶刀》.1994;344: 1046 - 1049。[PubMed][DOI][本文引用:][引用于Crossref: 636][被f6引用,出版:501][文章影响力:21.9][参考引文分析(0)] |
| 35. | Yildirim Z温特斯DK,约翰逊MG。两歧双歧杆菌NCFB 1454产双歧杆菌B的纯化、氨基酸序列及作用方式J苹果微生物.1999;86: 45 - 54。[PubMed][DOI][本文引用:][引用于Crossref: 111][引自f6出版社:112][文章影响:4.6][参考引文分析(0)] |
| 37. | Asahara T,田中荣,田中平,田中平,等。双歧杆菌和半乳糖化寡糖的联合应用提高小鼠对肠道沙门氏菌血清型鼠伤寒杆菌感染的耐药性。J苹果微生物.2001;91: 985 - 996。[PubMed][DOI][本文引用:][引用于Crossref: 102][引自f6出版社:106][文章影响:4.6][参考引文分析(0)] |
| 38. | 麦卡锡J, O'Mahony L, O'Callaghan L, Sheil B, Vaughan EE, Fitzsimons N, Fitzgibbon J, O'Sullivan GC, Kiely B, Collins JK。两种益生菌菌株在白细胞介素10基因敲除小鼠体内的双盲安慰剂对照试验及其与细胞因子平衡的机制联系。肠道.2003;52: 975 - 980。[PubMed][DOI][本文引用:][引用于Crossref: 339][引用于f6出版:310][文章影响力:17.0][参考引文分析(0)] |
| 39. | Resta-Lenert年代,巴雷特·柯。活的益生菌保护肠上皮细胞免受肠侵入性大肠杆菌(EIEC)感染的影响。肠道.2003;52: 988 - 997。[PubMed][DOI][本文引用:][引用于Crossref: 418][引用于f6出版社:409][文章影响力:20.9][参考引文分析(0)] |
| 40. | Asahara T杨建军,李建军,李建军,李建军,李建军。双歧杆菌保护小鼠免受志贺毒素大肠杆菌O157: H7的感染。感染Immun.2004;72: 2240 - 2247。[PubMed][DOI][本文引用:][引用于Crossref: 210][引用于f6出版:216][文章影响:11.1][参考引文分析(0)] |
| 41. | L O’mahony,陈凯,陈建军,陈建军,陈建军,陈建军。肠易激综合征中乳杆菌和双歧杆菌的研究进展。胃肠病学.2005;128: 541 - 551。[PubMed][DOI][本文引用:][引用于Crossref: 991][引自f6出版社:1041][文章影响:55.1][参考引文分析(0)] |
| 43. | Gionchetti P, Rizzello F, Venturi A, Brigidi P, Matteuzzi D, Bazzocchi G, Poggioli G, Miglioli M, Campieri M.慢性眼袋炎患者口服细菌治疗的维持治疗:双盲,安慰剂对照试验。胃肠病学.2000;119: 305 - 309。[PubMed][DOI][本文引用:][引用于Crossref: 1070][引用于f6出版社:1120][文章影响力:46.5][参考引文分析(0)] |
| 44. | 马德森K,王晓东,王晓东,王晓东,王晓东,王晓东,王晓东。益生菌对肠道上皮屏障功能的影响。胃肠病学.2001;121: 580 - 591。[PubMed][DOI][本文引用:][引用于Crossref: 762][引用于f6出版社:805][文章影响:34.6][参考引文分析(0)] |
| 45. | Gionchetti P, Rizzello F, Helwig U, Venturi A, Lammers KM, Brigidi P, Vitali B, Poggioli G, Miglioli M, Campieri M.益生菌治疗预防袋炎发作:一项双盲,安慰剂对照试验。胃肠病学.2003;124: 1202 - 1209。[PubMed][DOI][本文引用:][引用于Crossref: 798][引用于f6出版社:855][文章影响力:39.9][参考引文分析(0)] |
| 46. | •R, Fedorak RN, Tannock GW, Madsen KL, Gionchetti P, Campieri M, De Simone C, Sartor RB。VSL#3益生菌混合物诱导活动性溃疡性结肠炎患者缓解。我是胃肠醇吗.2005;One hundred.: 1539 - 1546。[PubMed][DOI][本文引用:][引用于Crossref: 503][引用于f6出版:524][文章影响力:27.9][参考引文分析(0)] |
| 47. | Furrie E[2]张建军,张建军,张建军,张建军。长双歧杆菌联合治疗对溃疡性结肠炎患者炎症反应的影响:一项随机对照试验。肠道.2005;54: 242 - 249。[PubMed][DOI][本文引用:][引用于Crossref: 497][引用于f6出版:481][文章影响力:27.6][参考引文分析(0)] |
| 48. | 月球的肯塔基州,韩彬,李俊,金玉生。用于监测人HaCat转染细胞中NF-kappaB活性的基于细胞的检测系统。学生物化学肛门.2001;292。17 - 21:区间[PubMed][DOI][本文引用:][引用于Crossref: 94][引自f6出版社:95][文章影响:4.3][参考引文分析(0)] |
| 49. | 佩洛夫EO, Kojima K, Ropeleski MJ, Musch MW, Tao Y, De Simone C, Chang EB。益生菌通过蛋白酶体抑制核因子κ b,诱导结肠上皮细胞产生热休克蛋白。胃肠病学.2004;127: 1474 - 1487。[PubMed][DOI][本文引用:][引用于Crossref: 241][引用于f6出版社:251][文章影响:12.7][参考引文分析(0)] |
| 50. | 皮卡德C(1)双歧杆菌作为益生菌的生理效应及临床应用。营养品和药物.2005;22: 495 - 512。[PubMed][DOI][本文引用:][引用于Crossref: 397][引用于f6出版社:401][文章影响:22.1][参考引文分析(0)] |
| 51. | Otte JM波多尔斯基DK。革兰氏阳性和革兰氏阴性微生物对肠细胞功能的调节。J是胃、肝、胃物理吗.2004;286: G613-G626。[PubMed][本文引用:] |
| 52. | Labeta莫[2]刘建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,李建军,等。乳源性高表达模式识别受体CD14介导的乳源性细菌先天识别。J经验医学.2000;191: 1807 - 1812。[PubMed][DOI][本文引用:][引用于Crossref: 166][引自f6出版社:175][文章影响:7.2][参考引文分析(0)] |
| 53. | 比达尔K刘建军,刘建军,刘建军,等。人母乳中可溶性CD14在先天免疫应答中的作用。口腔医学学报.2001;59: 330 - 334。[PubMed][DOI][本文引用:][引用于Crossref: 55][引自f6出版:47][文章影响:2.5][参考引文分析(0)] |
| 54. | 比达尔K约氏乳杆菌La1和嗜酸乳杆菌La10的脂质胆酸可拮抗人肠上皮HT29细胞对脂多糖和革兰氏阴性菌的反应性。感染Immun.2002;70: 2057 - 2064。[PubMed][DOI][本文引用:][引用于Crossref: 82][引用于f6出版:85][文章影响力:3.9][参考引文分析(0)] |
| 55. | Grangette C,赵建军,李建军,李建军,李建军,李建军,李建军,李建军。植物乳杆菌抗炎能力的研究进展。美国国家科学基金委.2005;102: 10321 - 10326。[PubMed][DOI][本文引用:][引用于Crossref: 316][引自f6出版社:333][文章影响:17.6][参考引文分析(0)] |
| 56. | Jijon H[2],杨海峰,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军,杨建军。胃肠病学.2004;126: 1358 - 1373。[PubMed][DOI][本文引用:][引用于Crossref: 222][引用于f6出版:238][文章影响:11.7][参考引文分析(0)] |
| 57. | Staudt C.wehselwirkungen von bifidobakterien mit darmepithelzellen and mit extrazellulären matrix- and plasmaprotein[论文].德语:乌尔姆大学,2002;.[本文引用:] |