条文本
摘要
人体肠道微生物群是一个复杂的生态系统,可以调节人体宿主与环境的相互作用。肠道微生物和常用的非抗生素药物之间的相互作用是复杂和双向的:肠道微生物组的组成可以受到药物的影响,但反之亦然,肠道微生物组也可以通过酶作用改变药物的结构和改变其生物利用度、生物活性或毒性(药物微生物学)来影响个人对药物的反应。在癌症治疗中,肠道微生物群也可以间接影响个体对免疫疗法的反应。在这篇综述中,我们讨论了微生物和药物之间的双向作用,描述了常用的非抗生素药物诱导的肠道菌群变化及其潜在的临床后果,并总结了微生物群如何影响药物疗效及其在免疫治疗中的作用。了解微生物群是如何代谢药物和降低治疗效果的,将开启调节肠道微生物群以改善治疗的可能性。
- 质子泵抑制
- 免疫疗法
- 药物代谢
- 肠道微生物
这是一篇开放获取的文章,按照创作共用署名4.0未移植(CC BY 4.0)许可发布,该许可允许其他人复制、重新发布、混合、转换和基于此作品的任何目的,只要原始作品被正确引用,提供许可证链接,并说明是否进行了更改。看到的:https://creativecommons.org/licenses/by/4.0/.
来自Altmetric.com的统计
关键信息
常用的非抗生素类药物与肠道菌群之间存在着复杂的双向作用。
常用的药物如质子泵抑制剂、二甲双胍、选择性血清素再吸收抑制剂和泻药会影响肠道微生物组的组成和功能。
质子泵抑制剂诱导的肠道微生物组的变化可导致定植耐药性的降低和肠道感染的发展,包括艰难梭状芽胞杆菌感染。
肠道微生物组组成与抗肿瘤反应和免疫检查点抑制治疗的临床疗效相关。
肠道微生物可以通过酶转化药物结构和改变药物的生物利用度、生物活性或毒性来促进药物的疗效和安全性。
深入了解肠道菌群如何与常用药物相互作用,使干预措施能够调节肠道菌群并优化治疗效果。
简介
在过去的十年中,我们见证了令人兴奋的发现,将人类肠道微生物组的组成和功能与许多常见疾病和表型联系起来。相关研究记录了患有胃肠道表型(包括炎症性肠病、肠易激综合征和结直肠癌)以及其他系统和器官疾病(包括心血管和代谢疾病、自身免疫疾病和精神疾病)的个体中各种肠道细菌的丰度变化。1 - 9除了相关性分析之外,干预研究和动物研究不仅证明了肠道微生物群与几种疾病的相关性,而且证明了它们之间的因果关系。10此外,内源性和外源性因素对肠道微生物组组成的影响正日益被了解。
最近一个非常重要的发现是,许多常用的非抗生素药物——如质子泵抑制剂(PPIs)和二甲福明——改变了微生物组的组成和功能。11日12这些变化可能影响健康结果(就PPIs而言)或降低药物疗效(就二甲双胍而言)。与此同时,越来越多的数据表明,肠道微生物组可以通过酶作用改变药物的结构,改变其生物利用度、生物活性或毒性,直接影响个体对特定药物的反应——这种现象现在被称为药物微生物组学(图1).最后,在癌症治疗中,肠道微生物群可以通过影响宿主的总体免疫状态,间接影响个体对免疫疗法的反应。13这些令人兴奋的关于非抗生素药物和肠道微生物群之间双向作用的新见解是当前综述的重点。
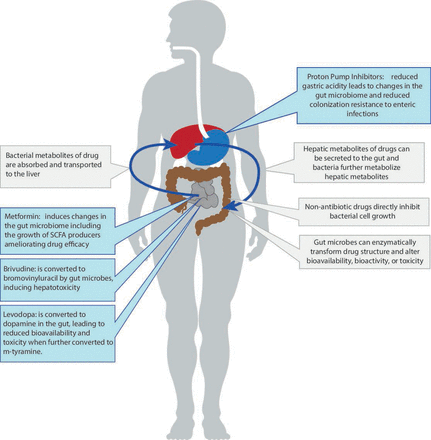
肠道微生物群与常用非抗生素药物之间不同的相互作用示意图概述。短链脂肪酸。
背景
肠道菌群研究进展
就在几十年前,我们分析肠道微生物群与人类健康之间关系的能力主要取决于巨大的技术挑战。在历史上,微生物组研究是使用培养方法进行的,其中一个或几个细菌物种被分离出来,并研究与一种疾病的关系。这项研究产生了许多重要的发现,但我们分析肠道生态系统其他组成部分的能力是有限的。细菌16S核糖体RNA基因测序技术的发展允许对肠道微生物组进行全面的分类评估,这极大地增加了我们对微生物组成的广泛变化的认识。最近,全基因组鸟枪测序,或宏基因组测序(MGS)已经成为研究微生物组的一种强大的方法。MGS不仅可以识别细菌,还可以识别病毒、原生动物和真菌,而且可以集中分析细菌基因和预测生物途径。然而,与所有基于测序的方法一样,MGS结果非常依赖于用于从粪便样本中分离DNA的方法,这是微生物组研究结果中技术差异的主要来源。14其他组学方法,如metatranscripics, metametabolomics和宏蛋白质组学,也越来越多地被用于获得肠道生态系统的全面图像。最后,培养组学分析允许对单个相关物种和菌株进行深入描述,再次成为了解特定类群与疾病相关作用的重要方法。
影响肠道微生物群的内在和外在因素
在下一代测序技术的帮助下,肠道微生物组分析已应用于多个人类队列。一个重要的发现是肠道生态系统个体间的巨大变异性:只有少数肠道微生物被大多数个体共享。例如,在3000个样本的欧洲数据集中,只有17种细菌被确定为所有样本95%的>的核心微生物组。15大多数细菌都是稀有的。在对1135个荷兰个体的种群研究中发现的639种物种中,469种(73%)存在于不到10个个体中。16这种个体间的高度差异性可能导致肠道微生物群执行的代谢功能的变化。
基于人类队列的分析进一步表明,肠道生态系统的动态特性反映了宿主与生活方式、饮食、生态和其他因素的复杂相互作用。数百个内在和环境因素影响健康个体的肠道微生物群,包括饮食、药物、吸烟、生活方式、宿主遗传和疾病。15日17在所有环境因素中,常用药物在肠道生态系统中发挥着特别重要的作用。
在人类队列中肠道微生物组组成与常用药物的关系
一些人类队列研究报告了使用特定药物与改变的微生物组成和功能图谱之间的联系表1).最早发现这一点的研究之一是在荷兰的生命线- deep队列中进行的,该研究报告了42种常用药物中的19种与微生物有关。17除抗生素外,许多人类靶向非抗生素药物与微生物组成的变化有关。与微生物相关的顶级药物包括PPIs、降脂他汀类药物、泻药、二甲双胍、β -受体阻滞剂和ACE抑制剂以及选择性血清素再摄取抑制剂抗抑郁药,在比利时佛兰德队列中也观察到类似的关联15在TwinsUK队列中18(表1).同样值得注意的是,这些药物-微生物的相关性大多是针对单个药物进行评估的。然而,我们知道患者经常服用多种药物,这种联合用药可能是评估药物-微生物相关性时的偏见来源。最近的一项研究进一步评估了综合用药和共病对肠道微生物群的影响。19这项研究对三个独立队列(包括炎症性肠病和肠易激综合征患者)的药物使用和肠道微生物群之间的关联进行了更深入的分析,发现41种药物类别中有19种与肠道微生物群相关。由于许多研究参与者使用多种药物,我们采用逐步的方法来回归出多种药物的影响。在对多药配伍进行统计校正后,PPIs、二甲双胍、抗生素和泻药仍显示出与微生物特征显著相关。19
尽管在多个人类队列中检测到的药物-微生物关联具有高度一致性,但估计效应大小的差异反映了不同欧洲国家和不同患者药物使用的差异。例如,在比利时Flemish队列中观察到的抗生素使用对微生物组成的影响高于荷兰lifeline - deep队列,这与比利时抗生素处方率高于荷兰的事实相一致。队列之间的年龄和性别差异也对药物使用的频率有很大影响,因此对观察到的结果也有很大影响。
影响肠道菌群的常用药物
质子泵抑制剂
PPIs是世界上最常用的药物之一,用于治疗胃酸相关疾病,如消化性溃疡、胃食管反流和消化不良,并用于预防非甾体抗炎药引起的胃十二指肠病变和出血。由于PPIs非常有效并且具有非常良好的安全性,因此在过去几十年里,PPIs的使用迅速增加。在荷兰,有200万人(约占人口的12%)现在按处方使用泮托拉唑或奥美拉唑,其他国家如英国也有类似的使用比例报告。20 21据估计,英国每年PPIs的总成本超过1亿英镑。22此外,由于PPIs在荷兰和许多其他国家都是非处方药,PPI使用者的总数将远远高于仅根据处方估计的数字。近年来,人们对慢性使用PPIs的安全性和潜在副作用给予了相当多的关注。尽管不良反应(ADR)的相对风险较低,但PPI使用者的全球数量较高,意味着发生ADR的患者绝对数量仍可能很高。虽然使用PPI有明确的循证适应症,但有研究表明,高达70%的PPI处方可能是不必要的,22在不符合循证处方标准的患者中,使用PPIs作为应激性溃疡的预防是这一现象的主要原因。另一个重要的因素是,一旦开始使用PPIs,很少会重新评估PPI最初的适应症,随后试图停止它们,导致不必要的慢性使用。23日24
来自荷兰的大规模基于人群的研究表明,PPIs是与肠道微生物群多样性下降和分类变化最相关的药物。17将这一分析扩展到16 s的数据,包括来自炎症性肠病队列和肠易激综合征队列的数据,在所有三个队列中再现了这些变化,并显示与非使用者相比,PPI使用者中高达20%的细菌类群的相对丰度发生了改变(或减少或增加)。25在一项分析1827对双胞胎粪便样本的16 s数据的研究中,也发现了类似的结果,即较低的微生物多样性和较低的肠道共生菌丰度。26此外,在12名健康志愿者中进行的一项小型交叉试验显示,在开始PPIs后,分类发生了相当大的变化。11
总体而言,PPI使用者粪便样本的分类变化显示肠道共生细菌的丰度下降,而来自口腔的细菌增加。这些变化包括肠杆菌科、肠球菌科和乳酸菌科的增加,瘤胃球菌科和双歧杆菌科的减少,而向典型口腔细菌的转变则反映在物种的增加上罗氏菌属dentocariosa而且罗氏菌属mucilaginosa,属放线菌和微球菌科。25此外,观察到的变化似乎是PPIs的一类效应,因为奥美拉唑、埃索美拉唑和泮托拉唑都显示出类似的变化。较高的剂量似乎也与较大的微生物变化有关。19
最近的一项研究使用宏基因组序列数据,允许高分辨率分类和预测途径分析,研究了41种常用药物对肠道微生物组的影响,再次观察到PPIs占最大数量的关联。19在校正了伴随使用其他药物的影响后,PPIs与24个类群和133个途径显著相关。预测的功能变化包括脂肪酸和脂类生物合成的增加,发酵烟酰胺腺嘌呤二核苷酸(NAD)的代谢,l -精氨酸的生物合成和嘌呤脱氧核糖苷的降解。这些途径的变化可以用观察到的特定类群丰度的变化来解释。例如,l -精氨酸生物合成在PPI使用者的微生物组中更为普遍。而几个细菌类群,包括双歧杆菌属而且瘤胃球菌属物种,被预测有助于这些途径,统计分析表明,只有在变形链球菌对PPI使用导致的预测通路变化有贡献。19PPIs诱导的胃酸减少被认为是观察到的微生物变化的原因,因为它使口腔细菌定植肠道微生物组,导致分类内稳态的改变(图1).这是通过观察PPI使用者肠道微生物群的“口化”得到支持的。25然而,一项评估常用药物(包括PPIs)对肠道共体的直接作用的体外研究显示,细菌生长速率发生了显著变化,这意味着PPIs与细菌H+/K+ATP酶的结合也可能介导了直接作用。27
重要的是要认识到ppi诱导的微生物组的变化实际上可能有助于临床重要疾病。例如,以前的研究定义了肠道微生物组的变化,导致对肠道感染的定植耐药性下降,包括艰难梭状芽胞杆菌,弯曲杆菌而且沙门氏菌,这与目前在PPI用户中观察到的相似。28 29在PPI用户中,ORs估计为1.5至1.8梭状芽孢杆菌其他致病菌为2.0 ~ 4.0。30.众所周知梭状芽孢杆菌在服用抗生素后,感染会在改变的肠道微生物环境中发生,31这在PPI的使用中也可能是真实的。此外,PPI的起始和退出影响失代偿性肝硬化的临床过程,可能是通过肠道菌群的变化。32最后,在儿童早期增加PPIs的使用可能导致正在发育的肠道微生物群的长期变化,这可能导致晚年的肥胖。33
虽然PPIs在循证适应症下的疗效和安全性仍然非常好,但医学界应该开始重新考虑PPIs的广泛和长期使用以及非处方可得性。我们已经到了这样的地步:我们需要仔细评估ppi诱导的西方社会多达五分之一人口微生物群变化的长期影响,这种变化发生在人类历史上相对较短的时间内,并具体检查改变早期生命发育中的肠道微生物群的影响及其对晚年健康和疾病的影响。
二甲双胍
二甲双胍是一种口服降糖化合物,用于治疗2型糖尿病(T2D)。虽然二甲双胍的确切工作机制很复杂,而且还没有被完全了解,但它确实抑制肝脏糖异生,越来越多的研究表明,它的一些有益作用是由肠道菌群介导的。34 35与PPIs相比,二甲双胍(几乎)仅用于糖尿病患者,这使得将该药对微生物组的影响与与潜在疾病相关的肠道微生物组的变化区分开来变得更加困难。PPIs用于治疗多种适应症或症状。然而,一项具有里程碑意义的研究已经做到了这一点,该研究表明,之前观察到的肠道微生物组的变化被认为是由潜在的T2D驱动的,实际上是由使用二甲双胍引起的。12
在一项针对健康志愿者的额外干预研究中,与接受安慰剂的对照组相比,使用二甲双胍导致>80物种的变化。值得注意的是,二甲双胍治疗显著增加大肠杆菌,降低Intestinibacter这与比较未接受治疗的患者与接受二甲双胍治疗的T2D患者的横断面队列研究结果一致。12个36随后,作者将二甲双胍治疗组或安慰剂治疗组的粪便样本移植到无菌小鼠体内,观察到接受二甲双胍治疗组志愿者粪便样本的小鼠血糖水平较低,这表明肠道微生物组对血糖水平有直接影响。这种作用被认为是由二甲双胍对短链脂肪酸(丁酸)产生细菌的作用和大量的Akkermansia muciniphila,以及通过常见的生物途径和编码在不同受二甲双胍影响的细菌中的基因,例如金属蛋白或金属转运体。此外,临床上众所周知,多达三分之一的服用二甲双胍的患者报告了腹泻、腹胀和恶心等胃肠道副作用,并确定了二甲双胍诱导的变化,包括毒力因子和气体代谢基因的增加(主要源于大肠杆菌物种),会导致这些副作用。12个36
二甲双胍和肠道菌群之间错综复杂的关系显示了一种常用药物如何改变肠道菌群,并解释了该药物的部分治疗功能及其一些副作用。它还强调,在对特定疾病或条件进行微生物组研究时,需要严格控制药物使用(包括二甲双胍、抗生素、PPIs和其他药物)等混杂因素。
其他常用非抗生素药物
使用来自英国、荷兰和比利时队列的横断面数据进行的基于人群的微生物组研究评估了包括药物使用在内的数百个因素。除了PPIs和二甲双胍外,这些研究还表明,其他常用药物,包括泻药、他汀类药物、抗抑郁药和阿片类药物,可以解释肠道微生物组组成的一些变化。15 18 37
在考虑使用泻药引起的微生物变化时,应考虑到肠道通过时间、粪便一致性和细菌数量(例如,每个样本的微生物负荷)都影响微生物组特征。38 39例如,增加的丰度拟杆菌在服用泻药的个体中观察到物种,但在低浓度的粪便样本中也有。然而,在一项对接触聚乙二醇(PEG)的小鼠的独立研究中,显示出类似的增加拟杆菌.在本研究中,聚乙二醇诱导轻度渗透性腹泻可引起肠道微生物群的长期变化、粘液屏障的短暂破坏以及随后的先天和适应性免疫反应。40PEG给药后,S24-7家族(拟杆菌门)消失,完全被拟杆菌科(Bacteroidaceae)的衍生物所取代。这种影响是永久性的,除非S24-7系列被替换。其他类群,如Verrucomicrobia和Gammaproteobacteria,表现出短暂的变化,但最终恢复到最初的水平。在服用肠道制剂的患者中,缺乏的人类数据也显示了微生物组多样性指标的短期短暂变化,但缺乏详细的研究。41然而,考虑到在小鼠身上的研究结果,使用泻药很可能对肠道微生物组组成有短期和长期的影响,这与粪便的稠度和每个样本的细菌数量无关。
肠道微生物群影响常用药物
出现pharmacomicrobiomics
在过去的几十年里,药物基因组学已经成为一个完善的领域,研究人类基因组变异如何影响药物的配置和作用。随着人们越来越认识到肠道微生物组是人类的第二基因组,药物微生物组学的概念作为药物基因组学的自然扩展被引入。虽然这一领域正在引起新的关注,但肠道微生物组可以影响药物疗效的想法可以追溯到1937年,当时发现了肠道微生物对抗菌药物百浪多息(prontosil)激活的影响。42 43口服药物通过上消化道继续进入肠道,在那里它们会遇到居住在我们肠道内的数千种不同的物种(图1).由此产生的相互作用是双向的。一方面,药物可以改变肠道微环境,影响细菌的生长、组成和功能,如上所述。另一方面,肠道微生物群可以通过酶转化药物结构,从而改变其生物利用度、生物活性或毒性,直接影响个体对特定药物的反应。44与人类基因不同,肠道微生物群是可改变的,这使得它成为优化治疗的一个有吸引力的治疗靶点。
药物与微生物在体外和动物研究中的双向作用
除了在人体中观察到的肠道-微生物之间的联系外,一些体外和动物研究也揭示了药物-微生物相互作用的作用模式以及对药物疗效和安全性的潜在后果。
建议药物影响肠道微生物群的机制
药物使用可能以不同的方式影响肠道微生物组成,至少提出了两种作用模式。第一种模式是,药物可以导致微生物群从身体其他部位转移到肠道。如上所述,PPIs可降低胃的酸性屏障,使口腔微生物通过胃进入肠道,从而诱发微生物失调。第二种作用模式,也可能是主要的作用模式,就是药物可以改变肠道微环境,直接影响细菌的生长。例如,二甲双胍已被发现可以促进肠道中短链脂肪酸生成菌的生长,这些细菌最终有助于二甲双胍在改善胰岛素抵抗和葡萄糖稳态方面的治疗效果。第二种作用模式可以是双向的。药物不仅可以促进某些细菌的生长,还可以抑制特定细菌的生长,例如,表现出抗生素的抗菌活性。一项具有里程碑意义的高通量研究证实了这一点27在该研究中,作者系统地评估了1000多种药物的抗菌效果,其中包括835种针对人体细胞的靶向药物。值得注意的是,这些药物中有24%显示出抗菌活性,影响了被研究的40种菌株中至少一种的生长速度。其中,有8种药物似乎对细菌有毒性,至少影响了50%的菌株的生长速度。这些药物包括四种抗肿瘤药物(柔红霉素、5-氟尿嘧啶、链脲佐菌素和氟脲嘧啶)、两种抗炎和抗风湿病药物(奥拉诺啡和太子苷)、一种抗痛风药物(苯溴马隆)和一种治疗消化性溃疡的药物(奥西沙卡因)。这一结果强烈强调了癌症治疗对肠道微生物群的副作用,因为这些药物通常具有细胞毒性。
提出了微生物影响药物疗效和安全性的机制
已有研究表明,肠道微生物可以通过酶转化药物结构和改变药物的生物利用度、生物活性或毒性来促进药物的疗效和安全性。例如,口服抗病毒药物brivudine可以被宿主和肠道菌群代谢为溴苯脲嘧啶,后者产生肝毒性。通过比较常规小鼠和无菌小鼠血浆和肝脏中溴维定和溴脲嘧啶的浓度,齐默尔曼等确定70%的溴夫定毒性可归因于肠道微生物,特别是叫多形拟杆菌而且拟杆菌ovatus.45同一个研究小组进一步进行了系统分析,测试了76种肠道微生物菌株对271种口服药物的代谢能力46并发现176种(66%)药物被至少一种细菌染色剂代谢。大多数微生物在体外代谢的药物包括PPIs(泮托拉唑、奥美拉唑和tenatoprazole)、化疗药物melphalan、抗疟疾的青蒿素和治疗帕金森病的药物甲磺酸。几乎所有被研究的细菌菌株都能代谢这些物质。超级药物代谢菌株是拟杆菌dorei(应变DSM17855)和梭状芽胞杆菌Sp,分别能代谢164和154种药物。
总而言之,这两项独立研究的结果,其中一项评估了药物的抗菌效果27一项是评估细菌代谢药物的能力,46显示可在细菌代谢下发挥作用但不显示强抗菌作用的可持续药物(图2).然而,一些药物的双向作用是明显的,例如左旋多巴。
肠道微生物群的双向作用:以左旋多巴为例
用于治疗帕金森病的左旋多巴是微生物影响药效的一个有趣的例子。口服后,左旋多巴需要通过小肠被吸收,这样它才能穿过血脑屏障进入大脑,在大脑中,人类的芳香氨基酸脱羧酶将左旋多巴转化为具有治疗活性的多巴胺。左旋多巴对大脑的生物利用度是药物疗效的关键因素,左旋多巴通常与儿茶酚代谢抑制剂(如卡比多巴和恩他卡彭)共同使用,以抑制其体外代谢。近年来,研究表明,肠道微生物的一部分微生物脱羧酶似乎能够代谢左旋多巴。通过酪氨酸脱羧酶(tyrDCs)进行的新型细菌l -多巴代谢已被发现,主要由粪肠球菌.47相反,突变这些tyrdc粪大肠可以阻断细菌的左旋多巴-多巴胺代谢,从而提高药物疗效。除了肠球菌种,tyrdc也存在于乳酸菌物种,尽管肠球菌而且乳酸菌不同的物种在l -多巴代谢效率上有很大的差异。48此外,l -多巴的肠道细菌代谢不仅降低了药物的可得性,还可诱发不良反应。Eggerthella lenta另外还有10种细菌含有多巴胺去羟化酶,这种酶能进一步将细菌产生的多巴胺转化为间酪胺,从而诱发高血压危像。47
有趣的是,在体外,细菌对儿茶酚代谢抑制剂卡比多巴和安他卡彭也有直接的代谢作用,这两种药物通常与左旋多巴共同使用。许多微生物可以代谢恩他卡彭。粪大肠例如,它能以98.9%的效率代谢左旋多巴和恩他卡彭。46相反,恩他卡彭也能抑制10种不同物种的生长速度,27包括瘤胃球菌属扭矩,进而以84%的效率代谢恩他卡彭。46这些结果表明药物与肠道微生物之间存在复杂的双向作用。
癌症免疫治疗中的肠道菌群和抗肿瘤反应
我们已经描述了常用的非抗生素药物如何影响肠道微生物组组成,以及肠道微生物组组成如何影响药物的可用性和疗效。此外,也有越来越多的证据表明,肠道微生物群参与调节癌症治疗的临床反应。这尤其发生在使用靶向程序性细胞死亡蛋白1 (PD-1)及其配体(PD-L1)或细胞毒性T淋巴细胞抗原4 (CTLA-4)的单克隆抗体进行免疫治疗的情况下。49个50这里假设的作用机制在于肠道微生物组在微调一般宿主免疫状态和随后在检查点抑制的抗肿瘤免疫系统激活中的作用(图3).

肠道微生物群参与调节癌症免疫治疗的临床反应。CTLA-4,细胞毒性T淋巴细胞抗原4;FMT,粪便微生物组移植;PD-1,程序性细胞死亡蛋白1;PD-L1:程序性细胞死亡蛋白1配体。
第一个突破性的研究提供了令人信服的证据,肠道微生物组影响肿瘤反应是在小鼠中进行的,这些发现后来在人类临床和微生物组数据中得到证实。观察到,在无菌小鼠和预先使用抗生素治疗的特异性无病原体小鼠中,抗ctla -4治疗的疗效降低。51然后,这些老鼠被口服该物种b . fragilis结合伯克不过或亚种,从而诱导th1介导的免疫反应和瘤内树突状细胞的成熟。这反过来又提高了抗ctla -4治疗的抗肿瘤反应性。在接下来的阶段,作者转移了高水平的患者的粪便材料b . fragilis这确实导致了抗ctla -4治疗的抗肿瘤反应的改善。51
与此同时,在另一种诱导PD-L1阻断的抗癌药物上也发表了类似的结果。在这种情况下,相对丰度较高的双歧杆菌属PD-L1阻断剂效果较好。52这种效应也可通过粪便微生物组移植或与有益种小鼠共住或给药引起双歧杆菌属同样是通过树突细胞的成熟和t细胞反应性的增加。最近的一项研究表明,在补充答:muciniphila.53在人类环境中,通过观察发现,与未接受抗生素治疗的患者相比,在PD-L1或PD-1抑制之前、期间或之后接受过抗生素治疗的使用检查点抑制剂的患者无进展生存期更低,从而进一步证实了肠道微生物组的作用。53
随后的一系列论文报道了与检查点抑制剂有反应或无反应相关的基线肠道微生物组成和特定分类群。其中包括,长双歧杆菌,屎肠球菌而且亚种,与检查点抑制剂的反应呈正相关大肠杆菌,两者呈负相关。54-57必须指出的是,目前不同研究报告的相关物种很少有重叠,对此有几种解释。这可能是由于研究之间缺乏标准化抽样协议、缺乏对混杂因素的标准化统计校正和/或由于样本量相对较小而导致的统计威力较低。旨在克服这些问题的更大的研究正在进行中(例如,ClinicalTrials.gov:NCT03643289).
肠道微生物群影响免疫治疗反应的确切机制仍有待阐明。据认为,微生物组是一般外周免疫稳态的部分原因,微生物抗原可诱导夸大的t细胞反应性,从而支持肿瘤特异性反应。在小鼠模型中,暴露于特定肠道微生物的先天和适应性免疫细胞都可以渗透到肿瘤微环境中,并产生CXCL9、CXCR3、CCR9和CXCL10等趋化因子,诱导免疫细胞运输到肿瘤部位。53 58另一个假设的机制是微生物和肿瘤相关抗原之间的交叉反应。59最后,肠道微生物群可以产生代谢物,如短链脂肪酸,可以对宿主免疫系统产生影响。13
肠道菌群影响临床反应的发现意味着,调节肠道菌群可能提高或恶化检查点抑制剂治疗后的生存率。有趣的是,在使用免疫检查点抑制剂治疗后,抗生素和PPIs的使用均与较短的生存期和无病生存期相关。60另一方面,提高生存率的潜力已经导致了多个正在进行的干预试验的启动。这些研究包括分析饮食干预的有效性,特定益生菌的使用,甚至在开始对转移性癌症的检查点抑制之前的粪便微生物组移植。目前正在进行一项1/2期临床试验,试验对象是一种口服微生物产品(VE800),该产品含有11株克隆共生菌株,被证明可以诱导CD8 + T细胞应答,并增强检查点抑制的有效性。值得注意的是,这11种菌株的鉴定(2018年才发表)以极快的速度在人体环境中进行了1/2阶段干预试验58(ClinicalTrials.gov标识符:NCT04208958).
认识到微生物群在抗肿瘤疗效中发挥作用是一项重大的科学突破,它改变了我们对如何预测和改进癌症免疫治疗的想法。了解潜在的机制将是至关重要的,而介入试验的结果将有助于优化免疫治疗。
结论
我们已经描述了常用的非抗生素药物和肠道微生物群之间复杂的双向作用,并介绍了不同的例子来强调具体的机制。临床医生需要意识到,不仅是抗生素会影响肠道微生物群,非抗生素药物也会改变肠道微生物群,最终导致健康结果受损。与此同时,药物微生物学领域正在兴起,对微生物组如何代谢药物或改善药效(例如抗癌治疗)的更深入了解将打开调节肠道微生物组以提高治疗效果的可能性。临床试验已经在进行中,其结果将在可预见的未来影响临床实践。
致谢
我们感谢Kate Mc Intyre和Melinde Wijers对手稿的编辑和Arnau Vich Vila的批判性阅读。
脚注
贡献者概念化和写作:RKW, AZ和JF。
资金RKW由Seerave基金会和荷兰消化基金会(16-14)支持。AZ由ERC启动拨款715772,NWO- vidi拨款016.178.056和NWO引力拨款Exposome-NL支持。JF得到了NWO重力荷兰芯片器官计划(024.003.001)和荷兰心脏基金会2018-27年度CVON赠款的支持。
相互竞争的利益RKW获得了武田、强生、Ferring和Tramedico的不受限制的研究资助,以及艾伯维、MSD和波士顿科学的演讲费,并担任了武田制药的顾问。
患者和公众的参与患者和/或公众未参与本研究的设计、实施、报告或传播计划。
病人同意发表不是必需的。
来源和同行评审委托;外部同行评议。



