条文本
摘要
客观的肝细胞癌(HCC)越来越多地与非酒精性脂肪性肝炎(NASH)相关。肝癌免疫治疗前景广阔;然而,最近的数据表明,NASH-HCC可能对传统的免疫检查点抑制(ICI)不太敏感。我们假设使用CXCR2小分子抑制剂靶向中性粒细胞可能使NASH-HCC对ICI治疗敏感。
设计中性粒细胞浸润在人肝癌和小鼠肝癌模型中均有表现。在NASH-HCC小鼠模型中使用抗pd1和/或CXCR2抑制剂进行晚期干预。肿瘤免疫微环境通过成像细胞术、RNA-seq和流式细胞术进行表征。
结果表达CXCR2的中性粒细胞在人NASH-HCC中高度表达,CXCR2是急性损伤中中性粒细胞募集的关键受体。在对ICI缺乏反应的NASH-HCC模型中,CXCR2拮抗剂与抗pd1联合使用抑制了肿瘤负担并延长了生存期。联合治疗瘤内XCR1升高+树突状细胞激活和CD8+与抗肿瘤免疫相关的T细胞数量,这是通过骨髓细胞募集的遗传损伤的治疗效果的丧失,xcr1配体XCL1的中和或CD8的耗尽来证实的+T细胞。治疗效果伴随着肿瘤相关中性粒细胞(TANs)的意外增加,TANs从原体转变为抗肿瘤祖细胞样中性粒细胞表型。发现重编程的tan与CD8直接接触+在细胞毒性抗肿瘤蛋白酶颗粒酶b富集的T细胞簇中,循环中未观察到中性粒细胞重编程,表明联合治疗选择性地影响TANs。
结论cxcr2抑制诱导肿瘤免疫微环境的重编程,促进NASH-HCC中的ICI。
- 肝细胞癌
- 免疫疗法
- 非酒精性脂肪肝炎
数据可用性声明
数据可在一个公共的、开放访问的存储库中获得。所有数据将在发布前以登录码、唯一标识符或公开数据集的网页链接保存。
这是一篇开放获取的文章,按照创作共用署名4.0未移植(CC BY 4.0)许可发布,该许可允许其他人复制、重新发布、混合、转换和基于此作品的任何目的,只要原始作品被正确引用,提供许可证链接,并说明是否进行了更改。看到的:https://creativecommons.org/licenses/by/4.0/.
统计数据来自Altmetric.com
本研究的意义
关于这个问题,我们已经知道了什么?
免疫检查点抑制(ICI)治疗是一种有前途的治疗晚期肝细胞癌(HCC)的新疗法。
只有少数HCC患者对ICI治疗有反应,最近的数据表明,非酒精性脂肪性肝炎(NASH)背景的HCC可能降低了对该治疗策略的敏感性。
中性粒细胞是NASH中典型的肝脏髓样成分,可在HCC肿瘤微环境或瘤周发现。
中性粒细胞具有相当大的表型可塑性,可以存在于促进肿瘤和抑制肿瘤的状态。
中性粒细胞可能有影响ICI治疗的能力。
本研究的意义
新的发现是什么?
CXCR2+中性粒细胞在人NASH和人及小鼠NASH- hcc模型的肿瘤中均有发现。
通过与CXCR2小分子抑制剂联合治疗,NASH-HCC对抗pd1治疗的耐药性被克服,有证据表明肿瘤负担减少,生存期延长。
抗pd1和CXCR2抑制剂结合可以选择性地将肿瘤相关中性粒细胞(TANs)从原体重编程为抗肿瘤表型。
重新编程的TANs在颗粒酶B内局部增殖+含有物理关联CD8的免疫簇+T细胞和抗原提呈细胞。
传统XCR1+在抗pd1和CXCR2抑制剂处理的hcc中,树突细胞和CD8一起被发现升高+治疗效果需要T细胞。
在可预见的未来,它会对临床实践产生怎样的影响?
tan可以被选择性地操纵以采用一种抗肿瘤表型,从而释放其癌症治疗的潜力。CXCR2拮抗剂联合ICI治疗在NASH-HCC(以及潜在的其他病因的HCC)中增加疗效的能力值得临床研究。
简介
原发性肝癌是全球最常见和最致命的恶性肿瘤之一,2020年有905万例新诊断病例和83万例死亡记录。1肝细胞癌(HCC)占原发性肝癌的85%,在慢性肝病的背景下发展,这是由持续病毒学(乙肝病毒(HBV)和丙肝病毒(HCV))或非病毒学肝损伤引起的。由于肥胖和代谢综合征的日益流行,肝癌的高比例现在被归因于非酒精性脂肪性肝炎(NASH),在英国和美国被确定为肝癌最常见的危险因素。2 3
肝癌可能的治疗方案,如肿瘤切除、肝移植或消融,目前仅限于少数在疾病早期被诊断的患者。4对于更晚期的HCC,已批准的全身治疗包括多激酶抑制剂和靶向血管内皮生长因子(VEGF)的药物。最近,随着PD1抗体(nivolumab和pembrolizumab)获得批准,免疫检查点抑制(ICI)已成为HCC的一种治疗方式,抗pdl1 (atezolizumab)和抗vegf (bevacizumab)的联合治疗现在是晚期HCC的一线治疗方法。5 - 7然而,只有少数HCC患者(高达30%)对免疫治疗有反应。5 - 8此外,最近有报道称,NASH背景下的HCC对免疫治疗的反应较差,这是由于NASH诱导的肝脏免疫成分的改变,特别是耗尽的CD8数量的增加+PD1+T细胞,似乎促进,而不是抑制,NASH-HCC。9日10因此,HCC的先进治疗策略需要对肿瘤微环境的复杂免疫景观有更深入的了解,特别是,还应该考虑到肝脏病理背景可能对与癌症生长相关的关键免疫细胞类型的数量、区域分布、表型和活性的影响。
最近使用成像细胞术(IMC)和单细胞测序来探测人类HCC的细胞成分,发现肿瘤微环境中具有肿瘤内区域特异性分布的免疫细胞具有相当大的异质性。11有证据表明癌症侵袭性较低和持续肝损伤(纤维化)的区域CD8富集+T细胞,B细胞和CD11b+CD15+GranzymeB+中性粒细胞。考虑到越来越多的证据表明中性粒细胞在各种癌症中具有促肿瘤和抗肿瘤的功能12日13包括肝细胞癌14我们有兴趣确定肿瘤微环境中中性粒细胞生物学的调节是否会影响NASH-HCC对抗pd1免疫治疗的耐药性。
在这里,我们确定了CXC趋化因子受体CXCR2几乎只位于人和小鼠NASH-HCC的中性粒细胞上。这一发现促使我们思考,CXCR2的拮抗是否可以与抗pd1结合来克服NASH-HCC对免疫治疗的耐药性。我们的研究结果表明,这种联合疗法重新规划了肿瘤中性粒细胞的表型,并增强了它们与CD8的联系+T细胞和传统树突状细胞(cDC)。重塑肿瘤免疫微环境与T细胞和dc依赖的肿瘤负担减少和生存率增加有关。我们认为中性粒细胞表型修饰和ICI联合可能改善NASH-HCC的预后。
Protumour CXCR2+中性粒细胞与NASH-HCC抗pd1免疫治疗相关
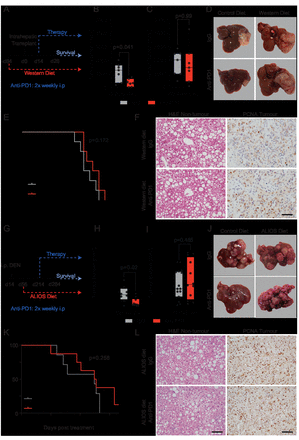
为了研究nnash -HCC对抗pd1治疗无反应性的免疫决定因素,我们设计了一个原位小鼠模型,使用Hep-53.4 HCC细胞系,选择Hep-53.4是由于其高突变负担(在线补充图1A-C).在高糖和高脂肪饮食引起脂肪变性的背景下,我们观察到与非脂肪变性对照组相比,体重增加和肿瘤更大(在线补充图1D,E).非脂肪变性小鼠的肿瘤对抗pd1治疗有反应,然而,在脂肪变性小鼠中,抗pd1对肿瘤负担、存活、脂肪变性、增殖或免疫细胞浸润均无益处(图1 f而且在线补充图1H,K).在另一个本土模型中,我们使用二乙基亚硝胺(DEN)单独或与美国生活方式诱导的肥胖综合征饮食(DEN/ALIOS)结合,后者在NASH背景下建立HCC15日16(在线补充图1I-O).在饲喂对照饮食的DEN小鼠中观察到抗pd1反应性,而在饲喂ALIOS饮食的小鼠中,抗pd1治疗对肿瘤负担、增殖、脂肪变性和动物存活没有影响(图1 g-l而且在线补充图1P,Q).然而,F4/80+和CD3+抗pd1处理的ALIOS喂养的小鼠免疫细胞浸润增加(在线补充图1R,S)表明预期的肿瘤免疫改变。
NASH-HCC对抗pd1免疫治疗耐药。(A) NASH-HCC模型时间线示意图。(B-D)原位肝癌小鼠肝内注射后第28天肿瘤负荷的量化和代表性图像,小鼠饲喂对照饲料或西餐饲料,并接受igg对照或抗pd1治疗。(E)原位NASH-HCC小鼠的生存图,喂养西方饮食,并用igg对照或抗pd1治疗。(F) h&e染色的非肿瘤肝脏和pcna染色的肿瘤的代表性图像,这些肿瘤来自于喂养西方饮食并经igg对照或抗pd1处理的原位NASH-HCC小鼠。比例尺= 100 μ m。(G) DEN/ALIOS NASH-HCC模型时间线示意图。(H-J) DEN小鼠饲喂对照日粮或经igg对照或抗pd1处理的ald,第284天肿瘤负荷的量化和代表性图像。(K)用igg对照或抗pd1治疗的DEN/ALIOS小鼠的生存图(治疗后第165天删除)。(L) DEN/ALIOS小鼠在284天接受igg对照或抗pd1治疗后,h&e染色的非肿瘤肝脏和pcna染色的肿瘤的代表性图像。 Scale bar = 100 µm. Dots in (B, C, H, I) represent individual mice. Significance tested using: Mann-WhitneyU-test (A, B, H, L)和Log-rank (Mantel-Cox) test (E, K)。确切的p值显示在图上。肝癌,肝细胞癌;NASH,非酒精性脂肪性肝炎;增殖细胞核抗原。
尽管循环中性粒细胞数量的增加与HCC生存率的降低有关,17相比之下,肿瘤相关中性粒细胞(TANs)的富集被报道与提高生存率相关。18后一个观察结果表明TANs可能影响HCC的进展,并提出了免疫治疗是否影响TANs的问题(反之亦然)。Ly6G+在原位肝癌小鼠的肿瘤组织和非肿瘤组织中均发现中性粒细胞,且在NASH存在时,中性粒细胞在两间室均显著升高,抗pd1治疗时保持高水平(图2一个而且在线补充图2A).TANs数量的增加也是DEN/ALIOS模型的一个特征,抗pd1治疗的增加达到显著性(图2 b而且在线补充图2A).此外,在胆碱缺乏-高脂肪饮食(CD-HFD)自发性NASH-HCC模型中,TANs升高,并在抗pd1治疗后保留,据报道在该模型中也失败9(在线补充图2B、C).因此,我们一致观察到TANs在NASH-HCC中积累,独立于所检查的模型,并在抗pd1治疗后保留在肿瘤中。TANs表现出功能异质性,包括影响肿瘤生长的抗肿瘤或原体表型。19利用肿瘤分离Ly6G的转录组分析+我们从DEN/ALIOS肿瘤中测定了TANs的表型。为了解释环境导致的基因表达差异,20.我们将TANs与外周血和肝脏中性粒细胞进行比较。表达增加的DEGs在炎症相关的过程网络中表达丰富(如,Nfkb1 / Rel,Mapk8 Jnk1 /,Mapk9 / Jnk2,Icam1)和钙(例如,Itpr1 Plcb1 Plcg1)信号(图2 c而且在线补充图2D).与原中性粒细胞表型相关的基因,包括Csf1, Ccl3, Vegfa而且Ptgs2月19 - 21日TANs也显著上调(在线补充图2E).
NASH-HCC和抗pd1耐药与CXCR2相关+中性粒细胞。(A) Ly6G的定量分析+igg对照或抗pd1处理的原位NASH-HCC小鼠的非肿瘤肝脏和肿瘤的计数/场。(B) Ly6G的定量分析+igg对照或抗pd1处理的DEN/ALIOS小鼠的非肿瘤肝脏和肿瘤的计数/场。(C)热图显示,与外周血和对照肝脏中性粒细胞相比,DEN/ALIOS TANs中与肿瘤前中性粒细胞表型相关的DEGs的行比例表达上调。(D)折叠变化的量化Cxcl而且创新领导力DEN/ALIOS非肿瘤肝脏和肿瘤之间的趋化因子转录。(E)流式细胞术定量CXCR2+在DEN/ALIOS小鼠外周血、非肿瘤肝脏和肿瘤细胞群中的百分比。误差条表示均值±SEM。(F) RNAscope的代表图像原位DEN/ALIOS小鼠肿瘤中CXCR2的水化染色。黑色箭头表示阳性浸润性非实质细胞,红色箭头表示阴性肿瘤细胞。(G-I) CD66b的定量和代表性图像+和CXCR2+细胞计数/毫米2非酒精性脂肪肝(NAFLD)-HCC和NASH-HCC患者切除组织的免疫组化。(J)热图显示与HBV、HCV和酒精相关肝癌(非NASH-HCC)相比,人类NASH-HCC中性粒细胞相关过程网络的行比例表达。比例尺= 100 μ m。数据来自;大部分Ly6G+中性粒细胞RNA-Seq (C),大块组织RNA-Seq (D),大块肿瘤微阵列(J)。(A, B, G, H)中的点代表单个小鼠。显著性检验采用:双向方差分析和Sidak多重比较检验(A, B, G, H)。确切的p值显示在图表上。ALIOS,美国生活方式诱导肥胖综合征饮食;方差分析,方差分析;窝,Diethylnitrosamine;GO,基因本体;乙型肝炎病毒;肝癌,肝细胞癌;丙型肝炎病毒;包含IHC,免疫组织化学; NASH, non-alcoholic steatohepatitis; TANs, tumour-associated neutrophils.
DEN/ALIOS肿瘤的转录组学分析发现,与正常肝脏相比,髓系相关细胞因子和趋化因子基因表达上调(图2 d).值得注意的是配体(Cxcl1, Cxcl2, Cxcl3, Cxcl5)的趋化因子受体CXCR2,后者被鉴定为主要由Ly6G表达+中性粒细胞在肿瘤组织中均增加(图2 d, E而且在线补充图2F).原位杂交分析Cxcr2在DEN/ALIOS小鼠肿瘤中证实表达Cxcr2在形态学上明确与浸润中性粒细胞相关,而在实质细胞和肿瘤细胞中不存在(图2 f).这证实了CXCR2是一种中性粒细胞趋化因子受体,可靶向操纵HCC-NASH模型中的TANs。14在人类中,CXCR2配体处于受控而且CXCL8与NASH相比,NASH- hcc显著上调(在线补充图2G).中性粒细胞趋化性/迁移基因本体论术语在晚期人类NASH (F4纤维化)中得到丰富22和肝脏CD66b的数量+中性粒细胞随着NASH的严重程度而增加(在线补充图2H,I).此外,在HCC患者组织中,CD66b+中性粒细胞和CXCR2+主要定位于NASH-HCC肿瘤的细胞,两种标记物的表达相关,进一步被证明在细胞水平上共定位(图2 g, H而且在线补充图2J,K).与小鼠模型相似,在HCC患者中,CXCR2表达仅限于浸润免疫细胞,而在肿瘤上皮细胞中缺失(图2我).我们还注意到,与HBV-HCC、HCV-HCC和酒精相关hcc相比,人NASH-HCC中中性粒细胞表达标记丰富23(图2 j).因此,表达cxcr2的中性粒细胞的肿瘤浸润是小鼠模型和人类NASH-HCC的特征,并与抗pd1治疗在NASH-HCC实验模型的耐药有关。9
CXCR2拮抗剂使NASH-HCC对免疫治疗再敏
接下来,我们测定了CXCR2小分子抑制剂(AZD5069)的作用。24在实验NASH-HCC中单独或与抗pd1联合使用。我们假设AZD5069会抑制肝脏中性粒细胞的招募。这在den诱导的急性肝损伤的背景下得到证实(在线补充图3A-C).我们也观察到F4/80无变化+巨噬细胞和CD3+T细胞(在线补充图3D,E).这些数据与之前的研究一致,表明在急性炎症环境下,CXCR2抑制可选择性地减少中性粒细胞的招募。24
然后,研究AZD5069/anti-PD1治疗方法中的任一或两种治疗方法在dan - alios模型中抑制肿瘤生长的能力(图3一).第284天,AZD5069单药治疗和AZD5069/抗pd1联合治疗与对照剂和抗pd1单药治疗相比,肿瘤负担降低,然而,没有发现肿瘤数量的变化,表明抑制了癌症进展(图3 b而且在线补充图3F,G).肿瘤检查显示,与包括AZD5069单药治疗在内的其他治疗组相比,AZD5069/anti-PD1组上皮有丝分裂体数量减少,肿瘤分期分级较低,但未显著改变潜在的NASH病理(图3氟而且在线补充图3H).这与临床相关,因为人类HCC中有丝分裂指数高是疾病特异性生存期较短的预测因子。25因此值得注意的是,与单一治疗相比,AZD5069/anti-PD1联合治疗提高了生存率(图3 g重要的是,AZD5069/抗pd1治疗的益处在原位NASH-HCC模型中得到了再现(图3 h-j).与DEN/ALIOS模型相比,AZD5069或anti-PD1单一疗法观察到缺乏治疗效果(图3 i, J).然而,AZD5069/anti-PD1联合治疗在第28天减少了肿瘤负担,并延长了生存期(相对于对照和单一治疗)(图3 i, J而且在线补充图3I).值得注意的是,治疗对脂肪变性或体重没有影响(在线补充图3J,K).AZD5069/抗- pd1治疗小鼠较晚到达临床终点,此时治疗组间肿瘤负担相似,这与抑制肿瘤生长一致(在线补充图3L).因此,尽管CXCR2单独拮抗剂提供了适度的模型依赖性抗肿瘤效益,与在非肝癌模型中观察到的类似,26-31我们发现,在NASH-HCC模型中,CXCR2抑制对抗pd1免疫治疗敏感,否则抗pd1单药治疗无效。
CXCR2的抑制+前列腺中性粒细胞使NASH-HCC对抗pd1治疗再敏。(A) DEN/ALIOS模型处理方案示意图。(B) DEN/ALIOS小鼠在每个治疗组第284天的肿瘤负担量化。(C) DEN/ALIOS小鼠在第284天每个肿瘤的平均有丝分裂体数的量化。(D)在每个治疗组的第284天,基于DEN/ALIOS小鼠的核分级对肿瘤分期进行量化。平均值±SEM。(E) DEN/ALIOS小鼠非肿瘤肝脏H&E代表性图像。比例尺= 100 μ m。(F) DEN/ALIOS小鼠肝脏中NAFLD活性评分(NAS)在第284天的量化。G) DEN/ALIOS小鼠的生存图(第365天删减)。 (H) Schematic for orthotopic NASH-HCC model treatment regime. (I) Quantification of tumour burden for the orthotopic NASH-HCC mice at day 28. (J) Survival plot in orthotopic NASH-HCC mice. One mouse censored due to non-liver related medical issue. Dots in (B, C, F, I) represent individual mice.Significance tested using: Kruskal-Wallis test with Dunn’s multiple comparisons test (B), One-Way ANOVA with Tukey multiple comparisons test (C, F, I), Log-rank (Mantel-Cox) test (G, J). Exact p-values indicated on graph. ALIOS, American lifestyle induced obesity syndrome diet; ANOVA, analysis of variance; DEN, Diethylnitrosamine; HCC, hepatocellular carcinoma; NAFLD, non-alcoholic fatty liver disease; NASH, non-alcoholic steatohepatitis.
AZD5069/抗pd1治疗促进抗肿瘤免疫微环境
为了进一步检验CXCR2拮抗剂使NASH-HCC对抗pd1治疗敏感的概念,我们询问联合治疗是否激活经典的t细胞介导的抗肿瘤免疫。肿瘤内T细胞的特征显示肿瘤内存在CD8+抗pd1和AZD5069/抗pd1治疗组T细胞均显著升高,只有抗pd1单药治疗显著影响CD4+T细胞(图4一而且在线补充图4A).联合治疗也增强了瘤内CD8+原位模型中T细胞数量(在线补充图4B)流式细胞术分析显示早期效应子CD8无明显表型变化+CD44嗨整个治疗组的T细胞。然而,单独抗pd1治疗显著增加了CD8的数量+PD1+T细胞,Pfister最近报道了这种效应等9他认为这种T细胞表型损害了抗pd1治疗NASH-HCC的疗效(在线补充图4C).CD4的百分比+PD1+与其他治疗组相比,抗pd1单一治疗组的T细胞水平也更高(在线补充图4D).分离CD3上的RNAseq+细胞显示最近发现的T细胞衰老标记物的表达增强Gzmk而且加工AZD5069联合抗pd1时,两者均被抑制(图4 b).伴随着这些变化,AZD5069/抗pd1治疗增强了Granzyme B (Gzmb)的表达,这是一种由中性粒细胞、NK细胞和最近激活的CD8表达的细胞毒性丝氨酸蛋白酶+T细胞及其表达与PD1免疫治疗的临床结果相关。32 - 35DEN/ALIOS肿瘤的免疫染色显示,Gzmb在载药组和单药组检测到的水平较低,但在AZD5069/抗- pd1联合治疗的情况下,Gzmb高表达,并定位于包含带状未成熟中性粒细胞和淋巴细胞的离散免疫细胞簇中(图4 c而且在线补充图4E).在原位肿瘤中,联合治疗也可增强Gzmb蛋白的表达,我们还注意到抗pd1单一治疗抑制了蛋白酶的表达,相对于对照(在线补充图4F).这些数据使我们怀疑CD8的耗竭+T细胞可调节AZD5069/抗pd1治疗的抗肿瘤作用。CD8的耗尽+T细胞是通过抗cd8 α和AZD5069/抗pd1治疗同时作用于具有原位NASH-HCC肿瘤的小鼠(图4 d).CD8的成功消耗+T细胞被CD4的比例增加所证实+相对于总CD3细胞+人口(在线补充图4G-I),结果与IgG对照相比,原位肿瘤负担更高(图4 e).CD8的需求+此外,我们还通过AZD5069/anti-PD1 (在线补充图4J-M).
AZD5069/抗pd1治疗促进抗肿瘤免疫微环境。(A) CD8的定量+每个治疗臂的肿瘤DEN/ALIOS模型中的计数/字段。(B)显示与CD8相关基因的行比例表达的热图+DEN/ALIOS治疗组的T细胞激活和衰竭。数据来自CD3块+用RNA-Seq分析肿瘤相关T细胞。(C)颗粒酶B的定量+在第284天,每个治疗组的DEN/ALIOS小鼠的肿瘤簇和颗粒酶B的代表性图像+AZD5069/anti-PD1治疗小鼠(黑色箭头=带状中性粒细胞;蓝色箭头=淋巴细胞)。比例尺= 100 μ m。(D)原位NASH-HCC模型中抗cd8a耗竭机制的时间线示意图。(E)肝内注射后第28天,AZD5069/anti-PD1和igg对照或anti-CD8α治疗的原位NASH-HCC小鼠肿瘤负担的量化。(F)流式细胞术定量肿瘤内XCR1细胞CD86中位荧光强度(MFI)+第284天DEN/ALIOS小鼠治疗组的cDC1细胞。(G) DEN/ALIOS方案和靶向治疗复合缺失小鼠的时间表示意图Ccr1 2 3 5敲除小鼠,命名为iCCR。(H) DEN/ALIOS小鼠在第284天的肿瘤负荷量化。(一)流式细胞术定量CD4+和CD8+细胞中CD3的百分比+WT-Vehicle、iCCR-Vehicle和iCCR-AZD5069/anti-PD1在第284天治疗DEN/ALIOS小鼠肿瘤中的T细胞。(J)颗粒酶B的定量分析+在第284天,AZD5069/Anti-PD1治疗WT和iCCR DEN/ALIOS小鼠出现聚集。(K)原位NASH-HCC模型中抗xcl1中和机制的时间线示意图。(L)肝内注射后第28天,用载药对照和igg对照或AZD5069/anti-PD1和igg对照或抗- xcl1治疗的原位NASH-HCC小鼠的肿瘤负担的量化。(M, N) CD8的定量+颗粒酶B+在肝内注射后第28天,用载药对照和igg对照或AZD5069/anti-PD1和igg对照或抗- xcl1治疗的原位nashi - hcc小鼠肿瘤的计数/场。(A, C, E, F, H-J, L-N)中的点代表单个小鼠。显著性检验方法:单因素方差分析与Tukey多重比较检验(A, C, F, L, M, N), Mann-WhitneyU-检验(E),双向方差分析与Tukey多重比较检验(I),无配对t检验(J)。图中显示精确的p值。ALIOS,美国生活方式诱导肥胖综合征饮食;方差分析,方差分析;窝,Diethylnitrosamine;肝癌,肝细胞癌;;免疫组化、免疫组化、NASH、非酒精性脂肪性肝炎;WT,野生型。
作为XCR1的招募和激活+肿瘤中的cDC1被认为是激活细胞毒性CD8的关键+T细胞和免疫疗法36我们接下来评估了在AZD5069/抗pd1治疗的小鼠中,CD86表面表达作为cDC1激活的标记。单抗pd1对肿瘤内XCR1的激活没有影响+DEN/ALIOS模型中cDC1细胞与对照对照的比较(图4 f).单独使用AZD5069对瘤内XCR1的激活也无影响+cDC1细胞,可能是由于CXCR2在cDC1细胞上表达有限(图2 e).然而,AZD5069/抗pd1联合治疗显著增加了肿瘤内cDC1细胞的活化(图4 f).由于与DC招募相关的几个CC趋化因子在小鼠NASH-HCC肿瘤中表达,对单一和双重疗法均有反应(在线补充图5A),我们接下来确定了扰动DC招募的效果,招募的小鼠缺乏Ccr1, Ccr2, Ccr3而且Ccr5,称为iCCR。37这些小鼠按照DEN/ALIOS模型和AZD5069/anti-PD1或对照治疗进行治疗(图4 g).cDC1和cDC2细胞数量,F4/80细胞数量较少+iCCR小鼠肿瘤中巨噬细胞而中性粒细胞减少(在线补充图5B-D).重要的是,在DEN/ALIOS模型中,仅iCCR小鼠骨髓招募缺失对肿瘤负担没有影响(图4 h).然而,与野生型小鼠不同,AZD5069/抗pd1治疗未能减轻iCCR小鼠的肿瘤负担(图4 h).这种效果的丧失与肿瘤相关CD3的减少有关+CD8+T细胞和颗粒酶B的损失+免疫簇(图4。J).为了证实这些数据,并更具体地阐明XCR1的作用+我们确定了AZD5069/抗pd1治疗原位NASH-HCC是否会受到抗XCL1介导的XCL1阻断的影响,XCL1是介导cDC1和CD8 T细胞相互作用的主要趋化因子(图4 k).38AZD5069/抗pd1治疗导致激活的瘤内XCR1增加+cDC1细胞与DEN/ALIOS小鼠的观察结果一致,但抗xcl1治疗可选择性抑制cDC1激活(在线补充图5E,F).这种作用与AZD5069/抗pd1治疗的抗肿瘤作用的丧失有关;与IgG对照相比,抗xcl1治疗小鼠的肿瘤负担增加(图4 l).AZD5069/anti- pd1诱导瘤内细胞毒CD8升高,证实了其对细胞毒T细胞的相关影响+和GzmB+当cDC1激活被抗xcl1选择性阻断时被抑制的细胞(图4 m, N).我们的结论是,联合抑制CXCR2和PD1可以刺激瘤内募集和激活cDC1细胞,从而实现T细胞介导的细胞毒性。
AZD5069/抗pd1治疗促进肿瘤中性粒细胞聚集和瘤内免疫中枢的形成
鉴于CXCR2几乎只在中性粒细胞上表达(图2 e),我们很好奇它们在AZD5069/抗pd1治疗及其相关肿瘤免疫细胞重构中的作用。出乎意料的是,我们观察到两种NASH-HCC模型的联合治疗与TANs的显著增加相关,而AZD5069单药治疗带来了预期的TANs减少(图5 a, B而且在线补充图6A).在整个治疗过程中不可能对肿瘤中性粒细胞浸润进行实时分析,因此我们每周从外周血中检测循环中性粒细胞样本。单抗pd1在整个治疗期间对循环中性粒细胞数量没有明显影响,而AZD5069刺激循环Ly6G的短暂增加+中性粒细胞在治疗开始后4周达到峰值(在线补充图6B).在AZD5069/anti-PD1治疗的小鼠中也观察到循环中性粒细胞的短暂增加,然而,这种效果在治疗开始后6周达到峰值。这些外周血数据表明,在CXCR2和PD1的双重长期靶向作用下,中性粒细胞行为发生了变化。
AZD5069/抗pd1治疗促进肿瘤中性粒细胞聚集和瘤内免疫中枢的形成。(A) Ly6G的定量分析+第284天,免疫组化对DEN/ALIOS小鼠肿瘤计数/场。(B) Ly6G的代表性图像+AZD5069/Anti-PD1处理小鼠的DEN/ALIOS肿瘤染色。黑色箭头表示单个Ly6G+中性粒细胞;红色箭头表示Ly6G簇+中性粒细胞。比例尺= 100 μ m。(C) car -control和AZD5069/anti-PD1治疗小鼠肿瘤的代表性H&E,发现中性粒细胞簇具有带状(蓝色箭头)和节段(黑色箭头)核形态。比例尺= 10µm。(D)第284天,每个治疗组DEN/ALIOS小鼠非肿瘤肝脏和肿瘤组织中NeP计数/克的流式细胞术定量。(E) AZD5069/anti-PD1治疗DEN/ALIOS小鼠的代表性瘤内IMC图像。DNA =白色;MPO =蓝色;Ki-67 =红色。n = 6小鼠。 Scale bar = 100 µm. (F) Quantification of MPO+ki - 67+IMC分析中DEN/ALIOS肿瘤的计数/字段。(G) AZD5069/anti-PD1治疗DEN/ALIOS小鼠的代表性瘤内IMC图像。MPO =青色;CD3 =黄色;MHCII =紫色。比例尺= 100 μ m。(H)使用留声机聚集细胞群对所有四个治疗组进行HistoCAT邻域聚类分析,其中红色表示显著相互作用,蓝色表示显著回避,白色表示无显著相互作用。每一列表示两种单元格类型的相互作用。每一行代表一个单独的鼠标。(一)HistoCAT邻域聚类分析放大图像。 Cluster showing specifically enriched cell-cell interactions. 7/8 cell-cell interactions characterised by antibodies used. Dots in (A, D, F) represent individual mice. Significance tested using: One-Way ANOVA with Tukey’s multiple comparisons test (A, F), Two-way ANOVA with Sidak’s multiple comparisons test (D). Exact p-values indicated on graph. ALIOS, American lifestyle induced obesity syndrome diet; ANOVA, analysis of variance; APC, antigen presenting cell; DEN, Diethylnitrosamine; HCC, hepatocellular carcinoma; ; IHC, immunohistochemistry, IMC, imaging mass cytometry; NASH, non-alcoholic steatohepatitis.
肿瘤的免疫组化分析发现了AZD5069/抗pd1治疗所特有的TANs簇,包括带状和节段中性粒细胞的混合种群(图5 b, C而且在线补充图6C).AZD5069/anti-PD1治疗的hcc中存在这些聚集的TANs是有趣的,并提示局部增殖。朱等39最近描述了从成人骨髓(BM)产生中性粒细胞的早期单位性中性粒细胞祖细胞(NeP)。值得注意的是,NePs不仅在BM中显著增加,而且在AZD5069/anti-PD1治疗小鼠的肿瘤中也显著增加(图5 d而且在线补充图6D,E).因此,AZD5069/anti-PD1治疗改变了颗粒生成,而瘤内NePs可能在局部产生中性粒细胞,从而解释了在接受联合治疗的小鼠中观察到的TANs数量意外升高。
为了验证AZD5069/anti-PD1联合治疗肿瘤中未成熟中性粒细胞的存在,我们使用DEN/ALIOS治疗组(在线补充图6F-J).中性粒细胞,无论是不成熟的还是成熟的,都表达初级颗粒蛋白MPO。我们证实了肿瘤内聚集的增殖性MPO+Ki67+在AZD5069/anti-PD1治疗的小鼠中,与单一治疗和对照相比,中性粒细胞明显增加(图5 e, F).IMC邻域分析揭示了MPO的密切相关性+Ki67+中性粒细胞和CD8+T细胞和MHC II类+(MHCII+)抗原呈递细胞(APCs),在IMC检测的7个AZD5069/anti-PD1治疗肿瘤中,有6个在相关区域发现APCs (图5胃肠道).相比之下,对于抗pd1和AZD5069单药治疗,IMC在每种治疗类型的肿瘤中只检测到这些混合免疫细胞集合体(图5我).
活体显微镜证实存在稳定的肿瘤相关Ly6G+AZD5069/anti-PD1治疗小鼠体内的聚类(在线补充图6K,L).Ly6G直接相互作用+tan和CD3+CD8+还观察到保持身体接触数分钟或更长时间的T细胞(在线补充图6M).
体外精确切肝切片(PCLS)纵向成像进一步询问Ly6G+细胞(中性粒细胞),CD8+T细胞和CD11c+细胞(DC和巨噬细胞亚群)在DEN/ALIOS小鼠肿瘤中的动态变化(在线补充图6N,O和视频).AZD5069/anti-PD1治疗小鼠的pcs具有预期的中性粒细胞CD11c数量升高+细胞和CD8+T细胞(在线补充图6P-R).尽管在所有组的pcl中T细胞速度保持较低,但在AZD5069/anti-PD1治疗的肿瘤中中性粒细胞速度增加,提示这些中性粒细胞具有更积极的迁移表型(在线补充图6S、T).Neutrophil-CD11c+细胞相互作用在肿瘤中是高的,而中性粒细胞- cd8+T细胞和CD11c+cd8+与对照相比,AZD5069/anti-PD1治疗的肿瘤中T细胞相互作用升高(在线补充图6U-Y,视频).这些数据提供了CXCR2联合靶向治疗的证据+中性粒细胞和PD1-PDL1免疫检查点重塑了NASH-HCC肿瘤免疫微环境,包括产生局部增殖的未成熟NeP,与细胞毒性T细胞有密切的物理联系。
AZD5069/anti-PD1联合治疗可重编程TAN表型
鉴于我们的观察结果与AZD5069/抗pd1联合治疗后的瘤内颗粒生成相一致,我们在这些条件下更精确地描述了TAN表型。Grieshaber-Bouyer等40最近报道了一种按时间顺序排列的中性粒细胞发育路径,称为“中性时间”。这从主要存在于BM中的未成熟前中性粒细胞(早期中性时间)延伸到主要位于循环和脾脏中的完全成熟中性粒细胞(晚期中性时间)(在线补充图7A).TAN转录组分析显示,AZD5069/抗pd1治疗诱导中性时间重编程沿中性时间谱(图6而且在线补充图7B).载体中的TANs,抗pd1和AZD5069治疗的肿瘤表型类似于成熟的中性粒细胞,表达晚期中性时间的基因特征(例如,Jund, Csf3r,Rps27) (图6而且在线补充图7B).然而,AZD5069/anti-PD1处理小鼠的TANs中,晚期中性时间基因被全面下调,相应的有早期中性时间特征的转录本上调(如,Mmp8, Retnlg, Ltf, Lcn2, Camp, Chil3, Tuba1b,Fcnb).乳铁蛋白(Ltf)是早期中性时间基因中特别感兴趣的,因为它的蛋白质具有良好的抗癌活性;包括DCs和巨噬细胞的激活以及增强自然杀伤细胞的细胞毒性。41-43在AZD5069/anti-PD1治疗的小鼠中,DEN/ALIOS肿瘤中乳铁蛋白的染色升高,该蛋白定位于富含中性粒细胞的免疫簇,其中包括带状未成熟中性粒细胞(图6 b, C).这些观察结果表明,重编程的TANs可能通过与其他免疫细胞网络形成抗肿瘤效应的潜在机制。
AZD5069/anti-PD1联合治疗可重编程TAN表型。(A)热图显示DEN/ALIOS小鼠TANs中后期和早期中性时间相关基因的行比例表达。(B) LTF的量化+第284天,免疫组化对DEN/ALIOS小鼠肿瘤计数/场。(C)第284天AZD5069/anti-PD1治疗DEN/ALIOS小鼠肿瘤中LTF阳性中性粒细胞(红色箭头)的代表图像。比例尺顶部= 100 μ m,底部= 10 μ m。(D)与HBV、HCV和酒精相关肝癌(非NASH-HCC)相比,人类NASH-HCC早期和晚期中性时间信号的行比例表达热图。共分析了237例患者。(E)热图显示已发表的HCC免疫分类特征的行比例表达;IFN,炎症,IFNAP,对ICI的反应和免疫抵抗,以及人类HCC活性和衰竭免疫亚群的晚期中性时间信号。共分析了228例患者。(F)热图显示与DEN/ALIOS外周血中性粒细胞和AZD5069/Anti-PD1治疗的TANs的中后期和早期中性时间特征相关的基因的行比例表达。(G)基因集富集分析(GSEA)显示TAN过程网络高度富集的归一化富集分数; Anti-PD1 vs Vehicle (Phagosome Antigen Presentation and Antigen Presentation), AZD5069 vs Vehicle (Neutrophil Activation and Phagocytosis), and AZD5069/Anti-PD1 vs Vehicle (G2-M). (H) Timeline schematic for neutrophil based therapy treatment regime in the orthotopic NASH-HCC model. (I) Quantification of tumour burden in orthotopic NASH-HCC mice treated with anti-PD1 and immature or mature neutrophils at day 28 post-intrahepatic injection. (J, K) Flow cytometric quantification and representative histogram plot of CD86 median fluorscent intensity (MFI) of intraturmoural XCR1+原位NASH-HCC中性粒细胞/抗pd1治疗小鼠在第28天的cDC1细胞。(L, M)肿瘤内CD8的定量+和gramzyme B+原位NASH-HCC中性粒细胞/抗pd1治疗小鼠肿瘤第28天的计数/场。数据来自:Bulk DEN/ALIOS Ly6G+(A, F, G)为TAN RNA-Seq数据,(D, E)为大块肿瘤微阵列。(B, I, J, L, M)为单个小鼠。显著性检验使用:单因素方差分析和Tukey多重比较检验(B, I, J, L, M)。确切的p值显示在图上。ALIOS,美国生活方式诱导肥胖综合征饮食;方差分析,方差分析;窝,Diethylnitrosamine;肝癌,肝细胞癌;包含IHC,免疫组织化学;ICI,免疫检查点抑制;NASH,非酒精性脂肪性肝炎;TANs,肿瘤相关中性粒细胞。
对nash相关和非nash相关HCC患者的转录组数据的查询发现,与其他病因的HCC相比,NASH-HCC的晚期中性时间特征明显丰富44(图6 d).此外,晚期中性时间谱与人类hcc特别相关,这些hcc是按基因表达分层到免疫级别的,特别是在这一组中,是典型的免疫治疗耐药的衰竭免疫级别的(图6 e).44-47这表明,人类NASH-HCC中的TANs与小鼠NASH-HCC中的TANs的成熟表型相似,并可能在预防患者的ICI反应中发挥作用,因此,我们推测它们可能对AZD5069/抗pd1治疗的类似治疗中性时间重编程很敏感。为了检查中性粒细胞重编程的阶段,我们在DEN/ALIOS模型中比较了治疗组的瘤内和循环中性粒细胞谱。中性时间重编程是针对AZD5069/anti-PD1治疗小鼠瘤内人群的,值得注意的是,在该治疗组的循环中性粒细胞中没有相关的中性时间变化(图6 f),这一观察结果与肿瘤选择性中性粒细胞重编程一致。因此,虽然联合治疗带来了TAN成熟度的重编程,但它保留了循环中性粒细胞的成熟表型,这是其经典的抗微生物监视功能所必需的。48 49
纯化Ly6G的RNA-Seq+中性粒细胞显示,与对照相比,AZD5069/抗pd1治疗小鼠的TANs在与细胞周期、吞噬和抗原递呈相关的过程网络中富集(图6克而且在线补充图7C).AZD5069单药治疗适度增强了与细胞分裂、吞噬和脱颗粒相关的信号的表达,同时也引起了原体基因表达的减少,当AZD5069与抗pd1联合使用时,所有这些作用都被强化了(图6克而且在线补充图7C-E).抗pd1治疗促进了抗原呈递和处理信号,AZD5069/抗pd1联合治疗也富集了抗原呈递和处理信号,但AZD5069单独治疗则没有(图6克).这些发现再次表明AZD5069/抗pd1治疗对TAN表型的组合作用。AZD5069单药治疗(而非抗pd1单药治疗)抑制了TANs中关键免疫检查点分子的表达,包括下调Cd80、Pvr、Sirpa、Pdl1而且Pdl2.这种免疫检查点基因表达的缺失在联合治疗和某些基因(如:Pvr而且Srpa)我们注意到,与单独AZD5069单药治疗相比,抑制作用更明显(在线补充图7F).因此,在AZD5069/anti-PD1治疗的肿瘤中观察到的富含tan的免疫中枢能够避免可能导致免疫衰竭的ICI信号。AZD5069/anti-PD1 TANs也显示出与急性全身炎症反应中中性粒细胞的转录变化有很强的相关性,50包括参与胞吐、髓细胞活化和脱颗粒的基因表达(在线补充图7G,H).最后,这些AZD5069/anti-PD1 TANs与最近客观表征的急性炎症不成熟ly6g非常相似Int从脂多糖(LPS)处理小鼠中分离的中性粒细胞群50(在线补充图7I).综上所述,AZD5069/anti-PD1联合治疗导致HCC-NASH TANs重编程,表现出不成熟、增殖和炎症特征。
根据这些数据,我们假设激活的早期中性时间tan具有抗肿瘤的特性。由于其相对较少的数量和缺乏特异性的表面标记,不可能从肿瘤中分离出重编程的TANs来正式测试这一假设。相反,作为原理证明,我们分离了在lps处理小鼠的BM中富集的炎症性未成熟中性粒细胞和从对照PBS处理小鼠中分离的成熟BM中性粒细胞池。将这些细胞过继转移到原位NASH-HCC小鼠,我们询问联合抗pd1治疗是否会产生抗肿瘤效果(图6 h而且在线补充图7J,K).炎症性未成熟中性粒细胞的转移导致循环中未成熟CXCR2的显著增加罗增加血液中的中性粒细胞,使肿瘤负担显著减轻(图6我而且在线补充图7L).相比之下,成熟中性粒细胞的转移对肿瘤负担没有影响(图6我).为了研究潜在的机制,我们检查了肿瘤内cDC1和CD8+T细胞。与AZD5069/anti-PD1治疗小鼠相似,我们注意到输注未成熟的中性粒细胞导致激活增加(CD86+)的肿瘤内XCR1+cDC1细胞和升高的CD8+肿瘤中的T细胞,不同于注射等量成熟中性粒细胞的小鼠(图6 j-l).此外,从LPS处理的中性粒细胞过继转移与瘤内Gzmb表达增加有关,表明肿瘤内细胞毒性活性的刺激(图6米).因此,我们得出结论,BM衍生的未成熟炎症中性粒细胞与AZD5069/抗- pd1重编程TANs表型相似,能够刺激HCC肿瘤内的免疫重塑并促进抗肿瘤作用。
讨论
免疫基础疗法对治疗晚期肝癌有很大的希望,然而目前的有效率很低,根据最近的报道,这至少部分取决于肿瘤的免疫细胞组成。45 51 52NASH背景下的HCC需要额外的考虑,因为炎症细胞和疾病中表现的各种代谢适应之间发生的串扰,如胰岛素抵抗、脂肪变性、氧化应激和线粒体功能改变。53Pfister和他的同事已经报道了NASH-HCC的免疫治疗可能会由于高数量的原体CD8而受到影响+PD1+肿瘤微环境中的T细胞。9本研究显示,在nnash - hcc中,用CXCR2拮抗剂选择性靶向中性粒细胞可促进抗pd1治疗的抗肿瘤效果,这种效果与经典CD8的激活机制相关+T细胞和DC介导的抗肿瘤免疫,但也与瘤内重编程的TAN成熟和表型。基于IMC,我们认为以其增殖和炎症特征为特征的重编程TANs与CD8紧密结合+T细胞和APCs在NASH-HCC肿瘤微环境中形成抗肿瘤gzmb分泌免疫枢纽。因此,我们的工作强调了在癌症中对先天免疫系统进行靶向治疗操作的强大潜力,但也揭示了C-X-C趋化因子/CXCR2和PD1/PDL1信号系统之间以前未被认识的串音,可能被利用来改善免疫治疗反应,不仅在NASH-HCC中,而且在其他类型的表现出免疫治疗耐药的癌症中。54 55
中性粒细胞浸润是人类NASH的一个重要病理特征,可能是由于肝脏CXCL8 (IL-8)和CXCL1的上调引起的,56 57我们在这里也报道了它在人类NASH-HCC中富集。此外,NASH中性粒细胞上CXCR2的表达通过一种涉及中性粒细胞衍生脂脂素2上调的自刺激机制选择性增强。58中性粒细胞一旦出现在NASH和NASH- hcc微环境中,就会暴露在高水平的TGF-β中,正如其他癌症报道的那样,月19 - 21日可以使TANs极化到所谓的“N2”促进肿瘤的状态。14这也是有关处理TANs和髓源性抑制细胞(MDSC)之间的关系,后者是由多形核粒细胞Ly6G组成的异质群体+Ly6C罗(PMN-MDSC)和单核细胞Ly6G-Ly6C嗨(M-MDSC)细胞。越来越多的证据表明,PMN-MDSC是免疫抑制中性粒细胞,其功能可能与被称为“N2”的tan非常相似,具有共同的原体特性。14 59在小鼠中,没有标记物可以区分PMN-MDSCs和中性粒细胞,因此,我们不能排除nna - hcc小鼠模型中的TANs包括PMN-MDSCs,它也可能在CXCR2拮抗和抗pd1联合治疗的反应中易发生重编程。然而,典型的抑制作用对DC和CD8+AZD5069/抗pd1联合治疗明显克服了与PMN-MDSCs和免疫抑制中性粒细胞活性相关的T细胞功能。
越来越多的证据表明,CXCR2抑制可能对许多人类癌症有治疗作用,包括;胰腺,肺,卵巢,前列腺,结肠,现在是肝脏。26 - 30日60此外,在肺癌基因小鼠模型中,抑制CXCR1和2受体结合抗pd1可放大抗肿瘤反应。61 62然而,到目前为止,被提出的作用机制被认为依赖于肿瘤免疫微环境的重编程,主要是由于髓系募集受损的结果。我们研究中最显著的免疫生物学发现是,矛盾的是,当与抗pd1结合时,CXCR2抑制会导致肿瘤中性粒细胞的增加和TAN中性时间的选择性重编程,而没有证据表明对循环中性粒细胞有类似的系统性影响。重编程TANs的不成熟增殖表型引起髓外颗粒生成,这可以在抗体介导的Ly6G缺失后的小鼠中看到+这是由于残余组织中性粒细胞的存活和扩张由高水平的系统性粒细胞集落刺激因子驱动,63事实上,这种反弹效应意味着我们无法利用这个协议直接询问重新编程的tan的功能。然而,作为原理证明,我们能够确定过过性转移从lps处理小鼠的BM中分离的未成熟活化的中性粒细胞对NASH-HCC具有抗肿瘤活性,这种作用伴随着肿瘤免疫的重塑,包括cDC1细胞的激活,CD8的升高+T细胞计数与抗肿瘤Gzmb的诱导作用这些变化在AZD506/抗pd1治疗中也被注意到。在未来的工作中,重要的是识别重编程TANs的选择性标记,这些标记可能被用于详细的功能表征,以及实现目前不可能的选择性实验操作。此外,准确确定CXCR2拮抗剂和抗pd1联合治疗如何以及为什么选择性地诱导肿瘤中增殖的未成熟中性粒细胞也很重要。在临床上,选择性重规划TANs同时在循环中保留成熟的抗微生物中性粒细胞的能力可能与HCC非常相关,因为细菌感染和脓毒性休克是肝硬化患者(90%的HCC发生)常见的临床挑战。64
总之,我们提出了一种新的联合免疫疗法,可增强抗pd1在NASH-HCC中的疗效。由于CXCR2拮抗剂AZD5069已被证明在人类中使用是安全的,因此确定HCC患者是否可以从类似的治疗中获益是及时的。
方法
小鼠伦理批准
所有使用原位NASH-HCC模型和DEN/ALIOS模型的动物实验均按照英国内政部许可证(PP8854860, PP390857和PP0604995)进行,并遵守arrival指南(https://www.nc3rs.org.uk/arrive-guidelines),并根据英国《1986年动物(科学程序)法》,并接受格拉斯哥大学及纽卡斯尔大学动物福利及伦理评审委员会的评审。所有小鼠均被置于特定的无病原体环境中,不受限制地获得食物和水,并在受控气候(19°C - 22°C,湿度45%-65%)下持续12小时的明暗循环。所有使用CD-HFD的动物实验都是按照德国法律和政府机构进行的,并得到了Regierungspräsidium卡尔斯鲁厄(G11/16, G129/16, G7/17)的批准。雄性小鼠被安置在德国癌症研究中心(DKFZ)(恒温20°C - 24°C,湿度45%-65%,昼夜循环12小时,并在特定的无病原体条件下维持。
量化和统计分析
使用GraphPad Prism软件(V.9 GraphPad software, La Jolla, CA, USA)和R (V.3.5.1)进行统计分析,并被认为具有统计学意义。P值包含在数字中。
中描述了其他方法在线补充资料.
数据可用性声明
数据可在一个公共的、开放访问的存储库中获得。所有数据将在发布前以登录码、唯一标识符或公开数据集的网页链接保存。
伦理语句
病人同意发表
伦理批准
收集和使用人体组织得到了东北-纽卡斯尔和北泰恩赛德研究伦理委员会的伦理批准。手术切除的人类肝组织是在完全伦理批准(H10/H0906/41)和通过CEPA生物库(17/NE/0070)下获得的,并在患者书面同意的情况下使用。HCC肿瘤和非肿瘤活检组织是在纽卡斯尔和北泰恩赛德地区伦理委员会、纽卡斯尔学术健康合作伙伴生物资源(NAHPB)和泰恩河畔纽卡斯尔NHS基金会信托研究与开发(R&D)部门批准的完全伦理批准下获得的。(参考编号:10/H0906/41;NAHPB 48项目;REC 12 /不/ 0395;研发6579;人体组织法执照12534)。
致谢
我们希望CRUK比特森研究所的核心服务和先进技术,特别感谢生物服务单元、分子服务、生物信息学、组织学部门和比特森高级成像资源。我们要感谢Danijela Heide, Jenny Hetzer对CD-HFD NASH-HCC模型的技术支持。我们要感谢Catherine Winchester和Nathalie Sphyris对手稿的批判性阅读。我们要感谢纽卡斯尔大学比较生物学中心、纽卡斯尔大学生物成像单元和纽卡斯尔大学流式细胞术核心设施的技术援助。
参考文献
补充材料
脚注
JL, JBGM和TJ是共同第一作者。
JML, LMC, TGB, OJS和DAM是联合高级作者。
推特@FFERCOQ, @ef_roger, @DrCEWilloughby, @mimue_lab
调整通知这篇文章在Online First发布后进行了修改。添加了联合高级共享作者声明,并更新了通信作者的地址。
贡献者JL, JM和TJ完成了手稿中提出的大部分实验室基础工作和分析。ER、TD、FF、WC、KG、AH、CN、SL、ML、RP、PH、RE、CEW、MR、CAF、DP、SR、NW、MVM、AC、DG、AF、DM、AF、XC-L、N-EM、CAF、XLRI、AJM、MVM、RAR进行了部分实验室实验及相关分析。ER、SB、JML、MFH和GG为实验设计和写作提供了建议和/或贡献。JL, JM, HR, LC, TB, OJS和DAM构思研究,设计实验并撰写手稿。所有作者都阅读并评论了最终稿。DAM、OJS、HR、LC和TB提供了资金。DAM是这项研究的担保人。
资金DM、OJS、HR和TB由CRUK (C9380/A26813)的项目赠款资助。DM由MRC项目赠款MR/ k009494 /1和MR/R023026/1支持。DM, OJS, HR, TB, JM和JML由CRUK项目赠款(C18342/A23390)支持。OJS由CRUK拨款(CRUK A21339)资助。LC由CRUK赠款(CRUK A23983)资助。结核病得到了阿斯利康的研究资金支持。结核病和MM由威康信托基金(WT107492Z)资助。HR由CRUK Newcastle实验癌症医学中心奖(C9380/A18084)资助。JM和TJ得到了CRUK核心资金(A17196和A31287)的支持。JL得到了纽卡斯尔大学医学院的资助。 DG is supported by the Newcastle CRUK Clinical Academic Training Programme. AC is funded by the WE Harker Foundation. RE is supported by a doctoral training grant from MICINN/MINECO (BES-2017-081286) and a mobility grant from Fundació Universitària Agustí Pedro i Pons. CEW is supported by a Sara Borrell fellowship (CD19/00109) from the Instituto de Salud Carlos III (ISCIII) and the European Social Fund. PH is supported by a fellowship grant from the German Research Foundation (DFG, HA 8754/1-1). CA-O is supported by a predoctoral research scholarship from Fulbright España. JL is supported by grants from the NIH (RO1DK56621 and RO1DK128289), the Samuel Waxman Cancer Research Foundation, the Spanish National Health Institute (PID2019-105378RB-I00), through an Accelerator award in partnership between Cancer Research UK, Fondazione AIRC and Fundación Científica de la Asociación Española Contra el Cáncer (HUNTER, C9380/A26813), and by the Generalitat de Catalunya (AGAUR, SGR-1358).
相互竞争的利益DM是Fibrofind的董事。JL和DM是Fibrofind有限公司的股东。SB拥有阿斯利康的股份。OJS获得了阿斯利康和诺华的资助。TGB获得了阿斯利康的研究资金支持。JML获得了拜耳医疗保健制药公司、卫材公司、百时美施贵宝、Boehringer-Ingelheim和益普生的研究支持,并获得了礼来、拜耳医疗保健制药公司、百时美施贵宝、卫材公司、Celsion公司、Exelixis、默克、益普生、基因泰克、罗氏、糖测试、Nucleix、Sirtex、Mina Alpha和阿斯利康的咨询费。
患者和公众的参与患者和/或公众未参与本研究的设计、实施、报告或传播计划。
来源和同行评审不是委托;外部同行评审。
补充材料本内容由作者提供。它没有经过BMJ出版集团有限公司(BMJ)的审查,也可能没有经过同行评审。讨论的任何意见或建议仅仅是那些作者(s)和不被BMJ认可。BMJ放弃从放在内容上的任何依赖产生的所有责任和责任。如果内容包含任何翻译材料,BMJ不保证翻译的准确性和可靠性(包括但不限于当地法规、临床指南、术语、药品名称和药物剂量),并且不对翻译和改编或其他原因引起的任何错误和/或遗漏负责。
请求的权限
如果您希望重用这篇文章的任何部分或全部,请使用下面的链接,它将带您访问版权清除中心的RightsLink服务。您将能够快速获得价格和以多种不同方式重用内容的即时许可。