Article Text
Abstract
ObjectiveDespite significant progresses in imaging and pathological evaluation, early differentiation between benign and malignant biliary strictures remains challenging. Endoscopic retrograde cholangiopancreatography (ERCP) is used to investigate biliary strictures, enabling the collection of bile. We tested the diagnostic potential of next-generation sequencing (NGS) mutational analysis of bile cell-free DNA (cfDNA).
DesignA prospective cohort of patients with suspicious biliary strictures (n=68) was studied. The performance of initial pathological diagnosis was compared with that of the mutational analysis of bile cfDNA collected at the time of first ERCP using an NGS panel open to clinical laboratory implementation, the Oncomine Pan-Cancer Cell-Free assay.
ResultsAn initial pathological diagnosis classified these strictures as of benign (n=26), indeterminate (n=9) or malignant (n=33) origin. Sensitivity and specificity of this diagnosis were 60% and 100%, respectively, as on follow-up 14 of the 26 and eight of the nine initially benign or indeterminate strictures resulted malignant. Sensitivity and specificity for malignancy of our NGS assay, herein named Bilemut, were 96.4% and 69.2%, respectively. Importantly, one of the four Bilemut false positives developed pancreatic cancer after extended follow-up. Remarkably, the sensitivity for malignancy of Bilemut was 100% in patients with an initial diagnosis of benign or indeterminate strictures. Analysis of 30 paired bile and tissue samples also demonstrated the superior performance of Bilemut.
ConclusionImplementation of Bilemut at the initial diagnostic stage for biliary strictures can significantly improve detection of malignancy, reduce delays in the clinical management of patients and assist in selecting patients for targeted therapies.
- biliary strictures
- diagnostic and therapeutic endoscopy
- cholangiocarcinoma
- pancreatic tumours
- mutation screening
Data availability statement
Data sharing not applicable as no datasets are generated and/or analysed for this study. Our data are not in a repository. Deidentified participant data are all included in the submission.
This is an open access article distributed in accordance with the Creative Commons Attribution Non Commercial (CC BY-NC 4.0) license, which permits others to distribute, remix, adapt, build upon this work non-commercially, and license their derivative works on different terms, provided the original work is properly cited, appropriate credit is given, any changes made indicated, and the use is non-commercial. See:http://creativecommons.org/licenses/by-nc/4.0/.
Statistics from Altmetric.com
- biliary strictures
- diagnostic and therapeutic endoscopy
- cholangiocarcinoma
- pancreatic tumours
- mutation screening
Significance of this study
What is already known on this subject?
In spite of significant advances in imaging, endoscopic and pathological evaluation, distinguishing between benign and malignant biliary strictures remains a diagnostic challenge. This situation dramatically affects the identification, management and prognosis of patients with biliopancreatic tumours.
Endoscopic retrograde cholangiopancreatography (ERCP) plays a key role in the evaluation of biliary strictures and enables the collection of bile samples.
The genetic landscape of biliopancreatic tumours has been defined in recent years.
What are the new findings?
We have selected a next-generation sequencing (NGS) panel open to clinical laboratory implementation and developed a mutational analysis of bile cell-free DNA (cfDNA) collected during ERCP, the Bilemut assay.
Our results confirm the better performance of liquid biopsy strategies increasing the diagnosis sensibility and the number of mutations detected in bile compared with the corresponding paired tumours.
We have tested the Bilemut assay in a prospectively collected cohort of bile cfDNA samples from patients undergoing first diagnostic ERCP. Our test alone was markedly superior to the initial pathological diagnosis, particularly for cases of strictures initially diagnosed as of benign or indeterminate origin.
Significance of this study
How might it impact on clinical practice in the foreseeable future?
Our findings highlight the remarkable diagnostic potential of bile cfDNA NGS-based analysis for patients undergoing ERCP. Implementation of Bilemut at the initial diagnostic stage for biliary strictures can significantly improve malignancy detection, reduce delays in clinical management of patients and assist in selecting patients for targeted therapies.
Introduction
The accurate aetiological diagnosis of biliary stenoses remains a clinical challenge. Strictures of the bile duct may have diverse origin,1and the discrimination between benign and malignant stenoses in their early stages has not been satisfactorily resolved yet.2Benign conditions include primary sclerosing cholangitis (PSC), chronic pancreatitis, choledocolithiasis and bile duct injury and infections, while malignant stenoses are mostly attributable to neoplasia arising from the biliary tree such as cholangiocarcinoma (CCA) or from the pancreas, like pancreatic ductal adenocarcinoma (PDAC).2–5CCAs and PDACs are very aggressive neoplasms, and therefore, their early diagnosis is essential for the application of potentially curative surgical procedures and/or pharmacological therapies.5–7Biliary cancers are technically difficult to biopsy,7and several multidisciplinary diagnostic tools are used to discriminate benign from malignant biliary strictures.4 8These include a range of non-invasive imaging techniques plus endoscopic retrograde cholangiopancreatography (ERCP). ERCP allows relief of biliary obstruction in patients with stenosis while providing high-resolution fluoroscopic images and tissue sampling by biliary brushings and endoluminal biopsies.4However, the sensitivity for detecting malignancy with ERCP, even when combined with brush cytology and fluorescent in situ hybridisation, plus the analysis of the circulating tumour biomarker carbohydrate antigen 19–9 (CA19-9), is still suboptimal, ranging from 14% to 60%.4 9–11Patients may often undergo repeated ERCP procedures, and critical therapeutic decisions can be delayed. Alternatively, a false diagnosis of malignant stricture may result in an unnecessary extensive surgery.12Therefore, the identification of robust markers that can allow early and reliable discrimination between benign and malignant biliary stenoses is very much needed.
Advances in the molecular characterisation of biliary tumour tissues have revealed their mutational landscape. In CCA, as well as in PDAC, next-generation sequencing (NGS) technologies have identified recurrent alterations in a relatively small number of oncogenes and tumour suppressor genes, includingTP53,KRAS,CDKN2A,SMAD4,PIK3CA,GNAS,ERBB2andFGFRs, with some of these being amenable to pharmacological targeting.7 13–20A recent study demonstrated that a customised NGS analysis of ERCP-obtained bile duct biopsies improved the sensitivity of pathological evaluation in the detection of malignant strictures.10
Liquid biopsy strategies are actively pursued in all fields of oncology,21 22and the detection of mutations in blood cell-free DNA (cfDNA) holds promise for the diagnosis of patients with pancreatic and biliary carcinomas.23 24Of note, the ERCP procedure enables the collection of biliary fluid. The cfDNA isolated from bile may include DNA molecules originating from premalignant or malignant cells anywhere in the bile duct system. Therefore, cfDNA analysis may avoid the limited sensitivity of intraductal tissue brushings and biopsies and capture the genetic alterations found in biliopancreatic tumours.10 25 26Earlier studies evaluated the presence of specificKRASandTP53mutations in bile DNA samples from patients with benign and malignant strictures.27–30These studies supported the potential of such analyses to improve diagnosis of malignant disease. Moreover, it was also realised that the detection of such mutations in bile samples from patients without malignancy could identify individuals with preneoplastic lesions and at risk of progressing to cancer.28However, the conventional sequencing technologies applied in these studies lacked the sensitivity of current amplification and sequencing tools, and the analyses were restricted to a few codons withinKRASandTP53genes, markedly reducing the overall performance of the assays.
In this prospective proof-of-concept pilot study, we evaluated if NGS mutational analysis of cfDNA in bile could represent a new type of liquid biopsy for the detection of malignancy. For a rapid translation of the expected results, we tested two commercially available NGS cancer gene panels open to clinical laboratory implementation.
Materials and methods
Patients
A cohort of 68 patients prescribed to undergo ERCP with a diagnosis of bile duct stenosis was prospectively accrued for the study from January 2017 to December 2020 at the Navarra University Hospital Complex, Pamplona, Spain. Their demographic and clinical characteristics are summarised infigure 1A.All patients were older than 18 years and provided written informed consent for the examination of their samples and the use of their clinical data. The initial diagnosis of the strictures at the time of bile sample collection was based on histological result from the first ERCP-bile duct brushing or biopsy, bile duct or pancreatic mass endoscopic ultrasound-guided fine needle aspiration (EUS-FNA) or percutaneous needle biopsy. The selection of the diagnostic procedure was established according to patient and tumour characteristics and following standard clinical practice. Initial diagnosis of indeterminate stenosis was assigned when there was no sufficient sample to establish a diagnosis. The final clinical diagnosis was defined as in previous studies, based on histological evidence and clinical or radiographic follow-up.4 8 10 31–34We designated malignant stenosis when we found histological evidence of adenocarcinoma or clinical or radiographic malignancy progression after ≤12 months of follow-up or death determined to be due to a malignancy involving the bile duct. We designated benign stenosis based on the absence of clinical and radiographic progression or resolution of the bile duct stricture after ≤12 months follow-up or when surgically resected specimens confirmed benign cholangiopathy. In total, 50 ERCP-bile duct brushings, nine ERCP-bile duct biopsies, 19 EUS-FNA and three percutaneous needle biopsies were collected for pathological evaluation to define the initial diagnosis. Representative images of cytological preparations resulting in correctly diagnosed and misdiagnoses cases after follow-up are shown inonline supplemental figure 1.In addition, 68 bile samples were collected. Diagnostic and clinical follow-up information for each patient is described in detail inonline supplemental table 1.The mean time of follow-up was 15.5 months (range: 0–42 months). Informed consent was obtained from each patient. Patients and the public were not involved in the design, conduct, reporting or dissemination plans of this research. The study protocol was approved by the ethics committee of the Navarra University Hospital Complex, Pamplona, Spain (protocol number: 2016/91).
Supplemental material
Supplemental material
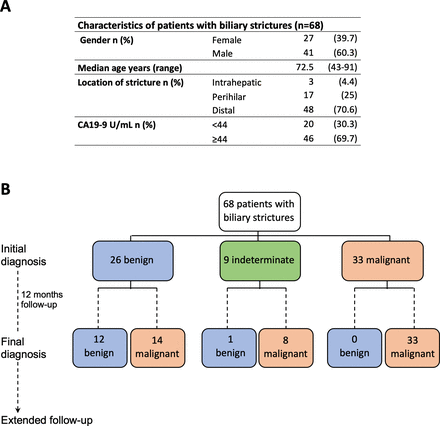
Characteristics of the patients included in the study and their diagnosis.(一个) Demographic description, location of biliary strictures and serum carbohydrate antigen 19–9 (CA19-9) levels of patients included in this study at the time of initial diagnosis. (B) Flow chart indicating the initial and final clinical diagnosis of the patients.
Additional details are provided asonline supplemental material 1.
Supplemental material
Results
Diagnostic performance of conventional clinicopathological evaluation of patients with bile duct stenoses
A cohort of 68 patients undergoing ERCP for a bile duct stricture was prospectively accrued (figure 1A). At the time of the initial ERCP, EUS and pathological examination, patients were diagnosed and classified as having stenoses of benign (n=26), indeterminate (n=9) or malignant origin (n=33) (figure 1B). After a follow-up time of 12 months, the final clinical diagnosis resulted in 14 out of the 26 cases initially classified as benign resulting malignant and eight out of the nine indeterminate cases also being malignant, while the malignancy of the remaining 33 cases was confirmed (figure 1Bandonline supplemental table 1). Our initial pathological diagnosis was in agreement with the high specificity for detection of malignancy, 100% in our case, reported in current clinical practice.10Also in line with current standards, the sensitivity for malignancy in our initial clinical diagnosis was 60%.1 4 8 10The evaluation of CA19-9 serum levels at a threshold of >44 U/mL10yielded a sensitivity of 74% and specificity of 61% for detecting malignancy. These findings confirm the poor overall performance of the currently implemented clinicopathological evaluation of patients with biliary strictures in terms of sensitivity yield and further emphasise the need to develop complementary effective strategies.
Mutational analysis of bile cfDNA: methodological set-up and selection of best-performing NGS panel
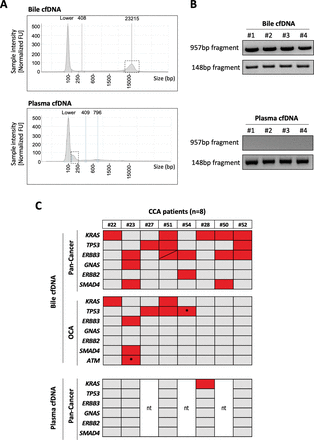
As introduced above, we hypothesised that the evaluation of the mutational landscape of bile cfDNA might improve the limited sensitivity of the overall diagnostic procedure, including the pathological analysis of intraductal tissue brushing and biopsies, therefore better detecting the eventual presence of tumours. We extracted and purified cfDNA from 1 mL of bile aliquots, and for comparison, we also extracted cfDNA from the same volume of plasma. Remarkably, we found that the total amount of cfDNA in bile was about 20-fold of that obtained from the same volume of plasma (886.10±182.3 ng/mLvs40.52±7.46 ng/mL, respectively, n=20). Most interestingly and consistent with a recent report that analysed bile cfDNA obtained by percutaneous transhepatic cholangial drainage,35we also observed that in contrast with cfDNA obtained from plasma, bile cfDNA was enriched in much larger DNA fragments. This can be appreciated in the electropherogram shown infigure 2A.Here, we provide direct confirmation of this difference by showing the PCR amplification of a large DNA fragment from a test gene (TP53) only in bile cfDNA, while a smaller DNA fragment from the same gene was amplified in cfDNA from both biofluids (figure 2B).
胆汁和等离子体的分析cell-free DNA (cfDNA) and comparison of Pan-Cancer and Oncomine Comprehensive Assay (OCA) panels’ performance in bile cfDNA from patients with cholangiocarcinoma (CCA).(一个). Representative electropherograms showing the size distribution of cfDNA obtained from human bile and plasma. (B) Representative images of agarose gels showing PCR-amplified fragments ofTP53gene of high and low molecular weight from four independent samples of bile or plasma cfDNA. (C) Heat maps show the mutated genes detected by both panels in the same bile samples, and the mutations detected by the Pan-Cancer panel in plasma cfDNA. Asterisks indicate specific mutations that are not included in the Pan-Cancer panel. ‘nt’: not tested. BP, base pairs; FU, fluorescence units.
Among the commercially available NGS panels open to clinical laboratory implementation, the Oncomine Comprehensive Assay panel V.3 (OCA, Thermo Fisher) presents an extensive mutational coverage and works well with the relatively larger DNA fragments obtained from formalin-fixed paraffin-embedded (FFPE) tissues.36On the other hand, the Oncomine Pan-Cancer Cell-Free assay has been developed for the evaluation of the small and low abundant circulating cfDNA obtained from plasma37and also works well in other biological samples such as cerebrospinal fluid.38Therefore, we tested side by side the performance of the OCA and Pan-Cancer NGS panels in eight bile samples from patients with firmly established CCA diagnosis. As shown infigure 2C, the Pan-Cancer Cell-Free assay detected a total of 18 mutations in all eight cfDNA samples. However, the OCA panel, which has a threefold higher coverage for genetic alterations than the Pan-Cancer assay, failed to detect any mutation in three patients, identifying a total of eight mutations. There were two specific mutations, inTP53andATMgenes, marked with an asterisk infigure 2C, that were detected only with the OCA panel as they are not included in the Pan-Cancer panel design. As the Pan-Cancer panel is designed for the analysis of liquid biopsies, we also tested five plasma cfDNA samples from this set of patients using this panel. As shown infigure 2C, only one of these samples tested positive in plasma, while mutations were found in all the paired bile samples. These observations indicated that the Pan-Cancer Cell-Free assay implemented in bile cfDNA samples, named here the Bilemut assay, has increased sensitivity for the detection of mutations and therefore was the optimal choice of our subsequent bile cfDNA screening.
Performance of the Bilemut assay in patients with malignant stenoses
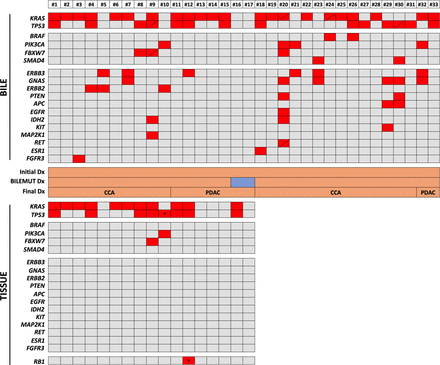
We first assessed the performance of the Bilemut assay in the 33 bile samples collected at the initial ERCP from patients with a confirmed final clinical diagnosis of malignancy (24 CCAs and nine PDACs), from which 17 paired tumour tissue samples were also available. The Bilemut assay identified mutations in all but two bile samples (numbers 16 and 17) corresponding to patients diagnosed with PDAC (figure 3upper panel). The OCA panel detected mutations in 12 of the 17 tumour tissues tested, with one CCA and four PDAC samples (including number 17) resulting negative (figure 3lower panel). Mutations inKRASandTP53genes were the most frequent alterations identified both in bile and tissues. However, the Bilemut assay captured mutations in a much wider range of genes, includingERBB3,GNAS,FBXW7,ERBB2,IDH2,MAPK2K1andFGFR3, across all samples compared with the OCA panel assay performed in tissues (figure 3). The sensitivity of the Bilemut assay in this set of samples was 93.9%. We also analysed plasma cfDNA from five patients diagnosed with PDAC (patient numbers 12–16). The Pan-Cancer panel did not detect mutations in any of them (data not shown). At this stage, we also tested six bile cfDNA samples collected from healthy living liver donors as negative controls for the Bilemut assay and did not find any genetic alterations (data not shown). Moreover, independent repeat analysis of two previously tested positive and negative bile cfDNA samples yielded the same results, attesting to the reproducibility of the Bilemut assay (data not shown).
Mutational profile of bile cell-free DNA (cfDNA) and paired tissue DNA samples from patients with malignant stenoses.The heatmap in upper panel shows the mutations detected with the Pan-Cancer panel in bile cfDNA, and the heatmap in the lower panel shows mutations identified with the Oncomine Comprehensive Assay (OCA) panel in the available paired tissues. Asterisks indicate specific mutations that are not included in the Pan-Cancer panel. Diagonal lines indicate the detection of two different mutations in the corresponding gene. The initial diagnosis (Dx), Bilemut diagnosis and final clinical diagnosis, as well as the type of tumour, are indicated. CCA, cholangiocarcinoma; PDAC, pancreatic ductal adenocarcinoma.
Performance of the Bilemut assay for the early diagnosis of patients with non-malignant bile duct strictures
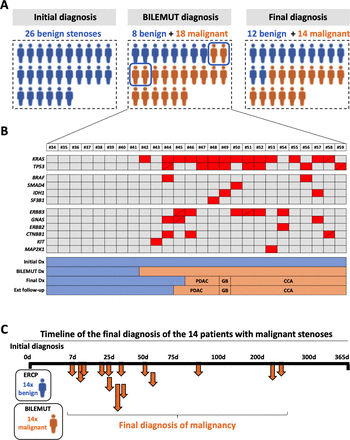
Next, we implemented the Bilemut assay in the cohort of patients that received an initial diagnosis of stenosis of benign origin (figure 1B). Bile samples were collected at the time of first ERCP; cfDNA was analysed; and according to the absence or presence of any genetic alteration, patients were classified as having benign or malignant stenoses. For patients with an initial pathological diagnosis of benign stenosis (n=26), mutations were found in 18 of them. Therefore, considering the application of Bilemut assay at the moment of the initial diagnosis, of the 26 benign stenoses, 18 would be classified as malignant and eight as benign. On the other hand, the final clinical diagnosis resulted in 14 of the 26 patients having malignant stenoses. These results are graphically summarised infigure 4A.所有的Bilemut突变景观se patients is shown infigure 4B, which also indicates their classification into benign and malignant stenoses according to the final clinical diagnosis. Infigure 4C, we show the timeline of the final clinical diagnosis of the 14 patients that ended up developing malignant stenoses. We were also able to analyse 10 paired tumour tissue samples. The results were similar to those shown infigure 3, with the Bilemut assay detecting a higher number of mutations than the OCA assay, which was negative for one tissue sample (number 53) (online supplemental figure 2A).
Supplemental material
Diagnostic performance of the Bilemut assay in patients with an initial diagnosis of benign stenosis.(一个) Schematic representation of the initial clinical diagnosis, the Bilemut assay diagnosis and the final clinical diagnosis of patients. The four Bilemut false-positive patients are encircled. (B) Heatmap showing the mutational profile of bile cell-free DNA (cfDNA), Bilemut assay, at the time of initial diagnosis. Diagonal lines indicate the detection of two different mutations in the corresponding gene. The initial diagnosis (Dx), Bilemut diagnosis, final diagnosis and extended follow-up diagnosis are indicated. The type of tumour diagnosed (pancreatic ductal adenocarcinoma (PDAC), cholangiocarcinoma (CCA) or gall bladder (GB)) is also indicated. (C). Chronology of malignancy detection during follow-up of patients with an initial diagnosis of benign stenosis. ERCP, endoscopic retrograde cholangiopancreatography.
There were four patients with a final clinical diagnosis of benign stenosis that had mutations in their bile cfDNA and therefore would be considered as false-positive cases for the Bilemut assay. Importantly, extended follow-up of these patients beyond 1 year revealed that one of them was diagnosed with PDAC ten months later (patient number 45). This finding underscores the value of the information provided by Bilemut assay also for its purported false-positive cases.
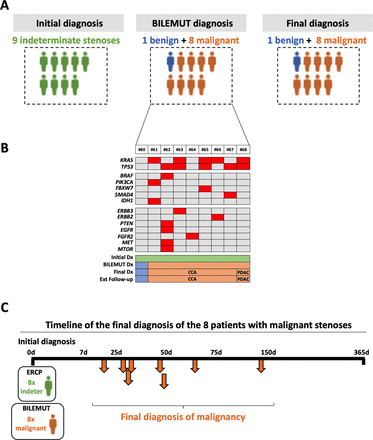
Next, we implemented the Bilemut assay in bile samples from patients with an initial pathological diagnosis of stenosis of indeterminate origin (figure 1B). Of the nine patients studied, mutations were detected in eight of them. Importantly, the final clinical diagnosis resulted in these eight patients developing malignant stenoses, as graphically summarised infigure 5A.Their Bilemut mutational landscape is shown infigure 5B.No mutations were detected in the only patient that received a final diagnosis of benign stenosis (patient number 60). This patient remains tumour-free 22 months after the initial diagnosis and Bilemut assay. We were also able to analyse three paired tumour tissue samples. As observed before, the Bilemut assay identified a greater number of mutations than the OCA panel, which was negative for one tissue sample (number 67) (online supplemental figure 2B). The timeline of the final diagnosis of the eight patients that ended up having malignant stenoses is shown infigure 5C.
Diagnostic performance of the Bilemut assay in patients with an initial diagnosis of indeterminate stenosis.(一个) Schematic representation of the initial clinical diagnosis, the Bilemut assay diagnosis and the final clinical diagnosis of patients. (B) Heatmap showing the mutational profile of bile cell-free DNA, Bilemut assay, at the time of initial diagnosis. The initial diagnosis (Dx), Bilemut diagnosis, final diagnosis and extended follow-up diagnosis are indicated. The type of tumour diagnosed (pancreatic ductal adenocarcinoma (PDAC) or cholangiocarcinoma (CCA)) is also indicated. (C) Chronology of malignancy detection during follow-up of patients with an initial diagnosis of indeterminate stenosis. ERCP, endoscopic retrograde cholangiopancreatography.
In the whole cohort of patients, the Bilemut assay had a sensitivity of 96.4% and a specificity of 69.2% for detecting malignancy. When considering patients with an initial diagnosis of stenosis of benign or indeterminate origin (n=35), the sensitivity of this assay for malignancy detection was 100%. In this same group of patients and considering the extended follow-up, elevated CA19-9 serum levels at a threshold of >44 U/mL10at the time of initial diagnosis yielded a sensitivity of 74% and a specificity of 50% for detection of malignancy, while Bilemut had a sensitivity and specificity of 100% and 80%, respectively.
Pathological molecular findings: mutational analyses
The most prevalent mutations identified with the Bilemut assay among positive bile samples were in theKRAS(71.9%),TP53(47.4%),ERBB3(22.8%),GNAS(15.8%),ERBB2(8.8%),BRAF(8.8%),PIK3CA(8.8%),FBXW7(7.0%) andSMAD4(7.0%) genes. The complete information of the different genes found in bile cfDNA is shown inonline supplemental table 2.这些数据与狗一般协议ational landscape described for biliary and pancreatic tumours, considering the high proportion of CCAs of extrahepatic origin included in our cohort of patients.13 23 39When the 30 paired bile and tumour tissue samples were compared, a total of 66 mutations were detected by the Bilemut assay, while the OCA analysis of tissues only identified 43 alterations. There were seven tissue samples (23%) in which no mutations were found but that were positive in the Bilemut assay, while this test only missed one case that had mutations in its paired tissue. There were 32 mutations detected both in tissue and bile samples, while the Bilemut assay detected 34 additional mutations not found in the corresponding tissues. ForKRAS, the most frequently mutated gene in our cohort of patients, 18 mutations were found in tissue samples, and all but two were also captured in bile cfDNA. However, bile cfDNA analysis identified five additionalKRASmutations that were not detected in paired tissues. ForTP53, 13 mutations were found in tissue samples, two of them not analysed by the Bilemut assay and another not detected. However, four additionalTP53mutations were found in bile cfDNA that were not detected in paired tissues. The concordance between the mutations detected in bile and tissue samples is described inonline supplemental figure 2C.The identity of all mutations identified in bile cfDNA and tissue samples is provided inonline supplemental table 3, and detailed information of the genes analysed by the Pan-Cancer and OCA panels is provided inonline supplemental table 4.
Supplemental material
Supplemental material
Supplemental material
The Pan-Cancer panel includes potentially actionable genetic alterations that are found in biliary and pancreatic malignancies, such as those involving theFGFRgenes,ERBB2andERBB3,BRAF,IDH1andIDH2,PIK3CA,MET,RETandMAP2K17 20 40.Our study shows that mutations in potentially actionable genes were detected in 54% of samples that were positive for the Bilemut assay (online supplemental table 3).
Discussion
In spite of recent and significant advancements in imaging, endoscopic and pathological approaches, the accurate aetiological diagnosis of biliary strictures is still far from satisfactory.8 41In this study, we demonstrate that the mutational analysis of bile cfDNA obtained at the first ERCP procedure in the evaluation of patients with suspected biliary strictures can transform the diagnostic pipeline. For a quick and widespread transfer to the clinic and after evaluating the concentrations and physical characteristics of cfDNA present in bile, we selected the Pan-Cancer Cell-Free assay, an NGS panel readily available for the clinical laboratory, which does not require specialised bioinformatic data interpretation.37 38With this assay, herein named the Bilemut assay, we first validated the high sensitivity for malignancy detection of bile cfDNA mutational analysis in a significant cohort of patients (n=33), which had a final clinical diagnosis of malignant strictures (75% of them were CCAs). Our findings are in agreement with recent reports that detected bile cfDNA mutations with high sensitivity in patients diagnosed with gall bladder cancer35 42and PDAC43or in two small groups of patients diagnosed with CCA (n=4 and 6).35 43We found that our NGS assay had a remarkably high sensitivity for detecting malignancy (96.4%) in comparison with that of the initial diagnosis (60%). Most importantly, our study demonstrated that the implementation of the Bilemut assay can be of particular value for patients that receive an initial diagnosis of stenosis of benign or indeterminate origin, in which this assay demonstrated a 100% sensitivity, considerably advancing in time the diagnosis of malignancy. A recent prospective study evaluated the performance of an NGS panel in DNA obtained from bile duct brushings and biopsies collected during ERCP for the detection of malignancy in patients with biliary stenosis.10Although this approach demonstrated an improved sensitivity over clinicopathological evaluation (73%vs48%), the authors still reported a 25% of false-negative cases. The reason for this limited performance was attributed to inadequate sampling of strictures and/or low specimen tumour cellularity.10This relatively high failure to detect mutations in bile duct brushings and biopsies is consistent with previous works that performed NGS analyses on tissue samples from biliary cancers (see, for instance,44) and with our current study in which 23% of tumour tissues were negative for mutations. As we postulate here, this limitation can be circumvented by the analysis of bile cfDNA, since this fluid may contain genetic material released from tumorous cells anywhere along the biliary tract. The high sensitivity of the Bilemut assay also suggests that in patients undergoing ERCP, this diagnostic approach could be more informative than the mutational analysis of plasma cfDNA, given the known limited performance of the latter in the setting of early-stage disease,22 45and our present observations.
One apparent shortcoming of our study was the detection of mutations in bile cfDNA from patients that received a final diagnosis of benign disease, thus lowering the specificity of the assay. However, this issue should be interpreted with caution. An earlier work that evaluated the presence ofKRASmutations in free cells present in bile from patients with PSC showed that on follow-up, only those individuals havingKRASmutations developed CCAs or dysplasias.28这些发现表明,问好的外观tions in bile cfDNA could indicate the existence of precancerous lesions or very early tumour stages, somewhere in the biliary tree. In fact, in our study, one of the four false-positive cases ended up developing PDAC when followed-up beyond the time established for the final clinical diagnosis. Therefore, those patients with a positive Bilemut assay and a final clinical diagnosis of benign disease may indeed benefit from closer follow-up surveillance.
除了早期癌症检测、肿瘤的基因can detect the presence of mutations amenable to targeted therapies, which also occur in biliary and pancreatic malignancies.7 18–20 40 46 47Analysis of bile cfDNA also provides such information and, as previously discussed, even with better sensitivity than tumour tissue genomic profiling.
We acknowledge that the performance of the Bilemut assay for early detection of malignancy needs to be validated in an independent cohort of patients. Ideally, future studies should include patients with PSC who are at high risk of CCA development,48as well as patients with CCA, that were underrepresented in our cohort.
Nevertheless, in view of the extraordinary sensitivity of the Bilemut assay, we strongly believe that its implementation may leverage the diagnosis and management of patients with biliary stenosis and suspicion of malignancy. Infigure 6A, we propose how Bilemut could be applied within an algorithm for the management of these patients. For those patients with suspicion of malignant stenosis, susceptible of surgical resection and who need preoperative ERCP biliary drainage (case 1), Bilemut could improve presurgical diagnosis and prevent unnecessary surgery in cases of benign aetiology.1 12In fact, had Bilemut been applied in these patients, 100% of them would have gone to surgery with a confirmed diagnosis of malignancy, while that only occurred in 48% of such cases. For those patients not amenable to surgery that require systemic treatment (case 2), Bilemut could confirm the pathological diagnosis, avoid the need of additional diagnostic tests and interventions and also identify mutations to guide targeted therapies. In patients that are not amenable to surgical or systemic therapy and that need biliary drainage (case 3), Bilemut could also confirm the diagnosis of malignancy and thus inform on patients’ prognosis. With the application of Bilemut, 100% of these patients would have received best supportive care with a confirmed diagnosis of malignancy, while this only occurred in 63% of these cases. Finally, in those patients with low suspicion of malignancy (case 4), Bilemut could complement the pathological diagnosis and reduce follow-up time and the number of tests performed. Moreover, as mentioned above, patients with a positive Bilemut that remain free of cancer on follow-up might still benefit from a closer clinical surveillance. Lastly, from a different perspective, although the costs of an NGS analysis such as Bilemut are still high, its application may avoid the need for repeat diagnostic procedures and other medical expenses, finally resulting in a positive benefit–cost ratio. The advantages and limitations of the Bilemut assay are summarised infigure 6B.
(一个) Implementation of the Bilemut assay in an algorithm for the management of patients with biliary stenosis. The four steps in which Bilemut could be applied are indicated by grey boxes. See text for details. This algorithm is based on the National Comprehensive Cancer Network guidelines. (B) Summary of the advantages and limitations of the Bilemut assay. ERCP, endoscopic retrograde cholangiopancreatography; NGS, next-generation sequencing.
Supplemental material
Data availability statement
Data sharing not applicable as no datasets are generated and/or analysed for this study. Our data are not in a repository. Deidentified participant data are all included in the submission.
Ethics statements
Patient consent for publication
Acknowledgments
We acknowledge the technical support of Sara Equiza, Teresa Imizcoz, Beatriz Ramirez and Maria Isabel Mora from CIMA LAB Diagnostics, University of Navarra.
Supplementary materials
-
Supplementary Data
This web only file has been produced by the BMJ Publishing Group from an electronic file supplied by the author(s) and has not been edited for content.
Footnotes
马先生是joint first authors.
JMU, CB and MAA are joint senior authors.
Twitter@danioyon, @LennyNelson15, @CUBEROlab, @Maite G Fernandez-Barrena, @pottoberasain
ContributorsConceptualisation: MA, JMU, CB and MAA. Methodology: MA, JMU, IA, DO, LZ, MRM, JMH, MR, ME, DR-C, CS, IF-U, JC, VJ, GA-A, DG, CZ, IG-B, LJN, JJV, BS, IG, KZ, MK, WP, PM, MUL, MGF-B, CB and MAA. Data curation: JMH, GA-A, AP, MR, MA, CB and JMU. Writing—original draft preparation: CB and MAA. Writing—review and editing: MR, JMU, LJN, MA, CB and MAA. Supervision: JMU, CB and MAA. Project administration: JMU, CB and MAA. Funding acquisition: MA, JMU, CB and MAA.
FundingFunding: We thank the financial support of CIBERehd; grants PI16/01126 and PI19/00163 from Instituto de Salud Carlos III (ISCIII) cofinanced by 'Fondo Europeo de Desarrollo Regional' (FEDER) 'Una manera de hacer Europa'; grants 58/2017 and 55/2018 from Gobierno de Navarra Salud; grant 0011-1411-2020-000010 from AGATA Strategic Project from Gobierno de Navarra; grant 2020/101 from Euroregion Nouvelle Aquitaine-Euskadi-Navarra; Fundación Eugenio Rodríguez Pascual; Fundación Mario Losantos, Fundación M Torres; grant 2018/117 from AMMF, the Cholangiocarcinoma Charity; the COST Action CA181122 Euro-cholangio-Net; POSTD18014AREC postdoctoral fellowship from AECC to MA; and Ramón y Cajal Program contracts RYC-2014-15242 and RYC-2018-024475-1 to FJC and MGFB. The generous support of Mr Eduardo Avila is acknowledged.
Competing interestsNone declared.
Provenance and peer reviewNot commissioned; externally peer reviewed.
Supplemental materialThis content has been supplied by the author(s). It has not been vetted by BMJ Publishing Group Limited (BMJ) and may not have been peer-reviewed. Any opinions or recommendations discussed are solely those of the author(s) and are not endorsed by BMJ. BMJ disclaims all liability and responsibility arising from any reliance placed on the content. Where the content includes any translated material, BMJ does not warrant the accuracy and reliability of the translations (including but not limited to local regulations, clinical guidelines, terminology, drug names and drug dosages), and is not responsible for any error and/or omissions arising from translation and adaptation or otherwise.