条文本
摘要
客观的吸烟是结直肠癌(CRC)的主要危险因素。我们的目的是调查吸烟是否通过改变肠道微生物群和相关代谢物来促进CRC。
设计经偶氮甲烷处理的C57BL/6小鼠每天暴露在香烟烟雾或清洁空气中2小时,持续28周。在小鼠粪便上平行进行鸟枪宏基因组测序和液相色谱质谱分析,以研究微生物群和代谢物的变化。无菌小鼠移植的粪便来自暴露于烟雾和无烟对照小鼠。
结果与不吸烟的对照组小鼠相比,暴露在香烟烟雾中的小鼠肿瘤发病率和细胞增殖显著增加。在暴露于烟雾的小鼠中观察到肠道微生物失调,细菌物种丰度存在显著差异,包括细菌的富集Eggerthella lenta和消耗Parabacteroides distasonis而且乳酸菌代谢组学分析显示,吸烟小鼠结肠中胆汁酸代谢物增加,尤其是牛磺酸脱氧胆酸(TDCA)。我们发现大肠lenta在吸烟小鼠中与TDCA呈正相关。此外,烟雾暴露小鼠表现出增强的致癌MAPK/ERK(丝裂原激活蛋白激酶/细胞外信号调节蛋白激酶1/2)信号(TDCA的下游靶点)和受损的肠道屏障功能。此外,无菌小鼠移植烟雾暴露小鼠(GF-AOMS)的粪便后,结肠子细胞增殖增加。同样,GF-AOMS显示肠道丰度增加大肠lentaTDCA激活MAPK/ERK通路,破坏结肠上皮肠屏障。
结论香烟烟雾引起的肠道菌群失调在CRC中起着自生作用。吸烟诱导的肠道菌群失调改变了肠道代谢产物,损害了肠道屏障功能,这可能激活结肠上皮中的致癌MAPK/ERK信号通路。
- 结肠直肠癌
- 细菌的发病机理
- 胆汁酸代谢
数据可用性声明
数据可以在一个公共的、开放访问的存储库中获得。所有与研究相关的数据都包含在文章中或作为补充信息上传。本研究生成的数据集可在中国科学院北京Gemonics研究所国家基因组数据中心/中国生物信息中心的基因组序列档案(GSA: CRA006099)中获取,并可在以下网站公开获取https://bigd.big.ac.cn/gsa/.
这是一篇开放获取的文章,根据创作共用署名非商业(CC BY-NC 4.0)许可证发布,该许可证允许其他人以非商业方式分发、混音、改编、在此基础上进行构建,并以不同的条款许可其衍生作品,前提是正确引用原始作品,给予适当的荣誉,任何更改都已注明,并且使用是非商业性的。看到的:http://creativecommons.org/licenses/by-nc/4.0/.
数据来自Altmetric.com
本研究的意义
关于这个问题我们已经知道了什么?
肠道菌群及其代谢产物在结直肠肿瘤发生过程中起重要作用。
吸烟是众所周知的结直肠癌的危险因素,但其促进结直肠癌发生的机制尚不清楚。
新的发现是什么?
吸烟增加结直肠肿瘤的发生和改变氮氧甲烷处理小鼠的微生物群组成,包括显着富集的细菌种类Eggerthella lenta.
吸烟显著改变了代谢组学特征,增加了致癌物质牛磺酸脱氧胆酸(TDCA)的生物合成,这也与癌症呈正相关大肠lenta.
烟雾暴露小鼠表现出受损的结肠上皮细胞和增强的致癌MAPK/ERK(丝裂原激活蛋白激酶/细胞外信号调节蛋白激酶1/2)和促炎(白细胞介素17和肿瘤坏死因子)信号通路。
将暴露在烟雾中的小鼠的粪便移植到无菌小鼠体内可使其富集大肠lenta受体小鼠结肠上皮受损,MAPK/ERK和促炎通路激活增加。
在可预见的未来,它会对临床实践产生怎样的影响?
我们的研究结果表明,吸烟导致微生物群及其代谢产物的组成改变,导致肠道屏障功能障碍和致癌和促炎信号通路的激活,促进结直肠肿瘤的发生。
在吸烟人群中,控制肠道菌群可能是一种很有前途的预防CRC的策略。
介绍
结直肠癌(CRC)是全球最常见的癌症之一。虽然有许多早期CRC筛查和预防的策略,但其负担预计将进一步增加。1有证据支持饮食、吸烟、肥胖和运动等生活方式与结直肠癌的关系。2
吸烟会增加患肺癌的风险,约80%的原发性肺癌可归因于吸烟。3.吸烟还会增加其他未直接接触香烟烟雾的器官患癌症的风险,如结肠、直肠、胰腺和肾脏。4研究表明,吸烟与人类结直肠癌发病率和死亡率显著相关,并且在动物模型中观察到吸烟还会增加结直肠癌发展的风险。5个6然而,吸烟促进结直肠癌发生和发展的机制尚不清楚。人们在戒烟后观察到细菌多样性增加。7 8报告还表明,微生物群和粘蛋白结构的改变与吸烟有关。9此外,我们已经很好地确立了肠道菌群改变与CRC的关系10 - 12和其他人。13CRC患者的肠道微生物可以促进受体小鼠的结肠肿瘤发生。11然而,肠道菌群的改变是否代表吸烟与CRC之间的联系仍然是难以捉摸的。
在本研究中,我们使用常规和无菌小鼠模型来确定吸烟在结直肠癌发展中的作用。我们证明了吸烟可以通过诱导肠道微生物群失调来促进CRC,从而影响代谢物,特别是牛磺酸去氧胆酸(TDCA)。肠道TDCA升高可激活结肠上皮的促癌MAPK/ERK(丝裂原活化蛋白激酶/细胞外信号调节蛋白激酶1/2)通路,进而促进结肠细胞增殖。此外,吸烟可损害肠道屏障功能,从而进一步促进TDCA激活结肠致癌MAPK/ERK信号通路。
材料与方法
动物实验
雄性10周龄C57BL/6小鼠购自香港中文大学(香港)动物中心。14所有小鼠都被随意给予食物和水,并在特定的无病原体环境中喂养。腹腔注射致癌物偶氧甲烷(AOM) (10 mg/kg;默克,达姆施塔特,德国)每周一次,连续6周诱导结直肠癌。在AOM注射开始时,小鼠每天暴露于香烟烟雾(气流2000 mL/min的4%)或清洁空气中2小时(每组15只小鼠,由4个笼子组成,每个笼子3-4只小鼠)28周。蠕动管泵(Masterflex, Illinois, USA)产生香烟烟雾。(万宝路香烟;Philip Morris International, Virginia, USA)用尼古丁(1.0 mg/支)点燃,通过泵持续吸入,与新鲜空气混合,然后泵入吸烟室。只有新鲜空气被泵入洁净室(图1一个).在第28周结束时,暴露在香烟烟雾中的小鼠和不吸烟的小鼠都牺牲了。
吸烟增加小鼠结直肠致瘤性。(A)为香烟烟雾暴露设计的吸烟或清洁室和aom诱发癌症模型的示意图概述。将混合的新风和烟风抽入吸烟室,将新风抽入洁净室。小鼠被放置在室内,每天2小时,持续28周。AOM (10 mg/kg)从第0天开始腹腔注射,每周1次,连续6周。第28周结束时处死小鼠(AOM组,n=15;AOM+吸烟组,n=15)。(B)献祭时结肠的代表性图像。AOM和AOM+吸烟组小鼠的肿瘤数量和肿瘤大小。(C) AOM组腺瘤和AOM+吸烟组腺癌H&E染色的代表性图像。 (D) Incidence of adenoma and adenocarcinoma in the colon of AOM-treated mice. Statistical significance was determined by Fisher’s exact test. (E) Representative images of immunohistochemistry staining of Ki67 positive cells and proportion of Ki67 positive cells in the colon. (F) Protein expression of PCNA in the colon of AOM-treated mice by western blot. Data are expressed as mean±SD. Statistical significance was determined by unpaired Student’s t-test. AOM, azoxymethane; PCNA, proliferating cell nuclear antigen.
雄性10周龄昆明小鼠购自中国重庆第三军医大学实验动物科学系。14所有小鼠都在无菌环境中自由进食和饮水。为了研究吸烟调节肠道菌群对结肠粘膜的直接影响,将暴露于烟雾或清洁空气中的常规C57BL/6小鼠(每组8只无菌小鼠,每笼2-3只小鼠)的粪便200 μL (0.7 g粪便/ 1 mL磷酸盐缓冲生理盐水)移植到16只小鼠体内。第0周口服灌胃粪便样本1次,每周收集无菌小鼠粪便样本1次。11灌胃后第20周处死小鼠。接下来,为了确定吸烟调节肠道菌群对肿瘤发生的直接贡献,30只小鼠被随机移植了暴露于烟雾或清洁空气中的常规C57BL/6小鼠的粪便(每组15只无菌小鼠,包括3个笼子,每个笼子5只小鼠)。小鼠也接受AOM诱导结直肠瘤变。AOM给药方案与常规小鼠相同。灌胃后第28周处死小鼠。
在牺牲时,仔细计算实体瘤病变的肿瘤数量并测量肿瘤负荷(每只小鼠中所有肿瘤的平均直径之和;平均直径[大直径+小直径]/2)。14动物实验符合香港中文大学和中国第三军医大学动物实验伦理委员会的规定。
宏基因组测序和分析
使用Quick-DNA粪便/土壤微生物Miniprep试剂盒(Zymo Research, Irvine, California, USA)提取粪便样本的基因组dna。采用Novogene进行DNA文库制备和鸟枪宏基因组测序,15中国天津,共产生34 457 567±3 248 626 (mean±SD;最小:24 136 603,最大:43 985 236)成对的结束读。在去除宿主DNA后,使用Kraken2 (v2.0.8-beta)算法获得微生物群的分类剖面,并使用KneadData (v0.7.2)进行reads质量过滤。标准Kraken 2数据库包含细菌、古菌和病毒结构域的完整NCBI RefSeq基因组,并收集了已知的载体作为参考。细菌种类差异丰度分析采用多元统计模型MaAsLin2。16(1)至少一个样品中丰度为>0.05%的细菌种;(2)调整后的p值<0.05(校正后的假发现率(FDR))和(3)丰度的fold change (FC) >1.5被认为有统计学意义。在精简到最小库大小,9 664 368读取后,我们计算alpha和beta多样性使用phyloseqR包。Alpha多样性采用Chao1、Fisher和Shannon统计。采用Arrhenius z距离获取Beta多样性,采用主坐标分析(PCoA)进行排序分析。群落差异用置换多元方差分析(PERMANOVA)检验,使用Arrhenius z距离进行1000次迭代。来测量的关联Eggerthella lenta对于结直肠癌,我们分析了包括185名结直肠癌患者和204名正常对照组在内的人类粪便样本的宏基因组测序数据,这些数据来自我们以前的出版物。17
中提供了其他方法在线补充信息.
结果
香烟烟雾促进小鼠结直肠肿瘤的发生
为了研究吸烟对结直肠肿瘤发生的影响,我们将aom处理过的C57BL/6小鼠暴露于清洁空气或香烟烟雾中(图1一个).暴露于香烟烟雾的小鼠结直肠肿瘤数量和肿瘤大小均显著大于无烟对照组小鼠(均p<0.01;图1 b).病理医生经显微镜组织学检查证实为结肠腺瘤及腺癌(图1 c).暴露于香烟烟雾显著增加结肠肿瘤的发病率(p<0.05) (图1 d).我们观察到,与无烟对照小鼠相比,暴露在香烟烟雾中的小鼠结肠上皮细胞增殖增加,其ki -67阳性细胞数量显著增加(图1 e)和细胞增殖蛋白标记物增殖细胞核抗原(PCNA)的高表达(图1 f).
香烟烟雾改变了小鼠肠道微生物群的组成和微生物的相互作用
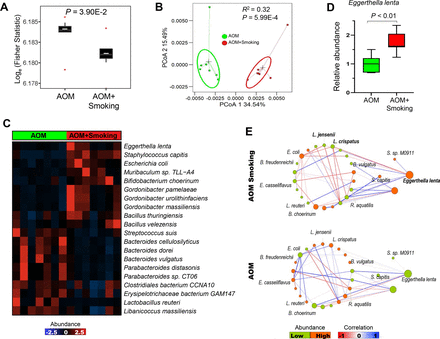
由于小鼠长期生活在一起,我们首先用16S测序的方法评估了微生物群落是否存在笼效应。我们发现笼效应在不同时间点对微生物群落没有影响(p>0.05, PERMANOVA) (在线补充图1).然而,吸烟对微生物群落的显著影响发生在实验结束时(结束时间点)(在线补充图1),表明长期吸烟是影响微生物区系的主要因素。然后,对粪便样本进行鸟枪宏基因组测序分析,以确定香烟烟雾暴露对肠道微生物群的潜在改变。在基线(初始时间点)时,吸烟小鼠与无烟对照小鼠的微生物群落在α和β多样性方面没有显著差异(在线补充图2A,B).28周后,我们观察到,与无烟对照小鼠相比,暴露在香烟烟雾中的小鼠的α多样性显著降低(图2一个而且在线补充图2C).PCoA分析(beta多样性)显示,与无烟对照小鼠相比,吸烟暴露小鼠肠道微生物群的聚类有显著差异(p<0.01, PERMANOVA;图2 b).20种细菌(p<0.05, FC>1.5)在香烟暴露小鼠(图2 c).在这其中,大肠lenta而且葡萄球菌capitis而肠道有益细菌包括这种乳酸菌,18Parabacteroides distasonis19而且拟杆菌dorei20.因为暴露在香烟烟雾中而精疲力竭。我们证实了更高的丰度大肠lenta定量PCR检测香烟烟雾暴露小鼠(p<0.01;图2 d).我们进一步评估了大肠lenta人类CRC使用我们发布的数据集。17大肠lenta与正常受试者(n=204)相比,CRC患者(n=185)中更丰富。在这些CRC患者中,吸烟者(n=30)具有较高的丰度大肠lenta与不吸烟者比较(n=87) (p<0.05) (在线补充图3A,B).
香烟烟雾调节小鼠肠道菌群。(A) AOM+吸烟和AOM组的Fisher统计量(alpha多样性)和(B) PCoA分析(beta多样性)。alpha和beta多样性的显著性分别采用双尾Mann-Whitney U检验和PERMANOVA检验。(C) AOM+吸烟组与AOM组的细菌差异。使用多元统计模型检测丰度差异(p<0.05 (FDR校正),FC >1.5, MaAsLin2)。(D)物种的丰富Eggerthella lenta用定量PCR方法验证AOM+吸烟组与AOM组的差异。(E) AOM+吸烟组和AOM组差异菌间的生态网络。用SparCC法测量相关性。选取AOM+吸烟组与AOM组>0.6相关强度差异的相关性进行可视化。急性中耳炎,azoxymethane;FC,折叠变化;PCoA,主坐标分析;置换多元方差分析。
微生物之间的相互作用可能促进疾病的发展。我们研究了吸烟小鼠和无烟对照组小鼠之间不同丰度细菌相互作用的生态网络(图2 e).我们观察到,在吸烟小鼠和无烟对照小鼠之间,细菌的共发生和共排除相互作用有显著差异。之间观察到共排他相关大肠lenta还有两种益生菌:乳酸菌jensenii而且乳酸菌crispatus(图2 d),暗示了富营养化的对立联想大肠lenta暴露在香烟烟雾中的老鼠体内的保护性细菌已经耗尽。
吸烟会改变粪便中的肠道微生物代谢产物
我们通过对小鼠粪便进行液相色谱质谱(MS)/MS分析,确定了烟雾暴露后粪便代谢物的变化。正交偏最小二乘判别分析显示,吸烟小鼠与不吸烟小鼠的粪便代谢谱有显著差异(图3一).与无烟对照小鼠相比,吸烟暴露小鼠粪便中41种代谢物(调整后p<0.05)发生改变(图3 b).改变的代谢物在不同的代谢组信号通路中富集或减少(图3 c).与无烟小鼠相比,吸烟小鼠中胆汁酸生物合成富集程度最高。在肠道中,细菌将初级胆汁酸转化为次级胆汁酸,部分被回肠末端和结肠吸收。在这些次生胆汁酸中,TDCA是已知的致癌物质。21日22吸烟小鼠TDCA的丰度显著增加(图3 b).吸烟小鼠的粪便TDCA升高被靶向MS进一步证实(p=0.0094) (图3 d).
吸烟会改变粪便中的肠道微生物代谢产物。(A) OPLS-DA法在AOM+吸烟组和AOM组之间的粪便代谢特征有显著差异,OPLS-DA法是一种有监督的多元回归分析,以确定不同组之间的可辨性模式。x轴捕捉组间的变化,而y轴捕捉组内的变化。(B) AOM+吸烟组与AOM组代谢物差异,p<0.05,双尾Mann-Whitney U检验。(C) AOM+吸烟组与AOM组差异代谢产物富集分析。包括富集评分>1分。(D) AOM+吸烟组和AOM组粪便中TDCA浓度采用靶向质谱法测定,p<0.05,双尾Student 's t检验。(E)用偏斯皮尔曼相关分析细菌与差异代谢物的关联。(F) TDCA与Eggerthella lenta采用带校正和不校正线性模型(有烟/无烟)。急性中耳炎,azoxymethane;正交偏最小二乘判别分析;TDCA,牛磺酸脱氧胆酸。
为了确定微生物群与代谢物之间的潜在关联,我们采用部分Spearman相关法对细菌与代谢物进行了相关分析。我们观察到大肠lenta与TDCA呈正相关,而两种益生菌;l . jensenii而且l . crispatus与TDCA呈负相关(图3 e).大肠lenta具有解凝初级胆汁酸的能力,表达胆汁酸外聚酶3β-羟基甾体脱氢酶(3β-HSDH);因此,它参与次生胆汁酸的合成,并影响粪便中TDCA的水平。第23 - 25因此,我们测量了编码3β-HSDH酶的基因丰度,并观察到与无烟小鼠相比,吸烟小鼠的基因丰度明显更高(在线补充图3C).与此相一致,我们进一步证实了大肠lenta与粪便中TDCA浓度呈正相关(图3 f).因此,肠道微生物失调和代谢产物的改变可能共同作用,促进结肠肿瘤的发生。
香烟烟雾损害肠道屏障功能
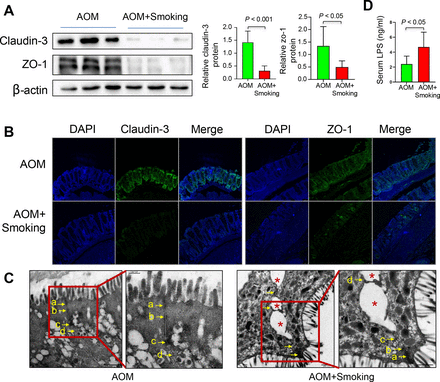
为了研究吸烟对肠道屏障功能的影响,我们分析了结肠紧密连接蛋白claudin-3和Zonula occludens-1 (ZO-1)的表达水平以及血清脂多糖(LPS)水平。western blot检测结果显示,吸烟显著降低claudin-3和ZO-1水平(图4一)及免疫荧光染色(图4 b).病理医生在电子显微镜检查下(图4 c).同时,我们发现,与不吸烟的小鼠相比,暴露于烟雾中的小鼠血清LPS水平显著升高(图4 d).这些结果共同表明,吸烟会导致肠道屏障功能受损。
香烟烟雾损害肠道屏障功能。(A) western blot检测aom处理小鼠结肠中claudin-3和ZO-1蛋白的表达。(B)免疫荧光染色观察aom处理模型结肠中claudin-3和ZO-1蛋白的表达。(C) aom处理小鼠结直肠肠道屏障结构的代表性图像。在电子显微镜下箭头指向细胞-细胞交界处。(a)紧密连接;(b)粘接接点;(c)细胞桥粒;(d)间隙连接。星号表示细胞连接中断。 (D) LPS concentration in the serum of mice in the AOM and AOM+Smoking group. Data are expressed as mean±SD. Statistical significance was determined by unpaired Student’s t-test. AOM, azoxymethane; DAPI, 4′,6-diamidino-2-phenylindole; LPS, lipopolysaccharide.
香烟烟雾增强结肠上皮中的致癌MAPK/ERK信号
为了从分子上深入了解吸烟的原生效应,我们使用小鼠癌症路径Finder PCR阵列分析了结肠上皮中癌症相关基因的表达。与无烟对照小鼠相比,我们观察到吸烟暴露小鼠有19个基因上调,7个基因下调(图5一个,在线补充表2).富集分析显示,香烟烟雾对有丝裂原活化蛋白激酶(MAPK)信号通路的激活程度最高(图5 b).既往研究报道TDCA可激活MAPK通路的ERK亚家族,26日27日因此,我们评估了暴露于香烟烟雾的小鼠与对照组小鼠结肠上皮中的MAPK/ERK激活。吸烟激活MAPK/ERK信号被磷酸化erk1 /2 (MAPK/ERK通路中的关键中介蛋白)水平升高所证实(图5 c).此外,我们观察到ERK磷酸化水平与TDCA水平呈正相关(在线补充图4A).这些结果表明,香烟烟雾可诱导ERK1/2磷酸化,并激活MAPK/ERK信号通路,促进结肠肿瘤的发生。
香烟烟雾增强结肠上皮中致癌MAPK/ERK通路和促炎通路的表达。(A)小鼠Cancer Pathway Finder PCR阵列分析AOM+吸烟组与AOM组结肠上皮差异表达基因(FC=AOM+吸烟/AOM,阳性对数2(FC)= AOM+吸烟组高表达,负对数2(FC)= AOM组高表达)。包括AOM+Smoking和AOM >2之间的FC。(B)通过富集分析,AOM+吸烟组与AOM组相比癌症信号通路的改变。包括浓缩分数>1。箭头表示富集方向,通过比较通路中上调和下调的基因计算得到。MAPK信号通路中的差异表达基因在网络中显示。(C) western blot检测aom处理小鼠结肠中ρ-ERK1/2蛋白的表达。(D)通过小鼠炎症反应和自身免疫阵列分析,AOM+吸烟小鼠与AOM小鼠结肠上皮的差异表达基因。(E)通过富集分析,AOM+吸烟组与AOM组相比炎症信号通路的改变。包括富集评分>1分。 The differentially expressed genes in TNF and IL-17 signalling pathways were shown in network. (F) Gene expression ofCxcl2,Il-17a而且il - 10定量RT-PCR。数据以均数±标准差表示。* * * p < 0.01, p < 0.05;采用双侧未配对Student 's t检验,分析差异有统计学意义。p值由FDR调整(在线补充表2、3).急性中耳炎,azoxymethane;ERK,细胞外信号调节蛋白激酶;FC,折叠变化;Il,白介素;MAPK,丝裂原活化蛋白激酶;RT-PCR、逆转录PCR;肿瘤坏死因子。
香烟烟雾增强了促炎信号基因的表达
肠道细菌失调与炎症密切相关,炎症与致癌因素和肿瘤发生有关。因此,我们使用小鼠炎症反应和自身免疫PCR阵列分析了促炎基因的表达。与无烟对照小鼠相比,我们在吸烟暴露小鼠中观察到27个基因上调,5个基因下调(图5 d,在线补充表3).香烟烟雾诱导了包括促炎白细胞介素17 (IL-17)信号通路和肿瘤坏死因子(TNF)信号通路的改变(图5 e).定量反转录PCR (RT-PCR)证实促炎蛋白表达增加Il-17a,Cxcl2抗炎表达降低il - 10与无烟对照小鼠相比,暴露在烟雾中的小鼠(图5 f).此外,相对mRNA表达Il-17a与?的丰度呈正相关大肠lenta在冒号中(在线补充图5).这些发现表明,吸烟促进了结肠肿瘤发生的炎症。
无菌小鼠粪便菌群移植与暴露于烟雾的常规小鼠肠道菌群的改变相似
为了证实香烟烟雾改变肠道菌群对结直肠肿瘤发生的直接作用,我们在无菌小鼠中进行了粪便菌群移植。无菌小鼠用暴露于香烟烟雾或无烟常规小鼠的粪便进行灌胃。20周后采集小鼠并进行检查(图6).我们进行了鸟枪宏基因组测序分析,以探索香烟烟雾改变的微生物群的定殖。与传统的AOM小鼠模型相似,以吸烟小鼠(GF-AOMS)粪便灌胃的无菌小鼠与以吸烟小鼠(GF-AOM)粪便灌胃的无菌小鼠相比,α多样性显著降低(图6 b而且在线补充图2C).Beta多样性分析再次显示,两组无菌小鼠的肠道微生物区系明显分离(GF-AOMS vs GF-AOM, p<0.01, PERMANOVA) (图6 c).进一步分析显示34种差异丰度的细菌(图6 d).一直以来,丰富的大肠lenta显著增加p . distasonisGF-AOMS小鼠显著降低(p<0.05, FC>1.5)。我们证实了明显更高的丰度大肠lenta经定量PCR检测,GF-AOMS组明显高于GF-AOM组(p<0.001,图6 e).
烟草暴露常规小鼠粪便微生物移植无菌小鼠肠道菌群的改变。(A)无菌小鼠模型概述示意图。无菌小鼠灌胃AOM+吸烟组和AOM组的粪便(n=8/组)。在第20周结束时处死小鼠。(B) GF-AOMS和GF-AOM组的Fisher统计量(alpha多样性)和(C) PCoA分析(beta多样性)。alpha和beta多样性的显著性分别采用双尾Mann-Whitney U检验和PERMANOVA检验。(D) GF-AOMS组和GF-AOM组之间的细菌差异。使用多元统计模型检测丰度差异(p<0.05 (FDR校正),FC >1.5, MaAsLin2)。(E)物种的丰富Eggerthella lenta通过定量PCR验证GF-AOMS组与GF-AOM组的差异。(F)细菌丰度的一致变化(吸烟小鼠与不吸烟小鼠的差异p<0.05;GF-AOMS小鼠vs GF-AOM小鼠)在两种小鼠模型(无菌小鼠和AOM小鼠)。计算了吸烟与不吸烟之间的丰度FC。红色点为无菌小鼠模型,黄色点为常规小鼠模型。(G)与供体相比,无菌小鼠灌胃喂养后网络模块保持不变。采用SparCC方法测量相关性,并基于细菌的一阶邻域提取网络模块。(H)采用靶向质谱法测定GF-AOMS组和GF-AOM组粪便中TDCA浓度,p<0.05,双尾Mann-Whitney U检验。急性中耳炎,azoxymethane;FC,折叠变化; GF-AOM, germ-free mice gavaged with stool from AOM donor mice; GF-AOMS, germ-free mice gavaged with stool from AOM+Smoking donor mice; PCoA, principal coordinates analysis; PERMANOVA, permutational multivariate analyses of variance; TDCA, taurodeoxycholic acid.
我们进一步测试了两种小鼠模型(无菌小鼠和常规AOM小鼠)之间微生物群变化的一致性。我们发现,与GF-AOM小鼠相比,吸烟暴露的AOM小鼠体内细菌丰度增加的细菌在GF-AOMS小鼠体内持续增加,而与GF-AOM小鼠相比,吸烟暴露的AOM小鼠体内细菌丰度降低的细菌在GF-AOMS小鼠体内持续减少(图6 f).重要的是,我们观察到大肠lenta益生菌增加了吗p . distasonis在吸烟暴露的AOM小鼠和GF-AOMS小鼠中含量都较低。相关分析显示,与供体小鼠相比,无菌小鼠粪便移植后生态网络模块是保守的(图6克).此外,与GF-AOM小鼠相比,GF-AOMS小鼠粪便TDCA水平也明显升高(图6 h).
香烟烟雾改变的微生物群增加无菌小鼠的结肠子细胞增殖和肿瘤发生
与GF-AOM小鼠相比,GF-AOMS小鼠结肠上皮细胞增殖增加,其表现为Ki-67阳性细胞比例较高(图7)和较高的PCNA表达水平(图7 b).此外,我们对无菌小鼠进行了AOM治疗,并用暴露于香烟烟雾的小鼠(GFAOM-AOMS)或无烟小鼠(GFAOM-AOM)的粪便进行灌胃(在线补充图6A).与GFAOM-AOM小鼠相比,GFAOM-AOMS小鼠的结肠肿瘤数量(p<0.05)和肿瘤大小(p<0.05)均有所增加(p<0.05)。在线补充图6B).这些在无菌小鼠中的结果与在常规小鼠中的观察结果一致,从而表明香烟烟雾改变的微生物群和代谢组可以直接促进结肠子细胞增殖和肿瘤发生。
在无菌小鼠中,香烟烟雾改变的微生物群增加了结肠腺细胞增殖,损害了肠道屏障功能,并增强了致癌MAPK/ERK和促炎基因的表达。(A)无菌小鼠结肠Ki67阳性细胞免疫组化染色及Ki67阳性细胞比例的代表性图像。(B) western blot检测无菌小鼠结肠中PCNA蛋白的表达。(C) western blot检测无菌小鼠结肠中claudin-3和ZO-1蛋白的表达。(D) GF-AOM组和GF-AOMS组小鼠血清中LPS浓度。(E)无菌小鼠结直肠肠道屏障结构的电子显微镜。箭头指向细胞-细胞连接。(F)小鼠Cancer Pathway Finder PCR阵列分析GF-AOMS组与GF-AOM组结肠上皮差异表达基因。(G)通过富集分析,GF-AOMS组与GF-AOM组相比,肿瘤信号通路的改变。包括浓缩分数>1。 The arrows represent the direction of enrichment, calculated by comparing the upregulated and downregulated genes in the pathway. The differentially expressed genes in MAPK signalling pathway were shown in network. (H) Protein expressions of ERK1/2 in the colon of mice in the GF-AOM and GF-AOMS group by western blot. (I) Differential expressed genes of colonic epithelium in the GF-AOMS group compared with the GF-AOM group by Mouse Inflammatory Response and Autoimmunity Array analysis. (J) The altered inflammatory signalling pathways in the GF-AOMS group compared with the GF-AOM by enrichment analysis. Enrichment scores >1 were included. The differentially expressed genes in TNF and IL-17 signalling pathways were shown in network. (K) Gene expression ofIl-17a,Cxcl2而且Cxcr2定量RT-PCR。(a)紧密连接;(b)粘接接点;(c)细胞桥粒;(d)间隙连接。星号表示细胞连接中断。数据以均数±标准差表示。* p < 0.05;采用双尾未配对Student 's t检验,分析差异有统计学意义。p值由FDR调整(在线补充表4、5).急性中耳炎,azoxymethane;ERK,细胞外信号调节蛋白激酶;GF-AOM,无菌小鼠灌胃AOM供体小鼠的粪便;GF-AOMS,无菌小鼠灌胃AOM+吸烟供体小鼠的粪便;Il,白介素;有限合伙人,脂多糖;MAPK,丝裂原活化蛋白激酶;PCNA,增殖细胞核抗原;RT-PCR、逆转录PCR; TNF, tumour necrosis factor
香烟烟雾改变的微生物群损害无菌小鼠的肠道屏障功能
接下来,我们研究了香烟烟雾改变的微生物群是否会影响无菌小鼠的肠道屏障功能。我们观察到GF-AOMS小鼠claudin-3和ZO-1表达降低,血清LPS水平升高(图7 c, D).EM也证实了GF-AOMS小鼠肠道屏障功能受损,其表现为根尖连接复合体的细胞间连接和结肠的细胞旁间隙变宽(图7 e).这些在无菌小鼠中的结果与常规小鼠一致,这表明香烟烟雾引起的微生物群和代谢组的改变可能会损害肠道屏障功能,从而进一步促进肿瘤的发生。
香烟烟雾改变的微生物群增强了无菌小鼠结肠上皮中的致癌MAPK/ERK通路
为了证实香烟烟雾改变的微生物群促进结肠腺细胞增殖的分子机制,我们对灌肠无菌小鼠的结肠上皮进行了癌症通路寻找器阵列。与GF-AOM小鼠相比,我们在GF-AOMS小鼠中鉴定出9个上调基因和3个下调基因(图7 f,在线补充表4).这些差异表达基因主要富集在MAPK/ERK信号通路中。与GF-AOM小鼠相比,GF-AOMS小鼠中磷酸化erk1 /2蛋白表达的升高证实了MAPK/ERK信号的激活(图7G和H).此外,我们观察到ERK磷酸化水平与TDCA水平呈正相关(在线补充图4B).同样,利用炎症反应和自身免疫PCR阵列,我们发现GF-AOMS与GF-AOM小鼠相比,有16个促炎基因上调(图7我,在线补充表5),这些基因也主要富集在TNF和IL-17信号通路中(图7 j).TNF和IL-17通路中关键促炎基因的上调,包括Il-17aC-X-C基序趋化因子配体2 (Cxcl2)和C-X-C基序趋化因子受体2 (Cxcr2)通过定量RT-PCR在GF-AOMS小鼠和GF-AOM小鼠中证实(图7 k).来自常规和无菌小鼠模型的一致发现表明,香烟烟雾改变的微生物群直接诱导结肠促炎TNF和IL-17信号通路以及致癌MAPK/ERK信号通路。因此,改变的肠道菌群有助于香烟烟雾在结直肠癌发生中的原生作用。
讨论
在这里,我们首次建立了一种新的肠道微生物群介导的吸烟诱导结直肠肿瘤发生的机制。吸烟是结直肠癌的危险因素。然而,对吸烟引起CRC的机制了解有限。尽管有几项研究表明肠道微生物群与吸烟之间存在关联,但目前尚不清楚暴露于吸烟所改变的微生物群是否在CRC的发生和发展中发挥重要作用。为了填补这一关键空白,我们进行了实验,使用aom诱导的CRC小鼠模型和移植了香烟烟雾改变的微生物群的无菌小鼠,将小鼠长期暴露在香烟烟雾中。
在本研究中,我们证明了吸烟可以通过调节肠道菌群的组成来促进结肠肿瘤的发生,并诱导肠道菌群失调。特别是,大肠lenta已被报道与CRC有关28 29在暴露于香烟烟雾的小鼠中显著增加。另一方面,p . distasonis在暴露于香烟烟雾的小鼠中,被证明可以增加紧密连接蛋白的结肠表达并减弱结直肠肿瘤的发生。19乳酸菌(这种l .,l . jensenii而且l . crispatus),以其抑制感染或致病菌增殖的能力而闻名,在暴露于香烟烟雾的小鼠中,其丰度较低。我们进一步论证了富富之间的拮抗关系大肠lenta和枯竭乳酸菌暴露在香烟烟雾中的老鼠的物种。综上所述,病原菌的增加和保护性细菌的丧失至少在一定程度上促进了吸烟诱导的结直肠癌成瘤。
我们还发现,胆汁酸生物合成途径是吸烟小鼠粪便中最显著富集的代谢途径。原发性胆汁酸在肝脏合成,经胆管分泌进入肠道。肠道共生菌群将初级胆汁酸转化为次生胆汁酸,主要被回肠末端和结肠吸收,少量随粪便排出。30.由于其促进肿瘤的特性,胆汁酸受到越来越多的关注。30 -在来自肠道菌群的次生胆汁酸中,我们证实吸烟小鼠的粪便中TDCA显著增加。既往研究证实TDCA可促进结直肠和食管腺癌的发生。21日22结肠腔内TDCA灌注可增加n -甲基-n′-硝基-n -亚硝基胍(MNNG)诱导的结直肠肿瘤发生频率。22我们进一步发现,粪便代谢产物的变化与肠道微生物丰度的变化显著相关,其中TDCA与肠道微生物丰度的正相关程度最高大肠lenta.这一结果得到了先前研究的支持,这些研究表明大肠lenta具有解凝初级胆汁酸的能力,表达胆汁酸外聚酶3β-HSDH。这些特征使其能够参与次生胆汁酸的合成,从而影响粪便中TDCA的浓度。第23 - 25
我们进一步评估了小鼠的肠道屏障功能,发现暴露在香烟烟雾中的小鼠的肠道屏障功能受损。烟草暴露小鼠中两种重要的紧密连接蛋白claudin-3和ZO-1的表达降低。受损的肠道紧密连接可以增加结肠的通透性,从而允许更多的肠道有害代谢产物,如TDCA进入结肠上皮细胞的细胞间隙,33 34激活MAPK/ERK信号通路。
接下来我们研究了香烟烟雾促进结肠肿瘤发生的分子机制,发现香烟烟雾诱导MAPK/ERK通路显著富集和激活。这一结果与此前报道的TDCA作为配体激活MAPK/ERK通路的功能一致。26日27日MAPK/ERK通路的激活对细胞增殖至关重要35并被证实参与了人类结直肠癌的发生、发展和癌变。36此外,我们发现香烟烟雾诱导了促炎IL-17和TNF通路。IL-17已被证明能促进结肠癌的发展。37之前的研究表明大肠lenta在IBD患者中富集,它可以通过心脏糖苷还原酶2诱导IL-17a,38支持我们的发现大肠lenta可能激活促炎细胞因子IL-17通路诱导肿瘤发生。TNF-α通路的激活诱导结肠炎和结直肠癌的发生。39这些发现共同表明,由吸烟相关的肠道生态失调和代谢产物改变引发的致癌MAPK信号通路和促炎IL-17和TNF信号通路的激活有助于吸烟相关的结肠肿瘤发生。
在无菌小鼠粪便菌群移植中,进一步研究了烟雾改变的肠道菌群在肿瘤发生中的直接作用。仅香烟烟雾改变肠道菌群可增加无菌小鼠结肠上皮细胞的增殖。受体无菌小鼠的肠道微生物组成与供体暴露于烟雾的常规小鼠的肠道微生物组成相似。特别是,大肠lenta在吸烟暴露的AOM小鼠和GF-AOMS小鼠中均显著富集。香烟烟雾改变的肠道菌群也增加了粪便TDCA水平,并诱导GF-AOM小鼠结肠上皮MAPK/ERK、IL-17和TNF信号通路的激活。这些发现共同表明,吸烟改变肠道菌群,通过增加结肠中TDCA水平,进一步激活结肠上皮中致癌MAPK/ERK、IL-17和TNF信号通路,促进结肠肿瘤的发生。此外,吸烟改变的肠道菌群损害了结肠上皮,这可以通过紧密连接蛋白claudin-3和ZO-1的表达减少来证明。肠屏障功能障碍可能促进致癌性TDCA进入结肠上皮细胞间隙,进一步激活致癌MAPK/ERK信号通路。
本研究通过调节肠道菌群组成,证明吸烟对结直肠癌有促进作用。与持续吸烟者相比,戒烟与改善crc特异性生存率有关。40因此,戒烟至少是通过重建健康的肠道微生物群来预防结直肠癌的实用方法之一。
总之,这项研究首次证明了香烟烟雾通过诱导肠道菌群失调促进结肠肿瘤的发生(在线补充图7).吸烟引起的肠道菌群失调可使结肠中TDCA水平升高,从而激活结肠上皮中致癌MAPK/ERK、IL-17和TNF信号通路。此外,肠道菌群失调引起的肠道屏障功能障碍可能进一步促进TDCA激活MAPK/ERK信号通路。
数据可用性声明
数据可以在一个公共的、开放访问的存储库中获得。所有与研究相关的数据都包含在文章中或作为补充信息上传。本研究生成的数据集可在中国科学院北京Gemonics研究所国家基因组数据中心/中国生物信息中心的基因组序列档案(GSA: CRA006099)中获取,并可在以下网站公开获取https://bigd.big.ac.cn/gsa/.
伦理语句
患者发表同意书
伦理批准
所有动物研究均按照香港中文大学和中国第三军医大学动物实验伦理委员会批准的准则进行。
参考文献
补充材料
脚注
XB, HW和WL是共同第一作者。
推特@Hongyan郭台铭
贡献者XB参与研究设计,进行实验并起草手稿;WL进行生物信息学分析并修改稿件;OOC对稿件进行了修改;CLiu提供生物信息学支持。LZ、CLi、YZ、GW、HG进行动物实验;WK进行组织学评价;HW进行无菌动物实验;EKN对这项研究发表了评论;JY设计、指导研究并修改手稿。JY负责本研究的整体内容。
资金国家重点研发计划项目(No: 2020YFA0509200/2020YFA0509203)资助;研资局香港主题研究计划(T21-705/20-N)、研资局合作研究基金(C4039-19GF、C7065-18GF)、研资局香港研究基金(14163817)、香港中文大学校长自由支配基金。
相互竞争的利益没有宣布。
出处和同行评审不是委托;外部同行评审。
补充材料此内容由作者提供。它没有经过BMJ出版集团有限公司(BMJ)的审查,也可能没有经过同行评审。讨论的任何意见或建议仅是作者的意见或建议,不被BMJ认可。BMJ不承担因对内容的任何依赖而产生的所有责任和责任。如果内容包括任何翻译材料,BMJ不保证翻译的准确性和可靠性(包括但不限于当地法规、临床指南、术语、药品名称和药物剂量),并且对因翻译和改编或其他原因引起的任何错误和/或遗漏不负责。
请求的权限
如果您希望重用本文的任何或全部内容,请使用下面的链接,该链接将带您到版权清除中心的RightsLink服务。您将能够快速获得价格和即时许可,以多种不同的方式重用内容。