条文本
摘要
客观的胎儿生长受限(FGR)是一种破坏性的妊娠并发症,增加了围产期死亡和发病率的风险。本研究旨在确定遗传和宫内环境对新生儿微生物群落的综合和相对影响,并探索选择性fgr诱导的肠道菌群破坏、代谢图谱紊乱和可能的结果。
设计我们对150对双胞胎新生儿的肠道微生物定植进行了分析和比较,这些新生儿根据其绒毛膜和胎儿出生体重不一致被分为四组。通过16S核糖体RNA、宏基因组测序和代谢组学检测肠道菌群失调和粪便代谢改变,并在随访2~3年后通过身体和神经认知发育调查探讨长期影响。
结果与选择性FGR相关的宫内不良环境因素在提高细菌多样性和改变早期生命肠道菌群组成方面的影响在遗传学中占主导地位,这种影响与双胞胎选择性FGR的严重程度正相关。在选择性FGR的背景下,遗传因素对肠道微生物的影响减弱。有选择性FGR和粪便代谢改变的双胎新生儿肠道菌群失调特征是肠道菌群丰度降低肠球菌而且不动杆菌降低了蛋氨酸和半胱氨酸的水平。相关分析表明,早期粪便半胱氨酸水平与婴儿身体和神经认知发育呈正相关。
结论不良的微生物群特征和明显的代谢改变与宫内不良环境影响的选择性FGR相关,强调了不良的生物结构对长期神经行为发育的可能影响。
- 肠道微生物
- 新生儿肠道
数据可用性声明
资料应合理要求提供。所有与研究相关的数据都包含在文章中或作为补充信息上传。不适用。
这是一篇开放获取的文章,按照创作共用署名非商业性(CC BY-NC 4.0)许可发布,该许可允许其他人以非商业性的方式发布、混编、改编、构建本作品,并以不同的条款授权他们的衍生作品,前提是原创作品被正确引用,给予适当的荣誉,任何更改都被注明,且使用是非商业性的。看到的:http://creativecommons.org/licenses/by-nc/4.0/.
来自Altmetric.com的统计
本研究的意义
关于这个话题我们已经知道了什么?
胎儿生长受限(FGR)与不良围产期和新生儿死亡率和较差的神经认知结局相关。
考虑到双胞胎中的胎儿遗传因子和母体因子相同,双胞胎的选择性FGR模型是研究胎盘相关生长障碍的极好方法。
一些对FGR仔猪的研究表明,FGR介导的肠道菌群定植明显失衡,代谢图谱受到干扰。
新的发现是什么?
我们建立了包括73对单绒毛膜(MC)双胞胎和77对双绒毛膜-双绒毛膜(DC)双胞胎在内的双胞胎出生队列,这是世界上双胞胎间出生体重不一致的DC双胞胎和MC双胞胎中数量最多的。
宫内环境和遗传都塑造了新生儿微生物群落,不利的宫内环境减少了遗传类群的定植。
在有选择性FGR的双胞胎新生儿中,肠道菌群失调和粪便代谢改变的特征是丰度降低肠球菌降低了蛋氨酸和半胱氨酸的水平。
与选择性FGR相关的不良宫内环境因素对婴儿的神经行为发育有长期影响。
本研究的意义
在可预见的未来,它会对临床实践产生怎样的影响?
选择性FGR新生儿肠球菌和不动杆菌丰度降低,蛋氨酸和半胱氨酸水平下调,可能引发氧化应激和1-C(一碳)代谢水平降低,这可能与选择性FGR的发病机制有关。
fgr诱导的纵向微生物转移和与代谢紊乱相关的神经行为障碍可能为改善不良预后提供一种无创监测和干预策略。
简介
胎儿生长限制(FGR)一般是指个体的生长潜力受到各种母体、胎儿和胎盘条件的限制。1高达10%的孕妇发生妊娠期妊娠,是婴儿发病率和死亡率的主要原因。2 3此外,FGR可能对终身健康产生不良后果,包括长期神经损伤,4个5认知和学习障碍,6增加未来发展为代谢综合征和随之而来的心血管和内分泌疾病的风险。7 8
近年来,有研究表明肠道细菌及其代谢产物在肠道-系统代谢相互作用中发挥着不可忽视的作用,可能影响生命早期的免疫和代谢发育9日10并通过微生物-肠道-大脑轴改变后代的认知发展和行为。11日12越来越多的研究表明,宿主遗传、产前环境和分娩方式可以塑造出生时的微生物群。13双胞胎具有高度的遗传和环境相似性,是研究遗传和环境因素对肠道菌群形成影响的极好模型。例如,一些双胞胎研究调查了肠道菌群的遗传决定因素。14日15然而,迄今为止,关于宫内环境对早期生命肠道菌群的影响的知识在很大程度上仍然未知。
双胞胎可分为双绒毛膜-羊膜双胞胎(DCDA)和单绒毛膜-羊膜双胞胎(MCDA),偶有不良围产期结局,主要与绒毛膜厚、出生体重不一致和至少有一个胎儿FGR有关。16日17双绒毛膜(DC)双胞胎妊娠的出生体重不一致可归因于各种遗传或环境因素,包括胎盘质量的差异和胎盘功能不全。18 19与DC双胎妊娠相比,单绒毛膜(MC)双胎妊娠出生体重不一致,即选择性FGR,具有更多的遗传相似性,主要是由于外周脐带插入影响宫内环境的差异、胎盘共享不均和胎盘血管解剖特征。20 21这可能导致MC双胞胎的围产儿死亡率高于DC双胞胎。22选择性FGR模型是研究胎盘相关生长障碍以及遗传和环境因素如何塑造肠道微生物群的理想模型。因此,迫切需要对出生体重不一致的双胞胎进行精心设计的研究,以阐明遗传和宫内环境对肠道菌群的影响。
在本研究中,我们收集了婴儿出生后第一次肠道排出至几天排出的粪便样本,然后将其用于16S核糖体RNA (rRNA)测序、代谢组学和宏基因组测序。对428份粪便样本进行16S rRNA测序,以确定早期生命菌群扰动。在新生儿出生后立即对218份粪便样本进行了非靶向气体代谢组学研究,以探讨遗传和环境因素对新生儿肠道微生物代谢的影响。结合这些结果,获得了与不良宫内环境相关的肠道菌群失调和粪便代谢改变的数据。此外,对12对选择性FGR双胞胎和10对出生体重一致的MC双胞胎进行宏基因组分析,以确定选择性FGR相关的微生物种类及其对代谢谱的影响。通过对94对平均年龄为2.5岁的双胞胎进行跟踪调查,我们进一步评估了早期生命肠道微生物和代谢物对长期身体和神经行为发展的影响。
材料和方法
主题招聘
本研究基于一项正在进行的双胞胎队列研究(临床试验ID:NCT03220750).2017年2月至2018年12月期间,在中国北京大学第三医院对母亲进行了知情同意。纳入标准包括两个活新生儿,来自MCDA和DCDA双胎妊娠,剖腹产和产后随访协议。排除标准包括母体因素,包括妊娠晚期抗生素使用、医疗并发症和严重妊娠并发症;胎儿因素包括至少一个胎儿的严重先天性异常或非整倍体(在线补充图S1);以及复杂的MC双胎妊娠,包括双对双输血综合征(TTTS), TTTS叠加在选择性FGR上,激光治疗TTTS后的选择性FGR,选择性FGR并发症伴有双胎贫血多血症序列和双胎动脉灌注逆转(在线补充图S2).
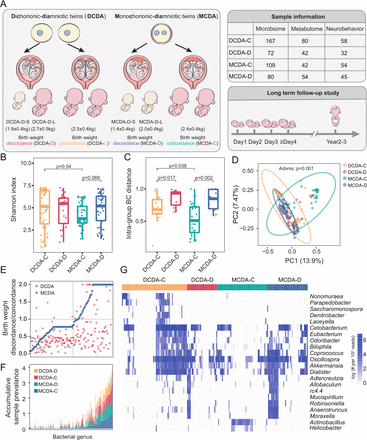
综述双胞胎队列和宫内环境对肠道菌群定植的影响。DCDA-C和DCDA-D分别代表出生体重一致的DC双胞胎和出生体重不一致的DC双胞胎。MCDA-C和MCD分别代表出生体重一致的MC双胞胎和出生体重不一致的MC双胞胎。(A) 150个双胞胎孕妇队列根据绒毛膜和胎儿出生体重的不一致被分为四组。每个双胞胎组的样本数量列于右表,用于肠道微生物组分析、代谢组学和随访调查。(B) dda - c、dda - d、MCDA-D和MCDA-C组间肠道菌群α多样性的比较。(C)计算布雷-柯蒂斯距离,并在四组之间进行比较。统计学意义由Wilcoxon秩和检验确定。(D) dda - c、dda -D、MCDA-D、MCDA-C组新生儿肠道菌群主成分分析图。椭圆表示95% CI。 (E) The ratio of the average relative abundance of each taxon in discordance and concordance of fetal birth weight in DC twins (red nodes) and MC twins (blue nodes). The x-axis represents different bacteria. (F) The cumulative frequency of discriminatory taxa in four group. The x-axis refers to discriminatory taxa among four groups. The y-axis represents the cumulative sample frequency of each taxon in the corresponding group. (G) The clustering of discriminatory taxa in the four groups, which is shown using the Pheatmap package in R. DC, dichorionic; MC, monochorionic.
宫内环境和遗传因素都会影响新生儿肠道微生物的组成。DCDA-C和DCDA-D分别代表出生体重一致的DC双胞胎和出生体重不一致的DC双胞胎。MCDA-C和MCDA-D分别代表出生体重一致的MC双胞胎和出生体重不一致的MC双胞胎。根据每对MCDA-D双胞胎的出生体重,MCDA-D- l和MCDA-D- s分别代表较大的双胞胎和较小的双胞胎。(A)使用ACE模型量化各种因素对形成新生儿肠道菌群的贡献,其中总方差被划分为遗传(A)、普通环境(C)和独特环境(E)效应。x轴指的是属水平的肠道微生物,它们的排名基于双胞胎的A值与出生体重一致。y轴表示每个属的遗传效应(红色)、常见环境效应(蓝色)和特定环境效应(灰色)的比例。(B)在DCDA-D和dda - c组之间或MCDA-D和MCDA-C组之间识别的区别属。x轴表示区分属的相对丰度。蓝圈和红圈分别表示DCDA-D或mcda -d减少的属和DCDA-D或mcda -d富集的属。 (C) Bacterial genera with significant differences among the MCDA-C, MCDA-D-L and MCDA-D-S groups (adjusted p<0.05). Genus abundance in each sample was normalised to 104读取。(D) MCDA-C、MCDA-D-L和MCDA-D-S组中4个物种的宏基因组测序数据的相对丰度。P值由双尾Wilcoxon秩和检验确定。直流,dichorionic;DCDA dichorionic-diamniotic;MC,经历;MCDA monochorionic-diamniotic。
本研究招募了双胞胎新生儿,根据他们的绒毛膜和胎儿出生体重的不一致性进行分组。出生体重不一致性计算为100 ×(较大出生体重-较小出生体重)/较大出生体重。23不一致双胞胎定义为DCDA双胞胎中出生体重不一致超过25%且其中一个出生体重<10百分位的双胞胎,基于以下原因:基于共识的诊断标准24DCDA和MCDA双胞胎出生体重不一致的标准。MCDA双胞胎中的不和谐双胞胎被定义为在没有TTTS的情况下相同的两个参数。24将双胞胎新生儿分为四组:MCDA- d(出生体重不一致的MCDA双胞胎,即选择性FGR)、MCDA- c(出生体重一致的MCDA双胞胎)、DCDA- d(出生体重不一致的DCDA双胞胎)和DCDA- c(出生体重一致的DCDA双胞胎)c一致性),根据绒毛膜和双胞胎间体重不一致性(在线补充图S3而且在线补充表S1-S3).
不良子宫环境对早期生命肠道菌群的纵向影响。DCDA-C和DCDA-D分别代表出生体重一致的DC双胞胎和出生体重不一致的DC双胞胎。MCDA-C和MCDA-D分别代表出生体重一致的MC双胞胎和出生体重不一致的MC双胞胎。根据每对DCDA-D双胞胎的出生体重,dda - d - l和dda - d - s分别代表较大的双胞胎和较小的双胞胎。根据每对MCDA-D双胞胎的出生体重,MCDA-D- l和MCDA-D- s分别代表较大的双胞胎和较小的双胞胎。(A)新生儿出生后几天内肠道菌群的微生物多样性。x轴上的刻度1、2、3和≥4分别代表第一天、第二天、第三天和4天后。P值由双尾Wilcoxon秩和检验确定。(B)各组(dda - c、dda - d、MCDA-C和MCDA-D组)在出生后几天内肠道菌群的α多样性。(C)各组出生后数天内微生物群落BC距离的短期变化规律。 (D) Abundance shifts of肠球菌而且不动杆菌在dda - c, dda - d - l, dda - d - s, MCDA-C, MCDA-D-L和MCDA-D-S组中。公元前,Bray-Curtis;直流,dichorionic;DCDA dichorionic-diamniotic;MC,经历;MCDA monochorionic-diamniotic。
粪便取样,DNA提取和高通量测序
从第一次肠道排出的粪便(胎粪)中收集粪便样本,每天收集,直到婴儿从新生儿科或产科病房出院。每个婴儿都有出生后至少3天的粪便样本。抽样是按照以前发表的协议进行的。14使用无菌塑料勺采集约1-1.5 g粪便样本,然后在严格无菌条件下放入无菌管中。所有标本在采集时立即在−20°C冷冻,然后运输和存储在−80°C,直到提取DNA和宏基因组和代谢组分析。DNA提取、PCR扩增、文库构建和测序操作使用无菌工具和容器,在严格控制、独立和无菌的工作场所按照统一的协议进行。为了排除环境和试剂来源可能的污染,我们首先在DNA提取和PCR扩增过程中使用无DNA的水作为阴性对照,以确保在此过程中没有扩增产物。如前所述,对所有粪便样本进行DNA提取。25日26日我们使用515F (5 ' -GTGCCAGCCGGTAA-3 ')和806R (5 ' -GGACTACHVGGTWTCTAAT-3 ')引物扩增16S rRNA基因的V3-V4区,然后在Illumina HiSeq 2500平台上进行PE250测序。每批DNA提取和PCR扩增均包括3个无DNA水阴性对照。只有阴性对照中无扩增产物时,才使用该批次样品进行后续测序和分析。使用聚焦超声仪(Covaris, Woburn, Massachusetts, USA)将12个II/III型选择性FGR和10个MCDA-C双胞胎胎粪样品(每个样品约0.5µg)的基因组DNA剪成约300 bp的片段。按照NEBNext Ultra DNA Library Prep Kit for Illumina的说明书,用0.2µg DNA构建宏基因组文库。在HiSeq 2500平台上用PE150进行宏基因组测序。
16S rRNA数据处理及微生物群落分析
原始16S rRNA测序数据经QIIME2处理。27用q2-feature分类器将扩增子序列变体(ASVs)与从Greengenes数据库中获得的参考序列(gg-13-8-99-nb-classifier)进行比较,得到相应的分类分配。28原始ASV数据计数转换为相对丰度。计算Alpha多样性(Shannon多样性指数)来表示样本内的多样性。采用Bray-Curtis (BC)距离矩阵表示样本间多样性。采用BC距离进行主坐标分析(PCoA)。分类学多样性由属级相对丰度表示,该丰度是通过将每个样本的总读数按总和归一化得到的。在对数变换之前,零值被+ 1处理掉。我们使用线性模型允许Tukey诚实显著差异(HSD)比较,以确定在包括母亲年龄、体重指数(BMI)和其他异常的母亲因素在内的DCDA-D组和DCDA-C组之间以及MCDA-C和MCDA-D组之间差异丰富的微生物种类。利用r中的Pheatmap包对Spearman相关阈值为r>0.5的差异属特征进行聚类。
遗传计算
为了确定由于遗传和环境对肠道菌群组成和功能的影响而产生的变异量,基于双胞胎的ACE模型29利用遗传因子对特定类群的遗传力进行了测定。ACE模型通过比较同卵双胞胎(MZ)和异卵双胞胎(DZ)的性状变异性,估计了与加性遗传(a)和共有/共享(C)或独特(E)环境因素相关的感兴趣性状的变异。ACE模型假设的双胞胎之间的相似(或差异)可以用基因或遗传、他们共同的环境(产前环境、家庭环境和社会经济地位,使双胞胎彼此相似)和他们特定的(非共有的)环境因素(我们研究中一些特殊的经历或疾病,如胎盘和脐带的差异,使双胞胎彼此不同)来解释。在计算微生物遗传力之前,对原始计数表进行过滤和转换:(1)ACE模型的数据来自MZ (MCDA组中所有双胞胎)和DZ (DCDA组中异性双胞胎)。(2)仅在分娩后第一天10%的粪便样本中存在属级类群,并通过总和、对数转换和缩放对原始微生物计数进行归一化。利用R的mets包计算各分类单元的遗传力,在计算A、C和E时控制母、新生儿因素。
宏基因组分析
选择出生后第一天内DNA量大于0.2µg的样本进行宏基因组测序,其中MCDA-D-II/III组12对,MCDA-C组随机选取10对。从原始宏基因组reads中丢弃适配器和低质量reads,根据人类基因组参考对剩余reads进行过滤,去除人类宿主DNA。使用带默认参数的MetaPhlAn2 (V.2.5.0)对获得的读取进行分类分析。30.使用HUMAnN2在默认参数下测定微生物群落的代谢途径。31
粪便样本的非靶向代谢组学分析
分娩后第一天内的粪便样本用于非靶向代谢组学,包括同样的10对MCDA-D-II/III组和9对MCDA-C组的宏基因组测序。粪便样品在SpeedVac (LabconcoTM)中干燥,称量10 mg±1 mg样品,然后在600µl的100%甲醇中加入内部标准混合物(10 mM 2,3,3,3-d4-丙氨酸;10毫米2、3、4、5、6-d5-phenylalanine;2毫米3,3-d2-tyrosine)。使用Qiagen Tissuelyser-II (Qiagen, Hilden, Germany)以30赫兹的频率将每种粪便-溶剂混合物均质。17 000 g离心15分钟后,分离上清液,使用SpeedVac (Labconco, USA)干燥。干燥的代谢物通过基于Smart发布的协议的氯甲酸甲酯(MCF)方法进行化学衍生等.32衍生样品由安捷伦GC7890系统与MSD5975耦合进行电子冲击电离(70 eV)分析(安捷伦,加利福尼亚州,美国)。气柱为ZB-1701 (30 m×250 μ m id ×0.15 μ m, 5 m保护柱,Phenomenex)。气相色谱烘箱程序和质谱参数按Han设定等.33衍生样品以脉冲无分裂模式注入气相色谱入口,温度为290°C,氦气设置为1 mL/min。辅助、质谱四极杆和质谱源的温度分别设置为250℃、230℃和150℃。检测质量范围为38 ~ 550 μ m。扫描速度为1.562 μs−1溶剂延迟为5.5 min。
采用自动质谱反褶积和识别系统软件,利用化学标准建立的内部MCF质谱库进行复合反褶积和识别。代谢产物的相对丰度由内部的MassOmics R包提取。粪便代谢物水平归一化到内部标准和干大便重量的相对水平。代谢产物的相对丰度差异和PCoA分析。采用具有16S rRNA分类和代谢物数据的样本进行关联分析,使用R的SpiecEasi包(V.1.0.7)中的SPARCC进行200次自助复制,以估计p值。使用R中的Pheatmap包显示相关性,差异有统计学意义(*p<0.05, **p<0.01, ***p<0.001)。
身体和神经认知发展的随访调查
我们队列中的婴儿在出生2或3年后参加了随访调查。每个婴儿的身体评估由训练有素的专业医生进行,评估包括身高和体重,根据世界卫生组织的规范测量。关于孩子第一次走路和说话的时间的信息是通过对父母的采访获得的。使用婴儿年龄和阶段问卷第三版(ASQ-3)对婴儿的神经行为发展进行评估,该问卷包含五个发展领域:沟通、大肌肉运动、精细运动、问题解决和个人社交,每个婴儿的综合评估可能有60分。34 35所有随访调查均通过电话或在线问卷进行口头回答。使用Z评分对身高和体重测量进行标准化,并根据世卫组织Anthro规划(V.3.2.2)对5岁或5岁以下儿童获得两种不同的Z评分,即年龄身高和年龄体重。采用Spearman相关法分析半胱氨酸相对丰度与第一次走路和说话时间之间的相关性。利用协变量中所包含的Spearman相关和与实际年龄的偏相关,确定半胱氨酸相对丰度与身体发育指标和ASQ-3五个发育域的相关性。
统计分析
采用Wilcoxon秩和检验进行组间比较,包括微生物α和β多样性、特定类群的相对丰度差异以及身体发育的后续指标如身高和体重。对微生物和代谢物进行排列多变量方差分析,使用R的素食包中的“Adonis”函数来检验群落差异的显著性。粪便微生物和代谢物相对丰度差异的效应量采用Tukey’s检验,p值根据Benjamini-Hochberg法的错误发现率0.05进行调整。利用MIMOSA和mmvec进一步计算16S rRNA测序、宏基因组测序和非靶向代谢组学生成的细菌与代谢物之间的相关性。36 37
结果
我们纳入了150例双胞胎妊娠病例,其中73例MC双胞胎和77例DC双胞胎。根据胎儿出生体重的不一致性,将73对MC双胞胎分为MCDA-D组(30例)和MCDA-C组(43例),将77对DC双胞胎分为DCDA-D组(26例)和DCDA-C组(51例)。图1一个而且在线补充表S4).DCDA-C组包括DCDA-C- ss(同性DCDA-C) 34例,dda - c - os(异性DCDA-C) 17例。根据生长受限的严重程度和脐带血受累情况,将MCDA-D组进一步分为MCDA-D-I组(MCDA-D伴I型选择性FGR, 10例)和MCDA-D-II/III组(MCDA-D伴II/III型选择性FGR, 20例)(在线补充图S3,在线补充表S1, S5).根据出生体重的不一致,MCDA-D组中较大的双胞胎称为MCDA-D- l组,较小的称为MCDA-D- s组。同样,在dda - d组的双胞胎也被分为dda - d - l(较大)和dda - d - s(较小)(在线补充表S5、S6).
在形成新生儿肠道菌群方面,宫内环境比遗传因素更重要
我们首先研究了不良宫内环境引起的绒毛膜和FGR是否会影响早期生命的微生物群落,观察到dda - c组肠道菌群的alpha多样性显著高于MCDA-C组(p=0.04, Wilcoxon’s秩和检验)(图1 b).DC双胞胎,尤其是DZ双胞胎的alpha多样性较高(在线补充图S4A),提出了绒毛膜在形成肠道菌群方面的作用,以及可能存在的微生物-遗传联系。但MCDA-D组肠道菌群α多样性略高于MCDA-C组(p=0.069, Wilcoxon’s秩和检验)和dda - c组(图1 b), MCDA-D-II/III组alpha多样性显著高于MCDA-C组(p=0.000102, Wilcoxon’s秩和检验)和MCDA-D-I组(p=0.000165, Wilcoxon’s秩和检验)(在线补充图S4B).这些结果表明,在形成早期肠道菌群方面,不利的宫内环境因素超过了遗传因素,导致出生时新生儿菌群的组成更加多样化。值得注意的是,这种效应与FGR的严重程度呈正相关。
选择性胎儿生长受限个体的不良菌群和代谢紊乱。DCDA-C和DCDA-D分别代表出生体重一致的DC双胞胎和出生体重不一致的DC双胞胎。MCDA-C和MCDA-D分别代表出生体重一致的MC双胞胎和出生体重不一致的MC双胞胎。(A) dda - c、dda - d、MCDA-D和MCDA-C组粪便代谢物主坐标分析图。椭圆表示95% CI。(B)将dda - c组与dda - d组、MCDA-D组与MCDA-C组进行比较,根据差异程度对差异代谢物进行鉴别和排序。蓝色和红色圆圈分别表示下调的或mcda -d代谢产物和上调的或dda -d代谢产物。(C)使用Pheatmap包测定DCDA-D组和DCDA-C组差异菌属水平相对丰度与粪便代谢物之间的相关性,差异有统计学意义(*p<0.05, **p<0.01, ***p<0.001)。(D)在MCDA-D组和MCDA-C组中差异属的相对丰度与粪便代谢物的相关性(*p<0.05, **p<0.01, ***p<0.001),使用Pheatmap包分析差异属与粪便代谢物的相对丰度具有统计学意义。(E) Kruskal检验中参与蛋氨酸和半胱氨酸合成途径的高丰度差异微生物基因的相对丰度和排序。 DC, dichorionic; DCDA, dichorionic-diamniotic; MC, monochorionic; MCDA, monochorionic-diamniotic.
接下来,我们在ASVs水平上计算每组个体之间微生物群落的BC距离(图1 c).MCDA-C组样本间BC距离显著小于dda - c组(p=0.038, Wilcoxon’s秩和检验)(图1 c而且在线补充图S4C).我们进一步发现,出生体重不一致的双胞胎(MCDA-D和DCDA-D)的微生物群落BC距离显著大于出生体重不一致的双胞胎(MCDA-C和dda - c) (p<0.01, Wilcoxon’s秩和检验)(图1 c).此外,MCDA-D-I组和MCDA-D-II/III组的个体间群落差异显著高于MCDA-C组(p<0.01, Wilcoxon’s秩和检验)(在线补充图S4D).这些结果表明,遗传和宫内环境都可以影响个体间的群落变异性,而宫内环境的影响更为明显和积极。
为了进一步探究四组微生物群落的聚类效应,进行了PCoA。样本在各组内聚类,组间分离(p=0.001, Adonis检验),dda - c和MCDA-C样本的分布相对分散于dda - d和MCDA-D样本(图1 d).值得注意的是,MCDA-C样本的分布比dda - c - ss和dda - c - os样本更分散(p=0.001, Adonis检验)(在线补充图S4E).相反,MCDA-D-II/III组的样本分布比MCDA-D-I组和MCDA-C组更紧凑(p=0.001, Adonis检验)(在线补充图S4F),揭示了与FGR相关的不良宫内环境可能会使不同新生儿的肠道微生物群落向同一方向形成。
为了辨别遗传和不利的宫内环境因素对细菌分类群的影响程度,分别计算了DCDA-D和DCDA-C组之间以及MCDA-D和MCDA-C组之间每个分类群的平均相对丰度比值(图1 e).在ddac - d和ddac - c组中,比值在1以下的类群数量明显大于比值在1以上的类群数量,而在MCDA-D和MCDA-C组中,比值在1以下的类群数量几乎相同。与各自的对照组(MCDA-C或dda - c)相比,MCDA-D组对特定细菌类群丰度的影响比DCDA-D组更显著,这可能与不良宫内环境的严重程度有关。MCDA-D组和DCDA-D组以低频菌群多见,提示不良宫内环境导致肠道菌群失调。在高频区,MCDA-D组的面积大于DCDA-D组,说明MCDA-D组差异菌的频率高于DCDA-D组(图1 f).这些结果进一步证实了宫内环境在形成新生儿肠道菌群方面起着重要作用。
通过对每组微生物的分类和丰度进行聚类分析,我们确定了4组21个属,其相对丰度存在差异,Spearman相关阈值为r>0.5 (图1 g).与其他三个组相比,有几十个丰富或贫乏的属,只有放线杆菌在MCDA-C组中略有富集,考虑到遗传和宫内环境的影响有限,这与MCDA-C组alpha多样性最低的结果一致。
特定的分类与不利的宫内环境或遗传因素相对应
为了评估宫内环境和遗传因素如何影响特定的细菌类群,双胞胎数据被分为两组(图2一个)、出生体重一致的双胞胎和出生体重不一致的双胞胎。我们观察到选择性FGR对特定类群的影响明显,表现为环境效应的增加(蓝点)和遗传效应的减少(红点)。为了评价三组分源的波动,我们比较了A、C(共同环境)和E因子对两组双胞胎微生物群落的影响。受E影响的特定类群数量显著高于受A或C影响的类群数量(在线补充图S5),遗传力为>0.2的高遗传细菌相对丰度,如Bilophila而且真细菌,在MCDA-C、dda - c - ss和dda - c - os组间差异显著(p<0.05, Tukey’s检验)(在线补充图S6).这些结果表明,当不良宫内因素出现时,遗传和常见环境因素对菌群的影响减弱。
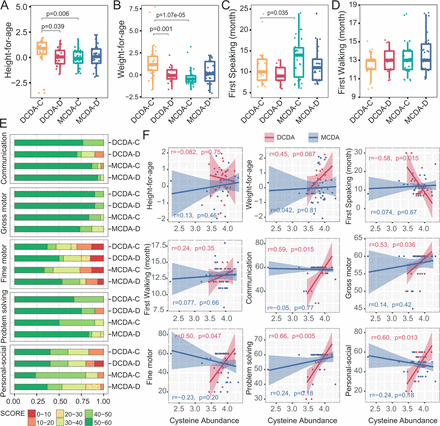
新生儿粪便代谢物与日后身体和神经认知发育的相关性。DCDA-C和DCDA-D分别代表出生体重一致的DC双胞胎和出生体重不一致的DC双胞胎。MCDA- c和MCDA- d分别代表出生体重一致的MCDA双胞胎和出生体重不一致的MCDA双胞胎。(A-D) dda - c、dda - d、MCDA-C和MCDA-D组之间年龄身高、年龄体重、第一次说话时间和第一次走路时间的比较。统计学意义由Wilcoxon秩和检验确定。(E)四组在《年龄与阶段》问卷第三版各发展领域得分区域百分比的比较。(F)粪便半胱氨酸浓度与身体和神经认知发育评价指标的相关性。线性回归趋势线周围的阴影显示95% CI。直流,dichorionic;DCDA dichorionic-diamniotic; MC, monochorionic; MCDA, monochorionic-diamniotic.
接下来我们探讨了与胎儿出生体重不一致相关的分类差异。值得注意的是,MCDA-D组和MCDA-C组的肠道菌群比较显示出比dda - c组更明显的菌群失调Coprococcus,Robinsoniella而且Oscillospira减少了不动杆菌,肠球菌而且放线杆菌在MCDA-D组(图2 b).上述属在MCDA-D-II/III组和MCDA-C组之间也观察到更显著的差异(在线补充图S7).这些结果表明不良宫内环境的严重程度与肠道菌群失调呈正相关。然后,我们探索了MCDA-D组或DCDA-D组中较小的双胞胎肠道菌群失调的程度(在线补充图S8).比较MCDA-D或DCDA-D组中较大和较小的双胞胎对,并将较大或较小的双胞胎对与对照组进行比较。MCDA-D-S和MCDA-C之间的失调最为明显(图2 c而且在线补充图S8).
我们最终对44个样本进行了全基因组鸟枪测序,其中包括12对MCDA-D-II/III和10对MCDA-C。比较MCDA-C、MCDA-D-L和MCDA-D-S组间的区别种。我们发现了两种肠球菌(肠球菌都有效而且粪肠球菌),在三组之间表现出显著差异。例如,大量的大肠都有效与MCDA-D-S组和MCDA-D-L组相比,MCDA-C组和MCDA-D-S组差异有统计学意义(p<0.05, Wilcoxon秩和检验)(图2 d).结合16S rRNA和宏基因组测序,我们发现有选择性FGR的新生儿肠道菌群失调的特征是缺乏肠球菌的丰度下降大肠都有效在较小的双胞胎中有选择性FGR。
不良宫内环境对肠道菌群的纵向影响
为了探索宫内环境和遗传关联如何影响新生儿肠道菌群的短期发育,我们进一步调查了出生后最初几天内肠道菌群的动态变化。通过线性时间序列模型分析(图3 a - b).一种可能的解释是出生时某些细菌类群消失,出生后随着环境波动,新生儿菌群的群落结构逐渐简化。
接下来,我们通过比较MCDA-C、dda - c - ss和dda - c - os组,研究了遗传关联对菌群多样性变化的影响。三组间α多样性差异在出生后几天内逐渐消失(在线补充图S9A-B).为了研究不良宫内环境的潜在影响,我们还比较了MCDA-D-I组、MCDA-D-II/III组和MCDA-C组微生物群落多样性下降的情况,发现在出生后3-4天,MCDA-D-II/III组的alpha多样性从出生时的最高水平急剧下降到与其他两组相似的水平(在线补充图S9C).在评估与选择性FGR相关的纵向微生物转移时,我们发现肠球菌而且不动杆菌在MCDA-D-S、MCDA-D-L和MCDA-C组中逐渐减少(图3 d).
然后我们计算并比较了四组个体在ASVs水平上微生物群落的BC距离(图3 c).在出生后几天内,MCDA-D组(p=0.37)、MCDA-C组(p=0.35)和dda - c组(p=0.15)的个体间相似性逐渐下降,而dda - d组与MCDA-D- i组相似,个体间相似性显著下降(p=0.05)。相反,MCDA-D-II/III组BC距离迅速增加(在线补充图S9D),表明不良宫内环境的严重程度可能导致出生后个体间的群落差异。这些纵向变化表明,不良的宫内环境因素在塑造肠道微生物群方面可能比遗传因素发挥更大的作用,而且这种影响在出生后的最初几天持续存在。
选择性FGR中与肠道菌群失调相关的代谢改变
为了描述与胎粪微生物迁移相关的代谢模式的变化,使用气相色谱-质谱(GC-MS)对粪便代谢谱进行了研究。PCoA显示样品的代谢物在各组内聚在一起,各组间分离(p=0.001, Adonis检验)(图4一).当比较dda - c - os组和dda - c - ss组的代谢物与MCDA-C组的代谢物时,观察到类似的变化,反映了代谢谱的遗传效应(在线补充图S10).
与dda - d组和dda - c组比较,MCDA-D组和MCDA-C组间代谢物差异更显著。在MCDA-D组中共观察到17种差异代谢物,其半胱氨酸、蛋氨酸和双吡啶酸浓度较低(图4 b).在MCDA-D-II/III组或MCDA-D-I组中发现半胱氨酸和蛋氨酸水平下调,特别是在具有选择性FGR的小双胞胎中(在线补充图S11、S12).我们进一步探讨了改变的肠道菌群和粪便代谢物之间的相关性。只有Oscillospira与四种代谢物呈负相关,这是由DCDA-D组和DCDA-C组的比较所揭示的(图4 c).相比之下,13个属与MCDA-D和MCDA-C个体的不同代谢物具有显著相关性。值得注意的是,选择性FGR中肠道菌群失调(图2)与这些代谢物(图4 d).与肠道菌群失调一致的是,MCDA-D组比DCDA-D组表现出更明显的代谢改变,与改变的肠道细菌的相关性更显著,这在使用MIMOSA (ref)和mmvec (ref)进行相关性分析(在线补充图S13A-C).
宏基因组测序数据显示,蛋氨酸合成途径与12个微生物基因密切相关,MCDA-D-L和MCDA-D-S组的相对丰度低于MCDA-C组。在12个微生物基因中,LysC、metB和metC的丰度显著降低(p<0.05, Kruskal检验)。我们发现半胱氨酸合成途径与4个微生物基因密切相关,MCDA-D-L和MCDA-D-S组相对丰度低于MCDA-C组。在4个微生物基因中,cyysk和cysE的丰度显著降低(p<0.05, Kruskal检验)(图4 e).值得注意的是,在元基因组数据中发现的cysE, cysK, lysC, metB和metC基因与代谢组学测定的许多氨基酸显著相关,如蛋氨酸,去缬氨酸,半胱氨酸,d -天冬氨酸和-丙氨酸(在线补充图S13D).有趣的是,当测量代谢产物和按宏基因组数据分类的细菌之间的相关性时(在线补充图S13E),我们发现这些氨基酸中的大多数与鲍曼不动杆菌,大肠都有效而且粪大肠,进一步强调了这些细菌的重要性。
以上结果进一步证实了遗传丰度的缺失通过下调MCDA-D的半胱氨酸和蛋氨酸代谢与选择性FGR相关。再加上惊人的减少大肠都有效而且粪大肠在MCDA-D中,我们推测肠道菌群的氨基酸代谢下调可能与选择性FGR的病理损伤有关。我们进一步基于宏基因组数据对这些基因和代谢产物进行代谢途径富集分析,比较MCDA-C和MCDA-D的差异,发现MCDA-D显著富集氮代谢、叶酸代谢和生物素代谢途径(在线补充图S13F).
新生儿半胱氨酸水平与生命后期的身体和神经认知发育相关
为了探讨早期生命代谢改变对后期身体和神经认知发展的可能影响,我们分析了出生后2-3年婴儿粪便代谢物水平与身体和神经认知发展评价指标之间的相关性。MCDA组和DCDA-D组的婴儿身高和体重均显著低于DCDA-C组(图5 a - b).同样,MCDA-C组婴儿的第一次说话时间也晚于dda - c组(p=0.035) (图5 c).四组患者首次行走时间无显著差异(图5 d),以及MCDA-C、MCDA-D-I和MCDA-D-II/III组的标准体重/身高(在线补充图S14)以及DCDA-D组和MCDA-D组中较小的双胞胎和较大的双胞胎之间的差异(在线补充图S15).
ASQ-3量表包含五个发展领域:沟通、大动作、精细动作、问题解决和个人社交,ASQ-3总分可达60分。我们将ASQ-3每个域的60分平均分为6个区间,并通过比较DCDA-D组和dda - c组或MCDA-D组和MCDA-C组在每个域的低分(30分或以下)的发生情况来评估婴儿的神经行为发展(图5 e).ddac - d组在个体-社会域、沟通和解决问题域出现较低得分(<20分)的频率高于ddac - c组。MCDA-D组和MCDA-C组在个人-社会领域也观察到类似的趋势。值得注意的是,在个人-社会领域,MCDA-D-II/III组较MCDA-D-I组表现出更高的低分数区间(10-20分)频率(在线补充图S14).在MCDA-D组和DCDA-D组中,较大的双胞胎和较小的双胞胎在五个发育域上几乎没有差异(在线补充图S15).
在dda - c组和dda - d组中,这5个结构域均与粪便半胱氨酸水平呈显著正相关。晚年体重与半胱氨酸水平的相关性为r=0.45 (p=0.067),但差异无统计学意义。粪便半胱氨酸水平与第一次说话时间呈显著负相关(p<0.05) (图5 f).在MCDA-C和MCDA-D组中没有出现这种关联,这可能是由于这些组中有更多的高质量的早期教育干预和出生后密集的托儿。这些结果表明,不利的宫内环境因素对身体和神经行为发育有相对长期的影响,特别是在个体-社会领域,早期粪便半胱氨酸水平低可能与FGR双胞胎婴儿的身体和神经行为发育有关。
讨论
流行病学研究表明,宿主遗传、产前环境包括孕产妇医疗障碍38和胎盘异常39或者这些因素的组合可以塑造新生儿出生时的微生物群。除了胎儿和遗传因素外,大多数FGR通常是在胎母界面慢性缺氧引起的不良宫内环境中发育的。然而,没有研究关注宫内环境和遗传因素如何决定早期生命的微生物特征,特别是选择性FGR。通过研究MZ和DZ双胞胎中选择性FGR新生儿的肠道菌群失调和粪便代谢改变,我们证明了宫内环境是新生儿微生物群落的一个更关键的驱动因素,而不是遗传,选择性FGR中的菌群失调对身体和神经认知发育有长期影响。
关于不良宫内环境对肠道微生物组成的影响,我们的研究结果显示,选择性FGR中肠道菌群失调的程度与选择性FGR的严重程度高度相关,这与之前的研究一致,表明出生体重是决定婴儿微生物平衡的潜在因素。40越来越多的证据表明,肠道菌群紊乱可能与FGR的炎症和代谢紊乱有关。41 42例如,耗尽的失调模式不动杆菌和丰富Stenotrophomonas与之前关于宫内生长受限仔猪的报道一致。43最近的一些研究已经观察到这一点Oscillospira与儿童和成人的瘦弱或较低的BMI呈正相关。44 45在我们的研究中,Oscillospira在具有选择性FGR个体的早期生命微生物组中富集。此外,属Coprococcus与低出生体重猪脂质代谢功能障碍和促炎反应呈正相关。46这两个Oscillospira而且Coprococcus丁酸盐生产商,47此前的研究表明,丁酸盐通过调节葡萄糖代谢,是结肠上皮的主要能量来源48并通过上调细胞内氧化应激和炎症,减轻缺血/再灌注损伤。49因此,我们推测选择性FGR中丁酸生成体丰度的升高可能是通过调节能量代谢和减少炎症反应来补偿宫内营养不良的一种机制。
粪便样本16S rRNA扩增和宏基因组测序显示该属肠球菌及其代表品种(大肠都有效)与选择性FGR密切相关。大肠都有效能清除血清中多余的自由基,促进各种抗氧化酶的释放,提高血清的抗氧化能力。50在这项研究中,我们发现丰富的肠球菌而且大肠都有效与粪样中蛋氨酸、半胱氨酸呈正相关。在有选择性FGR的个体中,参与蛋氨酸和半胱氨酸代谢的基因丰度显著降低。先前的研究51 52已经揭示了蛋氨酸可以通过消除活性氧(ROS)的浓度来对抗氧化应激,活性氧是烟酰胺腺嘌呤二核苷酸磷酸(NADPH)依赖性抗氧化酶的激活剂,如蛋氨酸亚砜还原酶A。53 54新的研究表明,FGR患者常见的病理异常包括母-胎盘-胎儿循环中的血管内皮受损,包括羊水,55由氧化应激增加引起。56-58因此,我们推测早期生命微生物群的动态变化和减少肠球菌定植可能下调蛋氨酸和半胱氨酸水平,并通过过度的氧化应激反应导致选择性FGR个体的血管损伤。
蛋氨酸作为主要的1 C(单碳)供体参与s -腺苷-蛋氨酸的生物合成,作为琥珀酰辅酶a的前体,同型半胱氨酸。59由于1c在核酸合成和蛋白质合成中的作用,60蛋氨酸和半胱氨酸的代谢在胎儿的营养和生长发育中起着至关重要的作用。61值得注意的是,之前的研究表明,胎龄13-17周羊水中的蛋氨酸可以预测最终的出生体重和长度。62此外,最近的一些研究表明,修饰的DNA甲基化,如多巴胺指定因子的启动子区域63 - 65由1c代谢(甲基转移酶)引起,与婴儿期FGR个体的神经行为发育异常相关。因此,低水平的蛋氨酸和半胱氨酸可能会干扰1c代谢,抑制DNA合成和甲基化,进而可能阻碍胚胎和胎儿的生长。这也许可以解释为什么在本研究中,FGR患者中半胱氨酸减少与发育迟缓和神经认知发育异常相关。
总之,我们报道了选择性FGR的不良宫内环境下新生儿的肠道菌群失调和粪便代谢改变,并探讨了它们对短期微生物群转移和长期神经行为发育的可能影响。食物丰度的下降肠球菌而且不动杆菌可能会下调蛋氨酸和半胱氨酸的水平,从而导致过度的氧化应激和低水平的1-C代谢。这些发现为与不良宫内环境相关的早期生命中的肠道破坏和代谢紊乱提供了新的见解,这无疑将提高我们对早期生命微生物定植的潜在机制的理解,并有助于通过针对肠道菌群和相关代谢物改善不良结果和抑制生命后期的相关代谢性疾病。
数据可用性声明
资料应合理要求提供。所有与研究相关的数据都包含在文章中或作为补充信息上传。不适用。
伦理语句
病人同意发表
伦理批准
本研究以人体为研究对象,经北京大学第三医院人体研究伦理委员会(IRB00006761-2016145)批准。参与者在参与研究前给予知情同意。
参考文献
补充材料
-
补充数据
这个网络仅文件已由BMJ出版集团从作者提供的电子文件生产(s),并没有编辑的内容。
脚注
JY, LH和JW贡献相当。
贡献者FZ作为保证人对整体内容负责。FZ和YZ构思了这个研究。JY,王金峰,NY, YW, SY, KC, WZ, ZS,王晶,HJ, NH, YY, ML, RS, YW采集样品并进行实验。JY, LH,王金峰,LX和JZ分析了数据。JY, LH,王金凤和FZ撰写了手稿。所有作者都认可了手稿的最终版本。
资金国家自然科学基金项目(32025009,81971399,32070122)和国家重点研发项目(2021YFA1301000, 2021YFC2300017)资助。
相互竞争的利益没有宣布。
来源和同行评审不是委托;外部同行评议。
补充材料本内容由作者提供。它没有经过BMJ出版集团有限公司(BMJ)的审查,也可能没有经过同行评审。讨论的任何意见或建议仅仅是那些作者(s)和不被BMJ认可。BMJ放弃从放在内容上的任何依赖产生的所有责任和责任。如果内容包含任何翻译材料,BMJ不保证翻译的准确性和可靠性(包括但不限于当地法规、临床指南、术语、药品名称和药物剂量),并且不对翻译和改编或其他原因引起的任何错误和/或遗漏负责。
请求的权限
如果您希望重用这篇文章的任何部分或全部,请使用下面的链接,它将带您访问版权清除中心的RightsLink服务。您将能够快速获得价格和以多种不同方式重用内容的即时许可。