条文本
文摘
客观的2019年12月以来,新发现的冠状病毒(严重急性呼吸系统综合症冠状病毒(SARS-CoV-2))引起了肺炎疫情在武汉,中国。SARS-CoV-2进入宿主细胞通过细胞受体ACE II (ACE2)和跨膜丝氨酸蛋白酶2 (TMPRSS2)。以识别可能的主要靶细胞SARS-CoV-2 ACE2的全面的解剖和TMPRSS2 coexpression模式在不同的细胞类型,五个数据集与单细胞转录组的肺、食管、胃粘膜、回肠和结肠进行分析。
设计分开五个数据集搜索、整合和分析。小提琴阴谋被用来显示分布的差异表达基因不同的集群。ACE2-expressing TMPRRSS2-expressing细胞突出和解剖特征成分和比例。
结果细胞类型在每个数据集是由已知的标记。ACE2和TMPRSS2不仅coexpressed肺at₂细胞和食管上皮和腺体细胞上也吸收从回肠和结肠肠上皮细胞中高度表达。此外,在所有coexpressing细胞正常的消化系统和肺部,ACE2的表达相对回肠和结肠中高度表达。
结论本研究提供的证据的潜在途径SARS-CoV-2在消化系统以及呼吸道基于单细胞转录组分析。这一发现可能对健康产生重大影响政策制定的预防SARS-CoV-2感染。我们的研究还演示了一个新颖的方法来识别病毒的主要细胞类型的coexpression单细胞测序数据的分析模式。
- 传染性疾病
- 受体结合
- 医疗决策分析
这是一个开放的分布式条依照创作共用署名非商业性(4.0 CC通过数控)许可证,允许别人分发,混音,适应,建立这个工作非商业化,和许可他们的衍生产品在不同的协议,提供了最初的工作是正确地引用,给出合适的信用,任何更改表示,非商业使用。看到的:http://creativecommons.org/licenses/by-nc/4.0/。
来自Altmetric.com的统计
本研究的意义
已知在这个问题上是什么?
ACE2和跨膜丝氨酸蛋白酶2 (TMPRSS2)的关键蛋白质严重急性呼吸系统综合症冠状病毒(SARS-CoV-2)进入细胞的过程。Coexpression这两种蛋白质在同一个细胞为病毒条目是至关重要的。
目前的主要靶细胞SARS-CoV-2尚不清楚,由于不完整的知识ACE2和TMPRSS2 coexpression模式细胞的呼吸道和消化道。
尽管飞沫传播被认为是主要传播途径,其他传播途径仍不清楚。
有什么新发现吗?
2型细胞是肺泡的主要细胞类型coexpressing ACE2与TMPRSS2肺部组织。
此外,ACE2和TMPRSS2也coexpressed上从食管上皮和腺体细胞和吸收从回肠和结肠肠上皮细胞。
它会如何影响临床实践在可预见的未来吗?
这项研究提供了一个潜在的证据SARS-CoV-2路线的消化系统以及呼吸道基于单细胞转录组分析。
粪口传播是SARS-CoV-2传播的可能途径。因此,这些数据可能对健康有显著影响关于SARS-CoV-2感染的预防策略设置。
介绍
在2019年底,越来越多的新型冠状病毒肺炎患者(冠状病毒病(COVID-19))与未知的发病机制出现在中国最大的城市之一,武汉,并迅速传遍整个国家。1一种新型冠状病毒被隔绝人类呼吸道上皮细胞和被任命为严重急性呼吸系统综合症冠状病毒(SARS-CoV-2)。2完整的基因组序列显示SARS-CoV-2股票86.9%核苷酸序列的身份类似非典冠状病毒中发现蝙蝠(bat-SL-CoVZC45 MG772933.1)。本研究建议SARS-CoV-2是困难的硬币冠状病毒(SARSr-CoV)成对蛋白质序列分析。2 3
关于SARS-CoV-2感染的临床表现,发烧和咳嗽是最常见的发病症状。3 4此外,2% - -10%的患者COVID-19有胃肠道症状,如呕吐、腹泻和腹痛。5个6然而,很少有人知道为什么以及如何SARS-CoV-2诱发肠道症状。此外,目前未知SARS-CoV-2是否可以通过消化道传播除了通过呼吸道。3
冠状病毒感染的前提是其进入宿主细胞。在这个过程中,峰值(S)糖蛋白识别宿主细胞受体和诱发病毒和细胞膜的融合。7metallopeptidase SARS-CoV-2感染,ACE II (ACE2)已经被证明是细胞受体,类似于冠感染。8 - 11目前,证据显示SARS-CoV-2需要ACE2进入宿主细胞。9旁边,跨膜丝氨酸蛋白酶(TMPRSS2)是主要宿主细胞蛋白酶打通人类冠状病毒S蛋白在细胞膜上,允许融合肽释放的病毒膜融合。12日13因此,coexpression ACE2与TMPRSS2 SARS-CoV-2的细胞进入过程的关键。
探讨SARS-CoV-2易感细胞类型和潜在的感染途径,我们分析了coexpression ACE2的模式在不同的细胞类型和TMPRSS2正常的人类肺和胃肠系统通过单细胞转录组基于公共数据库。一个惊人的发现是,ACE2和TMPRSS2 coexpressed不仅在肺肺泡2型(at₂)细胞,而且在食管上细胞上上皮和腺和回肠和结肠的吸收肠上皮细胞。这些发现表明,COVID-19的肠道症状可能与入侵SARS-CoV-2 ACE2, TMPRSS2 coexpressing肠上皮细胞。我们的单细胞转录组研究首次提供了证据表明,消化系统以及呼吸道是一个潜在的COVID-19路线,可能产生重大影响卫生政策制定关于COVID-19的预防。
材料和方法
数据源
单细胞表达矩阵为肺、食管、胃、回肠和结肠从基因表达获得综合(https://www.ncbi.nlm.nih.gov/),14单细胞门户(https://singlecell.broadinstitute.org/single_cell)和人类细胞图谱数据门户。(https://data.humancellatlas.org)。单细胞数据食管和肺被Madissoon从发表的研究获得等含有六个食管和五个肺组织样本。15胃粘膜的数据样本三non-atrophic胃炎和慢性萎缩性胃炎患者从GSE134520获得。16GSE13480917包括22回肠标本11只回肠克罗恩氏病和非炎症患者样本选择进行分析。数据从Smillie等18包括12个正常结肠样本。
质量控制
低质量的细胞用少于200或大于5000表达基因被删除。我们进一步需要独特的分子标识符的百分比(umi)映射到线粒体小于20%。
数据集成,减少尺寸和细胞集群
不同的数据处理方法进行了不同单细胞项目根据下载的数据。
胃和回肠数据集
一个单细胞的数据表达与R矩阵处理包修(V.3.1.4)。19我们第一次使用“NormalizeData”正常化单细胞基因表达数据。UMI数量总数正常化的UMI每个细胞,乘以000正常化和对数转换。高度可变的基因(HVGs)被确定使用函数“FindVariableGenes”。然后,我们使用了“FindIntegrationAnchors”和“Integratedata”功能合并多个样本数据在每个数据集。删除不必要的变异来源后,细胞周期阶段和线粒体等污染,从单细胞的数据集,我们使用了“RunPCA”功能进行主成分分析(PCA)与重大HVGs单细胞表达矩阵。然后,我们构建了一个K-nearest-neighbour图基于PCA的欧几里得距离空间使用的FindNeighbors函数和应用鲁汶算法迭代组细胞一起FindClusters函数最优分辨率。UMAP用于可视化的目的。
细胞类型和基因表达分析的识别
我们带注释的细胞集群基于已知的表达细胞标记和集群的文章中提供的信息。然后,我们使用了“RunALRA”功能修scRNA-seq转嫁损失值的数据。功能块并使用修拉小提琴情节生成显示估算基因表达。比较基因表达在不同的数据集,我们使用“分位数正常化”R包preprocessCore V.1.46.0 (R包。https://github.com/bmbolstad/preprocessCore)预处理数据。然后,基因表达数据进一步运用添加对正态分布的随机产生的意思等于和SD等于SD
结果
注释的细胞类型
消化系统是由食管、胃、回肠、结肠和盲肠(图1 a e)。在这项研究中,五个数据集的单细胞转录组食管、胃粘膜、回肠和结肠以及肺进行分析(在线补充文件1)。
单细胞地图集的消化道和肺组织。(F)统一歧管近似和投影(UMAP)地块的景观(A)食管细胞,(B)胃粘膜细胞,(C)回肠细胞(E)结肠细胞和肺细胞(F)。(D)回肠上皮细胞被进一步分为细细胞子集中的异质性的细胞群。DCs,树突细胞;GMC,腺粘液细胞;NKT自然杀伤T;PMC,坑粘液细胞;助教,交通放大。
在食管,14个细胞类型被确定在87 947个细胞。超过90%的细胞分为四个主要的上皮细胞类型:上、分层suprabasal和细胞分裂的suprabasal层(图2一个)。额外的细胞上皮的基底层集群最密切的腺管和粘液分泌细胞。淋巴管内皮细胞与血管组织。免疫细胞在食管包括T细胞、B细胞、单核细胞、巨噬细胞、树突细胞(dc)和肥大细胞。细胞类型中确定食管集群被注释的表达已知程控标记(图2 b)。
单细胞分析食管细胞。(一)统一歧管近似和投影(UMAP)情节显示食管细胞的景观。(B)点图显示食管细胞的标记基因。(C) UMAP情节展示ACE2的表达(蓝色)和跨膜丝氨酸蛋白酶(TMPRSS2;红色)。故事情节是显示这些基因的coexpression合并。(D)小提琴情节ACE2的表达水平和TMPRSS2集群。表达式是测量的日志2(TP10K + 1)的价值。DCs,树突细胞。
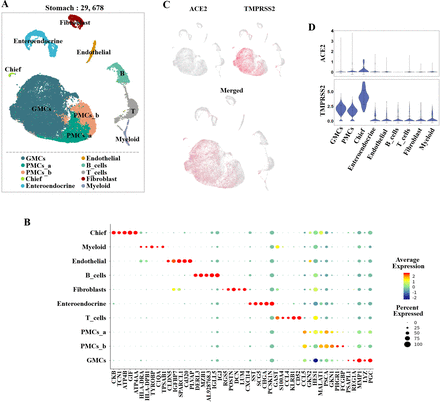
共有29 678细胞和细胞类型被确定在胃里后质量控制与高比例的胃上皮细胞,包括窦的基底腺粘膜细胞(gmc)坑粘液细胞(pmc),首席细胞和enteroendocrine细胞(图3一)。non-epithelial细胞谱系是由T细胞、B细胞、骨髓细胞、成纤维细胞和内皮细胞。集群中标识的细胞类型的胃被已知的程控注释标记(图3 b)。
单细胞分析胃粘膜细胞。(一)统一歧管近似和投影(UMAP)情节显示胃粘膜细胞的景观。(B)点图显示胃粘膜细胞的标记基因。(C) UMAP情节展示ACE2的表达(蓝色)和跨膜丝氨酸蛋白酶(TMPRSS2;红色)。故事情节是显示这些基因的coexpression合并。(D)小提琴情节ACE2的表达水平和TMPRSS2集群。表达式是测量的日志2(TP10K + 1)的价值。DCs,树突细胞;gmc,腺粘液细胞;pmc,坑粘液细胞。
质量控制后,50 286细胞和细胞类型被确定在回肠。检测细胞类型包括上皮细胞、内皮细胞、成纤维细胞和enteroendocrine细胞。确定免疫细胞是骨髓,CD4细胞+T, CD8+T和自然杀伤T细胞,以及等离子体和B细胞。在11 218上皮细胞(图4一),5个细胞类型被确定,即吸收肠上皮细胞,祖吸收,高脚杯,Paneth和未分化的细胞标记(图4 b)。
(单细胞分析回肠的上皮细胞。(一)统一歧管近似和投影(UMAP)情节显示回肠景观的上皮细胞。(B)点情节展示回肠上皮细胞的标记基因。(C) UMAP情节展示ACE2的表达(蓝色)和跨膜丝氨酸蛋白酶(TMPRSS2;红色)。故事情节是显示这些基因的coexpression合并。(D)小提琴情节ACE2的表达水平和TMPRSS2集群。表达式是测量的日志2(TP10K + 1)的价值。
47 442从结肠上皮细胞,包括吸收和分泌集群,后被注释的质量控制(图5一个)。的进一步吸收集群包括subclusters (TA)细胞(助教,助教2),不成熟的肠上皮细胞和肠上皮细胞。分泌集群包括subclusters祖细胞(分泌TA和不成熟的杯状细胞)和成熟的细胞(火焰杯,enteroendocrine细胞)。神经节细胞和自行车TA细胞也在最后UMAP识别。发现的细胞类型是已知的标记(图5 b)。
单细胞分析结肠上皮细胞。(一)统一歧管近似和投影(UMAP)情节显示结肠上皮细胞的景观。(B)点图显示结肠上皮细胞的标记基因。(C) UMAP情节展示ACE2的表达(蓝色)和跨膜丝氨酸蛋白酶(TMPRSS2;红色)。故事情节是显示这些基因的coexpression合并。(D)小提琴情节ACE2的表达水平和TMPRSS2集群。表达式是测量的日志2(TP10K + 1)的价值。助教,交通放大。
初步进行了质量控制后,57 020细胞和细胞类型被确定在肺(图6)。检测细胞类型包括纤毛,1型(AT1)和at₂肺泡细胞,纤维母细胞、肌肉细胞和内皮细胞。所确定的免疫细胞类型T, B和NK细胞,巨噬细胞、单核细胞和DCs。这些细胞类型identifiedby标记(图6 b)。
单细胞分析肺细胞。(一)统一歧管近似和投影(UMAP)情节显示肺细胞的景观。(B)点图显示肺细胞的标记基因。(C) UMAP情节展示ACE2的表达和跨膜丝氨酸蛋白酶(TMPRSS2)。故事情节是显示这些基因的coexpression合并。(D)小提琴情节ACE2的表达水平和TMPRSS2集群。表达式是测量的日志2(TP10K + 1)的价值。直流,树突细胞;NK,自然杀手。
细胞特定类型ACE2 TMPRSS2表达式
确定哪些细胞类型是潜在的靶细胞SARS-CoV-2肺癌和消化系统,我们探讨了ACE2的表达水平和TMPRSS2细胞群。在食管,ACE2在上部和复层上皮细胞高度表达。腺体ACE2表达水平也偏低。TMPRSS2表达主要在上层食管上皮和腺体细胞(图2 c)。然而,复层上皮细胞表达TMPRSS2在非常低的水平(图2 d)。关于胃,ACE2的表达在所有集群(相对较低图3 c)。然而,TMPRSS2 gmc中高度表达,pmc和细胞(图3 c, D)。在回肠的上皮细胞,ACE2下级吸收肠上皮细胞中高度表达,并表示在祖细胞吸收。TMPRSS2-expressing细胞广泛分布在所有上皮细胞subclusters (图4 c, D)。至于结肠,ACE2主要是肠上皮细胞和表达在不成熟的肠上皮细胞的较低水平。(图5 c)。TMPRSS2也显示,肠上皮细胞高表达和不成熟的肠上皮细胞,这是类似于ACE2。相对低的表达TMPRSS2还发现在高脚杯,神经节和TA细胞(图5 c, D)。在肺中,我们发现ACE2主要表达在at₂细胞和AT1也发现了和成纤维细胞。TMPRSS2也是AT1中高度表达,at₂细胞(图6 c, D)。因此,at₂细胞,具有相对较高的coexpression ACE2与TMPRSS2可能SARS-CoV-2的主要宿主细胞(图6 c, D)。
在所有ACE2-expressing细胞正常的消化系统和肺、ACE2也相对回肠和结肠中高度表达(图7)。TMPRSS2进一步在这些细胞相比,他们也显示,at₂相对较高表达,食管上、从回肠和结肠肠上皮细胞表达相对较低分层从食管上皮细胞(图7)。的RNA-seq数据肺、食管、胃、小肠、结肠横向和结肠癌乙状结肠GTEx获得数据库(在线补充文件2)。ACE2小肠和结肠中高度表达,以一个相对低表达在肺和食管(图7 b)。TMPRSS2高度表达的肺、胃、小肠和横结肠。然而,相对低的表达TMPRSS2被发现在乙状结肠(图7 b)。此外,我们还收集免疫组织化学图像显示ACE2在蛋白质水平的表达(图7 c)。代表图片来自肺(t - 28000,病人218),口腔黏膜(t - 51000,病人48),食管(t - 62000,病人3399),小肠(t - 65000,病人493),胃(t - 63700,病人148),十二指肠(t - 59000,病人1904),结肠直肠(t - 1×300,病人3266)和(1087 t - 68000,病人)。结果显示,ACE2表达主要是十二指肠、小肠、结肠和直肠,与RNA表达水平一致(图7 c)。
ACE2表达和跨膜丝氨酸蛋白酶(TMPRSS2) RNA和蛋白质含量在不同组织。(A)小提琴情节ACE2与TMPRSS2表达跨两个肺集群和七消化道集群。基因表达矩阵是正常和去噪去除不必要的技术变化四个数据集。(B)外部验证ACE2与TMPRSS2 RNA在不同的组织水平。表达式中的pTPM值来衡量RNA-seq Genotype-Tissue表达式的数据的数据库。免疫组织化学(C)代表ACE2的图像在不同的组织从HumanProtein图谱数据库。
讨论
冠状病毒是一种常见的上呼吸道感染源,胃肠道,在人类和其他哺乳动物中枢神经系统。23迄今为止,SARS-CoV-2的感染途径,其消化系统感染的能力仍不明朗。病毒进入过程取决于冠ACE2与细胞受体丝氨酸蛋白酶TMPRSS2。它表明细胞coexpressing ACE2 TMPRSS2是最容易被感染的细胞感染而细胞表达其中之一仍然是安全的。到目前为止,大多数的研究,特别是单细胞RNA-seq研究只关注ACE2。24日25日我们的研究是第一个研究忽视的两个关键蛋白质病毒入口过程,它可以提供更全面的信息的潜在靶细胞类型。此外,我们的研究显示了一个新颖的方法来识别病毒的主要细胞类型的coexpression单细胞测序数据的分析模式。
在这项研究中,我们发现coexpression ACE2与TMPRSS2肺AT1 at₂细胞,食管上皮和腺体细胞,上部和回肠和结肠的吸收肠上皮细胞。这些结果直接显示,第一次ACE2 TMPRSS2表达式并不是局限于肺和建议SARS-CoV-2可能存在的肺外传播。此外,这些发现表明,COVID-19的肠道症状可能与入侵SARS-CoC-2 ACE2, TMPRSS2 coexpressing肠上皮细胞。
一般来说,许多呼吸道病原体,如流感、冠状和SARSr-CoV,引起肠道症状,SARS-CoV-2。3 4作为一个经典的呼吸道冠状病毒、SARS常常引起肠道症状以及呼吸道症状。此外,通过粪便传播也是一个被忽视的非典型肺炎的风险。26肠非典和高致病性流感病毒的症状与渗透率增加肠道脂多糖,通过胃肠壁细菌轮回。27 28然而,SARS-CoV-2-induced肠道症状的机制目前还不清楚。
ACE2被发现与受体结合域定义交互的CTD1冠,促进有效的跨物种感染和人际传播。8 29的“向上”和“向下”过渡CTD1允许CTD1 ACE2绑定通过调节关系,CTD2, S1-ACE2复杂和S2亚基。30.从人类在人类海拉细胞,表达ACE2,麝猫和中国马蹄蝙蝠可以帮助多种SARSr-CoV,包括SARS-CoV-2,进入细胞,表明ACE2在细胞进入的重要作用。9 33节结构分析SARS-CoV-2年代的蛋白质,使其与高亲和力结合ACE2比非典浸S蛋白。34
TMPRSS2可以打通SARS-S蛋白和宿主细胞呈现条目endosomal通路使用独立的组织蛋白酶B / L。35不同于组织蛋白酶B / L,他们还可以促进病毒在宿主和分裂ACE2增加大约30倍病毒性传染性。36 37此外,SARS-CoV-2峰值蛋白质的键序列乳沟furin得分(0.688)高于thecorresponding序列冠(0.139),从而增加其传染性。38丝氨酸蛋白酶抑制剂可以阻止SARS-CoV-2肺细胞的感染。13
通过分析ACE2的coexpression TMPRSS2在正常人类的消化系统和肺,我们确定了at₂细胞最敏感的细胞在肺由于其高表达ACE2和TMPRRS2。AT1cells也可以感染的宿主细胞,具有比at₂细胞表达相对较低。这些结果与之前研究的结果一致。39在肺肺泡,AT1上皮细胞是负责气体交换和at₂细胞负责表面活性剂生物合成和自我更新。40在冠状病毒感染,at₂主要受感染的细胞类型,评估由病毒抗原和分泌小泡检测。其at₂细胞表达变量在不同的捐赠者,这可能是与磁化率和严重性差异有关。39因此,我们假设at₂细胞可能是关键SARS-CoV-2-invaded细胞肺癌和at₂细胞的数量可能与呼吸道症状的严重程度有关。
除了肺癌、coexpression ACE2与TMPRSS2被发现在食管上、腺体细胞和回肠和结肠的吸收肠上皮细胞。组织学检查食管和呼吸系统器官,如气管和肺部,来源于中间前肠的前部分。41从邻近的呼吸系统分离后,后续形态发生食管经历从一个简单的columnar-to-stratified鳞状上皮。42可以滋养上上皮黏膜下腺体和维持通过研磨生食。巴雷特食管,酸reflux-induced食管炎和多层上皮细胞与上皮细胞。43在消化系统中,除了用食管上皮和腺体细胞上表达,coexpression ACE2和TMPRSS2还发现在回肠和结肠的吸收肠上皮细胞,最脆弱的肠道上皮细胞。在微生物感染,肠道上皮细胞功能障碍,帮助协调免疫反应。44吸收肠上皮细胞可以被冠状病毒,感染轮状病毒和诺瓦克病毒,导致腹泻,吸收肠上皮细胞破坏,吸收不良、不平衡肠道分泌和肠神经系统激活。45-47尽管大多数病毒会死在强酸环境在胃里,仍有可能唾液和分泌物可能携带病毒进入消化道病毒复制可能会持续在这些敏感的细胞。因此,肠道腹泻的症状可能与感染相关ACE2-expressing和TMPRSS2-expressing肠上皮细胞。这也可以帮助解释,10%的患者出现腹泻和恶心1或2天前发烧和呼吸系统症状的发展。6
此外,由于ACE2的高表达和TMPRSS2在食管上细胞和回肠和结肠的吸收肠上皮细胞,我们建议消化系统可以通过SARS-CoV-2入侵和感染的可能途径。这个假设很支持的第一例SARS-CoV-2在美国,其粪便标本获得疾病第七天发现SARS-CoV-2 RNA。48SARS-CoV-2还从粪便标本分离出的确诊病例。49additionallyThe证据表明活病毒在粪便样本进一步支持我们的假设。
结论
这个单细胞转录组研究提供的证据的潜在途径SARS-CoV-2消化系统和呼吸道。它可能会对健康产生重大影响关于SARS-CoV-2感染的预防策略设置。此外,我们的研究提供了一种新颖的方法来指导识别病毒的主要细胞类型的thecoexpression单细胞测序数据的分析模式。
引用
脚注
赫兹、ZK HG和DX是共同第一作者。
生理改变、TM WZ,杰和HX联合高级作者。
赫兹、ZK HG和DX同样起到了推波助澜的作用。
生理改变、TM WZ,杰和HX同样起到了推波助澜的作用。
贡献者WZ和赫兹:研究设计。赫兹,WZ HG和DX:数据分析。ZK ZL, HG和DX:数据收集和生成。生理改变,JW, ZL, XC JX:数据解释。TM、ZK和HX:手稿起草。生理改变、TM WZ JL和HX:整体监督和组织研究。
资金HX支持由中国国家自然科学基金(批准31821003)和中国科技部(批准2018 aaa0100300)。
相互竞争的利益没有宣布。
病人和公众参与病人和/或公众没有参与设计,或行为,或报告,或传播本研究计划。
病人同意出版不是必需的。
伦理批准没有直接的人类受试者参与这个项目。使用现有的所有数据从之前的研究鉴定生物样品和数据。因此,道德监督和病人同意没有在这项研究处理。
出处和同行评议不是委托;外部同行评议。
数据可用性声明在人类细胞单细胞数据可以获得图说PRJEB31843加入代码(https://data.humancellatlas.org/explore/projects/c4077b3c - 5 - c98 4 - d26 a614 - 246 d12c2e5d7),基因表达综合(GSE134520和GSE134809)和单细胞门户加入代码SCP259 (https://singlecell.broadinstitute.org/single_cell/study/SCP259/intra-and-inter-cellular-rewiring-of-the-human-colon-during-ulcerative-colitis)。所有数据详细提出了相关研究文章或上传的补充信息。