条文本
摘要
客观的确定食管-胃-十二指肠镜检查(OGD)是否会在意识清醒的患者中产生气溶胶水平增加,并确定事件来源。
设计一项前瞻性环境气溶胶监测研究,在超洁净环境中对OGD患者进行。使用光学粒度仪在距离患者口腔20cm处取样。将OGD期间的气溶胶水平与受试者的潮汐呼吸和自愿咳嗽进行比较。
结果招募了接受减肥手术评估的患者(平均体重指数44,平均年龄40岁,n=15)。剧场低背景粒子浓度(3l−1)可侦测潮汐呼吸产生的气溶胶(平均粒子浓度118 L−1).OGD期间的气溶胶记录显示平均粒子数浓度为595 L−1具有广泛的范围(3-4320 L−1).产生生物气溶胶的事件,即咳嗽或打嗝,很常见。在60%的内窥镜检查中诱发了咳嗽,与患者的参考咳嗽相比,其峰值浓度和样本颗粒总数更大(1110 L vs 2320 L)−1780 vs 191粒子,n=9, p=0.008)。有咳嗽的内窥镜比潮汐呼吸产生更高水平的气溶胶,而没有咳嗽的内窥镜与背景没有什么不同。打嗝也会产生更高的气溶胶浓度,类似于自愿咳嗽时记录的浓度。除非引起咳嗽,否则内窥镜的插入和取出不会产生气溶胶。
结论OGD过程中诱发的咳嗽是气溶胶水平升高的主要来源,因此,OGD应被视为一个产生呼吸道气溶胶的高风险过程。对于那些有感染COVID-19或其他呼吸道病原体风险的患者,应在携带机载个人防护装备并采取适当预防措施的情况下进行OGD。
- 内窥镜检查
- 新型冠状病毒肺炎
- 内镜手术
数据可用性声明
数据可以在一个公共的、开放访问的存储库中获得。数据背后的数据和分析中使用的原始数据已经在生物研究数据库中公开,https://www.ebi.ac.uk/biostudies/,注册编号为S-BSST670。
在2019冠状病毒病(covid-19)大流行期间或由BMJ另行确定之前,本文根据BMJ的网站条款和条件免费供个人使用。阁下可使用、下载及列印文章作任何合法及非商业用途(包括文字及数据挖掘),但须保留所有版权声明及商标。
https://bmj.com/coronavirus/usage数据来自Altmetric.com
本研究的意义
关于这个主题我们已经知道了什么?
食管-胃-十二指肠镜(OGD)目前被归类为一种产生气溶胶的程序。最近的气溶胶采样研究表明,在OGD期间,背景上的颗粒浓度增加,但没有确定源事件。
新的发现是什么?
一个平稳的OGD(没有咳嗽或打嗝)不会产生与潮汐呼吸相关的气溶胶。更具体地说,为OGD插入和取出内窥镜不会产生气溶胶浓度的增加。然而,OGD的过程经常会引起意识清醒的患者咳嗽。这种由ogd引起的咳嗽比自愿咳嗽产生更高的气溶胶浓度,由此产生的空气颗粒羽状物可能与呼吸道病原体传播的风险增加有关。我们的研究将内窥镜检查过程中产生的气溶胶置于正常呼吸事件的有意义的背景下,并确定了指标风险事件。
在可预见的未来,它会对临床实践产生怎样的影响?
ogd诱发的咳嗽很常见。因此,应将OGD视为气溶胶产生风险高的患者,在有COVID-19或其他呼吸道病原体风险的患者中,应使用空气传播的个人防护装备并采取适当的预防措施。减少咳嗽和嗳气的策略可以减少气溶胶的产生。
简介
由SARS-CoV-2引起的COVID-19大流行导致医院医疗实践方式发生了巨大和广泛的变化。新型冠状病毒有三种主要传播途径:飞沫、接触和空气传播。SARS-CoV-2通过空气传播的程度仍存在争议1 - 4但随着传播能力增加的病毒新毒株(如B.1.1.7)的出现,这一问题日益引起关注。5个6世界卫生组织认为传染性呼吸道气溶胶由直径小于5 μm的颗粒组成,7它们在空气中悬浮数分钟或数小时,可能会导致病毒颗粒的远距离传播。8 9重要的是,这种尺寸的颗粒是可呼吸的,能够沉积在人体呼吸道深处,从而导致疾病传播。8
一些医疗干预措施已被指定为“产生气溶胶的程序”(agp)。这些agp被认为具有将呼吸道病原体通过空气传播给医护人员的最高风险。目前归类为agp的干预措施主要基于2003年SARS-CoV-1流行病的流行病学数据。10 11许多国家卫生保健组织,如疾病控制和预防中心,已采用或改编了世卫组织的agp清单12和英国公共卫生部13食道-胃-十二指肠镜(OGD)被归类为AGP,这一称号导致英国胃肠病学学会制定了安全内窥镜联合指南,14欧洲15和美国。16
目前的国家和国际指南建议在进行agp时使用空气预防个人防护装备(PPE),其中包括使用呼吸器(如FFP3或N95口罩)。其他建议包括在通风良好的封闭空间进行agp17 18并允许足够的“休息”时间,以便在手术后气溶胶可以散开。19这些预防措施不可避免地减缓了手术室或程序套件内的人员流动,由于身体和沟通困难,佩戴个人防护装备可能会影响所提供的护理质量。
将OGD归类为AGP并非基于该干预产生气溶胶的证据,也不是基于其与实施该程序的医护人员感染SARS-CoV-2的发病率增加有关。最近在临床环境中直接测量气溶胶水平的工作对包括气管插管和拔管在内的几个被定义为“产生气溶胶”的程序的有效性提出了质疑20.经皮气管切开术21以及呼吸支持治疗,如通过口罩持续正压气道。22 - 24
最近的两项概念验证研究报告了在OGD过程中测量到的气溶胶水平增加,并得出结论,该过程是一个AGP。25日26日然而,这些研究无法明确确定导致气溶胶产生的具体源事件(即,内窥镜插入/取出、咳嗽、深呼吸、胃肠道隆起或干呕),也无法将这些发现置于自然呼吸事件(潮汐呼吸和咳嗽)产生气溶胶的风险背景下。这一点很重要,因为咳嗽、说话和呼吸等呼吸活动已被证明会产生可测量浓度的气溶胶。27-31为了加强指定agp的证据基础和严格的基于空气传播的预防措施的基本原理,必须确定这些程序与自然呼吸事件相比产生了多少气溶胶。因此,我们定量了在意识清醒的患者中进行的OGD产生气溶胶的程度,并将其与在超清洁通风(UCV)手术室中同一患者咳嗽和潮汐呼吸产生的气溶胶进行了比较。
方法
道德
在英国一家医院(北布里斯托尔NHS信托)进行了一项前瞻性环境采样研究,以测量意识清醒的OGD患者产生的颗粒的数量和大小分布。
患者的选择
研究参与者年龄在18岁以上,作为减肥手术评估的一部分,他们正在接受诊断性OGD。内窥镜的适应症符合国际肥胖和代谢疾病外科联合会的立场声明,32该协会建议没有上消化道症状的患者在进行减肥和代谢手术前考虑OGD。所有患者均自我隔离2周,入院前72小时SARS-CoV-2 PCR检测阴性,并在进入研究前给予书面知情同意。
研究行为
该研究的目的是测量OGD常规操作过程中产生的气溶胶。为了灵敏地检测由自然呼吸事件或agp产生的气溶胶,必须在背景空气颗粒浓度非常低的环境中进行测量。因此,在手术室中使用UCV系统(Exflow 32, Howorth Air Technology, Farnworth, UK)进行记录,该系统具有高效微粒空气(HEPA)过滤。UCV系统提供了一个既超清洁又高度通风的环境。我们之前已经证明,UCV确保了非常低的背景颗粒浓度,能够检测由自然呼吸事件和agp产生的气溶胶。20 21 31 33
UCV在记录过程中处于待机模式,以尽量减少高换气速率对颗粒检测的影响。33当完全运行时,UCV系统产生清洁空气的“手术冠层”,在地板上标记的周长范围内垂直向下引导手术台上的空气。空气处理单元以50赫兹的速度运行,以产生这种超清洁区域,从而在周长内每小时更换500-600次空气。当系统处于“待机模式”时,空气处理单元中逆变器的频率降低到25hz,并且失去了受限层流的“外科冠层”;这样可以将换气次数减少到每小时25次(相当于一个标准手术室)。气流速度为0.25 m s−1在离地面1米的地方。这仍然提供了一个超干净的环境(最小化来自背景气溶胶的干扰)33但没有大量的换气,确保任何发现都可以推广到更典型的手术室设置。
根据信任和国家政策,所有卫生保健工作者和调查小组成员都佩戴了隐形眼镜和防飞沫防护装备。在整个研究过程中,室内工作人员的数量和他们的活动都保持在最低限度,以最大限度地减少外部和人为气溶胶的产生。
使用便携式光学粒度仪(OPS,型号3330,TSI,肖维瓦,明尼苏达州,美国)。OPS以1l min取样空气−1采用激光光学散射法检测颗粒,报告粒径在300 nm ~ 10µm范围内的颗粒数量浓度和大小分布,采样仓宽度为1s。所有空气样本通过3d打印漏斗(由聚乳酸在RAISE3D Pro2打印机上形成,3DGBIRE, Chorley,英国),最大直径为150毫米,锥高为90毫米,出口为10毫米。导电硅胶取样管(3001788,TSI, 1 m长,4.8 mm内径)将漏斗连接到OPS。硅胶管的内部体积为72.5 mL,在漏斗和粒度仪之间有一个传输滞后(流量为1 L min−1)为4.3 s,在测量时间登记时考虑了这一点。在之前的工作中,我们已经建立了该设置下直径<5µm颗粒的透射采样损失<10%。31值得注意的是,我们不能报告产生的粒子的绝对数量,只能报告采样和检测到的粒子数量,因为我们不能对从活动进入OPS仪器的所有空气进行采样。
在内镜检查前测量每位患者的参考气溶胶生成,患者仰卧在手术室的手术台上。采样漏斗由研究者手持,位于患者前方约20厘米处,朝向患者面部。参考序列包括1分钟安静的潮汐呼吸,然后每隔30秒进行三次最大的自主咳嗽,中间是潮汐呼吸。在患者准备进行内窥镜检查时,用漏斗在离患者(和任何其他工作人员)1米远的地方测量气溶胶,但仍在UCV系统的中心区域内。
所有患者均采用10%利多卡因口咽局部麻醉(多卡因,50 mL/500喷雾,阿斯利康,瑞典)。OGD以左侧卧位进行,内窥镜医师根据其正常做法,根据需要静脉注射咪达唑仑进行有意识镇静。在插入内窥镜(8.9 mm GIF-H290视频胃肠镜,EVIS X1 CV-1500视频系统,Olympus,东京,日本)之前插入护齿套。
用手持式取样漏斗在距离患者口腔20cm处测量内窥镜检查时产生的气溶胶。这使得内窥镜能够插入漏斗和口腔之间。分析了从内窥镜通过护齿套插入到内窥镜取出之间的所有时期内OGD过程中产生的气溶胶。对于那些进行了多次内窥镜插入的患者,这些时间是累计的。气溶胶采样开始用于参考记录,在最初的内窥镜插入之前进行,并持续到最后的内窥镜取出后。所有有意义的事件都有时间戳(即,内窥镜插入,内窥镜取出,咳嗽打嗝)。在受试者中平均咳嗽事件(包括内窥镜检查期间的自愿和诱发),然后在整个组中聚集。
数据从OPS导出,在TSI气溶胶仪器管理软件中进行处理,并在OriginPro (OriginLab, Northampton, Massachusetts, USA)和Prism V.8 (GraphPad, San Diego, California, USA)中进行分析。我们报告了采样的平均气溶胶浓度以及超过1 s采样时间的峰值浓度,报告为平均值(SD)。我们使用配对或非配对t检验或Mann-Witney和Wilcoxon检验进行适当的统计比较。统计学意义的标准为p<0.05。
结果
招募了15名患者:14名患者在减肥手术前接受评估,1名患者在胃分流手术后2年接受评估。男性2例,女性13例,平均体重指数(BMI)为46±9.3 kg/m2平均年龄42岁(21-75岁)。四名患者要求并接受了内窥镜医生给予咪达唑仑的额外有意识镇静。
背景采样显示空气非常干净,平均气溶胶数浓度,以下简称为浓度为3.1(3.7)粒L−1(相当于每分钟采样检测到大约3个颗粒)。患者的潮汐呼吸,通过口腔,产生的平均粒子浓度为118 (97.2)L−1平均峰值颗粒浓度为540 (410)L−1(n=15例)(图1).在9名患者中,记录了多一分钟的鼻呼吸;这产生的平均颗粒浓度为63.5 (72.0)L−1峰值颗粒浓度为327 (283)L−1(n = 9)。鼻呼吸产生的气溶胶浓度低于口呼吸(p=0.008, Wilcoxon检验)。
(A)平均粒子浓度和(B)记录过程中产生的峰值粒子浓度。注意浓度的对数刻度为平均值±SEM。OGD oesophago-gastro-duodenoscopy。
咳嗽的排尿期通常持续不到1秒,34气溶胶浓度迅速上升到一个尖峰,随后随着剩余的气溶胶到达采样漏斗,消散并被清洁的背景空气稀释(图2).15例患者的参考自愿咳嗽产生的气溶胶浓度曲线明显高于基线,平均峰值浓度为2330 (2120)L−1,平均每次咳嗽检测到的粒子总数为192(183),平均持续时间为19.8(5.8)秒。

在参考性自愿咳嗽(n=15例患者)中采样的平均颗粒浓度与食管胃十二指肠镜检查(OGD)中诱发的咳嗽(n=9例患者)和OGD中观察到的打嗝(n=4例患者)的平均颗粒浓度重叠。阴影区域代表SEM。
在内窥镜检查期间测量的平均气溶胶颗粒浓度为595 (1110)L−1(n = 15,图1一个),平均内镜时间为222 s (129-457 s)。这种气溶胶浓度远高于背景水平,但并不显著高于口腔呼吸时测量到的气溶胶水平(与118 L相比)−1, p=0.17, Wilcoxon检验)。我们注意到,内窥镜检查期间的平均气溶胶浓度范围非常大,从3升开始−1(与背景难以区分——看图3一)至4320 L−1(图3 b).在内窥镜检查时经常引起咳嗽(图3 b;9/15的受试者被观察到咳嗽,中位数为4次咳嗽(范围1-10次)。同样,在某些手术过程中诱发了打嗝(图2 b;4/15名受试者打嗝——每次内窥镜检查中位数为两次打嗝(范围1-4))。

在OGD进行一段时间的背景监测后,在呼吸操纵期间(潮汐呼吸和自主咳嗽)检测到连续的气溶胶时间序列。(A)平安无事的食管-胃-十二指肠镜检查(OGD),没有任何明显的气溶胶产生。(B)一个更有挑战性的内窥镜检查,需要多次尝试插入镜,在最后一次发作时引发咳嗽。
ogd诱发的咳嗽产生高浓度的气溶胶(图2A及3B),平均峰值浓度为11 710 (13 700)L−1每次咳嗽检测到的粒子总数为780(1010)。诱发性咳嗽的颗粒总数明显大于同一患者的自愿性咳嗽(780 vs 191, n=9, p=0.008, Wilcoxon检验),峰值质量浓度更高(4.51 vs 0.54µg/m)3., p=0.008, Wilcoxon检验)。同样,诱发性咳嗽比自愿性咳嗽的峰值颗粒浓度更大(11 710 v 2320 L)−1, p=0.008, Wilcoxon检验)。在平均14.5(4.8)秒的时间内,诱发性咳嗽产生的颗粒浓度在基线之上仍可检测到。对这些诱发性咳嗽的大小分布的分析表明,它们与自愿性咳嗽具有相似的分布,报告为OPS的大小分解容器的浓度分布数量,但随着每个尺寸容器中颗粒总数的增加(图4).
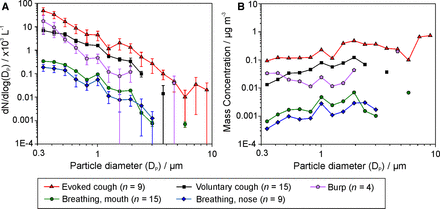
(A)事件的粒度分布。dN /网络日志本(DP)是每个仓内采样的浓度,由仓宽的对数归一化。误差条表示均值的SE。(B)每次活动产生的平均气溶胶浓度的大小分布,以质量浓度表示,假设单位密度计算。
在OGD过程中观察到的打嗝产生的平均峰值浓度为3060 (3830)L−1每次打嗝检测到的粒子总数为205(280)。同一患者自愿咳嗽和打嗝的峰值颗粒浓度或检测到的颗粒总数没有显著差异。对这些诱发打嗝的颗粒大小分布的分析表明,它们与咳嗽有不同的分布,粒径范围在0.5到1.5微米之间的颗粒总数减少(图4).
由于诱发性咳嗽或打嗝对颗粒浓度有很大影响,我们随后的分析将患者分为有此类“生物气溶胶生成事件”(BGEs)的患者和没有此类事件的患者。在11次有BGEs的内窥镜检查中采样的平均气溶胶数浓度高于没有引起咳嗽或打嗝的4次内窥镜检查中记录的平均气溶胶数浓度(808 (1240)L−1vs 10.0 (7.2) L−1, Mann-Whitney检验,p=0.0015)。当这些短暂的和离散的咳嗽或打嗝事件被排除在分析之外时,内镜检查剩余时间的平均颗粒浓度为31.4 (33.9)L−1确定离散BGEs在过程中负责气溶胶的整体升高。
对内窥镜插入(n=12)和取出(n=11)周围30 s采样窗口内气溶胶浓度波动的集中分析(在插入或取出前10 s开始),不包括触发BGEs的气溶胶,显示气溶胶浓度较低,与背景无显著差异,低于潮汐呼吸和自愿咳嗽(图5).在ogd期间没有发现其他重大气溶胶产生事件。
内窥镜(A)插入(n=12)和(B)取出(n=11)期间检测到的气溶胶浓度剖面。在内窥镜插入前后30秒内检测到气溶胶的低平均浓度(10.3 (9.5)L颗粒)−1)和去除(15.1(12.4)颗粒L−1),其浓度与背景无显著差异。注意,立即引起咳嗽或打嗝(即在采样窗口期间)的内窥镜插入(n=3)和取出(n=4)被排除在汇总分析之外。
讨论
我们测量了OGD患者产生的气溶胶。在手术过程中咳嗽的患者(60%)中,检测到非常高的颗粒浓度,大约是自愿咳嗽时的5倍。这表明OGD符合在内窥镜检查引起咳嗽的患者中产生气溶胶的高风险程序的标准。这与最近的研究结果一致,这些研究也得出结论,OGD与气溶胶生成增加有关。25日26日然而,我们明确指出,诱发性咳嗽和打嗝是指数危险事件,而不是从食管插入和取出内窥镜。
由于背景浓度极低,OGD期间在hepa过滤的超洁净环境中进行气溶胶采样为检测气溶胶提供了最佳设置。在邻近手术室(非ucv)取样显示基线颗粒含量为16 000颗粒L−1(与3 L−1).33在这样的剧场中采样意味着本研究中检测到的气溶胶(例如,与潮汐呼吸有关的气溶胶)将不可能在背景“噪音”中检测到。我们注意到,先前对OGD气溶胶产生的研究也发现了高本底计数(每立方英尺25 - 40000个颗粒,相当于~ 900-1400个颗粒L−1),手术室里有标准的通风系统。25这将阻止检测到呼吸产生的气溶胶,甚至是有意咳嗽产生的背景颗粒计数(可能主要是无机“灰尘”,而不是生物气溶胶)。重要的是,高时间分辨率(空气中颗粒的1hz测量)与低背景气溶胶浓度相结合,可以明确地将特定的呼吸或过程事件归因为气溶胶的来源(而不是在使用分分钟分析时试图通过推断来建立联系26).
我们研究设计的一个新颖方面是使用每个患者自己的呼吸事件作为比较。这使得在内窥镜检查过程中进行的气溶胶测量成为正常呼吸事件的有意义的生物学背景。这种方法还减少了受试者之间差异的影响,因此即使在相对较小的样本量内也能提高检测显著变化的能力。我们使用潮汐呼吸作为自然气溶胶生成的较低参考,并可以可靠地检测出背景上方的气溶胶浓度(这是第一次在对患者的研究中实现这种测量)。对于在手术过程中没有咳嗽的患者,检测到的浓度比咳嗽时甚至正常潮汐呼吸时更低。这可能是由于防咬器的存在,内窥镜本身或内窥镜医师的手或手术过程中浅呼吸/鼻呼吸造成的衰减。
本研究采用的采样方法适用于检测呼吸系统产生的气溶胶颗粒,一般在10 nm ~ 20µm范围内,在亚微米范围内优势较大29;我们没有检测到大于20微米的液滴,也不能在这些过程中对它们的存在或不存在做出声明。我们开始研究靠近发电源的气溶胶水平。通过在患者附近(20厘米)采样,我们可以准确测量内窥镜医生和助理在患者附近(1米内)的暴露风险,因此任何喷射出的气雾羽与其传播风险高度相关。世界卫生组织将气溶胶定义为由小于5微米的颗粒组成,但最近,这种严格的尺寸描述受到了质疑:小于100微米的潮湿呼出液滴的尺寸会大大减小,表现出与气溶胶相似的气动行为,从而可能在许多米范围内传播。35当考虑到室内颗粒的扩散时,这一点尤其相关。由于颗粒浓度相对较低,即使在具有标准通风的房间中,扩散也会发生巨大的稀释程度,目前还不能对呼吸性气溶胶进行直接的实验量化。我们认为,内窥镜小组的主要风险来自于近距离暴露于产生部位(患者)附近的呼吸气溶胶,但作为传播途径的潜在颗粒在房间内的持久性和分散性问题也可能是值得进一步调查的因素(回顾,见36).
呼吸性气溶胶被认为是双峰分布,两种模式的平均气动直径在800-1500 nm范围内;较小的模式被认为出现在下呼吸道,细支气管,而较大的被分配为喉模式。29OPS不能本质上区分呼吸性和非呼吸性气溶胶,但通过对事件进行时间戳,尽量减少研究者的移动,在靠近患者的地方采样,并使用漏斗定向聚焦来自患者的来源,我们降低了人工颗粒检测或室内工作人员检测气溶胶的风险。我们没有采取任何具体的预防措施,例如在这些内窥镜检查过程中限制工作人员的活动或改变他们的常规护理,因此,我们的结果是典型临床实践中产生的气溶胶的特征。在研究过程中检测到的颗粒大小分布是典型的呼吸气溶胶;粒子呈对数正态分布,峰值在亚微米范围内20 29 30自愿咳嗽和程序引起的咳嗽都有相似的情况。20.这表明在这两种情况下产生气溶胶的机制是相似的,并提供了一种特征指纹,将呼吸道气溶胶与其他潜在颗粒来源(即工作人员和患者运动释放的织物/被褥灰尘)区分开来。
由ogd诱发的咳嗽产生的颗粒数量增加,高于由意志性咳嗽产生的颗粒数量,可能与更强烈的反射性产生的保护性咳嗽有关,与内窥镜检查时口咽中液体的存在有关,或与内窥镜检查时口咽部分阻塞有关,减少了气道直径,增加了湍流流量。有趣的是,打嗝(爆发)也会产生可测量的气溶胶,但这与咳嗽有不同的大小分布(在0.5至1.5微米的大小范围内,颗粒的数量级更小),这反映了气溶胶的不同来源。然而,尽管BGE的胃源不太可能成为SARS-CoV-2的宿主(与肺部不同),但通过口咽和鼻咽膜的湍流气流仍可能导致产生含有病毒的气溶胶,因此不应将其视为风险。
我们的研究并不是为了观察使用镇静剂来减少咳嗽的潜在缓解效果。4例患者经要求给予咪达唑仑清醒镇静。所有接受咪达唑仑治疗的患者咳嗽,而其余患者的咳嗽率为50%。我们机构随后的一项关于上消化道内镜患者咳嗽发生率的探索性研究显示了类似的结果:服用咪达唑仑镇静组咳嗽67% (n=8/12),未服用咪达唑仑镇静组咳嗽40% (n=4/10)。这与已知的苯二氮卓类药物缺乏抗咳特性相吻合,苯二氮卓类药物倾向于保留气道反射(通常认为内窥镜检查在减少误吸和缺氧发生率方面具有安全优势)。同样,之前的两项关于内窥镜检查过程中气溶胶产生的研究25日26日未发现与镇静的存在或雾化产生的数量相关(均与咪达唑仑有关)。需要一项随机对照研究来回答是否可以使用有意识的镇静来减少内窥镜检查期间气溶胶的产生。然而,我们也注意到,这将是一个很难转化为指导方针的改变的试验,即使咳嗽的发生率大幅降低(如咪达唑仑和阿片类药物联合使用所注意到的50%)37 38)不能排除个别患者咳嗽或打嗝的可能性,因此仍然需要空气防护装备。这也必须与抑制保护性气道反射的可能有害影响相平衡,这可能会增加缺氧的风险。
我们的研究有几个局限性。我们的样本量相对较小,15名参与者中有14人的BMI为>40 kg m−2.这些BMI指数较高的患者可能比较瘦的患者产生更多的气溶胶(正如相模和同事的研究所表明的那样),26但这种影响可能同时适用于基线咳嗽测量和内窥镜检查,因此在我们的研究设计中,观察空气中颗粒的相对水平是受控制的。由于所有参与者都接受了COVID-19筛查,且没有急性疾病,因此不可能将我们的研究结果推断为活动性呼吸道疾病或COVID-19感染患者。我们的研究不能用于确定内镜检查期间COVID-19传播的风险,因为患者的风险状态(即感染COVID-19的可能性)是主要决定因素。我们的采样方法没有检测到小于300纳米(大约是SARS-CoV-2病毒直径的三倍)的气溶胶;然而,直径小于300纳米的呼吸颗粒极不可能携带活的病毒粒子,除非患者的病毒滴度极高。此较低尺寸限制不包括不能包含病毒的亚病毒大小的气溶胶39但它们总是以最高浓度和最高数量存在于任何环境中,因此我们的采样方法减少了这种无关的“噪声”信号。同样,使用我们的技术也无法检测到大于10微米的气溶胶。然而,大于5微米的颗粒被归类为液滴,并由液滴预防PPE(即防流体外科口罩)提供保护。
我们的发现具有临床相关性,特别是在COVID-19大流行的背景下。当口咽被检测时,进行OGD可能会不可预知地引发咳嗽,这种OGD诱发的咳嗽比呼吸性或自愿性咳嗽产生更多的气溶胶。根据我们的观察,OGD应该继续被指定为在意识清醒的患者中产生气溶胶的程序。因此,在护理任何已知或疑似感染COVID-19的患者时,应使用包括FFP3/N95口罩在内的空气防护个人防护装备和眼部防护用品。在SARS-CoV-2仍在社区内外传播期间,为了管理任何呼吸道病原体患者,这些预防措施可能必须继续下去。我们还注意到,目前尚无流行病学证据表明OGD与COVID-19传播风险增加有关,但这可能反映了内窥镜医生和内窥镜工作人员广泛采用空气防护装备和预防措施。考虑到气溶胶产生的风险增加,我们建议上消化道内镜应在换气量大的环境中进行,并仔细设计气流,以确保气溶胶的快速清除和扩散。19我们没有发现在OGD期间气溶胶产生增加的任何其他来源的证据,因此,如果患者在OGD期间没有咳嗽或打嗝,那么可以考虑减少病例之间房间换气的时间间隔。此外,应探索减少咳嗽和呕吐发生率的策略,作为减少气溶胶产生风险的一种手段。
数据可用性声明
数据可以在一个公共的、开放访问的存储库中获得。数据背后的数据和分析中使用的原始数据已经在生物研究数据库中公开,https://www.ebi.ac.uk/biostudies/,注册编号为S-BSST670。
伦理语句
患者发表同意书
伦理批准
作为AERATOR研究(批准于2020年9月18日)的一部分,大曼彻斯特REC(编号:20/NW/0393)批准了该研究的伦理批准。该研究已在ISRCTN注册中心(ISRCTN21447815)并被国家卫生条例授予紧急公共卫生状态。
致谢
作者承认AERATOR组。
参考文献
脚注
推特@_andyshrimp
FKAG和AJS贡献相同。
合作者AERATOR组:Arnold, D;布朗,J。Bzdek, B;戴维森,一个;多德,J;葛姆雷米;练习刀功F;汉密尔顿,F;Maskell N;穆雷,J; Keller, J; Pickering, A.E; Reid, J; Sheikh, S; and Shrimpton, A.
贡献者FKAG和AJS是本文的共同第一作者。AJS, JB, DJP和FH收集数据。FKAG、AJS和AEP进行数据分析。JB, AEP, AJS, FKAG和TMC起草了手稿。BRB、JPR和AEP提供了技术指导和建议。所有作者都阅读并批准了最终的手稿。
资金AERATOR研究完全由NIHR-UKRI快速滚动拨款(Ref: COV0333)资助。本报告介绍了由国家卫生研究所(NIHR)委托进行的独立研究。BRB由自然环境研究委员会(NE/P018459/1)支持。
免责声明本出版物中作者表达的观点和意见仅代表作者本人,并不一定反映NHS、NIHR、UKRI或卫生部的观点。
相互竞争的利益没有宣布。
患者和公众参与患者和/或公众未参与本研究的设计、实施、报告或传播计划。
出处和同行评审不是委托;外部同行评审。




