条文本
摘要
客观的在II/III期结肠癌(CC)中,富含基质的肿瘤是预后差的亚型,复发率高,对标准辅助化疗的反应有限。
设计为了解决富间质肿瘤患者缺乏有效治疗选择的问题,我们根据间质含量对人类肿瘤队列进行了分层,从而能够识别复发的生物学基础和潜在的治疗漏洞,特别是在可被临床利用的富间质肿瘤中。在基于人类肿瘤的发现和独立临床验证之后,我们使用了一系列的在体外和stroma-rich在活的有机体内用于测试和验证提高与减少人类肿瘤复发相关的生物学的治疗潜力的模型。
结果通过对CC中富含基质/高成纤维细胞(HiFi)亚型进行分析,我们确定并验证了HiFi特异性预后特征(HPS)的临床价值,该特征基于stat1相关信号传导对肿瘤进行分层(高HPS vs低HPS=HR 0.093, CI 0.019至0.466)。使用在硅片里,在体外而且在活的有机体内在模型中,我们证明了HPS与富含基质的CC中离散免疫谱系中的抗原处理和呈递有关,是双链RNA和病毒反应信号的下游。TLR3激动剂poly(I:C)的处理提高了HPS信号和抗原处理的表型在体外而且在活的有机体内模型。在一个在活的有机体内在富间质CC模型中,聚(I:C)治疗显著提高了全身细胞毒性T细胞活性(p<0.05),减少了肝转移(p<0.0002)。
结论这项研究揭示了新的生物学见解,为降低预后最差的CC患者的复发率提供了一种新的治疗选择。
- 癌症
- 结肠致癌作用
- 结肠直肠癌
- 辅助治疗
数据可用性声明
数据可以在一个公共的、开放访问的存储库中获得。
这是一篇开放获取的文章,根据创作共用属性4.0 Unported (CC BY 4.0)许可证发布,该许可证允许其他人出于任何目的复制、重新分发、重新混合、转换和构建此作品,前提是原始作品被正确引用,提供到许可证的链接,并表明是否进行了更改。看到的:https://creativecommons.org/licenses/by/4.0/.
数据来自Altmetric.com
本研究的意义
关于这个问题我们已经知道了什么?
在II/III期结肠癌(CC)患者中,富含基质的肿瘤组成与预后差有关,即使患者接受标准辅助化疗,其复发率也约为50%。在富含基质的细胞中观察到转化生长因子-β (TGF-β)信号的升高,这已被用作基于TGF-β阻断的试验的基础。
新的发现是什么?
在本研究中,我们超越了间质来源的TGF-β与不良预后之间已建立的联系,以识别、表征和治疗性地开发这一TGF-β高不良预后组复发的生物学基础。这种富含基质的亚型特异性方法揭示了stat1介导的抗原处理和病毒反应信号是通过toll样受体3 (TLR3)激动剂聚(I:C)靶向治疗的脆弱性,特别是在富含基质的CC中。
在可预见的未来,它会对临床实践产生怎样的影响?
这项研究揭示了对支持富间质瘤复发的生物学的新见解,并提供了一种新的治疗方案来降低富间质瘤患者的复发率,这代表了早期CC中预后最差的亚组。
简介
结直肠癌(CRC)是全球第三大最常见的癌症,每年诊断出约130万例。1尽管手术管理和辅助治疗方案都有所改善,但许多II期和III期结肠癌(CC)患者在手术后仍会复发;各期分别为~20%和36%。2基于潜在的转录信号,将CRC患者分为分子亚型,揭示了四种共识的分子亚型(CMS1-4),其中间质亚型(CMS4)3.具有最惨淡的预后。除了分子分型,这些预后差的富含基质的肿瘤也可以通过组织学鉴定。4 - 7基于这些证据,富含基质或高成纤维细胞亚型(HiFi)在II/III期CC中是预后较差的亚组,复发率为~ 50%-60%。3 8重要的是,即使在术后接受辅助治疗时,这种不良预后仍然是一个问题;在短期肿瘤治疗(SCOT)临床试验中,观察到富间质肿瘤患者使用FOLFOX(氟尿嘧啶与奥沙利铂丸注)和卡培他滨与奥沙利铂方案获益有限9在最近的一项荟萃分析中,发现辅助化疗对CMS4肿瘤无效。10
许多研究,包括我们自己的研究,已经定义和描述了富间质肿瘤与富上皮(低间质)肿瘤的生物学基础,后者主要由升高的转化生长因子-β (TGF-β)信号或间质/CMS4生物学的其他标志物所主导。11 - 14号TGF-β和间质信号级联的升高本身已被提出作为靶点,然而,没有证据表明这种生物学是导致50%-60%的富间质肿瘤最终复发与未复发肿瘤的差异结果的原因。识别和理解支持疾病复发的生物学,特别是在富含基质的肿瘤中,而不仅仅是富含基质与低基质肿瘤的特征,可以用于开发专门针对手术后复发的富含基质/CMS4肿瘤患者的新型治疗干预措施。
为了阐明与富间质组织学亚型患者预后相关的生物学,我们基于复发风险,将成纤维细胞分层与监督转录组分析相结合,以揭示与富间质局部(II/III期)CC特定相关的生物学。为了利用这一新的认识,我们进行了一系列的计算机分析,以确定潜在的分子脆弱性和治疗候选。使用大量体外和体内模型,我们测试并验证了poly(I:C)作为一种亚型特异性治疗方案的功能意义和潜在临床应用,旨在预防富含基质的CC的转移性复发。
结果
肿瘤样本中形态分子成纤维细胞测量的预后价值
为了测试基质基因签名和组织学之间的重叠,我们使用了患者匹配的转录数据和QuPath15来自结肠切除术(FOCUS队列,n=361)和直肠前处理活检(格兰pian队列;n=225),先前在S:CORT分层CRC计划中进行了描述16(图1一个).H&E数字间质评分与之前建立的许多转录特征之间观察到强相关性,包括使用ESTIMATE的StromalScore,17肿瘤相关成纤维细胞(CAF)评分等18和MCPcounter的成纤维细胞评分,19以及单独的CAF标记ACTA2(平滑肌肌动蛋白;αSMA)和FAP (图1 b, C).结合ACTA2而且FAP基因表达与现有的MCP成纤维细胞特征生成了单样本基因集富集分析(ssGSEA)“成纤维细胞评分”转录分类器,相关性高于其他方法(图1 c;皮尔森相关= 0.856,在线补充表1).这种方法使我们能够使用来自没有H&E图像的队列的转录数据,我们的发现可以转化为富含基质的组织学亚型,传统上可以从患者匹配的H&E切片中识别。
转录成纤维细胞评分的开发和验证。(A)通过组织学和转录组学研究间质/成纤维细胞评分之间的相关性示意图。(B) H&E幻灯片,将数字病理基质分类器应用于重点队列中具有高/低百分比基质的样本。(C)与组织学基质和转录分类器的相关矩阵(Pearson相关性)。(D)根据我们的成纤维细胞评分进行CMS分类。(UNK=未知/混合CMS分类)(t检验)。(E)显示CMS分类的成纤维细胞评分瀑布图。高成纤维细胞(HiFi) n=75,低成纤维细胞(LoFi) n=140。(F)在发现队列中,HiFi肿瘤的预后比LoFi更差(log-rank p=0.00779) (G)。对HiFi和LoFi样本的比较显示,先前发表的基质特征和基因集在HiFi样本中的表达明显高于LoFi(校正后p<0.15)。CC,结肠癌; CMS, consensus molecular subtypes. **** denotes p<0.0001.
使用来自n=215个未经治疗的II期CC肿瘤的发现队列的转录数据20.(在线补充表2),我们的ssGSEA成纤维细胞评分在CMS4肿瘤中明显高于其他亚型(图1 d;t检验p<0.0001)。由于成纤维细胞含量是一个已经确立的预后生物标志物,我们使用无复发生存期(RFS)数据和Cox模型(在线补充图1).这导致n=215例患者分层为高成纤维细胞(HiFi;n = 75;35%的队列)和低成纤维细胞(LoFi;n = 140;(65%)亚组,与LoFi肿瘤相比,HiFi肿瘤被分类为CMS4的比例更大(分别为69.1%和7.1%;图1 e;费雪精确检验p<2.2×10−16, (在线补充图1).与HiFi组相比,LoFi组富含上皮细胞的CMS2亚型更为普遍(分别为32.1%和9.3%;图1 e;费雪精确检验p=2.28×10−06, (在线补充图1).与之前的研究一致,我们观察到,与LoFi肿瘤相比,HiFi肿瘤的预后明显更差,患者复发率分别为45.3%和27.9% (图1 f;log-rank p=0.00779, HR= 1.851, 95% CI(1.168 ~ 2.932))。与我们最初的相关分析一致(图1 c),与LoFi肿瘤相比,HiFi肿瘤也有明显更高的StromalScore(使用ESTIMATE基因集)和成纤维细胞评分(图1 g;调整后的p<0.15),以及我们之前直接与CAF浸润相关的基因集,21包括上皮细胞向间充质细胞的转变(图1 g).
许多先前确定的预后因素在HiFi肿瘤中不是预后因素
尽管在我们的发现队列中,HiFi肿瘤的预后明显差于LoFi,但HiFi亚组的复发率仍保持在~ 40%-50% (图1 f),这意味着约有一半的II期富间质肿瘤患者仅靠手术就能治愈。与之前的研究一致,我们证明了TGF-β信号通路识别间质丰富亚型的能力(通过使用许多转录特征进行评估)。在线补充图2A).然而,重要的是,当这些特征的预后价值在HiFi亚型中进行专门评估时,它们不会根据复发状态对患者进行分层在线补充图2B).评估先前定义的CAF亚型在CC和胰腺癌中发展22 - 24未能根据复发情况区分HiFi肿瘤(在线补充图2C);CRC cafa和cafb(左上),胰腺myCAF和iCAF(右上),CRC差异收缩力(左下)和炎症相关成纤维细胞CD34-THY1+, CD34-THY1-和CD34+CAF(右下))。同样,基于成纤维细胞刚度相关基质指数的分层,25p53活性(标志基因集ssGSEA),茎样标记物,或根据我们的ssGSEA评分的整体成纤维细胞水平(在线补充图2D)均未能区分HiFi复发和非复发肿瘤。此外,虽然HiFi肿瘤的无监督聚类鉴定出两个聚类,但这些亚组没有不同的预后结果(在线补充图2E).由于先前确定的预后因素和无监督聚类对识别复发的HiFi患者没有额外的临床价值,我们接下来对II期未治疗发现队列中的肿瘤进行了监督分析,使用GSEA,然后是前沿分析(LEA)和Cox生存模型,对比手术后5年内复发的HiFi患者(n=34)和从未经历疾病复发的HiFi患者(n=41) (图2一个).
鉴定hifi特异性预后生物学(A)我们监督分析的工作流程摘要。(B)来自监督GSEA分析的显著基因集与HiFi肿瘤的良好预后相关。(C) 10个基因集的前沿分析(LEA)表明,在71个基因中,许多基因在干扰素反应基因集之间重叠,从而鉴定出7个基因HPS。(D)在发现队列中,HPS在HiFi肿瘤中的高表达与IFN α和γ反应信号的富集有关。(E)基于发现队列的中位分裂,HPS对HiFi肿瘤有很强的预后价值(log-rank p=0.0069;上)。在发现队列的LoFi样本中,HPS没有预后价值(log-rank p=0.63215;底部)。(F) HPS在HIFI肿瘤中的高表达(n=26)与IFN α和γ反应信号的富集有关。(G) HPS可以将验证队列中的HiFi样本分为两组,一组RFS明显较差,另一组RFS甚至比LoFi患者更好(log-rank p=0.00113; top). HPS has no prognostic value in the LoFi samples (log-rank p=0.46596; bottom). HiFi, high-fibroblast; LOFI, low-fibroblast; RFS, relapse-free survival.
干扰素相关的7个基因特征表明HiFi患者预后明显更好
GSEA揭示了HiFi组中与良好预后相关的10个显著基因集,包括干扰素α和干扰素γ反应升高(图2 b, (在线补充图2F).使用LEA,揭示了对HiFi肿瘤预后相关基因集贡献最大的特定基因,我们确定了71个由多个LEA亚群共享的基因(图2 c;左)。Cox生存分析,然后对每个基因进行多变量模型(调整年龄、性别、pT分期、肿瘤位置、肿瘤分化等级、淋巴血管浸润状态和粘液/非粘液亚型),筛选出7个LEA基因(p<0.05;表1);即Fgl2, psme1, sp110, wars, ccnd2, ccnd3, pnpt1我们将其称为hifi特异性预后特征(HPS),能够区分复发与非复发(图2 c;右)。我们接下来证实,使用HPS的中位分裂对HiFi患者进行分层足以代表相同的干扰素(IFN) α和IFN γ反应GSEA特征(图2 d),但HPS与HiFi肿瘤中TGF-β信号的水平无关(在线补充图2G).该HPS中值分割与受试者工作特征(AUROC)的最佳截断(在线补充图3),这可以根据复发情况对HiFi肿瘤患者进行显著分层,其中低表达与RFS降低相关(图2 e;最高;log-rank p=0.0069), HPS基因高表达患者的RFS结果与LoFi患者相似。
在发现队列中,使用任何单因素(HR 0.395, 95% CI(0.191至0.816),Wald检验p=0.012;表1)或调整年龄、性别、肿瘤位置、肿瘤分化、淋巴血管侵犯状况、肿瘤亚型和淋巴结数量的多因素分析(HR 0.218, 95% CI (0.087 ~ 0.544), Wald检验p=0.001;表1).此外,HPS对HiFi肿瘤患者的预后价值是亚型特异性的,因为当它用于对LoFi肿瘤患者进行分层时,它没有显著的预后价值(图2 e;底;log-rank p = 0.63215)。
为了独立验证这些发现,我们将我们的ssGSEA成纤维细胞评分方法应用于未经治疗的II/III期CC肿瘤的独立验证队列的转录谱26(GSE39582;n = 258 (在线补充表3).与发现队列相似,与所有其他亚型相比,CMS4肿瘤中的ssGSEA成纤维细胞评分显著更高(在线补充图4A);t检验p < 0.0001)。与公开队列中确定的间质丰富人群一致(在线补充图4B), ssGSEA成纤维细胞评分前20%的患者被归为HiFi (n=52),其余80%被归为LoFi (n=206),其中HiFi样本主要为CMS4 (在线补充图4C).相反,LoFi样本主要由富含上皮细胞的亚型组成;CMS2及CMS3 (在线补充图4C,D).HiFi肿瘤显示出更高的StromalScore和更高的成纤维细胞评分,以及与发现队列相似的富集模式(在线补充图4E).重要的是,与发现结果一致,在这个独立验证队列中,使用HPS中位数对HiFi肿瘤进行分层(再次与AUROC最佳截止值紧密一致;在线补充图3),结果显示低表达者(n=26)的IFN α和IFN γ反应信号明显较低(图2 f), RFS较高表达组(n=26)差(复发率分别为46.2%和7.7%;图2 g;最高;log-rank p = 0.00113)。在双单变量验证队列中,HPS也具有显著的预后意义(HR 0.123, 95% CI (0.027 ~ 0.550), p=0.006;表1)和多变量分析(HR 0.093, 95% CI (0.019 ~ 0.466), p=0.004;表1),这相当于hps低组的复发风险比hps高组高10倍。我们确认了HPS的亚型特异性,因为它在基于结果对LoFi人群进行分层时再次没有临床价值(图2 g;底;log-rank p = 0.46596)。
该验证队列包含了我们发现队列中没有的额外分子特征;然而,我们没有发现HPS与错配修复、CIMP或CIN状态之间存在显著相关性,也没有发现突变TP53,喀斯特而且BRAF(在线补充图4F).虽然绝大多数HiFi肿瘤为CMS4,但我们发现各种CMS的比例也没有显著差异3.结直肠固有亚型27HPS组之间的组(在线补充图4F),这表明我们的方法已经确定了无法通过现有的遗传和转录亚型分析识别的hifi特异性生物学。
stat1介导的生物学定义了HiFi肿瘤的复发
虽然我们的HPS足以根据RFS将肿瘤分为两组,但我们接下来研究了支撑HPS高与HPS低肿瘤的整体生物学差异。进行独立差异基因表达分析,发现和验证组均有41个基因表达显著差异(BH校正p<0.05);在高信号表达的肿瘤中,30个基因上调,11个基因下调(图3一,表2).
验证hifi特异性预后生物学和与STAT1的相关性(A)热图显示发现和验证队列中HPS表达组之间的差异比较所共享的上调和下调基因(每个亚组n=26;上调基因30个,下调基因11个(调整后p<0.05;表2))。(B)上调基因形成的串网络围绕STAT1形成簇。(C)的累积基因表达STAT1其三个靶基因(PSMB9, IRF1而且TAP1)在发现队列(左)和验证队列(右)中与HPS表达相关;t检验p<0.00001)。(D)的箱线图STAT1根据HPS组(高n=9和低n=9;t检验均p<0.05)。(E)描述与HiFi肿瘤中HiFi特异性预后特征相关的STAT1、IFN和复发特征的示意图。临床蛋白质组肿瘤分析联盟;高保真,high-fibroblast;HPS, hifi特异性预后特征。
使用STRING数据库(string-db.org)来识别和可视化相互作用,上调基因在STAT1周围形成了一个网络(图3 b).因为这些分析是基于总基因表达水平STAT1本身;为了评估下游的激活,我们接下来检查了STAT1与它的几个靶基因结合(STAT1, PSMB9(LMP2),IRF1而且TAP1),在发现和验证队列中,我们观察到它们的表达与HPS之间存在强烈的直接正相关(图3 c;Pearson相关系数r=0.70001, r=0.65831, (在线补充图4G).此外,另一个独立的II/III期结肠患者队列的分层(临床蛋白质组肿瘤分析联盟,CPTAC)28使用我们的成纤维细胞评分分为HiFi和LoFi,然后使用HPS进行亚分层,验证了在HPS高表达的HiFi患者中STAT1总基因和蛋白表达的显著富集(图3 d;t检验p=0.0024和p=0.018)。虽然这些信号通路可以作为一般肿瘤浸润水平的指示,但我们证明了基于ESTIMATE免疫评分的患者分层17无论是在发现队列还是验证队列中,都不足以对HiFi患者进行预后分层(在线补充图5A);左),且不始终对齐到HPS (在线补充图5A;右)。此外,使用CIBERSORT工具比较了发现组和验证组中免疫细胞的相对丰度,29显示树突状细胞(dc)的比例明显更大,仅在发现队列hps高患者与hps低患者中明显,而在验证队列中没有再现(在线补充图5B);t检验p=0.00076, p=0.51333)。
总之,我们的hifi特异性分析发现HPS的表达升高与疾病复发显著相关,特别是在富含基质的CC中(HPS根据ifn - α, ifn - γ和stat1相关生物信号区分原发肿瘤)。图3 e).
HiFi特异性stat1相关预后生物学与较高水平的免疫谱系特异性抗原处理和呈递相关
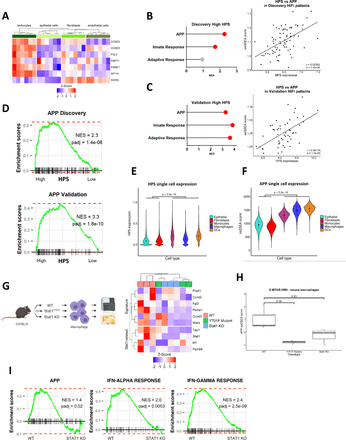
利用从结直肠癌组织中分离出的白细胞、上皮细胞、成纤维细胞和内皮细胞系(GSE39396)的转录数据,30.我们确定,与其他细胞类型相比,七个HPS基因中的六个与肿瘤浸润免疫谱系高度相关(图4一).与功能活跃的STAT1信号通路一致(图3 c),我们观察到主要组织相容性(MHC) I类受体表达增加,抗原,HLA-B而且HLA-C,在两个队列中均与HPS相关(在线补充图5C);t检验p<0.05,高于HPS中位数;HLA-B在发现队列中使用的阵列上不存在)。此外,提高适应性和先天免疫信号,以及ssGSEA基因本体论评分用于抗原处理和呈递(APP)机制(图4罪犯, (在线补充图5D)都与高HPS有关。接下来,我们研究了纯化免疫谱系(GSE24759)中HPS表达和APP之间的关系,31揭示了HPS表达之间显著且强的正相关(最初从大块肿瘤中鉴定;图4 c)和成熟抗原提呈细胞(APC)的APP信号(在线补充图5E;Pearson相关性r=0.89974, p=1.36×10−11).从进一步独立的CRC肿瘤队列中分离出的肿瘤浸润免疫群体的单细胞RNA-Seq数据的询问,32这再次证实了HPS表达的显著升高(图4 e;t检验p<0.0001)和APP信号(图4 f;t检验所有p<0.0001)在肿瘤浸润的单核细胞和巨噬细胞中,与上皮细胞和CAF群体相比,在dc中更大程度上。
CRC肿瘤单细胞数据证实了免疫特异性特征。(A)根据荧光激活细胞分选(FACS)纯化的CRC细胞谱系的公共数据集,HPS内单个基因的基因表达(n=4个群体,来自n=6例患者;总n = 24)。(B)来自发现队列的HPS高组与HiFi肿瘤低组相比,APP、适应性和先天信号的富集(左)(红色=调整后的p<0.05)。在发现队列中,APP的ssGSEA评分与HPS基因表达的相关性(Pearson的相关性r=0.5, p=1.4e-06;右)。(C)验证队列中HPS高组与HiFi肿瘤低组相比,APP、适应性和先天信号的富集(左)。验证队列中APP的ssGSEA评分与HPS基因表达的相关性(Pearson的相关性r=0.6, p=1.5e-05;右)。(D)在发现和验证队列中,HPS高组与HIFI肿瘤低组相比,使用成对GSEA富集APP。 (E, F) Immune cell populations have significantly higher expression of the HPS (E) and GO APP ssGSEA scores (F) than epithelial cells and fibroblasts (t-test both p<2.2e-16). (G) Expression levels of HPS genes and STAT1-related targets and (H) APP ssGSEA scores in bone-marrow derived macrophages with either wild-type (WT), mutant (Y701F mut) or knockout (KO)STAT1(每个基因型n=3) (t检验)。(I)在WT V STAT1 KO小鼠巨噬细胞中成对的GO APP、干扰素α和γ反应的GSEA。(每个基因型n=3)。APP,抗原加工呈递;结直肠癌;GSEA,基因集富集分析;高保真,high-fibroblast;HPS, hifi特异性预后特征;ssGSEA,单样本GSEA。
利用从WT中分离的骨髓来源的巨噬细胞(BMDM)的转录数据,Stat1Y701F(显性阴性)或Stat1-小鼠(E-MTAB-3598),33我们证实了功能性STAT1在调节HPS和STAT1靶点基因表达中的重要性(图4 g), APP信号使用ssGSEA (图4 h;t检验)和APP, IFN-alpha和IFN-gamma响应信号,使用成对的GSEA (图4我).
HPS信号与双链RNA和病毒反应级联有关
转录因子(TF)活性预测,使用DoRothEA资源,以确定与HiFi肿瘤中HPS相关的信号和表型相关的潜在调控机制(在线补充图6A)显示了与STAT1, STAT2, ifn (IRF1, IRF9)和NFκB (Nfkb1 rel rela relb) tf (图5一个).同时,我们将匠心途径分析与之前确定的HPS差异基因结合使用(图3一)来预测hifi特异性预后生物学的上游调控因子,并且与我们迄今为止的发现一致,干扰素γ (IFNG),IRF7而且STAT1均已确认(图5 b).此外,合成的双链RNA (dsRNA)病毒模拟物和TLR3激动剂Poly(I:C)也被确定为激活stat1介导的信号通路和与HiFi肿瘤预后相关的APP表型的上游调节因子和潜在治疗剂(图5 b).Poly(I:C)是一种通过病毒模拟的有效免疫佐剂,可安全用于诱导短暂的先天免疫反应和维持的适应性反应,值得注意的是,这与我们发现的与HPS相关的信号相同(图4 - 5).接下来,我们研究了上游事件,这些事件可能触发差异stat1介导的先天/适应性免疫活动和APP,与poly(I:C)的发现一致,这些分析揭示了与病毒反应相关的信号的富集和dsRNA存在于非复发性HPS高表达的HiFi肿瘤中(图5汉英).此外,这种病毒反应依赖于功能性STAT1的存在,强调了这种信号级联的重要性(图5 f;t检验p < 0.05)。
IFN和APP信号级联与stat1介导的病毒/dsRNA反应相关。(A)验证队列中HPS组的关键TF调控因子活性状态(每个亚组n=26)。(B)来自发现和验证队列中HPS差异表达基因的独特途径分析(IPA)的顶级上游调控因子(表2).(C)发现队列中HPS高组与HiFi肿瘤低组相比,HPS高组的多种病毒反应基因集和dsRNA反应富集(红色=校正后p<0.05;左)。在发现队列中,病毒应答的ssGSEA评分与HPS基因表达的相关性(Pearson相关性r=0.6, p=1.1e-08;右)。(D)验证队列中HPS高组与HiFi肿瘤低组相比,HPS高组的多种病毒反应基因集和dsRNA反应富集(左)(红色=调整后的p<0.05)。验证队列中病毒应答的ssGSEA评分与HPS基因表达的相关性(Pearson相关性r=0.7, p=2.4e-08;右)。(E)在发现和验证队列的非复发和复发HiFi肿瘤中使用成对GSEA富集病毒反应。(F)野生型(WT)、突变型(Y701F mut)或敲除型(KO)骨髓来源巨噬细胞中的病毒反应ssGSEA评分STAT1.(各基因型n=3) (t检验p<0.05)。(G)详细介绍了病毒反应/dsRNA信号在调节stat1介导的信号级联、HPS、APP和IFN信号在免疫谱系中的作用,从而导致HiFi肿瘤预后良好。APP,抗原加工呈递;结直肠癌;ds RNA,双链RNA;高保真,high-fibroblast;HPS, hifi特异性预后特征;ssGSEA,单样本GSEA;转录因子。
综上所述,这些数据证实,支持大量肿瘤来源的HPS的生物学与CC中肿瘤浸润专业APC中的功能性STAT1活性和APP显著相关,这可能是HiFi肿瘤子集中dsRNA和/或病毒反应的下游(图5克).
TLR3激动剂聚(I:C)提高了与改善HiFi CRC预后相关的机制表型
在原代人巨噬细胞免疫谱系(GSE46599, GSE1925和GSE41295)中检测ifn - α (IFNA), ifn - γ (IFNG)或poly(I:C)证实了它们诱导HPS基因表达的能力,同时增加了HPS基因的表达STAT1及其靶基因(图6).一种治疗形式的聚(I:C)最近在一些I期临床试验中表现出良好的安全性34 35;因此,我们选择poly(I:C)进行进一步测试。使用小鼠DC模型(GSE46478),我们观察到poly(I:C)处理后HPS基因和stat1相关基因的表达增加,同时显著诱导相同的STAT、IFN和NFκB调控(图6 b)和ifn - α反应、ifn - γ反应和APP与HiFi肿瘤预后相关(图6 c).利用RAW264.7巨噬细胞模型(GSE15066;图6D和E).
与未处理的对照样品(n=>3)相比,TLR3激动剂poly(I:C)可能是一种潜在的治疗HPS和STAT1靶标在不同数据集的人巨噬细胞中HiFi (a)基因表达的干扰素(IFN) α(左)(n=3), IFN γ(中)(n=6)和poly(I:C)(右)(n=4)。(B)经聚(I:C)处理或未处理的小鼠树突状细胞中HPS和STAT1靶点的基因表达(左)和TF活性(右)。(C)使用聚(I:C)或未使用聚(I:C)处理的小鼠树突状细胞中IFN α和γ反应的成对GSEA,以及APP基因集。(D)经poly(I:C)处理(n=12)或未处理的原始巨噬细胞中HPS和STAT1靶点的基因表达(左)和TF活性(右)。(E)在poly(I:C)处理或未处理的RAW巨噬细胞中IFN α和γ反应的成对GSEA,以及APP基因集。(F)流式细胞术分析原代小鼠间充质基质细胞(MSCs)和小鼠巨噬细胞系RAW264.7共培养的抗原处理情况,用荧光标记的卵清蛋白(DQ-Ova)孵育,并用poly(I:C)或对照(n=3)处理(t检验p<0.05)。(G). Poly(I:C)处理的树突状细胞与未处理的树突状细胞中差异表达基因(logFC >2和校正p<0.001),产生“Poly(I:C)签名”。(H)在发现和验证队列中,HPS高组与HiFi肿瘤低组相比,使用成对GSEA富集Poly(I:C)特征。APP,抗原加工呈递;高保真,high-fibroblast; HPS, HiFi-specific prognostic signature; TF, transcription factor.
此外,为了补充这种转录信号,并验证的效用在网上测量APP,我们接下来执行在体外抗原处理的表型测量,在RAW264.7巨噬细胞模型中使用荧光标记的卵细胞蛋白(DQ-ova),与肿瘤条件化的原代间充质基质细胞共培养,以代表HiFi肿瘤微环境(TME)的基质环境(图6 f).为了支持poly(I:C)在这种情况下的潜在治疗相关性,来自poly(I:C)处理的共培养的巨噬细胞具有显著更高的DQ-ova荧光,因此诱导抗原加工,在该模型中(图6 f;t检验p=0.036,(在线补充图6BC)。为了评估在免疫谱系中dsRNA/Poly(I:C)反应后是否能诱导与大量肿瘤样本中HPS相关的关键特征,我们创建了n=75(人)Poly(I:C)差异表达基因的“Poly(I:C)签名”,这些基因来自Poly(I:C)处理的dc (图6 b) (logFC >2,调整后p<0.001) (图6克(在线补充表4)。根据HiFi样本中的HPS亚群使用GSEA,与HPS低相比,HPS高的Poly(I:C)签名在发现和验证队列中显著富集(图6 h,(在线补充图6D),进一步证实了支持HPS的生物学可以通过免疫细胞中的病毒样dsrna反应进行治疗性诱导。
虽然先前的研究已经描述了聚(I:C)在肿瘤模型(主要是黑色素瘤)中的功效,但其在cms4相关基因工程小鼠模型(GEMM)中减少转移的能力尚未得到测试。为此,我们评估了一系列先前鉴定的gemm,以确定与HiFi转录信号和组织学相关的基因型。这些分析揭示了最近开发的富含基质的CMS4模型;喀斯特G12D / +,Trp53fl / fl(KP)和具有组成型激活NOTCH1胞内结构域(KPN)的KP36显示显著较高的成纤维细胞分数(图7)及间质组织学(图7 b)与一些Apc的模型。
HiFi模型中poly(I:C)的体内验证(A) CMS根据GEMM基因型成纤维细胞评分进行分类。(=Apcfl / flK =喀斯特G12D / +, p =p53fl / fl和n =Notch1Tg/+) (t检验p<0.01)。(B) H&E切片的基质评分,使用数字病理学应用于GEMM组织。(C)成纤维细胞评分的瀑布图显示CMS在GEMMs中的分类。(D) HiFi (n=10)和LoFi (n=10) GEMMs的比较,使用先前发表的基质特征和基因集图1 g.(E) CMS4 KP与CMS4 KPN中APP基因集的成对GSEA。(F)与生理盐水对照相比,用聚(I:C)处理的KPN模型在体内进行脾内转移试验。(G)来自体内研究的H&E数字病理学评估表明,与生理盐水对照(n=13)相比,聚(I:C)治疗小鼠的肝转移减少(n=16) (Mann-Whitney U检验)。(H)流式细胞术对治疗组肝转移的CD3 +细胞群的评估显示,与生理盐水(n=5)相比,聚(I:C)组(n=6) CD8 +T细胞显著升高,CD4 +T细胞显著减少(Mann-Whitney U试验;p < 0.05)。APP,抗原加工呈递;CMS,共识分子亚型;GEMM,基因工程小鼠模型;HiFi,高成纤维细胞; LoFi, low fibroblast. *** denotes p<0.0002, ** denotes p<0.05.
根据我们的发现和验证人类队列(图1 e而且在线补充图4C),我们发现CMS4分类和成纤维细胞评分之间有很强的相关性(图7 c).此外,评估在HiFi和LoFi人类肿瘤中观察到的相同信号(图1 g, (在线补充图4E)揭示了与LoFi GEMMs相比,HiFi/CMS4 GEMMs中HiFi相关信号级联(如EMT、肌生成和TGF-β信号)的富集模式类似(图7 d).虽然KP和KPN模型都与HiFi/CMS4分类相关,但KPN模型最能代表预后不良的HiFi模型,因为其先前报道的高度转移性。36
与这种不良预后一致,我们观察到与CMS4 KP模型相比,CMS4 kpn中APP信号通路显著减少(图7 e;NES = 1.8)。因此,我们选择KPN模型,通过脾内注射转移试验(图7 f).脾KPN植入后,聚(I:C)治疗(术后9 - 42天,每两周腹腔注射4mg /kg)显著降低体内肝转移负担,通过数字组织学评估(图7 g;Mann-Whitney U p<0.0002)。(在线补充图7A);个体体内实验),验证了我们的硅质和体外分析,并支持其在这种情况下的临床翻译。终点时,肝转移的FLOW分析(在线补充图7B)显示,与生理盐水对照组相比,聚(I:C)处理小鼠CD3 +CD8+细胞毒性T细胞显著升高,CD3 +CD4+T细胞互补显著减少(图7 h;Mann-Whitney U均p<0.05)。
讨论
我们和其他人先前已经证明了CRC亚型如何受到TME组成的严重影响,以及在成纤维细胞丰富的CMS4和茎样亚型中与不良预后的显著关联。37-42与富含上皮的亚型相比,富含基质的肿瘤显示出与TGF-β和其他基质生物学相关的升高的信号,这种升高的信号通常被用作靶向这些通路作为潜在治疗方案的基本原理。虽然大量的临床前数据支持TGF-β阻断是一个有希望的靶点,但在在体外而且在活的有机体内即使在过去十年中进行了大量的临床试验,研究也没有转化为对富含基质的肿瘤的临床疗效。43 44目前,将TGF-β阻断与免疫治疗相结合的研究正在进行,这可能会产生临床效益。然而,在这项研究中,我们揭示了与疾病复发相关的生物学在富含基质的肿瘤(TGF-β信号均升高)不与区分富间质亚型和富上皮亚型的生物学有关,也与未分层的II/III期CC队列的一般预后因素无关。因此,我们着手明确复发的预后生物学基础在利用这一新的认识来确定治疗的弱点,以降低这一预后差的患者组的复发率。该方法揭示了免疫谱系中病毒/dsRNA反应下游stat1介导的APP信号水平升高仅与HiFi肿瘤的RFS改善相关;在预后相对良好的LoFi组中没有提供预后价值的信号。此外,我们还展示了这种生物学的治疗潜力,因为使用poly(I:C)治疗可导致HiFi肿瘤中与良好预后相关的信号和表型的升高,最重要的是,在富含基质的CC小鼠模型中显著减少肝转移。本文提供的数据揭示了一种亚型特异性的治疗方法,通过poly(I:C)介导,可能改善预后不良患者的结局。早期CC高成纤维细胞亚型(图8).

图形化的总结
本体论/通路主导的转录分析方法具有识别与特定亚组相关的生物学意义信息的优势,在我们的病例中,HiFi肿瘤内复发,而不是可能被肿瘤内异质性等问题混淆的单个基因39 45或者分析平台/方法之间的技术差异。46此外,我们的研究旨在确定与改善结果相关的升高的表型及其调节因子,以告知促进这种生物学的新治疗方案;与那些依赖于试图下调或抑制生物学的方法相比,这种方法已知可以提供更多的生物学见解和更成功的治疗结果,后者可能会受到脱靶效应的困扰。47这里使用的整体发现方法,结合了生物学知识,使用了从“印记”集合中经过实验验证的签名,48表明stat1介导的病毒/dsRNA反应下游APP与降低HiFi肿瘤的复发率相关,这反过来可以通过IFNA、IFNG和dsRNA TLR3激动剂poly的治疗诱导(I:C)。
干扰素疗法已在多种癌症类型中进行了试验,但由于剂量限制毒性,其疗效一直受到阻碍。49使用TLR激动剂的试验可以诱导IFN的产生,同时与外源性IFN治疗相比,副作用更少。49在poly(I:C)治疗后,许多人或小鼠巨噬细胞和dc显示出相同的转录信号和APP激活,区分预后好与预后差的HiFi肿瘤,并足以减少HiFi特异性小鼠模型中的转移病灶。最近的一项乳腺癌研究也表明,DC亚群的预后价值取决于肿瘤本身的亚型,因为特异性的浆细胞样DC和cDC2细胞的特征在三阴性乳腺癌中是预后,但在管腔亚型中不是。50与此一致,我们确定的与HiFi肿瘤预后相关的生物学在LoFi患者中没有预后价值。
在复发率降低的HiFi肿瘤中观察到dsRNA和病毒反应信号的升高,这可能为不同亚型HiFi肿瘤中STAT1和ifn相关生物学的差异激活状态提供了生物学解释。在最近的一项胰腺癌研究中,这些相同的级联的激活被指出是内源性逆转录病毒转录物表达增加的下游后果。51在我们的研究中,我们强调了功能性STAT1在特定免疫谱系和与改善HiFi肿瘤预后相关的APP表型中调节这种潜在的病毒拟态信号的本质。在多种癌症中,肿瘤浸润dc的丰度和功能的增加与预后相关,52虽然dsRNA和病毒信号可以驱动它们的激活,但我们不能排除这些dc也受到我们研究中其他未发现的tme相关因子的调控,包括细胞因子和其他可溶性因子。本文提供的数据揭示了一些重要的生物级联,支持HiFi肿瘤的不良预后,然而,额外的分泌组、表观遗传和微生物组分析将有助于确定特定免疫谱系中调节激活和生存的因素,或者在dc的情况下,通过量化调节其作用、转归和树突生成的因素。
通过生长因子FLT3L的预处理,DC谱系的扩展和激活,促进造血祖细胞中的DC作用,随后的DC激活和生长,然后进行poly(I:C)治疗,已被证明是改善黑色素瘤模型中检查点封锁反应的一种方法。53最近关于CC新辅助免疫肿瘤治疗(联合CTLA4和PD1阻断)的安全性和有效性的数据证实了局部结肠肿瘤新辅助治疗计划的临床前景的变化。54该临床试验的结果表明,虽然微卫星不稳定性高的肿瘤普遍表现出对治疗的病理反应,但只有27%的微卫星稳定肿瘤有反应;一组迫切需要治疗干预,可以重新启动被抑制的先天免疫系统,并最终重新启动肿瘤免疫监测。总之,我们的子类型是特定的在网上数据,在在体外而且在活的有机体内本文提供的数据,强烈支持临床试验多聚(I:C)作为新辅助治疗的一种新治疗方案,以补充目前的辅助治疗标准,以降低富含基质细胞的CC患者的复发率。
总之,我们基于肿瘤的发现和验证在体外而且在活的有机体内模型,已经确定了病毒/dsRNA反应和IFN信号的关键作用,stat1介导的级联的上游,反过来驱动先天适应性免疫激活,作为富含基质的CRC复发的关键介质。本文提供的数据为临床测试多聚(I:C)作为一种新的治疗方案以降低早期CC预后最差组的转移复发率提供了强有力的生物学依据。
方法
其他方法的详细信息可在在线补充材料1.研究概述,包括使用的方法和标准在线补充图8.使用BioRender.com设计的原理图。
患者数据集和数据处理
该发现转录数据集之前已被组装用于fda批准的II期ColDx/GeneFx检测的开发,20.包括215名II期CC患者(ArrayExpress登录号E-MTAB-863)。由于这是一个现有的队列,我们没有进行样本量功率计算。临床病理资料已载入在线补充表2).II/III阶段未经处理的CC验证数据集(GSE39582)作为CEL文件从GEO下载,处理后以与发现数据集相同的方式进行分解(详细信息见下文)在线补充方法).临床病理资料已载入在线补充表3.来自CPTAC的RNA-seq和无标签蛋白质组学数据28结肠腺癌队列(n=100)从http://linkedomicsorg/cptac-colon/.S:CORT项目患者材料的使用得到了伦理委员会的批准(REC 15/EE/0241)。GSE39396:来自6例CRC患者的荧光激活细胞(FACS)纯化细胞(CD45 +白细胞,FAP +成纤维细胞,CD31 +内皮细胞和Epcam +上皮细胞)。数据从GEO以log2 RMA归一化形式检索。
生存分析
所有生存分析均在R中使用生存包(V.3.2-13)进行。对于Kaplan-Meier曲线和Cox比例风险模型,使用基因表达的中位数将患者分为高组和低组。在发现队列中,进行单变量Cox比例风险回归分析,以确定与RFS相关的基因。对可能性p<0.20的基因进行多变量Cox分析,对年龄、性别、pT分期、肿瘤位置、肿瘤分化程度、肿瘤亚型(粘液性/非粘液性)、淋巴血管浸润和淋巴结数量进行校正。共纳入214份样本(其中一份样本因缺乏临床病理信息而被移除)。验证数据集中的多变量分析根据年龄、性别、TNM分期和肿瘤位置进行了调整。模型中的所有变量都不显著(p>0.05),使用cox的发现和验证队列都符合比例风险假设。zph函数。
免疫谱系数据集
GSE24759: 38个纯化的人类造血细胞群。31GSE46599:原代人单核细胞分化为巨噬细胞并用干扰素治疗。55GSE1925:原代人单核细胞分化为巨噬细胞并用干扰素γ处理。56GSE41295;原代人单核细胞分化为巨噬细胞,用poly(I:C)处理。57GSE46478:来自C57BL/6小鼠的原发性dc。58GSE15066: poly(I:C)刺激小鼠巨噬细胞系RAW264.7。59E-MTAB-3598:从WT分离的BMDM, Stat1Y701F或Stat1-/-老鼠。33所有这些数据集都被分解到基因水平,使用与中概述的患者数据相同的方法在线补充方法部分。
GEMM数据集描述符和组织学
详细资料载于在线补充方法.简单地说,所有的动物实验都是根据英国内政部项目许可证(70/9112)进行的,遵守reach指南,并由当地动物福利机构和格拉斯哥大学的伦理审查委员会审查。对先前建立和描述的队列进行组织学评估,作为ACRCelerator计划的一部分(https://www.beatson.gla.ac.uk/ACRCelerate/acrcelerate.html).
KPN脾内模型
如前所述,进行脾内注射(Jackstadt等)36使用来自单一C57BL/6的肝转移类器官细胞悬液喀斯特G12D / +,Trp53fl / fl,组成型激活NOTCH1 (KPN)小鼠。类器官供体小鼠和受体小鼠性别和品系匹配。移植9天后,给予小鼠4 mg/kg生理盐水聚(I:C),两周腹腔注射(n=6)或生理盐水对照(n=6;N =5用于组织处理),直到第42天取样。盲治疗,记录体重和肝脏重量,并量化大体肝转移。用n=12聚(I:C)和n=12生理盐水重复研究,结果相似。
小鼠模型组织处理
取肝转移瘤活检组织行流式细胞术,其余组织固定于10%中性缓冲福尔马林中,经标准组织学处理制成石蜡。切割5µm切片,进行H&E染色。
流式细胞仪样品处理及染色
详细的协议和门控策略包括在在线补充方法,在线补充数据部分。在FlowJo V.10.7.2上进行分析。根据活/死染色、单细胞和CD45 +细胞的活细胞状态进行细胞门控。从这里开始,每个样本的数据被减少到12 000个事件,并鉴定出CD3+ CD4+和CD3+CD8+细胞。
转移得分
肝脏H&E切片使用Aperio AT2切片扫描仪20倍扫描,svs文件导入QuPath v0.2.3。像素阈值(分辨率:4.02µm/px;渠道:一般渠道;预滤器:高斯;平滑σ: 3.0;阈值:200.0)用于量化总组织面积。在每张幻灯片图像上手动标注肝脏转移。利用平均组织和肝脏转移面积来计算每只小鼠的肿瘤负担百分比。
数据可用性声明
数据可以在一个公共的、开放访问的存储库中获得。
伦理语句
患者发表同意书
参考文献
脚注
SMC, AMM和TRL是联合第一作者。
推特@ShaniaMCorry, @NiamhLeonard5, @DrPipDunne
贡献者研究概念与设计:SC、AmM、ML、PDD。进行实验并解释结果:SC, AmM, TL, NL, NF, RMB, PT, XL, RA, KLR, AoM, SaM, MG, MW, SDR, RJ, ADC, SaM, SiM, DL, MBL, HGC, EK, ST, TM, SJL, DS, AR, OJS, ML, PDD。数据生成:SC, AmM, TL, NL, NF, PT, XL, RA, KLR, ER, SS, SDR, DS, AR, PDD。草稿:SC, AmM, ML, PDD。审稿:所有作者。担保人:PDD。
资金本研究由CRUK早期检测项目资助(A29834;PDD),国际加速器奖,由英国癌症研究中心(A26825和A28223), FC AECC (GEACC18004TAB)和AIRC(22795)共同资助,CRUK核心基金(A21139;橙汁。A17196和A31287;CRUK Beatson研究所),贝尔法斯特女王大学基金会的资助,CRUK贝尔法斯特实验癌症医学中心,MRC‐CRUK分层医学项目的联合资助(S:CORT;MR/M016587/1)和英国健康数据研究实质性网站拨款。我们感谢Patrick G Johnston癌症研究应用基因组学中心的生物信息学支持。
免责声明这份手稿反映了作者的观点,可能不反映资助者的意见或观点。
相互竞争的利益ML已经从辉瑞、EMF Serono和罗氏获得了与这项工作无关的荣誉;ML从辉瑞公司获得了一笔不受限制的教育补助金,用于与这项工作无关的研究。PT从BMS、Merck、Roche、Lilly和Sanofi-Aventis获得了与目前工作无关的贡献的酬金和差旅费。作者声明没有其他潜在的利益冲突。
患者和公众参与患者和/或公众没有参与本研究的设计、实施、报告或传播计划。
出处和同行评审不是委托;外部同行评审。
代码的可用性重现所有结果的脚本和源文件将保存在我们的实验室网站(www.dunne-lab.com)上
补充材料此内容由作者提供。它没有经过BMJ出版集团有限公司(BMJ)的审查,也可能没有经过同行评审。讨论的任何意见或建议仅是作者的意见或建议,不被BMJ认可。BMJ不承担因对内容的任何依赖而产生的所有责任和责任。如果内容包括任何翻译材料,BMJ不保证翻译的准确性和可靠性(包括但不限于当地法规、临床指南、术语、药品名称和药物剂量),并且对因翻译和改编或其他原因引起的任何错误和/或遗漏不负责。
请求的权限
如果您希望重用本文的任何或全部内容,请使用下面的链接,该链接将带您到版权清除中心的RightsLink服务。您将能够快速获得价格和即时许可,以多种不同的方式重用内容。