条文本
摘要
客观的肝细胞癌(HCC)常发生于酒精性肝硬化患者,年风险高达2.5%。一些宿主遗传风险因素已被确定,但不能解释发生的大部分方差。本研究旨在鉴定酒精性肝硬化患者发生HCC的新易感位点。
设计从德国、奥地利、瑞士、意大利和英国招募的酒精相关性肝硬化和HCC患者(n= 1214例)和非HCC对照组(n=1866例),纳入了一项采用病例对照设计的两阶段全基因组关联研究。一个1520名滥用酒精但无肝病证据的验证队列被纳入,以控制与酒精滥用可能产生的关联效应。使用InfiniumGlobal筛选阵列(V.24v2, Illumina)和OmniExpress阵列(V.24v1-0a, Illumina)进行基因分型。
结果与变异rs738409 in有关PNPLA3rs58542926 inTM6SF2先前与酒精性肝硬化患者HCC风险增加相关的基因在全基因组意义上得到了证实。一种新的位点rs2242652(A)叔(端粒酶逆转录酶)在全基因组意义上也与HCC风险降低相关(p=6.41×10)−9, OR=0.61 (95% CI 0.52 ~ 0.70)。在校正性别、年龄、体重指数和2型糖尿病后,这种保护性关联仍然显著(p=7.94×10)−5, OR=0.63 (95% CI 0.50 ~ 0.79)。rs2242652(A)的运输叔与白细胞端粒长度增加有关(p=2.12×10−44).
结论本研究鉴定rs2242652在叔作为酒精性肝硬化患者HCC的新保护因素。
- 肝细胞癌
- 遗传多态性
数据可用性声明
应合理要求提供数据。
这是一篇开放获取的文章,根据创作共用属性4.0 Unported (CC BY 4.0)许可证发布,该许可证允许其他人出于任何目的复制、重新分发、重新混合、转换和构建此作品,前提是原始作品被正确引用,提供到许可证的链接,并表明是否进行了更改。看到的:https://creativecommons.org/licenses/by/4.0/.
数据来自Altmetric.com
关于这个问题我们已经知道了什么?
肝细胞癌(HCC)是最常见的原发性肝脏恶性肿瘤,全球每年约有80万人死于HCC。大多数酒精相关性hcc发生于已确诊的酒精相关性肝硬化(ArC)患者。
老年、男性、肥胖和2型糖尿病是ArC患者发生HCC的危险因素。
只有三个基因位点-PNPLA3,TM6SF2而且WNT3A-WNT9A迄今为止,在全基因组意义上,-已与酒精相关HCC的发展相关。其他风险位点可能存在。
新的发现是什么?
我们发现rs2242652种系变异叔作为ArC中HCC发展的新的易感位点。
具体而言,rs2242652 A等位基因与ArC患者HCC发展风险降低相关。
rs2242652的运输叔与患ArC的风险无关。
在可预见的未来,它会对临床实践产生怎样的影响?
探索TERT变异的功能意义可以为ArC患者的HCC发病机制提供重要的见解。
ArC患者的基因图谱可能为HCC筛查计划提供信息。
简介
肝细胞癌(HCC)是世界范围内最常见的原发性肝脏恶性肿瘤,每年约有80万人死亡。1全球HCC发病率正在上升,到2025年可能每年超过100万例。2酒精相关性肝病(ArLD)是欧洲和北美HCC的主要潜在原因。3 4大多数与酒精相关的HCC发生在已确诊肝硬化的患者中。队列研究表明,在专科护理中心接受治疗的酒精性肝硬化(ArC)患者中,HCC的累积发病率接近每年2.5%。3 4ArC患者发生HCC的临床危险因素包括年龄较大、男性、2型糖尿病和肥胖2 5但只能解释HCC发生的总变异性的一小部分。6 7
近年来,人们的兴趣集中在通过候选基因关联研究来剖析HCC潜在的宿主遗传学。在迄今为止进行的研究中,编码铂样磷脂酶结构域的基因位点包含3 (PNPLA3;Rs738409)和跨膜6超家族成员2 (TM6SF2;rs58542926)被证实会增加ArC患者发生HCC的风险,8而羟甾体17- β脱氢酶13的位点rs72613567:TA (HSD17B13)和rs429358:C载脂蛋白E (APOE),被发现可以降低风险。9 - 11由于这些基因的产物参与脂质周转和加工,因此同样的基因位点也调节非酒精性脂肪性肝病(NAFLD)患者发生HCC的风险就不足为奇了。12
目前确定的与ArC中HCC风险相关的变异仅占遗传风险的一小部分,这表明存在额外的遗传调节剂。7 8此外,迄今为止认识到的遗传风险位点与被认为对肝癌发生至关重要的基因无关。13确定这些额外的、潜在的肝癌发生的遗传调节剂需要大规模的全基因组关联研究(GWASs),在这些研究中,将病例定义为伴有HCC的ArC患者,并将对照组定义为没有HCC证据的ArC患者。这些定义对于检测与肝癌发生本身有直接分子联系的风险位点至关重要,而不是与酒精相关脂肪变性、炎症或纤维化的发展有直接分子联系。
在ArLD的HCC的欧洲GWAS,虽然不符合这个确切的设计,但最近由Trépo进行等.14在他们的发现分析中,将775例HCC病例(80%为F3/F4纤维化)与1332例非HCC对照(94%为F3/F4纤维化)进行比较,发现W附近的rs708113:T等位基因位点之间存在全基因组显著关联NT3A-WNT9A以及降低与酒精相关的HCC的风险。14
他的研究目的是在ArC背景下的HCC患者中进行GWAS,包括1066例病例和844例对照组,采用病例对照设计。
方法
病人群
德国/瑞士/奥地利酒精队列(发现队列)
ArC的诊断是基于长期、持续的酒精摄入史,女性至少40克/天,男性至少60克/天,同时进行肝组织组织学检查;或兼容的历史,临床,实验室,放射和内窥镜特征。如果患者有任何其他潜在的肝损伤原因,特别是如果他们乙型肝炎表面抗原(HBsAg)阳性,抗丙型肝炎IgG(抗丙型肝炎病毒(HCV) IgG),抗核抗体(滴度>1:80)或抗线粒体抗体(滴度>1:40),血清铁蛋白水平升高,转铁蛋白饱和度为>50%,血清铜蓝蛋白<20 mg/dL (0.2 g/dL),血清α -1抗胰蛋白酶<70 mg/dL (13 μ mol/L)或病状肥胖,则排除在外。HCC的诊断是根据肿瘤组织的组织学检查或多相CT或动态增强MRI图像的标准进行的15日16(在线补充方法A).
英国酒精队列(复制队列1)
英国生物样本库(UKB)是一个大规模的生物医学数据库,包含从2006-2010年从英国招募的大约50万中年人的前瞻性研究中获得的深入遗传和健康信息。17参与者已深入表型,并与英国医院住院患者,癌症和死亡率登记有关。使用此资源创建了嵌套的病例控制数据集(n=860)。病例定义为根据ArC国际疾病分类10 (ICD10:K70.3)入院,并诊断为HCC (ICD10:C22.0或ICD9:155.0)的参与者。对照组为因ArC入院但无HCC诊断记录的参与者。分析仅限于英国白人血统的参与者。这些嵌套的病例对照数据汇集了从伦敦皇家自由医院肝脏学中心招募的306例患者,如前所述,这些患者经组织学证实患有ArC伴或不伴HCC18(在线补充方法B).
德国和意大利酒精队列(复制队列2)
复制队列包括来自波恩大学的238例ArC患者(42例HCC)和来自米兰大学的72例ArC患者(36例HCC)。
基因分型和imputation
统计分析
GWAS分析
使用Plink V.2.0对7 946 762个变异进行了关联分析24用植入后获得的等位基因剂量(植入信息评分>0.3,次要等位基因频率>1%)。膨胀因子λGC未调整的GWAS分析为1.085,表明人口分层微妙。为了解释观察到的膨胀,计算了ld修剪数据集上的前20个主成分(pc),并将遗传血统的前15个主成分作为协变量纳入回归模型。25修正后的λGC是1.03。进行了两个发现性GWAS分析:GWAS 1(主要GWAS分析):仅将前15个pc作为协变量纳入回归模型。复制随访的单核苷酸多态性(SNPs)的p值阈值设置为p<5×10−6在复制阶段允许包含有暗示性关联的基因座。GWAS 2(敏感性GWAS分析):以性别、年龄和前15位PCs为协变量;前15个独立位点在第2期随访。
位点发现和注释
独立的基因组风险位点和先导变异(p<5×10)−6)来源于fua (V.1.3.1)26如前所述,基于GWAS汇总统计数据。27一个被定义为独立的位点必须与其他位点分离至少500kb的基因组距离;排名最高的snp被认为是潜在的先导标记。
动力分析
使用GAS功率计算器计算了确定ArC中SNP和HCC发展之间真正关联的预期功率。28等位基因频率较小的snp的功率>对于相对风险为1.5的等位基因,20%估计为49%,对于相对风险为1.6的等位基因,p值阈值为5×10,增加到81%−8(在线补充表1).
复制分析
在第二阶段,所选snp在来自英国、德国和意大利的独立样本中进行了验证。使用固定效应荟萃分析进一步分析研究特异性β估计值和标准误差。证明复制需要两个标准:(1)p<5.55×10−3(对应于初步分析中9项试验Bonferroni校正后p<0.05);或者p < 3.33×10−3(对应敏感性分析中15个试验Bonferroni校正后p<0.05)(2)以及发现样本与复制样本间等位基因效应方向的一致性(在线补充方法F).
其他复制分析
新的危险位点与HCC/肝癌之间的关系也通过以下方法进行了评估:(1)Trépo进行的近期与酒精相关的HCC GWAS的公开汇总统计数据等14;(2)来自两个大型人群队列(Finngen和BioBank Japan)的数据和(3)来自英国hcv相关肝硬化(STOP-HCV)患者队列的数据(在线补充方法F).
与其他癌症的关联(多效性)
此外,我们评估了UKB和fingen人群队列中新的风险位点是否与选定的与肝脏无关的癌症相关。每种癌症表型由住院、死亡记录和癌症登记记录中存在的ICD代码定义。此外,还检索了人类GWAS的NHGRI-EBI目录,以寻找新的风险位点与癌症表型的关联(在线补充方法F).
荟萃分析GWAS
使用METAL对所有数据集中(n=5 552 382)存在的标记进行固定效应meta分析29目的:(1)在发现阶段使用总研究样本(n=3080);(2)在阶段1和2数据集上确定复制位点的综合效应大小。
与hcc相关表型的关联
在总UKB中检测与两种hcc相关表型相关的复制位点:白细胞端粒长度33和肝脏脂肪含量。34UKB中474074名参与者的白细胞端粒长度可用(字段ID: 22191),而8315名成像亚研究参与者的肝脏脂肪含量可用(字段ID: 22436) (在线补充方法H).
患者和公众参与
本研究的设计和实施没有患者和公众参与。
结果
GWAS和基因座验证
在纳入后,共有7 946 762个MAF为>0.01的变异在1066例ArC和HCC患者和844例ArC对照组中检测了与HCC的相关性,但没有HCC的证据(表1).
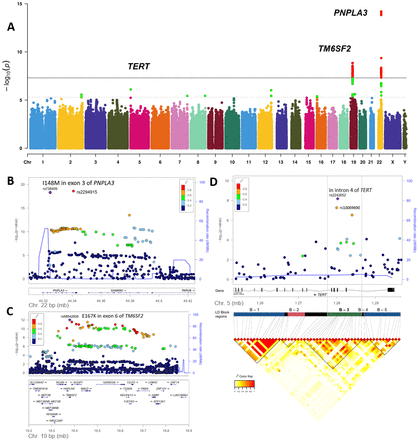
在全基因组意义上观察到与HCC的相关性(p<5×10−8)为两个独立的基因组位点,即PNPLA3而且TM6SF2(表2;图1一个,在线补充图1).最强的信号在rs2294915,位于PNPLA3(p = 6.21×10−15)编码1-酰基甘油-3-磷酸o -酰基转移酶。该标记SNP rs2294915,位于基因的内含子8PNPLA3,处于强连杆不平衡(LD) (r2=0.92),功能变体rs738409 C>G p。I148M的外显子3PNPLA3结果是相似的p发现阶段的值(p=7.23×10−15, OR (95% CI)=1.71(1.49 ~ 1.96))。
全基因组关联研究(Discovery GWAS)结果。遗传分析的主要发现。(A):主要发现队列中酒精相关性肝细胞癌(HCC)全基因组关联结果的曼哈顿图。P值(−log10)表示通过质量控制的snp。全基因组显著性阈值(5×10−8)显示为黑线。复制随访的阈值(p<5×10−6)显示为虚线。复制基因座的基因名称(表2)。p<5×10显著性变异−8用红色突出显示,p<5×10−6用绿色突出显示。(B) HCC危险位点的位点图PNPLA3.−log10 (p值,发现和复制样本的元分析)根据NCBI Build 37绘制SNP基因组位置,底部显示最近基因的名称和位置。该区域发现分析中p值最低的变体(先导变体)用紫色钻石标记。SNP被着色以反映与最显著SNP的相关性,红色表示与领先SNP的最高LD (r2 >0.8)。顶部的关联信号位于染色体的外显子3PNPLA3.1000基因组计划(hg19, EUR群体)估计的重组率用蓝色表示,以反映当地的LD结构。(C) HCC危险位点的位点图TM6SF2.最顶端的关联信号位于染色体的第6外显子TM6SF2.(D) HCC危险位点的位点图叔.的精细映射分析叔协会的信号。注释的LD- block是强成对LD snp的集群,反映了Discovery GWAS队列中的LD模式。前导关联信号位于蛋白质的内含子4叔基因(注释在反链上),位于LD区B-3,从内含子4到内含子2叔.国家生物技术信息中心;SNP,单核苷酸多态性。
与HCC相关的另一个全基因组意义的信号是rs58489806,位于的内含子1MAU2(p = 1.49×10−9)编码MAU2姐妹染色单体凝聚因子;另外49个全基因组显著snp被定位到该位点。变体rs58489806在强LD (r2=0.80),编码变体rs58542926 p.E167KTM6SF2基因座(编码跨膜6超家族成员2)产生(p=2.81×10−9, OR (95% CI)=1.94(1.56 ~ 2.42))。
在第二阶段,固定效应荟萃分析中,来自HCC相关位点的9个先导snp在来自英国、德国和意大利的独立队列中验证(表1;在线补充表2-4).除了rs2294915在PNPLA3(p = 6.19×10−6)和rs58489806TM6SF2 / MAU2(p = 5.22×10−4),在rs2242652:A的小等位基因上复制了疾病相关性(p=1.07×10−3)叔(端粒酶逆转录酶)(表2).在所有阶段1和阶段2样品的组合分析中,rs2242652:A在叔与酒精相关的HCC具有全基因组意义(p=6.41×10−9, OR (95% CI)=0.61 (0.52 ~ 0.72) (表2).保护作用与运输有关叔rs2242652:在对性别、年龄、身体质量指数(BMI)、2型糖尿病和遗传血统前15位pc进行校正后,A仍然显著,但没有达到全基因组显著性(p=7.94×10)−5;OR (95% CI)=0.63 (0.50 - 0.79) (在线补充表5)反映了与分析中大量缺失BMI和糖尿病数据点相关的能量损失(表1).
敏感性分析中,全基因组分析还对性别和年龄进行了额外调整,结果显示两个独立的基因组位点与HCC的全基因组显著相关PNPLA3而且TM6SF2与肝细胞癌相关的证据叔(p = 9.28×10−6).(表2;在线补充图2和3).在前15个相关基因座中,只有PNPLA3,TM6SF2而且叔被复制(表2).
初步研究的1期和2期数据集的联合GWAS荟萃分析和敏感性分析证实了rs738409基因组位点与HCC的全基因组显著相关PNPLA3, rs58542926 inTM6SF2和rs2242652 in叔.没有额外的风险位点获得全基因组意义p<5.0×10−8(在线补充表6).森林图显示了基因组位点之间的关联Pnpla3, tm6sf2, tert肝细胞癌显示在在线补充图4-6.这三个位点的区域关联图如图所示图1 b-1d而在在线补充图7-9.
先前报道的ArC背景下的HCC与HSD17B13rs72613567:助教(p = 8.95×10−3;OR=0.81 (95% CI 0.69 ~ 0.95)APOErs429358: C (p = 5.44×10−3;OR=0.74 (95% CI 0.60 ~ 0.91)在本研究中名义上显著,但在发现队列中未达到全基因组显著性(在线补充表5和7).相比之下,最近报道rs708113:T之间的关联WNT3A未经证实(在线补充表5和7).其他先前描述的HCC风险位点,例如,DEPDC5与hcv相关的HCC35或STAT4而且hla dq36在本研究中与arc相关的HCC无显著相关性(在线补充表7).
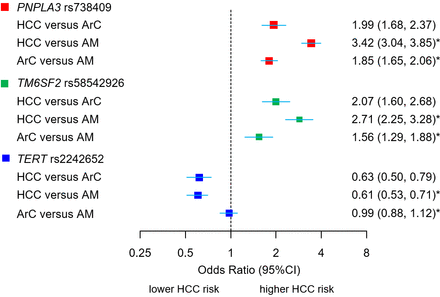
等位基因和基因型关联叔在单因素分析中,HCC与ArC (P等位基因的= 2.81×10−11P基因型的2.32×10−10)以及HCC与酒精滥用之间的差异,但ArC与酒精滥用之间的差异则不存在,使用的是第1阶段和第2阶段数据集的联合基因型计数(在线补充表8;图2).的纯合子载体对肝癌的保护作用更大叔rs2242652:A (OR=0.41 (95% CI 0.25 ~ 0.67))高于杂合携带者(OR=0.61 (95% CI 0.51 ~ 0.72)。相比之下,变体在PNPLA3而且TM6SF2与ArC和ArC相关的HCC密切相关(在线补充表9和10,图2).
小说之间的联系(叔)及确认基因座(PNPLA3,TM6SF2)与HCC和肝硬化表型。与无肝硬化的酒精滥用者(AM)相比,酒精相关性HCC和酒精相关性肝硬化(ArC)的易感位点ORs和95% ci。HCC与ArC的比较显示了合并的1期和2期样本的等位基因ORs(荟萃分析),来自等位基因剂量数据,根据年龄、性别、BMI、2型糖尿病状况和遗传血统的前15个主要成分进行了调整。* HCC与AM和ArC与AM的比较显示了未调整的等位基因or,这些等位基因or来自于2×2在总队列中观察到的等位基因计数列联表,见在线补充表2-4.BMI,身体质量指数;肝细胞癌。
精细定位的叔轨迹
在阶段1和阶段2样本的初步荟萃分析中,rs2242652:A中的小等位基因获得了最强的关联信号(p=6.40×10−09年;OR=0.61 (95% CI 0.52 ~ 0.72)),尽管rs10069690:T中的替代等位基因相似地相关(p=5.19×10)−08年, OR=0.66 (95% CI 0.57 ~ 0.77))。两种变体都位于基因的内含子4叔和相关(r2= 0.70;在线补充表11).对LD的结构进行了分析叔基因座显示,关联信号范围从内含子2到内含子6叔-此处称为LD块B-3区域(在线补充表11和图7).对B-3区20个snp的rs2242652:A或rs10069690:T等位基因量进行条件分析,证实rs2242652为先导位点(在线补充表11和12).事实上,在B-3基因区中,包括rs10069690在内的其他基因变体在rs2242652 (在线补充表11).
复制叔变异与HCC的关系
在hcv相关肝硬化患者中,rs2242652:A与HCC之间存在显著相关性(p=0.047;OR=0.72 (95% CI 0.53 ~ 0.99),在基于人群的fingen、UKB和BioBank日本队列中(表3,在线补充图10和表13).
协会叔非肝癌的变异
之间的关联叔rs2242652:A和10种最常见的癌症在UKB和fingen (FG)队列中进行了研究(在线补充图10).与膀胱癌有显著相关性(FG: p=6.10 × 10)6, OR=0.83 (95% CI 0.67 ~ 0.90), UKB: p=5.82 × 10−7, OR=0.84 (95% CI 0.79 ~ 0.90)),前列腺癌(FG: p=5.11 × 10−11, OR=0.87 (95% CI 0.84 ~ 0.90)), UKB: p=6.16 × 10−16;OR=0.86 (95% CI 0.83 ~ 0.89)),而肺癌和皮肤癌的相关性较弱。在这些队列中,前列腺癌和膀胱癌的效应值小于HCC/原发性肝癌的效应值(UKB: HCC: p=0.028;OR=0.80 (95% CI 0.66 ~ 0.89), FG:原发性肝癌:p=0.009;OR=0.81 (95% CI 0.69 - 0.95))。这些效应量与NHGRI-EBI人类GWASs目录(在线补充表14).
风险变异的加性效应
在发现和验证队列中,ArC患者发生HCC的比例随着风险增加等位基因rs738409:G的累积携带而增加PNPLA3, rs58542926:T inTM6SF2和rs2242652:G in叔(在线补充图11).在发现队列中,携带3 ~ 4个风险等位基因的患者,酒精相关HCC的OR为2.12 (95% CI 1.76 ~ 2.56),携带5 ~ 6个风险等位基因的患者,OR为5.24 (95% CI 2.82 ~ 9.77)。在线补充表15).在英国复制队列中,携带3 ~ 4个风险等位基因和5 ~ 6个风险等位基因的or甚至更高,分别为3.25 (95% CI 1.84 ~ 5.73)和17.8 (95% CI 6.38 ~ 49.6) (在线补充图12和表15).
UKB中与白细胞端粒长度和肝脏脂肪含量相关
中先导变异的小等位基因叔rs2242652: (p = 2.12×10−44)与LTL的增加显著相关,rs10069690:T与前导变异具有强LD (p=4.08×10)−84) (在线补充表16).位于测试区间的其他变异,即rs7726159,显示出与LTL更强的相关性(p=1.16×10)−219),尽管使用rs2242652 (r2= 0.354) (在线补充表11).HCC和LTL的主要关联信号均位于LD区B-3区域,但未观察到关联强度的直接相关(在线补充图13和表11).铅变异PNPLA3而且TM6SF2与LTL-rs738409 (p=0.458)和rs58542926 (p=0.475)无显著相关性,但与肝脏脂肪含量有显著相关性即。rs738409 (p = 3.39×10−61), rs58542926 (p=5.94×10−45),分别(在线补充表16);rs2242652在叔与肝脏脂肪含量无显著相关性(p=0.144)。
SNP遗传力分析
ArC- HCC的百分比遗传率由加性全基因组snp解释为h2在观察尺度上(GWAS队列)为29.6%,在假设疾病流行率为1%或2.5%的责任尺度上分别为20.4%或25.7% (在线补充表2020)。表型变异的比例,由于潜在的遗传变异PNPLA3/TM6SF2/叔LD区域,表示为h2,在观察量表上为7.5%,在责任量表上为4.2%或5.3%,假设疾病流行率相同(在线补充表17).方差分量1占总SNP遗传力的比例(PNPLA3/TM6SF2/叔模型1(调整为15台pc)为25.5%,模型2(调整为性别、年龄和15台pc)为22.2%。调整后的方差分量1为先导变异rs738409PNPLA3/ rs58542926TM6SF2/ rs2242652叔h2减少到0.000001%,表明方差分量1的遗传风险被三个已识别的先导变异完全捕获。
讨论
在这项研究中,发现了ArC中的HCC与先前确认的亚型之间的全基因组意义上的关联PNPLA3而且TM6SF2,还有一种变体叔(端粒酶逆转录酶)在5号染色体上,以前与这种表型无关。综上所述,这三个位点可以解释ArC患者中HCC总SNP遗传率的25%。
酒精相关性HCC的宿主遗传危险因素的鉴定主要是使用候选基因方法进行的。候选基因总是被选择,因为它们与酒精相关性肝损伤的进展有关,并且与突变体rs738409的正相关性PNPLA3,rs58542926 inTM6SF2已被确认。8 9已知这些变异可以改变肝脏脂肪含量和信号,但它们如何影响导致肿瘤启动或促进的机制在很大程度上尚不清楚。37 38在本研究中,ArC中HCC与rs738409之间的风险增加相关PNPLA3rs58542926 inTM6SF2在全基因组意义上得到了证实。
rs72613567之间也有显著的相关性HSD17B13rs429358 inAPOE和一个减少ArC患者发生HCC的风险。9 - 11在这项研究中,这些保护性关联得到了证实,但未能达到可检测的全基因组显著性水平(在线补充表5).
最近,Trépo提供了关于ArLD背景下HCC遗传格局的进一步见解等14他在法国和比利时的合作中发现了ArLD谱系人群的HCC GWAS。与本研究相似,他们证实了全基因组与酒精相关HCC和肝细胞癌变异风险增加的显著相关性PNPLA3和TM6SF2。此外,他们还发现了rs708113在基因中具有同样显著的相关性WNT3A-WNT9A染色体1q42上的区域,这与降低酒精相关HCC发生的风险有关。该变异的存在与肿瘤组织的免疫细胞浸润增加和-连环蛋白突变频率降低有关(CTNNB1)通常发生在HCC发生之前。39在慢性HCV感染或NAFLD背景的HCC患者中未观察到rs708113的这种保护作用。14
在本研究中,rs708113在WNT3A-WNT9A地区与HCC的发展没有显著相关,这可能反映了两项研究的队列组成的差异,尽管两项研究的参与者都是欧洲血统。在某种程度上,在法国-比利时队列中,rs58542926的效应量在种群多样性的假设得到了支持TM6SF2年超过rs738409PNPLA3在之前的候选基因关联研究中,这是ArLD最强的单一遗传风险位点。40
本研究的关键发现是对风险位点的识别叔这与脂质转换、炎症或纤维形成无关,但似乎对HCC的发展有很大影响。41像任何癌症一样,当健康的肝细胞在调节细胞分裂的特定基因中发生突变时,就会发生HCC。在肝细胞癌,叔是最常见的突变基因,在高达60%的肿瘤中存在突变(主要在启动子区域)。42这为本研究中报道的遗传多态性之间的联系提供了明确的合理性叔以及与酒精相关的HCC。在其他类型的癌症中,生殖系和体细胞变异之间也有类似的关系。43端粒调节的生物学仍在解开,仍然不完全理解。叔编码端粒酶的催化亚基(hTERT),维持端粒,在染色体末端发现的重复DNA片段。在大多数细胞中,端粒随着细胞的反复分裂而逐渐缩短,最终导致细胞停止分裂或发生凋亡。端粒酶通过在每个细胞分裂周期中在染色体末端添加小的重复DNA片段来抵消端粒的缩短。44端粒酶在大多数癌细胞中也异常活跃。45叔表达水平显著影响端粒酶在各种细胞和组织中的活性。46先前的研究表明,年龄较大、男性性别和肝硬化(都是HCC的经典危险因素)与肝组织中端粒长度较短有关。47因此,这项研究表明rs2242652:A降低了HCC风险,同时增加了端粒长度,这在方向上与之前的工作是一致的。从机制的角度来看,可能是较短的端粒使细胞更容易受到驱动基因突变的影响,从而加速肝癌的发生。47然而,需要指出的是,rs2242652与HCC之间的关联可能并不完全是通过端粒长度介导的。的确,对于变种叔,我们发现与端粒长度的关联强度与与HCC的关联强度之间没有很好的相关性。因此,rs2242652不仅仅是端粒长度的替代品。与此相关的是,作为其非规范功能的一部分叔也调节WNT/β-catenin通路。48 49这一信号通路也被认为在酒精诱导的纤维化和肝癌发生中发挥作用。14个50然而,关于酒精诱导的纤维化/肝硬化的风险,我们的数据明确表明与rs2242652无关联叔.
在以前的出版物中也有一些支持本研究的发现。在Trépo进行的GWAS中等14rs2242652:在叔与HCC风险降低相关,但OR较本研究弱,未达到统计学意义(p=0.179;OR=0.89 (95% CI 0.75 - 1.06))。然而,运输rs10069690:T在叔-最接近rs2242652的可用代理基因-与HCC发展风险显著降低相关(p=0.036;OR=0.84 (95% CI 0.71 ~ 0.99))。rs2242652:A在叔基于人群的fingen队列和日本BioBank队列中的肝癌和肝内胆管癌患者进一步证实了本研究的发现。一项涉及473例HCC患者和564名健康志愿者的汉族病例对照研究,发表在两份独立的出版物(黄等、张等51 52),也确定了在叔肝癌的发展;rs2242652:A in叔与HCC发生风险降低相关(OR =0.70, 95% CI 0.55 ~ 0.90, p= 0.004), rs10069690:T的携带也是如此(OR =0.75, 95% CI 0.59 ~ 0.96, p=0.021)。慢性HCV感染患者被排除在本研究之外,但尚不清楚HCC患者是否有潜在的慢性肝病,如果有,其病因是什么。
在慢性HCV背景下的HCC患者中已经确定了许多HCC风险位点35慢性乙肝病毒,36但本研究中无明显与arc相关HCC相关。然而,有一些证据表明,变异在叔在其他类型的慢性肝病中可能易患HCC。因此,在本研究中,在对STOP-HCV进行再分析后,观察到rs2242652: a与hcv相关肝硬化患者发生HCC的风险降低之间存在显著相关性53数据。还有,在小董书房等54显示rs10069690中常见等位基因T的携带与慢性病毒性肝炎背景下发生HCC的风险增加相关(OR = 2.78, 95% CI 1.62 ~ 4.78, p=0.00014)。因此,rs2242652与HCC之间的关系可能超出其与ArC的关系。需要进一步的工作来评估是否类似的关联适用于NAFLD患者。之前的一项研究表明,罕见的功能丧失生殖系突变叔与对照组相比,NAFLD-HCC患者中rs2242652位点富集,然而,该患者组中rs2242652位点的具体相关性尚不清楚。55
叔Rs2242652也与其他癌症的易感性有关,但关联的方向似乎因癌症类型而异(在线补充表14).在这项研究中,在UKB和fingen队列中,rs2242652:A与降低膀胱癌和前列腺癌的风险显著相关。Kote-Jarai等56找到了那节车厢叔rs2242652:A:与较低的前列腺癌发病风险相关叔在前列腺癌中,这种表达被报道可以提高生存率。显然还需要对不同人群进行进一步的大规模研究。
本研究有许多优点,包括:(1)采用两阶段GWAS方法;(2)大量精心挑选的病例和对照样本,重点关注已确诊的ArC患者中的HCC;(3)仔细排除混杂合并症;(4)统一纳入欧洲血统的白种人参与者;(5) rs2242652:A对HCC的保护作用已在日本和中国人群中得到证实,这表明它可能也适用于东亚人群。(6)尽管本研究仅限于ArC背景的HCC患者,但也纳入了hcv相关HCC患者队列,以评估我们的发现对其他病因的普遍性。这项研究也有一些局限性:(1)它是回顾性的,因此潜在的重要信息,如终生饮酒史,糖尿病和肥胖的信息一般不存在;(2)在GWAS分析所需的显著性水平上,它检测真实疾病相关性的能力相对较低,效应值较小(OR <1.4);(3)只有少数HCC病例具有组织学诊断的证实,因此无法获得用于分子分析的组织标本。
综上所述,本研究确定叔rs2242652:A作为ArC中HCC发展的一个新的遗传因素,证实了其重要性PNPLA3而且TM6SF2作为HCC的危险因素而HCC与rs2242652:A的关系叔是稳健的,这种保护等位基因的承载的功能含义尚不清楚。rs2242652:A的携带与白细胞端粒长度的增加显著相关,但其影响的数据叔肝组织中没有转录。因此,这种关联的功能含义需要在这一特定背景下进一步研究,因为叔转录,端粒长度和恶性肿瘤的风险仍然存在争议。57
数据可用性声明
应合理要求提供数据。
伦理语句
患者发表同意书
伦理批准
这项研究涉及人类参与者,并由伦理委员会的名称批准:Ethikkommission Technische Universität德累斯顿(德累斯顿大学)伦理名称ID: EK 594122019伦理委员会名称:Kantonale Ethikkommission Bern,瑞士(KEK)伦理名称ID:062 /11。参与者在参与研究前均知情同意参与研究。
致谢
作者要感谢所有参与这项研究的参与者、研究人员、临床医生和管理人员。
参考文献
补充材料
脚注
SB和HI是共同第一作者。
PD, SM, JH和FS是联合资深作者。
推特@StephanB76, @lucavalenti75
SB和HI的贡献相当。
PD, SM, JH和FS贡献相同。
调整通知这篇文章在Online First发表后已被更正。作者姓名Sascha A Müller已被更正。
贡献者SB, HI,进行生物信息学分析,分析数据,解释结果并撰写稿件;HI给出了概念性的建议;PLL、HDN、JUM、JF、KHW、JR、AM、MK、MC、FL、FE、AV、SM、JvF、RS、SRA、AM、JN负责样本采集,进行表型分析和数据整理,参与讨论,解释结果;CS协调和监督样本采集,进行表型分析,担任科学顾问;AF给出了概念性的建议,严格审查了手稿;CS, MR, HA, SS协调,管理样本收集,进行表型分析;VRT、MB、CL、RES、AC、AL、TR、MM、GS、BS、CD、SR、SGC、WLI、JRM、ING、EB、MAA、JQ采集样本,进行表型分型和数据整理,参与讨论,解释结果;LV、SAM、JF-D、JT、TB、MYM获取样本,提出概念建议,参与讨论、解读结果、编辑稿件;PD, SM, JH, FS构思实验和分析设计,监督,解释结果,撰写和审阅手稿。FS是本次研究的担保人。
资金这项工作由德国联邦教育和研究部(BMBF)资助的LiSyMKrebs (DEEP-HCC)网络资助JH (BMBF资助号031L0258A)。JT得到了德国研究基金会(DFG)项目ID 403224013- SFB 1382 (A09)、德国联邦教育和研究部(BMBF)的DEEP-HCC项目以及黑森州高等教育、研究和艺术部(HMWK)的ENABLE和ACLF-I集群项目的支持。这项工作得到了瑞士国家基金(SNF no。(310030_169196)和瑞士酒精研究基金会(SSA)。HDN和US得到了德国联邦议会(70112169)的资助。HI由医学研究基金会(C0825)的病毒性肝炎奖学金资助。JM由英国医学研究委员会(MC_UU_12014/1)和医学研究基金会(C0365)资助。EB由英国医学研究委员会、牛津NIHR生物医学研究中心资助,是NIHR高级研究员。STOP-HCV研究由英国医学研究理事会资助(MR/K01532X/1)。这项工作也得到了英国癌症研究中心(C30358/A29725)资助的Deliver研究的支持。 See:https://www.oxcode.ox.ac.uk/research-showcase/liver-cancer.AL得到了欧盟委员会通过“欧洲区域发展基金”(EFRE)以及萨克森-安哈尔特经济、科学和数字化区域部的资金支持,作为“晚年自主”(AiA)“lillife”项目(项目ID: ZS/2018/11/95324)研究小组的一部分。MICROB-PREDICT(项目ID 825694)、DECISION(项目ID 847949)、GALAXY(项目ID 668031)、LIVERHOPE(项目ID 731875)和IHMCSA(项目ID 964590)项目已获得欧盟地平线2020研究和创新计划的资助。这项研究使用了英国生物银行资源:申请号:8764。这项研究得到了德累斯顿BioBank资源(https://www.nct-dresden.de/forschung/core-units/biobank-dresden.html).
免责声明该手稿仅反映作者的观点,欧盟委员会对其所含信息的任何使用概不负责。资助者对研究设计、数据收集和分析、发表决定或手稿准备没有影响。
相互竞争的利益JT已从Versantis、Gore、Bayer、Alexion、Norgine、Grifols和CSL Behring收取演讲和/或咨询费。
患者和公众参与患者和/或公众没有参与本研究的设计、实施、报告或传播计划。
出处和同行评审不是委托;外部同行评审。
补充材料此内容由作者提供。它没有经过BMJ出版集团有限公司(BMJ)的审查,也可能没有经过同行评审。讨论的任何意见或建议仅是作者的意见或建议,不被BMJ认可。BMJ不承担因对内容的任何依赖而产生的所有责任和责任。如果内容包括任何翻译材料,BMJ不保证翻译的准确性和可靠性(包括但不限于当地法规、临床指南、术语、药品名称和药物剂量),并且对因翻译和改编或其他原因引起的任何错误和/或遗漏不负责。